Перейти к:
Выявление предикторов развития фибрилляции предсердий на электрокардиограмме с помощью нейросети
https://doi.org/10.15829/1560-4071-2024-5907
Аннотация
Фибрилляция предсердий (ФП) - распространённое нарушение сердечного ритма, грозным осложнением которого является кардиоэмболический инсульт, приводящий к инвалидизации и смерти пациента. Это обусловливает необходимость поиска ранних предикторов развития данной патологии. Изменение формы и длительности зубца Р и интервала PR на электрокардиографии (ЭКГ) ассоциировано с риском развития ФП. Для быстрого анализа ЭКГ в рутинной практике и выявления рисков возникновения и/или рецидивирования ФП рассматривается возможность использования нейронных сетей. За последние годы достижения в области совместных проектов медицины и искусственного интеллекта позволили добиться значительных успехов в области использования открытых баз данных ЭКГ для глубокого машинного обучения нейронной сети. Эти исследования показали, что с помощью искусственного интеллекта можно выявить предикторы развития ФП, что значительно снизит риск смертности от тромбоэмболических осложнений. В работе подробно рассмотрены результаты опубликованных исследований, подчеркивающие эффективность использования нейронных сетей для повышения оценки риска ФП.
Ключевые слова
Для цитирования:
Максакова А.Ю., Ким С.А., Ашурова М.А., Сергеева И.Г., Шляхтина Н.В., Епифанов Р.Ю., Столяров С.С. Выявление предикторов развития фибрилляции предсердий на электрокардиограмме с помощью нейросети. Российский кардиологический журнал. 2024;29(11S):5907. https://doi.org/10.15829/1560-4071-2024-5907
For citation:
Maksakova A.Yu., Kim S.A., Ashurova M.A., Sergeeva I.G., Shlyakhtina N.V., Epifanov R.Yu., Stolyarov S.S. Identification of atrial fibrillation predictors on an electrocardiogram using a neural network. Russian Journal of Cardiology. 2024;29(11S):5907. (In Russ.) https://doi.org/10.15829/1560-4071-2024-5907
Фибрилляция предсердий (ФП) является наиболее часто встречаемой аритмией с распространенностью от 2% до 4% среди взрослого населения, которая увеличивается с возрастом, достигая 13% среди лиц старше 80 лет [1]. Самыми грозными осложнениями ФП являются тромбоэмболические осложнения, вызывающие 20-30% всех ишемических и 10% криптогенных инсультов [2]. Несмотря на то, что в последнее время были достигнуты значительные успехи в области изучения ФП и кардиоэмболического инсульта, многие вопросы остаются спорными и открытыми, что требует более тщательного изучения. Важным компонентом своевременной тактики ведения пациента является идентификация риска инсульта в режиме реального времени, которая позволит предпринять неотложные меры по предупреждению инсульта и смерти. Процедура записи электрокардиографии (ЭКГ) является наиболее распространенным методом диагностики ФП. Расшифровка ЭКГ ручным способом является времязатратной и трудоемкой работой для врача, поэтому для облегчения анализа разработаны автоматизированные компьютерные методы с использованием нейронных сетей. За последние 5 лет они эволюционировали от традиционных методов, основанных на разработке функций, до более современных методов машинного обучения и даже с возможностью глубокого обучения (deep learning, DL).
На сегодняшний день большую популярность получил метод DL нейросети, т. к. он способен моментально принимать решения вследствие аналитической обработки исходно полученных данных. В отличие от традиционных алгоритмов машинного обучения, модели DL в последние годы продемонстрировали большой успех в области информационной медицины. Они предназначены для интеграции математических формул в модель, которая имеет возможность автоматически изучать входные данные. DL нейросети включает модели свёрточной нейронной сети и рекуррентной нейронной сети с долгой краткосрочной памятью и без [3-5]. Модели DL требуют большого количества сигналов ЭКГ в качестве обучающих данных для изучения взаимосвязи между характеристиками ЭКГ и соответствующими типами аритмий. Так как данные ЭКГ считаются конфиденциальной медицинской информацией, которую, как правило, трудно собрать и сформировать всеобъемлющую базу данных [6], для простоты доступа и объективного сравнения разработанных методов DL большинство исследований (89%, 326 из 368) проводятся на основе открытых и общедоступных баз данных. Например, MIT-BIH Arrhythmia Database (MITDB) и MIT-BIH Atrial Fibrillation Database (AFDB).
Предикторы развития ФП
Зубец Р является показателем электрической активности предсердий, поэтому изменение его формы и длительности на поверхностной ЭКГ и возможность прогнозирования на основании этого рисков развития или рецидивирования ФП изучаются уже давно. Некоторые исследования показали, что P-волновые индексы могут быть полезны для определения того, какие пациенты подвержены риску развития ФП [7]. К таким показателям относятся ширина зубца Р, площадь зубца Р и его амплитуда. Ширина зубца Р является общепринятым маркером времени проводимости предсердий [8].
Еще одним важным параметром для оценки возникновения ФП является дисперсия зубца Р. Дисперсия зубца P представляет собой разницу между максимальной и минимальной продолжительностью зубца P на ЭКГ в 12 отведениях. Считается, что различная длительность Р-волн отражает региональную задержку деполяризации предсердий и является результатом неоднородной и прерывистой предсердной проводимости из-за анизотропного распределения проводимости между волокнами миокарда предсердий. Эти региональные задержки потенциально могут выступать в качестве субстрата для рецидива ФП. В нескольких исследованиях использовалась дисперсия P-волн в качестве возможного предиктора рецидивов ФП после кардиоверсии, катетерной аблации или при послеоперационной ФП [9][10].
Морфологическим субстратом нарушения атриовентрикулярной проводимости можно считать фиброз миокарда предсердий. Tiffany WT, et al. (2015) продемонстрировали, что диффузный интерстициальный фиброз левого желудочка напрямую нарушает межпредсердную проводимость, что приводит к изменению амплитуды зубца P в отведении V1 (PTFV1) и других показателей зубцов P, таких как средняя продолжительность зубца P, амплитуда и продолжительность P в V1, PR интервал [11]. Кроме того, это исследование показало, что интерстициальный фиброз в большей степени влияет на продолжительность Р-волны, чем на QRS комплекс. Это указывает на то, что PTFV1 лучше отражает степень интерстициального фиброза, чем продолжительность комплекса QRS в V1. В частности, исследование PRIMERI продемонстрировало, что оба компонента PTFV1 (амплитуда и длительность терминальной части зубца Р) по-разному связаны с предсердными изменениями: длительность тесно связана с фиброзом предсердий, тогда как амплитуда достоверно связана с нагрузкой на левое предсердие (ЛП). Чем больше полость ЛП, тем глубже отрицательная фаза зубца Р в V1 [12]. Таким образом, взаимосвязь между миокардиальным фиброзом, конфигурацией и продолжительностью зубца Р можно объяснить диастолической дисфункцией левого желудочка, нарушением наполнения ЛП, перегрузкой ЛП и увеличением напряжения стенки ЛП. Перегрузка ЛП модулирует вектор формирования зубца Р на ЭКГ и обусловливает появление выраженной (-) фазы Р в V1.
Еще одним простым и доступным методом прогнозирования развития ФП предполагался анализ интервала P-R. Интервал PR представляет собой время, необходимое для передачи электрического импульса от синусового узла через атриовентрикулярный узел к волокнам Пуркинье. На ЭКГ в 12 отведении это измеряется с момента появления зубца P до начала сегмента QRS. Как удлиненные, так и короткие интервалы PR были связаны с ФП. Предполагаемые дегенеративные изменения миокарда и проводящей системы, вызывающие удлинение интервала PR, могут объяснить связь между увеличенным интервалом PR и ФП, в то время как ассоциация короткого интервала PR может быть объяснена генетикой, поскольку оба генетических локуса, ответственные либо за укорочение, либо за удлинение интервала PR, были связаны с повышенным риском развития ФП [13].
В ряде исследований показано, что увеличение продолжительности зубца Р как одного из компонентов удлинения PR-интервала вносит вклад в неблагоприятный прогноз. У таких пациентов можно рассматривать удлинение PR как маркер дегенеративных изменений миокарда, ассоциированных с фиброзом, сосудистым воспалением. Кроме того, удлинение интервала PR приводит к нарушению внутрисердечной гемодинамики, повышению внутрипредсердного давления, активации нейрогуморальных механизмов и эндотелиальной дисфункции, что обусловливает развитие в дальнейшем неблагоприятных сердечно-сосудистых событий. Однако укорочение интервала PR <120 мс также может приводить к повышению риска развития ФП. Предполагают, что это может быть связано с укорочением зубца Р, который является частью PR интервала, и следовательно, его изменение может влиять на исход [13]. Тем не менее Smith JW, et al. (2017) продемонстрировали то, что в большой эпидемиологической когорте интервал PR представляет совокупность отдельных компонентов, которые не всегда связанны с ФП. В то время как увеличение PQ >200 мс имело самую сильную корреляцию с частотой ФП, ее отдельные компоненты (от начала зубца Р до продолжительности пика зубца Р, от пика зубца Р до продолжительности окончания зубца Р) показали различные уровни связи с ФП (рис. 1) [14].
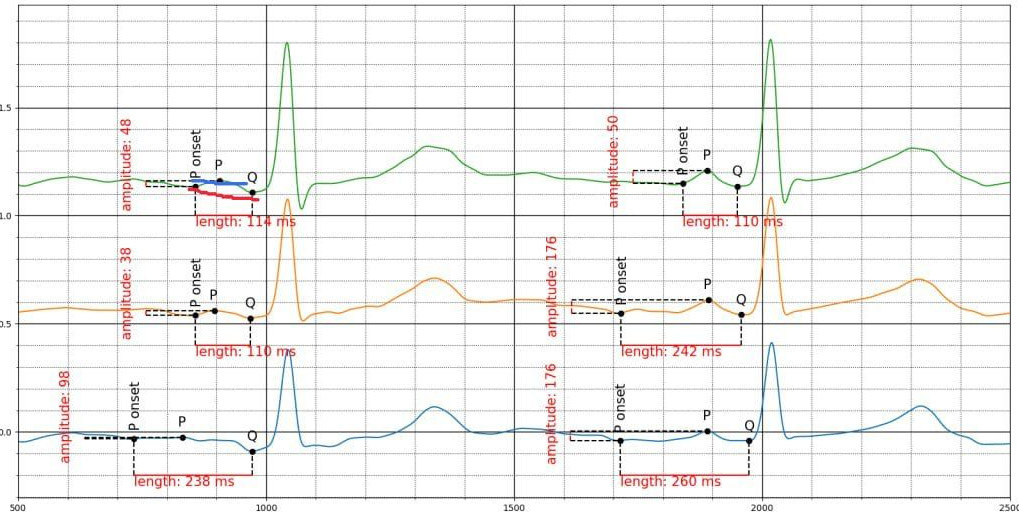
Рис. 1. Уровни связи PQ с ФП.
Терминальный индекс (PTFV1) вызвал значительный интерес как возможный предиктор ФП. PTFV1 — это продолжительность терминальной (отрицательной) части зубца P в отведении V1, умноженная на глубину. Превышение его показателя >0,04 мкВ·мс считается маркером аномалии или увеличения ЛП [15]. PTFV1 был изучен в 16 отдельных первичных исследованиях, 12 из которых были обобщены в метаанализе Huang Z, et al. (2020). Из 16 первичных исследований, 5 не продемонстрировали значимой прогностической роли PTFV1 в прогнозировании ФП. В 4 исследованиях конкретно изучался PTFV1 при ишемическом инсульте и все они продемонстрировали положительный результат [15].
Для обучения нейросети необходима сегментация ЭКГ. Автоматическая сегментация ЭКГ является сложной задачей и имеет две основные проблемы. Первая проблема заключается в разнообразии волновых образований и различных паттернах аномалий ЭКГ. Некоторые сердечные циклы могут содержать не все стандартные сегменты, например, зубец Р может отсутствовать [16]. Второй проблемой является шум, создаваемый устройствами мониторинга ЭКГ, которые измеряют электрическую активность сердечной мышцы. Например, волна Р имеет малую амплитуду, и ее может быть трудно идентифицировать из-за помех, возникающих при движении электродов или мышечном шуме [17].
Тема автоматической сегментации ЭКГ активно развивается с конца XXв, и на данный момент разработано множество автоматизированных подходов для обнаружения различных форм колебаний в сигналах ЭКГ. Ранние работы были в основном сосредоточены на разработке методов для идентификации и локализации комплекса QRS. Впоследствии были использованы более продвинутые методы для идентификации также волн Р и Т [17], но это требовало наличия комплексов QRS в качестве ориентира. Цель автоматической сегментации ЭКГ состоит в определении локализации волн, сегментов и интервалов для сравнения с известными паттернами с учетом их временных и морфологических характеристик. Большинство из данных алгоритмов основаны на двух этапах. На первом этапе сигнал ЭКГ преобразуется или фильтруется для выделения соответствующего участка ЭКГ. Это часто делается путем применения нескольких методов фильтрации или преобразования, таких как производные второго порядка, преобразование Фурье, вейвлет-преобразование, преобразование Гильберта, вейвлет-преобразования множественного порядка и др. На втором этапе алгоритм идентифицирует и локализует точки интереса. Обычно это достигается использованием эвристического подхода, основанного на адаптивном пороговом значении. В качестве альтернативы некоторые алгоритмы применяют стохастические или вероятностные модели, такие как скрытая Марковская (или полумарковская) модель, динамическое искажение времени и др. 1. Beyramienanlou H, et al. (2017) был предложен другой метод, основанный на огибающей энергии Шеннона, для обнаружения комплекса QRS в 12 отведениях сигнала ЭКГ [18]. Среди этих методов разграничение на основе вейвлет-преобразования широко признано одним из наиболее эффективных, обеспечивающим самую современную производительность в базе данных QT benchmark (QTDB). Однако эти методы часто требуют корректировки порогового значения, что может ограничить их применимость к другим наборам данных.
В последние годы DL демонстрирует значительные успехи в задачах, связанных с сегментацией ЭКГ. Как правило, разрабатывается модель сегментации, основанная на структуре кодер-декодер, которая может эффективно обнаруживать области, связанные с волнами P, QRS и T путем надлежащего обучения. Например, Москаленко В. и др. (2020) использовали архитектуру U-Net и сообщили о более точных результатах сегментации по сравнению с алгоритмами на основе вейвлет-преобразований в базе данных Университета Лобачевского (LUDB) 2. В аналогичном исследовании Jimenez-Perez G, et al. (2021) снова адаптировали U-сеть для сегментации, но с дополнительным акцентом на методы регуляризации для обучения с ограниченными данными [19]. Их модель продемонстрировала сопоставимые результаты с алгоритмами на основе вейвлет-преобразований на данных из LUDB и QTDB. Недавно Zhenqin C, et al. (2022) разработали модель 1D-U-Net для классификации точек выборки одного сердечного ритма по категориям P, QRS, T и none [20]. Вместе с предложенной ими стратегией постобработки алгоритм разграничения превзошел другие алгоритмы с точки зрения чувствительности как для QTDB, так и для LUDB, точность которых составили 99,88% и 99,48%, соответственно, что предполагает возможное применение данной модели для мониторинга состояния.
На данный момент было проведено несколько исследований возможностей нейронных сетей в диагностике различных сердечно-сосудистых патологий. Ярославская Е. И. и др. (2019) изучали применение аппарата искусственных нейронных сетей в прогнозировании ФП у мужчин с ишемической болезнью сердца (ИБС). В данном исследовании были отобраны чувствительные параметры для создания модели искусственных нейронных сетей для прогнозирования ФП у мужчин с ИБС. После математических обработок данных установлено, что при ИБС ФП связана с поражением правой коронарной артерии [21].
В исследовании Ribeiro AH, et al. (2020) были проанализированы 2322513 записей ЭКГ в 12 отведениях от 7 до 10 сек. от 1676384 пациентов были разделены на две основные группы; обучающий набор, содержащий 98% всех данных, и проверочный набор, содержащий остальные 2% всех записей (50 тыс.). Была обучена глубокая нейронная сеть, чтобы обнаруживать следующие патологии: атриовентрикулярную блокаду 1 степени, блокады правой и левой ножек пучка Гиса, синусовую брадикардию, синусовую тахикардию и ФП. Исследование показало, что модель может точно распознать ритм ЭКГ и морфологические аномалии на ЭКГ в 12 отведениях, открывая ряд перспектив для будущих исследований [22].
Acharya UR, et al. (2017) исследовали нормальные и аномальные сердечные сокращения, при этом использовав 9-слойную глубокую свёрточную нейронную сеть для автоматического определения 5 различных категорий сердцебиения сигналов ЭКГ: неэктопические, наджелудочковые эктопические, желудочковые эктопические, слившиеся комплексы и неизвестные сокращения. Базу данных ЭКГ 47 пациентов они получили из PhysioBank MIT-BIH с открытым доступом. База данных представляла собой 48-ч суточное мониторирование ЭКГ во II стандартном отведении. Анализ данных проводился на исходных ЭКГ и на ЭКГ, ослабленных шумом. Также этот набор был искусственно дополнен для того, чтобы отфильтровать записи от высокочастотного шума. Точность после дополнительных доработок составляет 94,03% и 93,47% при диагностической классификации сердечных сокращений на исходной и свободной от шума ЭКГ, соответственно. Когда сверточная нейронная сеть обучалась с использованием исходных данных, точность снижалась до 89,07% и 89,3% на шумных и бесшумных ЭКГ [23].
Также одним из видов искусственного интеллекта (ИИ) является нейронная сеть с радиальной базисной функцией (radial basis function, RBF), которая имеет преимущества быстрой скорости обучения и способности легко попасть в локальный оптимум, что делает ее более привлекательной для прогнозирования временных рядов. При использовании RBF-нейронной сети для прогнозирования сигналов временных рядов недостаточно только оптимизировать параметры ее внутренней структуры, необходимо также оптимизировать входные параметры его входного слоя. Входные параметры нейронной сети RBF включают размерность входных данных и время задержки. Основная идея нейронной сети RBF заключается в том, что RBF узла скрытого слоя преобразует входной вектор, отображает низкоразмерные входные данные в многомерное пространство, взвешивает суммы выходных данных узла и отображает результаты из многомерного пространства в низкомерное пространство для вывода [24].
Для определения точности RBF, Fang Y, et al. (2022) провели исследование, взяв за основу ЭКГ. Все ЭКГ данные, в количестве 8 тыс., были взяты из базы MIT-BIH, которая часто используется для изучения аритмии. Из них 5 тыс. образцов использовались для обучения, остальные 3 тыс. для тестирования RBF. Результаты показывали общую точность 98,77%. Для более точной оценки метода была проведена перекрестная проверка, для которой использовались те же 8 тыс. образцов, но в этот раз 4 тыс. из них использовались в качестве обучения, остальные 4 тыс. для тестирования. Результаты показали общую точность в 98,70%, что подтверждает процентную точность RBF [25].
Hygrell T, et al. (2023) ИИ был применен для прогнозирования пароксизмальной ФП на основе ЭКГ в I стандартном отведении с нормальным синусовым ритмом в течение 30 сек. Для анализа данного исследования использовались 478963 ЭКГ от 14831 пациента в возрасте >65 лет, снятых с частотой 500 Гц. 80% ЭКГ были включены в обучающий набор, остальные 20% в тестовый набор. Точность оценивалась по площади, ограниченной ROC-кривой, где AUC 0,80 [16]. Jiang J, et al. (2023) исследовали рецидивирование ФП с помощью сверточной нейронной сети у пациентов с пароксизмальной формой ФП после оперативного вмешательства по изоляции устьев легочных вен. В исследование были включены 2530 пациентов в возрасте ≥18 лет, которым была снята ЭКГ в 12 отведениях продолжительностью 10 сек и частотой 500 Гц. Под наблюдением в течение 12 мес. находились в общей сложности 1618 пациентов, где каждые 1, 2, 3, 6 и 12 мес. проводились ЭКГ и холтеровское мониторирование. Все 1618 пациентов рандомно были разделены на 3 основные группы: обучающую (n=971), проверочную (n=162) и тестовую (n=485). После обучения и проверки была выявлена ROC-кривая, где AUC равнялась 0,88 [26].
В последние годы основное внимание уделяется мобильным электрографическим приложениям с поддержкой ИИ для выявления аритмий сердца. Raghunath A, et al. (2023) была обучена нейронная сеть для прогнозирования ФП на основе мобильного электрокардиографа. Все данные были получены от пользователей устройства Alivecor KardiaMobile 6L. Были включены 73861 пользователей с 267614 мобильными ЭКГ приложениями, среди которых пользователи с пароксизмальной формой ФП составили 60,15%. Показатель площади ROC-кривой (AUC) равнялся 0,76 [27].
Заключение
Применение ИИ в медицине считается стратегическим и перспективным решением для повышения точности диагностики. По мере старения населения распространенность ФП увеличивается, что подчеркивает значимость раннего выявления аритмии для своевременного начала терапевтического лечения и предупреждения развития потенциальных осложнений. Сегодня для облегчения анализа ЭКГ имеются различные методы расшифровки на основе DL нейронных сетей. Высокая чувствительность и точность анализа ЭКГ с использованием нейронных сетей может стать лучшей альтернативой ручной интерпретации в современной медицине. Предложенные модели могут найти широкое применение в области телемедицинских технологий.
Развитие технологий ИИ и носимых устройств, ориентированных на потребителя, открывает новые широкие возможности для прогнозирования ФП.
Отношения и деятельность: все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье.
1. Vanio Markov, Vladimir Rastunkov, Daniel Fry, Wells Fargo. Quantum Time Series Similarity Measures and Quantum Temporal Kernels. IBM Quantum, IBM Research. December 5, 2023. doi:10.48550/arXiv.2312.01602.
2. Moskalenko V, Zolotykh N, Osipov G (2020). Deep Learning for ECG Segmentation. In: Kryzhanovsky, B., Dunin-Barkowski, W., Redko, V., Tiumentsev, Y. (eds) Advances in Neural Computation, Machine Learning, and Cognitive Research III. NEUROINFORMATICS 2019. Studies in Computational Intelligence, vol 856. Springer, Cham. doi:10.1007/978-3-030-30425-6_29.
Список литературы
1. Benjamin EJ, Muntner P, Alonso A, et al. American Heart Association Council on Epidemiology and Prevention Statistics Committee and Stroke Statistics Subcommittee. Heart Disease and Stroke Statistics-2019 Update: A Report From the American Heart Association. Circulation. 2019;139(10):e56-e528. doi:10.1161/CIR.0000000000000659.
2. Hindricks G, Potpara T, Dagres N, et al. 2020 ESC Guidelines for the diagnosis and management of atrial fibrillation developed in collaboration with the European Association for Cardio-Thoracic Surgery (EACTS): The Task Force for the diagnosis and management of atrial fibrillation of the European Society of Cardiology (ESC) Developed with the special contribution of the European Heart Rhythm Association (EHRA) of the ESC. Eur Heart J. 2021;42(5):373-498. doi:10.1093/eurheartj/ehaa612.
3. Andersen RS, Peimankar A, Puthusserypady S. A Deep Learning Approach for RealTime Detection of Atrial Fibrillation. Expert Systems with Applications. 2019;115:465-73. doi:10.1016/j.eswa.2018.08.011.
4. Wang J. A deep learning approach for atrial fibrillation signals classification based on convolutional and modified Elman neural network. Future Generation Computer Systems. 2020;102:670-9. doi:10.1016/j.future.2019.09.012.
5. Pourbabaee B, Roshtkhari MJ, Khorasani K. Deep convolutional neural networks and learning ECG features for screening paroxysmal atrial fibrillation patients. IEEE Transactions on Systems, Man, and Cybernetics: Systems. 2018;48(12):2095-210. doi:10.1109/TSMC.2017.2705582.
6. Dorado-Díaz PI, Sampedro-Gómez J, Vicente-Palacios V, et al. Applications of artificial intelligence in cardiology. The future is already here. Revista Española de Cardiología (English Edition). 2019;72(12):1065-75. doi:10.1016/j.rec.2019.05.014.
7. Aizawa Y, Watanabe H, Okumura K. Electrocardiogram (ECG) for the Prediction of Incident Atrial Fibrillation: An Overview. J Atr Fibrillation. 2017;10(4):1724. doi:10.4022/jafib.1724.
8. Conte G, Luca A, Yazdani S, et al. Usefulness of P‐wave duration and morphologic variability to identify patients prone to paroxysmal atrial fibrillation. American Journal of Cardiology. 2017;119(2):275-9. doi:10.1016/j.amjcard.2016.09.043.
9. Pérez-Riera AR, de Abreu LC, Barbosa-Barros R, et al. P-wave dispersion: An update. Indian Pacing Electrophysiol. J. 2016;16:126-33. doi:10.1016/j.ipej.2016.10.002.
10. Okutucu S, Aytemir K, Oto A. P-wave dispersion: What we know till now? JRSM Cardiovasc Dis. 2016;5:2048004016639443. doi:10.1177/2048004016639443.
11. Tiffany Win T, Ambale Venkatesh B, Volpe GJ, et al. Associations of electrocardiographic P-wave characteristics with left atrial function, and diffuse left ventricular fibrosis defined by cardiac magnetic resonance: the PRIMERI study. Heart Rhyth. 2015;12:155-62. doi:10.1016/j.hrthm.2014.09.044.
12. Kamel H, O'Neal WT, Okin PM, et al. Electrocardiographic left atrial abnormality and stroke subtype in the atherosclerosis risk in communities study. Ann Neurol. 2015;78:670-8. doi:10.1002/ana.24482.
13. Chousou PA, Chattopadhyay R, Tsampasian V, et al. Electrocardiographic Predictors of Atrial Fibrillation. Med Sci (Basel). 2023;11(2):30. doi:10.3390/medsci11020030.
14. Smith JW, O'Neal WT, Shoemaker MB, et al. PR-Interval Components and Atrial Fibrillation Risk (from the Atherosclerosis Risk in Communities Study). Am.J. Cardiol. 2017; 119:466-72. doi:10.1016/j.amjcard.2016.10.016.
15. Huang Z, Zheng Z, Wu B, et al. Predictive value of P wave terminal force in lead V1 for atrial fibrillation: A meta-analysis. Ann. Noninvasive Electrocardiol. 2020;25:e12739. doi:10.1111/anec.12739.
16. Hygrell T, Viberg F, Dahlberg E, et al. An artificial intelligence-based model for prediction of atrial fibrillation from single-lead sinus rhythm electrocardiograms facilitating screening. Europace. 2023;25(4):1332-8. doi:10.1093/europace/euad036.
17. Aspuru J, Ochoa-Brust A, Félix RA, et al. Segmentation of the ECG Signal by Means of a Linear Regression Algorithm. Sensors. 2019;19:775. doi:10.3390/s19040775.
18. Beyramienanlou H, Lotfivand N.Shannon's energy based algorithm in ECG signal processing. Comput. Math Methods Med. 2017;2017:16. doi:10.1155/2017/8081361.
19. Jimenez-Perez G, Alcaine A, Camara O.Delineation of the electrocardiogram with a mixedquality-annotations dataset using convolutional neural networks. Sci Rep. 2021;11(1): 863. doi:10.1038/s41598-020-79512-7.
20. Chen Zh, Wang M, Zhang M, et al. Post-processing refined ECG delineation based on 1D-UNet. Biomedical Signal Processing and Control. 2023;79, Part 1:104106. doi:10.1016/j.bspc.2022.104106.
21. Yaroslavskaya EI, Kuznetsov VA, Bessonov IS, et al. Association of atrial fibrillation with coronary bed lesions (according to the coronary angiography register). Russian Journal of Cardiology. 2019;(7):12-8. (In Russ.) Ярославская Е.И., Кузнецов В.А., Бессонов И.С. и др. Связь фибрилляции предсердий с поражением коронарного русла (по данным регистра коронарной ангиографии). Российский кардиологический журнал. 2019;(7):12-8. doi:10.15829/1560-4071-2019-12-18.
22. Ribeiro AH, Ribeiro MH, Paixão GMM, et al. Automatic diagnosis of the 12-lead ECG using a deep neural network. Nat Commun. 2020;11(1):1760. doi:10.1038/s41467-020-15432-4.
23. Acharya UR, Oh SL, Hagiwara Y, et al. A deep convolutional neural network model to classify heartbeats. Comput Biol Med. 2017;89:389-96. doi:10.1016/j.compbiomed.2017.08.022.
24. Huang F, Qin T, Wang L, et al. Hybrid Prediction Method for ECG Signals Based on VMD, PSR, and RBF Neural Network. Biomed Res Int. 2021;2021:6624298. doi:10.1155/2021/6624298.
25. Fang Y, Shi J, Huang Y, et al. Electrocardiogram Signal Classification in the Diagnosis of Heart Disease Based on RBF Neural Network. Comput Math Methods Med. 2022; 2022:9251225. doi:10.1155/2022/9251225.
26. Jiang J, Deng H, Liao H, et al. An Artificial Intelligence-Enabled ECG Algorithm for Predicting the Risk of Recurrence in Patients with Paroxysmal Atrial Fibrillation after Catheter Ablation. J Clin Med. 2023;12(5):1933. doi:10.3390/jcm12051933.
27. Raghunath A, Nguyen DD, Schram M, et al. Artificial intelligence-enabled mobile electrocardiograms for event prediction in paroxysmal atrial fibrillation. Cardiovasc Digit Health J. 2023;4(1):21-8. doi:10.1016/j.cvdhj.2023.01.002.
Об авторах
А. Ю. МаксаковаРоссия
Максакова А. Ю. - ординатор
Новосибирск
С. А. Ким
Россия
Ким С. А. - ординатор
Новосибирск
М. А. Ашурова
Россия
Ашурова М. А. - ординатор
Новосибирск
И. Г. Сергеева
Россия
Сергеева И. Г. - д.м.н., доцент, директор ЦПМО ИМПЗ
Новосибирск
Н. В. Шляхтина
Россия
Шляхтина Н. В. - к.м.н., доцент ЦПМО ИМПЗ
Новосибирск
Р. Ю. Епифанов
Россия
Епифанов Р. Ю. - м.н.с. лаборатории цифровых прикладных технологий ММЦ ММФ
Новосибирск
С. С. Столяров
Россия
Столяров С. С. - инженер лаборатории цифровых прикладных технологий ММЦ ММФ
Новосибирск
Дополнительные файлы
- Увеличение бремени фибрилляции предсердий среди взрослого населения и как следствие кардиоэмболического инсульта обусловливает необходимость поиска ранних предикторов развития данной аритмии.
- Индексы зубца Р являются показателями электрической активности предсердий, поэтому оценка их изменений на поверхностной электрокардиографии с помощью нейронных сетей может быть эффективна в определении предикторов развития фибрилляции предсердий.
- Модели глубокого обучения нейронной сети в последние годы продемонстрировали большой успех в области обработки медицинских данных.
Рецензия
Для цитирования:
Максакова А.Ю., Ким С.А., Ашурова М.А., Сергеева И.Г., Шляхтина Н.В., Епифанов Р.Ю., Столяров С.С. Выявление предикторов развития фибрилляции предсердий на электрокардиограмме с помощью нейросети. Российский кардиологический журнал. 2024;29(11S):5907. https://doi.org/10.15829/1560-4071-2024-5907
For citation:
Maksakova A.Yu., Kim S.A., Ashurova M.A., Sergeeva I.G., Shlyakhtina N.V., Epifanov R.Yu., Stolyarov S.S. Identification of atrial fibrillation predictors on an electrocardiogram using a neural network. Russian Journal of Cardiology. 2024;29(11S):5907. (In Russ.) https://doi.org/10.15829/1560-4071-2024-5907

















































