Перейти к:
Стратификация риска послеоперационной фибрилляции предсердий при выполнении изолированного коронарного шунтирования на работающем сердце: фокус на деформационные характеристики левого предсердия
https://doi.org/10.15829/1560-4071-2024-5903
EDN: FVUUNT
Аннотация
Цель. Изучить возможность использования показателей деформации левого предсердия (ЛП), полученных с помощью трансторакальной спекл-трекинг эхокардиографии, для прогнозирования впервые возникшей послеоперационной фибрилляции предсердия (ПОФП) у пациентов, перенесших коронарное шунтирование (КШ) на работающем сердце.
Материал и методы. В исследование было включено 111 больных ишемической болезнью сердца, направленных для проведения планового КШ. Критерии невключения: проведение повторного или сочетанного кардиохирургического вмешательства, наличие данных за перенесенный мозговой инсульт, наличие в анамнезе указаний на пароксизмы предсердной тахиаритмии, КШ, проведенное в условиях искусственного кровообращения, пациенты с хронической сердечной недостаточностью 4 функционального класса по классификации Нью-Йоркской ассоциации сердца. Включенным в исследование больным до операции проводилась трансторакальная спекл-трекинг эхокардиография с оценкой резервуарной, кондуитной и сократительной функций ЛП. После проведения КШ на работающем сердце больные проспективно наблюдались до выписки из стационара для регистрации первичной конечной точки — впервые возникшего устойчивого пароксизма ПОФП.
Результаты. В ходе наблюдения ПОФП была зарегистрирована у 11 больных (10%). Медиана регистрации конечной точки составила 4 дня. Сформированные в зависимости от достижения конечной точки группы оказались сопоставимы по основным клинико-демографическим характеристикам и анализируемым ультразвуковым параметрам. У большинства исследуемых больных было выявлено снижение функции ЛП, доминировали нарушения кондуитной (94 пациента, 85%) и резервуарной функций (85 больных, 77%).
Заключение. Полученные результаты могут указывать на отсутствие связей между параметрами деформации миокарда ЛП, полученными в ходе дооперационного скрининга, и риском ПОФП у больных с ишемической болезнью сердца, которым проводилось КШ на работающем сердце.
Ключевые слова
Для цитирования:
Илов Н.Н., Герасименко С.М., Стомпель Д.Р., Измайлов Х.З., Рашидова Т.К., Каримов И.Р., Колесников В.Н. Стратификация риска послеоперационной фибрилляции предсердий при выполнении изолированного коронарного шунтирования на работающем сердце: фокус на деформационные характеристики левого предсердия. Российский кардиологический журнал. 2024;29(7):5903. https://doi.org/10.15829/1560-4071-2024-5903. EDN: FVUUNT
For citation:
Ilov N.N., Gerasimenko S.M., Stompel D.R., Izmailov Kh.Z., Rashidova T.K., Karimov I.R., Kolesnikov V.N. Risk stratification of postoperative atrial fibrillation in isolated off-pump coronary artery bypass grafting: focus on left atrial strain characteristics. Russian Journal of Cardiology. 2024;29(7):5903. (In Russ.) https://doi.org/10.15829/1560-4071-2024-5903. EDN: FVUUNT
Ишемическая болезнь сердца (ИБС) и фибрилляция предсердий (ФП) являются одними из самых частых нозологических форм, с которыми сталкивается клиницист. Возникая у одного пациента, заболевания значительно ухудшают обоюдное течение и прогнозы, повышают сердечно-сосудистые риски. Более того, известно, что наличие и прогрессирование ИБС ассоциировано с более низкой эффективностью медикаментозного и интервенционного лечения ФП [1]. С другой стороны, возникновение пароксизмов ФП в раннем послеоперационном периоде после операции коронарного шунтирования (КШ) может приводить к декомпенсации сердечной деятельности и повышает смертность от сердечно-сосудистых заболеваний [2], увеличивает частоту инсультов [3]. Существование такой проблемы особенно остро стоит в случае отсутствия анамнестических указаний на наличие ФП до операции КШ и первой манифестации аритмии в раннем послеоперационной периоде.
Дебют послеоперационной ФП (ПОФП) создает условия гемодинамической нестабильности, что может стать критическим относительно клинического состояния больных ИБС после КШ. Увеличение продолжительности пребывания и лечения в отделении интенсивной терапии в сочетании с высокими рисками развития послеоперационных осложнений накладывают существенное экономическое бремя.
Стратификация риска ПОФП среди больных, направленных на КШ, является клинически значимой и сложной задачей. Клинико-анамнестические и лабораторные факторы, предложенные в качестве предикторов этого неблагоприятного исхода, продемонстрировали свои ограничения и невысокую диагностическую эффективность [4]. Вне зависимости от реализуемого патогенетического сценария, инициация ПОФП невозможна без наличия анатомического или электрофизиологического аритмогенного субстрата. Логично предположить, что более тщательное исследование функции предсердий может предоставить дополнительную информацию для решения обсуждаемой задачи.
Известно, что и спекл-трекинг эхокардиография (СТ-ЭхоКГ) является перспективным неинвазивным методом оценки функции левого предсердия (ЛП), дающим представление об изменении длины сегмента миокарда в разные фазы сердечного цикла [5]. Согласно недавно опубликованным результатам крупного метаанализа (1093 пациента из 12 исследований), деформационные показатели ЛП обладают важным прогностическим потенциалом в отношении определения вероятности развития ПОФП у пациентов, перенесших изолированное КШ и не имевших ранее зарегистрированных пароксизмов ФП [6]. Вместе с тем стоит признать небольшое число работ, особенно, отечественных, посвященных этой проблеме, что подчеркивает актуальность проведенного оригинального исследования.
Цель исследования: изучить возможность использования показателей деформации ЛП, полученных с помощью трансторакальной СТ-ЭхоКГ, для прогнозирования впервые возникшей ПОФП у пациентов, перенесших КШ на работающем сердце.
Материал и методы
В данное одноцентровое проспективное исследование было включено 111 больных ИБС, направленных для проведения планового КШ. Критерии невключения: проведение повторного или сочетанного кардиохирургического вмешательства, наличие данных за перенесенный мозговой инсульт, наличие в анамнезе указаний на пароксизмы предсердной тахиаритмии. Из исследования исключались больные с КШ, проведенным в условиях искусственного кровообращения, пациенты с хронической сердечной недостаточностью 4 функционального класса по классификации Нью-Йоркской ассоциации сердца.
Всем пациентам двумя экспертами в условиях нормосистолии проводилась трансторакальная СТ-ЭхоКГ на ультразвуковом аппарате экспертного класса EPIQ 5 (Philips, Нидерланды). Визуализация изучаемых структур, расчеты ультразвуковых параметров выполнялись с учетом действующих рекомендаций ASE и EACVI [7].
Двумерная эхокардиография с технологией отслеживания серого пятна и последующий анализ спекл-трекинга проводился на ультразвуковых изображениях с частотой кадров не менее 50 в сек. Кривые деформации ЛП были созданы путем автоматического отслеживания эндокардиальной границы в апикальной четырехкамерной проекции в конце диастолы в соответствии с R-R алгоритмом (нулевой уровень деформации установлен на зубце R). Фазовый анализ стрейна ЛП проводился следующим образом: стрейн резервуара определялся как пиковый продольный стрейн ЛП, стрейн сокращения был равен значению деформации ЛП в конце диастаза непосредственно перед началом зубца P на электрокардиограмме, а стрейн в фазу кондуита соответствовал разнице между значениями стрейна в фазу резервуара и в фазу кондуита [8]. Результаты сопоставлялись с данными о средних значениях показателей деформации ЛП у здоровых лиц: стрейн резервуара (Peak Atrial Longitudinal Strain, PALS) — 39,4% (95% доверительный интервал (ДИ): 38,0-40,8), стрейн кондуита (Left Atrial Conduit Strain, LACS) — 23,0% (95% ДИ: 20,7-25,2), стрейн сокращения (Left Atrial Contractile Strain, LACtS) — 17,4% (95% ДИ: 16,0-19,0) [9].
После проведения предоперационного скрининга проводилось изолированное КШ на работающем сердце, больные наблюдались до выписки из стационара для регистрации конечной точки: впервые возникшего устойчивого пароксизма ПОФП. Для контроля возникновения конечной точки во время пребывания в отделении анестезиологии и реанимации проводился непрерывный электрокардиографический мониторинг, после перевода в кардиохирургическое отделение электрокардиограмма регистрировалась при появлении жалоб на неритмичное сердцебиение. Больные получали медикаментозную терапию в соответствии с действующими клиническими рекомендациями. Антиаритмическая терапия назначалась только в случае регистрации ПОФП.
Материалы исследования были подвергнуты статистической обработке с использованием методов параметрического и непараметрического анализа. Накопление, корректировка, систематизация исходной информации и визуализация полученных результатов проводилась в электронных таблицах Microsoft Office Excel 2010. Статистический анализ осуществлялся с использованием программы IBM SPSS Statistics 26. Описание и сравнение количественных показателей выполняли с учетом распределения, соответствие которого нормальному оценивали с помощью критерия Колмогорова-Смирнова. При подтверждении нормальности распределения данные описывали с помощью средней арифметической (M), стандартного отклонения (SD) и 95% ДИ. Сравнение выполняли с помощью t-критерия Стьюдента. При отсутствии нормальности распределения указывали значения медианы (Me), нижнего и верхнего квартилей [Q1-Q3], показатели сравнивали с помощью критерия Манна-Уитни. Сравнение показателей, измеренных в номинальной шкале, проводили при помощи критерия хи-квадрат Пирсона. Время до регистрации конечных точек оценивали с использованием метода Каплана-Мейера.
Результаты
В ходе наблюдения ПОФП была зарегистрирована у 11 больных (10%). Медиана регистрации конечной точки составила 4 дня (рис. 1).
Сформированные в зависимости от достижения конечной точки группы оказались сопоставимы по основным клинико-демографическим характеристикам (табл. 1).
При анализе исследуемых ультразвуковых параметров статистически значимых различий выявлено не было (табл. 2).
Подавляющее большинство исследуемых больных имели снижение функции ЛП, доминировали нарушения кондуитной (94 пациента, 85%) и резервуарной функций (85 больных, 77%). Несмотря на более частую регистрацию снижений показателей деформации ЛП у больных с ПОФП, выявленные различия не носили статистически достоверного характера (рис. 2).
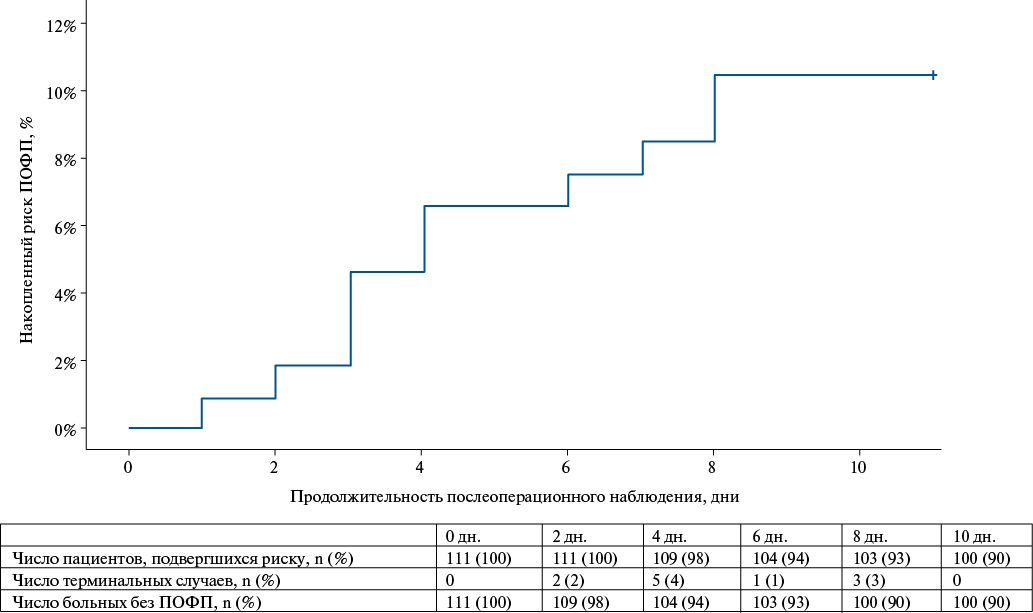
Рис. 1. Кривая выживаемости Каплана-Майера, отражающая накопленный риск ПОФП.
Сокращение: ПОФП — послеоперационная фибрилляция предсердия.
Таблица 1
Клинико-демографические характеристики пациентов, включенных в исследование
Ультразвуковой показатель | Все больные (n=111) | Больные с ПОФП (n=11) | Больные без ПОФП (n=100) | P 3-4 |
1 | 2 | 3 | 4 | 5 |
Возраст, лет | 62 (57-67) | 64 (58-66) | 62 (57-67) | 0,851 |
Мужской пол, n (%) | 93 (84) | 8 (73) | 85 (85) | 0,677 |
АГ, n (%) | 103 (93) | 11 (100) | 92 (92) | 0,330 |
СД, n (%) | 42 (38) | 4 (36) | 38 (38) | 0,915 |
Ожирение, n (%) | 92 (83) | 9 (82) | 83 (83) | 0,745 |
ХОБЛ, n (%) | 24 (22) | 3 (27) | 21 (21) | 0,631 |
ХБП, n (%) | 10 (9) | 9 (82) | 1 (1) | 0,992 |
ХСН ФК 2, n (%) | 56 (50) | 3 (27) | 53 (53) | 0,265 |
ХСН ФК 3, n (%) | 44 (40) | 6 (55) | 38 (38) | 0,287 |
СНнФВ, n (%) | 6 (5) | 0 | 6 (6) | 0,404 |
СНусФВ, n (%) | 25 (23) | 2 (18) | 23 (23) | 0,717 |
Примечание: данные представлены в виде абсолютного числа больных (%) или в виде Me (Q1-Q3), если не указано иное.
Сокращения: АГ — артериальная гипертензия, ПОФП — послеоперационная фибрилляция предсердия, СД — сахарный диабет, СНнФВ — сердечная недостаточность со сниженной фракцией выброса, СНусФВ — сердечная недостаточность с умеренно сниженной фракцией выброса, ХБП — хроническая болезнь почек, ХОБЛ — хроническая обструктивная болезнь лёгких, ХСН — хроническая сердечная недостаточность, ФК — функциональный класс.
Таблица 2
Ультразвуковые показатели пациентов, включенных в исследование
Ультразвуковой показатель | Все больные (n=111) | Больные c ПОФП (n=11) | Больные без ПОФП (n=100) | P 3-4 |
1 | 2 | 3 | 4 | 5 |
Объем ЛП, мл | 57 (46-66) | 57 (47-66) | 54 (40-65) | 0,435 |
Индексированный объем ЛП, мл/м2 | 28,4 (24,3-34,2) | 28,4 (24,3-34,2) | 27,7 (23-34,5) | 0,611 |
ЛПдл, см | 5,2 (4,8-5,5) | 5,2 (4,8-5,5) | 5,3 (4,7-5,5) | 0,949 |
ЛПшир, см | 3,8 (3,6-4,0) | 3,8 (3,6-4,0) | 3,8 (3,7-4,1) | 0,925 |
ЛПпз, см | 3,8 (3,4-4,0) | 3,8 (3,5-4,1) | 3,6 (3,3-3,9) | 0,153 |
ППдл, см | 4,6 (4,4-4,9) | 4,6 (4,4-4,9) | 4,6 (4,5-4,8) | 0,964 |
ППшир, см | 3,4 (3,1-3,6) | 3,4 (3,1-3,6) | 3,4 (3,1-3,8) | 0,804 |
ФВ ЛЖ, % | 55 (50-59) | 55 (49-59) | 55 (50-57) | 0,882 |
КДО ЛЖ, мл | 100 (86-123) | 105 (86-127) | 96 (84-100) | 0,176 |
PALS | 31,1 (26,1-37,6) | 31,1 (26,1-39,3) | 31,1 (23,8-34) | 0,338 |
LACS | 12,6 (9,3-19,5) | 13,8 (9,4-20,3) | 12,1 (8,6-16,5) | 0,326 |
LACtS | 16,9 (12,7-21,3) | 17,4 (12,8-21,3) | 15,4 (11,3-22,6) | 0,537 |
Примечание: данные представлены в виде абсолютного числа больных (%) или в виде Me (Q1-Q3), если не указано иное.
Сокращения: КДО ЛЖ — конечно-диастолический объём левого желудочка, ЛП — левое предсердие, ЛПдл — верхне-нижний размер левого предсердия, ЛПшир — медиально-латеральный размер левого предсердия, ЛПпз — передне-задний размер левого предсердия, ПОФП — послеоперационная фибрилляция предсердия, ППдл — верхне-нижний размер правого предсердия, ППшир — медиально-латеральный размер правого предсердия, ФВ ЛЖ — фракция выброса левого желудочка.
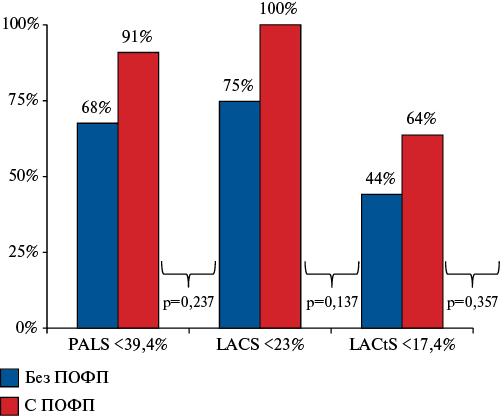
Рис. 2. Гистограммы сравнительного распределения частоты снижения резервуарной, кондуитной и сократительной деформации у больных ИБС в зависимости от регистрации конечной точки.
Сокращения: ПОФП — послеоперационная фибрилляция предсердия, PALS — стрейн резервуара (Peak Atrial Longitudinal Strain), LACS — стрейн кондуита (Left Atrial Conduit Strain), LACtS — стрейн сокращения (Left Atrial Contractile Strain).
Обсуждение
Важным трендом в современной коронарной хирургии является реализация персонифицированного подхода, направленного на минимизацию частоты нежелательных событий после КШ, часть из которых ассоциирована с ПОФП [10]. В проведенном исследовании частота ПОФП составила 10%, что намного ниже частоты этого осложнения, представленного другими авторами. Так, Higgs M, et al., проведя метаанализ 10 исследований (6173 участника), установили, что это осложнение возникает у 25% (95% ДИ: 0,19-0,30) больных после КШ. Похожую частоту ПОФП (24%) указывает и группа американских исследователей [11]. В недавно опубликованном оригинальном исследовании, проведенном согласно похожему дизайну, ПОФП была зарегистрирована в 33% случаев [12]. Подобные различия могут быть обусловлены рядом факторов, связанных как с характеристиками исследуемой популяции, так и с методологическими аспектами проведения исследований.
Установленная в данном исследовании частота первой манифестации ПОФП может объясняться хирургической техникой выполнения КШ на работающем сердце, рутинно используемой в ФГБУ "ФЦССХ" Минздрава России (г. Астрахань). Известно, что воспалительные медиаторы, особенно, при наличии хронического воздействия ишемии на миокард, могут инициировать аритмогенное ремоделирование предсердий. Отказ от использования искусственного кровообращения имеет ряд преимуществ, связанных со снижением системного воспалительного ответа на оперативное вмешательство, который может выступать важным фактором инициации ПОФП [13, 14]. Другим важным хирургическим аспектом, снижающим риск ПОФП, является задняя перикардиотомия, выполненная всем больным из проведенного исследования. Имеются данные, убедительно указывающие на то, что кровь, скапливающаяся в перикардиальном пространстве после кардиохирургического вмешательства, играет ведущую роль в формировании прооксидантной и провоспалительной среды, обладающей аритмогенным потенциалом [15]. Создание сообщения между полостью перикарда и левой плевральной полостью позволяет устранить этот патогенетический механизм и снизить вероятность ПОФП [16].
Большое число опубликованных работ указывает на важность предоперационной ультразвуковой оценки функции ЛП у больных ИБС, направляемых на КШ. Часто выдвигаются гипотезы, согласно которым деформационные показатели могут предоставить дополнительную информацию о риске ПОФП [12]. Так, в одной из работ было продемонстрировано, что больные после КШ без ПОФП имели лучшие показатели резервуарной (26,9±6,9 vs 20,5±4,3, p<0,001) и контрактильной функций ЛП (14,9±3,7 vs 12,8±3,7, p=0,012), а также достоверно более высокое значение глобального стрейна ЛП (24,3±6,6 vs 17,7±4,1, p<0,001) [17]. Вместе с тем стремительное увеличение числа публикаций, посвященных изучению связей между деформационными показателями ЛП и ПОФП, не привело к появлению валидного общепринятого алгоритма индивидуальной оценки риска ПОФП [18], что подчеркивает актуальность проведенного исследования.
Согласно распространенной экспертной позиции, в основе инициации структурной перестройки предсердий лежат повышенная системная гемодинамическая нагрузка и локальный миокардиальный стресс [19]. Активация патогенных сигнальных путей приводит к избыточной секреции матриксных протеиназ и фиброзных белков, таких как коллаген. Это приводит к увеличению жесткости миокарда (снижению его эластичности), что непосредственно сказывается на способности ЛП растягиваться и аккумулировать кровь во время систолы желудочков, нарушая его резервуарную функцию. Такой сценарий проаритмического ремоделирования предсердий объясняет имеющиеся литературные данные. Так, при проведении многофакторного анализа было установлено, что значения PALS <28% повышали риск ПОФП в 3,6 раза (95% ДИ: 2,2-5,9; р<0,001) [12]. Аналогичные результаты были получены и в крупном метаанализе [20].
В проведенном нами исследовании подавляющее большинство больных ИБС имели сниженные значения показателей деформации ЛП в сравнении с данными о средних значениях показателей деформации ЛП у здоровых лиц [9]. Возможно, неразрешенным вопросом, имеющим важное значение в контексте обсуждаемой проблемы, является отсутствие референтных диапазонов значений деформационных показателей ЛП, валидированных на разных когортах больных ИБС, направленных на операцию КШ. Этот факт может ограничивать прогностическую эффективность результатов СТ-ЭхоКГ. Это может объяснять полученные в ходе настоящего исследования результаты, указывающие на отсутствие связей между параметрами деформации миокарда ЛП, полученными в ходе дооперационного скрининга, и риском ПОФП у больных с ИБС, которым проводилось КШ на работающем сердце. Несмотря на отсутствие подобных выводов в найденных работах других исследователей, эти данные могут оказать значимый вклад в текущее понимание взаимосвязей между структурными изменениями сердца, аритмическими осложнениями и хирургическими особенностями кардиохирургических вмешательств. Опыт проведения научного поиска в направлении прогнозирования клинически важных конечных точек указывает на отсутствие единственного предиктора и на необходимость учета большого спектра факторов, которые в комбинации определяют вероятность наступления события, в данном случае ПОФП [21]. Считается, что ПОФП является результатом сочетания у больного нескольких факторов: морфологического и электрофизиологического субстрата, триггера и факторов, обеспечивающих поддержание аритмии. Вероятно, деформационные характеристики могут помочь только в выявлении групп больных ИБС с наличием морфологической основы для возникновения ФП. Вместе с тем целый ряд существенных факторов, связанных с наличием коморбидных состояний, хирургической техникой, течением раннего послеоперационного периода, могут выполнять роль патогенетических механизмов реализации ПОФП, модифицируя автономную регуляцию, системный воспалительный ответ и электролитный баланс. Складывающаяся гетерогенность патогенетических факторов затрудняет проведение предоперационной стратификации риска ПОФП и требует комплексного подхода к решению этой проблемы на основании разработки и валидации сложных многофакторных моделей, учитывающих разные предикторы аритмии.
Ограничения исследования. Точность и интерпретация результатов СТ-ЭхоКГ могут зависеть от множества факторов, включая технические аспекты ультразвукового оборудования и квалификацию оператора. Кроме того, размер выборки и её состав играют значительную роль. Вероятно, для решения поставленной задачи потребуются исследования с большим числом пациентов или с учетом дополнительных параметров, таких как степень ишемии или локализация поражений коронарных артерий, наличие других доказанных предикторов ПОФП.
Заключение
Полученные данные могут указывать на незначимый прогностический потенциал показателей деформации ЛП, полученных с помощью СТ-ЭхоКГ, для прогнозирования впервые возникшей ПОФП у пациентов, перенесших КШ на работающем сердце. Результаты исследования следует интерпретировать с позиций известных ограничений, что подчеркивает необходимость продолжения исследовательской работы для верификации первоначальных выводов.
Отношения и деятельность: все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье.
Список литературы
1. Бондаренко Б. Б., Григорьева А. В., Соколова Л. А. и др. Возможности предоперационного прогнозирования рецидивов фибрилляции предсердий после радиочастотной аблации легочных вен. Трансляционная медицина. 2020;7(5):616. doi:10.18705/23114495202075616.
2. Eikelboom R, Sanjanwala R, Le ML, et al. Postoperative Atrial Fibrillation After Cardiac Surgery: A Systematic Review and Meta Analysis. Ann Thorac Surg. 2021;111:54454. doi:10.1016/j.athoracsur.2020.05.104.
3. Megens MR, Churilov L, Thijs V. New‐Onset Atrial Fibrillation After Coronary Artery Bypass Graft and Long‐Term Risk of Stroke: A Meta‐Analysis. J Am Heart Assoc. 2017;6. doi:10.1161/JAHA.117.007558.
4. Мингалимова А. Р., Чащин М. Г., Арутюнян А. Г. и др. Среактивный белок: периоперационная динамика и прогностическая значимость в оценке риска развития фибрилляции предсердий у пациентов после коронарного шунтирования. Кардиоваскулярная терапия и профилактика. 2023;22(7):3594. doi:10.15829/1728880020233594.
5. Ганаев К. Г., Власова Э. Е., Авалян А. А. и др. Первый опыт применения технологии спекл трекинг эхокардиографии в двумерном режиме для оценки связи нарушения деформации левого предсердия с фибрилляцией предсердий после коронарного шунтирования. Российский кардиологический журнал. 2022;27(7):5026. doi:10.15829/1560407120225026.
6. Голухова Е. З., Булаева Н. И., Мрикаев Д. В. и др. Оценка деформации левого предсердия с помощью спекл трекинг эхокардиографии для прогнозирования послеоперационной фибрилляции предсердий после коронарного шунтирования: систематический обзор и метаанализ. Российский кардиологический журнал. 2023;28(7):5349. doi:10.15829/1560407120235349.
7. Lang RM, Badano LP, Mor Avi V, et al. Recommendations for cardiac chamber quantification by echocardiography in adults: An update from the American society of echocardiography and the European association of cardiovascular imaging. Eur Heart J Cardiovasc Imaging. 2015;16:23371. doi:10.1093/ehjci/jev014.
8. Badano LP, Kolias TJ, Muraru D, et al. Standardization of left atrial, right ventricular, and right atrial deformation imaging using twodimensional speckle tracking echocardiography: a consensus document of the EACVI/ASE/Industry Task Force to standardize deformation imaging. Eur Hear J — Cardiovasc Imaging. 2018;19:591600. doi:10.1093/ehjci/jey042.
9. Pathan F, D'Elia N, Nolan MT, et al. Normal Ranges of Left Atrial Strain by Speckle Tracking Echocardiography: A Systematic Review and Meta Analysis. J Am Soc Echocardiogr. 2017;30:5970.e8. doi:10.1016/j.echo.2016.09.007.
10. Taha A, Nielsen SJ, Bergfeldt L, et al. New‐Onset Atrial Fibrillation After Coronary Artery Bypass Grafting and Long‐Term Outcome: A Population‐Based Nationwide Study From the SWEDEHEART Registry. J Am Heart Assoc. 2021;10. doi:10.1161/JAHA.120.017966.
11. Kislitsina ON, Cox JL, Shah SJ, et al. Preoperative left atrial strain abnormalities are associated with the development of postoperative atrial fibrillation following isolated coronary artery bypass surgery. J Thorac Cardiovasc Surg. 2022;164:91724. doi:10.1016/j.jtcvs.2020.09.130.
12. Pastore MC, Degiovanni A, Grisafi L, et al. Left Atrial Strain to Predict Postoperative Atrial Fibrillation in Patients Undergoing Coronary Artery Bypass Grafting. Circ Cardiovasc Imaging. 2024;17. doi:10.1161/CIRCIMAGING.123.015969.
13. Chen YC, Liu CC, Hsu HC, et al. Systemic immune—inflammation index for predicting postoperative atrial fibrillation following cardiac surgery: a metaanalysis. Front Cardiovasc Med. 2024;11. doi:10.3389/fcvm.2024.1290610.
14. Arslan G, Erol G, Kartal H, et al. The Incidence of Atrial Fibrillation after On Pump Versus Off Pump Coronary Artery Bypass Grafting. Heart Surg Forum. 2021;24:E64550. doi:10.1532/hsf.3873.
15. St Onge S, Perrault LP, Demers P, et al. Pericardial Blood as a Trigger for Postoperative Atrial Fibrillation After Cardiac Surgery. Ann Thorac Surg. 2018;105:3218. doi:10.1016/j.athoracsur.2017.07.045.
16. Xiong T, Pu L, Ma YF, et al. Posterior pericardiotomy to prevent newonset atrial fibrillation after coronary artery bypass grafting: a systematic review and metaanalysis of 10 rando mized controlled trials. J Cardiothorac Surg. 2021;16:233. doi:10.1186/s1301902101611x.
17. Bagherinejad Somesarayi SA, Faridi L, Mohammadi K, et al. Conventional and twodimensional strain echocardiography in predicting postoperative atrial fibrillation after coronary artery bypass grafting surgery. Casp J Intern Med. 2023;14:608. doi:10.22088/cjim.14.1.60.
18. Fleet H, Pilcher D, Bellomo R, et al. Predicting atrial fibrillation after cardiac surgery: a scoping review of associated factors and systematic review of existing prediction models. Perfusion. 2023;38:92108. doi:10.1177/02676591211037025.
19. Илов Н. Н., Арнаудова К. Ш., Нечепуренко А. А. и др. Роль внеклеточного матрикса сердца в возникновении и прогрессировании хронической сердечной недостаточности. Российский кардиологический журнал. 2021;26(2S):4362. doi:10.15829/1560407120214362.
20. Kawczynski MJ, Gilbers M, Van De Walle S, et al. Role of preoperative transthoracic echocardiography in predicting postoperative atrial fibrillation after cardiac surgery: a systematic review of the literature and metaanalysis. EP Eur. 2021;23:173143. doi:10.1093/europace/euab095.
21. Iglesias Álvarez D, Fu X, Martínez Cereijo JM, et al. Clinical Profiling and Biomarkers for Post Operative Atrial Fibrillation Prediction in Patients Undergoing Cardiac Surgery. J Clin Med. 2023;12:3565. doi:10.3390/jcm12103565.
Об авторах
Н. Н. ИловРоссия
Николай Николаевич Илов — к. м. н., доцент кафедры сердечно-сосудистой хирургии; врачсердечно-сосудистый хирург отделения хирургического лечения сложных нарушений ритма сердца и электрокардиостимуляции.
Астрахань
Конфликт интересов:
авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье
С. М. Герасименко
Россия
Светлана Михайловна Герасименко — врач ультразвуковой диагностики.
Астрахань
Конфликт интересов:
авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье
Д. Р. Стомпель
Россия
Динара Рафаиловна Стомпель — зав. отделением функциональной диагностики, ассистент кафедры сердечно-сосудистой хирургии.
Астрахань
Конфликт интересов:
авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье
Х. З. Измайлов
Россия
Халит Зарифович Измайлов — врач функциональной диагностики.
Астрахань
Конфликт интересов:
авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье
Т. К. Рашидова
Россия
Тамара Кулумбековна Рашидова — врач ультразвуковой диагностики.
Астрахань
Конфликт интересов:
авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье
И. Р. Каримов
Россия
Ильфат Рамилевич Каримов — клинический ординатор кафедры сердечно-сосудистой хирургии.
Астрахань
Конфликт интересов:
авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье
В. Н. Колесников
Россия
Владимир Николаевич Колесников — главный врач.
Астрахань
Конфликт интересов:
авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье
Дополнительные файлы
- Большинство больных ишемической болезнью сердца, направляемых на операцию коронарного шунтирования, имеют сниженные значения деформационных показателей левого предсердия. Преимущественно выявляются нарушения кондуитной и резервуарной функций.
- Полученные данные могут указывать на отсутствие значимых связей между параметрами деформации миокарда левого предсердия и риском послеоперационной фибрилляции предсердий у пациентов, перенесших коронарное шунтирование на работающем сердце, что может объясняться особенностями проведенного хирургического лечения.
Рецензия
Для цитирования:
Илов Н.Н., Герасименко С.М., Стомпель Д.Р., Измайлов Х.З., Рашидова Т.К., Каримов И.Р., Колесников В.Н. Стратификация риска послеоперационной фибрилляции предсердий при выполнении изолированного коронарного шунтирования на работающем сердце: фокус на деформационные характеристики левого предсердия. Российский кардиологический журнал. 2024;29(7):5903. https://doi.org/10.15829/1560-4071-2024-5903. EDN: FVUUNT
For citation:
Ilov N.N., Gerasimenko S.M., Stompel D.R., Izmailov Kh.Z., Rashidova T.K., Karimov I.R., Kolesnikov V.N. Risk stratification of postoperative atrial fibrillation in isolated off-pump coronary artery bypass grafting: focus on left atrial strain characteristics. Russian Journal of Cardiology. 2024;29(7):5903. (In Russ.) https://doi.org/10.15829/1560-4071-2024-5903. EDN: FVUUNT
JATS XML

















































