Перейти к:
Госпитальные результаты имплантации центрифугальной системы поддержки функции левого желудочка пациентам с тяжелой хронической сердечной недостаточностью (опыт НМИЦ кардиологии им. ак. Е.И. Чазова)
https://doi.org/10.15829/1560-4071-2024-5846
EDN: LVLASA
Аннотация
Цель. Изучить госпитальные результаты имплантаций центрифугальной системы вспомогательного кровообращения (иЛЖ) и поддержки функции левого желудочка (ЛЖ) у пациентов с терминальной хронической сердечной недостаточностью (ХСН).
Материал и методы. Критериями включения в исследование являлись: расчетная площадь поверхности тела >1,2 м2, терминальная ХСН, фракция выброса ЛЖ <30%, сердечный индекс <2,2 л/мин, длительная оптимальная медикаментозная терапия ХСН. Пациенты рассматривались на имплантацию центрифугальной системы поддержки системной гемодинамики — иЛЖ в рамках конечной терапии (целевая терапия), но не исключалась возможность последующей трансплантации сердца при целесообразности.
Результаты. иЛЖ имплантирован 23 пациентам; все — мужчины, средний возраст 59,1±10 лет; средний индекс массы тела 26±4,6 кг/м2, 10 из них — с дилатационной и 13 — с ишемической кардиомиопатией. Сахарный диабет встречался у 3 (13%); хроническая болезнь почек — у 3 (13%); сопутствующий онкологический диагноз имелся у 4 (17%) пациентов. Среднее значение теста шестиминутной ходьбы (ТШХ) при поступлении в стационар — 257±71 м. Одному пациенту с раком желудка имплантация устройства выполнена в рамках стратегии "мост к лечению активного рака". 30-дневная летальность составила 9% (n=2). Один из двоих умерших больных имел длительный анамнез терминальной сердечной недостаточности, дефицит массы тела, проявления старческой астении с выраженной мышечной слабостью. Второй смертельный случай — исход ранней послеоперационной правожелудочковой недостаточности. К выписке у пациентов имелась оптимальная производительность иЛЖ в соответствии с антропометрическими характеристиками и физической активностью. По данным эхокардиографии достигнуты критерии разгрузки левых камер сердца. ТШХ при выписке — 298±78 м.
Заключение. Госпитальные результаты имплантации центрифугальной системы поддержки функции ЛЖ пациентам с терминальной ХСН демонстрируют высокую эффективность в поддержке системной гемодинамики на фоне приемлемого профиля безопасности у пациентов крайне высокого периоперационного риска.
Ключевые слова
Для цитирования:
Ганаев К.Г., Дзыбинская Е.В., Нарусов О.Ю., Власова Э.Е., Аманатова В.А., Шахраманова Ж.А., Латыпов Р.С., Мершин К.В., Певзнер Д.В., Терещенко С.Н., Ширяев А.А., Акчурин Р.С., Бойцов С.А. Госпитальные результаты имплантации центрифугальной системы поддержки функции левого желудочка пациентам с тяжелой хронической сердечной недостаточностью (опыт НМИЦ кардиологии им. ак. Е.И. Чазова). Российский кардиологический журнал. 2024;29(6):5846. https://doi.org/10.15829/1560-4071-2024-5846. EDN: LVLASA
For citation:
Ganaev K.G., Dzybinskaya E.V., Narusov O.Yu., Vlasova E.E., Amanatova V.A., Shakhramanova Zh.A., Latypov R.S., Mershin K.V., Pevzner D.V., Tereshchenko S.N., Shiryaev A.A., Akchurin R.S., Boytsov S.A. Inhospital outcomes of implantation of a centrifugal left ventricular assist device in patients with endstage heart failure: experience of the Chazov National Medical Research Center of Cardiology. Russian Journal of Cardiology. 2024;29(6):5846. (In Russ.) https://doi.org/10.15829/1560-4071-2024-5846. EDN: LVLASA
Хроническая сердечная недостаточность (ХСН) в XXIв стала основной причиной заболеваемости и смертности пациентов с сердечно-сосудистыми заболеваниями в развитых странах. За последние три десятилетия достижения в области доказательной медицины с усовершенствованием фармакологической терапии и внедрением новых устройств позволили более целостно и многофакторно подойти к вопросу лечения пациентов с ХСН, что закономерно привело к улучшению выживаемости, с одной стороны, и к увеличению частоты распространённости терминальной ХСН, с другой [1].
Трансплантация сердца (ТС) является золотым стандартом долгосрочного лечения подходящих пациентов с терминальной стадией ХСН. Однако ограниченность донорских сердец, временные ограничения донорских органов, а также несоответствие кандидатов в реципиенты привели к развитию механических устройств гемодинамической поддержки левого желудочка (ЛЖ).
Согласно российским исследованиям, ЭПОХА-ХСН и ЭПОХА-О-ХСН, частота ХСН в Российской Федерации составляет 7% (7,9 млн человек), из которой на III-IV функциональный класс приходится до 2,1% (2,4 млн человек) [2]. Несмотря на внушительное количество пациентов с терминальной ХСН, ТС рекомендуется только ограниченному числу подходящих пациентов. Общее число пациентов в листе ожидания на пересадку сердца в Российской Федерации к концу календарного года на протяжении последних лет составляло от 700 до 823 пациентов, а количество выполненных пересадок сердца варьировало от 250 до 335 операций в год за тот же промежуток времени. Эти цифры показывают нехватку донорских сердец для трансплантаций и тот факт, что большинство пациентов в итоге не попадают на ТС [3][4].
Имплантируемые вспомогательные устройства для ЛЖ (иЛЖ), которые осуществляют гемодинамическую поддержку, произвели революцию в лечении пациентов с выраженной сердечной недостаточностью (СН), став альтернативой пересадке сердца. Первоначально иЛЖ имплантировались как "мост к пересадке сердца", чтобы снизить высокий уровень смертности среди пациентов, ожидающих донорское сердце. Однако нехватка донорских органов, существенное увеличение коморбидности и возраста пациентов с ХСН, а также внедрение иЛЖ нового поколения привели к тому, что иЛЖ был одобрен в качестве конечной (целевой) терапии для лечения терминальной стадии ХСН [5].
Целью настоящего исследования является изучение госпитальных результатов имплантации иЛЖ у пациентов с терминальной ХСН.
Материал и методы
С 2022 по 2023гг в программу имплантации иЛЖ на базе НМИЦК им. акад. Е. И. Чазова включены больные с терминальной ХСН со сниженной фракцией выброса (ФВ) ЛЖ (ФВ <30%), рефрактерной к оптимальной медикаментозной терапии.
Дополнительными обязательными критериями для рассмотрения возможности включения пациента в программу имплантации иЛЖ являлись:
- Площадь поверхности тела >1,2 м2;
- Потребность в инотропной поддержке или сердечный индекс <2,2 л/мин/м2;
- Отсутствие значимой дисфункции правого желудочка (ПЖ);
- Отсутствие значимой коморбидной патологии, не связанной с ХСН, или наличие обратимой коморбидной патологии после ее компенсации;
- Социальный статус — поддержка родственников, хорошие бытовые условия и др.
Все пациенты обследовались по расширенному протоколу с предварительной консультацией врача-трансплантолога. Пациенты рассматривались на имплантацию иЛЖ в рамках конечной терапии, но не исключалась возможность последующей ТС при целесообразности. Со всеми пациентами проводились неоднократные консультации с подробным информированием и наглядным представлением недостатков и преимуществ возможных методов лечения.
Описание иЛЖ и особенности имплантации
иЛЖ состоит из 4 основных частей: насоса, кабеля, системного контроллера и внешнего источника энергии. Насос соединяется с полостью ЛЖ при помощи приточной канюли, а отточная канюля и сосудистый протез обеспечивают перемещение крови в аорту.
Источником энергии для насоса является пара внешних батарей или блок питания (предусмотрен резервный краткосрочный аккумулятор в системном контроле). Насос постоянно подключен к контроллеру для мониторинга и отображения всех параметров. При возникновении значимых отклонений система оповещает об этом посредством акустических и визуальных сигналов (рис. 1).
Операции выполнялись через срединную стернотомию в условиях параллельного искусственного кровообращения, что, прежде всего, позволило обеспечить интраоперационную безопасность — гемодинамическую стабильность во время всех хирургических этапов. Все этапы операции выполнялись под сопровождением чреспищеводной эхокардиографии (ЭхоКГ). После определения места расположения приточной канюли, в большинстве случаев, по технике "пришить, затем разрезать" устанавливалась манжета, и с помощью цилиндрического ножа формировалось круглое отверстие для приточной канюли (рис. 2).
Статистическая обработка данных проводилась с помощью программного обеспечения Statistica, версия 10 (StatSoft, США) и Medcalc, версия 5,0. Выполнена проверка данных на нормальность распределения (визуальный анализ гистограммы, асимметрия, эксцесс, коэффициент вариации, критерий Колмогорова-Смирнова). Часть количественных переменных представлена в виде среднего арифметического (M) и стандартного отклонения (SD), другая часть — в виде медианы (интерквартильный размах 25-й и 75-й процентили), Me (Q1-Q3). Анализировались госпитальные данные: гемодинамические и ЭхоКГ показатели, послеоперационные осложнения, длительность нахождения в реанимации и в стационаре, тест с шестиминутной ходьбой, параметры иЛЖ, 30-дневная летальность и особенности летальных случаев.
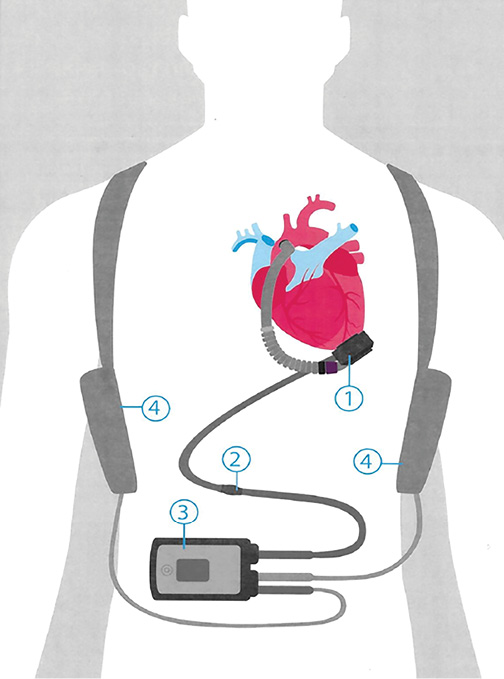
Рис. 1. Составные части системы иЛЖ.
1. Насос. 2. Кабель. 3. Системный контроллер с дисплеем. 4. Аккумуляторы.
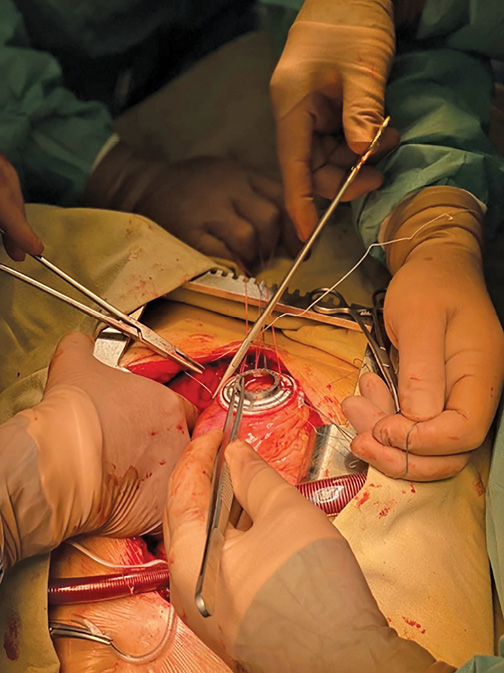
Рис. 2. Установка апикальной манжеты. Этап имплантации манжеты насоса.
Результаты и обсуждение
Имплантация иЛЖ выполнена 23 пациентам: все — мужчины, средний возраст 59,1±10 лет; средний индекс массы тела 26±4,6 кг/м2, площадь поверхности тела — 2,0±0,2 м2. По этиологии СН: 10/23 имели дилатационную кардиомиопатию и 13/23 — ишемическую кардиомиопатию. Сахарный диабет встречался у 3 (13%); хроническая болезнь почек — у 3 (13%); сопутствующий онкологический диагноз имелся у 4 (17%) пациентов. Среднее значение теста шестиминутной ходьбы при поступлении в стационар — 257±71 м (табл. 1).
Предымплантационные данные ЭхоКГ и центральной гемодинамики представлены в таблице 2. Все пациенты имели расширенный (дилатированный) ЛЖ с тяжелой систолической дисфункцией: конечно диастолический размер ЛЖ 8,1 см, конечно-диастолический объем ЛЖ 314 мл, ФВ ЛЖ 21±3%. У 22 пациентов отмечена исходная дисфункция ПЖ, которая потребовала предоперационной подготовки, в т. ч. с внутривенным введением левосимендана. Основной точкой приложения левосимендана являлся ПЖ — улучшение его функционального резерва к повышенной преднагрузке, которая возникает после имплантации иЛЖ.
Большинство имплантаций выполнено в рамках конечной терапии. Одному пациенту с раком желудка операция выполнена в рамках стратегии "мост к лечению активного рака". Выполнение вмешательства по удалению желудка на фоне терминальной СН было признано онкохирургами невозможным. ТС была противопоказана по причине наличия онкологического заболевания с неблагоприятным прогнозом. Поэтому первым этапом был имплантирован иЛЖ (операция и послеоперационный период без особенностей). Вторым этапом в ФГБУ "НМИЦ онкологии им. Н. Н. Блохина" выполнена операция: гастрэктомия, лимфодиссекция D2, спленэктомия, резекция хвоста поджелудочной железы. Операция прошла успешно. Явлений СН на фоне имплантированного иЛЖ не отмечалось.
В 6 случаях одномоментно с имплантацией иЛЖ выполнено коронарное шунтирование (среднее количество шунтов 1,7), а у 3 пациентов выполнено ушивание открытого овального окна. В 1 случае имплантация иЛЖ потребовала иссечения кальцинированной аневризмы ЛЖ. Длительность искусственного кровообращения составила 97±22 мин. Динамический контроль параметров центральной гемодинамики (в условиях отделения реанимации и интенсивной терапии (ОРИТ)) и дальнейший ЭхоКГ контроль показал улучшение показателей центральной гемодинамики после операции у всех пациентов — достижение адекватного сердечного индекса, среднего артериального давления на фоне разгрузки левых камер сердца (табл. 3).
Дооперационная подготовка с внутривенным введением левосимендана всем больным во многом себя оправдала в виде снижения частоты развития послеоперационной правожелудочковой недостаточности; ПЖ недостаточность, потребовавшая инотропной терапии в больших дозах и ингаляционной терапии оксидом азота в послеоперационном периоде, зарегистрирована в 3 (13%) случаях. Однако критерии ПЖ дисфункции отмечены у 7 (30%) пациентов. Заместительная почечная терапия проводилась у 2 пациентов. Рестернотомия выполнялась у 3 пациентов: в 2 случаях с целью гемостаза, в третьем случае для подключения ПЖ обхода с одномоментным коронарным шунтированием. Одному больному, учитывая развитие внелегочной формы острого респираторного дистресс-синдрома, была установлена вено-венозная экстракорпоральная мембранная оксигенация. Среди осложнений доминирующую роль занимал асептический левосторонний плеврит (18/23); торакоцентезы потребовались 13 из 23 больных. Трое пациентов в послеоперационном периоде имели рецидивирующую гемодинамически значимую желудочковую тахикардию (ЖТ) ("электрический шторм"). Двое из них в анамнезе имели частые желудочковые экстрасистолии, пароксизмы ЖТ, которым в кратчайшие сроки на фоне иЛЖ была выполнена радиочастотная аблация (РЧА) субстрата аритмии. В первом случае достигнуто полное устранение аритмии, во втором случае эпизоды "медленной" ЖТ сохранялись. Необходимость выполнения РЧА до имплантации иЛЖ была предметом обсуждения в процессе подготовки больных, однако индукция желудочковой аритмии при электрофизиологическом исследовании, на фоне критически низкого сердечного выброса, могла потребовать экстренной механической поддержки кровообращения. К тому же, имеющиеся желудочковые нарушения ритма сердца могли быть проявлением перегрузки левых камер сердца давлением, и имплантация иЛЖ устранила бы провоцирующий фактор аритмии. Таким образом, было принято решение о выполнении операций по имплантации иЛЖ с последующим выполнением РЧА ЖТ при сохранении показаний.
При выполнении аблации ЖТ на фоне иЛЖ мы столкнулись с техническими сложностями в виде электромагнитных помех при электрофизиологическом исследовании, которые были отфильтрованы в ручном режиме. На фоне работы иЛЖ, несмотря на индукцию ЖТ, гемодинамический профиль пациентов оставался относительно стабильным.
Значимый послеоперационный делирий наблюдался у 4 из 20 (20%) пациентов, из которых у одного с отягощенным неврологическим анамнезом (повторные инсульты), на фоне нейролептиков, развился злокачественный нейролептический синдром, который потребовал длительного лечения. Средняя длительность пребывания в ОРИТ и в стационаре после имплантации устройства составили 8,2±6,3 и 34±16,9 сут., соотносительная 30-дневная летальность составила 9% (табл. 4).
К выписке у всех пациентов достигнута оптимальная производительность иЛЖ в соответствии с антропометрическими характеристиками и физической активностью пациентов.
Наш опыт применения иЛЖ пациентам с терминальной ХСН согласуется с данными других исследований по всему миру и подтверждает безопасность и эффективность устройства для популяции пациентов в Российской Федерации.
Один из двоих умерших больных имел длительный анамнез терминальной СН, дефицит массы тела, проявления старческой астении с выраженной мышечной слабостью. Ему предлагалась операция по пересадке сердца задолго до включения в программу имплантации иЛЖ, но пациент отказался от предлагаемого вида лечения. Имплантация иЛЖ была выполнена по витальным показаниям в качестве "операции отчаяния". Пациент умер на 2-е сутки после операции от неокклюзирующей острой мезентеральной ишемии. Второй смертельный случай — исход ранней послеоперационной правожелудочковой недостаточности. В анамнезе пароксизмы гемодинамически значимой ЖТ. На 1-е послеоперационные сутки, несмотря на инотропную и ингаляционную NO терапию, отмечались быстропрогрессирующие явления дисфункции правых камер сердца с развитием непрерывно рецидивирующей, рефрактерной к медикаментозной и электроимпульсной терапии ЖТ, переходящей в фибрилляцию желудочков. Больной экстренно был взят в операционную для подключения системы "обхода ПЖ". Несмотря на обширное рубцовое поражение миокарда в бассейне левой коронарной артерии, с целью нивелирования вклада возможной ишемии в электрическую нестабильность миокарда, одномоментно было выполнено коронарное шунтирование. Больной скончался на 12-е послеоперационные сутки от диссеминированного внутрисосудистого свертывания и полиорганной недостаточности на фоне экстракорпорального правожелудочкового обхода (табл. 5).
Совсем недавно имплантацию иЛЖ в качестве целевой терапии применяли только пациентам, которые имели относительные или абсолютные противопоказания к ТС. В настоящее время внедрение иЛЖ нового поколения, оптимизация хирургических подходов и улучшение качества долгосрочной курации позволили рассматривать имплантацию иЛЖ как альтернативу ТС [5]. Однако, несмотря на сопоставимую двухлетнюю выживаемость с ТС при имплантации иЛЖ, отмечается немалая частота послеоперационных осложнений и отдаленных нежелательных явлений, что определяет крайнюю важность отбора "правильного" пациента и "правильного" времени имплантации иЛЖ [6]. Оценка кандидата на имплантацию иЛЖ должна включать рассмотрение множества факторов, в т. ч. психосоциальных, бытовых, организационных и т. д. Сама по себе операция и дальнейшее функционирование иЛЖ связано с ранними и поздними рисками неблагоприятных событий, значительным использованием ресурсов и затратами и повторными госпитализациями. Поэтому крайне важно, чтобы при отборе пациента достигался максимально возможный лечебный эффект, с самым высоким соотношением польза/риск для пациента.
Предоперационная оценка наличия сердечной кахексии должна являться обязательным условием обследования пациентов с терминальной СН. Сердечная кахексия может быть заподозрена при потере веса более чем на 5% в течение как минимум 6 мес., не связанной с применением диуретиков или другими несердечными причинами [7]. Ее наличие прогнозирует долгий реабилитационный период и повышение смертности независимо от клинико-демографических характеристик [8]. Проанализировав смертельный случай нашего больного, основываясь на данных литературы и опыте экспертных центров, мы полагаем, что решение об имплантации иЛЖ у пациентов с кахексией, выраженной старческой астенией, должно быть строго индивидуальным. Необходимость имплантации иЛЖ должна основываться на оценке тяжести сопутствующих состояний, их связи с низким сердечным выбросом и обратимостью заболеваний. Клиническая оценка кандидата на имплантацию иЛЖ должна быть комплексной и включать индивидуальный реабилитационный потенциал.
Таблица 1
Клинико-демографическая характеристика пациентов
Показатель | n=23 |
Возраст, лет; среднее значение ±СО | 59,1±10 |
Мужчины, n (%) | 23 (100) |
ИМТ, кг/м2; среднее значение ±СО | 26±4,6 |
ППТ, м2; среднее значение ±СО Диапазон (минимум, максимум) | 2,0±0,2 1,57, 2,6 |
САД, мм рт.ст.; среднее значение ±СО | 93±8 |
ДАД, мм рт.ст.; среднее значение ±СО | 63±6 |
Этиология ХСН | |
Ишемическая кардиомиопатия, n (%) | 13 (57) |
Дилатационная кардиомиопатия, n (%) | 10 (43) |
Коморбидность | |
Сахарный диабет, n (%) | 3 (13) |
ХБП, n (%) | 3 (13) |
КШ в анамнезе, n (%) | 1 (4) |
Онкопатология, n (%) | 4 (17) |
ТШХ, м; среднее значение ±СО | 257±71 |
NT-proBNP, пг/мл; медиана (Q1, Q3) | 2239 (1412, 4238) |
Сокращения: ДАД — диастолическое артериальное давление, ИМТ — индекс массы тела, КШ — коронарное шунтирование, ППТ — площадь поверхности тела, САД — систолическое артериальное давление, СО — стандартное отклонение, ТШХ — тест шестиминутной ходьбы, ХБП — хроническая болезнь почек, ХСН — хроническая сердечная недостаточность, NT-proBNP — N-концевой промозговой натрийуретический пептид.
Таблица 2
Предымплантационные данные ЭхоКГ и центральной гемодинамики на фоне оптимальной медикаментозной терапии
Показатели ЭхоКГ | n=23 |
ФВ ЛЖ, %; среднее значение ±СО Медиана (Q1, Q3) | 21±3 22 (20, 23) |
КДО ЛЖ, мл; медиана (Q1, Q3) | 314 (268, 370) |
КДР ЛЖ, см; медиана (Q1, Q3) | 8,1 (7,6, 8,5) |
ФВ ПЖ, %; среднее значение ±СО Медиана (Q1, Q3) | 42±7 42 (38, 46) |
TAPSE, см; среднее значение ±СО Медиана (Q1, Q3) | 1,7±0,4 1,7 (1,4, 1,9) |
RVD1/4AC; среднее значение ±СО Медиана (Q1, Q3) | 0,6±0,12 0,6 (0,5, 0,7) |
Митральная регургитация | |
1-2, n (%) | 12 (52) |
>2, <3, n (%) | 10 (44) |
≥3, n (%) | 1 (4) |
Параметры центральной гемодинамики (данные КПОС) | |
СИ, л/мин/м2; медиана (Q1, Q3) | 1,9 (1,8, 2,3) |
ДЛАср., мм рт.ст.; медиана (Q1, Q3) | 25 (16, 38) |
ДЗЛА, мм рт.ст.; медиана (Q1, Q3) | 16 (10, 22) |
ЛСС, ед. Вуд; медиана (Q1, Q3) | 2,5 (1,9, 3,3) |
Сокращения: ДЗЛА — давление заклинивания легочной артерии, ДЛАср. — среднее давление в легочной артерии, КДО — конечно диастолический объем, КДР — конечно диастолический размер, КПОС — катетеризация правых отделов сердца, ЛЖ — левый желудочек, ЛСС — легочное сосудистое сопротивление, ПЖ — правый желудочек, СИ — сердечный индекс, СО — стандартное отклонение, ФВ — фракция выброса, ЭхоКГ — эхокардиография, RVD1/4AC — отношение размера правого желудочка к левому, TAPSE — систолическая экскурсия плоскости трикуспидального кольца.
Таблица 3
Показатели ЭхоКГ и параметры центральной гемодинамики на фоне работы иЛЖ
Показатели ЭхоКГ | n=20 |
КДР ЛЖ, см; медиана (Q1, Q3) | 6,3 (6,0, 7,2) |
Митральная регургитация | |
1, n (%) | 14 (70) |
1-2, n (%) | 6 (30) |
АДср., мм рт.ст.; среднее значение ±СО Медиана (Q1, Q3) | 71±6 71 (68, 76) |
СИ, л/мин/м2 (1-2 сутки в ОРИТ); среднее значение ±СО Медиана (Q1, Q3) | 2,8±0,3 2,6 (2,4, 3,0) |
Сокращения: АДср. — среднее артериальное давление, КДР — конечно диастолический размер, ЛЖ — левый желудочек, ОРИТ — отделение реанимации и интенсивной терапии, СИ — сердечный индекс, СО — стандартное отклонение, ЭхоКГ — эхокардиография.
Таблица 4
Госпитальные результаты имплантации иЛЖ
Пациент-устройство (соотношение) | 23:23 |
Сочетанные операции | |
иЛЖ + КШ, n (%) | 7 (30) |
иЛЖ + ушивание ООО, n (%) | 4 (17) |
Поэтапные операции | |
иЛЖ (1 этап) + онкохирургия (2 этап), n (%) | 1 (4) |
иЛЖ (1 этап) + РЧА ЖТ (2 этап), n (%) | 2 (9) |
Обход ПЖ, n (%) | 1 (4) |
Вено-венозная ЭКМО | 1 (4) |
ЗПТ, n (%) | 2 (9) |
Послеоперационные осложнения | |
ПЖ дисфункция, n (%) | 7 (30) |
ПЖ недостаточность, n (%) | 3 (13) |
Послеоперационный делирий, n (%) | 4 (17) |
Плеврит, n (%) | 18 (78) |
30-дневная летальность, n (%) | 2 (9%) |
Продолжительность койко-дня в ОРИТ, дни; | 8,2±6,3 |
Продолжительность койко-дня в стационаре, дни; | 34±16,9 |
ТШХ, м; среднее значение ±СО | 298±78 |
Сокращения: ЖТ — желудочковая тахикардия, ЗПТ — заместительная почечная терапия, иЛЖ — центрифугальная система вспомогательного кровообращения, искусственный левый желудочек, КШ — коронарное шунтирование, ООО — открытое овальное окно, ОРИТ — отделение реанимации и интенсивной терапии, ПЖ — правый желудочек, РЧА — радиочастотная аблация, СО — стандартное отклонение, ТШХ — тест шестиминутной ходьбы, ЭКМО — экстракорпоральная мембранная оксигенация.
Таблица 5
Смертельные исходы
Пациент | Отличительные особенности | Продолжительность иЛЖ поддержки, дни | Причина смерти |
1 | Антропометрия: Рост — 168 см Вес — 46 кг ИМТ — 19 ППТ — 1,5 Старческая астения | 2 | Неокклюзирующая острая мезентеральная ишемия |
2 | Исходная ПЖ дисфункции, пароксизмы ЖТ Длительный анамнез тромбоза ПЖ | 12 | Ранняя послеоперационная правожелудочковая недостаточность |
Сокращения: ЖТ — желудочковая тахикардия, иЛЖ — центрифугальная система вспомогательного кровообращения, искусственный левый желудочек, ИМТ — индекс массы тела, ПЖ — правый желудочек, ППТ — площадь поверхности тела.
Заключение
Госпитальные результаты имплантации иЛЖ пациентам с терминальной ХСН демонстрируют высокую эффективность в поддержке системной гемодинамики на фоне приемлемого профиля безопасности у пациентов крайне высокого периоперационного риска. Случай поэтапного лечения больного с сопутствующим раком желудка показывает возможность безопасного выполнения хирургического лечения на фоне имплантированного иЛЖ в рамках стратегии "мост к лечению рака". Выраженный дефицит массы тела, при отсутствии обратимых причин, должен рассматриваться как фактор неблагоприятного послеоперационного исхода. Наличие правожелудочковой недостаточности, пароксизмов ЖТ в анамнезе являются факторами риска плохих ранних послеоперационных исходов и нуждаются в максимальной возможной коррекции в период до имплантации иЛЖ.
Отношения и деятельность: все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье.
Список литературы
1. McDonagh TA, Metra M, Adamo M, et al. 2021 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure. Eur Heart J. 2021;42(36):3599-726. doi:10.1093/eurheartj/ehab368.
2. Поляков Д.С., Фомин И.В., Беленков Ю.Н. и др. Хроническая сердечная недостаточность в Российской Федерации: что изменилось за 20 лет наблюдения? Результаты исследования ЭПОХА-ХСН. Кардиология. 2021;61(4):4-14.
3. Готье С.В., Хомяков С.М. Оценка потребности населения в трансплантации органов, донорского ресурса и планирование эффективной сети медицинских организаций (центров трансплантации). Вестник трансплантологии и искусственных органов. 2013;15(3):11-24.
4. Готье С.В., Хомяков С.М. Донорство и трансплантация органов в Российской Федерации в 2019 году. XII сообщение регистра Российского трансплантологического общества. Вестник трансплантологии и искусственных органов. 2020;22(2):8-34.
5. Varshney AS, DeFilippis EM, Cowger JA, et al. Trends and Outcomes of Left Ventricular Assist Device Therapy: JACC Focus Seminar. J Am Coll Cardiol. 2022;79(11):1092-107. doi:10.1016/j.jacc.2022.01.017.
6. Mehra MR, Uriel N, Naka Y, et al. MOMENTUM 3 Investigators. A Fully Magnetically Levitated Left Ventricular Assist Device — Final Report. N Engl J Med. 2019;380(17):1618- 27. doi:10.1056/NEJMoa1900486.
7. Okoshi MP, Capalbo RV, Romeiro FG, et al. Cardiac Cachexia: Perspectives for Prevention and Treatment. Arq Bras Cardiol. 2017;108(1):74-80. doi:10.5935/abc.20160142.
8. Vest AR, Price LL, Chanda A, et al. Cardiac Cachexia in Left Ventricular Assist Device Recipients and the Implications of Weight Gain Early After Implantation. J Am Heart Assoc. 2023;12(13):e029086. doi:10.1161/JAHA.122.029086.
Об авторах
К. Г. ГанаевРоссия
Ганаев Камиль Гаджимурадович — м.н.с. отдела сердечно-сосудистой хирургии
Москва
Е. В. Дзыбинская
Россия
Дзыбинская Елена Владимировна — с.н.с. лаборатории анестезиологии и защиты миокарда
Москва
О. Ю. Нарусов
Россия
Нарусов Олег Юрьевич — к.м.н., с.н.с. отдела заболеваний миокарда и сердечной недостаточности
Москва
Э. Е. Власова
Россия
Власова Элина Евгеньевна — к.м.н., с.н.с. отдела сердечно-сосудистой хирургии
Москва
В. А. Аманатова
Россия
Аманатова Валерия Александровна — к. м. н., м. н. с. отдела заболеваний миокарда и сердечной недостаточности
Москва
Ж. А. Шахраманова
Россия
Шахраманова Жанна Александровна — аспирант отдела заболеваний миокарда и сердечной недостаточности
Москва
Р. С. Латыпов
Россия
Латыпов Руслан Сергеевич — к.м.н., сердечно-сосудистый хирург
Москва
К. В. Мершин
Россия
Мершин Кирилл Вячеславович — к. м. н., сердечно-сосудистый хирург
Москва
Д. В. Певзнер
Россия
Певзнер Дмитрий Вольфович — д.м.н., руководитель отдела неотложной кардиологии
Москва
С. Н. Терещенко
Россия
Терещенко Сергей Николаевич — профессор, руководитель отдела заболеваний миокарда и сердечной недостаточности
Москва
А. А. Ширяев
Россия
Ширяев Андрей Андреевич — д.м.н., профессор, член-корр. РАН, руководитель лаборатории микрохирургии сердца и сосудов
Москва
Р. С. Акчурин
Россия
Акчурин Ренат Сулейманович — д. м. н., профессор, академик РАН, зам. генерального директора по хирургии, руководитель отдела сердечно-сосудистой хирургии
Москва
С. А. Бойцов
Россия
Бойцов Сергей Анатольевич — д.м.н., профессор, академик РАН, генеральный директор
Москва
Дополнительные файлы
- Искусственный левый желудочек (иЛЖ) демонстрирует высокую эффективность в поддержке системной гемодинамики у пациентов с терминальной сердечной недостаточностью.
- Хирургическое лечение злокачественной онкологии может быть безопасно выполнено на фоне иЛЖ в рамках стратегии "мост к лечению рака".
- Правожелудочковая недостаточность, пароксизмальная форма желудочковой тахикардии в анамнезе являются факторами риска плохих ранних послеоперационных исходов и нуждаются в максимальной возможной коррекции в период до имплантации иЛЖ.
Рецензия
Для цитирования:
Ганаев К.Г., Дзыбинская Е.В., Нарусов О.Ю., Власова Э.Е., Аманатова В.А., Шахраманова Ж.А., Латыпов Р.С., Мершин К.В., Певзнер Д.В., Терещенко С.Н., Ширяев А.А., Акчурин Р.С., Бойцов С.А. Госпитальные результаты имплантации центрифугальной системы поддержки функции левого желудочка пациентам с тяжелой хронической сердечной недостаточностью (опыт НМИЦ кардиологии им. ак. Е.И. Чазова). Российский кардиологический журнал. 2024;29(6):5846. https://doi.org/10.15829/1560-4071-2024-5846. EDN: LVLASA
For citation:
Ganaev K.G., Dzybinskaya E.V., Narusov O.Yu., Vlasova E.E., Amanatova V.A., Shakhramanova Zh.A., Latypov R.S., Mershin K.V., Pevzner D.V., Tereshchenko S.N., Shiryaev A.A., Akchurin R.S., Boytsov S.A. Inhospital outcomes of implantation of a centrifugal left ventricular assist device in patients with endstage heart failure: experience of the Chazov National Medical Research Center of Cardiology. Russian Journal of Cardiology. 2024;29(6):5846. (In Russ.) https://doi.org/10.15829/1560-4071-2024-5846. EDN: LVLASA
JATS XML

















































