Перейти к:
Изменение экспрессии изоформ LEPR в локальных жировых депо при коронарном атеросклерозе и приобретенных пороках сердца
https://doi.org/10.15829/1560-4071-2024-5826
EDN: RUVAOW
Аннотация
Цель. Оценить экспрессию изоформ рецептора лептина в локальных жировых депо у пациентов с ишемической болезнью сердца (ИБС) и приобретенными пороками сердца (ППС).
Материал и методы. В исследование включено 120 пациентов с ИБС. Группу сравнения составило 96 пациентов с дегенеративным аортальным стенозом (АС). Экспрессию шести изоформ гена рецептора лептина (LEPR1, LEPR2, LEPR2/2, LEPR3, LEPR3/2, LEPR4) оценивали с помощью количественной полимеразной цепной реакции в реальном времени в подкожной (ПЖТ), эпикардиальной (ЭЖТ) и периваскулярной (ПВЖТ) жировой ткани. Статистическую обработку данных проводили c использованием программного пакета Statistica 10.0 и SPSS 17.0 for Windows.
Результаты. В ЭЖТ выявлены минимальные уровни экспрессии LEPR1, LEPR2, LEPR2/2, LEPR3, LEPR3/2, LEPR4 относительно ПЖТ и ПВЖТ в группе пациентов с ИБС. У пациентов с ИБС уровни мРНК шести изоформ LEPR были ниже аналогичных показателей пациентов с АС. У лиц с ППС зарегистрировано снижение экспрессии LEPR1, LEPR2, LEPR2/2, LEPR3, LEPR3/2, LEPR4 в ПЖТ относительно ЭЖТ и ПВЖТ. Однако лишь изоформы LEPR1 и LEPR2 были статистически значимо ниже в ПЖТ у пациентов с АС при сравнении с пациентами с ИБС. В ПВЖТ установлены максимальные уровни мРНК шести изоформ LEPR в обеих группах. Между пациентами с ИБС и пороками сердца не наблюдалось статистически значимых различий в экспрессии LEPR1, LEPR2, LEPR2/2, LEPR3, LEPR3/2, LEPR4.
Заключение. Для пациентов с ИБС характерно выраженное снижение экспрессии шести изоформ LEPR в ЭЖТ. Снижение экспрессии изученных изоформ LEPR в ЭЖТ ассоциировано с нарушением адипогенеза, гипертрофией адипоцитов, формированием инсулинорезистентности, усилением провоспалительных факторов, гиперлептинемией, прогрессированием атеросклероза. Выявленные особенности ЭЖТ у пациентов с ИБС, вероятно, могут оказывать как местное, так и системное негативное влияние на сердечно-сосудистую систему.
Ключевые слова
Для цитирования:
Горбатовская Е.Е., Белик Е.В., Дылева Ю.А., Учасова Е.Г., Понасенко А.В., Фанаскова Е.В., Стасев А.Н., Груздева О.В. Изменение экспрессии изоформ LEPR в локальных жировых депо при коронарном атеросклерозе и приобретенных пороках сердца. Российский кардиологический журнал. 2024;29(8):5826. https://doi.org/10.15829/1560-4071-2024-5826. EDN: RUVAOW
For citation:
Gorbatovskaya E.E., Belik E.V., Dyleva Yu.A., Uchasova E.G., Ponasenko A.V., Fanaskova E.V., Stasev A.N., Gruzdeva O.V. LEPR isoform expression changes in local fat depots in coronary atherosclerosis and acquired heart defects. Russian Journal of Cardiology. 2024;29(8):5826. (In Russ.) https://doi.org/10.15829/1560-4071-2024-5826. EDN: RUVAOW
Ишемическая болезнь сердца (ИБС) и аортальный стеноз (АС) являются лидирующими нозологиями среди сердечно-сосудистых заболеваний (ССЗ). Несмотря на многочисленные исследования, проведенные на протяжении десятилетий, остается ряд нерешенных вопросов, касающихся развития и прогрессирования данных заболеваний [1]. Согласно современной патофизиологической модели ИБС, в основе лежит нарушение баланса между реальным кровоснабжением миокарда и его потребностями, обусловленное в большинстве случаев атеросклерозом коронарных артерий (КА). Молекулярные механизмы атеросклероза представляют собой сложную сеть клеточных событий, которые до конца не изучены. Представления о том, что развитие атеросклероза и заболеваний клапанов сердца взаимосвязано, является предметом дискуссий. Эпидемиологические данные свидетельствуют о том, что стеноз аортального клапана (АК) и атеросклероз имеют общие факторы риска. Кроме того, на начальных стадиях патогенез АС подобен атеросклерозу и характеризуется разрушением базальной мембраны, воспалением, клеточной инфильтрацией, отложением липидов. Впрочем, несмотря на то, что коронарный атеросклероз и стеноз АК имеют схожие патофизиологические предпосылки в отношении инициации, вероятно, существует различный механизм их эволюции.
В результате многочисленных исследований сформировалось предположение о том, что лептин может принимать участие как в ускорении атеросклеротического процесса, так и способствует кальцификации клапанных интерстициальных клеток, а также независимо предсказывает острые сердечно-сосудистые события [2][3]. Точный механизм воздействия лептина на сердечно-сосудистую систему до конца неясен.
Для реализации биологических эффектов лептину необходимо связаться со своими специфическими рецепторами (LEPR), которые широко распространены в центральной нервной системе и периферических органах и тканях [4]. Жировая ткань (ЖТ) является важной мишенью действия лептина посредством аутокринной регуляции за счет наличия как длинной, так и коротких изоформ LEPR [5]. Эффекты лептина на ЖТ могут различаться в зависимости от локализации, типа адипоцитов и включают помимо контроля липидного обмена другие физиологические процессы, такие как адипогенез, термогенез, апоптоз, воспаление, чувствительность к инсулину [6]. Нарушение образования лептин-рецепторного комплекса в ЖТ способствует гипертрофии адипоцитов, избыточному накоплению триглицеридов, повышенной продукции активных форм кислорода (АФК) и провоспалительных цитокинов, снижению деградации лептина и формированию местной лептинорезистентности, что может вносить непосредственный вклад в развитие и прогрессирование ССЗ.
У пациентов с ИБС и приобретенными пороками сердца (ППС) особый интерес представляет изучение экспрессии шести изоформ LEPR в жировые депо сердца. Поскольку эпикардиальная (ЭЖТ) и периваскулярная (ПВЖТ) ЖТ способны претерпевать структурные и функциональные изменения в патофизиологических условиях [7][8]. Понимание того, как уровень экспрессии изоформ LEPR влияет на эффекты лептина в ЭЖТ и ПВЖТ, может дать важные подсказки для понимания патофизиологии ССЗ. Однако в связи с особенностями локализации и трудностями получения образцов ткани у человека такие исследования единичны.
Цель исследования: оценить экспрессию изоформ рецептора лептина в локальных жировых депо сердца у пациентов с ИБС и ППС.
Материал и методы
Исследование проводилось в соответствии c "Правилами надлежащей клинической практики" и соответствовало стандартам локального этического учреждения и принципам Хельсинкской декларации. В исследование включено 120 пациентов с ИБС. Критериями включения служили наличие показаний к коронарному шунтированию (по данным коронарографии), мужской пол, возраст пациента от 18 до 75 лет, подписанное добровольное информированное согласие пациента на участие в исследовании. Критерии исключения: женский пол, отказ пациента от участия в исследовании, возраст пациента >75 лет, наличие сахарного диабета 1 и 2 типа, декомпенсация хронической сердечной недостаточности, не контролируемая артериальная гипертензия, наличие клинически значимой сопутствующей патологии. В группу сравнения вошло 96 пациентов АС, которым планировалась хирургическая коррекция изолированного порока АК, обусловленного дегенеративным повреждением или врожденной аномалией (двустворчатый клапан).
Пациенты с ИБС получали медикаментозную терапию, согласно клиническим рекомендациям по лечению стабильной ИБС (2020г) — гепарин, клопидогрел, аспирин, ингибиторы ангиотензинпревращающего фермента, β-адреноблокаторы, блокаторы кальциевых каналов, нитраты, статины; пациенты с ППС также — варфарин (табл. 1).
Во время кардиохирургического вмешательства (коронарного шунтирования или коррекции стеноза АК) были получены биоптаты ЖТ. Образцы подкожной ЖТ (ПЖТ) забирали из подкожной клетчатки нижнего угла средостенной раны, ЭЖТ — из правых отделов сердца (правого предсердия и правого желудочка) — зон наибольшего присутствия ЖТ, ПВЖТ — в области восходящей части аорты.
Суммарную РНК выделяли из ЖТ с использованием набора RNeasy® Plus Universal Mini Kit (Qiagen, Германия) в соответствии с протоколом производителя. Оценка количества и качества очищенной РНК производилась на спектрофотометре NanoDrop 2000 (Thermo Fisher Scientific) путем измерения поглощения света при 280 нм, 260 нм и 230 нм и расчета 260/280 (А260/280) и 260/230 (А260/280) и 260/230 (А260/280). Целостность РНК определяли электрофорезом в агарозном геле с последующей визуализацией с использованием системы Gel Doc™ XR+ (Bio-Rad, США). Экстрагированную РНК замораживали и хранили при -70 С.
Одноцепочечную кДНК синтезировали на 96 луночном термоцикле (Applied Biosystems, США) с использованием коммерческого набора для обратной транскрипции кДНК высокой емкости того же производителя. Обратную транскрипцию производили согласно установленной производителем набора программе. Оценку количества и качества синтезированной кДНК производили на спектрофотометре NanoDrop 2000. Образцы замораживали и хранили при -40 C.
Экспрессию шести изоформ гена рецептора лептина (LEPR1, LEPR2, LEPR2/2, LEPR3, LEPR3/2, LEPR4) с помощью количественной полимеразной цепной реакции в реальном времени с использованием анализов экспрессии генов TaqManTM на системе ViiA 7 (Applied Biosystems, США). Структура праймеров представлена в таблице 2. Каждая 20-мкл реакционная смесь содержала 10 мкл TaqManTM Gene Expression Master Mix (Applied Biosystems), 1 мкл TaqManTM Gene Expression Assay (Applied Biosystems) и 9 мкл матрицы кДНК (100 нг кДНК + очищенная вода, с отсутствием нуклеаз), и амплифицировали при следующих условиях термоциклирования: 2 мин при 50 С, 10 мин при 95 С и 40 циклов по 15 с при 95 С и 1 мин при 60 С. Отрицательный контроль готовили из 20 мкл реакционной смеси без матрицы кДНК для каждого образца. Расчет экспрессии тестовых генов производили по методу Пфаффла и выражали в логарифмической (log10) шкале как многократное изменение относительно контрольных образцов.
Статистическая обработка полученных данных была выполнена с помощью STATISTICA 12 и SPSS 17.0. Характер распределения выборки оценивали с применением теста Колмогорова-Смирнова. Количественные признаки представлены в виде абсолютных значений (n) и относительных значений (%), количественные данные — в виде медианы и значений 25-го и 75-го квартилей, Mе (Q25;Q75). Межгрупповое сравнение зависимых групп с распределением признаков, отличных от нормального, проводили при помощи критерия Фридмана, попарное сравнение — критерием Вилкоксона. При сравнении трех зависимых групп для оценки статистической значимости была применена поправка Бонферрони и установлен новый критический уровень значимости р≤0,013. С целью оценки различий количественных признаков при сравнении двух независимых групп был использован непараметрический критерий U-критерий Манна-Уитни. За уровень статистической значимости считали различия при p<0,05.
Таблица 1
Клиническая и анамнестическая характеристика обследованных пациентов
Признак | Пациенты с ИБС, n=120 | Пациенты с ППС, n=96 |
Анамнез | ||
Возраст, лет | 64 [ 58,0;69,0] | 65 [ 55,0;72,0] |
Отягощенная наследственность по сердечно-сосудистой патологии | 57 (47,5%) | 31 (32%) |
Курение | 90 (75%) | 80 (83,3%) |
Артериальная гипертензия в анамнезе | 102 (87,6%) | 64 (66,7%) |
Дислипидемия в анамнезе | 31 (25,8%) | 16 (16,7%) |
Инфаркт миокарда анамнезе | 46 (38,3%) | 8 (8,3%) |
ХИГМ, ОНМК, ТИА в анамнезе | 12 (10%) | 8 (8,3%) |
Индекс массы тела | ||
До 25 кг/м2 25,0-29,9 кг/м2 30,0-39,9 кг/м2 | 56 (46,9%) 53 (43,8%) 11 (9,4%) | 48 (50%) 40 (41,7%) 8 (8,3%) |
Поражение коронарного русла | ||
1-сосудистое поражение КА | 9 (7,5%) | 0 (0%) |
2-сосудистое поражение КА | 18 (15%) | 0 (0%) |
Многососудистое поражение КА | 93 (77,5%) | 0 (0%) |
Функциональная активность ЛЖ | ||
ФВ ЛЖ >50% 40-49% <40% | 106 (88,4%) 10 (8,3%) 4 (3,3%) | 88 (91,7%) 8 (8,3%) 0 (0%) |
Терапия | ||
Аспирин Клопидогрел Варфарин Гепарин β-блокаторы иАПФ Статины Блокаторы Са-каналов Нитраты Диуретики | 114 (95%) 18 (15%) 0 (0%) 120 (100%) 108 (90%) 90 (75%) 120 (100%) 90 (75%) 6 (5%) 96 (80%) | 0 (0%) 0 (0%) 80 (83,3%) 0 (0%) 86 (89,6%) 74 (77,1%) 70 (72,9%) 70 (72,9%) 10 (10,4%) 82 (85,4%) |
Сокращения: иАПФ — ингибиторы ангиотензинпревращающего фермента, ИБС — ишемическая болезнь сердца, КА — коронарная артерия, ЛЖ — левый желудочек, ОНМК — острое нарушение мозгового кровообращения, ППС — приобретенный порок сердца, ТИА — транзиторная ишемическая атака, ФВ — фракция выброса, ХИГМ — хроническая ишемия головного мозга.
Таблица 2
Последовательность нуклеотидов в праймерах рецептора лептина
Ген | Направленность сиквенса | Sequence (5'->3') | Количество нуклеотидов |
LEPR 1 NM_002303.6 (изоформа 1) | Forward primer | ttcttggtccagcccaccatt | 21 |
Reverse primer | agcagggatgtagctgagacaa | 22 | |
LEPR 2 NM_001003680.3 (изоформа 2, альтернативный 3'-концевой экзон) | Forward primer | ttcttggtccagcccaccat | 20 |
Reverse primer | tagcagggatgtagctgagaca | 22 | |
LEPR 2.2 NM_001198687.2 (содержит чередующиеся 5'-UTR и 3'-концевой экзон) | Forward primer | tttcttggtccagcccaccat | 21 |
Reverse primer | gcagggatgtagctgagacaat | 22 | |
LEPR 3 NM_001003679.3 (изоформа 3, альтернативный 3'-концевой экзон) | Forward primer | actgttgctttcggagtgagc | 21 |
Reverse primer | agccagcactgtatgttcca | 20 | |
LEPR 3.2 NM_001198689.2 (содержит чередующиеся 5'-UTR и 3'-концевой экзон) | Forward primer | ttcttggtccagcccaccatt | 21 |
Reverse primer | agcagggatgtagctgagacaa | 22 | |
LEPR 4 NM_001198688.1 (содержит чередующиеся 5'-UTR и 3'-концевой экзон) | Forward primer | ttcttggtccagcccaccatt | 21 |
Reverse primer | agcagggatgtagctgagacaa | 22 |
Результаты
При изучении экспрессии изоформ гена LEPR в локальных жировых депо было установлено, что минимальные уровни мРНК LEPR у пациентов с ИБС наблюдались в ЭЖТ, у пациентов с ППС — в ПЖТ. Максимальные уровни вне зависимости от нозологии выявлены в ПВЖТ (рис. 1).
При ИБС уровень мРНК гена LEPR1 в ЭЖТ был ниже ПЖТ в 2,1 раза, LEPR2 — в 2,1 раза, LEPR2/2 — в 1,2 раза, LEPR3 — в 2 раза, LEPR3/2 — в 1,1 раза, LEPR4 — в 1,5 раза, соответственно. Экспрессия гена LEPR1 в ЭЖТ была снижена относительно показателей ПВЖТ в 4,7 раза, LEPR2 — в 2,6 раза, LEPR2/2 — в 2,1 раза, LEPR3 — в 3,8 раза, LEPR3/2 — в 1,7 раза и LEPR4 — в 2,1 раза, соответственно (рис. 1 А).
Максимальный уровень мРНК гена LEPR всех шести изоформ был характерен для ПВЖТ у пациентов с ИБС. При сравнении экспрессии гена LEPR вышеперечисленных изоформ между ПЖТ и ПВЖТ статистически значимые различия отсутствовали.
Для пациентов с пороками минимальный уровень мРНК LEPR был характерен для ПЖТ (рис. 1 Б). Так, экспрессия гена LEPR1 в ПЖТ была снижена относительно ЭЖТ в 1,7 раза, LEPR2 — в 3 раза, LEPR4 — в 2,1 раза. Статистически значимых различий в уровне мРНК других изоформ рецептора лептина между ПЖТ и ЭЖТ не выявлено. В группе с ППС экспрессия гена LEPR1 в ПЖТ была ниже ПВЖТ в 2,5 раза (рис. 1 Б). Уровень мРНК LEPR2 в ПЖТ был снижен относительно ПВЖТ в 3,4 раза, LEPR2/2 — в 2,8 раза, LEPR3 — в 1,8 раза, LEPR3/2 — в 1,9 раза, LEPR4 в 2,5 раза, соответственно.
При сравнении уровня мРНК гена LEPR вышеперечисленных изоформ между пациентами с коронарогенной и некоронарогенной патологией было установлено, что экспрессия гена LEPR1 в ЭЖТ в группе ИБС была ниже аналогичного показателя в группе ППС в 1,5 раза, LEPR2 — в 2,8 раза, LEPR2/2 — в 1,5 раза, LEPR3 — в 2,2 раза, LEPR3/2 — в 1,9 раза, LEPR4 — в 2,1 раза (табл. 3).
У пациентов с ИБС экспрессия генов LEPR1 и LEPR2 в ПЖТ была выше аналогичного показателя пациентов с ППС в 2,2 раза и 2,3 раза, соответственно. Статистически значимых различий в уровне мРНК других изоформ LEPR в ПЖТ между группами пациентов не выявлено (табл. 3).
Для пациентов с ИБС была характерна повышенная экспрессия гена LEPR1 в ПВЖТ относительно лиц с АС в 2,1 раза (табл. 3). Статистически значимых различий между другими изоформами LEPR в ПВЖТ между пациентами с коронарогенной и некоронарогенной патологией не выявлено.
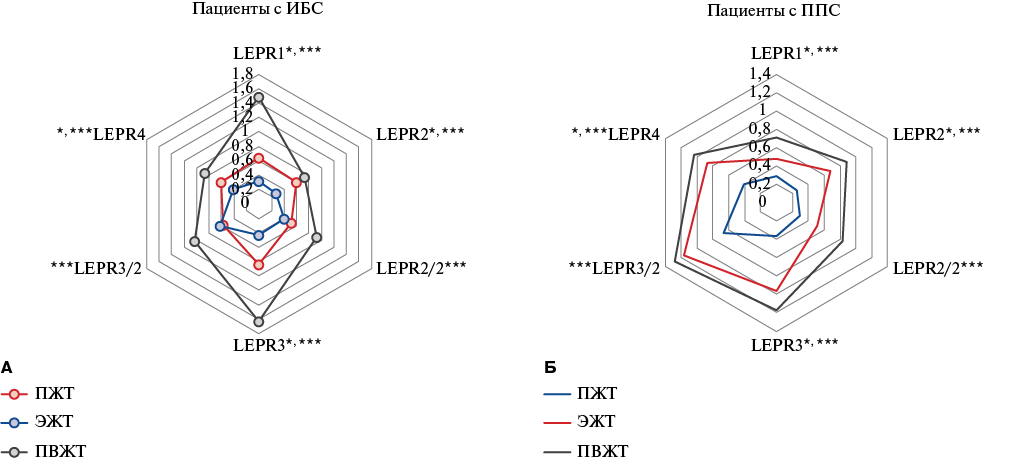
Рис. 1. Экспрессия изоформ LEPR в локальных жировых депо сердца: А — у пациентов с хронической формой ИБС, Б — у пациентов с ППС.
Примечание: * — статистически значимые различия ПЖТ/ЭЖТ, ** — статистически значимые различия ПЖТ/ПВЖТ, *** — статистически значимые различия ЭЖТ/ПВЖТ. Цветное изображение доступно в электронной версии журнала.
Сокращения: ИБС — ишемическая болезнь сердца, ПВЖТ — периваскулярная жировая ткань, ПЖТ — подкожная жировая ткань, ППС — приобретённые пороки сердца, ЭЖТ — эпикардиальная жировая ткань.
Таблица 3
Межгрупповое сравнение экспрессии гена LEPR обследованных пациентов
Показатель, ΔCt | ПЖТ | ЭЖТ | ПВЖТ | |||
ИБС | ППС | ИБС | ППС | ИБС | ППС | |
LEPR1 | 0,64 [ 0,39;1,49] | 0,29* [ 0,11;0,69] | 0,31 [ 0,18;0,54] | 0,48* [ 0,23;1,1] | 1,48 [ 0,91;2,09] | 0,71* [ 0,33;1,42] |
LEPR2 | 0,59 [ 0,35;1,48] | 0,26* [ 0,06;0,53] | 0,28 [ 0,16;0,88] | 0,78* [ 0,29;1,24] | 0,73 [ 0,53;1,03] | 0,98 [ 0,36;3,44] |
LEPR2/2 | 0,52 [ 0,43;1,04] | 0,29 [ 0,08;1,01] | 0,41 [ 0,13;2,07] | 0,61* [ 0,22;3,07] | 0,93 [ 0,71;2,85] | 0,83 [ 0,29;1,66] |
LEPR3 | 0,84 [ 0,32;1,41] | 0,66 [ 0,18;1,14] | 0,43 [ 0,21;1,79] | 0,96* [ 0,51;5,0] | 1,63 [ 1,29;2,51] | 1,17 [ 0,93;3,62] |
LEPR3/2 | 0,57 [ 0,45;1,37] | 0,56 [ 0,19;1,31] | 0,52 [ 0,35;0,91] | 1,16* [ 0,43;6,89] | 1,03 [ 0,73;1,75] | 1,28 [ 0,51;5,04] |
LEPR4 | 0,61 [ 0,42;1,09] | 0,41 [ 0,18;0,84] | 0,41 [ 0,27;1,07] | 0,87* [ 0,41;2,05] | 0,96 [ 0,63;1,75] | 1,04 [ 0,51;2,14] |
Примечание: * — статистически значимые различия между группами (p≤0,05).
Сокращения: ИБС — ишемическая болезнь сердца, ПВЖТ — периваскулярная жировая ткань, ПЖТ — подкожная жировая ткань, ППС — приобретённые пороки сердца, ЭЖТ — эпикардиальная жировая ткань.
Обсуждение
На сегодняшний день данных, касающихся изучения экспрессии изоформ LEPR у пациентов с ИБС и стеноза АК, немного, поскольку большая часть результатов получена при использовании животных и клеточных моделей. У человека идентифицированы шесть вариантов изоформ LEPR, которые были изучены в ходе нашего исследования. В результате установлены как тканеспецифические особенности экспрессии изоформ LEPR, так и различия в зависимости от нозологии. ЭЖТ демонстрирует минимальные уровни мРНК шести изоформ LEPR относительно ЖТ другой локализации в группе пациентов с ИБС. Кроме того, экспрессия шести изоформ LEPR в ЭЖТ у пациентов с ИБС была ниже аналогичных показателей пациентов с ППС. У лиц со стенозом АК наименьшие уровни мРНК LEPR выявлены в ПЖТ, однако лишь изоформы LEPR1 и LEPR2 были ниже, чем у пациентов с ИБС. Экспрессия шести изоформ LEPR в ПВЖТ была максимальной в обеих группах.
LEPR локализован в хромосоме 1 (1p31) и содержит 20 экзонов [9]. Для этого гена описаны несколько вариантов транскрипта, полученных в результате альтернативного сплайсинга (LEPR1, LEPR2, LEPR2/2, LEPR3, LEPR3/2, LEPR4), кодирующие шесть изоформ рецептора лептина. Изоформы LEPR имеют идентичные внеклеточный лиганд-связывающий и трансмембранный домены, представленные 816 и 34 аминокислотами, соответственно. Кроме того, изоформы LEPR имеют одинаковую последовательность первых 29 аминокислот во внутриклеточном домене. Эта последовательность содержит константный мотив box1. Дальнейшая внутриклеточная аминокислотная последовательность генерируется путем альтернативного сплайсинга мРНК LEPR. В зависимости от длины С-конца внутриклеточного домена изоформы рецептора лептина делятся на длинную (LEPR1) и короткие (LEPR2, LEPR2/2, LEPR3, LEPR3/2, LEPR4). Суммарно внутриклеточный домен LEPR1 представлен 302 аминокислотами на С-конце и имеет дополнительные мотивы box2 и box3. Поскольку изоформы LEPR не обладают собственной ферментативной активностью, дополнительные мотивы в LEPR1 необходимы для активации цитоплазматической тирозинкиназы, называемой янус-киназой 2 (JAK2), и дальнейшей передачи сигналов. Внутриклеточные домены LEPR2, LEPR2/2, LEPR3, LEPR3/2, LEPR4 короче и содержат от 32 до 40 аминокислот [9].
Эффект, наблюдаемый после взаимодействия лептина с рецептором, во многом определяется тем, с какой изоформой LEPR связался гормон. При образовании комплекса лептина с LEPR1 запускается как основной сигнальный путь JAK2/STAT3, так и дополнительные — фосфоинозитид-3-киназы (PI3K), митоген-активируемой протеинкиназы (МАРК) в центральной нервной системе и периферических тканях [10][11]. В результате стимулируется выработка анорексигенных пептидов, подавление потребления пищи и увеличение затрат энергии. Короткие изоформы LEPR выступают в роли переносчиков лептина через гематоэнцефалический барьер и в опосредовании лизосомальной деградации лептина.
Изоформы LEPR обнаружены в большинстве тканей, в т. ч. в жировой [6]. Поскольку адипоциты экспрессируют рецепторы лептина, лептин может оказывать прямое влияние на развитие и функцию ЖТ. В исследовании Bornstein SR, et al. (2000) было продемонстрировано, что инкубация адипоцитов in vitro в присутствии физиологических концентраций лептина способствовала активации пути JAK2/STAT3 [12]. Путь JAK2/STAT3 участвует в дифференцировки адипоцитов, регулируя транскрипцию CCAAT-энхансер-связывающих протеинов β (C/EBPβ) [13]. Уменьшение длинной изоформы LEPR в ЭЖТ у пациентов с ИБС и в ПЖТ у пациентов с ППС может приводить к нарушению ранних стадий адипогенеза. Снижение дифференцировки жировых клеток-предшественников приводит к избыточному накоплению триацилглицеролов в зрелых адипоцитах. Адипоциты подвергаются клеточной гипертрофии. Увеличенные жировые клетки выделяют избыток свободных жирных кислот (СЖК), АФК и провоспалительных цитокинов. Чрезмерный приток СЖК из эпикардиальных адипоцитов проникает в адвентицию и способствует накоплению липидов в атеросклеротических бляшках КА [14]. Воспаление ЭЖТ может вызывать дисфункцию в прилежащих тканях, приводя к нарушению микроциркуляции миокарда, к повышенной жесткости сосудов и дилатации левого предсердия [15]. Снижение способности адипоцитов к дифференцировке наряду с гипертрофией в ПЖТ у пациентов с ППС может вызвать воспаление и окислительный стресс в данном жировом депо. Однако из-за особенностей расположения не оказывает непосредственного влияния на сердечно-сосудистую систему. Кроме того, провоспалительная активность и производство АФК в ПЖТ ниже, чем в ЭЖТ [16].
Гипертрофия адипоцитов у пациентов с ИБС может быть также обусловлена снижением выработки оксида азота (NO). При связывании лептина с рецептором в ЖТ повышается активность синтазы NO посредством сложного механизма, включающего PKA (протеинкиназу A) и p42/44 MAPK (митоген-активируемую протеинкиназу), стимулирующую продукцию NO. NO ингибирует синтез глицерина, уменьшает вероятность повторной этерификации жирных кислот, снижает накопление липидов в адипоцитах [17]. Замедленная экспрессия LEPR1 в ЭЖТ у пациентов с ИБС, приводит к уменьшению продукции NO, индуцируя гипертрофию адипоцитов. Поскольку высвобождение лептина зависит от размера адипоцитов, уровень лептина в ЭЖТ повышается и может диффундировать непосредственно в стенки миокарда. Хроническое воздействие лептина способствует гипертрофии и фиброзу кардиомиоцитов, потенцируя дисфункцию миокарда.
Нарушение дифференцировки и гипертрофия адипоцитов, обнаруженные при снижении LEPR1, вызывают дефект доставки транспортера глюкозы типа 4 (GLUT4) к плазматической мембране, и, вероятно, являются одной из причин развития инсулинорезистентности (ИР) в ЖТ [18]. Второй причиной формирования ИР может быть гиперпродукция фактора некроза опухоли-α (ФНО-α). Так, в исследовании Huan J-N, et al. (2003) установлено, что дефицит длинной изоформы LEPR в ЖТ мышей TKO-OBR сопровождается увеличением ФНО-α [19]. ФНО-α индуцирует резистентность к инсулину за счет прямого негативного вмешательства в сигнальный путь инсулина, фосфорилирования IRS1, а также изменяя дифференцировку и метаболизм адипоцитов. В результате подавляется несколько важных метаболических эффектов инсулина, таких как стимуляция транспорта глюкозы в клетку, липогенеза, а также ингибирование изопротеренол-индуцированного липолиза. Увеличивается накопление энергии в ЖТ, которое приводит к повышенному выходу СЖК в кровоток, способствуя ускорению атеросклеротического процесса [20].
Основная функция коротких изоформ LEPR связана с интернализацией и деградацией лептина [9]. Снижение экспрессии пяти коротких изоформ LEPR в ЭЖТ у пациентов с ИБС, может приводить к снижению деградации лептина в данном жировом депо и увеличению его содержания. Таким образом, ЭЖТ возможно будет являться альтернативным источником лептина у пациентов с ИБС, способствующим развитию гиперлептинемии. Поскольку повышенный уровень лептина на сердечно-сосудистую систему оказывает действия, которые потенциально являются атерогенными, тромботическими и ангиогенными, снижение как длинной, так и коротких изоформ LEPR в ЭЖТ у пациентов с ИБС может способствовать прогрессированию ССЗ и развитию неблагоприятных сердечно-сосудистых событий.
Заключение
Для пациентов с ИБС характерно выраженное снижение экспрессии шести изоформ LEPR в ЭЖТ. Снижение экспрессии изученных изоформ LEPR в ЭЖТ ассоциировано с нарушением адипогенеза, гипертрофией адипоцитов, формированием ИР, усилением провоспалительных факторов, гиперлептинемией, прогрессированием атеросклероза. Выявленные особенности ЭЖТ у пациентов с ИБС, вероятно, могут оказывать как местное, так и системное негативное влияние на сердечно-сосудистую систему.
Отношения и деятельность. все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье.
Список литературы
1. Abdul-Rahman T, Lizano-Jubert I, Garg N, et al. The common pathobiology between coronary artery disease and calcific aortic stenosis: Evidence and clinical implications. Prog Cardiovasc Dis. 2023;79:89-99. doi:10.1016/j.pcad.2023.06.002.
2. Raman P, Khanal S. Leptin in Atherosclerosis: Focus on Macrophages, Endothelial and Smooth Muscle Cells. Int J Mol Sci. 2021;22(11):5446. doi:10.3390/ijms22115446.
3. Liu Y, Gu Y, Shen Y, et al. Association Between Serum Leptin Level and Calcific Aortic Valve Disease. J Am Heart Assoc. 2019;(19):e012495. doi:10.1161/JAHA.119.012495.
4. Liu Z, Xiao T, Liu H. Leptin signaling and its central role in energy homeostasis. Front Neurosci. 2023;17:1238528. doi:10.3389/fnins.2023.1238528.
5. Picó C, Palou M, Pomar CA, et al. Leptin as a key regulator of the adipose organ. Rev Endocr Metab Disord. 2022;23(1):13-30. doi:10.1007/s11154-021-09687-5.
6. Martínez-Sánchez N. There and Back Again: Leptin Actions in White Adipose Tissue. Int J Mol Sci. 2020;21(17):6039. doi:10.3390/ijms21176039.
7. Hu H, Garcia-Barrio M, Jiang ZS, et al. Roles of Perivascular Adipose Tissue in Hypertension and Atherosclerosis. Antioxid Redox Signal. 2021;34(9):736-49. doi:10.1089/ars.2020.8103.
8. Синицкий М. Ю., Понасенко А. В., Груздева О. В. Генетический профиль и секретом адипоцитов висцеральной и подкожной жировой ткани у пациентов с сердечно-сосудистыми заболеваниями. Комплексные проблемы сердечно-сосудистых заболеваний. 2017;6(3):155-65. doi:10.17802/2306-1278-2017-6-3-155-165.
9. Wauman J, Zabeau L, Tavernier J. The Leptin Receptor Complex: Heavier Than Expected? Front Endocrinol (Lausanne). 2017;8:30. doi:10.3389/fendo.2017.00030.
10. Tsirigotaki A, Dansercoer A, Verschueren KHG, et al. Mechanism of receptor assembly via the pleiotropic adipokine Leptin. Nat Struct Mol Biol. 2023;30(4):551-63. doi:10.1038/s41594-023-00941-9.
11. Чумакова Г. А., Отт А. В., Веселовская Н. Г. и др. Патогенетические механизмы лептинорезистентности. Российский кардиологический журнал. 2015;(4):107-10. doi:10.15829/1560-4071-2015-4-107-110.
12. Bornstein SR, Abu-Asab M, Glasow A, et al. Immunohistochemical and ultrastructural localization of leptin and leptin receptor in human white adipose tissue and differentiating human adipose cells in primary culture. Diabetes. 2000;49(4):532-8. doi:10.2337/diabetes.49.4.532.
13. Ambele MA, Dhanraj P, Giles R, et al. Adipogenesis: A Complex Interplay of Multiple Molecular Determinants and Pathways. Int J Mol Sci. 2020;21(12):4283. doi:10.3390/ijms21124283.
14. Iacobellis G. Epicardial adipose tissue in contemporary cardiology. Nat Rev Cardiol. 2022;19(9):593-606. doi:10.1038/s41569-022-00679-9.
15. Packer M. Epicardial Adipose Tissue May Mediate Deleterious Effects of Obesity and Inflammation on the Myocardium. J Am Coll Cardiol. 2018;71(20):2360-72. doi:10.1016/j.jacc.2018.03.509.
16. Manna P, Jain SK. Obesity, Oxidative Stress, Adipose Tissue Dysfunction, and the Associated Health Risks: Causes and Therapeutic Strategies. Metab Syndr Relat Disord. 2015;13(10):423-44. doi:10.1089/met.2015.0095.
17. Becerril S, Rodríguez A, Catalán V, et al. Functional Relationship between Leptin and Nitric Oxide in Metabolism. Nutrients. 2019;11(9):2129. doi:10.3390/nu11092129.
18. Kim JI, Huh JY, Sohn JH, et al. Lipid-overloaded enlarged adipocytes provoke insulin resistance independent of inflammation. Mol Cell Biol. 2015;35(10):1686-99. doi:10.1128/MCB.01321-14.
19. Huan JN, Li J, Han Y, et al. Adipocyte-selective reduction of the leptin receptors induced by antisense RNA leads to increased adiposity, dyslipidemia, and insulin resistance. J Biol Chem. 2003;278(46):45638-50. doi:10.1074/jbc.M304165200.
20. Hall ME, Harmancey R, Stec DE. Lean heart: Role of leptin in cardiac hypertrophy and metabolism. World J Cardiol. 2015;7(9):511-24. doi:10.4330/wjc.v7.i9.511.
Об авторах
Е. Е. ГорбатовскаяРоссия
Горбатовская Евгения Евгеньевна — очный аспирант, лаборант-исследователь лаборатории исследований гомеостаза отдела экспериментальной медицины, НИИ КПССЗ; ассистент кафедры медицинской биохимии, КемГМУ.
Кемерово
Конфликт интересов:
Нет
Е. В. Белик
Россия
Белик Екатерина Владимировна — к. м. н., н. с. лаборатории исследований гомеостаза отдела экспериментальной медицины.
Кемерово
Конфликт интересов:
Нет
Ю. А. Дылева
Россия
Дылева Юлия Александровна — к. м. н., с. н. с. лаборатории исследований гомеостаза отдела экспериментальной медицины.
Кемерово
Конфликт интересов:
Нет
Е. Г. Учасова
Россия
Учасова Евгения Геннадьевна — к. м. н., с. н. с. лаборатории исследований гомеостаза отдела экспериментальной медицины.
Кемерово
Конфликт интересов:
Нет
А. В. Понасенко
Россия
Понасенко Анастасия Валериевна — к. м. н., зав. лабораторией геномной медицины отдела экспериментальной медицины.
Кемерово
Конфликт интересов:
Нет
Е. В. Фанаскова
Россия
Фанаскова Елена Викторовна — к. м. н., зав. трансфузиологическим кабинетом.
Кемерово
Конфликт интересов:
Нет
А. Н. Стасев
Россия
Стасев Александр Николаевич — к. м. н., н. с. лаборатории пороков сердца отдела хирургии сердца и сосудов.
Кемерово
Конфликт интересов:
Нет
О. В. Груздева
Россия
Груздева Ольга Викторовна — д. м. н., доцент, профессор РАН, зав. лабораторией исследований гомеостаза отдела экспериментальной медицины, НИИ КПССЗ, зав. кафедры медицинской биохимии КемГМУ.
Кемерово
Конфликт интересов:
Нет
Дополнительные файлы
- Выявлены особенности экспрессии изоформ LEPRв локальных жировых депо сердца у пациентов с коронарогенной и некоронарогенной патологией.
- У пациентов с ишемической болезнью сердца наблюдается выраженное снижение экспрессии шести изоформ LEPRв эпикардиальной жировой ткани (ЭЖТ).
- Изменения в экспрессии LEPRв ЭЖТ у пациентов с коронарогенной патологией ассоциированы с нарушением адипогенеза, гипертрофией адипоцитов, формированием инсулинорезистентности, усилением провоспалительных факторов, гиперлептинемией, прогрессированием атеросклероза.
Рецензия
Для цитирования:
Горбатовская Е.Е., Белик Е.В., Дылева Ю.А., Учасова Е.Г., Понасенко А.В., Фанаскова Е.В., Стасев А.Н., Груздева О.В. Изменение экспрессии изоформ LEPR в локальных жировых депо при коронарном атеросклерозе и приобретенных пороках сердца. Российский кардиологический журнал. 2024;29(8):5826. https://doi.org/10.15829/1560-4071-2024-5826. EDN: RUVAOW
For citation:
Gorbatovskaya E.E., Belik E.V., Dyleva Yu.A., Uchasova E.G., Ponasenko A.V., Fanaskova E.V., Stasev A.N., Gruzdeva O.V. LEPR isoform expression changes in local fat depots in coronary atherosclerosis and acquired heart defects. Russian Journal of Cardiology. 2024;29(8):5826. (In Russ.) https://doi.org/10.15829/1560-4071-2024-5826. EDN: RUVAOW
JATS XML

















































