Перейти к:
Прогнозирование госпитальной летальности у пациентов с инфарктом миокарда и сахарным диабетом 2 типа: роль клеточных индексов системного воспаления
https://doi.org/10.15829/1560-4071-20245823
EDN: QKKOCJ
Аннотация
Цель. У пациентов с инфарктом миокарда с подъемом сегмента ST (ИМ) в сочетании с сахарным диабетом 2 типа (СД2) оценить значение клеточных индексов системного воспаления в прогнозе госпитальной летальности.
Материал и методы. В ретроспективное исследование методом "случай-контроль" были включены 125 больных ИМ и СД2, 25 из которых умерли в период индексной госпитализации. Определяли клеточный состав крови и уровень высокочувствительного С-реактивного белка (вчСРБ) в первые и третьи сутки от момента госпитализации. В группах госпитальной летальности и выживших пациентов рассчитывали и сравнивали клеточные индексы системного воспаления (нейтрофильно-лимфоцитарное отношение (НЛО), нейтрофильно-моноцитарное отношение (НМО), моноцитарно-лимфоцитарное отношение (МЛО), тромбоцитарно-лимфоцитарное отношение (ТЛО), индекс системного воспаления (SII), индекс системного воспалительного ответа (SIRI)) и средние уровни вчСРБ, а также их динамику. Прогностическую роль изучаемых показателей оценивали с помощью однофакторной и многофакторной логистической регрессии.
Результаты. В группе умерших пациентов, в сравнении с выжившими, были больше класс по Killip, индекс массы тела, объем вмешательства по количеству имплантированных стентов, выше уровень вчСРБ, ниже фракция выброса левого желудочка. Госпитальная летальность была ассоциирована с вчСРБ (отношение шансов 1,03 при 95% доверительном интервале: 1,003-1,05, р=0,029), НЛО (2,56 [1,73-9,78], р<0,001), НМО (1,16 [1,001-1,35], р=0,04), МЛО (23,7 [3,1-182,6], р=0,002), SII (1,001 [1,0-1,001], р=0,028), SIRI (1,29 [1,09-1,52], р=0,003) через 48 ч после поступления, а также со степенью изменения вчСРБ (1,03 [1,003-1,05], р=0,025), НЛО (1,58 [1,21-2,06], р=0,001), SII (1,001 [1,0-1,001], р=0,028) в течение первых трех суток. По результатам скорректированного многофакторного регрессионного анализа была выявлена совокупность независимых предикторов, обеспечивающая наибольшую точность оценки вероятности летального исхода: НЛО, SII и SIRI через 48 ч после поступления, степень изменения вчСРБ, индекс массы тела и количество имплантированных стентов.
Заключение. В работе продемонстрирована значимость клеточных индексов системного воспаления НЛО, SII и SIRI в оценке прогноза госпитальной летальности у пациентов с ИМ в сочетании с СД2.
Ключевые слова
Для цитирования:
Боковиков И.Ф., Протасов К.В. Прогнозирование госпитальной летальности у пациентов с инфарктом миокарда и сахарным диабетом 2 типа: роль клеточных индексов системного воспаления. Российский кардиологический журнал. 2024;29(7):5823. https://doi.org/10.15829/1560-4071-20245823. EDN: QKKOCJ
For citation:
Bokovikov I.F., Protasov K.V. Prediction of in-hospital mortality in patients with myocardial infarction and type 2 diabetes: the role of cellular indices of systemic inflammation. Russian Journal of Cardiology. 2024;29(7):5823. (In Russ.) https://doi.org/10.15829/1560-4071-20245823. EDN: QKKOCJ
Сердечно-сосудистые заболевания, такие как острый инфаркт миокарда (ИМ), характеризуется широкой распространённостью и повышенным уровнем смертности и инвалидизации населения. Госпитальная летальность от ИМ до сих пор остается высокой, достигая 10,5% [1].
Известно, что повреждение сердечной мышцы при ИМ в сочетании с гипоксией приводит к активации источников цитокинов, включая иммунокомпетентные клетки, кардиомиоциты и скелетную мускулатуру [2]. Дисбаланс в сторону чрезмерного и стойкого провоспалительного ответа приводит к постинфарктному ремоделированию миокарда и ухудшению прогноза после ИМ [3]. Высокий уровень лейкоцитов крови является сильным независимым предиктором неблагоприятных исходов у пациентов с ИМ. Клеточные индексы системного воспаления — отношения, рассчитанные по показателям периферической крови, такие как нейтрофильно-лимфоцитарное отношение (НЛО) [4], нейтрофильно-моноцитарное отношение (НМО) [5], тромбоцитарно-лимфоцитарное отношение (ТЛО) [6] и моноцитарно-лимфоцитарное отношение (МЛО) [7], индекс системного иммунного воспаления (SII) [8], индекс системной воспалительной реакции (SIRI) [9], широко используются для оценки прогноза и тяжести различных заболеваний в силу их доступности в реальной клинической практике. Предпринимались попытки изучения прогностической значимости вышеуказанных индексов при сердечно-сосудистых заболеваниях. В частности, высокий уровень НЛО явился независимым предиктором летального исхода при ИМ [7]. "Новые" индексы системного воспаления SII и SIRI были выше у пациентов с ИМ, по сравнению со стабильной ишемической болезнью сердца [8]. Индекс SIRI также явился независимым фактором риска развития больших неблагоприятных сердечно-сосудистых событий и определял прогноз у пациентов с ИМ, перенесших первичное чрескожное коронарное вмешательство (пЧКВ) [4][9].
Наличие сахарного диабета 2 типа (СД2) ухудшает прогноз при ИМ. Крупные наблюдательные исследования показали, что у пациентов с СД2 более высокая тридцатидневная и одногодичная летальность после ИМ. Тяжесть и продолжительность СД2 достоверно коррелируют с прогнозом [10]. Как показали многочисленные экспериментальные и клинические исследования, СД2 — это провоспалительное состояние [11], что является одной из причин высокого сердечно-сосудистого риска у больных СД2. В ряде работ изучались клеточные индексы системного воспаления при диабете. Оказалось, что высокий уровень НЛО ассоциирован с макрососудистыми осложнениями диабета [12]. Сравнительный анализ прогностического значения клеточных индексов системного воспаления в оценке риска госпитальной летальности больных ИМ в сочетании с СД2 ранее не проводился. Это и определило цель данной работы: оценить прогностическую ценность клеточных индексов системного воспаления в прогнозе госпитальной летальности у пациентов с ИМ в сочетании с СД2.
Материал и методы
По своему дизайну это было ретроспективное одноцентровое исследование по типу "случай-контроль". Были включены пациенты с ИМ с подъёмом сегмента ST электрокардиограммы и СД2, поступившие на лечение в региональный сосудистый центр в период с 2018 по 2020гг. Критерии включения: возраст от 45 до 75 лет, верифицированный ИМ, пЧКВ. Критерии невключения: хронические иммуновоспалительные заболевания, застойная хроническая сердечная недостаточность, хроническая болезнь почек с расчётной скоростью клубочковой фильтрации <15 мл/мин/1,73 м2, злокачественные новообразования в анамнезе, ИМ, острое нарушение мозгового кровообращения и ЧКВ в предшествующие 30 суток. Критерии исключения: случаи госпитальной летальности в первые 48 ч, кардиогенный шок при поступлении, преходящая гипергликемия, новая коронавирусная инфекция, госпитальная пневмония. Диагноз ИМ 1 и СД2 2 верифицировали по стандартным критериям.
Всем пациентам проведены трансторакальная эхокардиография с оценкой фракции выброса (ФВ) левого желудочка (ЛЖ), рассчитанной методом Simpson. Оценивали антропометрические данные. Учитывали уровни тропонина Т, глюкозы, высокочувствительного С-реактивного белка (вчСРБ), креатинина крови, скорости клубочковой фильтрации по CKD-EPI при поступлении и в динамике через 48 ч после пЧКВ.
У всех пациентов при поступлении и через 48 ч определяли количество лейкоцитов, нейтрофилов, лимфоцитов, моноцитов, тромбоцитов в крови и рассчитывали клеточные индексы системного воспаления НЛО, НМО, ТЛО, МЛО, SII, SIRI по формулам (рис. 1) [8][13]. Определяли степень их изменения между первым и вторым измерением.
Исследование клеточного состава крови проводили на гематологическом анализаторе ВС-6800Plus ("Mindray", Китай). вчСРБ определяли методом иммуноферментного анализа крови на анализаторе BS-200 ("Mindray", Китай).
Для оценки прогностического значения исследуемых показателей из общей выборки (313 пациентов с ИМ и СД2) по критериям включения и исключения в группу "случаев" включены 25 пациентов, умерших в период госпитализации (медиана выживаемости 6 (3;22) дней). В группу "контролей" включены выжившие пациенты с ИМ и СД2, сходные полу и возрасту, из расчёта 4:1. Таким образом, общее количество пациентов, включенных в исследование, составило 125 (68 мужчин и 57 женщин), средний возраст — 65 (61;69) лет.
На первом этапе ассоциации изучаемых показателей с развитием летального исхода определяли с помощью однофакторной логистической регрессии с расчетом отношения шансов (ОШ) и 95% доверительного интервала (ДИ) развития события при изменении предиктора на единицу. На втором этапе для выявления совокупности независимых предикторов летального исхода проводили многофакторный регрессионный анализ. В качестве ковариат в уравнение регрессии включали показатели воспаления, ассоциированные с летальным исходом по результатам однофакторной регрессии без поправки (многофакторная модель 1), с поправкой на пол, возраст и индекс массы тела (ИМТ) (многофакторная модель 2) и с поправкой на пол, возраст, ИМТ и общепризнанные предикторы неблагоприятного прогноза ИМ: креатинин крови при поступлении, ФВ ЛЖ через 48 ч, класс Killip, количество имплантированных стентов (многофакторная модель 3). Для скорректированной многофакторной модели строили ROC-кривую, рассчитывали площадь под кривой (AUC). Вычисляли ОШ (95% ДИ) развития неблагоприятного исхода у больных с ИМ и СД2.
Получено информированное согласие пациентов на проведение вмешательства. Протокол исследования одобрен комитетами по этике ИГМАПО — филиала ФГБОУ ДПО РМАНПО Минздрава России и ГБУЗ Иркутская ордена "Знак Почета" областная клиническая больница. В изучаемых группах рассчитывали и сравнивали средние значения или доли (%) вышеуказанных показателей. Использовали непараметрические методы статистики. Средние значения отображали в виде медианы (Ме) и интерквартильного размаха (ИР). Статистическую значимость различий в группах оценивали по U-критерию Манна-Уитни, критерию согласия Пирсона (хи-квадрат, χ2). Применяли пакеты прикладных программ "Statistica 8.0", "IBM SPSS Statistics 26".

Рис. 1. Формулы расчета клеточных индексов системного воспаления.
Сокращения: МЛО — моноцитарно-лимфоцитарное отношение, НЛО — нейтрофильно-лимфоцитарное отношение, НМО — нейтрофильно-моноцитарное отношение, ТЛО — тромбоцитарно-лимфоцитарное отношение, SII — индекс системного воспаления, SIRI — индекс системного воспалительного ответа.
Результаты
Всем пациентам выполнено пЧКВ, из них прямое стентирование без ангиопластики — 43 (34,4%), тромболизис в рамках фармакоинвазивного подхода — 27 (21,6%). Двойную антитромбоцитарную терапию получали 100% (n=25) пациентов основной группы и 99,0% (n=99) контрольной группы, бета-адреноблокаторы — 88,0% (n=22) и 99,0% (n=99), соответственно, блокаторы ренин-ангиотензин-альдостероновой системы — 84,0% (n=21) и 97,0% (n=97), антагонисты минералокортикоидных рецепторов — 80,0% (n=20) и 96,0% (n=96), статины — 96,0% (n=24) и 95,0% (n=95), сахароснижающие препараты — 92,0% (n=23) и 97,0% (n=97). Различий в назначенной терапии в исследуемых группах не было (р>0,05). Клиническая характеристика исследуемых групп представлена в таблице 1. Основными причинами внутригоспитальной летальности явились острая сердечная недостаточность и желудочковые нарушения ритма.
Из таблицы следует, что в группе умерших ИМТ и вчСРБ в динамике были больше, а ФВ ЛЖ — меньше, чем в группе выживших. По результатам однофакторной регрессии госпитальная летальность была ассоциирована с ИМТ, динамикой вчСРБ, ФВ ЛЖ, количеством имплантированных стентов и тяжестью сердечной недостаточности по Killip.
В таблице 2 приведены клеточный состав крови и клеточные индексы системного воспаления, определяемые в момент поступления, на третьи сутки, а также степени их изменения, рассчитанные между первым и вторым измерением.
Таким образом, среди изучаемых клеточных индексов по результатам однофакторной логистической регрессии с летальным исходом были ассоциированы вчСРБ, НЛО, НМО, МЛО, SII, SIRI через 48 ч после поступления, а также степень изменения вчСРБ, НЛО, SII.
Вышеперечисленные показатели были пошаговым способом включены в многофакторный логистический регрессионный анализ. Всего таким образом в анализ включено 10 ковариат. По результатам анализа получена совокупность независимых предикторов, обеспечивающая наибольшую точность оценки вероятности летального исхода у больных ИМ и СД2 (табл. 3).
При проведении многофакторного регрессионного анализа без поправки (модель 1) были определены следующие предикторы летального исхода: НЛО, SII и SIRI в динамике, а также степень изменения вчСРБ. После поправки на пол, возраст и ИМТ (модель 2), на пол, возраст, массу тела, креатинин крови, ФВ ЛЖ, количество имплантированных стентов и степень тяжести острой сердечной недостаточности (модель 3) найденные предикторы, а также ИМТ и количество имплантированных стентов, сохранили свое предсказательное значение.
Для оценки информативности скорректированной модели прогноза и для определения порогового значения логистической регрессионной функции были построены ROC-кривая и рассчитана AUC (рис. 2).
Площадь под ROC-кривой, соответствующей взаимосвязи прогноза летального исхода и значения логистической регрессионной функции, составила 0,982±0,009 с 95% ДИ: 0,965-0,999 (p<0,001), что соответствует отличной информативности классификатора. Пороговое значение функции Р(1) в точке cut-off составило 0,159. Значение функции, равное или превышающее данное значение, соответствовало высокому риску летального исхода. Чувствительность и специфичность метода составили 76,0% и 97,0%, соответственно, точность модели 0,928. Корректировка порога классификации исходя из результатов анализа ROC-кривой позволила увеличить чувствительность с 76% до 92%.
Таблица 1
Клиническая характеристика пациентов с ИМ и СД2
Показатель | Группа случаев госпитальной летальности (n=25) | Группа выживших (n=100) | ОШ [ 95% ДИ]α | р$ |
Мужчины/женщины, n (%) | 14/11 (56/44) | 54/46 (54/46) | 1,08 [ 0,45-2,62] | 0,858 |
Возраст, годы | 67,0 (62;69) | 65,0 (59;70) | 1,01 [ 0,95-1,09] | 0,702 |
Индекс массы тела, кг/м2 | 34,5 (31,1;37,2) | 29,4 (26,5;34,3)* | 1,18 [ 1,07-1,3] | 0,001 |
ТрТ при поступлении, мкг/л | 1,3 (0,5;2,5) | 1,8 (0,2;2,5)* | 1,00 [ 0,88-1,14] | 0,978 |
Креатинин при поступлении, мкмоль/л | 115,4 (102;119) | 101,9 (89;119)* | 1,01 [ 0,99-1,03] | 0,194 |
СКФ при поступлении, мл/мин/1,73 м2 | 55,3 (42,6;63,1) | 59,4 (47,1;72,9) | 0,98 [ 0,95-1,01] | 0,146 |
вчСРБ, г/л | 26,0 (21;37) 17,0 (14;54,7) -9,5 (-15;0,2) | 21,5 (13,35;29,4) 10,6 (7,2;16)* -9,8 (-15;-5,4) | 1,01 [ 0,99-1,03] 1,03 [ 1,003-1,05] 1,03 [ 1,003-1,05] | 0,092 0,029 0,025 |
— при поступлении | ||||
— через 48 ч | ||||
ΔвчСРБ | ||||
Глюкоза плазмы крови при поступлении, ммоль/л | 11,3 (8,7;14,7) | 10,9 (8,6;14,2) | 1,02 [ 0,93-1,13] | 0,649 |
Фракция выброса левого желудочка, % | 39,0 (34;44) | 45,5 (41;49)* | 0,9 [ 0,84-0,97] | 0,005 |
Количество имплантированных стентов 1 2 3 | 10 (40,0) 13 (52,0) 2 (8,0) | 82 (82,0)† 16 (16,0) 2 (2,0) | 4,58 [2,04-10,29] | <0,001 |
Класс Killip при поступлении I II III | 17 (68,0) 4 (16,0) 4 (16,0) | 85 (85,0) 10 (10,0) 5 (5,0) | 2,0 [ 1,04-3,85] | 0,038 |
Примечание: данные представлены в виде Ме (ИР) или абсолютного количества (n) и доли в %; α — ОШ и 95% ДИ развития события при изменении предиктора на единицу; $ — уровень значимости р предиктора по критерию Вальда; * — р<0,05 для межгрупповых различий средних значений; † — р χ2 Пирсона <0,05.
Сокращения: ДИ — доверительный интервал, ИМ — инфаркт миокарда, ОШ — отношение шансов, СКФ — скорость клубочковой фильтрации, ΔвчСРБ — степень изменения высокочувствительного С-реактивного белка, ТрТ — тропонин Т.
Таблица 2
Клетки крови и клеточные индексы воспаления у пациентов с ИМ и СД2
Показатель | Группа случаев госпитальной летальности (n=25) | Группа выживших (n=100) | ОШ [ 95% ДИ]α | р$ |
Лейкоциты, *109/л | ||||
— при поступлении | 13,7 (12,5;16,3) | 12,9 (9,3;14,6) | 1,09 [ 0,97-1,22] | 0,138 |
— через 48 ч | 10,9 (9,8;12,8) | 9,2 (7,9;10,5)* | 1,31 [ 1,11-1,54] | 0,001 |
Нейтрофилы, *109/л | ||||
— при поступлении | 9,1 (7,7;9,7) | 8,3 (6,1;10,1) | 1,03 [ 0,9-1,18] | 0,629 |
— через 48 ч | 6,1 (4,9;9,7)* | 5,3 (4,3;6,7)* | 1,26 [ 1,07-1,49] | 0,005 |
Лимфоциты, *109/л | ||||
— при поступлении | 1,8 (1,7;2,3) | 1,9 (1,5;2,7) | 1,16 [ 0,74-1,83] | 0,508 |
— через 48 ч | 1,9 (1,3;2,3) | 2,0 (1,7;2,4)* | 0,58 [ 0,28-1,19] | 0,137 |
Тромбоциты, *109/л | ||||
— при поступлении | 216,0 (190;256) | 230,5 (187;284) | 0,997 [ 0,990-1,004] | 0,397 |
— через 48 ч | 218,0 (184;251) | 253,5 (198;292)* | 0,990 [ 0,982-0,998] | 0,015 |
Моноциты, *109/л | ||||
— при поступлении | 1,1 (0,7;1,3) | 0,8 (0,5;1,1)* | 2,76 [ 1,07-7,1] | 0,035 |
— через 48 ч | 1,0 (0,8;1,2) | 0,8 (0,7;1)* | 3,36 [ 1,1-10,3] | 0,033 |
НЛО | ||||
— при поступлении | 4,6 (3,5;5,6) | 4,3 (2,5;5,5) | 0,99 [ 0,85-1,18] | 0,994 |
— через 48 ч | 5,6 (4,6;6,7) | 2,7 (2,1;3,2)* | 2,56 [ 1,73-3,78] | <0,001 |
— ΔНЛО | 0,7 (-0,3;1,9) | -1,4 (-3;-0,2)* | 1,58 [ 1,21-2,06] | 0,001 |
НМО | ||||
— при поступлении | 8,7 (6,8;13,3) | 9,8 (7,4;15,6) | 0,98 [ 0,93-1,03] | 0,345 |
— через 48 ч | 6,8 (6,2;8,4) | 6,5 (5,4;8,01)* | 1,16 [ 1,001-1,35] | 0,048 |
— ΔНМО | -0,6 (-6,04;1,01) | -3,4 (-8,9;-0,6)* | 1,09 [ 0,998-1,19] | 0,055 |
МЛО | ||||
— при поступлении | 0,5 (0,3;0,7) | 0,3 (0,2;0,6) | 2,83 [ 0,83-9,67] | 0,097 |
— через 48 ч | 0,5 (0,4;0,8) | 0,4 (0,3;0,5)* | 23,7 [ 3,1-182,6] | 0,002 |
— ΔМЛО | 0,01 (-0,2;0,4) | 0,03 (-0,2;0,2) | 2,36 [ 0,71-7,78] | 0,159 |
ТЛО | ||||
— при поступлении | 127,5 (91;138,9) | 115,4 (85,4;149,6) | 0,997 [ 0,988-1,01] | 0,556 |
— через 48 ч | 114,5 (85,5;151,2) | 119,6 (94,6;161,5) | 1,004 [ 0,998-1,01] | 0,204 |
— ΔТЛО | -2,4 (-14,9;34,4) | 4,5 (-14,9;32,2) | 1,01 [ 0,99-1,011] | 0,113 |
SII | ||||
— при поступлении | 916,5 (703;1312) | 902,7 (665;1324) | 1,00 [ 0,999-1,001] | 0,783 |
— через 48 ч | 698,5 (506;861) | 627,7 (426;855) | 1,001 [ 1,0-1,001] | 0,028 |
— ΔSII | -245,7 (-565;-68) | -277,9 (-627;11) | 1,001 [ 1,0-1,001] | 0,028 |
SIRI | ||||
— при поступлении | 5,1 (3,4;7,1) | 3,1 (1,5;5,6) | 1,06 [ 0,973-1,16] | 0,171 |
— через 48 ч | 3,5 (2,3;5,9) | 2,1 (1,6;2,9)* | 1,29 [ 1,09-1,52] | 0,003 |
— ΔSIRI | -0,8 (-3,3;1,1) | -0,9 (-3;0,5) | 1,09 [ 0,995-1,19] | 0,063 |
Примечание: данные представлены в виде Ме (ИР) или абсолютного количества (n) и доли в %; α — ОШ и 95% ДИ развития события при изменении предиктора на единицу; $ — уровень значимости р предиктора по критерию Вальда; * — р<0,05 для межгрупповых различий средних значений; Δ — степень изменения.
Сокращения: ДИ — доверительный интервал, ИМ — инфаркт миокарда, МЛО — моноцитарно-лимфоцитарное отношение, НЛО — нейтрофильно-лимфоцитарное отношение, НМО — нейтрофильно-моноцитарное отношение, ОШ — отношение шансов, ТЛО — тромбоцитарно-лимфоцитарное отношение, SII — индекс системного воспаления, SIRI — индекс системного воспалительного ответа.
Таблица 3
ОШ развития летального исхода у пациентов с ИМ и СД2 в скорректированных и нескорректированных моделях
Предиктор | Модель 1 | Модель 2 | Модель 3 | |||
ОШ [ 95% ДИ] | р | ОШ [ 95% ДИ] | р | ОШ [ 95% ДИ] | р | |
ΔвчСРБ | 1,05 [ 1,02-1,08] | 0,004 | 1,04 [ 1,00-1,07] | 0,028 | 1,04 [ 1,01-1,08] | 0,017 |
НЛО через 48 ч | 6,97 [ 3,05-15,95] | <0,001 | 7,95 [ 2,76-22,9] | <0,001 | 8,74 [ 2,28-33,48] | 0,002 |
SII через 48 ч | 0,99 [ 0,992-0,998] | <0,001 | 0,99 [ 0,991-0,998] | 0,001 | 0,99 [ 0,991-0,998] | 0,006 |
SIRI через 48 ч | 1,26 [ 1,07-1,49] | 0,006 | 1,32 [ 1,1-1,58] | 0,003 | 1,39 [ 1,12-1,71] | 0,003 |
ИМТ | — | — | 1,26 [ 1,02-1,56] | 0,035 | 1,26 [ 1,02-1,56] | 0,035 |
Количество имплантированных стентов | — | — | — | — | 6,57 [ 1,34-32,2] | 0,02 |
Примечание: модель 1 — без поправки, -2 Log правдоподобия =43,699, R2 Нэйджелкерка 0,757; модель 2 — с поправкой на пол, возраст и ИМТ; -2 Log правдоподобия =38,214, R2 Нэйджелкерка 0,792; модель 3 — с поправкой на пол, возраст, ИМТ, креатинин при поступлении, ФВ ЛЖ, количество имплантированных стентов и тяжесть сердечной недостаточности по Killip; -2 Log правдоподобия =32,564, R2 Нэйджелкерка 0,827.
Сокращения: ДИ — доверительный интервал, ИМТ — индекс массы тела, НЛО — нейтрофильно-лимфоцитарное отношение, ОШ — отношение шансов, ФВ ЛЖ — фракция выброса левого желудочка, SII — индекс системного воспаления, SIRI — индекс системного воспалительного ответа, ΔвчСРБ — степень изменения высокочувствительного С-реактивного белка.
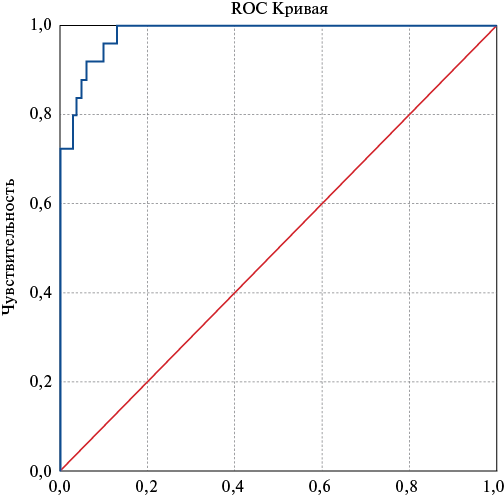
Рис. 2. ROC-кривая и площадь под кривой для прогностической модели 3.
Обсуждение
Известно, что выраженность системного и локального (в зоне ишемического повреждения) воспалительных процессов при ИМ отчётливо коррелирует с изменениями клеточного состава периферической крови [14]. Особенностью данного исследования явилась разработка модели прогнозирования госпитальной летальности на основе клеточных индексов системного воспаления у пациентов с ИМ в сочетании с СД2. Сравнительный анализ клинических данных показал, что в группе умерших были более выражены систолическая дисфункция ЛЖ и сердечная недостаточность по Killip, бόльший объем вмешательства по количеству имплантированных стентов, что было ожидаемым фактом и отражало бόльшую тяжесть поражения миокарда. При поступлении различия всех изучаемых клеточных показателей (за исключением моноцитов в группе умерших) отсутствовали. На третьи сутки течения ИМ в обеих группах расчетные индексы уменьшились, за исключением НЛО, что свидетельствует о снижении степени активности воспаления и инициации репаративного процесса на третьи сутки после реваскуляризации миокарда. Однако степень снижения вчСРБ, НЛО и SII была более выраженной в группе выживших пациентов, а уровни вчСРБ, НМО, МЛО, MHR, SII, SIRI на третьи сутки были выше в группе умерших. Все это указывает на замедленный темп снижения активности воспаления в группе госпитальной летальности. Первоначальный провоспалительный ответ не переходит в противовоспалительную репаративную фазу, что приводит к усилению повреждения и ремоделирования миокарда и увеличивает риск неблагоприятного исхода [14].
Результаты многофакторного регрессионного анализа и ROC-анализа позволили выявить совокупность независимых предикторов госпитальной летальности пациентов с ИМ и СД2. Как оказалось, наибольшей прогностической значимостью обладают 3 расчетных клеточных индекса (НЛО, SII, SIRI через 48 ч от начала госпитализации), а также степень изменения вчСРБ через 48 ч, количество имплантированных стентов и ИМТ. Предсказательная ценность модели не снижалась при включении таких известных предикторов риска смерти от ИМ, как ФВ ЛЖ, креатинин крови, класс Killip, количество имплантированных стентов, что указывает на самостоятельное прогностическое значение изучаемых расчетных индексов. Созданная математическая модель позволяет с высокой точностью (AUC=0,982) оценить вероятность развития летального исхода у пациента с ИМ в сочетании с СД2 на госпитальном этапе. Прогностическое значение клеточных индексов системного воспаления при ИМ изучалось в ряде ранее опубликованных работ. В одном из исследований было показано, что значение индекса SIRI ≥7,8 было связано с более высокой частотой (17,1%, р<0,001) развития основных неблагоприятных сердечно-сосудистых событий у больных ИМ, перенёсших пЧКВ (n=328), в первые 30 дней [15]. В исследовании Ji Z, et al. (2021) была отмечена способность НЛО предсказывать госпитальную летальность у пациентов с ИМ в возрасте <76 лет при значении >5,5 (ОШ 4,356, 95% ДИ: 2,552-7,435, р<0,001) [16]. Более высокие уровни SII были независимо связаны с 30-дневной сердечно-сосудистой смертностью (ОШ 2,37, 95% ДИ: 1,34-4,19, р=0,003) у пациентов с ИМ после пЧКВ [17]. Zhang X, et al. (2021) была отмечена прогностическая роль вчСРБ у пациентов с острым ИМ вне зависимости от установленных традиционных факторов риска [18]. В вышеприведенных работах, в отличие от данного исследования, были пациенты с ИМ и без СД2, а динамические изменения индексов в первые двое суток не учитывались. По нашим данным, прогноз госпитальной летальности точнее оценивается при их определении на третьи сутки течения ИМ, тогда как в большинстве работ по данной теме клеточные индексы определялись в первые сутки ИМ [15-18].
Значимость клеточных индексов воспаления в оценке прогноза летального исхода у больных ИМ и СД2 исследовалась в единичных работах. Ранее нами проведен сравнительный анализ клеточных индексов системного воспаления у больных ИМ с СД и без него, согласно которому при наличии СД отмечен более высокий индекс НЛО (5,3±1,3 и 4,7±0,9; р=0,038) и замедленная динамика снижения вчСРБ (на 14,7±5,3 и 18,2±5,3 мг/л; р=0,013) [19]. В исследовании Ji Z, et al. (2021) риск развития летального исхода у пациентов с СД2 в группе с НЛО >5,5 оказался в 6,6 раза выше, чем в группе с низким уровнем НЛО (95% ДИ: 2,6-16,5, р<0,001), однако это были пациенты с ИМ без подъёма сегмента ST [16]. Роль новых клеточных индексов воспаления SII и SIRI в прогнозе госпитальной летальности у больных ИМ и СД2 в доступной нам литературе не отражена.
Индекс ТЛО в изучаемых группах статистически значимо не различался и поэтому не был включен в многофакторный анализ. Кроме того, индекс МЛО, который был ассоциирован с прогнозируемым исходом в однофакторной регрессии, не вошел в скорректированную модель. Следовательно, клеточные индексы, при расчете которых не использовались нейтрофилы, обладали меньшей предсказательной ценностью.
Возможными ограничениями в нашем исследовании являлись, во-первых, малый объём выборки при краткосрочном периоде наблюдения, во-вторых, ретроспективный одноцентровый дизайн исследования.
Таким образом, по результатам работы впервые установлена высокая информативность совокупности простых и доступных в реальной клинической практике клеточных индексов воспаления НЛО, SII, SIRI в прогнозе госпитальной летальности больных с ИМ в сочетании с СД2.
Заключение
Полученные в работе данные подтверждают потенциальное значение клеточных индексов системного воспаления для оценки прогноза госпитальной летальности у пациентов с ИМ в сочетании с СД2.
Создана математическая модель прогноза и установлена совокупность независимых предикторов госпитальной летальности больных ИМ и СД2, включающая НЛО, SII, SIRI, а также степень изменения вчСРБ в первые двое суток, количество имплантированных стентов коронарных артерий и ИМТ.
Отношения и деятельность: все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье.
1 https://cr.minzdrav.gov.ru/schema/157_4.
2 https://cr.minzdrav.gov.ru/schema/290_2.
Список литературы
1. Щинова А. М., Потехина А. В., Долгушева Ю. А. Сопоставление госпитальной и отдаленной летальности и оценка их предикторов у пациентов, перенесших инфаркт миокарда и нестабильную стенокардию и др. Альманах клинической медицины. 2023;51(2):7785. doi:10.18786/20720505202351013.
2. Мусихина Н. А., Петелина Т. И., Костоусова А. И. Биомар керы воспаления у перенесших инфаркт миокарда пациентов с сохраненной и незначительно сниженной фракцией выброса левого желудочка, пятилетнее проспективное наблюдение. Российский кардиологический журнал. 2020;25(12):3726. doi:10.15829/1560407120203726.
3. An zai T. Inflammatory Mechanisms of Cardiovascular Remodeling. Circulation Journal. 2018;82(3):62935. doi:10.1253/circj.CJ180063.
4. Ghaffari S, Nadiri M, Pourafkari L, et al. The predictive Value of Total Neutrophil Count and Neutrophil/Lymphocyte Ratio in Predicting Inhospital Mortality and Complications after STEMI. J Cardiovasc Thorac Res. 2014;6(1):3541. doi:10.5681/jcvtr.2014.007.
5. Varman A, Alkan S. Evaluation of neutrophil/lymphocyte ratio, platelet/lymphocyte ratio, mean platelet volume, and neutrophil/monocyte ratio in patients with benign breast lesions. Bratislavske Lekarske Listy. 2021;122(7):48992. doi:10.4149/BLL_2021_079.
6. Xu X, Cai L, Chen T, et al. Predictive value of inflammation based Glasgow prognostic score, platelet lymphocyte ratio, and global registry of acute coronary events score for major cardiovascular and cerebrovascular events during hospitalization in patients with acute myocardial infarction. Aging (Albany NY). 2021;13(14):1827486. doi:10.18632/aging.203273.
7. Kahraman S, Agus HZ, Avci Y, et al. The Neutrophil to Lymphocyte Ratio (NLR) Is Associated With Residual Syntax Score in Patients With STSegment Elevation Myocardial Infarction. Angiology. 2021;72(2):16673. doi:10.1177/0003319720958556.
8. Dziedzic EA, Gąsior JS, Tuzimek A, et al. Investigation of the associations of novel inflammatory biomarkers—Systemic Inflammatory Index (SII) and Systemic Inflammatory Response Index (SIRI)—With the severity of coronary artery disease and acute coronary syndrome occurrence. International Journal of Molecular Sciences. 2022;23(17):9553. doi:10.3390/ijms23179553.
9. Han K, Shi D, Yang L, et al. Prognostic value of systemic inflammatory response index in patients with acute coronary syndrome undergoing percutaneous coronary intervention. Annals of medicine. 2022;54(1):166777. doi:10.1080/07853890.2022.2083671.
10. Milazzo V, Cosentino N, Genovese S, et al. Diabetes Mellitus and Acute Myocardial Infarction: Impact on Short and LongT erm Mortality. Adv Exp Med Biol. 2021;1307: 15369. doi:10.1007/5584_2020_481.
11. Barbu E, Popescu MR, Popescu AC, et al. Inflammation as a precursor of atherothrombosis, diabetes and early vascular aging. International Journal of Molecular Sciences. 2022;23(2):963. doi:10.3390/ijms23020963.
12. Zhang C, Chen H, Cui S, et al. PlateletL ymphocyte Ratio, NeutrophilL ymphocyte Ratio and Their Dynamic Changes with Type 2 Diabetes Mellitus: A Cohort Study in China. Endocr Res. 2022;47(34):13852. doi:10.1080/07435800.2022.2127757.
13. Чаулин А. М., Григорьева Ю. В., Павлова Т. В. и др. Диагностическая ценность клинического анализа крови при сердечнос осудистых заболеваниях. Российский кардиологический журнал. 2020;25(12):3923. doi:10.15829/1560407120203923.
14. Ong SB, HernándezR eséndiz S, CrespoA vilan GE, et al. Inflammation following acute myocardial infarction: Multiple players, dynamic roles, and novel therapeutic opportunities. Pharmacol Ther. 2018;186:7387. doi:10.1016/j.pharmthera.2018.01.001.
15. Chao Qu, Xiang Li, Hai Gao. The Impact of Systemic Inflammation Response Index on the Prognosis of Patients with STSegment Elevation Myocardial Infarction Undergoing Percutaneous Coronary Intervention. Rev. Cardiovasc. Med. 2023;24(5):153. doi:10.31083/j.rcm2405153.
16. Ji Z, Liu G, Guo, J, et al. The neutrophiltolymphocyte ratio is an important indicator predicting inhospital death in AMI patients. Frontiers in Cardiovascular Medicine. 2021;8:706852. doi:10.3389/fcvm.2021.706852.
17. Vatan MB, Çakmak AC, Ağaç S, et al. The systemic immunei nflammation index predicts impaired myocardial perfusion and shortterm mortality in STsegment elevation myocardial infarction patients. Angiology. 2023;74(4):36573. doi:10.1177/00033197221106886.
18. Zhang X, Wang S, Fang S, et al. Prognostic role of high sensitivity Creactive protein in patients with acute myocardial infarction. Frontiers in cardiovascular medicine. 2021;8:659446. doi:10.3389/fcvm.2021.659446.
19. Боковиков И. Ф., Протасов К. В., Храмцова Н. А. Лейко цитарные показатели воспаления у пациентов с острым инфарктом миокарда и сахарным диабетом 2 типа. Байкальский медицинский журнал. 2023;2(3):346. doi:10.57256/29490715202333436.
Об авторах
И. Ф. БоковиковРоссия
Иван Федорович Боковиков — аспирант кафедры кардиологии и функциональной диагностики, врач-кардиолог кардиологического отделения с ПИТиР.
Иркутск
Конфликт интересов:
авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье
К. В. Протасов
Россия
Протасов Константин Викторович — д. м. н., профессор, зав. кафедрой кардиологии и функциональной диагностики.
Иркутск
Конфликт интересов:
авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье
Дополнительные файлы
- В исследовании получены доказательства ассоциации системного воспаления с ранними неблагоприятными исходами инфаркта миокарда (ИМ) у больных сахарным диабетом 2 типа (СД2).
- Продемонстрирована возможность использования клеточных индексов системного воспаления (нейтрофильно-лимфоцитарное отношение, индекс системного воспаления SII и индекс системного воспалительного ответа SIRI) как предикторов неблагоприятных событий у пациентов с ИМ и СД2.
- Разработанная модель прогноза госпитальной летальности, включающая клеточные индексы системного воспаления и традиционные факторы риска, позволит оптимизировать стратификацию риска при ИМ в сочетании с СД2.
Рецензия
Для цитирования:
Боковиков И.Ф., Протасов К.В. Прогнозирование госпитальной летальности у пациентов с инфарктом миокарда и сахарным диабетом 2 типа: роль клеточных индексов системного воспаления. Российский кардиологический журнал. 2024;29(7):5823. https://doi.org/10.15829/1560-4071-20245823. EDN: QKKOCJ
For citation:
Bokovikov I.F., Protasov K.V. Prediction of in-hospital mortality in patients with myocardial infarction and type 2 diabetes: the role of cellular indices of systemic inflammation. Russian Journal of Cardiology. 2024;29(7):5823. (In Russ.) https://doi.org/10.15829/1560-4071-20245823. EDN: QKKOCJ
JATS XML

















































