Перейти к:
Интервальное гипоксическое прекондиционирование снижает риск пери- и послеоперационных осложнений при кардиохирургических операциях с использованием искусственного кровообращения
https://doi.org/10.15829/1560-4071-2024-5778
EDN: DKVMFM
Аннотация
Цель. Определить влияние интервальных гипоксически-гипероксических экспозиций (ИГГЭ) на исходы кардиохирургических вмешательств с применением искусственного кровообращения.
Материал и методы. Проведено проспективное одноцентровое рандомизированное контролируемое исследование у 110 пациентов с пороками клапанов сердца и/или патологии аорты из кардиохирургической клиники Первого МГМУ им. И. М. Сеченова. Общая выборка была случайным образом разделена на группу пациентов, проходивших курс ИГГЭ (66 пациентов), и контрольную группу пациентов, которым проводились плацебо-процедуры с атмосферным воздухом (44 пациента). Частоту и структуру интра- и послеоперационных осложнений анализировали в течение 30 дней после операции. Наличие когнитивных нарушений, а также уровень концентрации сывороточного тропонина I и лактата анализировали до и после операции.
Результаты. Пери- и ранние послеоперационные осложнения в виде сердечной смерти, нефатального инфаркта и острой сердечной недостаточности достоверно реже возникали у пациентов, проходивших курс ИГГЭ по сравнению с плацебо-ИГГЭ (1,6% vs 16,7%, p=0,009; 1,6% vs 16,7%, p=0,009; 6,3% vs 33,3%, p<0,001, соответственно). Медиана значений тропонина I через 24 ч после операции составила 1,068 нг/мл (0,388-1,397 нг/мл) в группе ИГГЭ и была достоверно ниже по сравнению с контрольной группой 1,980 нг/мл (1,068-3,239 нг/мл). Уровень лактата в сыворотке крови после операции составил 1,8±0,7 ммоль/л в группе ИГГЭ и был значимо ниже по сравнению с контрольной группой — 2,4±1,2 (p=0,05). Состояние когнитивных функций, в т. ч. по тестам MOCA и MMSE, оказалось значимо выше у пациентов, прошедших предоперационный курс ИГГЭ. Значимых осложнений или серьезных нежелательных явлений во время процедур ИГГЭ не наблюдалось.
Заключение. Применение индивидуально-адаптированных процедур гипоксического прекондиционирования снижает частоту пери- и послеоперационных осложнений, что сопровождается меньшей степенью ишемически-реперфузионного повреждения миокарда при искусственном кровообращении, с сохранением когнитивных функций пациентов. Процедуры ИГГЭ расширяют арсенал средств преабилитации пациентов, направляемых на хирургическое лечение пороков сердца и патологии аорты в условиях искусственного кровообращения.
Ключевые слова
Для цитирования:
Дхиф И., Глазачев О.С., Беставашвили А.А., Синьлян Ж., Гуляева-Сельцовская Е.П., Кузнецова Н.О., Сыркина Е.А., Смирнова В.В., Дудник Е.Н., Чомахидзе П.Ш., Тлисов Б.М., Комаров Р.Н., Копылов Ф.Ю. Интервальное гипоксическое прекондиционирование снижает риск пери- и послеоперационных осложнений при кардиохирургических операциях с использованием искусственного кровообращения. Российский кардиологический журнал. 2024;29(7):5778. https://doi.org/10.15829/1560-4071-2024-5778. EDN: DKVMFM
For citation:
Dhif I., Glazachev O.S., Bestavashvili A.A., Sinlyan Ch., GulyaevaSeltsovskaya E.P., Kuznetsova N.O., Syrkina E.A., Smirnova V.V., Dudnik E.N., Chomakhidze P.Sh., Tlisov B.M., Komarov R.N., Kopylov F.Yu. Intermittent hypoxic preconditioning reduces the risk of peri- and postoperative complications during on-pump cardiac surgery. Russian Journal of Cardiology. 2024;29(7):5778. (In Russ.) https://doi.org/10.15829/1560-4071-2024-5778. EDN: DKVMFM
В последние несколько лет отмечен значительный прогресс в области сердечно-сосудистой хирургии, в связи с внедрением инновационных технологий, улучшающих исходы для пациентов и снижающих риски осложнений [1][2]. Несмотря на достигнутые успехи, пери- и послеоперационные сердечно-сосудистые и иные осложнения в большинстве ведущих кардиологических центров возникают у 5% пациентов, а летальность колеблется в широком диапазоне от 1% до 6% [2-4]. Одной из основных причин многих осложнений, развивающихся при кардиохирургических интервенциях, являются ишемически-реперфузионные повреждения миокарда, неизбежные при применении искусственного кровообращения (ИК), а также церебральные нарушения, приводящие в последующем к прогрессированию когнитивной дисфункции [5-7].
В целях подготовки к хирургическим вмешательствам предложено расширить применение кардиореабилитации, в т. ч. и на предоперационный период (преабилитация) [8]. В качестве средств преабилитации для повышения устойчивости миокарда к стрессорным стимулам обосновано применение физических тренировок и дыхательной гимнастики [9-11], оптимизация предоперационной медикаментозной подготовки, в частности с включением никорандила [3], что ведет к снижению периоперационных кардиальных осложнений, частоты церебральных катастроф и повышает комплаентность пациентов [10][12][13]. В то же время применение дозированных физических нагрузок на этапе преабилитации не всегда возможно, учитывая возрастные ограничения пациентов, высокую коморбидность и низкие функциональные резервы. Последнее актуализирует разработку новых техник формирования кардиопротекторного фенотипа, среди которых методы ишемического или гипоксического прекондиционирования (ГП) [14].
Установлено, что кратковременные эпизоды гипоксии и последующей реоксигенации (при дыхании через лицевую маску газовыми смесями с разным содержанием кислорода) активируют продукцию ряда транскрипционных факторов (HIF-1α, NF-êB, NrF2), а также активных форм кислорода, что в комплексе запускает механизмы кардио- и нейропротекции, повышая мощность антиоксидантных систем, стимулируя выработку моноксида азота, эндотелиальных и сосудистых факторов роста, активность ферментов гликолиза, подавляя агрегацию тромбоцитов и адгезию лейкоцитов к эндотелию [14][15]. Показано, что эффективность интервального ГП можно усилить, заменив нормоксические паузы (периоды реоксигенации) между гипоксическими стимулами подачей пациенту гипероксической газовой смеси, что реализовано в методе интервальных гипоксически-гипероксических экспозиций (ИГГЭ) [16]. В ряде исследований установлено, что применение курса ИГГЭ изолированно или в сочетании с физическими нагрузками приводит к повышению нагрузочной толерантности у пациентов с сердечной недостаточностью (СН), улучшению когнитивных функций и оценок качества жизни у гериатрических пациентов, снижению уровня артериального давление (АД) и других кардиометаболических факторов риска у пациентов с метаболическим синдромом [17-20].
В выполненном ранее пилотном исследовании процедуры ИГГЭ были применены для прекондиционирования и кардиопротекции у пациентов при шунтировании коронарных артерий в условиях ИК [21]. У пациентов, прошедших курс ИГГЭ, в послеоперационном периоде отмечена меньшая степень повреждения миокарда по динамике значений тропонина I. В то же время значимых различий в частоте фатальных и нефатальных периоперационных осложнений не отмечено, что, вероятно, было связано с малым количеством и с относительно низким кардиохирургическим риском по шкале EuroSCORE II включенных в исследование больных.
Данное исследование выполнено в целях расширения опыта применения ИГГЭ в качестве метода прекондиционирования пациентов при различных кардиохирургических операциях с применением ИК, оценки их эффективности и безопасности, а также влияния на частоту возникающих пери- и послеоперационных осложнений, связанных с ишемически-реперфузионными повреждениями миокарда и мозга.
Материал и методы
Исследование выполнено на базе клиники кардиохирургии Первого МГМУ им. И. М. Сеченова (Сеченовский Университет), одобрено локальным этическим комитетом Университета (протокол № 28-20 от 07.10.2020г) и проведено в соответствии с этическими стандартами, изложенными в Хельсинкской декларации — Этические принципы медицинских исследований с участием людей (Бюллетень ВОЗ [ 2001]). Дизайн: одноцентровое слепое проспективное рандомизированное плацебо-контролируемое клиническое исследование. От всех участников было получено письменное информированное согласие. Исследование зарегистрировано на сайте ClinicalTrials.gov (NCT04833283).
В ходе исследования 214 больных с пороками клапанов и/или аневризмой аорты в возрасте от 20 лет до 78 лет в стабильном клиническом состоянии поступили в отделение сердечно-сосудистой хирургии для плановой операции в условиях ИК. После исключения 104 пациентов (отмена операции, отказ от участия в исследовании, недостаточный временной интервал для выполнения ИГГЭ до оперативного вмешательства), в работу были включены 110 пациентов, не имевших противопоказаний к плановому кардиохирургическому вмешательству, в т. ч. с кардиальной и внесердечной патологией в острой фазе или в фазе декомпенсации. Пациенты были случайным образом распределены в группу ИГГЭ (66 пациентов), либо в контрольную группу плацебо-ИГГЭ (44 пациента) методом "несимметричной монеты". Клинико-демографическая характеристика пациентов представлена в таблице 1.
Все пациенты находились под наблюдением и дистанционным контролем во время госпитализации и в течение 30 дней после выписки из клиники. Всем пациентам проводилась плановая предоперационная подготовка и обследование.
Процедуры интервального ГП в режиме ИГГЭ начинали проводить за 4-7 дней до операции с применением аппарата ReОxy Cardio (Aimediq S. A., Люксембург, регистрационное удостоверение РФ № РЗН 2014/1486).
Структура процедур формировалась индивидуально по результатам предварительного проведения с каждым пациентом гипоксического теста (ГТ). После предварительной инструкции пациенту предлагалось в течение 10 мин дышать через ротоносовую маску гипоксической газовой смесью с 12% О2 (ГГС-12) с мониторированием значений частоты сердечных сокращений (ЧСС) и сатурации гемоглобина кислородом (SpO2) с помощью пальцевого пульсометра (Masimo SET, США, точность измерения ±2%), инсталлированного в прибор ReОxy Cardio. При этом минимальное безопасное значение SpO2 было установлено на уровне 82%, а максимально допустимое увеличение ЧСС — не более 40% от исходных данных.
Критериями прекращения гипоксической фазы теста считали достижение критических значений ЧСС и/или SpO2, при этом фиксировали время достижения минимального значений SpO2 или максимальных значений ЧСС. По достижении в ГТ одного из этих критериев происходило автоматическое переключение работы аппарата на подачу гипероксической газовой смеси (35%О2), и пациент дышал этой смесью до восстановления значений SpO2 (значений 97-99%) с регистрацией времени восстановительного периода. При проведении ГТ фиксировали появление возможных побочных эффектов (головокружение, пресинкопальное состояние, стенокардия) или другие симптомы, которые могли приводить к ухудшению состояния пациента. Индивидуальные значения времени десатурации крови в гипоксическую фазу и восстановления SpO2 в фазу гипероксигенации являлись индикаторами для подбора интервалов гипоксических и гипероксических фаз в структуре процедур ИГГЭ.
В курсе процедур ИГГЭ, проводимых ежедневно, в ходе каждой тренировки, исходя из индивидуальных результатов ГТ, гипоксическая газовая смесь подавалась пациенту, чередуясь с подачей гипероксической газовой смеси. Один цикл процедуры состоял из гипоксических и гипероксических "интервалов", длительность которых регулировалась автоматически по принципу биологической обратной связи на основе мониторинга индивидуальных параметров SpO2 и ЧСС (при достижении в процедуре критических индивидуальных значений одного из показателей подача гипоксической смеси сменялась на гипероксическую, и наоборот). В среднем каждая тренировка включала 5-6 гипоксически-гипероксических циклов и длилась 40 мин. Продолжительность гипоксического периода в среднем составила от 3 до 6 мин, а гипероксического от 1,5 до 3 мин. Общее время вдыхания ГГС-12 за одну процедуру составило 20-28 мин. До и после процедуры измеряли значения АД и ЧСС. В зависимости от клинического состояния и длительности предоперационной подготовки в стационаре пациенты получали от 4 до 7 процедур ИГГЭ. Заключительная процедура проводилась за 9-12 ч до операции.
Пациентам контрольной группы проводились плацебо-процедуры — после проведения ГТ они дышали через аналогичную маску, зафиксированную на голове, но обычным атмосферным воздухом (21%О2), подаваемым по системе трубок дыхательного контура аппарата ReОxy Cardio, который был отсоединен от установки вне предела видимости пациента, что позволило полностью имитировать ИГГЭ. Режим проведения процедур (длительность каждой процедуры, их количество) полностью совпадал с таковым в опытной группе. После каждой плацебо-тренировки пациентов также опрашивали относительно возникновения побочных эффектов, данные вносились в дневник наблюдения. Аналогичным образом, до и после процедуры, измеряли значения АД и ЧСС.
Показаниями для вмешательства на аортальном клапане являлись: критический аортальный стеноз (в 36,5% случаев в группе ИГГЭ и 47,2% — в группе плацебо-контроля), аортальная недостаточность 3 степени с наличием клинических проявлений (36,5% и 44,4%), значимая аортальная недостаточность сочеталась с аневризмой корня и восходящего отдела аорты (в 25,8% и 27,8%, соответственно), что потребовало вмешательства на корне и восходящем отделе аорты.
Также среди пороков клапанов сердца, потребовавших хирургического вмешательства, были митральная регургитация 3 степени с выраженными клиническими проявлениями (42,9% и 52,8%). У 14,3% и 11,1% пациентов, соответственно, по данным мультиспиральной компьютерной томографии органов грудной клетки с контрастом была выявлена аневризма дуги аорты с вовлечением 0, 1, 2 зон по Стэнфордской классификации, что потребовало протезирования восходящего отдела и всей дуги аорты. Таким образом, по большинству причин кардиохирургических вмешательств группы сравнения не различались, за исключением тяжелого митрального стеноза (14,3% в группе ИГГЭ и отсутствие таких пациентов в группе контроля).
Кардиохирургические операции пациентам проводились в условиях ИК и фармако-холодовой кардиоплегии (растворы Нормакор, Кустодиол, Калифиоре). Все операции выполнялись стандартным доступом из срединной стернотомии и антероградной кардиоплегии через корень аорты с постоянной кровяной антероградной перфузией.
В качестве анестезии использовалась схема, включающая пропафенон, фентанил, реналин и аперомид.
Продолжительность ИК в группах значимо не различалась (56±14,8 мин в группе ИГГЭ и 59±15,1 мин — в контрольной группе). Также значимо не различалось время пережатия аорты: 42±7,3 мин в группе ИГГЭ и 43±7,8 мин в группе контроля.
До начала хирургического вмешательства, в конце и через 2, 6 и 24 ч после операции производили забор венозной крови для определения уровня высокочувствительного тропонина I (тест-набор Architect Stat, "Abbott", фотометр iMark с диагностическим интервалом 0,01-40,00 нг/мл); до и через 24 ч после операции — лактата (RAPIDLab 1200 System; Siemens Healthcare, Германия).
Через 24 ч после операции проводили оценку когнитивных функций с применением шкал MOCA, MMSE и теста 5(12) слов. Выбранные тесты обладают доказанной валидностью, широко применяются в оценке когнитивных функций пациентов с сердечно-сосудистой патологией [22].
Статистический анализ проводили с помощью программного продукта Statistica 10.0. Данные представлены как среднее значение и стандартное отклонение (M±SD). Проверка на нормальность распределения выполнена с применением теста Колмогорова-Смирнова. Различия качественных переменных анализировались при помощи критерия χ2 и точного метода Фишера. Для оценки значимости межгрупповых различий показателей применялся W-критерий Вилкоксона для связанных выборок, U-критерий Манна-Уитни — для несвязанных выборок. Различия считались значимыми при p<0,05.
Таблица 1
Клинико-демографические характеристики пациентов
Показатель | Группа ИГГЭ, n=66 | Группа плацебо-ИГГЭ, n=44 | Значимость различий |
Возраст | 59,1±15,2 | 56,9±12,9 | Р=0,23 |
Пол, муж. | 35 (55,6%) | 27 (75,0%) | Р=0,05 |
Кардиохирургический риск, EuroSCORE II | 3,8±3,2 | 4,6±3,4 | Р=0,13 |
ИБС | 17 (27,0%) | 11 (30,6%) | Р=0,70 |
Гипертоническая болезнь | 55 (83,3%) | 30 (68,2%) | Р=0,35 |
ХСН | 61 (92,4%) | 30 (68,2%) | Р=0,14 |
Фибрилляция предсердий, постоянная форма | 10 (15,9%) | 4 (11,1%) | Р=0,51 |
ХОБЛ | 2 (3,2%) | 6 (16,7%) | Р=0,03 |
Дислипидемия | 12 (19,0%) | 4 (11,1%) | Р=0,30 |
Курение | 15 (23,8%) | 16 (44,4%) | Р=0,03 |
Онкологические заболевания | 4 (6,3%) | 3 (8,3%) | Р=0,70 |
ОНМК в анамнезе | 2 (3,2%) | 2 (5,6%) | Р=0,62 |
Атеросклероз БЦА | 17 (27,0%) | 6 (16,7%) | Р=0,24 |
Атеросклероз Н/К | 17 (27,0%) | 5 (13,9%) | Р=0,13 |
Причина хирургического вмешательства: | |||
Аортальный стеноз | 23 (36,5%) | 17 (47,2%) | Р=0,30 |
Аортальная регургитация | 23 (36,5%) | 16 (44,4%) | Р=0,34 |
Митральный стеноз | 9 (14,3%) | 0 (0,0%) | Р=0,02 |
Митральная регургитация | 27 (42,9%) | 19 (52,8%) | Р=0,34 |
Стеноз легочной артерии | 0 (0,0%) | 1 (2,8%) | Р=0,36 |
Аневризма дуги аорты | 9 (14,3%) | 4 (11,1%) | Р=0,76 |
Аортальная регургитация + аневризма аорты | 16 (25,8%) | 10 (27,8%) | Р=0,83 |
Примечание: здесь и далее данные представлены как М±σ, категориальные переменные — в абсолютных значениях и доли в %.
Сокращения: БЦА — брахиоцефальные артерии, ИБС — ишемическая болезнь сердца, ИГГЭ — интервальные гипоксически-гипероксические экспозиции, Н/К — нижние конечности, ОНМК — острое нарушение мозгового кровообращения, ХОБЛ — хроническая обструктивная болезнь легких, ХСН — хроническая сердечная недостаточность.
Результаты
По большинству характеристик коморбидности, факторов риска, медикаментозной терапии на предоперационном этапе группы пациентов не различались (табл. 1 и 2). В группе ИГГЭ оказалось больше пациентов с митральным стенозом, и также несколько больше женщин. Среди пациентов с проявлениями хронической СН чаще встречался 2 функциональный класс (67% в группе ИГГЭ и 80% в контрольной группе), существенно реже — третий (22% в группе ИГГЭ и 9% в контрольной группе). Пациентов с хронической СН 4 функционального класса не было. Частота хронической обструктивной болезни легких оказалась выше в контрольной группе пациентов.
Основная и контрольная группы не различались по кардиотропной терапии, кроме приема сартанов — они чаще применялись у пациентов группы контроля (табл. 2).
При проведении ГТ и последующего курса процедур ИГГЭ не зафиксировано ни одного серьезного неблагоприятного осложнения (потеря сознания, эпизод ишемии миокарда, аритмия, значительные колебания уровня АД и т. п.). Лишь у трех пациентов было отмечено небольшое головокружение и слабость. При этом двое из них проходили ИГГЭ, а один пациент с указанными жалобами был в контрольной группе.
В группе ИГГЭ критерием смены гипоксической фазы на гипероксическую чаще была умеренная тахикардия, не сопровождающаяся ангинальным синдромом, уровень десатурации крови кислородом при гипоксической стимуляции достигал в среднем 82-83%, с быстрым восстановлением в гипероксическую фазу. После первой процедуры ИГГЭ ни один пациент не отказался от дальнейшего их прохождения.
Результаты сравнительного анализа периоперационного периода и осложнений, возникших во время хирургической операции и послеоперационном периоде представлены в таблицах 3 и 4. Время операции, а также продолжительность искусственной вентиляции легких в послеоперационном периоде оказались значимо меньше в группе ИГГЭ, чем в контрольной. Количество дней, проведенных в отделении реанимации, было значимо меньше в опытной группе.
Частота фатальных и нефатальных кардиальных осложнений также была существенно ниже в группе пациентов, прошедших курс ГП — лишь один летальный исход по причине интраоперационного инфаркта миокарда, один случай нефатального инфаркта и 4 случая острой СН, купированных во время операции. В контрольной группе обозначенные критические события развивались существенно чаще, так же как и ЭКГ-признаки ишемии миокарда — 26,8% случаев (в группе ИГГЭ — 9,1%). Частота случаев преходящих нарушений ритма сердца значимо не различалась.
В группе ИГГЭ значимо реже наблюдался послеоперационный гиповентиляционный синдром, а также случаи острой почечной недостаточности. При этом если в группе ИГГЭ уровень креатинина через 6 ч после операции составлял 92,8±23,1 мкмоль/л, то в группе контроля значения были повышенными: 120,8±61,2 мкмоль/л (Р=0,02).
Средние значения ключевых индикаторов повреждения и ишемии миокарда — тропонина I и лактата в венозной крови также значимо различались в группе ИГГЭ и контрольной группе на всех этапах анализа (рис. 1, 2). Так, значения тропонина I в группе пациентов, прошедших курс ИГГЭ, были значимо ниже как в конце проведения операции, так и через 2, 6 и 24 ч послеоперационного периода, не превышая значений 900 нг/мл, тогда как в группе контроля значения тропонина достигали величин 1400-1600 нг/мл.
Также значимо различались величины лактата крови через 24 ч после операции. При переводе пациентов в отделение реанимации и интенсивной терапии — если в группе ИГГЭ значения составляли 1,8±0,7 ммоль/л, существенно не превышая дооперационный уровень (1,4±0,6 ммоль/л), то в группе пациентов, прошедших плацебо-процедуры, уровень лактата сохранялся на высоком уровне — 2,4±1,2 ммоль/л, значимо превышая как уровень до операции, так и данные группы ИГГЭ.
В исследовании не выявлено случаев острого нарушения мозгового кровообращения у пациентов в пери- и постоперационном периодах, однако, учитывая возможный риск церебральных повреждений под действием ИК, проведен сравнительный анализ когнитивных функций пациентов в послеоперационном периоде (табл. 5). Через 24 ч после оперативного вмешательства у пациентов, в схему предоперационной подготовки которых входил курс ИГГЭ, отмечены существенно более высокие значения выполнения когнитивных тестов. Так, в этой группе средние значения выполнения тестов MOCA и MMSE соответствовали нормальному диапазону (более 23 и 27 баллов, соответственно), тогда как в группе контроля значения находились в диапазоне, соответствующем предементным когнитивным нарушениям. При индивидуальном анализе результатов трех тестов легкая степень когнитивных нарушений отмечена с равной частотой в группах сравнения, однако средняя и тяжелая степень нарушений мнестических функций встречалась значимо чаще в группе контроля (у 38,9% и 11,1% пациентов, соответственно, vs 6,3% и 1,6% в опытной группе).
Таблица 2
Сравнение медикаментозной терапии пациентов выделенных групп в предоперационном периоде госпитализации
Показатель | Группа ИГГЭ (n=66) | Группа плацебо-ИГГЭ (n=44) | Значимость различий |
Антагонисты альдостерона | 33 (52,4%) | 22 (61,1%) | Р=0,40 |
Диуретики | 24 (38,1%) | 16 (44,4%) | Р=0,54 |
Статины | 41 (62,1%) | 30 (68,2%) | Р=0,51 |
Β-адреноблокаторы | 34 (54,0%) | 18 (50,0%) | Р=0,80 |
Блокаторы кальциевых каналов | 0 (0,0%) | 1 (2,8%) | Р=0,36 |
Ингибиторы АПФ | 28 (44,4%) | 13 (36,1%) | Р=0,42 |
Сартаны | 4 (6,3%) | 9 (25,0%) | Р=0,01 |
Сокращения: АПФ — ангиотензинпревращающий фермент, ИГГЭ — интервальные гипоксически-гипероксические экспозиции.
Таблица 3
Параметры периоперационного периода
Показатель | Группа ИГГЭ | Группа плацебо-ИГГЭ | Значимость различий |
Продолжительность операции, мин | 390±114 | 450±146 | Р=0,02 |
Время ИВЛ после операции, час | 6,6±7,2 | 27,0±51,7 | Р<0,001 |
Объем интраоперационной кровопотери (мл) | 1,229±866 | 1,732±937 | Р=0,004 |
Количество дней в ОРИТ | 1,2±0,6 | 3,6±5,5 | Р=0,001 |
Сокращения: ИВЛ — искусственная вентиляция легких, ИГГЭ — интервальные гипоксически-гипероксические экспозиции, ОРИТ — отделение реанимации и интенсивной терапии.
Таблица 4
Кардиальные и иные осложнения в пери- и послеоперационном периоде
Показатель | Группа ИГГЭ | Группа плацебо-ИГГЭ | Значимость различий |
Смерть от сердечно-сосудистой причины | 1 (1,6%) | 6 (16,7%) | Р=0,009 |
Нефатальный инфаркт миокарда | 1 (1,6%) | 6 (16,7%) | Р=0,009 |
Нефатальный инсульт | 0 (0,0%) | 1 (2,8%) | Р=0,36 |
Острая сердечная недостаточность | 4 (6,3%) | 12 (33,3%) | Р<0,001 |
Желудочковая аритмия | 1 (1,5%) | 3 (7,3%) | Р=0,15 |
Пароксизмы фибрилляции или трепетания предсердий | 19 (28,8%) | 12 (29,3%) | Р=0,88 |
Негативная динамика сегмента ST ЭКГ | 6 (9,1%) | 11 (26,8%) | Р=0,02 |
Гиповентиляция легких/наличие субателектазов | 26 (39,4%) | 30 (73,2%) | Р=0,001 |
Острая почечная недостаточность | 4 (6,1%) | 8 (19,5%) | Р=0,05 |
Примечание: в группе ИГГЭ причина смерти — фибрилляция желудочков; в группе плацебо-ИГГЭ у 2 чел. — инфаркт миокарда, 3 — фибрилляция желудочков, 1 — острая сердечная недостаточность.
Сокращения: ИГГЭ — интервальные гипоксически-гипероксические экспозиции, ЭКГ — электрокардиография.
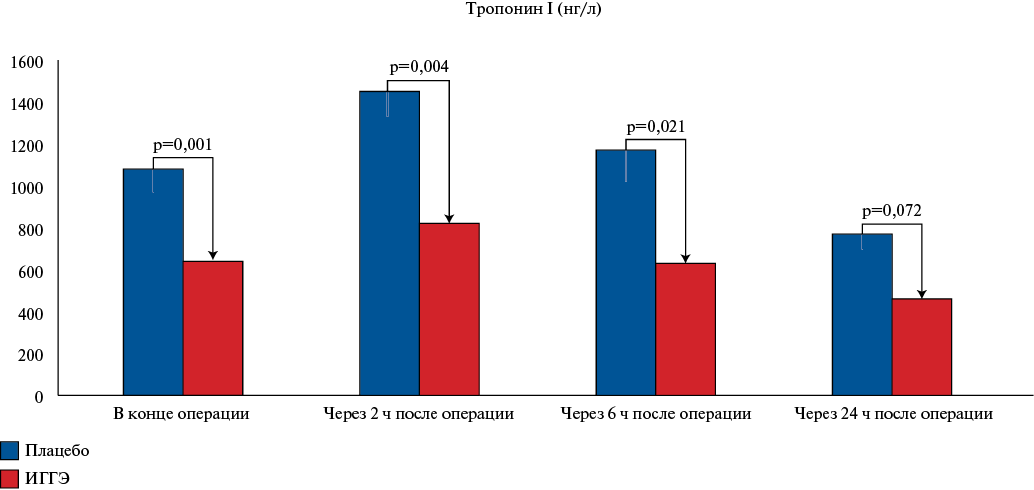
Рис. 1. Уровень тропонина I в крови до операции и в послеоперационном периоде.
Примечание: указана значимость межгрупповых различий на одном этапе наблюдения.
Сокращение: ИГГЭ — интервальные гипоксически-гипероксические экспозиции.
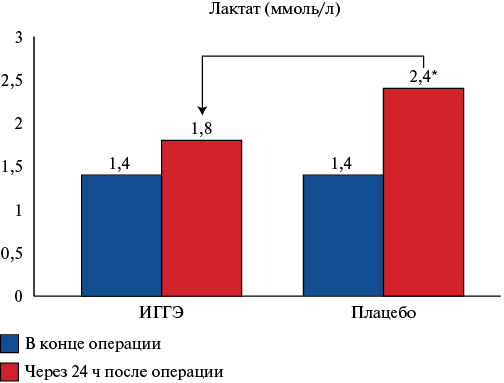
Рис. 2. Уровень лактата крови до и после вмешательства.
Примечание: * — p<0,05 — значимые межгрупповые различия значений после операции относительно исходного уровня.
Сокращения: ИГГЭ — интервальные гипоксически-гипероксические экспозиции.
Таблица 5
Состояние когнитивных функций пациентов выделенных групп в послеоперационном периоде
№ | Показатель | Группа ИГГЭ | Группа плацебо-ИГГЭ | Значимость различий |
1. | Средний балл теста MOCA | 27,2±2,5 | 20,9±9,7 | Р<0,001 |
2. | Средний балл теста MMSE | 27,2±2,6 | 20,8±9,7 | Р<0,001 |
3. | Тест "5(12) слов" | 63 (100%) | 29 (80,6%) | Р<0,001 |
4. | Степень нарушения когнитивных функций: | |||
— Легкая — Средняя — Тяжелая | 17 (27,2%) 4 (6,3%) 1 (1,6%) | 9 (25,0%) 14 (38,9%) 4 (11,1%) | Р=0,83 Р<0,001 Р=0,04 | |
Сокращения: ИГГЭ — интервальные гипоксически-гипероксические экспозиции, MOCA — (Montreal Cognitive Assessment) Монреальская шкала оценки когнитивных функций, MMSE — (Mini-mental State Examination) Краткая шкала оценки психического статуса.
Обсуждение
Основными результатами настоящего исследования являются меньшая частота фатальных и нефатальных послеоперационных осложнений, лучшая переносимость кардиохирургических операций и ИК (меньшее время искусственной вентиляции легких, нахождения в отделении реанимации и интенсивной терапии), а также существенно меньшая степень когнитивных нарушений у пациентов, прошедших курс ГП с применением протокола интервальных ИГГЭ. Феномен прекондиционирования и возможности его применения в качестве средства кардио- и нейропротекции хорошо известен [5][14], однако конкретные методики его прикладной реализации, за исключением индивидуально дозированных физических тренировок, применяются с достижением неоднозначных результатов. Применение в этих целях сравнительно коротких экспозиций гипоксии и нормоксии/гипероксии имеет существенные основания, хотя детальные механизмы развивающихся адаптивных перестроек до конца не исследованы [15]. В ряде работ показано, что достаточно короткие экспозиции дыхания пациентом гипоксической или умеренно гипероксической газовой смесью сопровождаются активацией различных факторов транскрипции с последующей экспрессией генов и синтезом белков, обеспечивающих комплекс взаимодополняющих адаптивных эффектов: митохондриальный биогенез, повышение мощности антиоксидантных систем, гликолитических ферментов, транспорта и утилизации железа, продукции оксида азота, гемоксигеназы, эритропоэтина, эндотелиальных и тромбоцитарных сосудистых факторов роста, отдельных миокинов и др., что повышает устойчивость миокарда и мозга к ишемически-реперфузионным повреждениям. Эти процессы описаны как гипоксически-гипероксический парадокс [23-26].
Известно, что ишемическое/ГП инициирует каскад как срочных (в течение минут после воздействия), так и отсроченных (через 1-2 ч) молекулярных и биохимических процессов. Первое временное "окно" прекондиционирования предложено использовать в работе Мандель И. А. и др. [27], где апробирована методика подачи пациентам, находящимся в наркозе непосредственно перед операцией аортокоронарного шунтирования, сначала гипоксической (FiO2=0,11, 10 мин), а затем гипероксической (FiO2=0,75, 30 мин) газовых смесей. Установлено, что в сравнении с группой контроля у пациентов, прошедших однократно процедуру интраоперационного гипоксически-гипероксического кондиционирования, отмечено меньше периоперационных осложнений, более частое восстановление спонтанного синусового ритма, что сопровождалось значимо меньшими значениями индикаторов эндотелиальной дисфункции (эндотелин-1) и оксидативного стресса через 24 ч после операции. Однако такой подход технически сложен и требует специальных навыков и компетенций анестезиологов.
Нами же предложен и применен более "физиологичный" метод ГК, основанный на использовании разрешенного к применению в РФ медицинского оборудования — гипоксикатора ReOxy, с повторяющейся индукцией отсроченных эффектов прекондиционирования, что в результате наряду с зафиксированным меньшим количеством послеоперационных осложнений сопровождалось меньшей степенью ишемически-реперфузионных повреждений миокарда по динамике значений тропонина I и лактата в раннем послеоперационном периоде. Системный характер вмешательства, по-видимому, обеспечивает большую защиту от ишемически-реперфузионного повреждения у кардиохирургических пациентов с повышенным риском ишемических событий, чем локальное или дистанционное ишемическое прекондиционирование.
Как справедливо отмечается в ряде клинических работ, существенную роль в инициации защитных или, напротив, маладаптивных механизмов играет доза воздействия — степень и продолжительность индуцируемой гипоксемии и последующей реоксигенации [28][29]. Очевидно, необходимо уделять особое внимание отработке индивидуальных критериев подбора протоколов ИГГЭ в предоперационные периоды, что является перспективой наших дальнейших исследований.
Важно отметить высокую безопасность процедур ИГГЭ, назначаемых в зависимости от индивидуальной гипоксической чувствительности пациентов, тестируемой при ГТ. Ни один из 66 пациентов в основной группе, а также ни один из 44 пациентов контрольной группы (плацебо-процедуры, проводимые с применением того же аппарата) не предъявлял существенных жалоб на побочные эффекты. Наряду с относительной простотой применения системы, её безопасность делает данный вид преабилитации доступным для широкого практического применения в практике кардиохирургии.
Ограничения исследования. Объем выборки, а также тот факт, что исследование было одноцентровым, требуют дальнейших, более масштабных контролируемых работ по анализу эффективности и безопасности применения ИГГЭ в качестве метода кардио- и нейропротекции при подготовке к кардиохирургическим операциям. Группы сравнения не были полностью сбалансированы по отдельным факторам риска, причинам кардиохирургических вмешательств. Когнитивные функции пациентов оценивались только в послеоперационном периоде, что не позволяет в полной мере оценить нейропротективные эффекты процедур ИГГЭ. Отдельного изучения требуют эффекты ГК на риск возникновения по причине ИК неврологических, кардиальных осложнений и уровень качества жизни пациентов в отдаленном послеоперационном периоде.
Заключение
Применение индивидуально-адаптированных процедур интервальных ИГГЭ в режиме ГП снижает частоту пери- и послеоперационных осложнений, что сопровождается меньшей степенью ишемически-реперфузионного повреждения миокарда при ИК, с сохранением когнитивных функций пациентов. Процедуры ИГГЭ расширяют арсенал средств преабилитации пациентов, направляемых на хирургическое лечение пороков сердца и патологии аорты в условиях ИК.
Благодарности. Авторы выражают благодарность компании AiMediq S. A. (Люксембург) за предоставленный прибор ReOxy Cardio для проведения процедур ИГГЭ.
Отношения и деятельность. Работа выполнена при поддержке Министерства науки и высшего образования Российской Федерации в рамках государственной поддержки создания и развития научного центра мирового уровня "Цифровой биодизайн и персонализированное здравоохранение" № 075-15-2022-304.
Список литературы
1. Neumann FJ, Sousa Uva M, Ahlsson A, et al. 2018 ESC/EACTS Guidelines on myocardial revascularization. European Heart Journal. 2019;40(2):87165. doi:10.1093/eurheartj/ehy394.
2. Engelman DT, Ben Ali W, Williams JB, et al. Guidelines for Perioperative Care in Cardiac Surgery: Enhanced Recovery After Surgery Society Recommendations. JAMA Surgery. 2019;154(8):75566. doi:10.1001/jamasurg.2019.1153.
3. Аргунова Ю. А., Барбараш О. Л. Возможности медикаментозной кардиопротекции при подготовке к коронарному шунтированию. Кардиология и сердечно сосудистая хирургия. 2022;15(3):23641. doi:10.17116/kardio202215031236.
4. Ball L, Costantino F, Pelosi P. Postoperative complications of patients undergoing cardiac surgery. Current Opinion in Critical Care. 2016;22(4):38692. doi:10.1097/MCC.0000000000000319.
5. Davidson SM, Ferdinandy P, Andreadou I. Multitarget strategies to reduce myocardial ischemia/reperfusion injury: JACC review topic of the week. Journal of American college of cardiology. 2019;73(1):8999. doi:10.1016/j.jacc.2018.09.086.
6. Ивкин А. А., Григорьев Е. В., Шукевич Д. Л. Роль искусственного кровообращения в развитии послеоперационной когнитивной дисфункции. Кардиология и сердечнососудистая хирургия. 2021;14(2):16874. doi:10.17116/kardio202114021168.
7. Малева О. В., Сосни на А. С., Сырова И. Д. и др. Ранняя послеоперационная когнитивная дисфункция после коронарного шунтирования и каротидной эндартерэктомии. Кардиология и сердечно сосудистая хирургия. 2022;15(5):4706. doi:10.17116/kardio202215051470.
8. Gogayeva OK, Rudenko AV, Lazoryshynets VV. Postoperative cerebrovascular complications in highrisk patients with coronary artery disease in cardiac surgery. Ukrainian Neurosurgical Journal. 2021;27;2:4955. doi:10.25305/unj.228425.
9. Abreu A. Prehabilitation: expanding the concept of cardiac rehabilitation. European Journal of Preventive Cardiology. 2018;25(9):9703. doi:10.1177/2047487318763666.
10. Quindry JC, Franklin BA. Exercise Preconditioning as a Cardioprotective Phenotype. American Journal of Cardiology. 2021;148:815. doi:10.1016/j.amjcard.2021.02.030.
11. Santa Mina D, Clarke H, Ritvo P, et al. Effect of totalbody prehabilitation on postoperative outcomes: a systematic review and metaanalysis. Journal of Physiotherapy. 2014;100(3):196207. doi:10.1016/j.physio.2013.08.008.
12. Аргунова Ю. А., Короткевич А. А., Помешкина С. А. и др. Эффективность физических тренировок как метода кардиопротекции у пациентов перед коронарным шунтированием. Российский кардиологический журнал. 2018;(6):15965. doi:10.15829/1560407120186159165.
13. Тарасова И. В., Моськин Е. Г., Трубникова О. А. и др. Влияние физической преабилитации на нейрофизиологические показатели пациентов после коронарного шунтирования. Кардиология и сердечно сосудистая хирургия. 2020;13(5):38590. doi:10.17116/kardio202013051385.
14. Stray Gundersen S, Massoudian SD, Wojan F, et al. Hypoxic preconditioning reduces endothelial ischemiareperfusion injury in older adults. American Journal of PhysiologyReguloratory Integrative and comparative physiology. 2022;1;323(5):R832R838. doi:10.1152/ajpregu.00200.2022.
15. Burtscher J, Citherlet T, Camacho Cardenosa A, et al. Mechanisms underlying the health benefits of intermittent hypoxia conditioning. Journal of Physiology. 2023. Ahead of print. doi:10.1113/JP285230.
16. Dudnik E, Zagaynaya E, Glazachev OS, et al. Intermittent hypoxia hyperoxia conditioning improves cardiorespiratory fitness in older comorbid cardiac outpatients without hematological changes: a randomized controlled trial. High Altitude Medicine and Biology. 2018;19:33943. doi:10.1089/ham.2018.0014.
17. Glazachev OS, Kryzhanovskaya SYu, Zapara MA, et al. Safety and efficacy of intermittent hypoxia conditioning as a new rehabilitation/secondary prevention strategy for patients with cardiovascular diseases: a systematic review and metaanalysis. Current Cardiology Review. 2021;18756557. doi:10.2174/1573403X17666210514005235.
18. Behrendt T, Bielitzki R, Behrens M, et al. Effects of Intermittent Hypoxia Hyperoxia Exposure Prior to Aerobic Cycling Exercise on Physical and Cognitive Performance in Geriatric Patients — A Randomized Controlled Trial. Frontiers of Physiology. 2022;13:899096. doi:10.3389/fphys.2022.899096.
19. Bestavashvili AA, Glazachev OS, Bestavashvili AA, et al. The Effects of Intermittent Hypoxic Hyperoxic Exposures on Lipid Profile and Inflammation in Patients With Metabolic Syndrome. Frontiers in cardiovascular medicine. Med. 2021;8:700826. doi:10.3389/fcvm.2021.70082.
20. Bayer U, Likar R, Pinter G, et al. Intermittent hypoxic hyperoxic training on cognitive performance in geriatric patients. Alzheimers Dement (NY). 2017;3(1):11422. doi:10.1016/j.trci.2017.01.002.
21. Тутер Д. С., Комаров Р. Н., Глазачев О. С. и др. Применение интервальных гипоксически гипероксических тренировок для профилактики интраоперационных и ранних послеоперационных осложнений при шунтировании коронарных артерий. Российский кардиологический журнал. 2018;(6):16672. doi:10.15829/1560407120186166172.
22. Галяутдинов Г. С., Лонкин М. А. Диагностика когнитивных нарушений и определение качества жизни у пациентов, страдающих хронической сердечной недостаточностью. Практическая медицина. 2016;(9):1821.
23. Balestra C, MrakicSposta S, Virgili F. Oxygen Variations — Insights into Hypoxia, Hyperoxia and Hyperbaric Hyperoxia — Is the Dose the Clue? International Journal of molecular sciences. 2023;24:13472. doi:10.3390/ijms241713472.
24. Burtscher J, Mallet RT, Pialoux V, et al. Adaptive Responses to Hypoxia and/or Hyperoxia in Humans. Antioxidant and Redox Signaling. 2022;37(1315):887912. doi:10.1089/ars.2021.0280.
25. Hadanny A, Efrati S. The Hyperoxic Hypoxic Paradox. Biomolecules. 2020;10(6):958. doi:10.3390/biom10060958.
26. Schottlender N, Gottfried I, Ashery U. Hyperbaric Oxygen Treatment: Effects on Mitochondrial Function and Oxidative Stress. Biomolecules. 2021;11(12):1827. doi:10.3390/biom11121827.
27. Mandel IA, Podoksenov YK, Mikheev SL, et al. Endothelial Function and Hypoxic Hyperoxic Preconditioning in Coronary Surgery with a Cardiopulmonary Bypass: Randomized Clinical Trial. Biomedicines. 2023;11(4):1044. doi:10.3390/biomedicines11041044.
28. Behrendt T, Bielitzki R, Behrens M, et al. Effects of Intermittent Hypoxia Hyperoxia on Performance and Health Related Outcomes in Humans: A Systematic Review. Sports Medicine Open. 2022;8(1):70. doi:10.1186/s4079802200450x.
29. Lizamore CA, Hamlin MJ. The use of simulated altitude techniques for beneficial cardiovascular health outcomes in nonathletic, sedentary, and clinical populations: A literature review. High Altitude Medicine and Biology. 2017;18:30521. doi:10.1089/ham.2017.0050.
Об авторах
И. ДхифРоссия
Инесс Дхиф — аспирантка кафедры кардиологии, функциональной и ультразвуковой диагностики Института клинической медицины им. Н. В. Склифосовского.
Москва
Конфликт интересов:
нет
О. С. Глазачев
Россия
Инесс Дхиф — аспирантка кафедры кардиологии, функциональной и ультразвуковой диагностики Института клинической медицины им. Н. В. Склифосовского.
Москва
Конфликт интересов:
нет
А. А. Беставашвили
Россия
Афина Автандиловна Беставашвили — н. с. Института персонализированной кардиологии Центра "Цифровой биодизайн и персонализированное здравоохранение", врач функциональной диагностики, кардиолог УКБ № 1.
Москва
Конфликт интересов:
нет
Ж. Синьлян
Россия
Жанг Синьлян — аспирант кафедры спортивной медицины и медицинской реабилитации.
Москва
Конфликт интересов:
нет
Е. П. Гуляева-Сельцовская
Россия
Екатерина Петровна Гуляева-Сельцовская — соискатель кафедры кардиологии, функциональной и ультразвуковой диагностики Института клинической медицины им. Н.В. Склифосовского.
Москва
Конфликт интересов:
нет
Н. О. Кузнецова
Россия
Наталья Олеговна Кузнецова — к. м. н., н. с. Института персонализированной кардиологии Центра "Цифрового биодизайна и персонализированного здравоохранения".
Москва
Конфликт интересов:
нет
Е. А. Сыркина
Россия
Елена Абрамовна Сыркина — доцент, к. м. н., кафедры кардиологии, функциональной и ультразвуковой диагностики Института клинической медицины им. Н. В. Склифосовского.
Москва
Конфликт интересов:
нет
В. В. Смирнова
Россия
Виктория Витальевна Смирнова — сотрудник, Университетская клиническая больница № 3, Лечебно-диагностическое отделение № 1.
Москва
Конфликт интересов:
нет
Е. Н. Дудник
Россия
Елена Николаевна Дудник — доцент кафедры нормальной физиологии.
Москва
Конфликт интересов:
нет
П. Ш. Чомахидзе
Россия
Петр Шалвович Чомахидзе — д. м. н., профессор кафедры кардиологии, функциональной и ультразвуковой диагностики Института клинической медицины им. Н. В. Склифосовского, в. н. с. Института персонализированной кардиологии Центра "Цифрового биодизайна и персонализированного здравоохранения".
Москва
Конфликт интересов:
нет
Б. М. Тлисов
Россия
Борис Магометович Тлисов — к. м. н., сердечно-сосудистый хирург отделения кардиологии УКБ № 1.
Москва
Конфликт интересов:
нет
Р. Н. Комаров
Россия
Роман Николаевич Комаров — д. м. н., профессор, зав. кафедрой сердечно-сосудистой хирургии ИПО.
Москва
Конфликт интересов:
нет
Ф. Ю. Копылов
Россия
Филипп Юрьевич Копылов — д. м. н., профессор, профессор кафедры кардиологии, функциональной и ультразвуковой диагностики Института клинической медицины им. Н. В. Склифосовского, директор Института персонализированной кардиологии Центра "Цифрового биодизайна и персонализированного здравоохранения".
Москва
Конфликт интересов:
нет
Дополнительные файлы
- Применение интервальных гипоксически-гипероксических экспозиций в режиме гипоксического прекондиционирования снижает частоту пери- и послеоперационных осложнений.
- В исследовании не зарегистрировано случаев острого нарушения мозгового кровообращения у пациентов после курса гипоксического прекондиционирования в пери- и послеоперационном периодах, с сохранением более высокого уровня когнитивных функций по сравнению с группой плацебо-воздействий.
- В сравнении с группой контроля у пациентов, прошедших процедуры предоперационного гипоксически-гипероксического кондиционирования, отмечено частое спонтанное восстановление синусового ритма, что сопровождалось значимо меньшими значениями индикаторов повреждения миокарда, эндотелиальной дисфункции и оксидативного стресса через 24 ч после операции.
Рецензия
Для цитирования:
Дхиф И., Глазачев О.С., Беставашвили А.А., Синьлян Ж., Гуляева-Сельцовская Е.П., Кузнецова Н.О., Сыркина Е.А., Смирнова В.В., Дудник Е.Н., Чомахидзе П.Ш., Тлисов Б.М., Комаров Р.Н., Копылов Ф.Ю. Интервальное гипоксическое прекондиционирование снижает риск пери- и послеоперационных осложнений при кардиохирургических операциях с использованием искусственного кровообращения. Российский кардиологический журнал. 2024;29(7):5778. https://doi.org/10.15829/1560-4071-2024-5778. EDN: DKVMFM
For citation:
Dhif I., Glazachev O.S., Bestavashvili A.A., Sinlyan Ch., GulyaevaSeltsovskaya E.P., Kuznetsova N.O., Syrkina E.A., Smirnova V.V., Dudnik E.N., Chomakhidze P.Sh., Tlisov B.M., Komarov R.N., Kopylov F.Yu. Intermittent hypoxic preconditioning reduces the risk of peri- and postoperative complications during on-pump cardiac surgery. Russian Journal of Cardiology. 2024;29(7):5778. (In Russ.) https://doi.org/10.15829/1560-4071-2024-5778. EDN: DKVMFM
JATS XML

















































