Перейти к:
Острый коронарный синдром с подъемом сегмента ST у ребенка с мышечной дистрофией Дюшенна: клинический случай
https://doi.org/10.15829/1560-4071-2024-5763
EDN: JVXBZN
Аннотация
Введение. Мышечная дистрофия Дюшенна — Х-сцепленное мышечное заболевание, вызванное отсутствием дистрофина. Это приводит к гибели мышечных клеток и кардиомиоцитов и последующему их замещению жировой и фиброзной тканью. Клинически данное заболевание проявляется прогрессирующей мышечной слабостью и кардиомиопатией. Мы сообщаем о случае молодого пациента с острым повреждением миокарда без окклюзии коронарных артерий на фоне мышечной дистрофии Дюшенна.
Краткое описание. 15-летний пациент мужского пола с мышечной дистрофией Дюшенна, отсутствием факторов риска ишемической болезни сердца и известными кардиологическими заболеваниями обратился с давящей болью в груди. Электрокардиограмма показала элевацию сегмента ST по нижней и боковой стенкам. Учитывая клиническую картину давящей боли в груди, изменения на электрокардиограмме и повышенные сердечные биомаркеры был поставлен первоначальный рабочий диагноз острого инфаркта миокарда, в связи с чем пациент был доставлен в катетерную лабораторию для выполнения коронароангиографии, которая продемонстрировала нормальную анатомию сердца и коронарные артерии без гемодинамически значимых стенозов. Пациент был выписан из стационара на 14 сут. с окончательным диагнозом кардиомиопатии на фоне мышечной дистрофии Дюшенна и рекомендациями по приему периндоприла 5 мг в сутки и бисопролола 5 мг в сутки.
Дискуссия. Практикующие врачи первой линии должны знать о высокой распространенности кардиомиопатии у пациентов с миодистрофией Дюшенна, которая увеличивается с возрастом. Сердечные биомаркеры могут быть хронически повышены при данной патологии, однако высокий уровень настороженности в сочетании с эхокардиографией и в идеале с магнитнорезонансной томографией могут помочь в диагностике острого повреждения миокарда в этих случаях. Основываясь на этом случае, мы обсуждаем дилеммы ведения и последующего наблюдения этой сложной группы пациентов.
Ключевые слова
Для цитирования:
Татаринцева З.Г., Бабичева О.В., Барбухатти К.О. Острый коронарный синдром с подъемом сегмента ST у ребенка с мышечной дистрофией Дюшенна: клинический случай. Российский кардиологический журнал. 2024;29(10S):5763. https://doi.org/10.15829/1560-4071-2024-5763. EDN: JVXBZN
For citation:
Tatarintseva Z.G., Babicheva O.V., Barbuhatti K.O. ST-segment elevation acute coronary syndrome in a child with Duchenne muscular dystrophy: a case report. Russian Journal of Cardiology. 2024;29(10S):5763. (In Russ.) https://doi.org/10.15829/1560-4071-2024-5763. EDN: JVXBZN
Мышечные дистрофии представляют собой группу генетических заболеваний, характеризующихся дегенерацией мышц и последующим их замещением жировой и фиброзной тканью. Мышечная дистрофия Дюшенна (МДД) — Х-сцепленное заболевание, вызванное отсутствием дистрофина из-за дефектного синтеза [1]. Отсутствие дистрофина приводит к хрупкости сарколеммы и дегенерации мышечных клеток, а также к конформационным изменениям в активируемых растяжением кальциевых каналах, что приводит к патологической утечке кальция в мышечный цитозоль и гибели клеток [2].
Поражение сердца является хорошо известным осложнением мышечных дистрофий. Оно характеризуется апоптозом кардиомиоцитов и их замещением фиброзной тканью, что часто связано с компенсаторной гипертрофией окружающей мышцы и может быть субстратом нарушений сердечного ритма [3]. По мере нарастания фиброза миокарда левый желудочек (ЛЖ) прогрессивно расширяется, что в конечном итоге приводит к клинической картине дилатационной кардиомиопатии (КМП) [3]. Ингибиторы ангиотензинпревращающего фермента (иАПФ) или блокаторы рецепторов ангиотензина и глюкокортикостероиды используются для задержки или защиты от развития КМП, связанной с МДД, хотя доказательства в пользу использования последних противоречивы [4]. При выявлении КМП показано традиционное лечение сердечной недостаточности (СН) [5].
Клинический случай
Мы представляем случай 15-летнего ребенка европеоидной расы с МДД, который поступил в отделение детской реанимации с давящими болями за грудиной.
У представляемого пациента диагноз МДД был установлен в первые годы жизни (делеция экзонов 46-51 гена МДД). Он принимал стероидные препараты (дефлозакорт 27 мг/сут.) в течение длительного времени, а в возрасте 10 лет был назначен периндоприл 5 мг, который пациент принимал нерегулярно по инициативе матери. В анамнезе не было курения или употребления наркотиков, традиционных факторов риска развития ишемической болезни сердца и известной кардиологической патологии. Из-за прогрессирующей нервно-мышечной слабости к 12 годам он стал малоподвижным и частично зависимым от инвалидной коляски.
В возрасте 15 лет у пациента появилась давящая загрудинная боль, продолжающаяся в течение часа. При клиническом обследовании обращала на себя внимание избыточная масса тела (индекс массы тела 24,57 кг/м2). Объективный статус пациента не имел особенностей, за исключением тахикардии покоя с частотой сердечных сокращений 103 уд./мин.
На электрокардиограмме (ЭКГ) в 12 отведениях при поступлении в отделение неотложной помощи выявлен синусовый ритм, подъем сегмента ST в V3-V5 отведениях более чем на 2 мм, укорочение интервала PQ, а также расщепление комплекса QRS (рис. 1).
Лабораторные анализы демонстрировали повышение трансаминаз крови, лактатдегидрогеназы, высокочувствительного тропонина и кардиоспецифических ферментов (табл. 1).
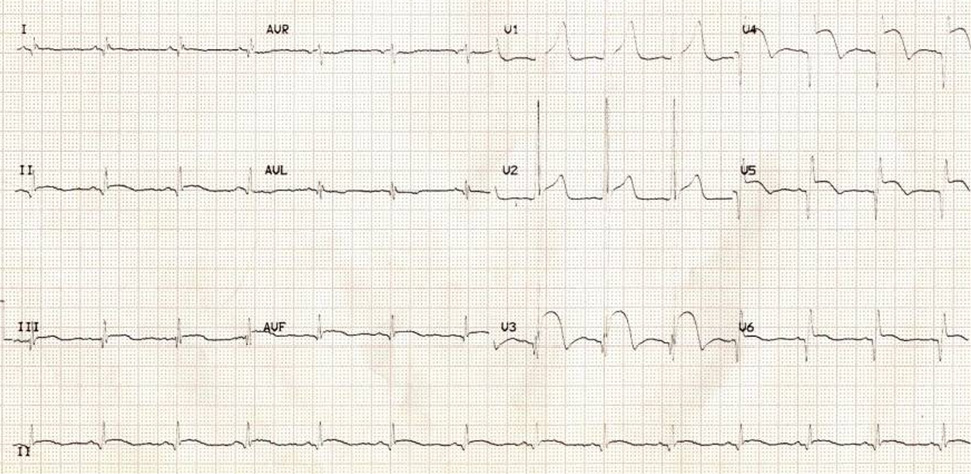
Рис. 1. ЭКГ пациента на фоне терапии β-блокатором (бисопролол 5 мг).
Таблица 1
Основные гематологические показатели пациента при поступлении в стационар
Показатель | Результат | Ед. изм. | Референсные значения | |
Биохимия крови | ||||
Глюкоза | 5,00 | ммоль/л | 3,50-6,38 | |
< | Мочевина | 2,10 | ммоль/л | 2,50-8,30 |
< | Креатинин | 11,00 | мкмоль/л | 44,00-115,00 |
Билирубин общий | 9,30 | мкмоль/л | 3,40-20,50 | |
< | Общий белок | 61,39 | г/л | 64,00-85,00 |
Альбумин | 47,30 | г/л | 32,00-52,00 | |
> | Аспартатаминотрансфераза | 553,0 | ед./л | 0,0-35,0 |
> | Аланинаминотрансфераза | 151,0 | ед./л | 5,0-55,0 |
> | Лактатдегидрогеназа | 2684,0 | ед./л | 125,0-480,0 |
Триглицериды | 1,45 | ммоль/л | <1,69 | |
Креатининкиназа | 645 | ед./л | <200,0 | |
Креатининкиназа МВ-фракция | 94 | ед./л | <24,00 | |
Гормоны, маркеры | ||||
> | Тропонин I высокочувствительный | >25 | нг/мл | 0,000-0,040 |
NT-proBNP | 196,00 | пг/мл | <222,00 | |
Сокращение: NT-proBNP — N-концевой промозговой натрийуретический пептид.
Больной поступил в детское отделение реанимации с дифференциальным диагнозом острого инфаркта миокарда или острого повреждения миокарда, связанного с КМП. КМП часто описывается при МДД и протекает бессимптомно в течение длительного времени. При поступлении в отделение неотложной помощи клиническая картина нашего пациента не соответствовала СН, на эхокардиографии (ЭхоКГ) было обнаружено структурно нормальное сердце, уровень N-концевого промозгового натрийуретического пептида был в пределах референсных значений. Однако следует отметить, что вследствие малой мобильности пациента по причине мышечной дистрофии на фоне основного заболевания, оценить объективно такие симптомы СН, как одышку при нагрузке, и/или ограниченную толерантность к физической нагрузке было невозможно. Кроме того, на ранних стадиях заболевания ЭхоКГ может выглядеть нормальной.
Учитывая клиническую картину давящей боли в груди, изменения ЭКГ и повышенные сердечные биомаркеры был поставлен первоначальный рабочий диагноз острого коронарного синдрома с подъемом сегмента ST, в связи с чем пациент был доставлен в катетерную лабораторию для выполнения коронароангиографии, которая продемонстрировала нормальную анатомию сердца и коронарные артерии без гемодинамически значимых стенозов.
У детей с подъемом сегмента ST и повышенным уровнем тропонинов наиболее частой причиной данного состояния является вирусный миокардит, который был исключен отрицательными серологическими показателями (энтеровирус, аденовирус, парвовирус В19, цитомегаловирус, вирус герпеса человека и вирус Эпштейна-Барр). Появляется все больше доказательств того, что воспаление может быть провоцирующим фактором развития КМП при МДД. Предыдущие работы показали, что у пациентов с МДД с воспалением миокарда при биопсии сердца, которое проявляется в виде лейкоцитарной инфильтрации (в основном Т-клеток и макрофагов), быстрее прогрессирует симптоматическая СН по сравнению с пациентами с МДД без воспаления. Отличительным признаком заболеваний сердца при МДД является фиброз боковой стенки вследствие продолжающегося воспаления, которое можно отсрочить с помощью стероидных препаратов. Этот фиброз часто лучше всего охарактеризовать с помощью магнитно-резонансной томографии (МРТ) сердца [6].
К сожалению, нашему пациенту при поступлении не была проведена МРТ сердца. Пациенту продолжено лечение стероидными препаратами, назначена кардиотропная терапия периндоприлом, бисопрололом и спиронолактоном. В динамике тропонины крови анализировались ежедневно и отмечалась тенденция к снижению: уровень тропонина составил 8,2 нг/л, зафиксированный в день выписки. Пациент был выписан из стационара на 14 сут. с окончательным диагнозом КМП на фоне МДД и рекомендациями по приему периндоприла 5 мг в сутки и бисопролола 5 мг в сутки. Также было рекомендовано инициировать прием касимерсена. Данный препарат связывается с экзоном 45 пре-мРНК дистрофина, что приводит к исключению этого экзона во время обработки мРНК у пациентов с генетическими мутациями, которые поддаются пропуску экзона 53. Пропуск 45 экзона приводит к выработке укороченного белка дистрофина у пациентов с генетическими мутациями.
Обсуждение
Сердечные заболевания при МДД были описаны доклинически уже у детей раннего возраста. К 18 годам у подавляющего большинства пациентов с МДД наблюдаются заболевания сердца, наиболее распространенной из которых является КМП. Чаще встречается дилатационная КМП, за которой следует гипертрофическая. Симптомы часто отсутствуют из-за ограничения физической активности [7].
При поздних стадиях КМП сообщалось о таких аритмиях, как предсердная тахикардия, желудочковая тахикардия и фибрилляция желудочков. Синусовая тахикардия, выявленная и у нашего пациента, является наиболее распространенной наблюдаемой аритмией [8, 9]. Тяжелая дисфункция ЛЖ, выявленная при ЭхоКГ, и позднее усиление гадолиния, наблюдаемое при МРТ сердца, также связаны с более высоким риском аритмий [10].
Сердечные биомаркеры могут быть хронически повышены у пациентов с МДД из-за повреждения скелетных мышц, при этом сердечный тропонин I более специфичен, чем сердечный тропонин Т, возможно, потому что он не экспрессируется в скелетных мышцах человека и тесно связан с сердечно-сосудистыми заболеваниями [11]. Кроме того, пороговые уровни тропонина для диагностики острого коронарного синдрома не подтверждены у детей и детей с МДД. В серии случаев, проведенных Hor KN, et al., уровни тропонина I варьировались от 31 нг/мл до 62 нг/мл (референтный диапазон: <0,03 нг/мл) [12].
Двумерная ЭхоКГ является современным стандартом мониторинга систолической функции ЛЖ у пациентов с МДД, но она не может выявить раннюю систолическую дисфункцию. Спекл-трекинг ЭхоКГ в подобной ситуации является перспективным и объективным исследованием. Taqatqa А, et al. продемонстрировали на 35 пациентах, что сегментарная продольная деформация, измеренная в различных сегментах, была ниже у пациентов с МДД по сравнению с контрольной группой [13].
МРТ рекомендуется для скрининга прогрессирования заболевания, показывающего характерные изменения в задне-базальных и базальных нижнелатеральных областях ЛЖ. Позднее усиление гадолиния в субэндокарде предполагает ишемическое повреждение, тогда как субэпикардиальная локализация соответствует миокардиту или инфильтративному заболеванию. При МДД рекомендуется проводить МРТ сердца ежегодно после 10 лет [14].
Hor KN, et al. сообщили о восьми педиатрических случаях МДД, у которых были жалобы на боли в грудной клетке, подъем сегмента ST и повышенный уровень тропонина. У всех восьми пациентов нормальная коронарная перфузия была подтверждена с помощью КТ-ангиографии или катетеризации сердца, тогда как при МРТ было продемонстрировано нарушение систолической функции. Авторы объяснили это прогрессированием КМП, приводящей к эпизодическому повреждению миокарда [12]. Имеется множество сообщений о случаях инфаркта миокарда у детей с МДД в возрасте 10-13 лет [15].
Принцип фармакологического лечения МДД заключается в отсрочке развития СН. Ранняя стероидная терапия оказывает благотворное влияние на функцию легких, функцию ЛЖ и скелетных мышц. В то время как данные рандомизированных контролируемых исследований показали пользу кортикостероидов для восстановления мышечной силы, единого мнения относительно наиболее подходящего режима приема стероидов не существует. В настоящее время в рекомендациях по лечению отсутствуют сравнительные данные об эффективности различных режимов дозирования. В мире наиболее распространенными схемами применения глюкокортикоидов являются либо преднизолон 0,75 мг/кг/сут., либо дефлазакорт 0,9 мг/кг/сут. Дефлазакорт используется для лечения МДД уже >20 лет, и опубликованные данные показывают, что он является потенциально более безопасной и эффективной альтернативой преднизолону. Дефлазакорт оказывает положительное влияние на многие аспекты заболевания и может использоваться у всех пациентов с МДД независимо от генетической мутации 1. Учитывая мировые данные по использованию глюкокортикоидов у данной популяции пациентов, было принято решение не использовать пульс терапию преднизолоном для лечения пациента в конкретном клиническом случае.
Аналогично было доказано, что использование иАПФ задерживает возникновение и прогрессирование дисфункции ЛЖ. иАПФ рекомендуются в качестве терапии первой линии, которая, как доказано, снижает смертность и количество госпитализаций у пациентов с МДД и СН [16, 17].
Также было показано, что бета-блокаторы эффективны при МДД в качестве антиаритмических средств, улучшают фракцию выброса ЛЖ и способствуют обратному ремоделированию желудочков. Антагонисты альдостерона, такие как эплеренон, также оказали положительное влияние, если их начать в более молодом возрасте, в дополнение к иАПФ и бета-блокаторам [18].
На ранней стадии КМП необходимо проводить расширенное кардиологическое исследование с целью выявления ранних изменений со стороны сердца и их коррекции на доклиническом этапе. Внедрение комплекса обследования сердечно-сосудистой системы в широкую кардиологическую практику и своевременное назначение необходимого лечения в зависимости от стадии кардиомиопатического процесса будет способствовать увеличению срока жизни больных с МДД [19].
Заключение
Пациенты с МДД могут обращаться в отделение неотложной помощи с различными жалобами, которые часто имеют респираторный или сердечный характер. У пациентов могут наблюдаться боли в груди, очаговая элевация сегмента ST и другие изменения на ЭКГ, значительное повышение уровня сердечных ферментов, что требует проведения дифференциальной диагностики между острым инфарктом миокарда, острым повреждением миокарда на фоне основного заболевания, миокардитом и перикардитом. Правильная диагностика важна с точки зрения определения стратегии лечения и прогноза для пациента.
Практикующие врачи первой линии должны знать о высокой распространенности КМП у пациентов с МДД, которая увеличивается с возрастом. Таким пациентам следует выполнить ЭКГ, которую, если возможно, следует сравнить с исходной ЭКГ. Сердечные биомаркеры могут быть хронически повышены при МДД. Однако высокий уровень подозрения в сочетании с эхокардиограммой может помочь в диагностике острого повреждения миокарда. Там, где это возможно, МРТ и/или спекл-трекинг ЭхоКГ помогают в обследовании пациентов с повреждением миокарда, связанным с МДД.
Информированное согласие
Пациент дал письменное добровольное информированное согласие на публикацию описания клинического случая.
Отношения и деятельность: все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье.
1 Циркунова А. Г., Смекалова Е. А., Кураш И. А. и др. Глюкокортикостероиды в терапии мышечной дистрофии Дюшенна. Молодой ученый. 2019; 10(248):83-6.
Список литературы
1. Nowak KJ, Davies KE. Duchenne muscular dystrophy and dystrophin: pathogenesis and opportunities for treatment. EMBO Rep. 2004;5(9):872-6. doi:10.1038/sj.embor.7400221.
2. Verhaert D, Richards K, Rafael-Fortney JA, Raman SV. Cardiac involvement in patients with muscular dystrophies: magnetic resonance imaging phenotype and genotypic considerations. Circ Cardiovasc Imaging. 2011;4(1):67-76. doi:10.1161/CIRCIMAGING.110.960740.
3. Turner D, Ruemmele FM, Orlanski-Meyer E, et al. Management of Paediatric Ulcerative Colitis, Part 1: Ambulatory Care-An Evidence-based Guideline From European Crohn's and Colitis Organization and European Society of Paediatric Gastroenterology, Hepatology and Nutrition. J Pediatr Gastroenterol Nutr. 2018;67(2):257-91. doi:10.1097/MPG.0000000000002035. Erratum in: J Pediatr Gastroenterol Nutr. 2020;71(6):794. doi:10.1097/MPG.0000000000002967.
4. Mitropoulou P, Hobson A, Morton G, Anantharam B. ST-elevation myocardial infarction in a young patient with Duchenne's muscular dystrophy: a case report. Eur Heart J Case Rep. 2022;6(5):ytac184. doi:10.1093/ehjcr/ytac184.
5. Feingold B, Mahle WT, Auerbach S, et al. Management of cardiac involvement associated with neuromuscular diseases: a scientific statement from the American Heart Association. Circulation. 2017;136. doi:10.1161/CIR.0000000000000526.
6. Abutaleb ARA, McNally EM, Khan SS, еt al. Myocarditis in Duchenne Muscular Dystrophy After Changing Steroids. JAMA Cardiol. 2018;3(10):1006-10. doi:10.1001/jamacardio.2018.2695.
7. Fayssoil A, Abasse S, Silverston K. Cardiac Involvement Classification and Therapeutic Management in Patients with Duchenne Muscular Dystrophy. J Neuromuscul Dis. 2017;4(1):17-23. doi:10.3233/JND-160194.
8. Горькова Н. Б. Кардиомиопатии при прогрессирующих мышечных дистрофиях. Кардиология ПФО: возможности и перспективы: III съезд кардиологов приволжского федерального округа, Самара: Медфорум, 2010, сс. 141-2. EDN UMYPSF.
9. McNally EM, Kaltman JR, Benson DW, et al.; Working Group of the National Heart, Lung, and Blood Institute; Parent Project Muscular Dystrophy. Contemporary cardiac issues in Duchenne muscular dystrophy. Working Group of the National Heart, Lung, and Blood Institute in collaboration with Parent Project Muscular Dystrophy. Circulation. 2015;5;131(18):1590-8. doi:10.1161/CIRCULATIONAHA.114.015151.
10. D'Amario D, Amodeo A, Adorisio R, et al. A current approach to heart failure in Duchenne muscular dystrophy. Heart. 2017;103(22):1770-9. doi:10.1136/heartjnl-2017-311269.
11. Giannitsis E, Mueller C, Katus HA. Skeletal myopathies as a non-cardiac cause of elevations of cardiac troponin concentrations. Diagnosis (Berl). 2019;6(3):189-201. doi:10.1515/dx-2019-0045.
12. Hor KN, Johnston P, Kinnett K, et al. Progression of Duchenne Cardiomyopathy Presenting with Chest Pain and Troponin Elevation. J Neuromuscul Dis. 2017;4(4):307-14. doi:10.3233/JND-170253.
13. Taqatqa A, Bokowski J, Al-Kubaisi M, et al. The Use of Speckle Tracking Echocardiography for Early Detection of Myocardial Dysfunction in Patients with Duchenne Muscular Dystrophy. Pediatr Cardiol. 2016;37(8):1422-8. doi:10.1007/s00246-016-1451-2.
14. Gulati R, Behfar A, Narula J, et al. Acute Myocardial Infarction in Young Individuals. Mayo Clin Proc. 2020;95(1):136-56. doi:10.1016/j.mayocp.2019.05.001.
15. Al Hajri HS, El Husseiny EM, Qayyum H. Chest Pain and Electrocardiographic Changes in a Child With Duchenne Muscular Dystrophy. Cureus. 2022;14(6):e26105. doi:10.7759/cureus.26105.
16. Duboc D, Meune C, Pierre B, et al. Perindopril preventive treatment on mortality in Duchenne muscular dystrophy: 10 years' follow-up. Am Heart J. 2007;154(3):596-602. doi:10.1016/j.ahj.2007.05.014.
17. Гайнетдинова Д. Д., Новоселова А. А. Современные возможности диагностики и лечения мышечной дистрофии Дюшенна. Казанский медицинский журнал. 2020;101(4):530-7. doi:10.17816/KMJ2020-530.
18. Raman SV, Hor KN, Mazur W, et al. Eplerenone for early cardiomyopathy in Duchenne muscular dystrophy: a randomised, double-blind, placebo-controlled trial. Lancet Neurol. 2015;14(2):153-61. doi:10.1016/S1474-4422(14)70318-7.
19. Черникова В. В. Ранняя диагностика кардиомиопатий у больных с миодистрофией Дюшена. Аспирантские чтения — 2013: Материалы докладов Всероссийской конференции с международным участием "Молодые учёные — медицине", Самара. 2013;(10):52-55. EDN UHDBGH.
Об авторах
З. Г. ТатаринцеваРоссия
Зоя Геннадьевна Татаринцева— к.м.н., зав. отделением кардиологии; ассистент кафедры кардиохирургии и кардиологии факультета повышения квалификации и профессиональной переподготовки специалистов
О. В. Бабичева
Россия
Ольга Васильевна Бабичева — к.м.н., врач-кардиолог; доцент кафедры кардиохирургии и кардиологии
К. О. Барбухатти
Россия
Кирилл Олегович Барбухатти — д.м.н., профессор, кардиохирург, зав. отделением кардиохирургии; зав. кафедрой кардиохирургии и кардиологии ФПК и ППС
Дополнительные файлы
- Сердечно-сосудистые осложнения мышечной дистрофии Дюшенна хорошо известны и проявляются дилатационной кардиомиопатией.
- Иногда могут наблюдаться необычные проявления: инфаркт миокарда с подъемом сегмента ST или острое повреждение миокарда без обструкции коронарных артерий.
- Наблюдение за пациентами с мышечной дистрофией Дюшенна в специализированных клиниках имеет решающее значение для обеспечения раннего выявления сердечно-сосудистых поражений и координации соответствующего лечения.
Рецензия
Для цитирования:
Татаринцева З.Г., Бабичева О.В., Барбухатти К.О. Острый коронарный синдром с подъемом сегмента ST у ребенка с мышечной дистрофией Дюшенна: клинический случай. Российский кардиологический журнал. 2024;29(10S):5763. https://doi.org/10.15829/1560-4071-2024-5763. EDN: JVXBZN
For citation:
Tatarintseva Z.G., Babicheva O.V., Barbuhatti K.O. ST-segment elevation acute coronary syndrome in a child with Duchenne muscular dystrophy: a case report. Russian Journal of Cardiology. 2024;29(10S):5763. (In Russ.) https://doi.org/10.15829/1560-4071-2024-5763. EDN: JVXBZN
JATS XML

















































