Перейти к:
Полиморфизм генов и сывороточные уровни некоторых ангиогенных факторов роста и про- и противовоспалительных цитокинов у пациентов с постинфарктным ремоделированием сердца
https://doi.org/10.15829/1560-4071-2024-5733
EDN: NVVJAF
Аннотация
Цель. Изучить полиморфные варианты генов IL10, FGF2, VEGFD, TRAIL, SELE, TNFA и TNFβ у пациентов с первичным инфарктом миокарда (ИМ) с подъемом сегмента ST (ИМпST) и их связь с поздним постинфарктным ремоделированием сердца.
Материал и методы. В исследование включено 74 пациента 61±10,7 лет и диагнозом первичный ИМпSТ. Все пациенты через 60 (40; 80) мин после поступления в стационар прошли чрескожное коронарное вмешательство с восстановлением кровотока в симптом-зависимой коронарной артерии. На 1, 7 сут. ИМ, через 6 и 12 мес. на системе Multiplex Instrument FLEXMAP 3D (Luminex Corporation) с использованием диагностической панели MILLIPLEX Human Cytokine/Chemokine Panel II измерены сывороточные уровни фактора роста фибробластов (FGF), интерлейкина-10 (IL-10), цитокинов семейства фактора некроза опухоли: TNF-α, TNF-β и лиганда, индуцирующего апоптоз (TRAIL). Позднее ремоделирование левого желудочка (ЛЖ) определяли через 12 мес. по данным 2D-трансторакальной эхокардиографии. Прирост конечно-диастолического объема ЛЖ на 15% и более к 12 мес. считали поздним ремоделированием. Пациенты прогенотипированы по 16 SNP в генах TNFβ, TNF, Il10, TNFRSF1B, VEGFD, TRAIL, FGF2, SELE.
Результаты. Неблагоприятное ремоделирование ЛЖ диагностировано у 19 больных (25,7%). Анализ генных ассоциаций показал статистически значимую связь rs1800629 TNFA (χ2=4,748; p=0,029), rs5353 SELE (χ2=10,85; p=0,004) и rs6632528 VEGFD (χ2=8,127; p=0,017) с увеличением риска развития ИМпST. Выявлена более высокая концентрация IL-10 на 7 сут. ИМ (p=0,05) и через 6 мес. (p=0,028) у носителей генотипа A/T rs3024492 в гене IL10, а также FGF у носителей генотипа T/T rs13122694 в гене FGF2 к 6 мес. после индексного события (p=0,04). Обнаружена зависимость основных показателей ЛЖ от генотипов полиморфизма rs3024492 IL10, rs13122694 FGF2 и rs4830939 VGEFD. В 1 сут. ИМ у гетерозигот по rs3024492 IL10 контрактильная функция ЛЖ была хуже в сравнении с носителями генотипа T/T. Также носители генотипа T/T rs13122694 FGF2 отличались более высокими показателями фракции выброса ЛЖ, продольной глобальной деформации ЛЖ и меньшими значениями конечно-систолического индекса ЛЖ в раннем постинфарктном периоде. В отдаленном постинфарктном периоде носители генотипа T/T rs4830939 VEGFD отличались большей степенью дилатации ЛЖ, чем носители генотипов C/C и C/T.
Заключение. Таким образом, в настоящем исследовании показан вклад полиморфизма генов системы воспаления в формирование предрасположенности к ИМпSТ — как на уровне фенотипа в целом, так и на уровне формирования отдельных признаков.
Для цитирования:
Николаева А.М., Бабушкина Н.П., Рябова Т.Р., Долбня А.Д., Кологривова И.В., Шаврак В.Е., Рябов В.В. Полиморфизм генов и сывороточные уровни некоторых ангиогенных факторов роста и про- и противовоспалительных цитокинов у пациентов с постинфарктным ремоделированием сердца. Российский кардиологический журнал. 2024;29(3):5733. https://doi.org/10.15829/1560-4071-2024-5733. EDN: NVVJAF
For citation:
Nikolaeva A.M., Babushkina N.P., Ryabova T.R., Dolbnya A.D., Kologrivova I.V., Shavrak V.E., Ryabova V.V. Gene polymorphism and serum levels of some angiogenic growth factors and pro- and anti-inflammatory cytokines in patients with post-infarction cardiac remodeling. Russian Journal of Cardiology. 2024;29(3):5733. (In Russ.) https://doi.org/10.15829/1560-4071-2024-5733. EDN: NVVJAF
На сегодняшний день эффективность методов своевременного восстановления кровотока при инфаркте миокарда (ИМ) не вызывает сомнений [1]. Однако, несмотря на проведение всего комплекса мероприятий, направленного на ограничение зоны некроза, часть пациентов подвержена развитию патологического постинфарктного ремоделирования сердца, что, в свою очередь, определяет ухудшение эпидемиологического тренда и увеличение распространенности хронической сердечной недостаточности (СН) в структуре сердечно-сосудистых заболеваний (ССЗ). Общеизвестно, что хроническая СН поддерживает высокую коморбидность населения, ассоциирована с повышенной летальностью и частыми госпитализациями, создавая огромную экономическую нагрузку на систему здравоохранения [2][3].
В классическом понимании процесс ремоделирования левого желудочка (ЛЖ) характеризуется нарушением нормальной архитектоники сердца, прогрессирующей дилатацией камер и снижением глобальной сократительной функции ЛЖ. На протяжении полувека активного изучения проблемы постинфарктного ремоделирования было доказано, что нарушение согласованной работы, дисбаланс про- и противовоспалительных маркеров и персистенция хронического асептического воспаления имеют фундаментальное значение в восстановительной регенерации миокарда [4]. При этом в эксперименте и клинических исследованиях при одинаковом объеме ишемического повреждения миокарда между пациентами продемонстрирована вариабельность характера, выраженности и длительности воспаления, что явилось основанием дальнейшего изучения механизмов, регулирующих синтез белковых молекул, участвующих в воспалении [5].
Последние годы предметом активного изучения являются гены, которые в совокупности с общепризнанными факторами риска ССЗ оказывают влияние на развитие, характер и течение заболевания. В настоящее время хорошо известно, что гены цитокинов отличаются высокой степенью полиморфизма. Полиморфизм в генах цитокинов оказывает влияние на эффективность транскрипции, стабильность и качество мРНК, а также функциональную активность белковых продуктов [6]. В исследованиях последних лет сообщается возможная связь полиморфизма генов с цитокиновой дисрегуляцией при постинфарктной регенерации миокарда и показывается необходимость в проведении клинических исследований для полного раскрытия индивидуальных особенностей иммунного воспаления при ИМ [7].
Так, недавно при исследовании крупной выборки пациентов была обнаружена ассоциация изоформы D сосудисто-эндотелиального фактора (VEGF-D) и полиморфных вариантов его гена с неблагоприятным прогнозом после острого коронарного события [8]. VEGF-D является одним из основных регуляторов лимфоангиогенеза, фиброгенеза и апоптоза. В исследованиях последних лет все чаще подчеркивается роль лимфоангиогенеза в процессе постинфарктного заживления миокарда. Считается, что подавление лимфоангиогенеза при ИМ замедляет элиминацию маркеров воспаления, связано с большей макрофагальной инфильтрацией и способствует затяжному течению воспаления [9].
Ранее в проведенном нами исследовании установлена прогностическая роль интерлейкина-10 (IL-10), фактора роста фибробластов (FGF) и сосудисто-эндотелиального факторов роста (VEGF) в отдаленном постинфарктном периоде у пациентов с ИМ с подъемом сегмента ST (ИМпST) [10]. Таким образом, представляет интерес изучение генетических механизмов, в частности, полиморфизмов генов белков, показавших свое значение в неблагоприятное течение ИМ [11].
Целью исследования является изучение полиморфных вариантов генов IL10, FGF2, VEGFD, TRAIL, SELE, TNFA, TNFβ и TNFRSF1B у пациентов с первичным ИМпST и их значимость в развитии позднего постинфарктного ремоделирования сердца.
Материал и методы
В исследование включено 74 пациента с первичным ИМпST, госпитализированных в ОНК НИИ Кардиологии Томского НИМЦ с 2019 по 2021гг. Диагноз ИМпST устанавливали в соответствии с четвертым универсальным определением ИМ: наличие клиники ишемии миокарда, элевация сегмента ST на электрокардиограмме не менее чем в двух смежных отведениях и повышение уровня высокочувствительного тропонина I >99-го перцентиля верхней границы нормы [12]. У всех пациентов в среднем через 60 (40; 80) мин было выполнено чрескожное коронарное вмешательство с восстановлением антеградного кровотока в симптом-зависимой коронарной артерии. Всем пациентам в соответствии с современными клиническими рекомендациями назначали двойную антитромбоцитарную терапию (100%), статины (100%), блокаторы ренин-ангиотензиновой системы (99%) и бета-блокаторы (96%).
Критерии включения в исследование: первичный ИМпST, возраст старше 18 лет и постоянное проживание на территории Томской области. Более 95% включенных в исследование пациентов — русские.
Критериями невключения были: кардиогенный шок, аутоиммунные, онкологические заболевания, терминальная хроническая болезнь почек, фибрилляции/трепетания предсердий, гемодинамически значимые клапанные пороки сердца и выраженные когнитивные дисфункции.
Протокол исследования отвечал требованиям Хельсинкской декларации и был одобрен локальным этическим комитетом НИИ Кардиологии. Всеми пациентами подписано информированное согласие на участие в исследовании, в т. ч. и на проведение генетического тестирования.
Для проведения генетического исследования всем пациентам на 1 сут. ИМ проводили забор венозной крови из периферической вены. Выделение ДНК из лейкоцитов венозной крови проводилось фенол-хлороформным методом.
В качестве контроля привлечена популяционная выборка русских г. Томска (136 индивидов), сформированная из образцов ДНК "Биобанка населения Северной Евразии" НИИ медицинской генетики Томского НИМЦ.
Молекулярно-генетическое исследование выполнено на базе Центра коллективного пользования научно-исследовательским оборудованием и экспериментальным биологическим материалом "Медицинская геномика" НИИ медицинской генетики Томского НИМЦ РАН. Генотипирование выполнялось с помощью метода полимеразной цепной реакции (ПЦР) в режиме реального времени (real-time PCR) по технологии TaqMan с использованием олигонуклеотидных зондов FAM/HEX — BHQ1 (ООО "ДНК-Синтез", Москва) комплементарных региону, содержащему анализируемый фрагмент, либо методом ПЦР-ПДРФ (табл. 1).
Исследование сывороточных уровней белковых молекул (TNF-α, FGF, IL-10 и ТRAIL) проводили с использованием системы Multiplex Instrument FLEXMAP 3D (Luminex Corporation), диагностической панели MILLIPLEX map Human Cytokine/Chemokine Panel II и программного обеспечения MILLIPLEX Analyst 5.1 (MerckKGaA, Milliplex, Германия) в четырех временных точках: на 1, 7 сут. ИМ, через 6 и 12 мес.
Для оценки структурно-функциональных характеристик миокарда ЛЖ в 1, 7 сут. болезни и через 12 мес. была выполнена трансторакальная двухмерная 2D-допплер-эхокардиография на аппарате GE Vivid E9 c электрокардиографической синхронизацией и использованием матричного датчика с частотой 1,7-4,6 МГц (М5S). Измерение объемных параметров и фракции выброса ЛЖ проводилось модифицированным методом Симпсона.
По приросту конечного-диастолического объема ЛЖ на >15% [13] к 12 мес. постинфарктного периода больные были разделены на две группы: с дезадаптивным ремоделированием ЛЖ (РЛЖ+) и без него (РЛЖ-).
Анализ полученных данных проводили в пакете программ STATISTICA 10.0. Проверку нормальности распределения количественных переменных осуществляли с помощью критерия Колмогорова-Смирнова. Сравнение частот выбранных маркеров между исследуемой и контрольной группой проводилось с помощью критерия χ2 с поправкой Йейтса. Статистическую значимость различий количественных переменных в трех и более независимых группах оценивали с использованием критерия Краскела-Уоллиса. Различия считали статистически значимыми при p<0,05.
Таблица 1
Условия для генотипирования изученных полиморфных вариантов
Ген | SNP | Последовательность праймеров и TaqMan-проб (5'-3') | Температура отжига праймеров, С |
TNFB (LTA) | rs909253* | F: CCGTGCTTCGTGCTTTGGACTA R: AGAGGGGTGGATGCTTGGGTTC | 61 |
TNFA | rs1800629# | F: AGGCAATAGGTTTTGAGGGCCAT R: TCCTCCCTGCTCCGATTCCG | 57 |
Il10 | rs1800872$ | F: GGTCATGGTGACATACCT R: AAAAAGTTGATTTCCTGGGG | 57 |
TNFRSF1B | rs1061622 | F: CCGTGAATGAGCCCAG R: CAGAAGGAGTGAATGAATGAG FAM-AGACTGCATCCATGCTTGC-BHQ1 HEX-AGACTGCATCCCTGCTTGC-BHQ1 | 60 |
VEGFD | rs6632528 | F: GGTGGGGAGAGAGAGATGAA R: GTAGGGACGCAACAGGATTAC FAM-TCTCCAATGTATGCCGCAGGTT-BHQ1 HEX-TCTCCAACGTATGCCGCAGGTT-BHQ1 | 55 |
VEGFD | rs4830939 | F: GCATAGGTACTGGGTTAAGC R: TCCAGTTTTCCAGCTTAGAC FAM-TCATTAGTCTTACCACTTGTGCTTGCA-BHQ1 HEX-TCATTAGTCTTACCACTTGTGTTTGCA-BHQ1 | 57 |
VEGFD | rs2175887 | F: TGTCCAACCCATACACGACAT R: CATTGGGTAAGGGAGCATGA FAM-CTCCTGGGGAGTATAAGATTCCTCA -BHQ1 HEX-CTCCTGGGGAGGATAAGATTCCTCA -BHQ1 | 62 |
IL10 | rs3024492 | F: GCAGATCAGTTCTTTCCCTTG R: GCTCTGGGCTCCTTTTATGA FAM-CTCCTGGAGTCAGATCTCTTGCTCAT-BHQ1 HEX-CTCCTGGTGTCAGATCTCTTGCTCAT-BHQ1 | 50 |
IL10 | rs3024490 | F: AGCTAAGCCAGATGATACAGTAAA R: CCTCATGTCCTGTTCTCTGC FAM-AGAAGTAAAGAAAGGTCTGATTCGAGGT-BHQ1 HEX-AGAAGTAAAGAAATGTCTGATTCGAGGT-BHQ1 | 60 |
TRAIL | rs432821 | F: TCCTAAGTCCACTGCCAGAAA R: TACAACCTCCACCTCCCAGAT FAM-TCTACTAAAAATGCAAAAAAATTAGCTGGGC-BHQ1 HEX-TCTACTAAAAATACAAAAAAATTAGCTGGGC-BHQ1 | 62 |
FGF2 | rs308447 | F: GATTAGACCTCCCACCAACAG R: AGCAAGTCCTCACCACCAGT FAM-TCTCTTTCTGTATTTAGAAGATTAGCTTTGA-BHQ1 HEX-TCTCTTTTTGTATTTAGAAGATTAGCTTTGA-BHQ1 | 60 |
FGF2 | rs308403 | F: CATCCTGTATCCATCTTTCCTTT R: ACTTATTTGAAGTTGTTGCCCA FAM-TTCTTTACTCTTTCCTATTCTGAGGGTCTGA-BHQ1 HEX-TTCTTTACTCTTTTCTATTCTGAGGGTCTGA-BHQ1 | 55 |
FGF2 | rs13122694 | F: TGCGTCAGGAATAAGAACCC R: GCTGGATCAAATGGTGGTTC FAM-AGTTGCCTTGCTGAGAATTAAAAAGAAA-BHQ1 HEX-AGTTGCCTTGCTGAGATTTAAAAAGAAA-BHQ1 | 54 |
SELE | rs3917412 | F: TGTAATTCTGTGTCCCTGCG R: GGCTCATAGGTACACACTGGAA FAM-TCATTTCATTCAAGCGACTTGCTCCAT-BHQ1 HEX-TCATTTCATTCAAGTGACTTGCTCCAT-BHQ1 | 55 |
SELE | rs1534904 | F: TACACTGAAGGCTCTGGGCTC R: AGACCACTCAGCATAGGCAAAG FAM-AACCACTGAGGATTTGAAAGAGCACCAT-BHQ1 HEX-AACCACTGAGGATTTTAAAGAGCACCAT-BHQ1 | 57 |
SELE | rs5353 | F: AAGAAGGAAATCGTGGGTAGC R: TTCCCAAAACGGTAAGTGC FAM-TAAGACTTTCATCATTTAGGTCAAAGAGAAA-BHQ1 HEX-TAAGACTTTCATTATTTAGGTCAAAGAGAAA-BHQ1 | 60 |
Примечание: * — по Stuber F, et al., 1996; # — по Wilson AG, et al., 1992; $ — по Брагина Е. Ю. и др., 2017; для остальных SNP праймеры и пробы подбирались с применением программы Vector NTI.
Результаты
Средний возраст пациентов составил 60,7±10 лет. Количество лиц мужского пола значимо преобладало в группе пациентов с РЛЖ+. Частота встречаемости других традиционных факторов риска ишемической болезни сердца (ИБС) (артериальной гипертензии, сахарного диабета, курения, ожирения) в группах была одинаковой. Клинико-демографическая характеристика пациентов и показатели рутинных лабораторных анализов подробно описаны ранее [14]. Патологическое РЛЖ в отдаленном постинфарктном периоде чаще встречалось у мужчин, было связано с передней локализацией инфаркта и его трансмуральным характером повреждения. Данные рутинных лабораторных анализов свидетельствовали о более выраженном остром миокардиальном повреждении и системной воспалительной реакции в виде значимого повышения тропонина I, натрийуретического пептида, лейкоцитов, С-реактивного белка, печеночных трансаминаз и креатинина в раннем постинфарктном периоде в группе больных с РЛЖ [14].
Распределение частот генотипов в группах соответствовало равновесию Харди-Вайнберга, кроме rs5353 в гене SELE пациентов за счет недостатка гетерозигот.
Для трех изученных SNP (rs1800629 в гене TNF, rs5353 в гене SELE и rs6632528 в гене VEGFD) показаны статистически значимые различия по частотам аллелей/генотипов между исследованными группами (табл. 2 и 3).
Так, по rs1800629 в гене TNF зарегистрированы статистически значимые различия по частотам аллелей (p=0,029). Рисковым является частый аллель G (отношение шансов (ОШ) 2,37; 95% доверительный интервал (ДИ): 1,08-5,43; χ2=4,75; p=0,029), рисковый эффект реализуется через гомозиготный генотип GG (ОШ 2,63; 95% ДИ: 1,10-6,55; χ2=4,92; p=0,026), гетерозиготный генотип является протективным (ОШ 0,37; 95% ДИ: 0,14-0,94; χ2=4,48; p=0,034) (рис. 1).
По rs5353 в гене SELE выявлены статистически значимые различия между частотами генотипов контрольной выборки и группы больных (p=0,004). Генотип СС является рисковым по отношению к ИМ (ОШ 6,93; 95% ДИ: 1,68-32,98; p=0,003 (pf=0,002)), см. рисунок 2.
Поскольку ген VEGFD расположен на Х-хромосоме, анализ проводился для мужчин и женщин отдельно (табл. 3). У женщин по rs6632528 в гене VGEFD обнаружены статистически значимые различия между частотами генотипов контрольной выборки и группы больных (p=0,017). При этом генотип TT обладает протективным действием, по отношению к развитию ИМ (ОШ 0,32, 95% ДИ: 0,10-0,96; χ2=4,18; p=0,041), а генотип CT предрасполагает к развитию ИМ (ОШ 4,23; 95% ДИ: 1,35-13,53; χ2=6,66; p=0,010) (рис. 3). Однако к этим результатам следует относиться с осторожностью, т. к. в исследованной группе только 24 женщины.
Несмотря на то, что подгруппы, дифференцированные по наличию/отсутствию РЛЖ по частотам генотипов в ряде случаев, отличались на 14-18% (рис. 4), статистически значимых различий не зарегистрировано, что может объясняться малым размером выборки РЛЖ+ (19 человек). Выявленные для общей группы пациентов ассоциации с rs5353 в гене SELE и rs1800629 в гене TNF регистрируются и для группы без РЛЖ (рис. 5). Так, показан рисковый эффект генотипа СС для развития ИМ без последующего РЛЖ (ОШ 8,67; 95% ДИ: 2,03-42,45; χ2=11,04; p=0,00089 (pf=0,00084)). Следует отметить, что частота аллеля С в подгруппе РЛЖ+ и контрольной выборке практически не отличаются (21,05% и 20,22%), в то время как в группе РЛЖ- эта величина составляет 30%, патологический эффект аллеля С реализуется только через гомозиготный генотип (частота гетерозиготного генотипа у пациентов ниже, чем в контроле (табл. 4, рис. 4). Соответственно, генотип СС rs5353, с одной стороны, предрасполагает к развитию ИМ, в то же время с другой стороны, способствует более благоприятному течению восстановительного постинфарктного периода.
Определение сывороточных уровней цитокинов IL-10, TRAIL и ангиогенного фактора роста — FGF-2 методом мультиплексного анализа показало, что у всех пациентов медиана исследуемых белков во всех временных точках находились в пределах референсных значений. Тем не менее необходимо отметить, что определены более высокие значения IL-10 на 7 сут. (p=0,009), TRAIL в 1 сут. (p=0,009), на 6 (p=0,04) и 12 мес. (p=0,02) ИМ у пациентов с РЛЖ+ в сравнении с пациентами без него. Статически значимого межгруппового различия в концентрациях VGEF и FGF во всех точках исследования не было выявлено.
Сравнение концентраций биомаркеров в зависимости от распределения генотипов полиморфных вариантов генов показало более высокие уровни IL-10 rs3024492 на 7 сут. ИМ и через 6 мес. у носителей генотипа A/T, а также FGF к 6 мес. ИМ у гомозиготных носителей минорного аллеля T rs13122694 (табл. 5). Значимого различия в значениях TRAIL между исследуемыми генотипами TRAIL rs432821 не обнаружено.
При анализе данных эхокардиографии обнаружена зависимость основных показателей ЛЖ от распределения генотипов полиморфизма rs3024492 IL10, rs13122694 FGF2 и rs4830939 VGEFD. В 1 сут. ИМ у носителей гетерозиготного генотипа A/T rs3024492 IL10 контрактильная функция ЛЖ была хуже в сравнении с носителями генотипа T/T. Подобно этому гомозиготное носительство генотипа T/T rs13122694 FGF2 характеризовалось лучшей сократительной функцией миокарда: более высокими показателями фракции выброса ЛЖ, продольной глобальной деформации ЛЖ и меньшими значениями конечно-систолического индекса ЛЖ в раннем постинфарктном периоде. В отдаленном постинфарктном периоде зависимость структурно-функциональных показателей ЛЖ от генотипов только у полиморфизма rs4830939 VEGFD. Так, пациенты с генотипами T/T отличались большей степенью дилатации ЛЖ, чем носители генотипа C/C и C/T (табл. 6).
Таблица 2
Частоты аллелей и генотипов аутосомных локусов в сравниваемых группах
rs; ген | Генотипы и редкий аллель | Частота генотипа и редкого аллеля в группе больных (%) | Частота генотипа и редкого аллеля в контрольной выборке (%) | χ2; p |
rs1800872 (IL10) | G/G | 58,11 | 67,53 | χ2=2,318; p=0,314 |
G/T | 36,49 | 29,00 | ||
T/T | 5,41 | 3,46 | ||
Аллель T | 23,65 | 17,97 | χ2=1,971; p=0,160 | |
rs3024490 (IL10) | G/G | 64,86 | 61,76 | χ2=0,559; p=0,756 |
G/T | 29,73 | 30,15 | ||
T/T | 5,41 | 8,09 | ||
Аллель T | 20,27 | 23,16 | χ2=0,312; p=0,576 | |
rs3024492 (IL10) | A/A | 56,76 | 52,94 | χ2=0,773; p=0,679 |
A/T | 32,43 | 38,24 | ||
T/T | 10,81 | 8,82 | ||
Аллель T | 27,03 | 27,94 | χ2=0,007; p=0,932 | |
rs432821 (TRAIL) | A/A | 66,22 | 64,71 | χ2=0,262; p=0,877 |
A/G | 24,32 | 23,53 | ||
G/G | 9,46 | 11,76 | ||
Аллель G | 21,62 | 23,53 | χ2=0,104; p=0,747 | |
rs1800629 (TNF) | G/G | 90,54 | 78,47 | χ2=5,708; p=0,058 |
G/A | 8,11 | 19,17 | ||
A/A | 1,35 | 2,36 | ||
Аллель A | 5,41 | 11,95 | χ2=4,748; p=0,029 | |
rs909253 (LTA) | T/T | 60,81 | 55,21 | χ2=0,903; p=0,637 |
T/G | 33,78 | 39,75 | ||
G/G | 5,41 | 5,05 | ||
Аллель G | 22,30 | 24,92 | χ2=0,317; p=0,574 | |
rs1061622 (TNFRSF1B) | T/T | 68,92 | 60,76 | χ2=1,991; p=0,369 |
T/G | 27,03 | 32,27 | ||
G/G | 4,05 | 6,98 | ||
Аллель G | 17,57 | 23,11 | χ2=1,862; p=0,172 | |
rs308447 (FGF2) | C/C | 45,95 | 52,21 | χ2=0,814; p=0,666 |
C/T | 37,84 | 32,35 | ||
T/T | 16,22 | 15,44 | ||
Аллель T | 35,14 | 31,62 | χ2=0,390; p=0,532 | |
rs308403 (FGF2) | C/C | 43,24 | 50,00 | χ2=1,015; p=0,602 |
C/T | 41,89 | 35,29 | ||
T/T | 14,86 | 14,71 | ||
Аллель T | 35,81 | 32,35 | χ2=0,371; p=0,543 | |
rs13122694 (FGF2) | A/A | 50,00 | 59,56 | χ2=2,562; p=0,278 |
A/T | 41,89 | 30,88 | ||
T/T | 8,11 | 9,56 | ||
Аллель T | 29,05 | 25,00 | χ2=0,615; p=0,433 | |
rs3917412 (SELE) | C/C | 55,41 | 58,09 | χ2=0,196; p=0,907 |
C/T | 39,19 | 37,50 | ||
T/T | 5,41 | 4,41 | ||
Аллель T | 25,00 | 23,16 | χ2=0,092; p=0,762 | |
rs1534904 (SELE) | G/G | 45,95 | 50,74 | χ2=1,315; p=0,518 |
G/T | 47,30 | 39,71 | ||
T/T | 6,76 | 9,56 | ||
Аллель T | 30,41 | 29,41 | χ2=0,010; p=0,919 | |
rs5353 (SELE) | T/T | 58,11 | 61,76 | χ2=10,85; p=0,004 |
T/C | 28,38 | 36,03 | ||
C/C | 13,51 | 2,21 | ||
Аллель C | 27,27 | 20,22 | χ2=2,630 p=0,105 |
Примечание: цветом выделены значимые различия.
Таблица 3
Частоты аллелей и генотипов Х-сцепленных локусов в сравниваемых группах
rs; ген | Генотипы и редкий аллель | Частота генотипа и редкого аллеля в группе больных (%) | Частота генотипа и редкого аллеля в контрольной выборке (%) | χ2; p |
rs6632528 (VEGFD) | T/T | 41,67 | 69,09 | χ2=8,127; p=0,017 |
T/C | 54,17 | 21,82 | ||
C/C | 4,17 | 9,09 | ||
Аллель C (f) | 31,25 | 20,00 | χ2=1,773; p=0,183 | |
Аллель C (m) | 22,00 | 27,16 | χ2=0,21; p=0,650 | |
rs4830939 (VEGFD) | C/C | 66,67 | 52,73 | χ2=2,217; p=0,330 |
C/T | 29,17 | 32,73 | ||
T/T | 4,17 | 14,55 | ||
Аллель T (f) | 18,75 | 30,91 | χ2=0,91; p=0,166 | |
Аллель T (m) | 28,00 | 29,63 | χ2=0,40; p=0,999 | |
rs2175887 (VEGFD) | T/T | 33,33 | 18,18 | χ2=3,544; p=0,170 |
T/G | 50,00 | 47,27 | ||
G/G | 16,67 | 34,55 | ||
Аллель G (f) | 41,67 | 58,18 | χ2=3,027; p=0,082 | |
Аллель G (m) | 50,00 | 50,62 | χ2=0,01; p=0,911 |
Примечание: частоты генотипов приведены только для женщин; частоты аллелей — и для женщин (f), и для мужчин (m); цветом выделены значимые различия.

Рис. 1. Частоты генотипов и аллелей rs1800629 TNF.
Сокращение: ИМпST — инфаркт миокарда с подъемом сегмента ST.

Рис. 3. Частоты генотипов и аллелей VGEFD rs6632528.
Сокращение: ИМпST — инфаркт миокарда с подъемом сегмента ST.

Рис. 2. Частоты генотипов и аллелей rs5353 SELE.
Сокращение: ИМпST — инфаркт миокарда с подъемом сегмента ST.

Рис. 4. Частота генотипов и аллелей rs5353 в гене SELE, дифференцированных по наличию патологического РЛЖ в отдаленном постинфарктном периоде (РЛЖ+ и РЛЖ-) по сравнению с контролем.
Сокращение: РЛЖ — ремоделирование левого желудочка.
Таблица 4
Сравнение частот аллелей и генотипов аутосомных локусов между группой пациентов в зависимости от наличия/отсутствия РЛЖ и контрольной группой
rs; ген | Генотипы и редкий аллель | РЛЖ+, % | РЛЖ-, % | χ2; p | ||
РЛЖ+ vs РЛЖ- | РЛЖ+ vs контроль | РЛЖ- vs контроль | ||||
rs1800629 (TNF) | G/G | 84,21 | 92,73 | χ2=3,192; p=0,203 | χ2=1,398; p=0,497 | χ2=6,322; p=0,042 |
G/A | 10,53 | 7,27 | ||||
A/A | 5,26 | 0,00 | ||||
Аллель A | 10,53 | 3,64 | χ2=1,448; p=0,229 | χ2=0,000; p=0,995 | χ2=5,956; p=0,015 | |
rs5353 (SELE) | T/T | 63,16 | 56,36 | χ2=1,492; p=0,474 | χ2=0,702; p=0,704 | χ2=13,580; p=0,001 |
T/C | 31,58 | 27,27 | ||||
C/C | 5,26 | 16,36 | ||||
Аллель C | 21,05 | 30,00 | χ2=0,726; p=0,394 | χ2=0,009; p=0,924 | χ2=3,691; p=0,055 | |
Примечание: цветом выделены значимые различия.
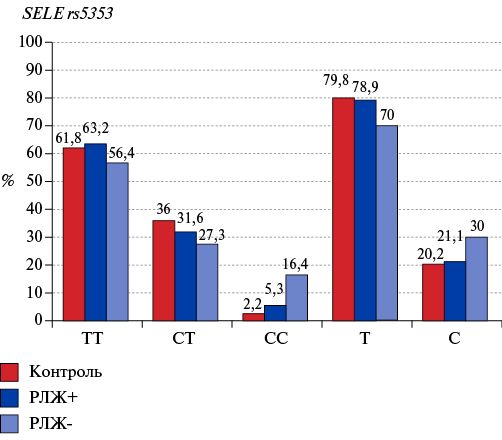
Рис. 5. Частота генотипов и аллелей rs1800629 в гене TNF в группах, дифференцированных по наличию патологического РЛЖ в отдаленном постинфарктном периоде (РЛЖ+ и РЛЖ-) по сравнению с контролем.
Сокращение: РЛЖ — ремоделирование левого желудочка.
Таблица 5
Сывороточные уровни цитокинов и ангиогенных факторов роста в раннем и отдаленном постинфарктном периоде в зависимости от распределения полиморфизмов генов
SNP/белок | Время | Генотипы | p | ||
C/C (N=43) | A/C (N=27) | A/A (N=4) | |||
rs1800872/IL-10, пг/мл | 1 сут. 7 сут. 6 мес. 12 мес. | 2,6 (1,4; 5,4) 2,7 (1,8; 4,1) 2,2 (1,2; 4,6) 3,0 (1,1; 4,2) | 2,3 (0,8; 4,8) 2,6 (0,4; 4,8) 1,7 (0,7; 4,1) 1,8 (0,9; 3,0) | 2,1 (1,2; 2,9) 3,9 (0,5; 4,8) 1,0 (0,6; 1,3) 1,6 (0,3; 3,0) | 0,68 0,70 0,20 0,29 |
rs3024492/IL-10, пг/мл | 1 сут. 7 сут. 6 мес. 12 мес. | А/А (N=38) | А/Т (N=23) | T/T (N=9) | 0,68 0,05 0,028 0,12 |
2,3 (1,3; 5,4) 2,1 (1,02; 3,7) 1,6 (0,7; 3,4) 1,8 (0,9; 3,6) | 2,6 (1,2; 5,4) 3,7 (2,4; 6,5) 3,1 (2,0; 5,8) 3,3 (1,3; 4,3) | 1,3 (1,0; 4,2) 2,9 (1,8; 3,6) 1,4 (1,0; 5,5) 2,4 (1,2; 3,6) | |||
rs432821/TRAIL, пг/мл | 1 сут. 7 сут. 6 мес. 12 мес. | A/A (N=49) | A/G (N=18) | G/G (N=7) | 0,40 0,56 0,27 0,36 |
44,1 (30,1; 71,9) 61,6 (43,3; 94,0) 82,2 (61,3; 124,7) 79,8 (55; 114,3) | 83,6 (28,7; 120,0) 59,7 (45,3; 134,8) 60,1 (36,4; 115,4) 66,5 (56,9; 139,2) | 42,3 (24,9; 71,6) 59,5 (3,2; 67,6) 78,4 (71,1; 248,3) 122,8 (84,9; 161,8) | |||
rs308447/FGF-2, пг/мл | 1 сут. 7 сут. 6 мес. 12 мес. | C/C (N=35) | C/T (N=27) | T/T (N=12) | 0,52 0,81 0,11 0,78 |
13,4 (0,01; 47,6) 18,6 (0,01; 50,7) 21,4 (0,01; 42,4) 27,1 (0,01; 44,9) | 0,01 (0,01; 47,1) 5,3 (0,01; 57,3) 0,01 (0,01; 26,9) 3,4 (0,01; 39,7) | 36,5 (0,01; 66,7) 25 (0,01; 77,5) 60,7 (0,7; 81,6) 0,01 (0,01; 56,7) | |||
rs13122694/FGF-2, пг/мл | 1 сут. 7 сут. 6 мес. 12 мес. | A/A (N=38) | A/T (N=30) | T/T (N=6) | 0,77 0,39 0,04 0,87 |
0,01 (0,01; 49,3) 14,2 (0,01; 43,2) 2,6 (0,01; 41,1) 14,2 (0,01; 42,8) | 31,8 (0,01; 51,6) 5,3 (0,01; 57,7) 1,7 (0,01; 49,8) 3,4 (0,01; 39,7) | 28 (0,01; 66,7) 43,9 (8,2; 77,5) 62 (59,4; 65,6) 34,5 (0,01; 56,7) | |||
Примечание: цветом выделены значимые различия.
Таблица 6
Основные эхокардиографические показатели в зависимости от генотипа
IL10 rs3024492 | 1 сут. ИМ | p | ||
A/A (N=42) | A/T (N=23) | T/T (N=9) | ||
ФВ ЛЖ, % КДИ ЛЖ, мл/м2 КСИ ЛЖ, мл/м2 | 55 (44,6; 62,4) 50,7 (43,1; 57,5) 22,8 (18,3; 28,6) | 50 (45,9; 58,3) 52,8 (47,6; 66,4) 26,2 (20,6; 33,1) | 61,3 (56,8; 69,8) 49,9 (42; 54,2) 19 (13,7; 23,8) | 0,02 0,18 0,02 |
FGF2 rs13122694 | 1 сут. ИМ | |||
A/A (N=38) | A/T (N=30) | T/T (N=6) | 0,06 0,03 0,08 0,02 | |
КДИ ЛЖ, мл/м2 КСИ ЛЖ, мл/м2 ФВ ЛЖ, % GLS, % | 53,3 (47,3; 58,2) 22,8 (19; 29,9) 56,9 (45,9; 61,5) -12,4 (-14,6; -9,2) | 50,9 (45,9; 61,4) 24,5 (21,1; 31,4) 52,4 (45,1; 58,4) -15,5 (-18; -11,6) | 42,7 (38,3; 49) 15,5 (12,2; 20,6) 61,2 (57,3; 72,9) -16 (-18,4; -14,6) | |
FGF2 rs13122694 | 7 сут. ИМ | 0,05 0,04 0,13 | ||
A/A (N=38) | A/T (N=30) | T/T (N=6) | ||
КДИ ЛЖ, мл/м2 КСИ ЛЖ, мл/м2 ФВ ЛЖ, % | 50,5 (42,3; 64,4) 21,4 (17,2; 28,9) 57,9 (51; 63,7) | 52,5 (48,3; 66,6) 23,6 (20,3; 32,5) 53,4 (48,9; 60,8) | 38,8 (36,7; 48,6) 14,6 (11,3; 21,5) 62,5 (55,7; 69,2) | |
VEGFD rs4830939 | 12 мес. ИМ | |||
C/C (N=51) | C/T (N=9) | T/T (N=14) | 0,23 0,021 0,06 | |
ФВ ЛЖ, % КДИ ЛЖ, мл/м2 КСИ ЛЖ, мл/м2 | 57 (49,3; 66,5) 54,1 (43,5; 64,8) 22,1 (15,3; 31,5) | 66 (57,5; 69) 44 (34,5; 46) 15 (10,8; 19,4) | 53 (45,6; 62) 62 (56; 85,2) 27,2 (22,2; 56) | |
Примечание: цветом выделены значимые различия.
Сокращения: ИМ — инфаркт миокарда, КДИ — конечно-диастолический индекс, КСИ — конечно-систолический индекс, ЛЖ — левый желудочек, ФВ — фракция выброса, GLS — глобальная продольная деформация.
Обсуждение
Клинико-лабораторная характеристика проанализированной выборки соответствовала "классическому" портрету пациента с патологическим постинфарктным РЛЖ: преобладание в гендерной структуре лиц мужского пола, переднего Q-образующего ИМ, больший объем повреждения миокарда и более выраженный системный воспалительный ответ. Вклад перечисленных факторов в формировании РЛЖ по дилатационному типу подтверждается ранее проведенными исследованиями [15].
Известно, что хроническая коронарная болезнь относится к заболеваниям, развитие которых имеет многофакторную природу. На сегодняшний день результаты ассоциативных исследований предлагают целый ряд генов-кандидатов, предрасполагающих к развитию ИБС и его клинических форм, включая полиморфные варианты генов цитокинов, факторов адгезии, системы гемостаза, липидного обмена, которые в совокупности со средовыми факторами оказывают влияние на естественное течение заболевания и определяют исход болезни. Одним из потенциальных ключевых факторов, ответственных за вариабельность степени иммунного воспаления между индивидами в популяции при ИМ, является полиморфизм генов факторов воспаления.
В нашем исследовании из всех изученных маркеров ассоциацию с развитием ИМпST показали три маркера — rs1800629 TNFA, rs5353 SELE и rs6632528 VEGFD.
Полиморфный вариант rs1800629 -308G/A TNFA — один из широко изученных генетических маркеров, показавших свое значение в развитии ИМ и СН. Считается, что транзиция гуанина на аденин в положении -308 приводит к усилению экспрессии TNFA, синтезу молекул эндотелиальной адгезии лейкоцитов и фактора активации тромбоцитов, создавая условия для развития атеротромбоза [16][17]. Данные о взаимосвязи минорного аллеля A с риском развития ИМпST противоречивы, как и в случае многих других низкополиморфных маркеров. Так, в исследовании Коненкова В. И. и др., так же как и в настоящем исследовании, показан протективный эффект гетерозиготного генотипа, но в качестве рискового (в отличие от наших результатов) выступает генотип AA [18]. В проведенном нами ранее исследовании выявлена ассоциации сочетания генотипов LTA/TNF с ИБС, рисковое сочетание включало в себя генотип GG гена TNF [19]. В то же время в исследованиях Biswas S, et al. [16] и Zeybek U, et al. [17] гетерозиготный генотип и гомозиготный по редкому аллелю преобладают у пациентов с ИМпST. В отечественной литературе данная взаимосвязь показана на 2012 пациентах регистра Оракул I и II, в котором носительство редкого аллеля A rs1800629 явилось одним из независимых предикторов неблагоприятного исхода после перенесенного острого коронарного события (доля больных с острым коронарным синдромом (ОКС) с подъемом сегмента ST 36,8%) [20]. Несколько иные результаты получены в работе Голышко В. С. и др., в которой носительство генотипа GG было связано с более высокой концентрацией TNF-α, чем у больных с гетерозиготным генотипом G/A и объясняется большей физиологической стабильностью экспрессии гена ввиду наличия мутантного и исходного аллеля в генотипе [21]. Напротив, в работе Зыкова М. В. и др. носительство генотипа АА было ассоциировано с большей экспрессией гена и высокими значениями цитокина, хотя частота носительства аллеля А между исследуемой и контрольной группами не отличалась [22]. Противоречивость данных может объясняться популяционными особенностями распределения частот аллелей, даже незначительные изменения которых для низкополиморфных локусов могут иметь критическое значение.
Процесс адгезии лейкоцитов к клеткам эндотелия и их трансэндотелиальная миграция является одним из первых этапов характерного для атерогенеза местного воспаления. Данный процесс запускается чрезмерной экспрессией на поверхности клеток эндотелия молекул межклеточной адгезии — ICAM-1 и молекул адгезии сосудистых клеток — VCAM-1, P- и E-селектинов. В свою очередь, Е-селектин способствует рекрутированию полиморфно-ядерных лейкоцитов, миелоидных клеток и Т-лимфоцитов в очаг воспаления [23]. Ген Е-селектина расположен на хромосоме 1q22-q25 и состоит из 13 экзонов. Из всех изученных полиморфизмов SELE только единицы показали свою связь с коронарной болезнью сердца и ИМ. Наиболее изученным полиморфизмом SELE в отношении риска ИБС является 128Arg. В частности, с риском развития ИМ были связаны rs5361 (561 A/С) и G98T (rs1805193) [24][25]. Влияние генотипа C/C rs5353 на риск развития ИМ в нашей работе показано впервые.
Семейство VEGF представлено из четырех различных изоформ: VEGF-A, B, C, D, каждая из которых, взаимодействуя с соответствующими рецепторами, реализует свои функции: ангио-лимфопролиферация, фиброгенез и подавление апоптоза. Описано, что при ИМ указанные изоформы отличаются между собой разными пространственно-временными характеристиками. В частности, в первые часы и дни ИМ усилена преимущественно экспрессия VEGFA, затем в последующие дни и в отдаленном периоде — VEGFD, которому отводится функция регуляции лимфоангиогенеза, фиброгенеза и апоптоза [26]. Большинство исследований полиморфизма генов ангиогенных факторов роста направлены на поиск ассоциации с неопластическими заболеваниями.
В последнее время в литературе все чаще обсуждается роль лимфатической системы в постинфарктной восстановительной регенерации миокарда. Описано, что лимфоангиогенез способствует своевременной элиминации избытка медиаторов воспаления и тем самым ослабляет интенсивность воспаления в миокарде. Одним из ключевых регуляторов данного процесса является VEGF-D. К примеру, на мышиной модели подавление лимфопролиферации через блокирование рецепторов VEGFR3 приводило к уменьшению лимфы, усилению воспаления, гипертрофии и периваскулярному фиброзу миокарда, а также формированию неблагоприятного ремоделирования и прогрессированию систолической дисфункции сердца [26][27]. Кроме того, подавление лимфоангиогенеза ассоциировалось с меньшей степенью макрофагальной инфильтрации в ткани миокарда. В 2023г опубликован результат крупного исследования, направленного на выявление связи изоформ VEGF и полиморфизма их генов с исходами после острого коронарного события. Проанализированы пациенты с ОКС из исследований PLATO, а в качестве группы контроля выбраны пациенты из исследования STABILITY [8]. Выявлено, что концентрация VEGF-D в плазме и полиморфизмы VEGFD независимо связаны с худшим исходом у пациентов с ОКС и хроническим коронарным синдромом. В нашем исследовании ассоциации между частотами встречаемости SNP VEGFD и риском развития неблагоприятного ремоделирования не установлено. Тем не менее выявлена взаимосвязь носительства генотипа ТТ VGEF rs4830939 с большей степенью дилатации ЛЖ через 12 мес. после ИМпST.
IL-10 — широко изученный цитокин с противовоспалительной активностью. Ген IL10 локализован в хромосомном сегменте 1q31-32. Полиморфизм rs1800872 относится к наиболее изученным полиморфным вариантам IL10. Сообщается его связь с риском развития ИБС, ИМ, а также в единичных работах описана связь генотипа СС с повышенной концентрацией белка в сыворотке [16]. У носителей генотипа A/C rs3024492 большая дилатация ЛЖ и худшая сократительная функция ЛЖ в первые сутки ИМ несколько противоречат функциональным свойствам данного гена. С другой стороны, полученную закономерность косвенно можно интерпретировать как защитную реакцию в ответ на высокую степень повреждения миокарда и воспаление. Напротив, в случае носительства минорного аллеля T эхокардиографическая картина отличалась более сохранной сократительной функцией ЛЖ, при этом из 9 носителей генотипа T/T в течение одного года вторичная конечная точка в виде повторного ИМ достигнута только у одного пациента. Ранее исследований по выявлению связи интронного полиморфизма rs3024492 с ССЗ не проводилось.
Большинство исследований по частотам распределения полиморфных вариантов FGF2, как и у большинства ангиогенных факторов роста, посвящены неопластическим заболеваниями. Ген FGF2 находится в локусе 4q25-q27. Исследований по выявлению взаимосвязи полиморфных вариантов генов с постинфарктным РЛЖ не найдено. В нашем исследовании выявлена зависимость сывороточного уровня FGF-2 на 6 мес. после ИМ от генотипов rs13122694 в гене FGF2 генотипа T/T rs13122694 с уровнем FGF-2 в крови на 6 мес. ИМ. Более высокие концентрации FGF-2 и более высокие показатели сократительной функции ЛЖ в первые сутки ИМ могут свидетельствовать о протективном действии генотипа T/T.
TRAIL — лиганд, идуцирующий апоптоз. По последним данным на мышиной модели также показано как его прямое повреждающее действие на кардиомиоциты, так и опосредованное, через активацию рекрутирования лейкоцитов, миграции макрофагов, экспрессии и секреции провоспалительных цитокинов при реперфузионно-ишемическом повреждении миокарда и усиление интенсивности асептического воспаления в инфарцированном участке миокарда. Ранее проведенные работы продемонстрировали связь данного маркера с СН и частотой неблагоприятных исходов после ИМ [28]. В нашем исследовании у пациентов с РЛЖ обнаружены были высокие концентрации TRAIL. Связи с уровнями белков и эхокардиографических параметров в зависимости от распределения генотипов не найдено. Ранее связь полиморфизма TRAIL с ССЗ не исследовалось. В основном работы посвящены изучению связи полиморфных вариантов TRAIL с онкологическими и аутоиммунными заболеваниями.
В настоящем исследовании выявлены ассоциации полиморфизма генов TNF, SELE, VEGFD с ИМпST. Кроме того, зарегистрировано влияние изученных SNP в генах IL10 и FGF2 на уровень соответствующих белковых продуктов этих генов. Помимо этого, выявлены ассоциации полиморфизма генов Il10, FGF2, VEGFD с основными эхокардиографическими параметрами.
Ограничения исследования. Настоящее исследование является "пилотным", в которое включено 74 пациента. Для получения более убедительных данных требуется проведение анализа на выборке большего размера.
Заключение
Таким образом, у больных с первичным ИМпST, проживающих на территории Томской области, показан вклад полиморфизма генов системы воспаления в формирование предрасположенности к ИМпST — как на уровне фенотипа в целом, так и на уровне формирования отдельных признаков.
Отношения и деятельность: все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье.
Список литературы
1. Frantz S, Hundertmark MJ, Schulz-Menger J, et al. Left ventricular remodelling post-myocardial infarction: pathophysiology, imaging, and novel therapies. Eur Heart J. 2022;43(27):2549-61. doi:10.1093/eurheartj/ehac223.
2. Dutka M, Bobiński R, Korbecki J. The relevance of microRNA in post-infarction left ventricular remodelling and heart failure. Heart Fail Rev. 2019;24(4):575-86. doi:10.1007/s10741-019-09770-9.
3. Jenča D, Melenovský V, Stehlik J, et al. Heart failure after myocardial infarction: incidence and predictors. ESC Heart Fail. 2021;8(1):222-37. doi:10.1002/ehf2.13144.
4. Prabhu SD, Frangogiannis NG. The Biological Basis for Cardiac Repair After Myocardial Infarction: From Inflammation to Fibrosis. Circ Res. 2016;119(1):91-112. doi:10.1161/CIRCRESAHA.116.303577
5. Westman PC, Lipinski MJ, Luger D, et al. Inflammation as a Driver of Adverse Left Ventricular Remodeling After Acute Myocardial Infarction. J Am Coll Cardiol. 2016;67(17):2050-60. doi:10.1016/j.jacc.2016.01.073.
6. Khazim K, Azulay EE, Kristal B, Cohen I. Interleukin 1 gene polymorphism and susceptibility to disease. Immunol Rev. 2018;281(1):40-56. doi:10.1111/imr.12620.
7. Yalta K, Yilmaz MB, Yalta T, et al. Late Versus Early Myocardial Remodeling After Acute Myocardial Infarction: A Comparative Review on Mechanistic Insights and Clinical Implications. J Cardiovasc Pharmacol Ther. 2020;25(1):15-26. doi:10.1177/1074248419869618.
8. Davidsson P, Eketjäll S, Eriksson N, et al. VEGF-D plasma levels and VEGFD genetic variants are independently associated with outcomes in patients with cardiovascular disease. Cardiovasc Res. 2023;119(7):1596-605. doi:10.1093/cvr/cvad039.
9. Heron C, Dumesnil A, Houssari M, et al. Regulation and impact of cardiac lymphangiogenesis in pressure-overload-induced heart failure. Cardiovasc Res. 2023;119(2):492-505. doi:10.1093/cvr/cvac086.
10. Ryabov VV, Kirgizova MA, Suslova TE, et al. Relationships of growth factors, proinflammatory cytokines, and anti-inflammatory cytokines with long-term clinical results of autologous bone marrow mononuclear cell transplantation in STEMI. PLoS One. 2017;12(5):e0176900. doi:10.1371/journal.pone.0176900.
11. Николаева А. М., Бабушкина Н. П., Рябов В. В. Некоторые про- и противовоспалительные цитокины, полиморфные варианты их генов и постинфарктное ремоделирование сердца. Российский кардиологический журнал. 2020;25(10):4007. doi:10.15829/1560-4071-2020-4007.
12. Thygesen K, Alpert JS, Jaffe AS, et al. Fourth universal definition of myocardial infarction (2018). 2018;72(18):2231-64. doi:10.1016/j.jacc.2018.08.1038.
13. Reindl M, Reinstadler SJ, Tiller C, et al. Prognosis-based definition of left ventricular remodeling after ST-elevation myocardial infarction. Eur. Radiol. 2019;29(5):2330-9. doi:10.1007/s00330-018-5875-3.
14. Николаева А. М., Кологривова И. В., Рябова Т. Р. и др. Сывороточные уровни GM-CSF, CCL11, CCL22 и TRAIL у больных первичным инфарктом миокарда с подъемом сегмента ST и постинфарктное ремоделирование сердца. Сибирский журнал клинической и экспериментальной медицины. 2023;38(2):104-13. doi:10.29001/2073-8552-2023-38-2-104-113.
15. Berezin AE, Berezin AE. Adverse Cardiac Remodelling after Acute Myocardial Infarction: Old and New Biomarkers. Disease Markers. 2020;2020:1215802. doi:10.1155/2020/1215802.
16. Biswas S, Ghoshal PK, Mandal N. Synergistic effect of anti and pro-inflammatory cytokine genes and their promoter polymorphism with ST-elevation of myocardial infarction. Gene. 2014;544:145-51. doi:10.1016/j.gene.2014.04.065.
17. Zeybek U, Toptas B, Karaali ZE, et al. Effect of TNF-α and IL-1β genetics variants om the development of myocardial infarction in Turkish population. Molecular Biology Reports. 2011;38:5453-7. doi:10.1007/s11033-011-0701-x.
18. Коненков В. И., Шевченко А. В., Прокофьев В. Ф., Воевода М. И. Полиморфизм генов белков — регуляторов воспаления при атеросклерозе, осложненном развитием острого инфаркта миокарда. Атеросклероз. 2011;7(1):5-18.
19. Бабушкина Н. П., Кучер А. Н., Буйкин С. В. и др. Ассоциации полиморфных вариантов генов ядерного и митохондриального геномов с ишемической болезнью сердца. Медицинская генетика. 2014;5:36-46.
20. Бражник В. А., Минушкина Л. О., Аверкова А. О. и др. Полиморфизм гена TNF с острым коронарным синдромом: данные регистров Оракул I и II. Российский кардиологический журнал. 2018;(10):22-7. doi:10.15829/1560-4071-2018-10-22-27.
21. Голышко В. С., Снежицкий В. А., Ершова М. В., Кузнецов О. Е. Влияние полиморфизма генов TNF (G308A) и IL-10 (G-1082A) при инфаркте миокарда на экспрессию про- и противовоспалительных цитокинов. Журнал Гродненского государственного медицинского университета. 2012;(3):55-8.
22. Зыков М. В., Макеева О. А., Голубенко М. В. и др. Исследование полиморфизма rs1800629 (G-308A) гена TNF у больных с инфарктом миокарда с подъемом сегмента ST. Российский кардиологический журнал. 2014;(10):13-8. doi:10.15829/1560-4071-2014-10-13-18.
23. Wu Zh, Lou Yu, Lu L, et al. Heterogeneous Effect of Two Selectin Gene Polymorphisms on Coronary Artery Disease Risk: A Meta-Analysis. PLoS One. 2014;9(2):e88152. doi:10.1371/journal.pone.0088152.
24. Gorący J, Kaczmarczyk M, Ciechanowicz A, et al. E-selectin gene haplotypes are associated with the risk of myocardial infarction. Arch Med Sci. 2019;15(5):1223-31. doi:10.5114/aoms.2019.84413.
25. Yoshida M, Takano Y, Sasaoka T, et al. E-selectin polymorphism associated with myocardial infarction causes enhanced leukocyte-endothelial interactions under flow conditions. Arterioscler Thromb Vasc Biol. 2003;23(5):783-8. doi:10.1161/01.ATV.0000067427.40133.59.
26. Zhao T, Zhao W, Chen Y, et al. Differential expression of vascular endothelial growth factor isoforms and receptor subtypes in the infarcted heart. Int J Cardiol. 2013;167(6):2638-45. doi:10.1016/j.ijcard.2012.06.127.
27. Pajula J, Lähteenvuo J, Lähteenvuo M, et al. Adenoviral VEGF-DΔN ΔC gene therapy for myocardial ischemia. Front Bioeng Biotechnol. 2022;10:999226. doi:10.3389/fbioe.2022.999226.
28. Kakareko K, Rydzewska-Rosołowska A, Zbroch E, Hryszko T. TRAIL and Cardiovascular Disease — A Risk Factor or Risk Marker: A Systematic Review. J Clin Med. 2021;10(6):1252. doi:10.3390/jcm10061252.
Об авторах
А. М. НиколаеваРоссия
Антонина Михайловна Николаева — аспирант отделения неотложной кардиологии.
Томск
Конфликт интересов:
нет
Н. П. Бабушкина
Россия
Надежда Петровна Бабушкина — к. б. н., н. с. лаборатории популяционной генетики.
Томск
Конфликт интересов:
нет
Т. Р. Рябова
Россия
Тамара Ростиславовна Рябова — к. м. н., с. н. с. лаборатории ультразвуковой и функциональной диагностики.
Томск
Конфликт интересов:
нет
А. Д. Долбня
Россия
Андрей Дмитриевич Долбня — студент 6 курса.
Томск
Конфликт интересов:
нет
И. В. Кологривова
Россия
Ирина Вячеславовна Кологривова — к. м. н., н. с. отделения функциональной и лабораторной диагностики.
Томск
Конфликт интересов:
нет
В. Е. Шаврак
Россия
Валентина Евгеньевна Шаврак — студент 2 курса.
Томск
Конфликт интересов:
нет
В. В. Рябов
Россия
Вячеслав Валерьевич Рябов — д. м. н., руководитель отделения неотложной кардиологии, в. н. с..
Томск
Конфликт интересов:
нет
Дополнительные файлы
- В развитии инфаркта миокарда (ИМ) с подъемом сегмента ST помимо традиционных факторов риска ишемической болезни сердца показан вклад полиморфизма генов воспаления.
- Носительство редкого аллеля T rs3024492 IL10 и rs13122694 FGF2 было связано с более высокой экспрессией гена в отделанном постинфарктном периоде.
- При гомозиготном наследовании редкого аллеля T rs4830939 VGEFD показана большая степень дилатации левого желудочка в отдаленном пост-ИМ периоде.
Рецензия
Для цитирования:
Николаева А.М., Бабушкина Н.П., Рябова Т.Р., Долбня А.Д., Кологривова И.В., Шаврак В.Е., Рябов В.В. Полиморфизм генов и сывороточные уровни некоторых ангиогенных факторов роста и про- и противовоспалительных цитокинов у пациентов с постинфарктным ремоделированием сердца. Российский кардиологический журнал. 2024;29(3):5733. https://doi.org/10.15829/1560-4071-2024-5733. EDN: NVVJAF
For citation:
Nikolaeva A.M., Babushkina N.P., Ryabova T.R., Dolbnya A.D., Kologrivova I.V., Shavrak V.E., Ryabova V.V. Gene polymorphism and serum levels of some angiogenic growth factors and pro- and anti-inflammatory cytokines in patients with post-infarction cardiac remodeling. Russian Journal of Cardiology. 2024;29(3):5733. (In Russ.) https://doi.org/10.15829/1560-4071-2024-5733. EDN: NVVJAF
JATS XML

















































