Перейти к:
Кластеры пациентов с острым коронарным синдромом без подъема сегмента ST по результатам анализа лабораторных маркеров
https://doi.org/10.15829/1560-4071-2024-5708
EDN: JKHCPA
Аннотация
Цель. Выявить кластеры пациентов с острым коронарным синдромом (ОКС) без подъема сегмента ST (ОКСбпST) по результатам анализа лабораторных маркеров, в т. ч. по оценке функциональной активности тромбоцитов (ФАТ).
Материал и методы. В исследование включено 109 пациентов, госпитализированных в кардиологическое отделение c ОКСбпST. Всем пациентам выполняли стандартное обследование, в т. ч. клинический анализ крови, и определяли ФАТ методом импедансной агрегатометрии с различными индукторами (аденозиндифосфат в концентрации 5 и 10 мкмоль/л, коллаген 2 мкмоль/л) и оценивали методом проточной цитометрии уровень экспрессии Р-селектина. Наблюдение за пациентами проводили в течение 6 мес. На основании полученных данных выполняли кластеризацию методом К-средних.
Результаты. В течение 6 мес. наблюдения у пациентов было зарегистрировано 18 неблагоприятных исходов (инфаркт миокарда, нестабильная стенокардия). В результате кластерного анализа было выявлено 3 кластера: первый кластер включал 39 (36%) пациентов с более высокими значениями моноцитов и более низким уровнем гемоглобина, что, вероятно, свидетельствует о хроническом воспалении и тенденции к анемии. Второй кластер включал 13 пациентов (12%) более старшего возраста с высокой коморбидностью и характеризовался высокими показателями ФАТ. Как в первом, так и во втором кластерах зарегистрировано по 23% неблагоприятных исходов. В третьем кластере преобладали более молодые пациенты с небольшим количеством сопутствующей патологии, течение ОКС было благоприятным (отсутствовали признаки гиперагрегации тромбоцитов, хронического воспаления и анемии). Данный кластер включал более половины (n=57, 52%) всех пациентов; неблагоприятные исходы в течение 6 мес. развивались в 2 раза реже, чем в других кластерах (11% vs 23%).
Заключение. Среди пациентов с ОКСбпST выявлены группы, различающиеся по лабораторным показателям, на основании которых методом к-средних сформированы кластеры. Кластеры с высокими показателями ФАТ, количества моноцитов и низкими значениями гемоглобина включали пациентов более старшего возраста с выраженной коморбидностью и в них выявлена тенденция к более частым неблагоприятным исходам заболевания.
Ключевые слова
Для цитирования:
Недбаева Д.Н., Михалева В.С., Золотова Е.А., Сироткина О.В., Кухарчик Г.А. Кластеры пациентов с острым коронарным синдромом без подъема сегмента ST по результатам анализа лабораторных маркеров. Российский кардиологический журнал. 2024;29(7):5708. https://doi.org/10.15829/1560-4071-2024-5708. EDN: JKHCPA
For citation:
Nedbaeva D.N., Mikhaleva V.S., Zolotova E.A., Sirotkina O.V., Kukharchik G.A. Clusters of patients with non-ST-segment elevation acute coronary syndrome depending on the laboratory data. Russian Journal of Cardiology. 2024;29(7):5708. (In Russ.) https://doi.org/10.15829/1560-4071-2024-5708. EDN: JKHCPA
Пациенты с острым коронарным синдромом (ОКС) без подъема сегмента ST (ОКСбпST) представляют гетерогенную по клиническому течению группу, прогноз в которой во многом определяется состоянием системы гемостаза. Для оценки тромбоцитарного гемостаза используются как количественные показатели, так и функциональная активность тромбоцитов (ФАТ), а также генетическое тестирование. Это позволяет выявить пациентов высокого риска, оценить эффективность проводимой антитромботической терапии, выявить резистентность к терапии и определить показания к ее эскалации или деэскалации [1].
Помимо тромбообразования, тромбоциты играют важную роль в различных процессах. В частности, тромбоциты участвуют в атерогенезе путем выделения медиаторов воспаления, высвобождения микровезикул и взаимодействия с окисленными липопротеинами низкой плотности (ЛНП). Благодаря наличию большого количества иммунных рецепторов, молекул адгезии и медиаторов, тромбоциты участвуют в воспалительных и иммунных реакциях. В различных исследованиях было показано их взаимодействие с эндотелием сосудов, лейкоцитами (преимущественно моноцитами, но также нейтрофилами, Т-лимфоцитами, дендритными клетками), гладкомышечными клетками сосудов, ЛНП, с высвобождением медиаторов воспаления, влияющих на ряд биологических функций клеток-мишеней (секрецию, адгезию, миграцию, протеолиз и коагуляцию). Таким образом, тромбоциты являются связующим звеном между атеросклерозом, тромбозом и воспалением [2-5]. В то же время показатели воспаления, наряду с другими параметрами клинического анализа крови, имеют независимую прогностическую ценность. Описана взаимосвязь количества лейкоцитов, ширины распределения эритроцитов, среднего объема тромбоцитов с неблагоприятными исходами у пациентов с ишемической болезнью сердца. Была показана также прогностическая значимость различных гематологических индексов, в т. ч. ассоциированных с воспалением и дислипидемией [4]. Это особенно важно при ОКСбпST, с учетом гетерогенности клинических проявлений данного состояния, при котором прогноз зависит от различных факторов.
Цель: выявить кластеры пациентов с ОКСбпST по результатам анализа лабораторных маркеров, в т. ч. по результатам оценки ФАТ.
Материал и методы
В исследование включено 109 пациентов, госпитализированных в кардиологическое отделение c диагнозом ОКСбпST. Дизайн исследования — проспективное когортное одноцентровое. Критерии включения: диагноз ОКСбпST при поступлении. Критерии исключения: не подтвержденный ОКС, терминальная стадия соматического заболевания. Тактика ведения больных соответствовала действующим клиническим рекомендациям. Исследование было выполнено в соответствии со стандартами надлежащей клинической практики (Good Clinical Practice) и принципами Хельсинкской декларации. Протокол исследования был одобрен локальным этическим комитетом. До включения в исследование у всех участников было получено письменное информированное согласие.
Стандартные гематологические исследования выполняли на анализаторе 5-diff (Mindrey BC-6200, производства компании Mindrey, КНР). Показатели липидного обмена и уровень креатинина определяли на биохимическом анализаторе Abbott Architect 8000 (производства компании Abbott, США). Определение ФАТ проводили методом импедансной агрегатометрии (CHRONO-LOG 590, импедансный, четырехканальный, производства CHRONO-LOG Corporation, США) на 3-4 сут. госпитализации, оценивали следующие показатели: максимальная амплитуда кривой агрегации, Ом; скорость агрегации, Ом/мин; время задержки, сек; площадь под кривой. В качестве индукторов агрегации были выбраны аденозиндифосфат (АДФ) в концентрации 5 и 10 мкмоль/мл и коллаген (2 мкг/мл). Экспрессию Р-селектина (CD62P) на поверхности тромбоцитов оценивали на проточном цитометре BD FACSCalibur (производства компании BD Biosciences, США) как процент клеток позитивно-меченых CD62P-PE до и после индукции 20 мкмоль/л АДФ. Рассчитывали ΔР-селектина, показывающую прирост увеличения количества клеток, экспрессирующих Р-селектин, после добавления АДФ.
Наблюдение за пациентами проводили в течение 6 мес. с регистрацией комбинированной конечной точки — инфаркт миокарда, нестабильная стенокардия, кардиальная смерть.
Статистический анализ. Статистический анализ данных проводили с использованием статистического пакета программ Statistica, версия 13.0 (TIBCO Software Inc.). Для количественных показателей проверку вида распределения проводили с помощью критерия Колмогорова-Смирнова. Данные представлены в виде среднего и стандартного отклонения (M±SD) при нормальном распределении или медианы и межквартильного размаха — Me (Q1; Q3) в случае распределения, отличного от нормального. Для сравнения непрерывных переменных использовали критерий Краскела-Уоллиса и критерий Манна-Уитни. При множественных сравнениях групп применяли поправку Бонферрони. Сравнение качественных переменных проводили с помощью критерия χ2. Статистическая значимость признаков и проверка гипотез подтверждалась значением p<0,05.
Кластерный анализ выполняли методом К-средних (мера расстояния — Евклидово расстояние). Для выполнения кластерного анализа была проведена оценка структуры данных. Проанализированы показатели клинического и биохимического анализов крови (общее число показателей составило 37), а также ФАТ методом импедансной агрегатометрии (индукторы агрегации АДФ в концентрации 5 и 10 мкмоль/мл и коллаген 2 мкг/мл) и экспрессия Р-селектина методом проточной цитометрии. Для дальнейшего включения в кластеры были выбраны факторы с учетом наибольших показателей коэффициента внутригрупповой вариации и предполагаемой клинической значимости, а также при условии отсутствия значимой корреляции между показателями, включенными в анализ. В кластерный анализ были включены следующие параметры: гемоглобин, моноциты, ФАТ (методом импедансной агрегатометрии с индуктором АДФ, концентрация 10 мкмоль/л, показатель максимальная амплитуда) и экспрессия Р-селектина методом проточной цитометрии. Распределение данных показателей представлено на рисунке 1.

Рис. 1. Нормированные значения лабораторных показателей, включенных в кластерный анализ.
Примечание: * — импедансная агрегатометрия с индуктором АДФ 10 мкмоль/л, амплитуда, ** — экспрессия рецепторов Р-селектина при индукции АДФ, %.
Сокращения: АДФ — аденозиндифосфат, ФАТ — функциональная активность тромбоцитов.
Результаты
Значительная часть пациентов имела коморбидную патологию: в большинстве случаев — 1 и 2 сопутствующих заболевания (по 27% пациентов), 3 заболевания — в 20% случаев, несколько реже — 4 и 5 заболеваний (12% и 8%, соответственно). Клиническая характеристика пациентов представлена в таблице 1.
В течение 6 мес. наблюдения зарегистрировано 18 неблагоприятных исходов. Из них 6 — за время госпитализации (инфаркт миокарда 4А типа), 12 — сердечно-сосудистые события в течение 6 мес. наблюдения (4 — инфаркт миокарда, 8 — нестабильная стенокардия). Случаев кардиальной смерти, в т. ч. внезапной, среди пациентов, включенных в исследование, зарегистрировано не было.
В результате кластерного анализа было получено 3 кластера (рис. 2, 3), каждый из которых включал различное количество пациентов, в зависимости от показателей лабораторных маркеров. В структуре кластеров выделены следующие особенности: для первого кластера характерны более низкие значения гемоглобина, ФАТ и высокие значения моноцитов, что может отражать склонность к анемии и хроническому воспалению. Особенностями второго кластера были высокие показатели ФАТ (как с использованием метода импедансной агрегатометрии, так и при определении экспрессии Р-селектина), что может свидетельствовать о более высоких тромботических рисках в данной группе. Третий кластер, напротив, имел благоприятные для прогноза показатели: более высокие значения гемоглобина и низкие — активности тромбоцитов и количества моноцитов. Подробная клиническая характеристика пациентов и показатели ФАТ в зависимости от кластера представлены в таблицах 2 и 3. Необходимо отметить, что количество тромбоцитов во всех кластерах было в пределах референсных значений и не различалось между кластерами, однако были выявлены значимые различия по большинству показателей ФАТ с выраженным повышением во втором кластере.
Характеристики кластеров представлены на рисунке 4.
Первый кластер включал 39 (36%) пациентов с более высоким содержанием моноцитов и более низким уровнем гемоглобина, что, вероятно, свидетельствует о хроническом воспалении и тенденции к анемии. Второй кластер включал наименьшее количество пациентов (n=13, 12%), которые были старше по возрасту и имели высокую коморбидность, а также характеризовался высокими показателями ФАТ. Как в первом, так и во втором кластерах зарегистрировано по 23% неблагоприятных исходов. В третьем кластере, напротив, преобладали более молодые пациенты с небольшим количеством сопутствующей патологии, течение ОКС было более благоприятным (отсутствовали признаки гиперагрегации тромбоцитов, хронического воспаления и анемии). Кластер включал более половины (n=57, 52%) всех пациентов; неблагоприятные исходы в течение 6 мес. у таких пациентов развивались в 2 раза реже, чем в других кластерах (11% vs 23%).
Таблица 1
Клиническая характеристика пациентов
Показатель | Значение |
Возраст, M±SD, лет | 65±10 |
Мужчины, n (%) | 70 (64%) |
Женщины, n (%) | 39 (36%) |
Инфаркт миокарда, n (%) | 22 (20%) |
Нестабильная стенокардия, n (%) | 87 (80%) |
Гипертоническая болезнь, n (%) | 104 (95%) |
Сахарный диабет 2 типа, n (%) | 25 (23%) |
Ожирение, n (%) | 21 (19%) |
Мультифокальный атеросклероз, n (%) | 20 (18%) |
Курение, n (%) | 29 (27%) |
Гемоглобин, Me (Q1;Q3), г/л | 137 (127;147) |
Эритроциты, Me (Q1;Q3), 10*12/л | 4,5 (4,2;4,8) |
Тромбоциты, Me (Q1;Q3), 10*9/л | 218 (186;249) |
Лейкоциты, Me (Q1;Q3), 10*9/л | 7,7 (6,3;9,2) |
Нейтрофилы, Me (Q1;Q3), 10*9/л | 4,3 (3,5;5,8) |
Лимфоциты, Me (Q1;Q3), 10*9/л | 1,9 (1,4;2,5) |
Моноциты, Me (Q1;Q3), 10*9/л | 0,56 (0,43;0,71) |
Креатинин, Me (Q1;Q3), мкмоль/л | 83 (74;98) |
ЛНП, Me (Q1;Q3), ммоль/л | 2,4 (1,7;3,4) |
Сокращение: ЛНП — липопротеины низкой плотности.
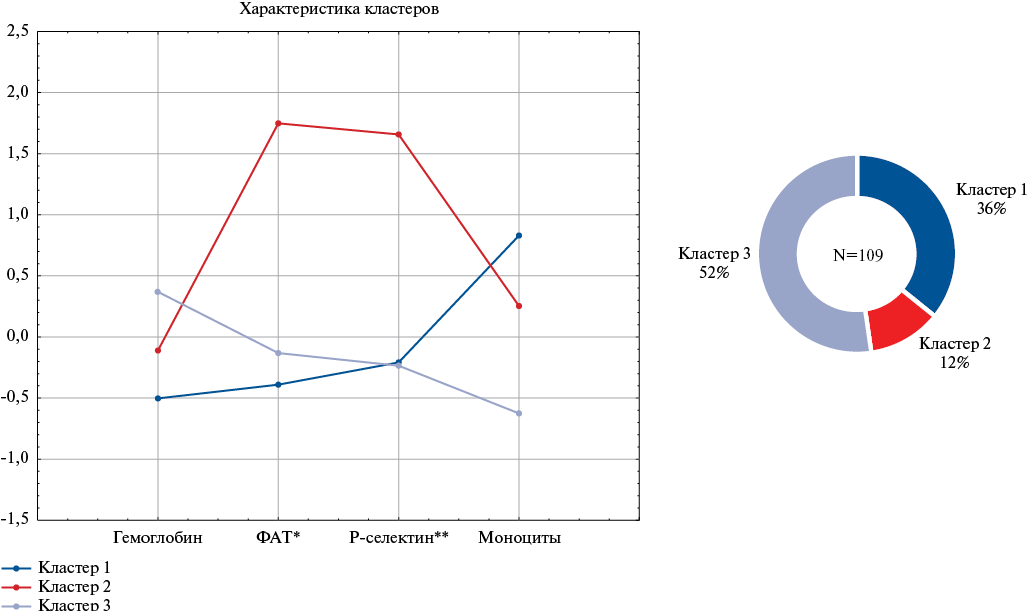
Рис. 2. Распределение пациентов по кластерам.
Примечание: * — импедансная агрегатометрия с индуктором АДФ 10 мкмоль/л, амплитуда, ** — экспрессия рецепторов Р-селектина при индукции АДФ, %.
Сокращения: АДФ — аденозиндифосфат, ФАТ — функциональная активность тромбоцитов.

Рис. 3. Значения лабораторных показателей у пациентов различных кластеров.
Примечание: * — импедансная агрегатометрия с индуктором АДФ 10 мкмоль/л, амплитуда, ** — экспрессия рецепторов Р-селектина при индукции АДФ, %.
Сокращения: АДФ — аденозиндифосфат, ФАТ — функциональная активность тромбоцитов.
Таблица 2
Клинико-лабораторные показатели у пациентов различных кластеров
Показатель | Кластер 1 (n=39), M±SD/Me (Q1;Q3) | Кластер 2 (n=13), M±SD/Me (Q1;Q3) | Кластер 3 (n=57), M±SD/Me (Q1; Q3) | Р |
Средний возраст, лет | 67±11 | 69±6 | 62±11 | 0,012 |
Мужчины, n (%) | 21 (54%) | 10 (77%) | 39 (68%) | — |
ИБС в анамнезе, n (%) | 29 (74%) | 12 (92%) | 37 (65%) | — |
МФА, n (%) | 8 (21%) | 3 (23%) | 9 (16%) | — |
СД 2 типа, n (%) | 9 (23%) | 3 (23%) | 13 (23%) | — |
Курение, n (%) | 17 (44%) | 8 (62%) | 30 (52%) | — |
Гемоглобин, г/л | 128±17 | 135±15 | 142±12 | 0,0001 |
Эритроциты, 10*12/л | 4,3±0,5 | 4,6±0,6 | 4,7±0,6 | 0,002 |
Тромбоциты, 10*9/л | 203 (143;249) | 213 (191;242) | 219 (190;250) | — |
Лейкоциты, 10*9/л | 6,5 (5,3;7,5) | 7,4 (5,8;8,7) | 7,9 (6,3;9,7) | 0,002 |
Нейтрофилы, 10*9/л | 3,6 (2,9;4,3) | 4,2 (3,3;4,9) | 4,8 (3,9;6,3) | — |
Лимфоциты, 10*9/л | 1,8 (1,2;2,4) | 3,3 (1,5;2,6) | 2,1 (1,5;2,6) | — |
Моноциты, 10*9/л | 0,64 (0,51;0,76) | 0,63 (0,49;0,73) | 0,51 (0,41;0,66) | 0,02 |
Креатинин, мкмоль/л | 81 (69;96) | 80 (74;117) | 84 (75;102) | — |
ЛНП, ммоль/л | 2,2 (1,7;3,2) | 2,9 (2,1;3,6) | 2,6 (1,7;3,4) | — |
Сокращения: ИБС — ишемическая болезнь сердца, ЛНП — липопротеины низкой плотности, МФА — мультифокальный атеросклероз, СД — сахарный диабет.
Таблица 3
ФАТ у пациентов различных кластеров
Показатель | Кластер 1 (n=39), Me (Q1;Q3) | Кластер 2 (n=13), Me (Q1;Q3) | Кластер 3 (n=57), Me (Q1;Q3) | Р |
Импедансная агрегатометрия с АДФ, 10 мкмоль/мл | ||||
Амплитуда, Ом | 0 (0;1) | 6 (4;10) | 1 (0;2) | 0,0001 |
Скорость реакции Ом/мин | 2 (2;4) | 4 (3;7) | 2 (2;4) | 0,002 |
Lag time, с | 293 (247;300) | 76 (63;188) | 293 (244;300) | 0,006 |
AUC | 0 (0;4) | 9 (8,5;28) | 0 (0;1) | 0,0001 |
Импедансная агрегатометрия с АДФ, 5 мкмоль/мл | ||||
Амплитуда, Ом | 0 (0;1) | 1 (0,5;5,5) | 0 (0;1) | 0,003 |
Скорость реакции, Ом/мин | 2 (2;2) | 3 (2;6) | 2 (2;3) | 0,013 |
Lag time, с | 273 (94;319) | 120 (38;252) | 250 (17;300) | — |
AUC | 0 (0;1) | 6 (1;24) | 0 (0;0) | 0,0001 |
Экспрессия рецепторов Р-селектина, % | ||||
Без АДФ, % | 2,9 (1,4;6,1) | 2,6 (2,1;10,1) | 1,7 (0,8;3,4) | 0,012 |
С АДФ, % | 5,2 (3,2;9,8) | 23 (18;37) | 2,9 (1,5;11,1) | 0,0001 |
Дельта | 1,2 (0,6;3,9) | 20 (6;27) | 1,1 (0,3;7,0) | 0,0001 |
Сокращения: АДФ — аденозиндифосфат, AUC — площадь под кривой агрегации.
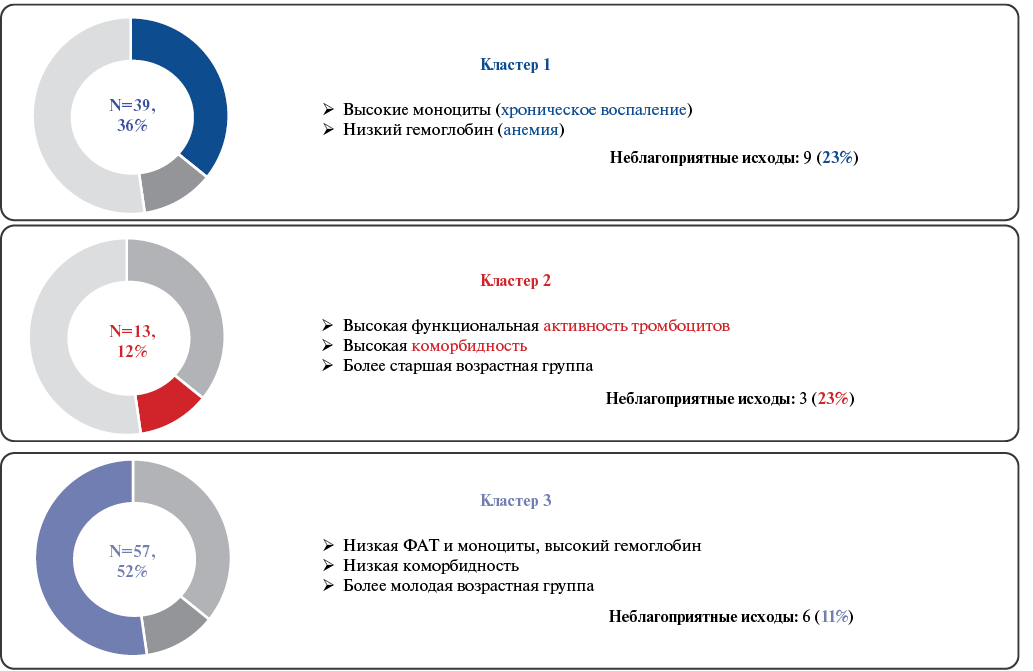
Рис. 4. Характеристики кластеров.
Сокращение: ФАТ — функциональная активность тромбоцитов.
Обсуждение
Данное исследование продемонстрировало гетерогенность группы пациентов c ОКСбпST: у 20% больных развился инфаркт миокарда, среди сопутствующих заболеваний у 23% пациентов встречался сахарный диабет, у 19% — ожирение, у 18% — мультифокальный атеросклероз, 27% имели такой фактор риска, как курение. Среди всех факторов риска и сопутствующих заболеваний, как было показано в проведенных ранее исследованиях, некоторые были ассоциированы с высокой ФАТ: курение, сахарный диабет, мультифокальный атеросклероз и пожилой возраст (p<0,05). Связь данных состояний с показателями активности тромбоцитарного гемостаза свидетельствует об их вероятной роли в патогенезе тромботических осложнений [6].
В исследованиях других авторов также подчеркнута неоднородность группы пациентов с ОКС, у которых широко представлена мультиморбидность, различные варианты поражения коронарного русла, которые в значительной степени определяли прогноз пациентов [7, 8]. Неоднократно было показано преимущество комбинированных шкал риска, включающих как клинические, так и лабораторные и инструментальные параметры, для комплексной оценки прогноза при ОКС [4][8]. Патогенез ОКС обусловлен в основном поражением коронарного русла, патофизиологическими проявлениями которого являются нарушения липидного обмена, хроническое воспаление, окислительный стресс, эндотелиальная дисфункция. Все эти процессы находят отражение в лабораторных показателях крови. Известно о связи анемии, показателей воспаления и дислипидемии с неблагоприятным прогнозом [4]. Аналогичные изменения лабораторных параметров (содержание гемоглобина, моноцитов) были представлены у пациентов первого кластера в нашем исследовании. Так, уровень гемоглобина составил у пациентов 1 кластера 128±17 г/л, хотя у большинства больных он был в пределах референсных значений, при сравнении со значениями, полученными у пациентов 2 и 3 кластеров (135±15 г/л и 142±12 г/л, соответственно) определена тенденция к снижению гемоглобина у больных 1 кластера. В то же время у пациентов 1 кластера зарегистрированы более высокие значения содержания моноцитов, по сравнению с пациентами 2 и 3 кластеров (0,64 (0,51;0,76) ×109/л vs 0,63 (0,49;0,73) ×109/л vs 0,51 (0,41;0,66) ×109/л), что, по всей вероятности, является отражением хронического вялотекущего воспаления. Ряд исследований, проведенных ранее, демонстрирует эффективность противовоспалительной терапии с использованием канакинумаба (исследование Cantos) или колхицина (исследования LoDoCo2 и COLCOT) у пациентов, недавно перенесших инфаркт миокарда, что несомненно подтверждает роль воспаления как одной из рациональных терапевтических мишеней для снижения сердечно-сосудистого риска, и прогностическое значение оценки остаточного воспалительного риска [9]. Результаты проведенного нами исследования также позволяют предположить ассоциативную связь между хроническим воспалением у пациентов 1 кластера и неблагоприятными исходами при ОКСбпST.
Роль тромбоцитов в поддержании гемостаза хорошо изучена, а в исследованиях последних лет была продемонстрирована их роль в воспалительных и иммунных реакциях. Тромбоциты на своей поверхности содержат широкий спектр рецепторов, участвующих не только в обеспечении гемостаза, но и в реализации других функций, в т. ч. регуляции воспаления, репарации, опухолевого роста и метастазирования [3][10][11]. Одними из наиболее частых осложнений при ОКС как в раннем, так и в отдаленном периоде являются повторные ишемические события, тромбозы стента, а также кровотечения. Тактика ведения пациентов зависит от соотношения геморрагического и ишемического риска, на основе которых разрабатывается персонифицированный подход к терапии [12-14]. В проведенном нами исследовании подтверждается значимость высокой ФАТ (высокая амплитуда кривой агрегации, выраженная экспрессия Р-селектина на поверхности активированных тромбоцитов) для развития повторных ишемических событий при ОКСбпST, что было продемонстрировано во втором кластере пациентов. По результатам импедансной агрегатометрии с АДФ в концентрациях 5 мкмоль/мл и 10 мкмоль/мл практически все показатели значимо отличались у пациентов 2 кластера. Скорость агрегации была значительно выше — 4 (3;7) Ом/мин с индуктором АДФ (10 мкмоль/л); время задержки меньше — 76 (63;188) сек; площадь под кривой больше — 9 (8,5;28), чем аналогичные показатели у пациентов 1 и 3 кластеров. Параметры агрегации при воздействии АДФ в концентрации 5 мкмоль/л при сравнении между кластерами имели такой же характер, за исключением времени задержки, которое было также меньше у пациентов 2 кластера, однако не достигло статистической значимости. Определенный интерес вызывает результат анализа экспрессии Р-селектина на поверхности активированных тромбоцитов. Показатель ΔР-селектина у пациентов 2 кластера был существенно выше, чем у пациентов 1 и 3 кластера (20 (6;27) vs 1,2 (0,6;3,9) vs 1,1 (0,3;7,0), соответственно), что свидетельствует о недостаточно сниженной ФАТ, несмотря на проводимую антиагрегантную терапию.
В ряде работ также доказано, что изменения функции тромбоцитов у пациентов с ССЗ нередко обусловлены метаболическими нарушениями, в т. ч. ассоциированными с факторами риска и коморбидной патологией (ожирение, инсулинорезистентность, дислипидемия, гипергликемия). Отдельно отмечается связь повышенной ФАТ с возрастом, и, в частности, с синдромом старческой астении [15]. У пациентов с ожирением и сахарным диабетом 2 типа повышен ряд показателей тромбоцитарного гемостаза, включая средний объем тромбоцитов, уровень циркулирующих микровезикул, продуктов окисления, растворимого P-селектина и CD40L, что позволяет говорить о взаимосвязи между коморбидной патологией, воспалением и тромбообразованием [16].
Полученные нами данные о взаимосвязи между лабораторными показателями, характеризующими воспаление, повышение агрегационной способности тромбоцитов, безусловно, могут быть в дальнейшем использованы для подбора персонифицированной терапии пациентов с ОКСбпST, в зависимости от того, какие механизмы преобладают у пациента: воспалительный ответ или недостаточно сниженная ФАТ. Однако следует отметить, что данное исследование, как и ряд других проведенных ранее, имеет ограничения. Исследование является одноцентровым, соответственно, полученные результаты следует интерпретировать с осторожностью. В данном анализе представлены результаты наблюдения в течение первых 6 мес., когда регистрируется сравнительно невысокое количество неблагоприятных исходов. В связи с этим актуально продолжение исследований в данной области, с включением большего количества пациентов и длительным сроком наблюдения.
Заключение
Среди пациентов с ОКСбпST выявлены группы, различающиеся по лабораторным показателям, на основании которых методом к-средних были определены кластеры. У включенных в исследование пациентов с ОКСбпST количество тромбоцитов было в пределах референсных значений, при этом выявлены различия по их функциональной активности. Кластеры с более высокими показателями ФАТ, количества моноцитов и низкими значениями гемоглобина фенотипически включали пациентов более старшего возраста и у них чаще регистрировались неблагоприятные сердечно-сосудистые события.
Неоднородность группы пациентов с ОКСбпST, различия в клиническом течении и исходах заболевания подчеркивают необходимость продолжения исследований для определения возможностей вклада показателей активности тромбоцитов и маркеров воспаления для подбора персонализированной терапии больных с ОКСбпST.
Отношения и деятельность: все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье.
Список литературы
1. Sibbing D, Aradi D, Alexopoulos D, et al. Updated Expert Consensus Statement on Platelet Function and Genetic Testing for Guiding P2Y12 Receptor Inhibitor Treatment in Percutaneous Coronary Intervention. JACC: Cardiovascular Interventions. 2019;16(26):152137. doi:10.1016/j.jcin.2019.03.034.
2. Gardin C, Ferroni L, Leo S, et al. Platelet-Derived Exosomes in Atherosclerosis. Int. J. Mol. Sci. 2022;23(20):12546. doi:10.3390/ijms232012546.
3. Koenen RR. Platelets: from simple fragments to inflammation regulators. European Heart Journal: 2023;44(8):6335. doi:10.1093/eurheartj/ehac705.
4. Циванюк М. М., Гельцер Б. И., Шахгельдян К. И. и др. Показатели клинического анализа крови, липидного спектра и их соотношений в прогнозировании обструктивного поражения коронарных артерий у больных с острым коронарным синдромом без подъема ST. Российский кардиологический журнал. 2022;27(8):5079. doi:10.15829/1560407120225079.
5. Николаева Т. О. Роль тромбоцитов в патогенезе атеросклероза. Атеросклероз. 2021;17(3):10619. doi:10.52727/2078256X-2021173106119.
6. Недбаева Д. Н., Сироткина О. В., Минеева Е. В. и др. Влияние коморбидной патологии на показатели функциональной активности тромбоцитов у пациентов с нестабильной стенокардией. Трансляционная медицина. 2023;10(4):25263. doi:10.18705/231144952023104252263.
7. Зыков М. В., Кашталап В. В., Быкова И. С. и др. Связь мультиморбидности с риском развития сердечно-сосудистых осложнений у пациентов с острым коронарным синдромом. Кардиологический вестник. 2018;13(2):5965. doi:10.17116/Cardiobulletin201813259.
8. Demandt JPA, Zelis JM, Koks A, et al. Prehospital risk assessment in patients suspected of non-ST-segment elevation acute coronary syndrome: a systematic review and metaanalysis. BMJ Open. 2022;12:e057305. doi:10.1136/bmjopen2021057305.
9. Nidorf SM, Fiolet ATL, Mosterd A, et al. Colchicine in Patients with Chronic Coronary Disease. New England Journal of Medicine. 2020;383(19):183847. doi:10.1056/NEJMoa2021372.
10. Tyagi T, Jain K, Gu SX, et al. A guide to molecular and functional investigations of platelets to bridge basic and clinical sciences. Nat Cardiovasc Res. 2022;1:22337. doi:10.1038/s4416102200021z.
11. Scridon A. Platelets and Their Role in Hemostasis and Thrombosis-From Physiology to Pathophysiology and Therapeutic Implications. Int J Mol Sci. 2022;23(21):12772. doi:10.3390/ijms232112772.
12. Towashiraporn K, Krittayaphong R. Current Perspectives on Antithrombotic Therapy for the Treatment of Acute Coronary Syndrome. Int J Gen Med. 2022;15:2397414. doi:10.2147/IJGM.S289295.
13. Nso N, Nassar M, Zirkiyeva M, et al. Factors Impacting Stent Thrombosis in Patients With Percutaneous Coronary Intervention and Coronary Stenting: A Systematic Review and Meta-Analysis. Cureus. 2022;14(4):e23973. doi:10.7759/cureus.23973.
14. Ullrich H, Münzel T, Gori T. Coronary stent thrombosis — predictors and prevention. In Deutsches Arzteblatt International. 2020;117(18):3206. doi:10.3238/arztebl.2020.0320.
15. Iyer KS, Dayal S. Modulators of platelet function in aging. 2019;31(4):47482. doi:10.1080/09537104.2019.1665641.
16. Barale C, Russo I. Influence of Cardiometabolic Risk Factors on Platelet Function Int. J. Mol. Sci. 2020;21(2):623. doi:10.3390/ijms21020623.
Об авторах
Д. Н. НедбаеваРоссия
Дарья Николаевна Недбаева — аспирант Института медицинского образования.
Санкт-Петербург
Конфликт интересов:
авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье
В. С. Михалева
Россия
Валерия Сергеевна Михалева — студент Института медицинского образования.
Санкт-Петербург
Конфликт интересов:
авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье
Е. А. Золотова
Россия
Екатерина Алексеевна Золотова — аспирант Института медицинского образования.
Санкт-Петербург
Конфликт интересов:
авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье
О. В. Сироткина
Россия
Ольга Васильевна Сироткина — д. б. н., профессор кафедры лабораторной медицины и генетики Института медицинского образования.
Санкт-Петербург
Конфликт интересов:
авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье
Г. А. Кухарчик
Россия
Галина Александровна Кухарчик — д. м. н., доцент, декан лечебного факультета, профессор кафедры факультетской терапии с клиникой Института медицинского образования.
Санкт-Петербург
Конфликт интересов:
авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье
Дополнительные файлы
- Пациенты с острым коронарным синдромом без подъема сегмента ST представляют собой гетерогенную группу, различающуюся по клиническим и лабораторным данным.
- Кластеры с высокими показателями функциональной активности тромбоцитов, количества моноцитов и низкими значениями гемоглобина фенотипически включали пациентов более старшего возраста и у них чаще регистрировались неблагоприятные сердечно-сосудистые события.
Рецензия
Для цитирования:
Недбаева Д.Н., Михалева В.С., Золотова Е.А., Сироткина О.В., Кухарчик Г.А. Кластеры пациентов с острым коронарным синдромом без подъема сегмента ST по результатам анализа лабораторных маркеров. Российский кардиологический журнал. 2024;29(7):5708. https://doi.org/10.15829/1560-4071-2024-5708. EDN: JKHCPA
For citation:
Nedbaeva D.N., Mikhaleva V.S., Zolotova E.A., Sirotkina O.V., Kukharchik G.A. Clusters of patients with non-ST-segment elevation acute coronary syndrome depending on the laboratory data. Russian Journal of Cardiology. 2024;29(7):5708. (In Russ.) https://doi.org/10.15829/1560-4071-2024-5708. EDN: JKHCPA
JATS XML

















































