Перейти к:
Постгеномные аспекты резистентности к ацетилсалициловой кислоте у пациентов с ишемической болезнью сердца
https://doi.org/10.15829/1560-4071-2024-5667
EDN: NQSBXT
Аннотация
Цель. Изучение уровня экспрессии мРНК гена P-селектина (SELP) и уровня межклеточного взаимодействия у пациентов с ишемической болезнью сердца (ИБС) до и после коронарного шунтирования (КШ) при резистентности к ацетилсалициловой кислоте (АСК).
Материал и методы. В исследование было включено 65 пациентов с ИБС, которым планировалось проведение КШ. Всем участникам определены экспрессия SELP, уровень агрегатов тромбоцитов с лейкоцитами, уровень экспрессии Р-селектина на агрегатах. Резистентность к АСК определялась при уровне агрегации тромбоцитов с арахидоновой кислотой ≥20% хотя бы в одной пробе. Все исследования проводились до и на 8-10-е сут. после КШ.
Результаты. Среди пациентов 29,4% (30 человек) были резистентными к АСК хотя бы в одной точке, 7,8% (8 человек) приобрели устойчивость после КШ. У резистентных к АСК выше уровень SELP (0,41 у.е. [0,28; 0,48] vs 0,32 [0,23; 0,39], р=0,037), абсолютного содержания агрегатов моноцит+тромбоцит (24,70 у.е. [9,69; 39,90] vs 10,15 у.е. [5,27; 30,63], р=0,037) и относительного количества агрегатов тромбоцит+тромбоцит CD62P (7,37% [3,43; 35,49] vs 4,84% [0,90; 9,63], р=0,045). Выявлена отрицательная корреляционная связь между экспрессией SELP и относительным содержанием агрегатов моноцит+тромбоцит (ρ=-0,349, р=0,013) на 8-10-е сут. после КШ. По итогам многофакторного регрессионного анализа установлено, что уровень экспрессии мРНК гена SELP является предиктором развития резистентности к АСК до КШ (отношение шансов 404,48; 95% доверительный интервал: 1,68-97461,63).
Заключение. Повышение экспрессии SELP ассоциировано с увеличением агрегационной активности тромбоцитов, что способствует недостаточному ответу тромбоцитов на антитромботическую терапию у пациентов с КШ. Уровень экспрессии мРНК гена SELP может рассматриваться как предиктор развития резистентности к АСК.
Ключевые слова
Для цитирования:
Гринштейн Ю.И., Косинова А.А., Мальцева А.Н., Субботина Т.Н., Семащенко К.С., Левагина П.И., Шаврина Е.О., Савченко А.А. Постгеномные аспекты резистентности к ацетилсалициловой кислоте у пациентов с ишемической болезнью сердца. Российский кардиологический журнал. 2024;29(10):5667. https://doi.org/10.15829/1560-4071-2024-5667. EDN: NQSBXT
For citation:
Grinshtein Yu.I., Kosinova A.A., Maltseva A.N., Subbotina T.N., Semashchenko K.S., Levagina P.I., Shavrina E.O., Savchenko A.A. Postgenomic aspects of resistance to acetylsalicylic acid in patients with coronary artery disease. Russian Journal of Cardiology. 2024;29(10):5667. (In Russ.) https://doi.org/10.15829/1560-4071-2024-5667. EDN: NQSBXT
Проблема развития повторных сердечно-сосудистых событий после коронарной реваскуляризации остаётся актуальной, несмотря на проводимую вторичную профилактику. Отсутствие ответа и сохранение высокой реактивности тромбоцитов на терапии ацетилсалициловой кислотой (АСК) варьирует от 5% до 60% в зависимости от способа выявления данного феномена [1][2]. В настоящее время нет стандартизованных тестов для оценки функции тромбоцитов в реальной клинической практике. В частности, обсуждается персонализированный подход в оценке геморрагического/ишемического риска при назначении антитромбоцитарной терапии [3]. Большое внимание уделяется поиску предикторов развития резистентности к антитромбоцитарным препаратам, в частности, к АСК, для управления кардиоваскулярными рисками. В качестве предикторов нами ранее описаны генетические факторы — полиморфизмы rs6133, rs6131, rs6136, rs2228315 гена Р-селектина (SELP) [4], клеточные — дезорганизация межклеточного взаимодействия и повышение количества тромбоцит-лейкоцитарных и тромбоцит-тромбоцитарных агрегатов [4] и молекулярные — изменение метаболической активности тромбоцитов по продукции активных форм кислорода [5].
Однако существует структура, играющая важную роль в "проявлении признака" (экспрессии) генов, малоизученная в развитии резистентности к АСК — мРНК. Это чувствительный индикатор биологической активности, в котором изменение паттерна экспрессии генов отражается в изменении биологического процесса.
Предполагаемая гипотеза нашего исследования — у пациентов с ишемической болезнью сердца (ИБС) уровень экспрессии SELP и количество межклеточных агрегатов могут быть маркерами развития недостаточного ответа тромбоцитов на АСК после коронарного шунтирования (КШ).
Поэтому целью работы стало изучение уровня экспрессии мРНК SELP и уровня межклеточного взаимодействия у пациентов с ИБС до и после КШ при резистентности к АСК.
Материал и методы
В проспективное когортное исследование было включено 65 пациентов с ИБС, у которых по данным коронароангиографии было подтверждено атеросклеротическое поражение коронарных артерий и проведено аорто- или маммарокоронарное шунтирование на базе Федерального центра сердечно-сосудистой хирургии г. Красноярска (ФЦССХ).
Протокол исследования одобрен этическим комитетом КрасГМУ им. В. Ф. Войно-Ясенецкого. Исследование проведено согласно стандартам надлежащей практики и принципам Хельсинкской декларации. Все пациенты подписали информированное согласие об участии в исследовании. Лечение проводилось согласно действующим рекомендациям Российского кардиологического общества (Стабильная ишемическая болезнь сердца, 2020г)1. Основные группы использованных лекарственных препаратов: антиагреганты (АСК и клопидогрел), ингибиторы ангиотензинпревращающего фермента/блокаторы рецепторов ангиотензина II, бета-адреноблокаторы, блокаторы кальциевых каналов, статины, диуретики.
Критерии включения пациентов: гемодинамически значимые стенозы ≥2 коронарных артерий при коронароангиографии, стабильная стенокардия напряжения II-IV функциональных классов (ФК) согласно Канадской классификации, подписанное информированное согласие. Критерии исключения: обострение язвенной болезни желудка и двенадцатиперстной кишки, хроническая болезнь почек (скорость клубочковой фильтрации <60 мл/мин/1,73 м²), повышение уровня трансаминаз в 3 и более раз, непереносимость или невозможность приема клопидогрела и АСК. В ходе исследования 2 пациента были исключены досрочно, первый — по причине отмены оперативного вмешательства, второй — ввиду летального исхода в послеоперационном периоде (развитие острого инфаркта миокарда).
В числе участников исследования 47% имели II ФК стабильной стенокардии, 42,4% — III ФК при многососудистом поражении коронарного русла. Медиана возраста пациентов составила 64,0 [ 60,0; 67,5] года. Характеристика пациентов представлена в таблице 1.
Таблица 1
Общая клинико-лабораторная характеристика пациентов и в зависимости от наличия резистентности к АСК до КШ
Параметр | Все пациенты (n=65) | чАСК (n=50) | рАСК (n=15) | р-уровень |
Пол, n (%) — мужской — женский | 48 (73,8) 17 (26,2) | 38 (76,0) 12 (24,0) | 10 (33,3) 5 (66,7) | 0,512 |
Возраст (годы), Me [ 25; 75] | 64,0 [ 60,0; 67,5] | 63,5 [ 60,0; 67,3] | 65 [ 60,0; 69,0] | 0,596 |
Табакокурение, % | 33,8 | 38,0 | 20,0 | 0,231 |
Ожирение, % | 47,7 | 50,0 | 40,0 | 0,565 |
Артериальная гипертензия, % | 93,8 | 94,0 | 93,3 | 0,660 |
Сахарный диабет, % | 33,8 | 34,0 | 33,3 | 1,000 |
Стабильная стенокардия, II ФК, % | 47,7 | 44,0 | 60,0 | 0,379 |
Стабильная стенокардия, III ФК, % | 41,5 | 46,0 | 26,7 | 0,239 |
Инфаркт миокарда в анамнезе, % | 61,5 | 66,0 | 46,7 | 0,230 |
Количество тромбоцитов, 10⁹/л | 227,0 [ 184,5; 259,0] | 221,0 [ 178,5; 268,5] | 230,0 [ 201,0; 255,0] | 0,686 |
Количество лейкоцитов, 10⁹/л | 7,6 [ 6,7; 8,5] | 7,7 [ 6,7; 8,5] | 7,2 [ 5,5; 8,9] | 0,533 |
Общий холестерин, ммоль/л | 4,4 [ 3,8; 5,5] | 4,4 [ 3,8; 5,9] | 4,3 [ 3,5; 4,9] | 0,235 |
ЛНП, ммоль/л | 2,6 [ 2,1; 2,3] | 2,7 [ 2,1; 3,4] | 2,2 [ 1,6; 2,9] | 0,462 |
Креатинин, мкмоль/л | 113,0 [ 100,0; 126,5] | 115,0 [ 105,0; 127,3] | 95,0 [ 89,0; 114,0] | 0,003 |
Количество поражённых атеросклерозом коронарных артерий | 3,0 [ 2,0; 4,0] | 3,0 [ 2,0; 4,3] | 3,0 [ 2,0; 3,0] | 0,412 |
Количество шунтов | 2,0 [ 1,5; 3,0] | 2,0 [ 1,0; 3,0] | 2,0 [ 2,0; 3,0] | 0,383 |
КШ с ИК, % | 73,8 | 70,0 | 86,7 | 0,317 |
Длительность ИК, мин | 65,0 [ 21,5; 98,0] | 72,0 [ 60,0; 115,0] | 85,0 [ 67,5; 102,0] | 0,242 |
Время общей анестезии, мин | 250,0 [ 200,0; 317,5] | 270,0 [ 134,0; 322,5] | 290,0 [ 210,0; 325,0] | 0,250 |
Послеоперационные осложнения в общем, % | 26,1 | 24,0 | 33,3 | 0,512 |
ОИМ, % | 1,5 | 2,0 | 0,0 | 1,000 |
ОНМК, % | 7,7 | 8,0 | 6,7 | 1,000 |
Кровотечения, % | 3,1 | 2,0 | 6,7 | 0,411 |
Плеврит с плевральной пункцией, % | 16,9 | 14,0 | 26,7 | 0,435 |
Примечание: количественные данные представлены в виде медианы и интерквартильного диапазона — Ме [ 25%; 75%]; качественные показатели оформлены в виде n (%), где n — число больных в каждой из представленных групп.
Сокращения: рАСК — резистентные к ацетилсалициловой кислоте пациенты, чАСК — чувствительные к ацетилсалициловой кислоте пациенты, ИК — искусственное кровообращение, КШ — коронарное шунтирование, ЛНП — липопротеиды низкой плотности, ОИМ — острый инфаркт миокарда, ОНМК — острое нарушение мозгового кровообращения, ФК — функциональный класс.
Для снижения риска геморрагических осложнений за 5 дней до КШ отменялись антиагреганты в соответствии с принятыми стандартами лечения ФЦССХ г. Красноярска. АСК в дозировке 100 мг назначалась с 1-х сут., клопидогрел 75 мг — с 3-х сут. при перенесенном остром коронарном синдроме <1 года назад. 42 пациента находились на монотерапии АСК, 23 — на двойной антиагрегантной терапий — АСК (100 мг) + клопидогрел (75 мг). Также пациенты получали: ингибиторы ангиотензинпревращающего фермента/антагонисты ренин-ангиотензиновых рецепторов, ингибиторы протонной помпы, бета-адреноблокаторы, статины, антагонисты кальция, нестероидные противовоспалительные средства и наркотические анальгетики в раннем послеоперационном периоде, при наличии сахарного диабета — сахароснижающую терапию.
До и на 8-10-е сут. после КШ выполнялись следующие обследования: развернутый и биохимический анализы крови, оптическая агрегатометрия, определение резистентности к АСК, проточная цитометрия и определение уровня SELP.
Для исследований периферическая кровь из локтевой вены забиралась в пробирку с 3,2% цитратом натрия. Оптический агрегометр CHRONO-LOG 490 применялся для оценки агрегации с использованием индуктора — арахидоновая кислота 1 мМ до и после инкубации с 10 мкл АСК in vitro.
Резистентность к АСК устанавливали при уровне агрегации тромбоцитов с арахидоновой кислотой ≥20%2 хотя бы в одной точке наблюдения: при инкубации плазмы пациента с АСК in vitro до КШ без антиагрегантной терапии и на 8-10-й день после операции на фоне антиагрегантной терапии.
С помощью проточного цитометра Navios (BeckmanCoulter, США) измерялось относительное (%) и абсолютное (у. е.) количество межклеточных агрегатов с использованием моноклональных антител: тромбоциты (CD41), моноциты (CD14, CD16), уровень экспрессии Р-селектина на тромбоцитах (CD62P). Применялся забуференный 10% раствор формалина для снижения повышенной агрегации ввиду транспортировки образцов крови в лабораторию для проведения проточной цитометрии.
Для оценки относительного уровня экспрессии SELP использовали РНК, выделенную из тромбоцитов цельной крови с помощью набора реагентов "Рибо-преп" (ООО ИнтерЛабСервис). Предварительно готовили богатую тромбоцитами плазму, магнитные частицы Dynabeads CD45 (ThermoFisherScientific) использовали для очищения образца от примеси лейкоцитов. Концентрации образцов РНК измеряли с использованием набора реагентов Quant-iT™ ssRNA AssayKit и флуориметра Qubit 3 (Invitrogen). С выделенными образцами мРНК (в составе тотальной РНК) проводили совмещенную с обратной транскрипцией ПЦР с детекцией результатов в режиме реального времени (ОТ-ПЦР-РВ) с использованием набора реагентов "БиоМастер ОТ-ПЦР-РВ" (ООО Биолабмикс). ОТ-ПЦР-РВ осуществляли с использованием специфических праймеров и TaqMan зондов для выявления мРНК SELP и GAPDH (ThermoFisherScientific) в двух технических повторах. Расчет относительного уровня экспрессии SELP осуществляли методом 2-ΔCt, позволяющим провести относительную количественную оценку интересующего гена в сравнении с референсным геном.
Статистическая обработка результатов осуществлялась с помощью пакета прикладных программ SPSS Statistics (версия 20.0). Для описания полученных данных вычислялись медиана (Ме) и интерквартильный размах (25 и 75 процентили). Для качественных показателей использовались число наблюдений и доля (в процентах) от всех участников или количества пациентов в соответствующей подгруппе. Статистическая значимость различий между показателями независимых выборок оценивалась по непараметрическому критерию Манна-Уитни. Для категориальных переменных применялся критерий χ². Статистически значимыми считались различия при р<0,05. Для корреляционного анализа использовался коэффициент Спирмена ρ. Связь считалась статистически значимой при р<0,05. Для прогнозирования вклада каждого из факторов в развитии резистентности к АСК применён метод логистического регрессионного анализа, где использовались бинарные переменные: 0 — чувствительность к АСК, 1 — резистентность к АСК. Введены предикторы: курение, сахарный диабет, ожирение, мультифокальный атеросклероз и экспрессия SELP. Модель считалась статистически значимой при р<0,05 согласно критерию χ² Вальда. Для оценки результатов прогнозирования использовался ROC-анализ. Количественная интерпретация проводилась по ROC-кривым с оценкой показателя AUC (Area under ROC curve — площадь под ROC-кривой): от 0,9 до 1 — отличное качество модели, 0,8-0,9 — очень хорошее, 0,7-0,8 — хорошее, 0,6-0,7 — среднее, 0,5-0,6 — неудовлетворительное качество модели.
Результаты
По итогам проведённого исследования 23,1% (15 человек) были резистентными к АСК до КШ, 29,4% (30 человек) имели устойчивость к АСК хотя бы в одной точке. 7,8% (8 человек) определялись как чувствительные к АСК до КШ, но приобрели резистентность к АСК на 8-10-е сут. после КШ. У 10,8% (11 пациентов) резистентность к АСК определялась как до КШ, так и на 8-10-й день после КШ.
Все пациенты с ИБС разделены на две группы сравнения по наличию резистентности до КШ.
Оценка межклеточных агрегатов и уровня экспрессии SELP в зависимости от чувствительности к АСК показала следующие результаты. У резистентных к АСК пациентов до КШ выявлено статистически значимое повышение уровня экспрессии SELP (0,41 [ 0,28; 0,48] vs 0,32 [ 0,23; 0,39], р=0,037), а также увеличение абсолютного содержания агрегатов моноцит+тромбоцит (24,70 у. е. [ 9,69; 39,90] vs 10,15 у. е. [ 5,27; 30,63], р=0,037) и возрастание относительного количества агрегатов тромбоцит+тромбоцит CD62P (7,37% [ 3,43; 35,49] vs 4,84% [ 0,90; 9,63], р=0,045).
Мы разделили всех пациентов с ИБС на две группы в зависимости от уровня экспрессии мРНК SELP по значению медианы до (0,332 у. е.) и на 8-10-е сут. после КШ (0,396 у. е.). До КШ статистически значимых отличий по количеству клеточных агрегатов в группах не регистрировалось. Во второй точке зафиксировано более высокое количество агрегатов нейтрофил+тромбоцит при уровне SELP 0,396 у. е. и выше (85,80 у. е. [ 33,15; 182,00] и 30,40 у. е. [ 14,08; 130,00], соответственно, р=0,030). То же происходит во второй точке наблюдения с относительным количеством агрегатов нейтрофил+тромбоцит CD62P (88,71% [ 74,03; 100,00] vs 73,47% [ 52,18; 89,79], соответственно, р=0,014).
При измерении уровня агрегационной активности тромбоцитов с арахидоновой кислотой у всех пациентов с ИБС со значением ≥50% статистически значимо повышался относительный уровень агрегатов моноцит+тромбоцит (43,28% [ 27,24; 71,25] vs 40,51% [ 23,96; 62,36], р=0,024).
При проведении корреляционного анализа установлена отрицательная связь между уровнем экспрессии SELP и относительным содержанием агрегатов моноцит+тромбоцит (ρ=-0,349, р=0,013) на 8-10-е сут. после КШ у всех пациентов с ИБС (рис. 1).
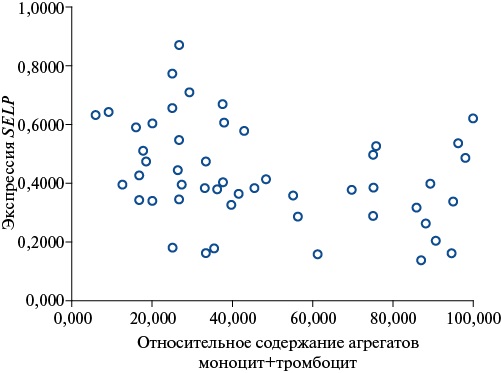
Рис. 1. Корреляционные взаимосвязи между уровнем экспрессии SELP и относительным содержанием агрегатов моноцит+тромбоцит (%) у всех пациентов с ИБС на 8-10-е сут. после КШ.
Учитывая многофакторный механизм развития резистентности к АСК, мы провели логистический регрессионный анализ для оценки значимости предполагаемых клинико-генетических предикторов в возникновении резистентности к АСК до КШ (табл. 2).
Таблица 2
Сводные данные по логистической регрессионной модели прогнозирования развития резистентности к АСК у пациентов с ИБС
Предикторы | Коэффициент регрессии (B) | Сред. ош. | Вальд | р | Exp (B) | 95% доверительный интервал для EXP(B) | |
Нижняя | Верхняя | ||||||
Курение | -0,92 | 0,75 | 1,50 | 0,22 | 0,40 | 0,09 | 1,74 |
Сахарный диабет | -0,36 | 0,69 | 0,28 | 0,60 | 0,70 | 0,18 | 2,68 |
Ожирение | -0,62 | 0,66 | 0,90 | 0,34 | 0,54 | 0,15 | 1,94 |
Мультифокальный атеросклероз | -0,03 | 0,93 | 0,00 | 0,98 | 0,97 | 0,16 | 5,99 |
Экспрессия SELP до КШ | 6,00 | 2,80 | 4,60 | 0,03 | 404,48 | 1,68 | 97461,63 |
Константа | -2,59 | 1,14 | 5,22 | 0,02 | 0,08 | ||
Сокращения: КШ — коронарное шунтирование, Сред. ош. — среднеквадратичная ошибка, Exp (B) — отношение шансов.
Статистически значимым предиктором, повышающим вероятность развития резистентности к АСК до КШ, является уровень экспрессии SELP (отношение шансов 404,48; 95% доверительный интервал: 1,68-97461,63).
Регрессионная модель развития резистентности к АСК представлена следующим уравнением:
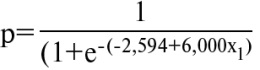 ,
,
где: р — вероятность развития у пациента резистентности к АСК, х1 — уровень экспрессии SELP, е — основание натурального логарифма 2,72.
Модель является статистически значимой (р<0,001) и согласуется с исходными данными по критерию Хосмера-Лемешева (0,795).
Представленная модель даёт самый высокий коэффициент детерминации — 0,125, что отражает статистически значимую вероятность развития резистентности к АСК при повышении экспрессии SELP в 12,5% случаев. Специфичность — 42,9%, чувствительность — 86,4%, площадь под кривой — 0,719 (рис. 2).
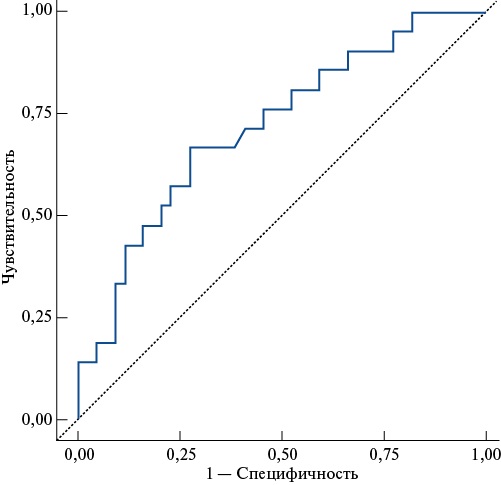
Рис. 2. ROC-кривая результатов прогнозирования при помощи регрессионной модели развития резистентности к АСК у пациентов с ИБС в зависимости от уровня экспрессии гена SELP до КШ.
Модели с другими показателями, такими как: относительное и абсолютное содержание тромбоцитов CD62P и агрегатов нейтрофил+тромбоцит, моноцит+тромбоцит, тромбоцит+тромбоцит, а также с экспрессией Р-селектина на данных агрегатах, в т. ч. на 8-10-е сут. после КШ — оказались статистически незначимыми.
Обсуждение
Изучение уровня экспрессии мРНК гена адгезивной молекулы Р-селектина и образование лейкоцит-тромбоцитарных агрегатов представляет несомненный интерес в плане их возможного влияния на эффективность антитромбоцитарной терапии у пациентов с ИБС, в т. ч. после КШ.
Согласно нашим данным, при увеличении экспрессии мРНК гена SELP статистически значимо возрастает абсолютное количество агрегатов нейтрофил+тромбоцит и относительное количество агрегатов нейтрофил+тромбоцит CD62P после КШ. Возможно, это связано с применением искусственного кровообращения, которое может вызывать активацию тромбоцитов и системный воспалительный ответ. В одном из исследований, описывающих функциональную активность тромбоцитов у пациентов, подвергшихся КШ, установлено, что количество тромбоцит-тромбоцитарных и тромбоцит-моноцитарных агрегатов, а также уровень экспрессии Р-селектина тромбоцитами были выше в первые сутки и через 1 мес. после операции в сравнении с показателями до КШ, повышенное количество тромбоцит-моноцитарных агрегатов снижалось через 3 мес. после КШ. Из возможных причин развития данного феномена предполагается также развитие воспалительного ответа вследствие применения искусственного кровообращения и уменьшение активности воспаления спустя 3 мес. после оперативного вмешательства [6].
Хотя уровни мРНК не обязательно пропорциональны выработке функциональных белков, в нескольких исследованиях была показана корреляция между экспрессией мРНК Р-селектина и функциональным белком [7][8].
В настоящем исследовании выявлено, что при повышении уровня агрегационной активности тромбоцитов с арахидоновой кислотой после КШ статистически значимо повышается относительное количество агрегатов моноцит+тромбоцит. При повреждении эндотелия возникает активация тромбоцитов, в просвет сосуда активно поступают вещества, способствующие рекрутингу лейкоцитов и образованию между ними межклеточных связей [9]. Чаще всего тромбоциты образуют агрегаты с моноцитами и нейтрофилами [10][11]. Согласно литературным данным, тромбоцит-моноцитарные агрегаты могут быть более чувствительным маркером воспаления и активации тромбоцитов после КШ, чем уровень Р-селектина [6].
По результатам нашего исследования у резистентных к АСК пациентов до КШ выше уровни SELP, агрегатов тромбоцит+тромбоцит CD62P и моноцит+тромбоцит.
Как правило, более высокий уровень активированных тромбоцитов с экспрессированным на них P-селектином, большее количество тромбоцитарно-лейкоцитарных агрегатов и повышенный уровень растворимого P-селектина в периферической крови чаще регистрируется у пациентов с воспалительными и тромботическими расстройствами [12]. Song C, et al. обнаружили высокую экспрессию Р-селектина при ИБС, а также связь между тяжестью ИБС и уровнем Р-селектина [13], а в другом исследовании у здоровых пожилых лиц уровень экспрессии Р-селектина представлен в качестве маркера неблагоприятных сердечно-сосудистых событий [14]. Но в то же время в российском исследовании не было установлено статистически значимого увеличения Р-селектина при ИБС [15].
Нами также составлена прогностическая модель развития резистентности. При включении клинико-лабораторных предикторов, уровня экспрессии SELP, количества межклеточных агрегатов в модель, статистическую значимость продемонстрировал лишь уровень экспрессии SELP. Причем его вклад в развитие резистентности составляет 12,5%.
Изучение экспрессии SELP, количества межклеточных агрегатов может помочь в прогнозировании развития резистентности к АСК и как следствие послеоперационных осложнений после КШ. Будущие исследования должны дать валидизацию оценки лейкоцит-тромбоцитарных комплексов, экспрессии SELP и перспективу внедрения результатов в кардиологическую практику.
Ограничения исследования. Небольшой объем выборки. Дальнейшие исследования необходимы для уточнения предикторов недостаточного ответа тромбоцитов на АСК с целью персонификации антитромбоцитарной терапии у пациентов после КШ.
Заключение
С увеличением экспрессии SELP статистически значимо возрастает абсолютное количество агрегатов нейтрофил+тромбоцит и относительное количество агрегатов нейтрофил+тромбоцит CD62P после КШ. При повышении уровня агрегационной активности тромбоцитов с арахидоновой кислотой после КШ статистически значимо повышается относительное количество агрегатов моноцит+тромбоцит. Более высокий уровень SELP, абсолютного количества агрегатов моноцит+тромбоцит, а также относительного содержания агрегатов тромбоцит+тромбоцит CD62P ассоциированы с резистентностью к АСК. Уровень экспрессии SELP является предиктором развития резистентности к АСК.
Отношения и деятельность: все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье.
1. https://scardio.ru/content/Guidelines/2020/Clinic_rekom_IBS-unlocked.pdf.
2. Гринштейн Ю. И., Филоненко И. В., Савченко А. А., Савченко Е. А., Гринштейн И. Ю. Способ диагностики резистентности к ацетилсалициловой кислоте. Патент на изобретение RU 2413953 C1, 10.03.2011.
Список литературы
1. Пучиньян Н. Ф., Фурман Н. В., Долотовская П. В. и др. Высокая остаточная реактивность тромбоцитов на фоне двойной антиагрегантной терапии, выявленная методом оптической агрегометрии, и частота развития атеротромботических осложнений после стентирования коронарных артерий у больных ишемической болезнью сердца в реальной клинической практике. Рациональная Фармакотерапия в Кардиологии. 2016;12(4):385-90. doi:10.20996/1819-6446-2016-12-4-385-390.
2. Snoep JD, Hovens MM, Eikenboom JC, et al. Association of laboratory-defined aspirin resistance with a higher risk of recurrent cardiovascular events: a systematic review and meta-analysis. Arch Intern Med. 2007;167(15):1593-9. doi:10.1001/archinte.167.15.1593.
3. Кобалава Ж. Д., Писарюк А. С., Филькова А. А. и др. Фенотипы тромбоцитов и практические аспекты методов тестирования функции тромбоцитов в кардиологии. Рациональная Фармакотерапия в Кардиологии. 2023;19(6):614-27. doi:10.20996/1819-6446-2023-2981. EDN KAAWKP.
4. Гринштейн Ю. И., Косинова А. А., Мальцева А. Н. и др. Нарушение тромбоцит-лейкоцитарного взаимодействия и повышение уровня Р-селектина как возможные причины резистентности к ацетилсалициловой кислоте у пациентов до и после коронарного шунтирования. Креативная кардиология. 2023;17(2):237-46. doi:10.24022/1997-3187-2023-17-2-237-246.
5. Косинова А. А., Монгуш Т. С., Гринштейн Ю. И. и др. Изучение ассоциации полиморфизмов Т715Р (RS6136), M62I (RS2228315), S290N (RS6131), V640L (RS6133) в гене Р-селектина и его лиганда с резистентностью к ацетилсалициловой кислоте у пациентов с ишемической болезнью сердца после коронарного шунтирования. Российский кардиологический журнал. 2019;(10):22-8. doi:10.15829/1560-4071-2019-10-22-28.
6. Grinshtein YI, Savchenko AA, Kosinova AA, et al. Resistance to Acetylsalicylic Acid in Patients with Coronary Heart Disease Is the Result of Metabolic Activity of Platelets. Pharmaceuticals. 2020;13(8):178. doi:10.3390/ph13080178.
7. Ivert T, Dalén M, Ander C, et al. Increased platelet reactivity and platelet-leukocyte aggregation after elective coronary bypass surgery. Platelets. 2019;30(8):975-81. doi:10. 1080/09537104.2018.1542122.
8. Armstead VE, Minchenko AG, Schuhl RA, et al. Regulation of P-selectin expression in human endothelial cells by nitric oxide. Am J Physiol. 1997;273(2 Pt 2):740-6. doi:10.1152/ajpheart.1997.273.2.H740.
9. Eguchi H, Ikeda H, Murohara T, et al. Endothelial injuries of coronary arteries distal to thrombotic sites: role of adhesive interaction between endothelial P-selectin and leukocyte sialyl Lewis X. Circ Res. 1999;84(5):525-35. doi:10.1161/01.res.84.5.525.
10. Свиридова С. П., Сомонова О. В., Кашия Ш. Р. и др. Роль тромбоцитов в воспалении и иммунитете. Исследования и практика в медицине. 2018;5(3):40-52. doi:10.17709/2409-2231-2018-5-3-4.
11. Витковский Ю. А., Кузник Б. И., Солпов А. В. Патогенетическое значение лимфоцитарно-тромбоцитарной адгезии. Медицинская иммунология. 2006;8(5-6):745-753. doi:10.15789/1563-0625-2006-5-6-745-75.
12. Pircher J, Engelmann B, Massberg S, et al. Platelet-Neutrophil Crosstalk in Atherothrombosis. Thromb Haemost. 2019;119(8):1274-82. doi:10.1055/s-0039-1692983.
13. Song C, Wu G, Chang S, et al. Plasma P-selectin level is associated with severity of coronary heart disease in Chinese Han population. The Journal of international medical research. 2020;48(6):300060519896437. doi:10.1177/0300060519896437.
14. Batko-Szwaczka A, Francuz T, Kosowska A, et al. Predictors of Adverse Outcomes in Healthy Aging Adults: Coronary Artery Disease, Lower Educational Status and Higher P-Selectin Levels. Clin Interv Aging. 2022;5(17):1173-85. doi:10.2147/CIA.S363881.
15. Логаткина А. В., Терехов И. В., Бондарь С. С., Никифоров В. С. Диагностическая ценность растворимых молекул адгезии и костимуляторных молекул иммунокомпетентных клеток у больных ишемической болезнью сердца. Медицинская иммунология. 2019;21(6):1169-78. doi:10.15789/1563-0625-2019-6-1169-1178.
Об авторах
Ю. И. ГринштейнРоссия
Д.м.н., профессор, зав. кафедрой терапии Института последипломного образования.
Красноярск
Конфликт интересов:
Нет
А. А. Косинова
Россия
К.м.н., ассистент, кафедра терапии Института последипломного образования; с.н.с. лаборатории цифровых управляемых лекарств и тераностики.
Красноярск
Конфликт интересов:
Нет
А. Н. Мальцева
Россия
Выпускник аспирантуры кафедры терапии Института последипломного образования.
Красноярск
Конфликт интересов:
Нет
Т. Н. Субботина
Россия
Д. б. н., доцент кафедры медицинской биологии, руководитель Научно-практической лаборатории молекулярно-генетических методов исследований.
Красноярск
Конфликт интересов:
Нет
К. С. Семащенко
Россия
Лаборант-исследователь Научно-практической лаборатории молекулярно-генетических методов исследований.
Красноярск
Конфликт интересов:
Нет
П. И. Левагина
Россия
Лаборант-исследователь Научно-практической лаборатории молекулярно-генетических методов исследований.
Красноярск
Конфликт интересов:
Нет
Е. О. Шаврина
Россия
Лаборант-исследователь лаборатории клеточно-молекулярной физиологии и патологии.
Красноярск
Конфликт интересов:
Нет
А. А. Савченко
Россия
Д.м.н., профессор, руководитель лаборатории клеточно-молекулярной физиологии и патологии.
Красноярск
Конфликт интересов:
Нет
Дополнительные файлы
- Изучение причин резистентности к ацетилсалициловой кислоте (АСК) остается актуальным вопросом.
- У пациентов с ишемической болезнью сердца после коронарного шунтирования при повышении уровня экспрессии мРНК гена SELP увеличивается уровень лейкоцит-тромбоцитарных агрегатов, в т. ч. экспрессирующих Р-селектин.
- Повышение агрегационной активности тромбоцитов и экспрессии гена SELP ассоциировано с возникновением резистентности к АСК.
- Ген SELP может быть предиктором развития резистентности к АСК.
Рецензия
Для цитирования:
Гринштейн Ю.И., Косинова А.А., Мальцева А.Н., Субботина Т.Н., Семащенко К.С., Левагина П.И., Шаврина Е.О., Савченко А.А. Постгеномные аспекты резистентности к ацетилсалициловой кислоте у пациентов с ишемической болезнью сердца. Российский кардиологический журнал. 2024;29(10):5667. https://doi.org/10.15829/1560-4071-2024-5667. EDN: NQSBXT
For citation:
Grinshtein Yu.I., Kosinova A.A., Maltseva A.N., Subbotina T.N., Semashchenko K.S., Levagina P.I., Shavrina E.O., Savchenko A.A. Postgenomic aspects of resistance to acetylsalicylic acid in patients with coronary artery disease. Russian Journal of Cardiology. 2024;29(10):5667. (In Russ.) https://doi.org/10.15829/1560-4071-2024-5667. EDN: NQSBXT
JATS XML

















































