Перейти к:
Динамика сосудистой жесткости и центрального артериального давления после эндоваскулярной изоляции аневризмы аорты у пациентов с артериальной гипертензией. Результаты годичного наблюдения
https://doi.org/10.15829/1560-4071-2023-5645
EDN: TQNPCF
Аннотация
Цель. Оценка динамики артериальной жесткости, центрального артериального давления (ЦАД) и определение потенциально влияющих на них факторов у пациентов с аневризмой нисходящего грудного и брюшного отделов аорты, в сочетании с артериальной гипертензией, через год после эндоваскулярной изоляции аневризмы аорты ((T)EVAR).
Материал и методы. Включались пациенты ≥18 лет без клинически значимых нарушений ритма сердца. До операции и через год выполнялось обследование: определение периферического артериального давления, частоты сердечных сокращений (ЧСС), ЦАД, индекса аугментации (AIx), давления в точке максимума подъема прямой пульсовой волны (PT1h), времени возврата отраженной волны (Тr) и каротидно-феморальной скорости распространения пульсовой волны (кфСРПВ).
Результаты. Включено 50 пациентов (средний возраст 68±9 лет, 41 мужчина, 16 — с аневризмой нисходящего грудного отдела аорты, 34 — с аневризмой брюшного отдела аорты), обследовано повторно 23 пациента. После (T) EVAR выявлено увеличение кфСРПВ (+2,6 м/с, р<0,001), PT1h (+5 мм рт.ст., р=0,026), периферического пульсового давления (+7 мм рт.ст., р=0,039), ЧСС (+5 уд./мин, р=0,025). Показатели ЦАД и AIx не изменились. Найдена зависимость снижения Tr от длины стент-графта (β=0,42) и снижения ЧСС (β=-0,52). За год зарегистрировано 6 сердечно-сосудистых осложнений.
Заключение. Имплантация эндопротеза сопровождается повышением кфСРПВ вне зависимости от локализации аневризмы. Повышение PT1h через год после (T)EVAR может отражать снижение растяжимости аорты, ухудшение демпфирующей функции. Отсутствие динамики ЦАД, AIх, вероятно, объясняется особенностями отраженной волны после операции. Предикторы увеличения Tr — снижение ЧСС и имплантация более протяженных стент-графтов.
Ключевые слова
Для цитирования:
Гуревич А.П., Емельянов И.В., Ионов М.В., Ванюркин А.Г., Чернявский М.А., Конради А.О. Динамика сосудистой жесткости и центрального артериального давления после эндоваскулярной изоляции аневризмы аорты у пациентов с артериальной гипертензией. Результаты годичного наблюдения. Российский кардиологический журнал. 2023;28(12):5645. https://doi.org/10.15829/1560-4071-2023-5645. EDN: TQNPCF
For citation:
Gurevich A.P., Emelyanov I.V., Ionov M.V., Vanyurkin A.G., Chernyavsky M.A., Conradi A.O. Changes of vascular stiffness and central blood pressure after endovascular aneurysm repair in patients with hypertension. Results of one-year follow-up. Russian Journal of Cardiology. 2023;28(12):5645. (In Russ.) https://doi.org/10.15829/1560-4071-2023-5645. EDN: TQNPCF
На сегодняшний день из всех инвазивных методик лечения аневризм нисходящего грудного (АНГА) и брюшного отделов аорты (АБА) все чаще отдается предпочтение эндоваскулярной изоляции аневризмы аорты ((thoracic) endovascular aneurysm repair, (T) EVAR), а не открытому типу вмешательства [1]. Это связано с малой травматичностью, низким периоперационным риском на фоне совершенствующихся технологий доставки графтов и их материалов [2][3]. Среди различных групп пациентов у (T)EVAR наиболее высокий класс доказательств у пожилых, больных с высоким сердечно-сосудистым риском и коморбидностью [4]. Расширяется доказательная база (T)EVAR и для пациентов относительно молодого возраста [5]. На современном этапе развития подобные процедуры выгодно отличаются от открытых за счет высокой краткосрочной результативности [1].
Судя по опубликованным данным, изначальные преимущества (T)EVAR с течением времени частично утрачиваются, высокий риск сердечно-сосудистых осложнений (ССО) сохраняется [4]. Причины снижения отдаленной эффективности (T)EVAR не вполне ясны. Были предложены различные объяснения: у большинства пациентов с аневризмой аорты (АА) часто выявляются ассоциированные сердечно-сосудистые заболевания, продолжается экспозиция значимых факторов сердечно-сосудистого риска [6]. Одними из ключевых таких факторов у данной когорты пациентов считаются артериальная жесткость и артериальная гипертензия (АГ).
Неинвазивная оценка каротидно-феморальной скорости распространения пульсовой волны (кфСРПВ), а также систолического центрального артериального давления (ЦАД), центрального пульсового давления, индекса аугментации (AIx) вполне доступна, методики воспроизводимы и широко используются если не в рутинной, то исследовательской работе. Известно, что повышенная артериальная жесткость (оцениваемая по показателю кфСРПВ) является независимым предиктором ССО [7]. Предполагается, что изменения биомеханических свойств аорты и уменьшение ее податливости после (T)EVAR непосредственно влияют на гемодинамику в аорте [8]. Однако доказательная база воздействия (T)EVAR на морфологию центральной пульсовой волны ограничена небольшим количеством исследований с весьма противоречивыми результатами. Неоднозначны и данные об изменениях изначально повышенных значений кфСРПВ после выполнения (T)EVAR в долгосрочной перспективе [9-14]. Особое внимание исследователей уделяется жесткости стенки аорты и особенностям отраженной волны как модуляторам изменения структуры и функции миокарда левого желудочка у пациентов после (T)EVAR [15].
Таким образом, представляется актуальной динамическая оценка изменений ключевых показателей центральной гемодинамики и их взаимосвязи с параметрами глобальной артериальной жесткости после имплантации эндопротеза.
Цель исследования состояла в оценке динамики показателей артериальной жесткости и ЦАД, и определении потенциально влияющих на нее факторов у пациентов с АНГА/АБА, в сочетании с АГ, через 1 год после эндоваскулярной изоляции аневризмы.
Материал и методы
Исследование было наблюдательным, проспективным в одной группе на базе ФГБУ "НМИЦ им. В. А. Алмазова" Минздрава России. Проводилось в соответствии со стандартами надлежащей клинической практики (Good Clinical Practice) и положениями Хельсинкской декларации (2013г пересмотра). Протокол исследования, индивидуальная регистрационная карта пациента, информационный листок и форма информированного согласия пациента были одобрены локальным этическим комитетом (протокол № 7/22 от 11.07.2022).
Критерии включения:
- пациенты обоего пола в возрасте от 18 лет и старше;
- установленный диагноз эссенциальной АГ;
- установленный диагноз АА.
Всем пациентам выполнялась мультиспиральная компьютерная ангиография с применением контрастного вещества (йопромид).
Показания для выполнения (T)EVAR соответствовали клиническим рекомендациям профильных сообществ:
- диаметр АНГА от ≥55 мм;
- диаметр АБА ≥45-50 мм у женщин и ≥50-55 мм у мужчин, в зависимости от степени риска периоперационных осложнений; прогрессирующий рост бессимптомной АА >10 мм в год;
- при мешотчатой АА — вне зависимости от ее диаметра [16].
Критерии невключения:
- анамнез значимых сердечно-сосудистых и внесердечных заболеваний в острой и подострой форме (>6 мес. от возникновения или последнего рецидива/обострения);
- наличие клинически значимых нарушений ритма сердца и проводимости;
- наличие имплантированных внутрисердечных устройств;
- ранее проведенные вмешательства (открытого типа или эндоваскулярные) на любом участке аорты;
- хроническая болезнь почек С4 стадии и выше;
- системные заболевания соединительной ткани.
С пациентами через 12 мес. проводился телефонный или очный контакт. Оценку периферического артериального давления (АД) и ЦАД, артериальной жесткости проводили пациентам перед оперативным лечением, а также при контрольном очном осмотре через 12 мес.
Измерение периферического АД и частоты сердечных сокращений (ЧСС) проводили в положении пациента сидя после пятиминутного отдыха осциллометрическим автоматическим тонометром AND UA-651 BLE (AND, Япония) с плечевой манжетой, соответствующей окружности плеча. Выполняли 3 последовательных измерения на доминантной руке с интервалом в 1-2 мин, рассчитывали средние значения систолического АД (САД), диастолического АД (ДАД) и ЧСС из двух последних измерений.
Для оценки артериальной жесткости и ЦАД использовался метод аппланационной тонометрии (SphygmoCor (AtCor Medical, Австралия)), валидированный для популяции пациентов с АА [17]. Исследование проводилось в положении пациента сидя. Регистрация пульсовой волны на лучевой артерии осуществлялась с помощью высокоточного пьезоэлектрического датчика Миллара (Millar Instruments, США) в течение ~10 сек после получения изображения сфигмограммы с постоянной формой. Определялись также: индекс аугментации (AIx, соотношение амплитуд прямой и отраженной пульсовой волн по отношению к пульсовому давлению в аорте, выраженное в %), скорректированный по стандартной ЧСС 75 уд./мин; давление в точке максимума подъема прямой пульсовой волны ЦАД (PT1h); время возврата отраженной волны (Тr); давление аугментации; амплификация САД (модуль разности периферического САД и центрального САД).
Далее определялась кфСРПВ: в положении пациента лежа на спине последовательно регистрировалась пульсовая волна на правой сонной и бедренной артериях. Сфигмограмма была синхронизирована с зубцом R на поверхностной электрокардиограмме, расчет показателя основывался на времени, необходимом для прохождения прямой волны кровотока между точками ее регистрации [7].
Статистический анализ. Количественные переменные представлены в виде среднего и среднеквадратичного отклонения (М (SD)), 95% доверительного интервала (ДИ), или же медианы (Ме) и межквартильного размаха (IQR). Проверка согласия распределения количественных показателей с Гауссовым проводилась при помощи критерия Шапиро-Уилка.
В случае соответствия данных нормальному распределению значимость различий между переменными осуществлялась согласно критерию t-Стьюдента, в противном случае — по критериям U-Манна-Уитни или Уилкоксона. Сравнения категориальных переменных выполнялись с использованием χ²-теста и теста Мак-Немара (для связанных выборок). Пропущенные данные исключались попарно.
Для оценки степени и значимости корреляционной связи между количественными переменными вычислялся двусторонний линейный коэффициент корреляции Пирсона или Спирмена (в зависимости от типа распределения данных). Для оценки зависимостей друг от друга некоторых количественных переменных, представляющих практический интерес, проводился линейный регрессионный анализ. С учетом размера выборки в модель включалось не более трех независимых переменных при учете отсутствия коллинеарности между ними. Переменные включались на основании анализа литературных источников, априорных логических предположений, патофизиологии изучаемых процессов, пошаговым способом с расчетом наилучшего значения R² модели.
Различия показателей считались статистически значимыми при значениях р<0,05. Все этапы статистической обработки данных были проведены с использованием программного пакета SPSS Statistics ver. 23.0 (IBM Corp., США).
Результаты
Общий дизайн исследования представлен на рисунке 1. Изначально было включено 50 пациентов (средний возраст 68±9 лет, 41 мужчина) с длительным анамнезом АГ (медиана 10 (IQR (6; 15) лет)) и ранее диагностированной АА, госпитализированных для плановой (T)EVAR в клинику ФГБУ "Национальный медицинский исследовательский центр им. В. А. Алмазова" Минздрава России в период 2017-2021гг. Исходная клинико-демографическая характеристика пациентов представлена в таблице 1.
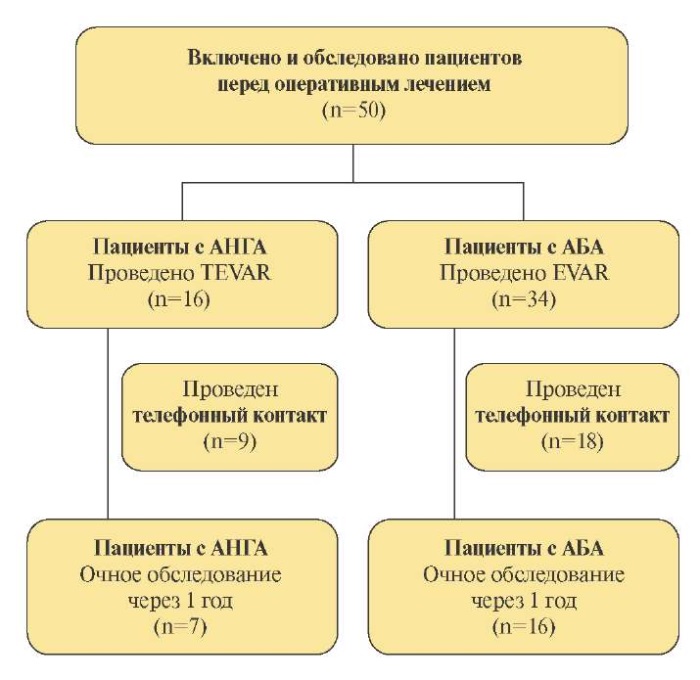
Рис. 1. Ход исследования.
Сокращения: АБА — аневризма брюшной аорты,
АНГА — аневризма нисходящей грудной аорты,
EVAR — эндоваскулярная изоляция брюшной аорты стент-графтом,
TEVAR — эндоваскулярная изоляция грудной аорты стент-графтом.
Таблица 1
Клинико-демографическая характеристика включенных пациентов (n=50)
|
Показатели, n (%); M±SD; Me (Q 25%; 75%) |
Значения |
|
Возраст, годы |
68±9 |
|
Пол: мужчины, n (%) |
41 (82) |
|
Индекс массы тела, кг/м² |
28,4 (25,4; 31,3) |
|
Курение, n (%) |
26 (52) |
|
Длительность анамнеза АГ, годы |
10 (6; 15) |
|
ИБС, n (%) |
36 (72) |
|
ИМ, n (%) |
10 (20) |
|
ОНМК, n (%) |
5 (10) |
|
Сахарный диабет тип 2, n (%) |
9 (18) |
|
ХБП, n (%) |
2 (4) |
|
Медикаментозная терапия |
|
|
Бета-адреноблокаторы, n (%) |
38 (76) |
|
иАПФ или БРАII, n (%) |
44 (88) |
|
Блокаторы кальциевых каналов, n (%) |
14 (28) |
|
Диуретики, n (%) |
5 (10) |
|
Моно-/комбинированная антигипертензивная терапия, n (%) |
12 (24)/38 (76) |
|
Ингибиторы ГМГ-КоА-редуктазы (статины), n (%) |
47 (94) |
|
АСК, n (%) |
49 (98) |
|
Характеристика и количество выполненных операций в зависимости от локализации аневризмы |
|
|
Эндопротезирование нисходящей грудной аорты |
16 (32) |
|
Эндопротезирование брюшной аорты |
34 (68) |
|
Длина стент-графта, мм |
148±49 |
Сокращения: АГ — артериальная гипертензия,
АСК — препараты ацетилсалициловой кислоты в кишечно-растворимой оболочке,
БРАII — блокаторы рецепторов ангиотензина II,
иАПФ — ингибиторы ангиотензинпревращающего фермента,
ИБС — ишемическая болезнь сердца,
ИМ — инфаркт миокарда,
ОНМК — острое нарушение мозгового кровообращения,
ТИА — транзиторная ишемическая атака,
ХБП — хроническая болезнь почек.
По результатам измерения АД на плечевой артерии врачом, контроль АГ (АД <140 и <90 мм рт.ст.) при включении был достигнут у 23 пациентов, — изолированная систолическая АГ была выявлена у 12 пациентов, изолированное повышение ДАД — у одного больного, и стабильно систоло-д иастолическая АГ — у 14 пациентов.
Всем пациентам выполнено (T)EVAR стандартным пункционным доступом к общим бедренным артериям. Непосредственным техническим успехом считалось оптимальное позиционирование модулей графта и полная изоляция АА, оцениваемое при контрольной ангиографии. Среднее время наблюдения пациентов после выписки из стационара составило 12±1 мес. Из 50 включенных спустя 1 год после (T)EVAR у 23 больных был проведен очный визит. Пациенты группы очного наблюдения не отличались от общей группы по клинико-демографическим характеристикам.
Показатели гемодинамики и сосудистой жесткости исходно и через год после (T)EVAR представлены в таблице 2. Было выявлено увеличение кфСРПВ через 1 год после выполнения (T)EVAR по сравнению с исходными показателями. Разность средних составила 2,6 м/с (95% ДИ: 1,3-3,3, р<0,001) независимо от локализации эндопротеза: 2,9 м/с (95% ДИ: -0,1-5,8, р<0,05) в подгруппе TEVAR и 2,0 м/с (95% ДИ: 0,83,2, р=0,002) в подгруппе EVAR (рмежгрупповая=0,504). После операции повышение кфСРПВ, по сравнению с возрастными референсными значениями [7], зафиксировано у 20 больных. Выявлено повышение давления в PT1h через 1 год после операции (+5 мм + рт.ст. (95% ДИ: 1-10, р=0,026). Через год после вмешательства наблюдалось небольшое, но значимое повышение ЧСС по сравнению с исходной: разность средних составила 5 уд./мин (95% ДИ: 1-9, р=0,025).
Таблица 2
Динамика показателей периферического и ЦАД, артериальной жесткости
после эндоваскулярной изоляции АА (n=23)
|
Показатели, M±SD; Me (Q 25%; 75%) |
Исходно |
1 год после (T) EVAR |
Значение р |
|
Периферическое САД, мм рт.ст. |
140±16 |
147±17 |
0,191 |
|
Периферическое ДАД, мм рт.ст. |
81±10 |
80±12 |
0,721 |
|
Периферическое пульсовое давление, мм рт.ст. |
60±11 |
67±13 |
0,039 |
|
Центральное САД, мм рт.ст. |
130±16 |
135±16 |
0,299 |
|
Центральное ДАД, мм рт.ст. |
81±11 |
81±12 |
0,937 |
|
Центральное пульсовое давление, мм рт.ст. |
49±12 |
54±14 |
0,084 |
|
PT1h, мм рт.ст. |
34±7 |
39±8 |
0,026 |
|
Амплификация САД, мм рт.ст. |
8 (6; 13) |
11 (8; 15) |
0,026 |
|
Давление аугментации, мм рт.ст. |
15±9 |
16±9 |
0,484 |
|
Индекс аугментации, стандартизированный по ЧСС в 75 уд./мин, % |
27 (16; 35) |
25 (18; 31) |
0,922 |
|
Время возврата отраженной волны, мсек |
140 (131; 145) |
138 (133; 149) |
0,588 |
|
кфСРПВ, м/с |
11,1±2,1 |
13,4±2,5 |
<0,001 |
|
ЧСС, уд./мин |
64±9 |
68±11 |
0,025 |
Сокращения: ДАД — диастолическое артериальное давление,
САД — систолическое артериальное давление,
кфСРПВ — каротидно-феморальная скорость распространения пульсовой волны,
ЧСС — частота сердечных сокращений,
PT1h — величина давления в точке максимального подъема
центральной пульсовой волны,
(T)EVAR — эндоваскулярная изоляция аорты стент-графтом,
Tr — время возврата отраженной волны.
Наблюдалось значимое повышение периферического пульсового давления (∆ +7 мм рт.ст., р=0,039), но не центрального пульсового давления (р=0,08). Ни периферическое САД, ни центральное САД после операции, проанализированные по отдельности, значимо не изменились. Но к концу наблюдения различия между периферическим и центральным САД были значимо выше по сравнению с исходными показателями (∆ +3 мм рт.ст., р=0,026). Ни периферическое ДАД, ни центральное ДАД не изменились после имплантации стент-графта. Статистически значимых различий давления аугментации по сравнению с исходным выявлено не было (р=0,484).
Учитывая отсутствие значимых изменений AIx, по сравнению с исходными значениями, но широкую его вариабельность (исходно медиана AIx 27% (IQR (16%; 35%)), через 12 мес. медиана 25% (IQR (18%; 31%)) в общей группе, были проанализированы особенности отраженной волны, в зависимости от локализации АА. Изначально медианы AIx у пациентов с АНГА и с АБА существенно различались (8% (IQR (4; 14)) у пациентов с АНГА vs 32% (IRQ (26; 36)) у пациентов с АБА; р<0,001). Однако не было выявлено значимой динамики показателя AIx (p=0,9) через год, и повторно определенные значения также не различались в подгруппах пациентов АНГА и АБА (р=0,1 и р=0,3, соответственно). Тем не менее разность финальных и исходных показателей AIx между группами TEVAR и EVAR достигла статистической значимости (р=0,043), оказалась положительной и более выраженной в группе пациентов с АНГА (+4% vs -2% — при АБА).
Средняя длина стент-графта при АНГА значительно превышала таковую у больных с АБА (201±38 мм vs 124±33 мм; р=0,001). С учетом ранее описанного эффекта по изменению формы пульсовой волны и времени возникновения отдельных ее составляющих после хирургического лечения АА [18], зависимой переменной в регрессионном анализе стала разность времени возврата пульсовой волны (∆Tr), определенного исходно и через год после вмешательства. Регрессионный анализ выявил, что кроме разности ЧСС между финальным и исходным обследованиями (β=-0,52), длина имплантированного графта (β=0,42) в значительной степени определяет изменение переменной ∆Tr (R²=0,53, p=0,004).
Была выявлена средней силы положительная взаимосвязь между магнитудой изменений периферического САД, систолического ЦАД и кфСРПВ (r=0,658; р=0,002 и r=0,634; р=0,004, соответственно). Взаимосвязи между изменениями ЧСС и динамикой кфСРПВ не выявлено (р=0,488).
Через 12 мес. ото всех пациентов (n=50) получена информация относительно случившихся ССО. В течение 1 года после (T)EVAR у 6 участников исследования наступили осложнения. Один пациент скончался (сердечная смерть), у 5 случились нефатальные ССО: инфаркт миокарда у одного пациента, нестабильная стенокардия — у одного, острое нарушение мозгового кровообращения — у одного, острая декомпенсированная сердечная недостаточность — у одного, и фибрилляция предсердий de novo также у одного включенного больного.
Обсуждение
Было показано, что в отдаленном послеоперационном периоде повышаются периферическое пульсовое давление, ЧСС и кфСРПВ по сравнению с исходными значениями. Однако ЦАД и AIx значимо не изменились. Найдена зависимость разности финальных и исходных показателей Tr от длины имплантированного стент-графта, а также более длительный возврат пульсовой волны определялся у пациентов с более низкой конечной, нежели предоперационной, ЧСС.
До операции у 21 пациента кфСРПВ уже была выше референсных значений [7], практически у половины пациентов отсутствовал контроль АГ. При обследовании через 1 год после (T)EVAR кфСРПВ сохранялась повышенной по сравнению с исходными значениями, что соответствует результатам других исследований [9-14]. Ранее было показано увеличение кфСРПВ через 6 мес. после TEVAR на небольшой выборке пациентов с АНГА [9]. Что касается АБА, то по данным Lantelme P, et al. (2009) [10] и Lee CW, et al. (2013) [11] было выявлено повышение кфСРПВ через 1 мес. после EVAR. Исследовательская группа Kadoglou NPE выявила долгосрочное повышение данного показателя через 6-12 мес. после операции [12][13].
До настоящего времени окончательно невыясненным остается вопрос о том, что влияет на повышение кфСРПВ: установка более жестких эндоваскулярных конструкций, заметное уменьшение объема расширенного участка аорты после его изоляции из кровотока, или их сочетание. Повышение жесткости аорты и нарушение растяжимости ее стенки после эндопротезирования может способствовать снижению демпфирующей функции, поскольку ни один из используемых в настоящее время стент-г рафтов не обладает способностью к продольному расширению. Это может вызывать дисбаланс в растяжимости стентированного и интактного отделов аорты по данным экспериментальных исследований [19], что приводит к усилению продольной деформации, увеличению напряжения в стенке аорты и повышению АД проксимальнее изолированной зоны.
В настоящей работе также установили нарушение демпфирования пульсовой волны у пациентов после (T)EVAR, что подтверждается повышением уровня PT1h спустя 12 мес. после операции. Мы предполагаем, что выявленное изменение формы центральной пульсовой волны может способствовать дальнейшему ремоделированию аорты, объяснять выявленное в клинических исследованиях возрастание постнагрузки на миокард левого желудочка при артифициальном снижении эластичности аорты [5][15].
В некоторых исследованиях высказывалось предположение, что (T)EVAR приведет к тому, что отраженная пульсовая волна будет возвращаться к сердцу раньше и с увеличенной амплитудой из-за возникновения дополнительной точки ее отражения в непосредственной близости от сердца, повышая и ЦАД, и AIx. Хотя эта гипотеза и подтвердилась на компьютерных моделях, при переходе от экспериментов к клиническим исследованиям значимых изменений AIx после операции не обнаружилось [14]. Мы также исследовали динамику AIx у пациентов в отдаленном периоде после (T)EVAR и показали отсутствие изменений показателя в общей группе пациентов. Однако наблюдались статистически значимые различия ∆AIx между подгруппами TEVAR и EVAR: у пациентов с АНГА показатель AIx возрос, а у пациентов с АБА оказался чуть ниже исходных значений. Наши результаты не позволяют полностью исключить вышеуказанную гипотезу из научной повестки, однако необходимы дальнейшие исследования с более крупными выборками больных.
В настоящей работе установлено, что имплантация более длинного стент-г рафта сопровождается увеличением времени возврата отраженной волны. Вероятнее всего это происходит в результате уменьшения скорости и амплитуды отраженной волны, и, следовательно, снижения их влияния на суммирующую пульсовую волну, что было ранее продемонстрировано в экспериментальных и клинических исследованиях [18][20]. Повышение скорости потока крови в аорте при изоляции аневризмы более длинным стент-графтом, возможно, приводит к компенсаторной вазодилатации периферических артерий, вызывающей снижение амплитуды и/или скорости отраженной волны. Изменения Tr следует рассматривать в тесной связи с другими параметрами гемодинамики, прежде всего, АД и ЧСС. Включив все 3 показателя в регрессионную модель, лишь более низкие показатели ЧСС к году послеоперационного наблюдения и протяженность стент-графта оказывали наибольший эффект на увеличение времени возврата отраженной пульсовой волны. Факт сильной зависимости Tr от снижения ЧСС может иметь важное значение для оценки эффективности медикаментозного лечения после (T)EVAR в отношении артериальной жесткости, однако в данной работе мы не проводили подробного анализа влияния медикаментозной терапии (в частности, приема бета-адреноблокаторов и их дозировок) на Tr.
При исследовании динамики АД после (T)EVAR мы показали, что рост периферического пульсового давления через 1 год после операции реализовывался преимущественно за счет более отчетливого повышения периферического САД в динамике. Однако динамики абсолютных значений периферического САД до операции и спустя 1 год не наблюдалось, т. е. можно говорить лишь о тенденции. Существенного увеличения систолического и пульсового ЦАД в отдаленном послеоперационном периоде не произошло, что также соответствует данным литературы [14]. Известно, что пульсовая волна, распространяясь дистальнее аорты по магистральным артериям, амплифицируется. Поэтому не вызывает удивления наблюдаемое нами более выраженное повышение периферического нежели центрального пульсового давления после операции.
Нами также была показана положительная корреляция между магнитудой изменений кфСРПВ, периферического и центрального САД в отдаленном периоде после операции в общей группе пациентов, что говорит о тесной взаимосвязи увеличения глобальной артериальной жесткости и повышения САД при АГ.
Частота развития ССО у больных через год после (T)EVAR была невысокой — 6 из 50 (12%), из них 1 (2%) — фатальное. Sharples L, et al. в 2022г опубликовали результаты 12-мес. наблюдения 150 пациентов после TEVAR, летальность составила 17,5% [21]. Оценить связи ССО с показателями центральной гемодинамики, сосудистой жесткости в нашем исследовании затруднительно в связи с его ограничениями.
Ограничения исследования. Исследование носит наблюдательный характер, нет группы сравнения, а выборка пациентов — небольшая. Объективный осмотр удалось провести менее чем у половины включенных пациентов. Длительность наблюдения ограничена 12 мес., поэтому долгосрочную прогностическую значимость динамики кфСРПВ и АД оценить невозможно.
Заключение
Имплантация эндопротеза в аорту сопровождается повышением кфСРПВ вне зависимости от локализации аневризмы в течение 1 года. Морфологические изменения центральной волны давления после изоляции АА, обусловленные повышением PT1h, потенциально могут отражать снижение растяжимости аорты и ухудшение ее демпфирующей функции. Отсутствие значимой динамики ЦАД и AIх, вероятно, объясняется особенностями отраженной волны. Предиктором увеличения времени возврата отраженной волны после (T)EVAR является урежение ЧСС и имплантация более протяженных стент-графтов.
Отношения и деятельность. Исследование выполнено за счет гранта Российского научного фонда (соглашение № 23-25-00272 от 12.01.2023).
Список литературы
1. Шломин В. В., Бондаренко П.Б., Гусинский А. В. и др. Двадцатилетний опыт лечения аневризм и расслоений грудной и торакоабдоминальной аорты без использования искусственного кровообращения. Кардиология И Сердечно-Сосудистая Хирургия. 2021;14(4):266-75. doi:10.17116/kardio202114041266.
2. Чернявский М.А., Жердев Н.Н., Чернова Д.В. и др. Случай гибридного хирургического лечения мешотчатой аневризмы дуги аорты у пациента с впервые выявленной коарктацией аорты. Российский кардиологический журнал. 2018;(11):130-2. doi:10.15829/1560-4071-2018-11-130-132.
3. Sveinsson M, Sonesson B, Kristmundsson T, et al. Long-term outcomes after fenestrated endovascular aortic repair for juxtarenal aortic aneurysms. J Vasc Surg. 2022;75:1164-70. doi:10.1016/j.jvs.2021.11.050.
4. Patel R, Powell JT, Sweeting MJ, et al. The UK EndoVascular Aneurysm Repair (EVAR) randomised controlled trials: long-term follow-up and cost-effectiveness analysis. Health Technol Assess Winch Engl. 2018;22:1-132. doi:10.3310/hta22050.
5. Kamenskiy A, Aylward P, Desyatova A, et al. Endovascular Repair of Blunt Thoracic Aortic Trauma is Associated With Increased Left Ventricular Mass, Hypertension, and Off-target Aortic Remodeling. Ann Surg. 2021;274:1089-98. doi:10.1097/SLA.0000000000003768.
6. Kessler V, Klopf J, Eilenberg W, et al. AAA Revisited: A Comprehensive Review of Risk Factors, Management, and Hallmarks of Pathogenesis. Biomedicines. 2022;10:94. doi:10.3390/biomedicines10010094.
7. Reference Values for Arterial Stiffness' Collaboration. Determinants of pulse wave velocity in healthy people and in the presence of cardiovascular risk factors: "establishing normal and reference values". Eur Heart J. 2010;31:2338-50. doi:10.1093/eurheartj/ehq165.
8. Rovas G, Bikia V, Stergiopulos N. Design and computational optimization of compliance-matching aortic grafts. Front Bioeng Biotechnol. 2023;11:1179174. doi:10.3389/fbioe.2023.1179174.
9. Moulakakis KG, Kadoglou NPE, Antonopoulos CN, et al. Changes in Arterial Stiffness and N-terminal pro-brain natriuretic peptide Levels after Endovascular Repair of Descending Thoracic Aorta. Ann Vasc Surg. 2017;38:220-6. doi:10.1016/j.avsg.2016.04.025.
10. Lantelme P, Dzudie A, Milon H, et al. Effect of abdominal aortic grafts on aortic stiffness and central hemodynamics. J Hypertens. 2009;27:1268-76. doi:10.1097/HJH.0b013e3283299b22.
11. Lee CW, Sung SH, Chen CK, et al. Measures of carotid-femoral pulse wave velocity and augmentation index are not reliable in patients with abdominal aortic aneurysm. J Hypertens. 2013;31:1853-60. doi:10.1097/HJH.0b013e328362360a.
12. Kadoglou NPE, Moulakakis KG, Papadakis I, et al. Changes in Aortic Pulse Wave Velocity of Patients Undergoing Endovascular Repair of Abdominal Aortic Aneurysms. J Endovasc Ther. 2012;19:661-6. doi:10.1583/JEVT-12-3916MR.1.
13. Kadoglou NPE, Moulakakis KG, Papadakis I, et al. Differential effects of stent-graft fabrics on arterial stiffness in patients undergoing endovascular aneurysm repair. J Endovasc Ther Off J Int Soc Endovasc Spec. 2014;21:850-8. doi:10.1583/14-4772MR.1.
14. Holewijn S, Vermeulen JJM, van Helvert M, et al. Changes in Noninvasive Arterial Stiffness and Central Blood Pressure After Endovascular Abdominal Aneurysm Repair. J Endovasc Ther Off J Int Soc Endovasc Spec. 2021;28:434-41. doi:10.1177/15266028211007460.
15. van Bakel TMJ, Arthurs CJ, Nauta FJH, et al. Cardiac remodelling following thoracic endovascular aortic repair for descending aortic aneurysms. Eur J Cardio-Thorac Surg Off J Eur Assoc Cardio-Thorac Surg. 2019;55:1061-70. doi:10.1093/ejcts/ezy399.
16. Isselbacher EM, Preventza O, Hamilton Black J, et al. 2022 ACC/AHA guideline for the diagnosis and management of aortic disease: A report of the American Heart Association/ American College of Cardiology Joint Committee on Clinical Practice Guidelines. J Thorac Cardiovasc Surg. 2023:S0022-5223(23)00347-1. doi:10.1016/j.jtcvs.2023.04.023.
17. Holewijn S, Vermeulen JJM, van Helvert M, et al. Validation of Central Pressure Estimation in Patients with an Aortic Aneurysm Before and After Endovascular Repair. Cardiovasc Eng Technol 2022;13:265-78. doi:10.1007/s13239-021-00574-3.
18. Takano T, Iwai-Takano M, Tsuboko Y, et al. Reflected wave intensity increases based on aortic diameter after endovascular aortic therapy in a goat model. Sci Rep. 2021;11:3830. doi:10.1038/s41598-020-80920-y.
19. Bianchi D, Conti M, Bissacco D, et al. Impact of thoracic endovascular aortic repair on aortic biomechanics: Integration of in silico and ex vivo analysis using porcine model. Int J Numer Method Biomed Eng. 2023;39(4):e3594. doi:10.1002/cnm.3594.
20. Salvi L, Alfonsi J, Grillo A, et al. Postoperative and mid-term hemodynamic changes after replacement of the ascending aorta. J Thorac Cardiovasc Surg. 2022;163:1283-92. doi:10.1016/j.jtcvs.2020.05.031.
21. Sharples L, Sastry P, Freeman C, et al. Endovascular stent grafting and open surgical replacement for chronic thoracic aortic aneurysms: a systematic review and prospective cohort study. Health Technol Assess Winch Engl. 2022;26:1-166. doi:10.3310/ABUT7744.
Об авторах
А. П. ГуревичРоссия
Гуревич Александра Павловна — м.н.с. научно-исследовательской лаборатории патогенеза и терапии артериальной гипертензии научно-исследовательского отдела "Артериальная гипертензия"
Санкт-Петербург
Конфликт интересов:
Нет
И. В. Емельянов
Россия
Емельянов Игорь Витальевич — к.м.н., с.н.с. научно-исследовательской лаборатории патогенеза и терапии артериальной гипертензии научно-исследовательского отдела "Артериальная гипертензия"
Санкт-Петербург
Конфликт интересов:
Нет
М. В. Ионов
Россия
Ионов Михаил Васильевич — к.м.н., н.с. научно-исследовательской лаборатории патогенеза и терапии артериальной гипертензии научно-исследовательского отдела "Артериальная гипертензия"
Санкт-Петербург
Конфликт интересов:
Нет
А. Г. Ванюркин
Россия
Ванюркин Алмаз Гафурович — н.с. НИО сосудистой и интервенционной хирургии, сердечно-сосудистый хирург
Санкт-Петербург
Конфликт интересов:
Нет
М. А. Чернявский
Россия
Чернявский Михаил Александрович — д.м.н., зав. научно-исследовательского отдела сосудистой и интервенционной хирургии
Санкт-Петербург
Конфликт интересов:
Нет
А. О. Конради
Россия
Конради Александра Олеговна — д.м.н., академик Российской академии наук, зам. генерального директора по научной работе
Санкт-Петербург
Конфликт интересов:
Нет
Дополнительные файлы
- У пациентов с артериальной гипертензией и аневризмой аорты после выполнения эндоваскулярной изоляции аневризмы аорты вне зависимости от ее локализации значимо увеличивается каротидно-феморальная скорость распространения пульсовой волны.
- После выполнения эндопротезирования аорты изменяется форма центральной пульсовой волны, отражая снижение растяжимости стенки аорты и ухудшение функции демпфирования.
- Имплантация более протяженных стент-графтов, а также более низкая частота сердечных сокращений после операции приводит к увеличению времени возврата отраженной пульсовой волны.
Рецензия
Для цитирования:
Гуревич А.П., Емельянов И.В., Ионов М.В., Ванюркин А.Г., Чернявский М.А., Конради А.О. Динамика сосудистой жесткости и центрального артериального давления после эндоваскулярной изоляции аневризмы аорты у пациентов с артериальной гипертензией. Результаты годичного наблюдения. Российский кардиологический журнал. 2023;28(12):5645. https://doi.org/10.15829/1560-4071-2023-5645. EDN: TQNPCF
For citation:
Gurevich A.P., Emelyanov I.V., Ionov M.V., Vanyurkin A.G., Chernyavsky M.A., Conradi A.O. Changes of vascular stiffness and central blood pressure after endovascular aneurysm repair in patients with hypertension. Results of one-year follow-up. Russian Journal of Cardiology. 2023;28(12):5645. (In Russ.) https://doi.org/10.15829/1560-4071-2023-5645. EDN: TQNPCF
JATS XML

















































