Перейти к:
Оценка уровня N-концевого промозгового натрийуретического пептида у пациентов с аритмией на фоне недифференцированной дисплазии соединительной ткани
https://doi.org/10.15829/1560-4071-2023-5641
EDN: QLTPNO
Аннотация
Цель. Изучить взаимосвязь уровня N-концевого промозгового натрийуретического пептида (NT-proBNP) с морфофункциональными изменениями миокарда у пациентов с нарушениями ритма сердца на фоне недифференцированной дисплазии соединительной ткани (НДСТ).
Материал и методы. В одномоментное сравнительное исследование включены пациенты молодого и среднего возраста с аритмическим синдромом на фоне НДСТ: группа 1 (18-44 лет, n=127), группа 3 (45-59 лет, n=10). В группы контроля (n=30, группа 2; n=8, группа 4) включены добровольцы с единичными фенотипическими признаками НДСТ, сопоставимые по возрасту и полу. Выполнено стандартное клиническое обследование, 72-часовое мониторирование электрокардиограммы, Speckle-tracking эхокардиография, оценка уровня NT-proBNP.
Результаты. У пациентов 1 и 3 групп отмечено статистически значимое повышение концентрации NT-proBNP по сравнению с группами контроля. При этом средний уровень NT-proBNP в исследуемых группах не превышал референсных значений. Выявлены достоверные корреляционные связи между NT-proBNP и частотой сердечных сокращений (r1=0,462, p=0,010; r3=0,397, p=0,034), уровнем диагностического порога НДСТ (r1=0,496, p=0,001; r3=0,401, p=0,043), наличием пролапса митрального клапана (r1=0,469, p=0,002) и митральной регургитации (r1=0,53, p=0,008), желудочковой экстрасистолией (ЖЭС) III (r1=0,582, p=0,045), IVa (r1=0,39, p=0,042) и V классов (r1=0,397, p=0,037); сердечным индексом (r1=-0,329, p=0,037) и фракцией выброса (r1=-0,407, p=0,044). Однако достоверной корреляции между глобальной продольной деформацией левого желудочка с уровнем NT-proBNP не выявлено.
Заключение. В исследовании продемонстрирована ассоциация уровня NTproBNP с диагностическим порогом НДСТ, пролапсом митрального клапана, митральной регургитацией, ЖЭС, что позволяет использовать данный биомаркер в качестве дополнительного диагностического критерия изменения сердечной мышцы на фоне НДСТ.
Для цитирования:
Логинова Е.Н., Нечаева Г.И., Дакуко А.Н., Богатырев И.В., Потапов В.В., Кириченко Н.А., Шарун И.В. Оценка уровня N-концевого промозгового натрийуретического пептида у пациентов с аритмией на фоне недифференцированной дисплазии соединительной ткани. Российский кардиологический журнал. 2023;28(11):5641. https://doi.org/10.15829/1560-4071-2023-5641. EDN: QLTPNO
For citation:
Loginova E.N., Nechaeva G.I., Dakuko A.N., Bogatyrev I.V., Potapov V.V., Kirichenko A.N., Sharun I.V. Assessment of N-terminal pro-brain natriuretic peptide in patients with arrhythmia due to undifferentiated connective tissue disease. Russian Journal of Cardiology. 2023;28(11):5641. (In Russ.) https://doi.org/10.15829/1560-4071-2023-5641. EDN: QLTPNO
За последнее десятилетие в России отмечается рост внезапной сердечной смерти (ВСС), в т.ч. среди лиц молодого, трудоспособного возраста; ведущим механизмом развития ВСС у молодых признаны нарушения ритма и проводимости сердца [1]. Такая же тенденция характерна и для пациентов с недифференцированной дисплазией соединительной ткани (НДСТ), распространенность которой в общей популяции достигает 1:5 [1][2]. Морфологическое исследование миокарда жертв ВСС аритмического генеза у пациентов с фенотипическими проявлениями НДСТ продемонстрировало неравномерную гипертрофию и атрофию отдельных кардиомиоцитов с периваскулярным разрастанием рыхлой соединительной ткани (субклинический фиброз), что, возможно, служит основой электрической нестабильности миокарда [3]. При этом в популяционном мультиэтническом исследовании (MESA Study) была выявлена взаимосвязь между фиброзом миокарда (подтвержденным при магнитно-резонансной томографии) и увеличением уровня N-концевого промозгового натрийуретического пептида (NT-proBNP), в т.ч. в когорте практически здоровых людей [4]. Бесспорно, наиболее важную роль NT-proBNP играет в скрининге, оценке эффективности терапии и прогнозировании риска развития осложнений хронической сердечной недостаточности (ХСН) [5]. Однако за последние годы накоплено достаточно объективных данных о прогностической роли NTproBNP у пациентов без клинических проявлений ХСН, включая бессимптомную патологию миокарда и синдром Марфана [6-9]. Ключевая роль в повышении биомаркера при наследственных нарушениях соединительной ткани реализуется через трансформирующий фактор роста бета (TGF-β), повышение которого встречается и при НДСТ [9][10]. Учитывая довольно высокую распространенность НДСТ, наличие начальных признаков фиброза миокарда у жертв внезапной аритмической смерти при НДСТ, а также данные о взаимосвязи уровня NT-proBNP с объемом миокардиального экстрацеллюлярного матрикса, целью настоящего исследования стало изучение взаимосвязи уровня NT-proBNP с морфофункциональными изменениями миокарда у пациентов с нарушениями ритма сердца на фоне НДСТ.
Материал и методы
Исследование выполнено в соответствии со стандартами надлежащей клинической практики (Good Clinical Practice) и принципами Хельсинкской декларации. Протокол исследования был одобрен локальным этическим комитетом ФГБОУ ВО ОмГМУ Минздрава России (Протокол № 7 от 06 апреля 2022г). До включения в исследование у всех участников получено Информированное согласие на участие в исследовании.
В течение 2022г в одномоментное сравнительное исследование, с учетом прогредиентного течения диспластического процесса, включали пациентов молодого и среднего возраста с аритмическим синдромом на фоне НДСТ, наблюдавшихся амбулаторно на базе университетской клиники ФГБОУ ВО ОмГМУ Минздрава России: группа 1 (18-44 лет, n=127), группа 3 (45-59 лет, n=10). В группы контроля включены добровольцы с единичными фенотипическими признаками НДСТ, сопоставимые по возрасту и полу: группа 2 (18-44 лет, n=30), группа 4 (45-59 лет, n=8). Критерии включения: указание на наличие аритмического синдрома в анамнезе; возраст 18-44 года (молодой возраст), 45-59 лет (средний возраст); наличие признаков НДСТ с показателем прогноза течения НДСТ >17 баллов [11]; добровольное информированное согласие пациента на участие в проведении исследования. Критерии невключения: наличие дифференцированных, наследственных синдромов дисплазии соединительной ткани (синдром Марфана, Элерса-Данло и т.д.); деформации скелета в результате травматических повреждений; наличие острых или обострение хронических соматических заболеваний; наличие заболеваний, способных оказать влияние на результаты исследования (артериальная гипертензия, ишемическая болезнь сердца, ХСН (в т.ч. с сохраненной фракцией выброса (ФВ) левого желудочка (ЛЖ)), пороки сердца, семейные формы нарушений липидного обмена, сахарный диабет, ожирение); алкоголизм, наркомания, использование препаратов, которые могут повлиять на результат исследования (кардиотоксические (химиотерапевтические) препараты, сакубитрил/валсартан, антиаритмические лекарственные средства); беременность и лактация; невыполнение пациентом протокола исследования.
Участникам всех групп исследования проведены сбор жалоб, анамнеза, физикальное обследование с определением индекса массы тела и индекса Варге, определение диагностического порога НДСТ [11]. Оценка сывороточного уровня NT-proBNP проводилась методом иммуноферментного анализа в Академическом центре лабораторной диагностики ФГБОУ ВО ОмГМУ Минздрава России. Нарушения сердечного ритма и проводимости были верифицированы с помощью электрокардиографии (ЭКГ) и 72-ч мониторирования ЭКГ. Кроме того, всем участникам исследования проведена трансторакальная эхокардиография и Speckle-tracking эхокардиография с определением изменений продольной деформации миокарда ЛЖ.
Статистический анализ полученных результатов проводили с помощью следующих пакетов для языка Python: SciPy, Pandas, Pyplot и Seaborn. Данные представлены в виде среднего арифметического (M) значения и стандартного отклонения средней (SD). Статистическую значимость различий определяли с использованием параметрического критерия t Стьюдента в случае нормального распределения признака, при несоблюдении последнего — критерия Манна-Уитни. Различия считались значимыми при p≤0,05. Значимость различий качественных показателей определяли с помощью критерия χ2 и точного критерия Фишера. Корреляционный анализ непрерывных признаков производился с помощью коэффициента корреляции Пирсона. Для корреляционного анализа качественных показателей использовался коэффициент Спирмена.
Исследование выполнено за счет гранта Российского научного фонда № 22-25-20100 "Оценка структурно-функциональных изменений миокарда у пациентов с недифференцированной дисплазией соединительной ткани, проживающих в Омске и Омской области" https://rscf.ru/project/22-25-20100/.
Результаты
В ходе исследования установлено, что для пациентов с аритмическим синдромом на фоне НДСТ характерны статистически значимо более низкие показатели индекса массы тела и индекса Варге на фоне более высокого диагностического порога НДСТ. Показатели частоты сердечных сокращений и артериального давления в исследуемых группах значимо не отличались, отмечалась склонность к гипотонии, особенно у пациентов с выраженной диспластической стигматизацией (табл. 1).
Статистически значимо чаще в группе пациентов молодого возраста с аритмическим синдромом отмечалось наличие пролапса митрального клапана (ПМК) и митральной регургитации (МР) по сравнению с участниками контрольной группы; в группах среднего возраста различия были статистически не значимы.
По данным 72-ч мониторирования ЭКГ у всех пациентов с аритмическим синдромом на фоне НДСТ выявлена наджелудочковая экстрасистолия. Частота встречаемости желудочковых экстрасистол (ЖЭС, согласно классификации (B. Lown и M.Wolf (1971), в модификации M.Ryan и сотр. (1975)) представлена в таблице 2.
На рисунке 1 представлена оценка глобальной продольной деформации ЛЖ в исследуемых группах. Несмотря на то, что медиана показателей продольного стрейна была в пределах нормальных значений, показатели у пациентов первой группы были статистически значимо ниже, чем в группе контроля. Среди участников среднего возраста получены подобные, но недостоверные отличия.
В ходе исследования отмечено статистически значимое повышение концентрации NT-proBNP у пациентов 1, 3 групп по сравнению с группами контроля (рис. 2). При этом в целом средний уровень содержания в сыворотке крови NT-proBNP не превышал референсных значений.
Учитывая влияние гормонального фона на уровень NT-proBNP, проведен анализ данных в зависимости от пола. Отмечены значимо более высокие показатели средних значений NT-proBNP у всех женщин исследуемых групп: 49,77 пг/мл у женщин vs 38,1 пг/мл у мужчин в группе 1 (p=0,037), 27,32 пг/мл у женщин vs 13,45 пг/мл у мужчин в группе 2 (p=0,044), 49,52 пг/мл у женщин vs 16,11 пг/мл у мужчин в группе 3 (p=0,036). В группе контроля 4 тенденция к увеличению биомаркера у женщин была статистически не значима. Тенденции к увеличению средних значений NT-proBNP с возрастом отмечено не было.
При проведении корреляционного анализа в группах пациентов с аритмическим синдромом на фоне НДСТ (r1—корреляции внутри группы 1, r3—корреляции внутри группы 3) выявлена прямая средней степени зависимости статистически значимая взаимосвязь уровня NT-proBNP: с частотой сердечных сокращений (r1=0,462, p=0,010; r3=0,397, p=0,034), с уровнем диагностического порога НДСТ (r1=0,496, p=0,001; r3=0,401, p=0,043), с наличием ПМК (r1=0,469, p=0,002) и МР (r1=0,53, p=0,008), с наличием ЖЭС III (r1=0,582, p=0,045), ЖЭС IVa (r1=0,39, p=0,042), V классов (r1=0,397, p=0,037); отмечена обратная слабой и средней степени зависимости статистически значимая взаимосвязь уровня NT-proBNP с сердечным индексом (r1=-0,329, p=0,037) и ФВ (r1=-0,407, p=0,044). Однако достоверной корреляции в целом между глобальной продольной деформацией ЛЖ с уровнем NT-proBNP не выявлено.
Таблица 1
Клинико-функциональная характеристика исследуемых групп
Параметры, ед. | Группа 1 (n=127) | Группа 2 (n=30) | Группа 3 (n=10) | Группа 4 (n=8) | р |
Средний возраст, годы | 30,82±8,17 | 34,13±6,87 | 50,10±3,24 | 54,00±3,85 | p1-2=0,426 p3-4=0,067 |
Пол: Ж/М, n (%) | 84/43 (66%/34%) | 21/9 (70%/30%) | 7/3 (70%/30%) | 5/3 (60%/40%) | p1-2=0,689 p3-4=0,786 |
ИМТ, кг/м2 | 18,75±1,47 | 21,42±1,96 | 21,12±2,42 | 24,35±1,55 | p1-2=0,001 p3-4=0,005 |
Индекс Варге | 1,57±0,15 | 2,10±0,23 | 1,61±0,23 | 1,89±0,15 | p1-2=0,001 p3-4=0,009 |
ДП НДСТ, баллы | 35,01±8,97 | 15,29±1,45 | 31,28±5,82 | 14,73±1,16 | p1-2=0,001 p3-4=0,001 |
ЧСС, уд./мин | 80,62±12,51 | 80,20±12,42 | 78,88±14,87 | 71,50±7,23 | p1-2=0,868 p3-4=0,054 |
САД, мм рт.ст. | 116,27±5,61 | 118,57±5,48 | 119,80±5,14 | 123,13±2,70 | p1-2=0,792 p3-4=0,118 |
ДАД, мм рт.ст. | 67,28±5,96 | 69,47±5,98 | 70,80±3,40 | 73,25±3,54 | p1-2=0,877 p3-4=0,055 |
СИ, л/мин/м2 | 2,537±0,531 | 2,836±0,698 | 2,388±0,473 | 2,79±0,907 | p1-2=0,365 p3-4=0,274 |
ФВ, % | 70,297±8,079 | 70,27±5,863 | 71,95±5,716 | 72,388±4,88 | p1-2=0,986 p3-4=0,866 |
ПМК, n (%) | 55 (43%) | 2 (7%) | 3 (30%) | 0 | p1-2=0,011 p3-4=0,114 |
Митральная регургитация, | 55 (43%) | 5 (17%) | 3 (30%) | 1 (12%) | p1-2=0,027 |
n (%) | p3-4=0,423 | ||||
Трикуспидальная | 44 (35%) | 8 (27%) | 5 (50%) | 1 (12%) | p1-2=0,407 |
регургитация, n (%) | p3-4=0,115 |
Примечание: данные в таблице указаны как среднее значение ± стандартное отклонение; p — статистическая значимость межгрупповых различий.
Сокращения: ДАД — диастолическое артериальное давление, ДП НДСТ — диагностический порог недифференцированной дисплазии соединительной ткани, ИМТ — индекс массы тела, ПМК — пролапс митрального клапана, САД — систолическое артериальное давление, СИ — сердечный индекс, ФВ — фракция выброса, ЧСС — частота сердечных сокращений.
Таблица 2
Частота встречаемости ЖЭС в 1 и 3 группах
Класс ЖЭС | Группа 1 (n=127) | Группа 3 (n=10) |
ЖЭС I класса, n (%) | 59 (46,50%) | 2 (20%) |
ЖЭС II класса, n (%) | 36 (28,30%) | 4 (40%) |
ЖЭС III класса, n (%) | 12 (9,50%) | 3 (30%) |
ЖЭС IVа класса, n (%) | 19 (14,70%) | 1 (10%) |
ЖЭС IVb класса, n (%) | 3 (2,40%) | — |
ЖЭС V класса, n (%) | 2 (1,60%) | — |
Сокращение: ЖЭС — желудочковая экстрасистолия.
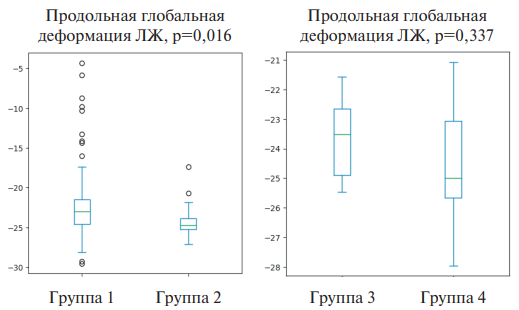
Рис. 1. Результаты исследования глобальной продольной деформации мио- карда в исследуемых группах.
Сокращение: ЛЖ — левый желудочек.
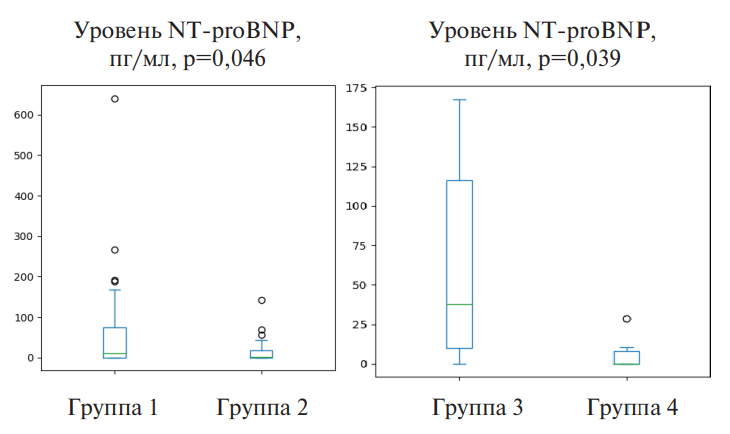
Рис. 2. Результаты исследования уровня NT-proBNP в исследуемых группах.
Сокращения: NT-proBNP — N-концевой промозговой натрийуретический пептид.
Обсуждение
Результаты ряда крупномасштабных исследований свидетельствуют о том, что даже незначительное повышение NT-proBNP может отражать начальную стадию сердечно-сосудистых заболеваний, что позволяет своевременно выявлять бессимптомных пациентов с формирующимся нарушением структуры и функции миокарда [5-7]. В нашем исследовании впервые при НДСТ была проведена оценка уровня NT-proBNP у пациентов с аритмическим синдромом на фоне НДСТ. Средний уровень данного маркера у участников исследования не превышал референсных значений (<125 пг/мл), при этом в 1 и 3 группах пациентов отмечены статистически значимо более высокие концентрации в сыворотке крови данного биомаркера, что может свидетельствовать о начальных этапах периваскулярного разрастания соединительной ткани в миокарде [3]. На наш взгляд, следует учитывать более высокий уровень NT-proBNP у пациентов с аритмическим синдромом на фоне НДСТ, по сравнению с группами контроля, поскольку в исследовании MESA-Study была выявлена прямая корреляционная зависимость между повышением уровня NT-proBNP (начиная с 10 пг/мл) и фракцией внеклеточного объема миокарда, подтвержденной при магнитнорезонансной томографии [4]. Отсутствие в исследуемых группах достоверной корреляции между уровнем NT-proBNP и глобальной продольной деформацией ЛЖ (коррелирующей со степенью миокардиального фиброза по данным Lisi M, et al. (2022) [12]), по нашему мнению, не исключает ранней доклинической стадии формирования фиброза миокарда.
В то же время выявленная в группе 1 статистически значимая взаимосвязь уровня NT-proBNP с частотой сердечных сокращений, величиной диагностического порога НДСТ, наличием ЖЭС высоких градаций согласуется с данными исследования Schaeffer BN, et al. (2015), продемонстрировавшего предиктивную роль биомаркера в отношении ранней диагностики желудочковых нарушений ритма у пациентов с наследственными нарушениями соединительной ткани [9]. Наличие в группе 1 статистически значимой взаимосвязи уровня NT-proBNP с сердечным индексом и ФВ подтверждает данные Johl MM, et al. (2017) и позволяет предположить наличие у пациентов с аритмическим синдромом на фоне НДСТ ранней стадии снижения сократительной функции миокарда [13]. Кроме того, установлена прямая средней степени зависимости статистически значимая взаимосвязь уровня NT-proBNP с наличием ПМК и МР в группе 1, что, по-видимому, связано с механическим влиянием пролабирующих створок на миокард и гемодинамическими нарушениями. При этом в исследовании Gallo G, et al. (2020) была отмечена худшая выживаемость пациентов с МР и уровнем NTproBNP >31 пг/мл, не превышающим общепринятых референсных значений [14]. В исследовании Park SJ, et al. (2017) даже у пациентов с сохранной ФВ на фоне МР при повышении уровня NT-proBNP отмечен неблагоприятный сердечно-сосудистой прогноз [15]. По мнению Gallo G, et al. (2020), использование данного лабораторного биомаркера может представлять собой важный инструмент для диагностики сердечнососудистого риска у пациентов с ПМК и МР до развития гемодинамических последствий на доклинической стадии повреждения миокарда [14].
Однако существует и ряд спорных аспектов в отношении диагностической и прогностической роли NT-proBNP у молодых, мало- или асимптомных пациентов с НДСТ. В настоящее время не установлен согласованный пороговый уровень биомаркера для разных возрастных групп и заболеваний вне ХСН [14]. Модуляторами уровня NT-proBNP при НДСТ, как и в популяции, являются пол, возраст, масса тела и функция почек (для пациентов с НДСТ характерна внутриклубочковая гиперфильтрация), что представляет собой потенциальные факторы, искажающие результаты [2][5][6][13]. Широкое внедрение в клиническую практику лабораторного исследования NT-proBNP у пациентов с аритмическим синдромом на фоне НДСТ может быть ограничено и экономическим фактором. В то же время следует помнить, что данный биомаркер позволяет получить точную прогностическую информацию о неблагоприятных сердечно-сосудистых событиях у пациентов не только с ХСН, но и с другой кардиальной патологией, а также без предшествующего анамнеза сердечнососудистой патологии [5-7].
Ограничения исследования. Учитывая небольшой размер выборки, результаты исследования не могут быть распространены на всю популяцию пациентов с НДСТ; исследованию присущи ограничения нерандомизированных, одноцентровых, сравнительных исследований.
Заключение
В исследовании продемонстрирована ассоциация уровня NT-proBNP с диагностическим порогом НДСТ, ПМК, МР, ЖЭС, что позволяет использовать данный биомаркер в качестве дополнительного диагностического критерия изменения сердечной мышцы на фоне НДСТ. Результаты исследования в будущем могут способствовать разработке индивидуальных программ ведения пациентов с дисплазиями соединительной ткани.
Благодарности. Коллектив авторов выражает благодарность за помощь в проведении исследования: Зыкиной Анне Владимировне, доктору физико-математических наук, заведующей кафедрой "Прикладная математика и фундаментальная информатика" ФГАОУ ВО ОмГТУ.
Отношения и деятельность. Исследование выполнено за счет гранта Российского научного фонда № 22-25-20100 "Оценка структурно-функциональных изменений миокарда у пациентов с недифференцированной дисплазией соединительной ткани, проживающих в Омске и Омской области" https://rscf.ru/project/22-25-20100/.
Список литературы
1. Национальные рекомендации по определению риска и профилактике внезапной сердечной смерти (2-е издание). М.: ИД "МеДпрактИка-М". 2018. p. 247. ISBN: 978- 5-98803-397-4.
2. Нечаева Г.И., Мартынов А.И. Современный подход при дисплазии соединительной ткани в кардиологии: диагностика и лечение: руководство для врачей. Москва: ГЭОТАР-Медиа. 2023. p. 432. ISBN: 978-5-9704-7325-2.
3. Шилова М.А. Внезапная сердечная смерть лиц молодого возраста: факторы риска, причины, морфологические эквиваленты. Международный журнал сердца и сосудистых заболеваний. 2015;3(6):25-34. doi:10.18565/cardio.2015.7.78-83.
4. Almeida AG. NT-proBNP and Myocardial Fibrosis: The Invisible Link Between Health and Disease. J Am Coll Cardiol. 2017;70(25):3110-2. doi:10.1016/j.jacc.2017.11.010.
5. Драпкина О.М., Шепель Р.Н., Джиоева О.Н. Натрийуретические пептиды: новые задачи — новые решения. Кардиоваскулярная терапия и профилактика. 2021;20(7):3102. doi:10.15829/1728-8800-2021-3102.
6. Чаулин А.М., Дупляков Д.В. Повышение натрийуретических пептидов, не ассоциированное с сердечной недостаточностью. Российский кардиологический журнал. 2020;25(S4):4140. doi:10.15829/1560-4071-2020-4140.
7. Ullah A, Sajid S, Qureshi M, et al. Novel Biomarkers and the Multiple-Marker Approach in Early Detection, Prognosis, and Risk Stratification of Cardiac Diseases: A Narrative Review. Cureus. 2023;15(7):e42081. doi:10.7759/cureus.42081.
8. Zeppenfeld K, Tfelt-Hansen J, de Riva M, et al. ESC Scientific Document Group. 2022 ESC Guidelines for the management of patients with ventricular arrhythmias and the prevention of sudden cardiac death. Eur Heart J. 2022;43(40):3997-4126. doi:10.1093/eurheartj/ehac262.
9. Schaeffer BN, Rybczynski M, Sheikhzadeh S, et al. Heart rate turbulence and deceleration capacity for risk prediction of serious arrhythmic events in Marfan syndrome. Clin Res Cardiol. 2015;104(12):1054-63. doi:10.1007/s00392-015-0873-9.
10. Тимофеев Е.В., Малев Э.Г., Лунева Е.Б. и др. Активность трансформирующего фактора роста-β у лиц молодого возраста с марфаноидной внешностью. Педиатр. 2019;10(1):49-56. doi:10.17816/PED10149-56.
11. Клинические рекомендации российского научного медицинского общества терапевтов по диагностике, лечению и реабилитации пациентов с дисплазиями соединительной ткани (первый пересмотр). Медицинский вестник Северного Кавказа. 2018;13(1.2):137- 209. doi:10.14300/mnnc.2018.13037.
12. Lisi M, Cameli M, Mandoli GE, et al. Detection of myocardial fibrosis by speckletracking echocardiography: from prediction to clinical applications. Heart Fail Rev. 2022;27(5):1857-67. doi:10.1007/s10741-022-10214-0.
13. Johl MM, Malhotra P, Kehl DW, et al. Natriuretic peptides in the evaluation and management of degenerative mitral regurgitation: A systematic review. Heart. 2017;103(10):738- 44. doi:10.1136/heartjnl-2016-310547.
14. Gallo G, Forte M, Stanzione R, et al. Functional Role of Natriuretic Peptides in Risk Assessment and Prognosis of Patients with Mitral Regurgitation. J Clin Med. 2020;9(5):1348. doi:10.3390/jcm9051348.
15. Park SJ, Cho EJ, Ahn J, et al. Additive prognostic values of NT-proBNP and exercise stress echocardiography in asymptomatic patients with degenerative mitral regurgitation and preserved left ventricular ejection fraction. Int J Cardiol. 2017;236:387-92. doi:10.1016/j.ijcard.2017.02.063.
Об авторах
Е. Н. ЛогиноваРоссия
Логинова Екатерина Николаевна — кандидат медицинских наук, доцент, доцент кафедры внутренних болезней и семейной медицины ДПО
Омск
Г. И. Нечаева
Россия
Нечаева Галина Ивановна — доктор медицинских наук, профессор, профессор кафедры внутренних болезней и семейной медицины ДПО
Омск
А. Н. Дакуко
Россия
Дакуко Анастасия Николаевна — кандидат медицинских наук, доцент кафедры госпитальной педиатрии с курсом ДПО
Омск
И. В. Богатырев
Богатырев Илья Вячеславович — студент 615 группы лечебного факультета
Омск
В. В. Потапов
Россия
Потапов Виктор Владимирович — кандидат медицинских наук, заведующий отделом функциональных методов исследований БУЗОО Клинический диагностический центр, доцент кафедры внутренних болезней и семейной медицины ДПО ФГБОУ ВО Омский государственный медицинский университет Минздрава России
Омск
Н. А. Кириченко
Россия
Кириченко Александр Николаевич — младший научный сотрудник ЦНИЛ
Омск
И. В. Шарун
Россия
Шарун Иван Владимирович — старший преподаватель кафедры "Прикладная математика и фундаментальная информатика" факультета информационных технологий и компьютерных систем
Омск
Дополнительные файлы
- Аритмии широко распространены у пациентов с недифференцированной дисплазией соединительной ткани и нередко являются причиной внезапной сердечной смерти.
- Ассоциация N-концевого промозгового натрийуретического пептида с желудочковой экстрасистолией и митральной регургитацией у молодых пациентов с недифференцированной дисплазией соединительной ткани свидетельствует о диагностической роли биомаркера у данной когорты пациентов.
- Результаты исследования в будущем могут способствовать разработке индивидуальных программ ведения пациентов с дисплазиями соединительной ткани.
Рецензия
Для цитирования:
Логинова Е.Н., Нечаева Г.И., Дакуко А.Н., Богатырев И.В., Потапов В.В., Кириченко Н.А., Шарун И.В. Оценка уровня N-концевого промозгового натрийуретического пептида у пациентов с аритмией на фоне недифференцированной дисплазии соединительной ткани. Российский кардиологический журнал. 2023;28(11):5641. https://doi.org/10.15829/1560-4071-2023-5641. EDN: QLTPNO
For citation:
Loginova E.N., Nechaeva G.I., Dakuko A.N., Bogatyrev I.V., Potapov V.V., Kirichenko A.N., Sharun I.V. Assessment of N-terminal pro-brain natriuretic peptide in patients with arrhythmia due to undifferentiated connective tissue disease. Russian Journal of Cardiology. 2023;28(11):5641. (In Russ.) https://doi.org/10.15829/1560-4071-2023-5641. EDN: QLTPNO
JATS XML

















































