Перейти к:
Сердечно-сосудистые предикторы течения постковидного периода: результаты когортного исследования
https://doi.org/10.15829/1560-4071-2024-5632
EDN: REXCGP
Аннотация
Цель. Оценить сердечно-сосудистые факторы риска как предикторы развития постковидного синдрома (ПС).
Материал и методы. В данное проспективное когортное исследование включались взрослые пациенты, госпитализированные в университетскую клинику с клинически или лабораторно подтвержденным диагнозом новой коронавирусной инфекции. При поступлении оценивался ряд факторов сердечно-сосудистого риска, включая сердечно-лодыжечный сосудистый индекс (CAVI). После выписки из стационара пациенты наблюдались в течение 6 мес. Затем из электронных медицинских карт и выписок собраны данные о течении постковидного периода и оценены два исхода: развитие ПС и развитие новых/ухудшение течения имеющихся хронических заболеваний в постковидном периоде.
Многофакторная логистическая регрессия использовалась для оценки связи между потенциальными предикторами и исходами, отношения шансов (ОШ) с 95% доверительными интервалами (95% ДИ) рассчитаны для установления силы связи. За уровень статистической значимости принято p<0,05.
Результаты. В окончательный анализ включено 125 пациентов (68 (54,4%) женщин), медиана возраста 59,0 [50,5;71,0] лет. ПС диагностирован у 32,8% пациентов. Наиболее распространенными симптомами были слабость (19,2%), головные боли (11,2%) и одышка (10,4%). В многофакторном анализе CAVI ≥9,5, повышение систолического артериального давления (САД) и скорости клубочковой фильтрации (СКФ) при поступлении были ассоциированы с развитием ПС, с ОШ 2,415 (95% ДИ: 1,174-2,846), 1,045 (95% ДИ: 1,010-1,082), 0,971 (95% ДИ: 0,946-0,998), соответственно. Возраст (ОШ 1,056, 95% ДИ: 1,009-1,105) и индекс массы тела (ОШ 1,132, 95% ДИ: 1,027-1,248) были связаны с развитием новых или ухудшением течения имеющихся хронических заболеваний в постковидном периоде.
Заключение. Такие объективные показатели, как САД, индекс CAVI и СКФ, могут являться предикторами развития ПС, а возраст и индекс массы тела связаны с неблагоприятным течением хронических заболеваний в постковидном периоде.
Для цитирования:
Подзолков В.И., Брагина А.Е., Тарзиманова А.И., Шведов И.И., Огибенина Е.С., Аванесян М.А., Фомин А.С. Сердечно-сосудистые предикторы течения постковидного периода: результаты когортного исследования. Российский кардиологический журнал. 2024;29(3):5632. https://doi.org/10.15829/1560-4071-2024-5632. EDN: REXCGP
For citation:
Podzolkov V.I., Bragina A.E., Tarzimanova A.I., Shvedov I.I., Ogibenina E.S., Avanesyan M.A., Fomin A.S. Cardiovascular predictors of the post-COVID-19 course: results of a cohort study. Russian Journal of Cardiology. 2024;29(3):5632. (In Russ.) https://doi.org/10.15829/1560-4071-2024-5632. EDN: REXCGP
Пандемия новой коронавирусной инфекции (COVID-19) не теряет свою актуальность. Несмотря на тренд к снижению смертности, количество заболевших остается существенным, и отмечается высокая распространенность различных симптомов, персистирующих или возникающих в постковидном периоде [1]. Единого общепринятого определения и классификации данного состояния не разработано, для его обозначения авторами используются различные термины (post COVID-19 condition, long COVID-19, post-COVID-19 syndrome, chronic COVID-19). В Российской Федерации чаще используется понятие "постковидный синдром" (ПС), кодирующееся U09.9 по МКБ-10.
По данным систематического обзора и метаанализа Chen C, et al., глобальная распространенность ПС составила 43% (39-46%), причем у пациентов, перенесших госпитализацию, этот показатель был выше — 54% (37-65%) [2].
Известно, что сахарный диабет (СД), артериальная гипертензия (АГ) и сердечно-сосудистые заболевания являются факторами риска тяжелого течения и смерти у пациентов с COVID-19 [3][4]. Артериальная жесткость наравне с эндотелиальной дисфункцией является универсальным маркером поражения сосудистой стенки и предиктором сердечно-сосудистых осложнений. В ряде работ продемонстрирована связь тяжести течения и неблагоприятного прогноза COVID-19 с сердечно-лодыжечным сосудистым индексом (Cardio-Ankle Vascular Index, CAVI), который представляет собой расчетный показатель жесткости артериальной стенки [5]. В связи с этим, закономерным представляется изучение связи сердечно-сосудистых предикторов с развитием ПС.
Имеются данные о связи женского пола, возраста, тяжести острой COVID-19 с развитием ПС [6]. Однако в этих работах отсутствовал акцент на сердечно-сосудистые предикторы. Исследования по оценке связи сердечно-сосудистых факторов риска с развитием ПС в российской популяции не проводились. Учитывая высокую распространенность, последствия перенесенной COVID-19 представляют серьезную социальную проблему, поэтому выявление предикторов их развития является важной задачей.
Целью нашего исследования являлось выявление сердечно-сосудистых предикторов развития ПС.
Материал и методы
В данное проспективное когортное исследование включались взрослые пациенты (старше 18 лет), выписанные из инфекционного отделения № 2 Университетской клинической больницы № 4 Сеченовского университета, где они проходили лечение по поводу COVID-19. Все больные дали письменное информированное согласие на участие в исследовании. Протокол исследования одобрен локальным этическим комитетом ФГАОУ ВО Первого МГМУ им. И. М. Сеченова.
Критериями исключения являлись наличие состояний, препятствующих точной оценке CAVI; также из исследования исключались пациенты, отказавшиеся от дальнейшего участия, проживающие вне Москвы или не прикрепленные к организациям здравоохранения города Москвы; при недостаточности/отсутствии данных об осмотрах в электронной медицинской карте.
Данные о течении острого периода COVID-19 получены из электронных историй болезни и выписных эпикризов пациентов. Данные о течении 6-мес. постковидного периода получены на основании результатов госпитализаций и амбулаторных осмотров в Единой медицинской информационно-аналитической системе (ЕМИАС), проведенных после окончания лечения по поводу острой COVID-19.
Всем пациентам во время госпитализации проведена оценка артериальной жесткости с помощью измерения CAVI с использованием сфигмоманометра Vasera VS-1500N (Fukuda Denshi, Япония) по стандартной методике. Оценивались лодыжечно-плечевой индекс и отдельно CAVI на правых и левых конечностях (R-CAVI и L-CAVI, соответственно), результирующий индекс CAVI вычислялся как максимальное из значений R-CAVI и L-CAVI. Скорость клубочковой фильтрации (СКФ) определена по формуле CKD-EPI.
В качестве оцениваемых исходов рассматривалось:
1) развитие ПС, который диагностировался при сохранении или появлении новых симптомов по крайней мере через 4 нед. после начала острой инфекции SARS-CoV-2, персистировавших не менее 2 мес. и не имевших других причин.
2) развитие новых/ухудшение течения имеющихся хронических заболеваний в постковидном периоде в течение 6 мес. от начала симптомов острой COVID-19.
При анализе развития исходов учитывались данные медицинской документации об обращении для оказания внеочередной медицинской помощи в течение 6 мес. после перенесенного острого периода COVID-19.
Статистический анализ результатов проводился с использованием SPSS 20.0 (IBM). Распределения оценивались по критерию Колмогорова-Смирнова. Количественные показатели представлены в виде средних значений и среднеквадратического отклонения, либо в виде медианы и межквартильного интервала, качественные — в виде процентного соотношения. Достоверность различий между группами для количественных показателей оценивали по t-критерию Стьюдента или критерию Манна-Уитни, для качественных — по критерию хи-квадрат или точному тесту Фишера. Однофакторный и многофакторный логистический регрессионный анализ использовался для оценки связи между предикторами и развитием исходов. В многофакторную модель включались показатели, значимо ассоциированные с развитием исходов по результатам однофакторного анализа. Для оценки силы связи рассчитаны отношения шансов (ОШ) с 95% доверительными интервалами (ДИ). За уровень статистической значимости принят p<0,05.
Результаты
В окончательный анализ из 202 пациентов после отбора (рис. 1) включено 125 пациентов (57 (45,6%) мужчин и 68 (54,4%) женщин). Средний возраст составил 59,20±13,37 лет.
Все пациенты разделены в зависимости от оцениваемых исходов на 2 подгруппы: IA — лица с развитием ПС, и IБ — без него; IIA — с развитием новых/ухудшением течения имеющихся хронических заболеваний, IIБ — без ухудшения.
ПС выявлен у 32,8% пациентов. Клиническая характеристика подгрупп IA и IБ при исходном обследовании во время острой COVID-19 приведена в таблице 1.
Среди госпитализированных чаще встречались АГ (63,2%), ожирение (40,0%), СД (16,8%) и хроническая болезнь почек (ХБП) (16,0%). Пациенты с развитием ПС были старше, имели больше распространенность АГ, а также более высокие уровни систолического артериального давления (САД), СКФ и индекса CAVI.
Степень поражения легких во время острой COVID-19 определялась по данным компьютерной томографии (КТ) и была следующей: КТ-2 (57,6%), КТ-1 (32,0%), КТ-3 (10,4%), КТ-0 (0,0%). В соответствии с критериями исключения исключены пациенты с обширным поражением легких (КТ-4).
По результатам проведенного однофакторного регрессионного анализа степень поражения легких не была ассоциирована с развитием ПС, что может объясняться тем, что в исследование не включались как пациенты с тяжелым течением COVID-19, так и амбулаторные пациенты с легким течением COVID-19.
Частоты различных симптомов ПС приведены на рисунке 2.
Наиболее распространенными симптомами являлись слабость (19,2%), головные боли (11,2%) и одышка (10,4%).
Для отбора потенциальных предикторов проведен однофакторный регрессионный анализ в отношении развития ПС. В анализ включены следующие показатели: возраст, пол; наличие в анамнезе АГ, СД, ишемической болезни сердца, онкологического заболевания, ХБП; ожирение, САД, насыщение гемоглобина кислородом, С-реактивный белок, СКФ, CAVI ≥9,5. С развитием ПС были связаны возраст (p=0,002), АГ (р<0,001), САД (p=0,004), СКФ (p=0,004) и CAVI ≥9,5 (p=0,002).
Учитывая сильную корреляцию индекса CAVI и возраста (коэффициент корреляции Спирмена r=0,725, р<0,001), возраст и индекс CAVI не включались одновременно в регрессионную модель. Из двух показателей, характеризующих АД (АГ в анамнезе, САД), выбран уровень САД для включения в многофакторную модель как объективный показатель состояния пациента, наряду с уровнем индекса CAVI и СКФ. Результаты многофакторной логистической регрессии в отношении развития ПС приведены в таблице 2.
В результате индекс CAVI ≥9,5, САД и СКФ оказались предикторами развития ПС. При включении в модель возраста вместо индекса CAVI не получено достоверной связи возраста с развитием ПС (ОШ 1,032, 95% ДИ: 0,989-1,076, p=0,146).
Вторым оцениваемым исходом в нашем исследовании было развитие новых/ухудшение течения имеющихся хронических заболеваний в постковидном периоде (рис. 1). У 34 (27,2%) пациентов, завершивших участие в исследовании, выявлены различные заболевания в постковидном периоде (табл. 3).
Частота развития нарушений углеводного обмена и анемии, а также случаев ухудшения течения АГ и фибрилляции предсердий была высокой в постковидном периоде, что свидетельствует о необходимости углубленного наблюдения за больными, перенесшими COVID-19.
Клиническая характеристика подгрупп IIA и IIБ при исходном обследовании во время острого периода COVID-19 представлена в таблице 1. Представители группы с развитием новых/ухудшением течения имеющихся хронических заболеваний были старше, у них была выше распространённость АГ, ожирения, более высокие значения индекса массы тела (ИМТ).
Для отбора потенциальных факторов риска, ассоциированных с развитием новых/ухудшением течения имеющихся хронических заболеваний в постковидном периоде проведен однофакторный регрессионный анализ, в который включены возраст, пол; наличие в анамнезе АГ, СД, ишемической болезни сердца, онкологического заболевания, ХБП; ИМТ, ожирение, САД, насыщение гемоглобина кислородом, С-реактивный белок, СКФ и повышенный CAVI (>9,5). С развитием новых/ухудшением течения имеющихся хронических заболеваний оказались связаны возраст (p=0,007), АГ (p=0,025), ИМТ (p=0,006), ожирение (p=0,029).
Для уточнения независимой связи предикторов с развитием данного исхода построена многофакторная модель (табл. 4). По результатам проведенного анализа возраст и увеличение ИМТ как непрерывной переменной были ассоциированы с развитием новых/ухудшением течения имеющихся хронических заболеваний в постковидном периоде независимо от пола и наличия АГ и СД.
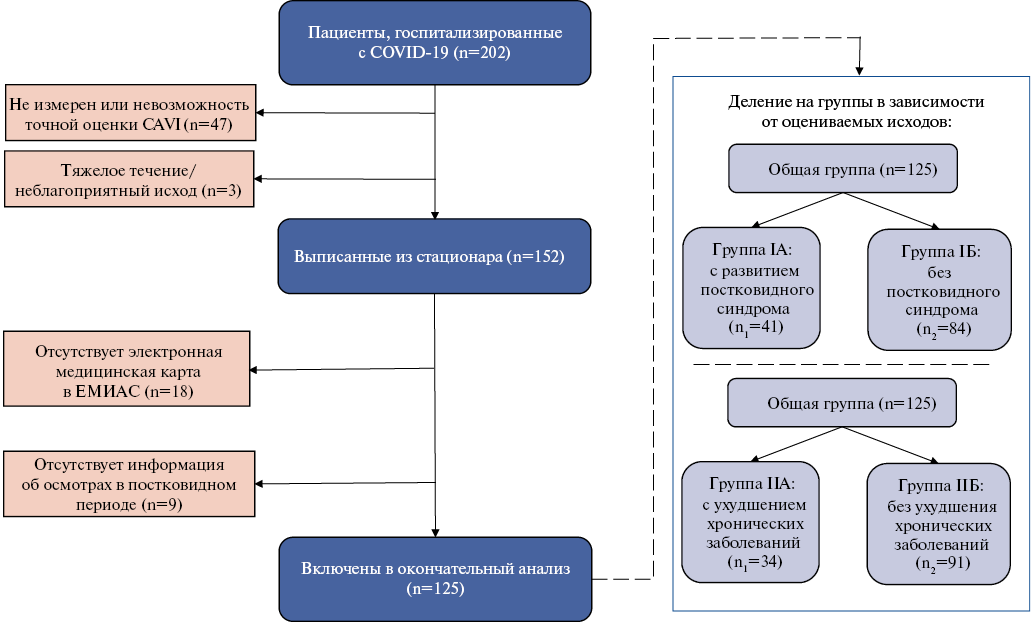
Рис. 1. Диаграмма пациентов, включенных в исследование.
Сокращения: CAVI — сердечно-лодыжечный сосудистый индекс, COVID-19 — новая коронавирусная инфекция.
Таблица 1
Сравнение течения острого COVID-19 в группах с развитием ПС (IA) и без него (IБ), и в группах с развитием новых/ухудшением течения имеющихся хронических заболеваний (IIA) и без него (IIБ)
Показатели на момент госпитализации, n (%); M±SD; Me [Q 25%;75%] | Группа IA (n=41) | Группа IБ (n=84) | P | Группа IIА (n=34) | Группа IIБ (n=91) | P |
Возраст, годы | 64,76±12,06 | 56,49±13,21 | 0,001 | 64,65±12,84 | 57,16±13,06 | 0,005 |
Пол, муж./жен., n (%) | 15 (36,6)/26 (63,4) | 42 (50)/42 (50) | 0,157 | 14 (41,2)/20 (58,8) | 43 (47,3)/48 (52,7) | 0,544 |
Койко-день, дни | 13,00 [ 10,00;16,50] | 11,00 [ 9,00;14,00] | 0,143 | 12,50 [ 9,75;16,25] | 11,00 [ 9,00;14,00] | 0,295 |
АГ, n (%) | 36 (87,8) | 43 (51,2) | <0,001 | 27 (79,4) | 52 (57,1) | 0,022 |
СД, n (%) | 10 (24,4) | 11 (13,1) | 0,113 | 5 (14,7) | 11 (12,1) | 0,765 |
ИБС, n (%) | 8 (19,5) | 11 (13,1) | 0,348 | 5 (14,7) | 14 (15,4) | 0,925 |
ОНМК, n (%) | 2 (4,9) | 1 (1,2) | 0,206 | 1 (2,9) | 2 (2,2) | 0,809 |
Онкологические заболевания, n (%) | 1 (4) | 1 (2,9) | 0,824 | 0 (0,0) | 2 (4,9) | 0,569 |
ХБП, n (%) | 10 (24,4) | 10 (11,9) | 0,074 | 9 (26,5) | 11 (12,1) | 0,051 |
ИМТ, кг/м2 | 30,12 [ 26,10;32,38] | 27,79 [ 24,78;31,78] | 0,065 | 31,11 [ 27,53;33,60] | 27,47 [ 24,78;31,25] | 0,003 |
Ожирение, n (%) | 21 (51,2) | 29 (34,5) | 0,074 | 19 (55,9) | 31 (34,1) | 0,027 |
САД, мм рт.ст. | 130,00 [ 120,00;140,00] | 120,00 [ 113,75;130,00] | 0,003 | 127,50 [ 120,00;135,00] | 120,00 [ 117,00;130,00] | 0,073 |
ЧСС, уд./мин | 80,00 [ 75,00;86,00] | 84,00 [ 75,75;92,00] | 0,056 | 80,00 [ 74,75;88,25] | 82,00 [ 76,00;90,00] | 0,339 |
SрO2, % | 95,50 [ 93,00;97,00] | 94,00 [ 93,00;96,00] | 0,121 | 94,00 [ 93,00;96,00] | 95,00 [ 93,00;96,00] | 0,933 |
СРБ, мг/л | 18,00 [ 7,10;50,30] | 21,62 [ 7,25;45,20] | 0,950 | 18,80 [ 7,08;56,25] | 23,44 [ 8,00;45,19] | 0,951 |
Анемия, n (%) | 8 (20,0) | 7 (8,5) | 0,070 | 8 (23,5) | 7 (8,0) | 0,029 |
Д-димер, мг/л | 0,60 [ 0,36;0,80] | 0,41 [ 0,29;0,87] | 0,278 | 0,48 [ 0,28;0,80] | 0,44 [ 0,29;0,88] | 0,878 |
CAVI ≥9,5, n (%) | 20 (48,8) | 18 (21,4) | 0,002 | 13 (38,2) | 25 (27,5) | 0,244 |
СКФ, мл/мин/1,73 м2 | 62,30 [ 55,30;79,15] | 77,20 [ 65,88;87,45] | 0,001 | 65,30 [ 53,25;82,48] | 75,00 [ 63,40;86,80] | 0,057 |
Сокращения: АГ — артериальная гипертензия, ИБС — ишемическая болезнь сердца, ИМТ — индекс массы тела, ОНМК — острое нарушение мозгового кровообращения, САД — систолическое артериальное давление, СД — сахарный диабет, СКФ — скорость клубочковой фильтрации, СРБ — С-реактивный белок, ХБП — хроническая болезнь почек, ЧСС — частота сердечных сокращений, CAVI — сердечно-лодыжечный сосудистый индекс, М — среднее, Me — медиана, SD — стандартное отклонение, SрO2 — насыщение гемоглобина кислородом, Q 25%;75% — межквартильный интервал.
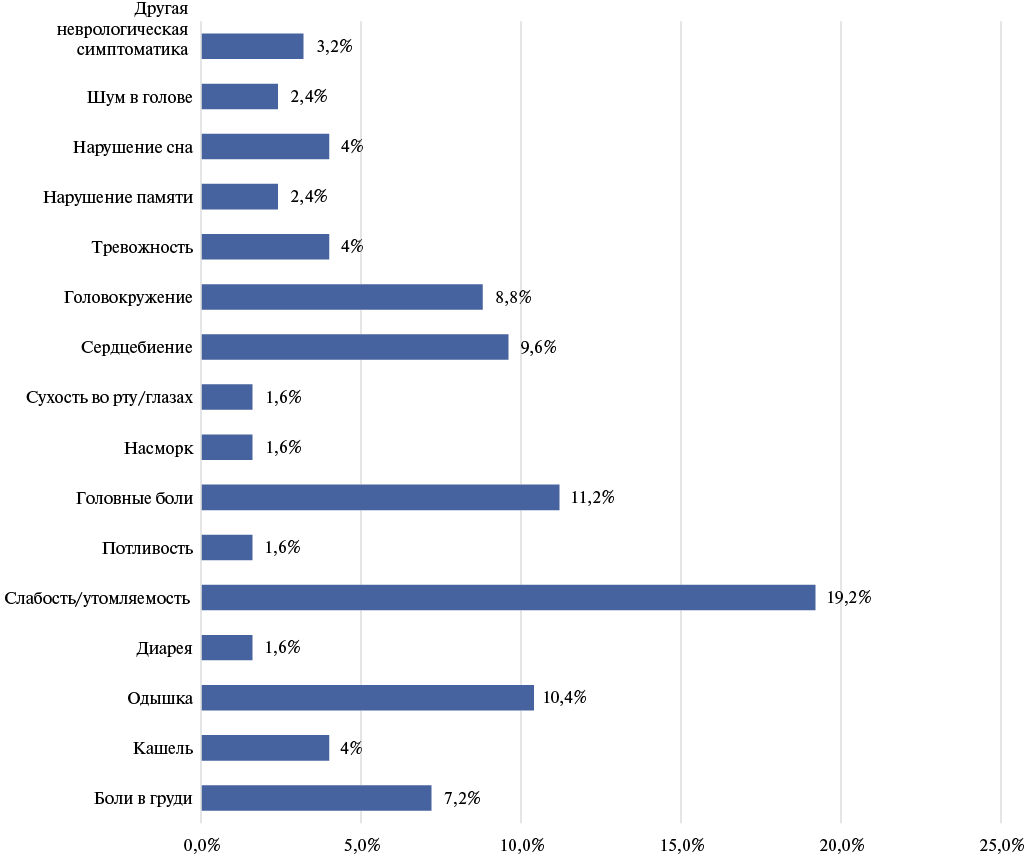
Рис. 2. Частота развития симптомов в постковидном периоде.
Таблица 3
Частота развития новых/ухудшения течения имеющихся хронических заболеваний в постковидном периоде
Заболевание | Общая группа (N=125) |
Новые случаи нарушения углеводного обмена, n (%): — диабет — гипергликемия натощак | 14 (11,2) 5 (4,0) 9 (7,2) |
Неконтролируемая АГ, n (% от пациентов с АГ) | 8 (10,1) |
Ухудшение течения ФП, n (% от пациентов с ФП) | 4 (44,4) |
Анемия, n (% от пациентов с данными об уровне гемоглобина) | 7 (20,6) |
Злокачественные новообразования, n (%) | 3 (2,4) |
Сокращения: АГ — артериальная гипертензия, ФП — фибрилляция предсердий.
Таблица 2
Результаты многофакторной логистической регрессии в отношении развития ПС
ОШ | 95% ДИ | Р | |
САД при поступлении | 1,045 | 1,010-1,082 | 0,011 |
CAVI ≥9,5 | 2,415 | 1,023-5,704 | 0,044 |
СКФ | 0,971 | 0,946-0,998 | 0,032 |
Сокращения: ДИ — доверительный интервал, ОШ — отношение шансов, САД — систолическое артериальное давление, СКФ — скорость клубочковой фильтрации, CAVI — сердечно-лодыжечный сосудистый индекс.
Таблица 4
Результаты многофакторной логистической регрессии в отношении развития новых/ухудшения течения имеющихся хронических заболеваний в постковидном периоде
ОШ | 95% ДИ | Р | |
Возраст | 1,056 | 1,009-1,105 | 0,020 |
Мужской пол | 1,137 | 0,469-2,760 | 0,776 |
Наличие АГ в анамнезе | 0,752 | 0,209-2,709 | 0,663 |
ИМТ | 1,132 | 1,027-1,248 | 0,013 |
Сокращения: АГ — артериальная гипертензия, ДИ — доверительный интервал, ИМТ — индекс массы тела, ОШ — отношение шансов.
Обсуждение
Нами проведено когортное исследование, оценивающее связь артериальной жесткости, а также ряда других объективных показателей, с развитием ПС. Особенностью нашего исследования является оценка распространенности ПС по данным медицинской документации. В отличие от ранее выполненных работ, в которых наличие ПС выявлялось по результатам заполняемых самостоятельно пациентом опросников или телефонных опросов [7], наш протокол исследования позволил снизить субъективность в оценке наличия и тяжести симптомов, а также учесть длительность наличия постковидных симптомов.
Частота развития ПС у госпитализированных пациентов в нашем исследовании составила 32,8%, что несколько ниже по сравнению с проведенными ранее исследованиями [2]. Меньшая распространенность ПС и отдельных симптомов в постковидном периоде по сравнению с аналогичными исследованиями может объясняться тем, что в нашем исследовании учитывались только зафиксированные в медицинской документации симптомы как минимум средней тяжести, которые потребовали внеочередного обращения за медицинской помощью.
Слабость (19,2%) была самым распространенным симптомом в постковидном периоде, что согласуется с данными ранее проведенных исследований [8][9]. Слабость, повышенная утомляемость является частым симптомом после перенесенного острого повреждения легких и исследовалась в работах до эпохи COVID-19 [10]. Поэтому закономерно их наличие в постковидном периоде, особенно, у госпитализированных больных.
По сравнению с ранее проведенными исследованиями нами не получено данных о достоверной связи женского пола с развитием ПС. Это может объясняться тем, что женщины чаще сообщают о симптомах при самостоятельном заполнении опросников, в то время как мужчины склонны реже упоминать нетяжелые симптомы.
В нашем исследовании часть пациентов жаловалась на сердцебиение (9,6%) и боли в груди (7,2%). Это может говорить о длительном поражении сердечно-сосудистой системы у больных, перенесших острый COVID-19, и соответствует данным ранее проведенных исследований, оценивающих частоту жалоб на сердцебиение в 9-10%, а болей в груди — в 5-7% [9].
В ряде исследований у небольшого процента пациентов сохранялись жалобы на нарушение вкуса и обоняния после острого периода COVID-19 (2,9% по данным Арутюнова Г. П. и др. [11]). В нашем исследовании не выявлены пациенты с нарушениями вкуса и обоняния, что может объясняться тем, что большинство пациентов набрано во время волн пандемии, вызванных штаммами дельта и омикрон, при которых потеря вкуса/обоняния развивается в меньшем проценте случаев по сравнению с первоначальным штаммом SARS-CoV-2 [12].
АГ является предиктором тяжелого течения и летального исхода COVID-19 [3], что может являться как следствием поражения органов-мишеней у больных с АГ, так и усиления воспалительного ответа у пациентов с АГ и COVID-19. Однако роль АГ в развитии ПС не до конца изучена. Большинство исследований не рассматривали связь АГ с развитием симптомов в постковидном периоде. В исследовании Zhang X, et al. показана связь АГ с развитием одышки в однофакторном анализе, не подтвердившаяся в многофакторном анализе [8]. С другой стороны, исследование Fernández-de-las-Peñas C, et al., посвященное уточнению предиктивной роли АГ, показало связь АГ с длительными симптомами в постковидном периоде [13].
В нашем исследовании повышение САД было связано с развитием ПС. Патофизиология этого состояния не до конца изучена. Вероятным механизмом взаимосвязи АГ и ПС является дисрегуляция ренин-ангиотензин-альдостероновой системы и калликреин-кининовой системы, а также имеющаяся при АГ эндотелиальная дисфункция, которая усиливает повреждающее действие вируса в отношении сосудистой стенки и его провоспалительную активность [14].
В проведенных на данный момент исследованиях не оценивалась предиктивная роль таких объективных показателей, как САД, СКФ и сосудистая жесткость, оцененная по индексу CAVI. В проведенной нами работе впервые показана независимая связь повышения данных показателей с развитием ПС.
В ряде исследований выявлена связь возраста с развитием таких симптомов, как слабость, одышка, тревога и депрессия, а также наличием ≥3 симптомов в постковидном периоде [8, 9]. Ожирение также по нескольким источникам повышает риски развития ПС [15]. В нашей работе возраст и увеличение ИМТ не были ассоциированы с развитием ПС, но была показана их связь с развитием новых/ухудшением течения имеющихся хронических заболеваний после перенесенного COVID-19.
Таким образом, патофизиология развития ПС имеет многофакторный характер и, как показано в данном исследовании, вероятно, включает в себя наличие изменений сосудистой стенки, поражение почек, а также изменения метаболического статуса организма.
Ограничения исследования. Ограничениями данного исследования являлись одноцентровой характер, относительно небольшой объем выборки, а также сужение исследуемой популяции до госпитализированных больных с COVID-19 средней степени тяжести, в связи с невозможностью оценки индекса CAVI у тяжелых больных.
Заключение
В нашем исследовании показано, что такие объективные показатели, как САД, индекс CAVI и СКФ, могут являться предикторами развития ПС, а возраст и ИМТ связаны с неблагоприятным течением хронических заболеваний в постковидном периоде. Полученные результаты требуют уточнения в более крупных исследованиях.
Отношения и деятельность: все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье.
Список литературы
1. Michelen M, Manoharan L, Elkheir N, et al. Characterising long COVID: a living systematic review. BMJ Glob Heal. 2021;6(9):e005427. doi:10.1136/bmjgh-2021-005427.
2. Chen C, Haupert SR, Zimmermann L, et al. Global Prevalence of Post-Coronavirus Disease 2019 (COVID-19) Condition or Long COVID: A Meta-Analysis and Systematic Review. J Infect Dis. 2022;226(9):1593-607. doi:10.1093/infdis/jiac136.
3. Podzolkov VI, Bragina AE, Tarzimanova AI, et al. Arterial Hypertension and Severe COVID-19 in Hospitalized Patients: Data from a Cohort Study. Ration Pharmacother Cardiol. 2023;19(1):4-10. doi:10.20996/1819-6446-2023-01-10.
4. Chazova IE, Blinova NV, Zhernakova JV, et al. Russian medical society expert consensus on arterial hypertension: arterial hypertension and Post-COVID syndrome. Syst Hypertens. 2022;19(3):5-13. doi:10.38109/2075-082X-2022-3-5-13.
5. Aydın E, Kant A, Yilmaz G. Evaluation of the cardio-ankle vascular index in COVID-19 patients. Rev Assoc Med Bras. 2022;68(1):73-6. doi:10.1590/1806-9282.20210781.
6. Munblit D, Bobkova P, Spiridonova E, et al. Incidence and risk factors for persistent symptoms in adults previously hospitalized for COVID-19. Clin Exp Allergy. 2021;51(9):1107-20. doi:10.1111/cea.13997.
7. Huang C, Huang L, Wang Y, et al. 6-month consequences of COVID-19 in patients discharged from hospital: a cohort study. Lancet. 2021;397(10270):220-32. doi:10.1016/S0140-6736(20)32656-8.
8. Zhang X, Wang F, Shen Y, et al. Symptoms and Health Outcomes among Survivors of COVID-19 Infection 1 Year after Discharge from Hospitals in Wuhan, China. JAMA Netw Open. 2021;4(9):1-11. doi:10.1001/jamanetworkopen.2021.27403.
9. Huang L, Yao Q, Gu X, et al. 1-year outcomes in hospital survivors with COVID-19: a longitudinal cohort study. Lancet. 2021;398(10302):747-58. doi:10.1016/S0140-6736(21)01755-4.
10. Fan E, Dowdy DW, Colantuoni E, et al. Physical complications in acute lung injury survivors: A two-year longitudinal prospective study. Crit Care Med. 2014;42(4):849-59. doi:10.1097/CCM.0000000000000040.
11. Арутюнов Г. П., Тарловская Е. И., Арутюнов А. Г. и др. Клинические особенности постковидного периода. Результаты международного регистра "Анализ динамики коморбидных заболеваний у пациентов, перенесших инфицирование SARS-CoV-2 (АКТИВ SARSCoV-2)". Предварительные данные (6 месяцев наблюдения). Российский кардиологический журнал. 2021;26(10):4708. doi:10.15829/1560-4071-2021-4708.
12. Coelho DH, Reiter ER, French E, et al. Decreasing Incidence of Chemosensory Changes by COVID-19 Variant. Otolaryngol Neck Surg. 2023;168(4):704-6. doi:10.1177/01945998221097656.
13. Fernández-de-las-Peñas C, Torres-Macho J, Velasco-Arribas M, et al. Preexisting hypertension is associated with a greater number of long-term post-COVID symptoms and poor sleep quality: a case-control study. J Hum Hypertens. 2022;36(6):582-4. doi:10.1038/s41371-022-00660-6.
14. Cooper SL, Boyle E, Jefferson SR, et al. Role of the Renin—Angiotensin—Aldosterone and Kinin—Kallikrein Systems in the Cardiovascular Complications of COVID-19 and Long COVID. Int J Mol Sci. 2021;22(15):8255. doi:10.3390/ijms22158255.
15. Desgranges F, Tadini E, Munting A, et al. Post-COVID-19 Syndrome in Outpatients: a Cohort Study. J Gen Intern Med. 2022;37(8):1943-52. doi:10.1007/s11606-021-07242-1.
Об авторах
В. И. ПодзолковРоссия
д. м. н., профессор, зав. кафедрой факультетской терапии № 2 Института клинической медицины им. Н. В. Склифосовского.
Москва
Конфликт интересов:
Конфликт интересов не заявляется.
А. Е. Брагина
Россия
д. м. н., профессор кафедры факультетской терапии № 2 Института клинической медицины им. Н.В. Склифосовского.
Москва
Конфликт интересов:
Конфликт интересов не заявляется.
А. И. Тарзиманова
д. м. н., профессор кафедры факультетской терапии № 2 Института клинической медицины им. Н.В. Склифосовского.
Москва
Конфликт интересов:
Конфликт интересов не заявляется.
И. И. Шведов
Россия
Аспирант кафедры факультетской терапии № 2 Института клинической медицины им. Н.В. Склифосовского.
Москва
Конфликт интересов:
Конфликт интересов не заявляется.
Е. С. Огибенина
Россия
Соискатель кафедры факультетской терапии № 2 Института клинической медицины им. Н.В. Склифосовского.
Москва
Конфликт интересов:
Конфликт интересов не заявляется.
М. А. Аванесян
Россия
Студент кафедры факультетской терапии № 2 Института клинической медицины им. Н.В. Склифосовского.
Москва
Конфликт интересов:
Конфликт интересов не заявляется.
А. С. Фомин
Россия
Студент кафедры факультетской терапии № 2 Института клинической медицины им. Н.В. Склифосовского.
Москва
Конфликт интересов:
Конфликт интересов не заявляется.
Дополнительные файлы
- Постковидный синдром — широко распространенное состояние после перенесенной новой коронавирусной инфекции (COVID-19).
- Поиск предикторов его развития является актуальной задачей.
- Показана связь систолического артериального давления, артериальной жесткости, скорости клубочковой фильтрации, измеряемых при госпитализации по поводу острой COVID-19, с развитием постковидного синдрома.
- Показана связь возраста и индекса массы тела с развитием новых/ухудшением течения имеющихся хронических заболеваний в постковидном периоде.
Рецензия
Для цитирования:
Подзолков В.И., Брагина А.Е., Тарзиманова А.И., Шведов И.И., Огибенина Е.С., Аванесян М.А., Фомин А.С. Сердечно-сосудистые предикторы течения постковидного периода: результаты когортного исследования. Российский кардиологический журнал. 2024;29(3):5632. https://doi.org/10.15829/1560-4071-2024-5632. EDN: REXCGP
For citation:
Podzolkov V.I., Bragina A.E., Tarzimanova A.I., Shvedov I.I., Ogibenina E.S., Avanesyan M.A., Fomin A.S. Cardiovascular predictors of the post-COVID-19 course: results of a cohort study. Russian Journal of Cardiology. 2024;29(3):5632. (In Russ.) https://doi.org/10.15829/1560-4071-2024-5632. EDN: REXCGP
JATS XML

















































