Перейти к:
Нейтрофильные внеклеточные ловушки — перспективный маркер неблагоприятного прогноза у оперированных пациентов с инфекционным эндокардитом
https://doi.org/10.15829/1560-4071-2024-5624
EDN: PBXUQU
Аннотация
Цель. Определение прогностического значения формирования нейтрофильных внеклеточных ловушек (НВЛ) в мазках крови у оперированных пациентов с инфекционным эндокардитом (ИЭ).
Материал и методы. Проспективно включено 46 пациентов с достоверным диагнозом ИЭ и 50 пациентов с клапанными пороками сердца без ИЭ, госпитализированных в кардиохирургический стационар в 2021-2022гг (г. Москва), сопоставимых по полу и возрасту. Всем пациентам проводилось определение НВЛ при поступлении и в динамике через 7 дней после операции исследованием окрашенных мазков крови по типу монослой с помощью системы автоматической микроскопии МЕКОС-Ц2 (Россия). Включенные в исследование пациенты проспективно наблюдались в течение госпитального периода лечения (Ме [IQR] 30,0 [21,0-41,0] дней) для регистрации первичной комбинированной конечной точки (госпитальная летальность от всех причин, эмболические, внутрисердечные, инфекционные осложнения) и отдельных ее компонентов.
Результаты. Пациенты с ИЭ были преимущественно представлены лицами мужского пола (n=37, 80,4%) с медианой возраста 55,5 [44,0-70,0] лет. Первичная комбинированная конечная точка была зарегистрирована у 76,1% (n=35) обследованных с ИЭ. Уровень НВЛ в динамике через 7 дней был значимо выше у пациентов с ИЭ, имевших события из первичной комбинированной конечной точки, чем в группе оперированных пациентов с пороками сердца без ИЭ (Ме [IQR] 4,4 [0,6-26,6] vs 2,9 [1,1-4,3], соответственно, p<0,05). Пациенты с ИЭ, умершие в стационаре, отличались достоверно более высоким уровнем НВЛ по сравнению с выжившими пациентами с ИЭ и группой контроля как при поступлении (9,2 [1,8-18,9] vs 4,2 [0,3-28,5] и 3,4 [1,7-6,9], соответственно, p<0,05), так и в динамике (18,2 [5,2-26,6] vs 4,0 [1,0-26,6] и 2,9 [1,1-4,3], соответственно, p<0,001). Пороговое значение НВЛ в динамике ≥11,2% с высокой точностью прогнозировало летальный исход в стационаре (чувствительность 80,0%, специфичность 90,0%, положительная прогностическая ценность 66,7%, отрицательная прогностическая ценность 100,0%, площадь под кривой 0,915, р=0,003) и развитие послеоперационного сепсиса (чувствительность 75,0%, специфичность 88,0%, положительная прогностическая ценность 60,0%, отрицательная прогностическая ценность 100,0%, площадь под кривой 0,884, р=0,01). Полученные отрезные значения достоверно предсказывали вероятность летального исхода — отношение шансов (ОШ) 23,9 (95% доверительный интервал (ДИ): 1,7-344,8, p=0,02) и сепсиса — ОШ 22,0 (95% ДИ: 1,9-256,8, p=0,01) в стационаре у оперированных пациентов с ИЭ.
Заключение. Уровень нейтрофильных внеклеточных ловушек в мазках крови у оперированных пациентов c ИЭ является новым перспективным маркером прогнозирования осложненного течения заболевания. Значения НВЛ ≥11,2% у оперированных пациентов с ИЭ в 24 раза увеличивают вероятность госпитальной летальности и в 22 раза — развитие послеоперационного сепсиса.
Ключевые слова
Для цитирования:
Котова Е.О., Моисеева А.Ю., Кобалава Ж.Д., Писарюк А.С., Кассина Д.В., Гурьев А.С., Гусарова Т.А. Нейтрофильные внеклеточные ловушки — перспективный маркер неблагоприятного прогноза у оперированных пациентов с инфекционным эндокардитом. Российский кардиологический журнал. 2024;29(7):5624. https://doi.org/10.15829/1560-4071-2024-5624. EDN: PBXUQU
For citation:
Kotova E.O., Moiseeva A.Yu., Kobalava Zh.D., Pisyaryuk A.S., Kassina D.V., Gur’ev A.S., Gusarova T.A. Neutrophil extracellular traps as a promising marker of poor prognosis in operated patients with infective endocarditisarditis. Russian Journal of Cardiology. 2024;29(7):5624. (In Russ.) https://doi.org/10.15829/1560-4071-2024-5624. EDN: PBXUQU
Достигнутые успехи современных диагностических и лечебных подходов ведения пациентов с инфекционным эндокардитом (ИЭ) не приводят к достаточному снижению заболеваемости и летальности, наоборот, наблюдаются опасные тенденции к их росту, а прогноз болезни остается неблагоприятным. Остро необходимым представляется поиск ранних предикторов осложненного течения ИЭ на любом этапе болезни, в т. ч. после хирургического лечения. Существующие маркеры оценки риска неблагоприятных событий при ИЭ применяются редко и не обладают оптимальной прогностической ценностью [1]. Основываясь на современной концепции патогенеза ИЭ — иммунотромбозе, обсуждается роль нейтрофильных внеклеточных ловушек (НВЛ) как возможного раннего и патогенетически обоснованного маркера прогрессирования инфекции, в особенности, эмболических событий и госпитальной летальности [2][3]. Впервые нетоз как компонент врожденного иммунитета, отличный от фагоцитоза и дегрануляции, и основанный на формировании НВЛ в ответ на инфекцию, описал Brinkmann V, et al. в 2004г [3]. Стимуляция нейтрофилов патогенами и в большей степени медиаторами воспаления вызывает высвобождение из них хроматиновых волокон с антимикробными компонентами, такими как эластаза, катепсин G и миелопероксидаза с формированием НВЛ. Роль НВЛ заключается в захвате и уничтожении патогенных микроорганизмов [3]. Однако избыточная продукция НВЛ, по всей видимости, приводит к повреждению клеток, прогрессированию воспаления и тромбообразованию [4][5]. В патогенезе ИЭ предполагается развитие неконтролируемого процесса нетоза. Однако роль НВЛ у пациентов с ИЭ не изучена, в частности, после кардиохирургических вмешательств. Таким образом, целью данного исследования являлось определение прогностической значимости формирования НВЛ у оперированных пациентов с ИЭ.
Материал и методы
Проспективное когортное исследование выполнено у пациентов старше 18 лет, подписавших информированное согласие на сбор обезличенных медицинских данных. Включено 46 оперированных пациентов с достоверным диагнозом ИЭ по критериям Дюка 2015 [1][6], госпитализированных в кардиохирургический стационар (г. Москва) в 2021-2022гг, и 50 пациентов, оперированных по поводу клапанных пороков сердца, исключая ИЭ, в качестве группы контроля. Не включали пациентов с неактивным ИЭ, небактериальным тромбоэндокардитом, активными онкологическими заболеваниями и получающих иммуносупрессивную терапию. Группы были сопоставимы по полу и возрасту. Исследование выполнено в соответствии со стандартами надлежащей клинической практики (Good Clinical Practice), принципами Хельсинкской декларации и одобрено локальным этическим комитетом Медицинского института Российского университета дружбы народов имени Патриса Лумумбы (протокол № 27 от 18.03.2021).
Всем пациентам выполняли традиционные лабораторно-инструментальные обследования, в т. ч. оценку маркеров воспаления и эхокардиографическое исследование сердца. Исследование уровня НВЛ проводили в мазках крови от каждого пациента основной группы и группы контроля при поступлении и на 7 сут. после кардиохирургической операции. Временной интервал в 7 дней был выбран эмпирически, как усредненный показатель для оценки динамики лабораторных показателей на фоне проводимого лечения. Из пробирки с ЭДТА брали 2 мл крови для изготовления стерильных мазков на предметных стеклах по типу "монослой" с дальнейшей фиксацией в красителе-фиксаторе эозине метиленовом синем по Май-Грюнвальду ("ООО Минимед", Россия) (3,5 мин) и окраской в красителе Азур-Эозин по Романовскому-Гимзе ("ООО Минимед", Россия) (20-25 мин) 1. Микроскопию окрашенных мазков проводили с помощью системы автоматической микроскопии МЕКОС-Ц2 (ООО "Медицинские компьютерные системы (МЕКОС)", Россия)1. Далее выполнялся подсчет количества нативных неразрушенных фагоцитов (нейтрофилов, эозинофилов, базофилов, моноцитов) и уровня НВЛ по формуле: НВЛ, % = NНВЛ / (N нативные нейтрофилы + N эозинофилы + N базофилы) × 100%.
Исходы исследовались за период лечения в кардиохирургическом стационаре. Оценивалась первичная комбинированная конечная точка (ПККТ) и отдельные ее компоненты: госпитальная летальность от всех причин, эмболические события, внутрисердечные (абсцесс, фистула/перфорация клапана, отрыв хорд, увеличение регургитации/вегетаций, дисфункция протеза) и инфекционные (сепсис) осложнения.
Статистический анализ проведен в программе IBM SPSS Statistics, Version 27. Количественные переменные описывали как медиана (Me) и интерквантильный размах (IQR). Качественные переменные описывали абсолютными (n) и относительными (%) значениями. Также оценивалась отрицательная (ОПЦ) и положительная прогностическая ценность (ППЦ). Пороговые значения для количественных предикторов устанавливались на основе ROC-анализа при оптимальном соотношении чувствительности и специфичности с определением площади под кривой (AUC). Связь между определенным исходом и фактором риска оценивали с помощью отношения шансов (ОШ) с определением 95% доверительного интервала (ДИ). Вероятность выживания оценивали методом построения кривых выживаемости Каплана-Мейера, сравнение производили с помощью логрангового критерия. Во всех видах анализа статистически значимым считалось значение p<0,05.
Результаты
Оперированные пациенты с ИЭ были преимущественно представлены лицами мужского пола среднего возраста с частым поражением трикуспидального и аортального клапанов (табл. 1). У половины пациентов имелись сердечно-сосудистые заболевания, часто встречался вирусный гепатит С, хроническая болезнь почек и сахарный диабет. Первичный ИЭ отмечался у 37,0% (n=17) пациентов. В структуре вторичного ИЭ преобладали дегенеративные пороки сердца, так же как и у оперированных пациентов с пороками сердца без ИЭ.
Внутрисердечные осложнения при поступлении имелись у 84,8% (n=39) пациентов с ИЭ, представленные отрывом хорд (23,9%, n=11), абсцессами клапанов (23,9%, n=11), перфорацией створок (21,7%, n=10), параклапанными фистулами (8,7%, n=6) и дисфункцией протеза (6,5%, n=3). Сочетанные повреждения клапанного аппарата имелись у 2 пациентов. Эмболические события до операции наблюдались у 23,9% (n=11) пациентов, после операции эмболических событий не было ни у одного наблюдавшегося.
Дооперационная антибактериальная терапия проводилась всем пациентам с ИЭ (медиана составила 27,5 [ 17,3-38,8] дней), из них в большинстве случаев были назначены схемы, включающие гликопептиды в 82,6% (n=38) случаев, несколько реже — цефалоспорины 50,0% (n=23), аминогликозиды 28,3% (n=13) и карбапенемы 21,7% (n=10). После операции антибактериальная терапия продолжалась в среднем 2-6 нед.
Осложненное течение раннего послеоперационного периода имелось у 76,1% (n=35) пациентов с ИЭ, наиболее часто отмечалось острое повреждение почек у 54,3% (n=25) и постперикардиотомный синдром у 28,3% (n=13) пациентов. Госпитальная летальность среди оперированных пациентов с ИЭ составила 10,9% (n=5).
Этиологическая принадлежность ИЭ установлена у 84,9% пациентов, преимущественно представленная стафилококками (41,3%), с преобладанием Staphylococcus aureus (34,8%), энтерококками (10,9%) и стрептококками (10,9%). Сочетание возбудителей Enterococcus faecalis + S. aureus выявлено у 10,9% пациентов. Другие возбудители определены у 4,4% обследованных, представленные Pseudomonas aeruginosa (2,2%) и Granulicatella adiacence (2,2%). У 3 (6,5%) пациентов выявлен ИЭ, вызванный Bartonella quintana. Исследование уровня НВЛ в зависимости от этиопатогенетического агента не выявило значимых различий.
Внутригрупповых отличий по уровню НВЛ при поступлении и в динамике не было выявлено как в основной группе пациентов с ИЭ, так и в группе контроля (оперированные пациенты с пороками сердца без ИЭ). При этом уровни НВЛ при поступлении достоверно не отличались между пациентами с ИЭ и без ИЭ, что, вероятно, объясняется длительным дооперационным периодом антибактериальной терапии в основной группе, повлиявшей на активность воспаления (рис. 1, табл. 2). Однако обращала внимание достоверная разница между уровнем НВЛ на 7 день после операции в группе с ИЭ и группе контроля, что, вероятно, связано с наличием бактериального воспаления и одновременно свидетельствует об отсутствии вклада хирургического лечения в повышение НВЛ, сопровождающегося лишь асептическим воспалением.
События из ПККТ наблюдались у 76,1% (n=35) оперированных пациентов с ИЭ и ассоциировались с повышением уровня НВЛ через 7 дней после операции, по сравнению с оперированными пациентами с пороками сердца без ИЭ (табл. 3). В группе контроля за период наблюдения события из ПККТ не было.
При анализе отдельных компонентов ПККТ отмечались более высокие уровни НВЛ у пациентов с ИЭ в отношении госпитальной летальности как при поступлении, так и в динамике, по сравнению с выжившими пациентами с ИЭ и оперированными пациентами с пороками сердца без ИЭ (табл. 4).
Методом ROC-анализа вычислено пороговое значение НВЛ в динамике для прогнозирования госпитальной летальности, составившее 11,2%, характеризующееся чувствительностью 80,0%, специфичностью 90,0%, ППЦ 66,7%, ОПЦ 100,0%, AUC 0,915, р=0,003 (рис. 2).
При проведении многофакторного регрессионного анализа выявлено, что уровень НВЛ выше найденного отрезного значения повышал вероятность госпитальной летальности у оперированных пациентов с ИЭ (ОШ 23,9; 95% ДИ: 1,7-344,8, p=0,02) (табл. 5).
Наличие внутрисердечных осложнений при поступлении также ассоциировалось с достоверно более высокими исходными уровнями НВЛ по сравнению с пациентами без аналогичных изменений (табл. 6).
Сепсис в послеоперационном периоде у пациентов с ИЭ диагностирован у 8,7% (n=4) пациентов и также ассоциировался с повышением уровня НВЛ в динамике (табл. 7).
Методом ROC-анализа вычислено пороговое значение НВЛ в динамике для прогнозирования послеоперационного сепсиса, также составившее 11,2%, характеризующееся чувствительностью 75,0%, специфичностью 88,0%, ППЦ 60,0%, ОПЦ 100,0%, AUC 0,884, р=0,01 (рис. 3). Найденное отрезное значение НВЛ в динамике в 22 раза увеличивало вероятность развития сепсиса у оперированных пациентов с ИЭ (ОШ 22,0 (95% ДИ: 1,9-256,8, p=0,01)).
Интерес представляет клиническое наблюдение пациентки с длительным анамнезом внутривенной наркомании и ИЭ трикуспидального клапана, вызванным S. aureus, у которой развился ранний протезный ИЭ, сопровождавшийся 19-кратным увеличением НВЛ в динамике (1,3%→24,6%).
Таким образом, исходно высокие уровни НВЛ могут свидетельствовать о тяжелом инфекционном поражении клапанного аппарата сердца, однако увеличение этого показателя в динамике также ассоциировано с развитием осложнений в послеоперационном периоде у пациентов с ИЭ (сепсис, ранний протезный ИЭ), что свидетельствует о важности определения уровня НВЛ в динамике.
Мы также проанализировали связь уровня НВЛ с развитием эмболических событий, однако в нашей когорте пациентов данной закономерности обнаружено не было, что, вероятно, было обусловлено давностью эмболических событий в предшествующие госпитализации и отсутствием их в послеоперационном периоде (табл. 8).
При многофакторном регрессионном анализе предикторами эмболических осложнений являлись традиционные показатели: правосторонний ИЭ (ОШ 34,09 (95% ДИ: 3,99-291,16), р<0,0001), внутривенная наркомания (ОШ 10,46 (95% ДИ: 2,50-43,81), р<0,001), вирусный гепатит С (ОШ 7,50 (95% ДИ: 2,00-28,05), р<0,002) и увеличение размера вегетаций (ОШ 3,89 (95% ДИ: 1,18-12,84), р<0,02).
При анализе выживаемости также отмечались худшие показатели у оперированных пациентов с ИЭ и НВЛ ≥11,2% в динамике через 7 дней после операции (рис. 4). Отметим, что расхождение кривых Каплана-Мейера отмечалось уже в раннем послеоперационном периоде.
Таким образом, повышение НВЛ в динамике ≥11,2% у оперированных пациентов с ИЭ ассоциировалось с осложненным течением раннего послеоперационного периода и худшей выживаемостью.
Таблица 1
Клинико-демографическая характеристика оперированных пациентов c ИЭ и пороками сердца без ИЭ
Параметр | Оперированные ИЭ+ (n=46) | Оперированные ИЭ- (n=50) |
Мужчин, n (%) | 37 (80,4) | 40 (80,0) |
Локализация поражений клапана/вегетаций: | ||
— Один клапан | ||
• Трикуспидальный клапан, n (%) • Аортальный клапан, n (%) • Митральный клапан, n (%) | 15 (32,6)* 11 (23,9)* 9 (19,6) | 1 (2,0)* 41 (82,0)* 4 (8,0) |
— Два клапана | ||
• Аортальный и митральный клапан, n (%) • Митральный и трикуспидальный клапан, n (%) • Аортальный и трикуспидальный клапан, n (%) | 5 (10,9) 3 (6,5) 2 (4,3) | 4 (8,0) 0 (0) 0 (0) |
— Три клапана | ||
• Аортальный, митральный и трикуспидальный клапан, n (%) | 1 (2,2) | 0 (0) |
Сердечно-сосудистые заболевания, n (%) • Артериальная гипертония, n (%) • Сердечная недостаточность в анамнезе, n (%) • Ишемическая болезнь сердца, n (%) • Фибрилляция предсердий, n (%) | 25 (54,3)* 23 (50,0) 8 (17,4)* 6 (13,0) 4 (8,7) | 50 (100)* 37 (74,0) 50 (100)* 20 (40,0) 9 (18,0) |
Вирусный гепатит С, n (%) | 18 (39,1)* | 2 (4,0)* |
Хроническая болезнь почек, n (%) | 7 (15,2)* | 14 (28,0)* |
Сахарный диабет 2 типа, n (%) | 7 (15,2) | 7 (14,0) |
Инсульт/транзиторная ишемическая атака в анамнезе, n (%) | 4 (8,7) | 1 (2,0) |
Хроническая обструктивная болезнь легких/бронхиальная астма, n (%) | 4 (8,7) | 8 (16,0) |
Внутривенное употребление психоактивных препаратов, n (%) | 17 (37,0)* | 0 (0)* |
Индекс Чарльсон, баллы, Me [IQR] | 4,0 [ 2,0-6,0] | 4,0 [ 2,0-5,0] |
Примечание: * — р<0,05 — значимость различий между группами.
Сокращения: ИЭ — инфекционный эндокардит, Me — медиана, IQR — интерквантильный размах.
Таблица 2
Динамика уровня НВЛ в группе оперированных пациентов с ИЭ и оперированных пациентов с пороками сердца без ИЭ
Группа | НВЛ 0 дней, %, Me [IQR] | НВЛ 7 дней, %, Me [IQR] |
Оперированные пациенты с ИЭ | 4,2 [ 2,0-6,2] | 4,3 [ 2,3-6,2]* |
Оперированные с пороками сердца без ИЭ | 3,4 [ 1,7-6,9] | 2,9 [ 1,1-4,3]* |
Примечание: * — p<0,05 — значимость различий НВЛ в динамике через 7 дней после операции по сравнению с оперированными пациентами с пороками сердца без ИЭ.
Сокращения: ИЭ — инфекционный эндокардит, Me — медиана, НВЛ — нейтрофильные внеклеточные ловушки, IQR — интерквантильный размах.
Таблица 3
Уровень НВЛ в зависимости от наличия событий из ПККТ у оперированных пациентов с ИЭ по сравнению с группой контроля
Показатель | ИЭ с событиями ПККТ | ИЭ без событий ПККТ | Оперированные с пороками сердца без ИЭ |
НВЛ 0 дней, Me [IQR], % | 4,8 [ 0,4-28,5] | 3,7 [ 1,5-5,5] | 3,4 [ 1,7-6,9] |
НВЛ 7 дней, Me [IQR], % | 4,4 [ 0,6-26,6]* | 4,0 [ 2,4-4,9] | 2,9 [ 1,1-4,3]* |
Примечание: * — p<0,05 — значимость различий между группой ИЭ с событиями ПККТ.
Сокращения: ИЭ — инфекционный эндокардит, Me — медиана, НВЛ — нейтрофильные внеклеточные ловушки, ПККТ — первичная комбинированная конечная точка, IQR — интерквантильный размах.
Таблица 4
Уровень НВЛ у оперированных пациентов в зависимости от госпитальной летальности по сравнению с группой контроля
Показатель | ИЭ с госпитальной летальностью | ИЭ без госпитальной летальности | Оперированные с пороками сердца без ИЭ |
НВЛ 0 дней, Me [IQR], % | 9,2 [ 1,8-18,9]*, † | 4,2 [ 0,3-28,5]* | 3,4 [ 1,7-6,9]† |
НВЛ 7 дней, Me [IQR], % | 18,2 [ 5,2-26,6]§, || | 4,0 [ 1,0-26,6]§ | 2,9 [ 1,1-4,3]|| |
Примечание: * — p<0,05, † — p<0,05, § — p<0,001, || — p<0,001 — значимость различий между группами.
Сокращения: ИЭ — инфекционный эндокардит, Me — медиана, НВЛ — нейтрофильные внеклеточные ловушки, IQR — интерквантильный размах.
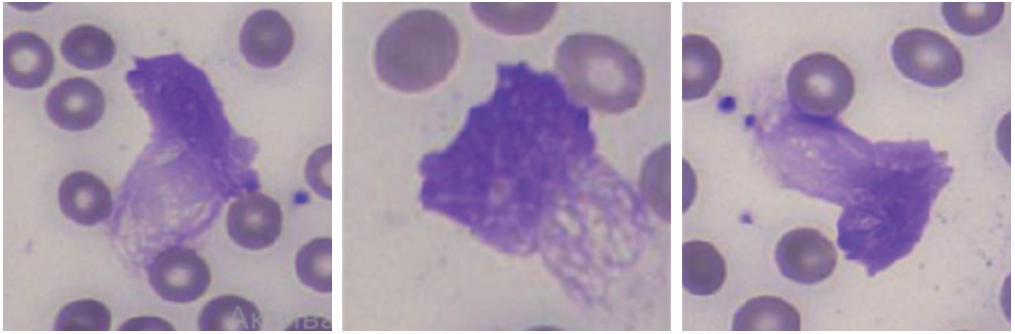
Рис. 1. НВЛ у пациентов с ИЭ (окраска по Романовскому-Гимзе (×500)).
Таблица 5
Однофакторный и многофакторный анализ вероятности развития госпитальной летальности при ИЭ
Показатель | Однофакторный анализ | Многофакторный анализ | ||||
ОШ | 95% ДИ | р | ОШ | 95% ДИ | р | |
НВЛ 7 дней ≥11,2% | 37,0 | 3,3-416,9 | 0,0001 | 23,9 | 1,7-344,8 | 0,02 |
Послеоперационный сепсис | 44,0 | 4,8-401,6 | 0,0001 | 15,8 | 1,0-273,0 | 0,05 |
Возраст ≥60 лет | 1,4 | 0,2-8,8 | 0,71 | — | — | — |
Сердечно-сосудистые заболевания в анамнезе | 1,5 | 0,3-9,3 | 0,64 | — | — | — |
Эмболические события | 0,6 | 0,1-6,1 | 0,69 | — | — | — |
Staphylococcus sp. | 0,4 | 0,1-2,5 | 0,33 | — | — | — |
Левосторонний ИЭ | 2,9 | 0,3-27,2 | 0,32 | — | — | — |
Вегетации ≥13 мм | 0,1 | 0,1-1,1 | 0,09 | — | — | — |
Сокращения: ДИ — доверительный интервал, ИЭ — инфекционный эндокардит, НВЛ — нейтрофильные внеклеточные ловушки, ОШ — отношение шансов.
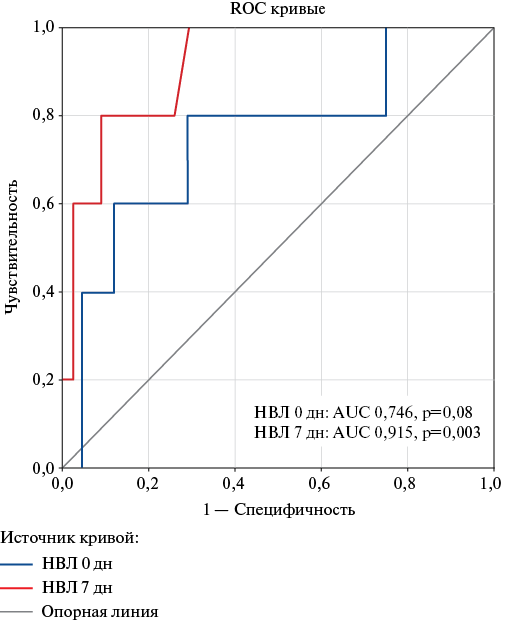
Рис. 2. Анализ ROC-кривой: связь значения НВЛ при поступлении и в динамике с госпитальной летальностью у оперированных пациентов с ИЭ.
Сокращение: НВЛ — нейтрофильные внеклеточные ловушки.
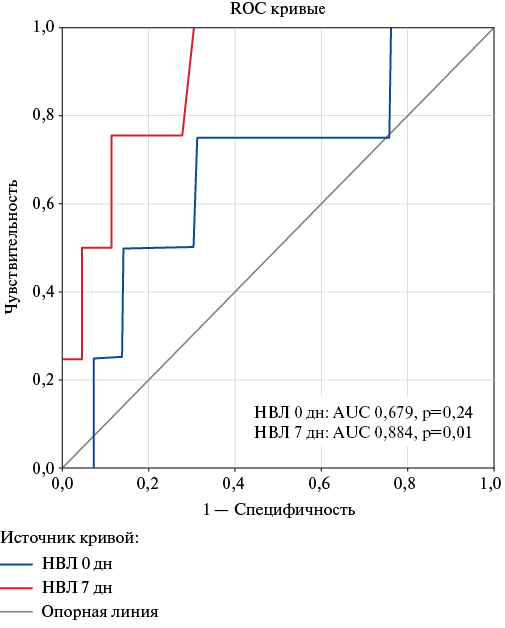
Рис. 3. Анализ ROC-кривой: связь значения НВЛ при поступлении и в динамике с развитием сепсиса у оперированных пациентов с ИЭ.
Сокращение: НВЛ — нейтрофильные внеклеточные ловушки.
Таблица 6
Уровень НВЛ в зависимости от наличия внутрисердечных осложнений у оперированных пациентов с ИЭ по сравнению с оперированными пациентами с пороками сердца без ИЭ
Показатель | ИЭ с внутрисердечными осложнениями | ИЭ без внутрисердечных | Оперированные с пороками сердца без ИЭ |
НВЛ 0 дней, Me [IQR], % | 4,8 [ 0,4-28,5]* | 1,3 [ 0,3-6,2]* | 3,4 [ 1,7-6,9] |
НВЛ 7 дней, Me [IQR], % | 4,3 [ 2,1-6,0] | 4,0 [ 2,6-6,8] | 2,9 [ 1,1-4,3] |
Примечание: * — p<0,05 — значимость различий между группами.
Сокращения: ИЭ — инфекционный эндокардит, Me — медиана, НВЛ — нейтрофильные внеклеточные ловушки, IQR — интерквантильный размах.
Таблица 7
Уровень НВЛ в зависимости от развития сепсиса у оперированных пациентов с ИЭ по сравнению с оперированными пациентами с пороками сердца без ИЭ
Показатель | ИЭ с послеоперационным сепсисом | ИЭ без послеоперационного сепсиса | Оперированные с пороками сердца без ИЭ |
НВЛ 0 дней, Me [IQR], % | 7,1 [ 2,6-15,9] | 4,2 [ 1,9-6,2] | 3,4 [ 1,7-6,9] |
НВЛ 7 дней, Me [IQR], % | 15,4 [ 5,2-24,6]*, ** | 2,9 [ 0,8-22,3]* | 2,9 [ 1,1-4,3]** |
Примечание: *, ** — p<0,05 — значимость различий между группами.
Сокращения: ИЭ — инфекционный эндокардит, Me — медиана, НВЛ — нейтрофильные внеклеточные ловушки, IQR — интерквантильный размах.
Таблица 8
Уровень НВЛ в зависимости от наличия эмболических событий у оперированных пациентов с ИЭ по сравнению с оперированными пациентами с пороками сердца без ИЭ
Показатель | ИЭ с эмболическими событиями | ИЭ без эмболических событий | Оперированные с пороками сердца без ИЭ |
НВЛ 0 дней, Me [IQR], % | 4,8 [ 1,3-6,2] | 4,2 [ 2,4-8,5] | 3,4 [ 1,7-6,9] |
НВЛ 7 дней, Me [IQR], % | 2,6 [ 1,8-5,3] | 4,9 [ 2,6-9,1] | 2,9 [ 1,1-4,3] |
Сокращения: ИЭ — инфекционный эндокардит, Me — медиана, НВЛ — нейтрофильные внеклеточные ловушки, IQR — интерквантильный размах.
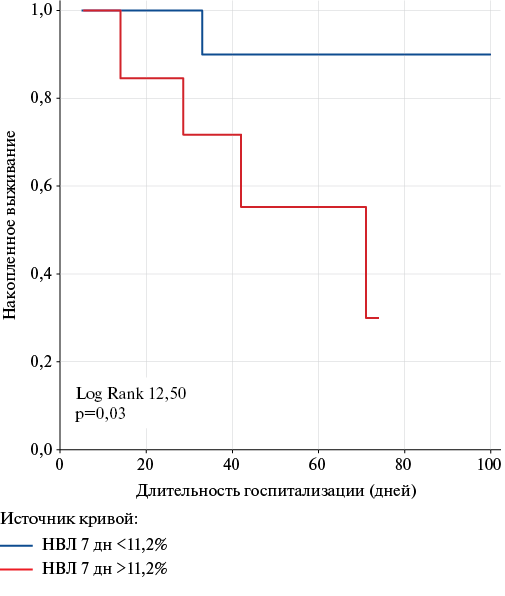
Рис. 4. Кривые выживаемости Каплана-Мейера у оперированных пациентов с ИЭ в госпитальном периоде в зависимости от уровня НВЛ через 7 дней после операции.
Сокращение: НВЛ — нейтрофильные внеклеточные ловушки.
Обсуждение
Иммунотромбоз является новым патофизиологическим механизмом при инфекционных заболеваниях и представляет собой физиологический процесс активации эндотелиального, тромбоцитарного и плазменного звеньев гемостаза, приводящий к высвобождению НВЛ, служащих для захвата и уничтожения бактерий, попавших в кровоток [2][7]. В отечественной и зарубежной литературе имеются сведения о том, что образование НВЛ играет важную роль при разных аутоиммунных заболеваниях [8][9], а также при бактериальных, вирусных, грибковых инфекциях, в т. ч. при сепсисе [4][10][11].
Изучение НВЛ при ИЭ ограничивается только экспериментальными исследованиями. Анализ литературы свидетельствует как о позитивном, так и о негативном влиянии формирования НВЛ на патофизиологические процессы, происходящие в тканях и органах. Jung CJ, et al. (2015) продемонстрировали амбивалентную роль НВЛ на крысиной модели ИЭ (n=9, НВЛ в вегетациях), вызванного Streptococcus mutans: с одной стороны, на ранних стадиях заболевания НВЛ обладали защитным механизмом, сдерживающим инфекцию, с другой стороны — на поздних стадиях болезни происходило развитие неконтролируемого нетоза, приводящего к усилению коагуляции, способствующему росту вегетации, прогрессированию воспаления, повреждению клапанов и подклапанных структур [10]. Схожие результаты получены Hsu CC, et al. (2019) также на крысиной модели ИЭ (НВЛ в вегетациях), вызванного S. aureus, подтвердившие существенную роль НВЛ в росте вегетаций [12]. В этом же исследовании было выявлено, что введение ДНКазы I значительно уменьшало размер вегетаций. Таким образом, можно предположить, что активность инфекционного процесса негативно влияет на образование НВЛ, определяя развитие неконтролируемого нетоза.
Исследования НВЛ на пациентах с ИЭ отсутствуют, однако имеются данные, полученные от пациентов с инфекциями кровотока. Так, Li RHL, et al. (2018) у пациентов с сепсисом продемонстрировали негативную роль НВЛ в прогнозировании госпитальной летальности, ассоциированной с развитием диссеминированного внутрисосудистого свертывания и полиорганной дисфункции [4]. В наше исследование были включены пациенты с осложненным ИЭ, потребовавшим кардиохирургического лечения. Среди обследованных с ИЭ мы наблюдали более высокий уровень НВЛ, особенно в динамике, отличающийся от показателей у оперированных пациентов с пороками сердца без ИЭ, что, вероятно, свидетельствует о развитии неконтролируемого нетоза при ИЭ, приведшем к деструктивным процессам в сердце. Также у оперированных пациентов с ИЭ нами выявлена связь высокого уровня НВЛ с неблагоприятным прогнозом (госпитальной летальностью и инфекционными осложнениями). Отдельно отметим, что повышение уровня НВЛ не имело связи с самим фактом хирургического вмешательства, т. к. мы не наблюдали прироста уровня НВЛ после кардиохирургических операций у пациентов группы контроля. Данный феномен позволяет предположить связь повышения НВЛ в группе пациентов с ИЭ именно в контексте наличия тяжелой бактериальной инфекции.
Исследования по определению пороговых уровней НВЛ для прогнозирования неблагоприятных событий единичны. В частности, у 73 пациентов с сепсисом различной этиологии было отмечено, что при уровне НВЛ ≥23,0% летальность наблюдалась в 100% случаев [13]. В другом исследовании, включившем 34 пациента с коронавирусной инфекцией, вызванной вирусом SARS-CoV-2, отмечено, что повышение НВЛ ≥16% служит критерием негативного прогноза заболевания и риска летального исхода [14]. В ходе нашего исследования определен отрезной уровень для прогнозирования госпитальной летальности у оперированных пациентов с ИЭ, составивший 11,2%, при котором вероятность смерти в стационаре увеличивалась в 24 раза. Более низкие пороговые уровни НВЛ, полученные нами, вероятно, объясняются особенностью изучаемой популяции — одновременное сочетание осложненного течения ИЭ с предшествующей длительной антибактериальной терапией (медиана дооперационного антибактериального лечения — 27,5 дней), уменьшающей активность воспаления, но не позволяющей добиться полного контроля над инфекцией.
Более того, нам удалось определить отрезной уровень для прогнозирования септических осложнений в послеоперационном периоде у пациентов с ИЭ, также составивший 11,2%, при котором в 22 раза увеличивалась вероятность развития сепсиса у оперированных пациентов. Аналогичных данных в научной литературе мы не нашли. Тем не менее наши результаты согласуются с ранее проведенными исследованиями у пациентов с сепсисом любой этиологии, свидетельствующими о высоком уровне НВЛ при инфекциях кровотока [4][13].
Отсутствие ассоциаций этиологической принадлежности ИЭ и уровня циркулирующих НВЛ в крови в нашем исследовании могло быть связано с несколькими причинами. Во-первых, некоторые микроорганизмы, в частности, S. aureus, способны вырабатывать различные факторы вирулентности, препятствующие образованию или способствующие разрушению НВЛ, ограничивая их количество и защитную активность, реализуя механизмы ускользания бактерии от системы врожденного иммунитета для выживания в среде хозяина [7]. Во-вторых, вовлеченность большого количества НВЛ в состав вегетации могла нивелировать их уровень в циркулирующей крови. В-третьих, недостаточное количество пациентов с установленной этиологией ИЭ, а также трудности определения истинной этиологической принадлежности ИЭ могли внести вклад в получение неопределённых результатов. Для подтверждения этих гипотез необходимо проведение дальнейших исследований на большей популяции пациентов с ИЭ с определением уровня НВЛ в разных видах биологического материала (цельная кровь, ткани резецированных клапанов, вегетации).
Связь маркеров воспаления и НВЛ имеет разнонаправленные ассоциации. Так, Zhang F, et al. (2017) у 23 пациентов с сепсисом не получили корреляционных связей НВЛ с параметрами воспаления [15], в отличие от Zuo Y, et al. (2020), продемонстрировавших четкие взаимосвязи маркеров воспаления и НВЛ у 50 пациентов с COVID-19 [16]. В нашем исследовании не выявлено ассоциаций между лейкоцитами, скоростью оседания эритроцитов, С-реактивным белком и НВЛ, что может быть связано с низкой активностью воспаления на фоне предшествующей антибактериальной терапии.
В единичных экспериментальных исследованиях на крысиной модели ИЭ была выявлена связь НВЛ с увеличением размеров вегетаций и эмболическими событиями [10][12]. Учитывая особенности патогенеза ИЭ, основанные на иммунотромбозе, мы также предполагали наличие связи НВЛ с эмболиями. Однако в нашей когорте пациентов данная гипотеза не нашла подтверждения, что могло быть связано с некоторыми ограничениями исследования. Так как уровень НВЛ динамичен, наиболее информативно его изучение в непосредственной близости от наблюдаемого события. Мы имели возможность исследовать уровень НВЛ при поступлении в стационар, когда эмболические события были отдаленно свершившимися, а в послеоперационном периоде мы не наблюдали ни одного события. Вышесказанное определяет необходимость проведения дальнейших исследований на широкой популяции пациентов с ИЭ.
Таким образом, НВЛ являются новыми перспективными маркерами оценки прогноза у пациентов с ИЭ, в т. ч. оперированных. Значения НВЛ ≥11,2% с высокой точностью предсказывают наступление летального исхода в стационаре и развитие послеоперационного сепсиса, а также неконтролируемое течение инфекционного процесса с развитием внутрисердечных и инфекционных осложнений. Для расширения прогностического потенциала НВЛ, в первую очередь направленного на своевременную оценку риска эмболических событий, актуально продолжение исследований на более крупных популяциях пациентов с ИЭ.
Ограничения исследования. ИЭ относится к непредсказуемым заболеваниям, что определяет необходимость постоянного поиска новых возможностей оценки прогноза и определения неблагоприятного течения заболевания. Исследуемая нами группа пациентов, госпитализированных в кардиохирургический стационар по причине невозможности контроля над течением ИЭ и имеющая длительный этап консервативного лечения, неизбежно имела ограничения для изучения, такие как низкая частота развития анализируемых событий из конечных точек и длительные временные промежутки между возникновением неблагоприятного события и взятием крови на исследование.
Также следует отметить отсутствие стандартизированной методики определения НВЛ [17][18]. НВЛ могут быть идентифицированы как различными методами (гистохимические исследования с последующей световой микроскопией, проточная цитофлуориметрия, иммунофлуоресцентная микроскопия, различные другие виды микроскопии — конфокальная, сканирующая и трансмиссионная электронная, а также другие), так и в различных формах — от изучения компонентов НВЛ (внеклеточная ДНК, нейтрофильная эластаза 2, миелопероксидаза и катепсин G, гистоны H1, H2A, H2B, H3 и H4 и другие) до определения целых клеток. В зарубежных исследованиях преимущественно представлено изучение компонентов НВЛ без их количественной оценки. Мы применили простой в исполнении метод, разработанный в России, по изучению цельно клеточного состава клеток крови с обнаружением НВЛ в мазках при автоматической микроскопии1, позволивший нам провести количественный подсчет форменных элементов для выведения пороговых значений. Однако, безусловно, это несколько ограничило прямое сравнение полученных результатов с рядом ранее проведенных немногочисленных исследований.
Заключение
НВЛ в крови у оперированных пациентов c ИЭ являются новыми перспективными маркерами прогнозирования осложненного течения заболевания. Значения НВЛ ≥11,2% у оперированных пациентов с ИЭ в 24 раза увеличивают вероятность госпитальной летальности и в 22 раза — развитие послеоперационного сепсиса.
Отношения и деятельность. Работа выполнена при поддержке гранта Российского научного фонда (проект № 22-75-10012) с использованием человеческого биоматериала, собранного и сохраняемого в рамках научной программы. Оборудование для сбора, хранения и транспортировки биоматериала человека, оборудование для обследования пациентов приобретено за счет средств Программы стратегического академического лидерства РУДН, Приоритет 2030.
1. Волков А, Мосальская Д, Гурьев А, авторы; ООО "Медтехнопарк", патентообладатель. Способ определения относительного количества этотически трансформированных фагоцитов. Пат. 2712179 Рос. Федерация. Опубл. 24.01.2020.
Список литературы
1. Демин А., Кобалава Ж., Скопин И. и др. Инфекционный эндокардит и инфекция внутрисердечных устройств. Клинические рекомендации 2021. Российский кардиологический журнал. 2022;27(10):5233. doi:10.15829/1560407120225233.
2. Писарюк А., Замарашкина В., Сафарова Н. и др. Роль нарушений в системе гемостаза при инфекционном эндокардите: связь с возбудителем, биомаркеры, место антитромботической терапии (систематический обзор). Рациональная Фармакотерапия в Кардиологии. 2022;18(3):32031. doi:10.20996/1819644620220614.
3. Brinkmann V, Reichard U, Goosmann C, et al. Neutrophil extracellular traps kill bacteria. Science. 2004;303(5663):15325. doi:10.1126/science.1092385.
4. Li R, Tablin F. A Comparative Review of Neutrophil Extracellular Traps in Sepsis. Front Vet Sci. 2018;5:291. doi:10.3389/fvets.2018.00291.
5. Papayannopoulos V. Neutrophil extracellular traps in immunity and disease. Nat Rev Immunol. 2018;18(2):13447. doi:10.1038/nri.2017.105.
6. Habib G, Lancellotti P, Antunes M, et al.; ESC Scientific Document Group. 2015 ESC Guidelines for the management of infective endocarditis: The Task Force for the Management of Infective Endocarditis of the European Society of Cardiology (ESC). Endorsed by: European Association for CardioThoracic Surgery (EACTS), the European Association of Nuclear Medicine (EANM). Eur Heart J. 2015;36(44):3075128. doi:10.1093/eurheartj/ehv319.
7. Meyers S, Crescente M, Verhamme P, Martinod K. Staphylococcus aureus and Neutrophil Extracellular Traps: The Master Manipulator Meets Its Match in Immunothrombosis. Arterioscler Thromb Vasc Biol. 2022;42(3):26176. doi:10.1161/ATVBAHA.121.316930.
8. Khandpur R, CarmonaRivera C, Vivekanandan-Giri A, et al. NETs are a source of citrullinated autoantigens and stimulate inflammatory responses in rheumatoid arthritis. Sci Transl Med. 2013;5(178):178ra40. doi:10.1126/scitranslmed.3005580.
9. Schauer C, Janko C, Munoz L, et al. Aggregated neutrophil extracellular traps limit inflammation by degrading cytokines and chemokines. Nat Med. 2014;20(5):5117. doi:10.1038/nm.3547.
10. Jung C, Yeh C, Hsu R, et al. Endocarditis pathogen promotes vegetation formation by inducing intravascular neutrophil extracellular traps through activated platelets. Circulation. 2015;131(6):57181. doi:10.1161/CIRCULATIONAHA.114.011432.
11. Yipp B, Petri B, Salina D, et al. Infection-induced NETosis is a dynamic process involving neutrophil multitasking in vivo. Nat Med. 2012;18(9):138693. doi:10.1038/nm.2847.
12. Hsu C, Hsu R, Ohniwa R, et al. Neutrophil Extracellular Traps Enhance Staphylococcus Aureus Vegetation Formation through Interaction with Platelets in Infective Endocarditis. Thromb Haemost. 2019;119(5):78696. doi:10.1055/s00391678665.
13. Gur'ev A, Mosalskaia D, Lopatin A, Volkov A. Prognostic value of cellular markers in sepsis: extracellular DNA traps and platelet count relation. Berlin, 32nd Annual Congress of the European Society of Intensive Care Medicine ESICM LIVES 2019. Intensive Care Med Exp. 2019;000809:2378. doi:10.1186/S406350190265Y.
14. Кассина Д., Василенко И., Гурьев А. и др. Нейтрофильные внеклеточные ловушки: значение для диагностики и прогноза COVID19. Альманах клинической медицины. 2020;48(S1):S4350. doi:10.18786/20720505202048029.
15. Zhang F, Zhang Z, Ma X. Plasma level of neutrophil extracellular traps in septic patients and its clinical significance: a prospective observational study. Zhonghua Wei Zhong Bing Ji Jiu Yi Xue. 2017;29(2):1226. Chinese. doi:10.3760/cma.j.issn.20954352.2017.02.006.
16. Zuo Y, Yalavarthi S, Shi H, et al. Neutrophil extracellular traps in COVID19. JCI Insight. 2020;5(11):e138999. doi:10.1172/jci.insight.138999.
17. Masuda S, Nakazawa D, Shida H, et al. NETosis markers: Quest for specific, objective, and quantitative markers. Clin Chim Acta. 2016;459:8993. doi:10.1016/j.cca.2016. 05.029.
18. Kasprzycka W, Homa-Mlak I, Mlak R, Małecka-Massalska T. Direct and indirect methods of evaluating the NETosis process. J Pre Clin Clin Res. 2019;13(1):506. doi:10.26444/jpccr/105563.
Об авторах
Е. О. КотоваРоссия
Елизавета Олеговна Котова — к. м. н., доцент кафедры внутренних болезней с курсом кардиологии и функциональной диагностики им. В. С. Моисеева, Медицинский институт.
Москва
Конфликт интересов:
нет
А. Ю. Моисеева
Россия
Моисеева Александра Ю. — к. м. н., ассистент кафедры внутренних болезней с курсом кардиологии и функциональной диагностики им. В. С. Моисеева, Медицинский институт.
Москва
Конфликт интересов:
нет
Ж. Д. Кобалава
Россия
Жанна Давидовна Кобалава — д. м. н., профессор, член-корр. РАН, зав. кафедрой внутренних болезней с курсом кардиологии и функциональной диагностики им. В. С. Моисеева, Медицинский институт.
Москва
Конфликт интересов:
нет
А. С. Писарюк
Россия
Александра Писарюк — к. м. н., врач-кардиолог отделения реанимации и интенсивной терапии; доцент кафедры внутренних болезней с курсом кардиологии и функциональной диагностики им. В. С. Моисеева, Медицинский институт.
Москва
Конфликт интересов:
нет
Д. В. Кассина
Россия
Кассина Дарья В. — н. с. лаборатории биомедицинских методов исследования.
Москва
Конфликт интересов:
нет
А. С. Гурьев
Россия
Гурьев Александр С. — к. ф.-м. н., с. н. с. лаборатории биомедицинских методов исследования.
Москва
Конфликт интересов:
нет
Т. А. Гусарова
Россия
Татьяна Анатольевна Гусарова — зав. патологоанатомическим отделением.
Москва
Конфликт интересов:
нет
Дополнительные файлы
- Нейтрофильные внеклеточные ловушки в мазках крови представляют новый прогностический маркер осложненного течения инфекционного эндокардита.
- Показано, что значения нейтрофильных внеклеточных ловушек в мазках крови пациентов с инфекционным эндокардитом выше 11,2% в 24 раза увеличивают вероятность госпитальной летальности и в 22 раза — развитие послеоперационного сепсиса.
- Представленные данные позволяют обсуждать значимый вклад нейтрофильных внеклеточных ловушек в патогенез инфекционного эндокардита и развитие осложнений.
Рецензия
Для цитирования:
Котова Е.О., Моисеева А.Ю., Кобалава Ж.Д., Писарюк А.С., Кассина Д.В., Гурьев А.С., Гусарова Т.А. Нейтрофильные внеклеточные ловушки — перспективный маркер неблагоприятного прогноза у оперированных пациентов с инфекционным эндокардитом. Российский кардиологический журнал. 2024;29(7):5624. https://doi.org/10.15829/1560-4071-2024-5624. EDN: PBXUQU
For citation:
Kotova E.O., Moiseeva A.Yu., Kobalava Zh.D., Pisyaryuk A.S., Kassina D.V., Gur’ev A.S., Gusarova T.A. Neutrophil extracellular traps as a promising marker of poor prognosis in operated patients with infective endocarditisarditis. Russian Journal of Cardiology. 2024;29(7):5624. (In Russ.) https://doi.org/10.15829/1560-4071-2024-5624. EDN: PBXUQU
JATS XML

















































