Перейти к:
Факторы, связанные с риском прогрессирования и декомпенсации хронической сердечной недостаточности у пациентов с имплантированным кардиовертером-дефибриллятором
https://doi.org/10.15829/1560-4071-2024-5619
EDN: YUEMYV
Аннотация
Цель. Провести анализ клинико-анамнестических факторов, связанных с риском острой декомпенсации и прогрессирования сердечной недостаточности (ОДСН) у пациентов с имплантированным кардиовертером-дефибриллятором (ИКД) с составлением прогностической модели на основе данных Кузбасского регистра пациентов с ИКД.
Материал и методы. Проспективное наблюдение 260 пациентов с низкой фракцией выброса левого желудочка, возраст 59 (53; 66) лет, 214 (82,3%) мужчин из Кузбасского регистра пациентов с имплантированным кардиовертером-дефибриллятором. У 156 (60%) пациентов — ишемическая кардиомиопатия, у остальных — неишемическая кардиомиопатия. Средний период наблюдения — 4,2±2,3 года после имплантации ИКД. Базовые сведения о пациентах: демографические данные, социальное положение, анамнез основного заболевания, сопутствующие заболевания, показатели жизненно важных функций, стандартные клинико-инструментальные и лабораторные показатели, медикаментозная терапия, внесенные в регистровую базу данных. В течение периода наблюдения анализировались все случаи ОДСН и смерти.
Результаты. Всего в группе наблюдения умерло 54 (20,8%) пациента, из которых 48 (88,9%) умерло по причине ОДСН. За период наблюдения 34 пациента были госпитализированы по поводу ОДСН, из них 13 (38,2%) умерли. 35 (13,5%) пациентов умерли на догоспитальном этапе по поводу ОДСН, развившейся на фоне основного заболевания (у 10 (27%) — дилатационная кардиомиопатия, у 1 (2,8%) — ревматический митральный порок, у остальных 24 (68,6%) — ишемическая кардиомиопатия). Таким образом, всего было зарегистрировано 69 случаев ОДСН, что составило 26,5% от общей группы. Летальность в общей группе от ОДСН составила 18,5%. Согласно кривой Каплана-Майера, большинство случаев смерти развилось в первые 1,5 года наблюдения.
В регрессионную модель прогнозирования риска ОДСН вошли величина левого предсердия (р=0,05), мужской пол (р=0,001), класс NYHA (р=0,0001), фракция выброса левого желудочка <40% (р=0,0001), отсутствие приема блокатора ренин-ангиотензин-альдостероновой системы (р=0,007) и амиодарона (р=0,028). Площадь под ROC-кривой (AUC) созданной модели составила 0,8, чувствительность модели равна 69,2%, специфичность — 80%.
Заключение. Выявлен комплекс рутинных клинико-анамнестических факторов, позволяющий прогнозировать риск развития ОДСН у пациентов с ИКД, который необходимо учитывать перед принятием решения об имплантации девайса. Особенное внимание следует уделять обязательной оптимальной медикаментозной терапии хронической сердечной недостаточности как основному модифицируемому фактору риска острой декомпенсации сердечной недостаточности.
Ключевые слова
Для цитирования:
Лебедева Н.Б., Талибуллин И.В., Парфенов П.Г., Егле А.П., Барбараш О.Л. Факторы, связанные с риском прогрессирования и декомпенсации хронической сердечной недостаточности у пациентов с имплантированным кардиовертером-дефибриллятором. Российский кардиологический журнал. 2024;29(3):5619. https://doi.org/10.15829/1560-4071-2024-5619. EDN: YUEMYV
For citation:
Lebedeva N.B., Talibullin I.V., Parfenov P.G., Egle A.P., Barbarash O.L. Factors associated with the risk of progression and decompensation of heart failure in patients with an implantable cardioverter-defibrillator. Russian Journal of Cardiology. 2024;29(3):5619. (In Russ.) https://doi.org/10.15829/1560-4071-2024-5619. EDN: YUEMYV
Сердечная недостаточность с низкой фракцией выброса (ФВ) левого желудочка (ЛЖ) (СНнФВ) является основным показанием для применения имплантируемых кардиовертеров-дефибрилляторов (ИКД) с целью первичной профилактики внезапной сердечной смерти (ВСС), от которой умирает половина пациентов с сердечно-сосудистыми заболеваниями [1]. С учетом большого количества пациентов с СНнФВ в Российской Федерации (РФ), потребность в ИКД, как основном методе профилактики ВСС, очень высока, вместе с тем по уровню обеспеченности регионов методами интервенционной аритмологии РФ находится на одном из последних мест в Европе [2].
Однако ВСС — не единственный и, как показывает современная клиническая практика, не основной механизм смерти у пациентов с хронической сердечной недостаточностью (ХСН). Так, Виноградова Н. Г. и др., проведя анализ причин смерти на амбулаторном этапе, показали, что пациенты с ХСН в 2 раза чаще умирают от острой декомпенсации сердечной недостаточности (ОДСН), чем от злокачественных желудочковых нарушений ритма [3].
Таким образом, очевидно, что пациенты с низкой ФВ ЛЖ, несмотря на наличие ИКД, могут иметь неблагоприятный прогноз, обусловленный высоким конкурирующим риском ОДСН и неаритмической смерти, что свидетельствует о необходимости совершенствования подходов к определению показаний для имплантации ИКД [4]. Первичная профилактика ВСС с помощью девайса клинически оправдана, если она сопровождается снижением смерти от всех причин. Таким образом, если у пациента принимается решение об имплантации ИКД, предполагается, что все риски неаритмической смерти учтены и компенсированы. Учитывая, что пациенты с низкой ФВ ЛЖ погибают или внезапно, или от ОДСН, при принятии решения об имплантации девайса важно оценивать именно риск ОДСН. В этом направлении эффективность применения ИКД для снижения общей смерти может повысить персонифицированный подход к отбору пациентов для ИКД-терапии с учетом риска развития неблагоприятного отдаленного прогноза, в т. ч. ОДСН. Поиск простых клинических предикторов ОДСН у пациентов с ХСН перед имплантацией ИКД является весьма актуальной задачей, поскольку поможет практикующему врачу выделить тех пациентов, которые получат максимальную пользу по выживаемости от ИКД-терапии, и тем самым персонифицировать подход к отбору на этот высокотехнологичный и не всегда доступный вид медицинской помощи. В связи с этим целью настоящего исследования явился анализ клинико-анамнестических факторов, связанных с риском ОДСН у пациентов ИКД, с составлением прогностической модели на основе данных "Кузбасского регистра пациентов с имплантированным кардиовертером-дефибриллятором".
Материал и методы
Выполнено одноцентровое обсервационное проспективное исследование на основе данных "Кузбасского регистра пациентов с имплантированным кардиовертером-дефибриллятором", в который последовательно включались все пациенты Кемеровской области, которым имплантировался ИКД с 2015 по 2019гг, всего 264 пациента. Организация регистра и форма информированного согласия были одобрены локальным этическим комитетом учреждения и соответствовали положениям Хельсинкской декларации. Информированное согласие подписывалось всеми пациентами при поступлении в стационар. При ведении регистра соблюдались все требования Федерального закона от 27.07.2006 № 152-ФЗ "О персональных данных".
Критерии включения в регистр: возраст старше 18 лет, имплантированный ИКД.
Необходимые данные собирались в стационаре и вносились в запатентованную электронную форму 1. Базовые сведения о пациентах включали демографические данные, социальное положение, анамнез основного заболевания, сопутствующие заболевания, показатели жизненно важных функций, стандартные клинико-инструментальные и лабораторные показатели, названия и дозы сердечно-сосудистых препаратов, специфические параметры, относящиеся к ИКД, госпитальные вмешательства и осложнения.
На проспективном этапе в регистр вносились данные о динамике состояния пациентов (стадия и функциональный класс ХСН), кратности посещений кардиолога, хирурга-аритмолога, медикаментозной терапии. Регистрировались жесткие конечные точки: смерть, госпитализация, ОДСН, острое нарушение мозгового кровообращения, острый коронарный синдром, реваскуляризация миокарда, ортотопическая пересадка сердца, а также ИКД-связанные события (ревизия электрода ИКД, ре-имплантация ИКД, шок).
С учетом регистрового характера исследования подробный анализ частоты адекватных и неадекватных срабатываний ИКД с программатора устройства не проводился, что явилось ограничением исследования. Данные о срабатываниях ИКД были получены со слов пациента и из записей хирурга-аритмолога.
На проспективном этапе путем телефонного опроса, изучения медицинской документации (выписки из историй болезни, амбулаторные карты, записи хирурга-аритмолога, данные из государственных органов регистрации) у 260 пациентов удалось получить данные о статусе жив/умер и о жестких конечных точках, 4 пациента были потеряны для наблюдения и расценены как умершие. Таким образом, в анализ отдаленного этапа вошли данные о 260 пациентах с ИКД. Средний период наблюдения составил 4,6±2,3 года (отдаленный этап). В настоящем разделе работы анализировались случаи смерти и ОДСН.
Характеристика группы до имплантации ИКД представлена в таблице 1.
Таблица 1
Характеристика группы до имплантации ИКД
Показатель | n=260 (100%) |
Мужчины | 214 (82,3) |
Возраст (Ме (Q25; Q75)), лет | 59 (53; 66) |
Работающие | 28 (10,8) |
ИБС | 194 (74,6) |
Постинфарктный кардиосклероз | 156 (60) |
Некоронарогенные заболевания | 66 (25,4) |
Артериальная гипертензия | 199 (76,5) |
Сахарный диабет 2 типа | 34 (13,1) |
Хроническая болезнь почек II-III ст. | 83 (31,9) |
Хроническая обструктивная болезнь легких | 23 (8,8) |
Хроническая ишемия головного мозга | 66 (25,4) |
ФВ ЛЖ (Ме (Q25; Q75)), % | 30 (25; 36,5) |
ХСН | 260 (100) |
Фибрилляция предсердий | 106 (40,8) |
ХСН I | 35 (13,5) |
ХСН IIА | 147 (56,5) |
ХСН IIБ | 76 (29,6) |
ХСН III | 2 (0,8) |
NYHA I | 4 (1,5) |
NYHA II | 175 (67,3) |
NYHA III | 63 (24,2) |
NYHA IV | 18 (6,9) |
Первичная профилактика ВСС | 158 (60,8) |
Сокращения: ВСС — внезапная сердечная смерть, ИБС — ишемическая болезнь сердца, ФВ ЛЖ — фракция выброса левого желудочка, ХСН — хроническая сердечная недостаточность, NYHA — функциональный класс хронической сердечной недостаточности по классификации Нью-Йоркской ассоциации сердца.
Статистический анализ. Статистическая обработка результатов проводилась с использованием пакетов прикладных программ "Statistica 10.0 for Windows" (StatSoftInc., США) и SPSS 10.0 (IBM, США). Нормальность распределения проверялась с помощью критерия Шапиро-Уилка. Сравнение между собой непрерывных величин с нормальным распределением осуществлялось с помощью t-теста Стьюдента, при отсутствии нормальности распределения применялся непараметрический критерий Манна-Уитни (U-критерий). Сравнение дискретных величин осуществлялось с использованием критерия χ2 с поправкой на непрерывность по Йетсу. При малом числе случаев в одной из сравниваемых групп (≤5), использовался двусторонний критерий Фишера (F-критерий). Различия считались статистически достоверными при значениях двустороннего р<0,05.
Для выявления факторов, связанных с неблагоприятным прогнозом, применялся однофакторный и многофакторный пошаговый анализ методом логистической (для качественных параметров) и линейной (для количественных параметров) регрессии с вычислением коэффициентов регрессии. Относительный вклад отдельных признаков выражался величиной статистики Вальда. При моделировании применялось регрессивное уравнение:
y=a+b1×X1+b2×X2+...bi×Xi,
где y — зависимая переменная, принимающая два значения; 0 — нет события; 1 — есть событие; a — константа; bi — коэффициенты регрессии; Хi — переменные.
Рассчитывалась вероятность возникновения события Р по формуле 2:
P=1/(1+e-y),
где Р — прогностическая вероятность, е — экспонента, приближенное значение которой равно 2,718.
После формирования моделей был рассчитан диапазон качественной оценки прогностической вероятности возникновения события. В качестве порога отсечения взято значение 0,5. Рассчитывалась вероятность возникновения события Р. Валидность модели оценивалась на основании процента верно переклассифицированных случаев и критерия Somers'D. Проверка общей согласованности прогностической модели с реальными данными осуществлена по критерию согласия Хосмера-Лемешова. Уровень качества созданной модели оценивался путем ROC-анализа, при этом использовалось значение величины площади под ROC-кривой (AUC, area under the curve) с расчетом чувствительности и специфичности. Граница критического уровня значимости р соответствовала 0,05.
Работа выполнена в рамках фундаментальной темы института "Разработка инновационных моделей управления риском развития болезней системы кровообращения с учетом коморбидности на основе изучения фундаментальных, клинических, эпидемиологических механизмов и организационных технологий медицинской помощи в условиях промышленного региона Сибири" (№ госрегистрации 122012000364-5 от 20.01.2022).
Результаты
За период наблюдения умерло 54 (20,8%) пациента, из которых у 48 (88,9%) причиной смерти явилась ОДСН. Были госпитализированы по поводу ОДСН 34 пациента, из них 13 (38,2%) умерли в стационаре, еще 35 (13,5%) пациентов умерли на догоспитальном этапе по поводу ОДСН, развившейся на фоне основного заболевания (у 10 (27%) — дилатационная кардиомиопатия, у 1 (2,8%) — ревматический митральный порок, у остальных 24 (68,6%) — ишемическая кардиомиопатия). Таким образом, было зарегистрировано 69 случаев ОДСН, что составило 26,5% от общей группы. Летальность в общей группе от ОДСН составила 18,5%. При этом шоки ИКД регистрировались только у 10,6% пациентов, и у всех из них ИКД был применен в качестве метода вторичной профилактики ВСС.
Кривая выживаемости Каплана-Майера показала, что наибольшее число смертельных исходов развивалось в течение первых полутора лет (рис. 1).
Анализ динамики состояния пациентов показал, что после имплантации ИКД медиана ФВ ЛЖ в общей группе осталась неизменной — 31 (25; 42) vs 30 (25,3; 36,5)% исходно (р>0,05), однако за период наблюдения и объективные, и субъективные симптомы ХСН ухудшились (табл. 2).
Так, значительно увеличилось количество пациентов с ХСН IIБ стадии — на 41,2% (р<0,01), а также с NYHA III-IV на 6,2% (p<0,05).
Подавляющее большинство пациентов, 204 (78,5%), наблюдались у хирурга-аритмолога с посещениями 1-2 раза в год и 234 (90%) пациента наблюдались у терапевта. У кардиолога регулярно наблюдались всего 80 (30,8%).
На оптимальной медикаментозной терапии (ОМТ) ХСН, подразумевающей прием трехкомпонентной нейро-гуморальной блокады (блокатор ренин-ангиотензин-альдостероновой системы (РААС), бета-адреноблокатор (БАБ), антагонист минералокортикоидных рецепторов), согласно существующим на момент исследования рекомендациям, находились менее половины пациентов при включении в исследование, и всего 6,9% к концу периода наблюдения [5] (табл. 2). В динамике за период наблюдения существенно снизилась частота приема БАБ с 90,6% до 64,3% (р<0,05) и антагонистов минералокортикоидных рецепторов с 50,8% до 17,4% (р<0,05). Частота приема диуретиков, несмотря на ухудшение течения ХСН, не увеличилась, частота приема оральных антикоагулянтов, дезагрегантов и статинов не соответствовала количеству пациентов, которым эти препараты были показаны в соответствии с диагнозом (рис. 2).
С целью выявления клинико-анамнестических факторов, определяемых до имплантации ИКД и связанных с риском ОДСН, был проведен однофакторный линейный регрессионный анализ с использованием непараметрического U-критерия Манна-Уитни для количественных переменных и логистический регрессионный анализ с использованием хи-квадрата Пирсона и отношением шансов с расчетом 95% доверительного интервала для качественных признаков.
Клинико-инструментальными показателями, повышающими риск прогрессирования ХСН и ОДСН, явились толщина межжелудочковой перегородки и повышенное систолическое давление в легочной артерии (табл. 3).
Качественно оцениваемыми параметрами, связанными с риском ОДСН, оказались: наличие в анамнезе хронической ишемии головного мозга, ФВ ЛЖ <40%, NYHA III-IV, а также отсутствие ОМТ и, в меньшей степени — отсутствие приема ингибитора ангиотензинпревращающего фермента (иАПФ) (табл. 4).
Для определения наиболее значимых предикторов ОДСН далее была выполнена пошаговая логистическая регрессия с включением наиболее важных переменных (все из них могут быть определены при скрининге пациента) с составлением прогностической модели риска развития ОДСН (табл. 5).
Формула прогностической вероятности развития ОДСН в течение четырехлетнего периода наблюдения имеет следующий вид:
P=1/(1+2,718-3,784+0,543×Х1+2,284×Х2+2,273×Х3-2,597×Х4-1,48-1,759×Х5-1,388×Х6-0,936×Х7)×100% [5],
где Х1 — левое предсердие, указывается в см;
Х2 — пол, Х2=0, если пациент женщина, Х2=1, если пациент мужчина;
Х3 — ФВ ЛЖ, Х3=0, если ФВ ЛЖ >40%, Х3=1, если ФВ ЛЖ <40%;
Х4 — функциональный класс NYHA, Х4=0, если NYHA I-II, Х4=1, если NYHA III-IV;
Х5 — прием иАПФ, Х5=0, если пациент не принимает, Х5=1, если пациент принимает;
Х6 — прием блокатора РААС (иАПФ или сартана) в целевой дозе, Х6=0, если пациент не принимает, Х6=1, если пациент принимает в целевой дозе;
Х7 — прием амиодарона, Х7=0, если пациент не принимает, Х7=1, если пациент принимает;
Р>50% свидетельствует о высоком риске развития прогрессирования и декомпенсации ХСН.
Критерий согласия Хосмера-Лемешова для данной прогностической модели составил: χ2=10,081, р=0,259.
При проведении ROC-анализа площадь под ROC-кривой (AUC) созданной модели составила 0,8, что свидетельствует о высокой прогностической способности. Чувствительность модели равна 69,2%, специфичность — 80% (рис. 3).
Все приведённые показатели подтверждают высокую валидность модели.
Для удобства практического применения использования прогностической модели создана компьютерная программа для применения на базе операционных систем Microsoft Windows 9x/NT/2000/Vista, 7, 8 2.
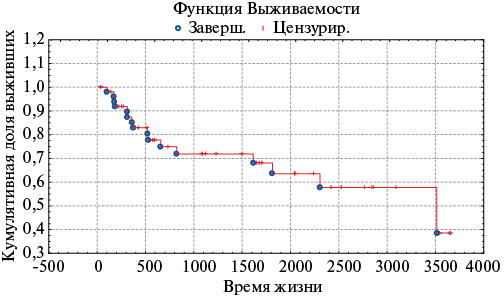
Рис. 1. Кривая выживаемости Каплана-Майера.
Таблица 2
Анализ динамики объективных и субъективных проявлений сердечной недостаточности
Показатель | Исходно, n=260 (100%) | В динамике, n=260 (100%) | р |
ФВ ЛЖ, %, Ме (Q25; Q75) | 30 (25,3; 36,5) | 31 (25; 42) | 0,134 |
ХСН I, n (%) | 35 (13,5) | 32 (12,3) | 0,142 |
ХСН IIА, n (%) | 147 (56,5) | 44 (16,9) | 0,01 |
ХСН IIБ, n (%) | 76 (29,6) | 184 (70,8) | 0,012 |
ХСН III, n (%) | 2 (0,8) | 0 | 0,365 |
NYHA I, n (%) | 4 (1,5) | 3 (1,2) | 0,421 |
NYHA II, n (%) | 175 (67,3) | 160 (61,5) | 0,872 |
NYHA III, n (%) | 63 (24,2) | 80 (30,7) | 0,054 |
NYHA IV, n (%) | 18 (6,9) | 17 (6,5) | 0,052 |
ОМТ, n (%) | 119 (45,8) | 18 (6,9) | 0,001 |
Сокращения: ОМТ — оптимальная медикаментозная терапия, ФВ ЛЖ — фракция выброса левого желудочка, ХСН — хроническая сердечная недостаточность, NYHA — функциональный класс хронической сердечной недостаточности по классификации Нью-Йоркской ассоциации сердца.
Таблица 3
Связь исходных клинико-инструментальных данных с риском ОДСН в отделенном периоде у пациентов с низкой ФВ ЛЖ и имплантированным ИКД, Me (Q25; Q75)
Показатель | Нет прогрессирования ХСН | Есть прогрессирование ХСН | U (p) |
СКФ, мл/мин | 74,23 (60,27; 88,73) | 64,25 (59,27; 91,64) | 1,01 (p=0,3119) |
Калий, ммоль/л | 4,7 (4,4; 5) | 4,9 (4,6; 5,5) | 1,29 (p=0,1966) |
QT, мсек | 0,41 (0,36; 0,44) | 0,4 (0,35; 0,42) | 0,59 (p=0,5519) |
ЧСС, в мин | 72 (65; 84) | 68 (61; 82) | 0,45 (p=0,6550) |
МЖП, см | 1 (0,9; 1,1) | 0,9 (0,8; 1) | 1,92 (p=0,0544) |
P (ЛА), мм рт.ст. | 35 (30; 44) | 47 (35; 63) | 2,26 (p=0,0241) |
ЛП, см | 5,1 (4,7; 5,4) | 5,1 (4,8; 5,5) | 0,49 (p=0,6263) |
Возраст, годы | 59 (53; 66) | 57 (48; 71) | 0,19 (p=0,8498) |
Сокращения: ЛП — левое предсердие, МЖП — межжелудочковая перегородка, Р (ЛА) — систолическое давление в легочной артерии, СКФ — скорость клубочковой фильтрации, ЧСС — частота сердечных сокращений, ХСН — хроническая сердечная недостаточность.

Рис. 2. Сравнительный анализ медикаментозной терапии.
Сокращения: АМКР — антагонисты минералокортикоидных рецепторов, АРА-II — антагонисты рецепторов ангиотензина II, АРНИ — ангиотензиновых рецепторов и неприлизина ингибитор, БАБ — бета-адреноблокатор, иАПФ — ингибитор ангиотензинпревращающего фермента, ОАК — оральные антикоагулянты.
Таблица 4
Связь исходных клинико-анамнестических параметров с риском ОДСН в отделенном периоде у пациентов с низкой ФВ ЛЖ и имплантированным ИКД
Показатель | Х2 | ОШ | ДИ 95% | p |
Мужской пол | 0,19 | 1,29 | 0,41-4,11 | 0,6643 |
Работающие | 1,44 | 0,41 | 0,09-1,84 | 0,2305 |
АГ | 0,00 | 1,01 | 0,32-3,18 | 0,9903 |
СД | 0,01 | 1,07 | 0,3-3,89 | 0,9136 |
ХОБЛ | 1,87 | 0,53 | 0,07-4,18 | 0,1719 |
ХИГМ | 15,63 | 6,05 | 2,26-16,2 | 0,0001 |
ХБП | 0,01 | 0,96 | 0,35-2,62 | 0,9288 |
ИБС | 1,07 | 1,93 | 0,54-6,86 | 0,3019 |
Реваскуляризация | 0,15 | 1,20 | 0,47-3,08 | 0,6991 |
ИМ | 1,67 | 1,98 | 0,69-5,69 | 0,1969 |
ФВ ЛЖ <40% | 5,06 | 2,60 | 1,11-6,11 | 0,0245 |
ХСН IIБ-III | 2,06 | 1,98 | 0,77-5,1 | 0,1514 |
NYHA III-IV | 18,67 | 2,25 | 2,13-4,48 | 0,0034 |
ФП | 1,09 | 0,51 | 0,14-1,83 | 0,2973 |
Нет иАПФ | 3,65 | 1,72 | 1,09-2,99 | 0,0460 |
Нет ОМТ | 9,35 | 4,40 | 1,59-12,17 | 0,0022 |
Амиодарон | 4,64 | 3,29 | 1,06-10,23 | 0,0312 |
Сокращения: АГ — артериальная гипертензия, ДИ — доверительный интервал, ИБС — ишемическая болезнь сердца, ИМ — инфаркт миокарда, иАПФ — ингибиторы ангиотензинпревращающего фермента, ОМТ — оптимальная медикаментозная терапия, ОШ — отношение шансов, СД — сахарный диабет, ФВ ЛЖ — фракция выброса левого желудочка, ФП — фибрилляция предсердий, ХОБЛ — хроническая обструктивная болезнь легких, ХИГМ — хроническая ишемия головного мозга, ХБП — хроническая болезнь почек, ХСН — хроническая сердечная недостаточность, NYHA — функциональный класс хронической сердечной недостаточности по классификации Нью-Йоркской ассоциации сердца.
Таблица 5
Коэффициенты регрессии прогностической модели риска развития прогрессирования и декомпенсации ХСН в течение четырехлетнего периода наблюдения у пациентов с низкой ФВ ЛЖ и имплантированным ИКД
Показатели | Переменные в уравнении | ||||
B | Стандартная ошибка | Вальд | р | Exp (B) | |
ЛП (Х1) | 0,543 | 0,279 | 3,777 | 0,052 | 1,721 |
Пол (Х2) | 2,284 | 0,711 | 10,327 | 0,001 | 9,812 |
ФВ ЛЖ <40% (Х3) | 2,723 | 0,677 | 16,190 | 0,000 | 15,230 |
NYHA III-IV (Х4) | -2,597 | 0,523 | 24,694 | 0,000 | 0,074 |
Прием иАПФ (Х5) | -1,759 | 0,703 | 6,268 | 0,012 | 0,172 |
Прием блокатора РААС (Х6) | -1,388 | 0,515 | 7,272 | 0,007 | 0,249 |
Прием амиодарона (Х7) | -0,936 | 0,425 | 4,855 | 0,028 | 0,392 |
Константа | -3,784 | 1,589 | 5,673 | 0,017 | 0,023 |
Сокращения: иАПФ — ингибиторы ангиотензинпревращающего фермента, ЛП — левое предсердие, РААС — ренин-ангиотензин-альдостероновая система, ФВ ЛЖ — фракция выброса левого желудочка, NYHA — функциональный класс хронической сердечной недостаточности по классификации Нью-Йоркской ассоциации сердца.
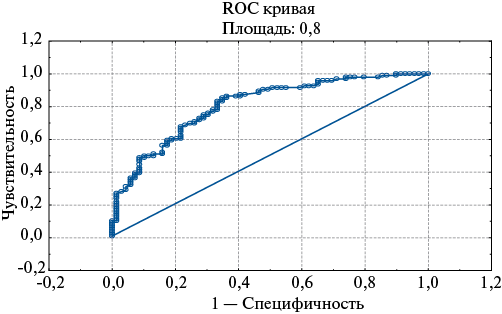
Рис. 3. Прогностическая мощность модели (ROC-кривая).
Обсуждение
Современная клиническая практика свидетельствует о том, что вклад мероприятий по снижению риска ВСС, в т. ч. имплантации ИКД, в улучшение прогноза пациентов с СНнФВ может отличаться от результатов, ранее показанных в рандомизированных клинических исследованиях [1, 6]. Существуют данные российских обсервационных исследований, которые подтверждают меньшую эффективность применения ИКД в группе первичной профилактики ВСС в реальной клинической практике, что проявляется в низкой частоте срабатываний девайса и высокой смертности. Так, по данным исследования, проведенного на базе Филиала НИИ кардиологии "Тюменский кардиологический центр" с включением 199 пациентов, частота срабатываний ИКД была существенно ниже, чем по данным РКИ, а смертность в течение трех лет составила 17% [7]. По данным ретроспективного исследования 419 пациентов с ИКД, проведенного в Астрахани, у 1/3 пациентов имплантация ИКД была необоснованной, в течение 5 лет наблюдения ИКД-шоки регистрировались у 38%, из них у 37% — немотивированные, а смертность составила 19,5% [8]. В целом существующие данные свидетельствуют о более низкой выживаемости пациентов с ИКД в течение года в РФ, 80-83% vs 92-98% за рубежом [9]. Таким образом, низкая ФВ ЛЖ в настоящее время выступает не столько как маркер жизнеугрожающих аритмий, приводящих к ВСС, сколько как индикатор риска, указывающий на плохой прогноз для жизни.
Полученные в настоящем исследовании результаты также убедительно продемонстрировали, что в условиях реальной клинической практики прогноз у пациентов с низкой ФВ ЛЖ в большей степени обусловлен тяжестью основного заболевания и риском ОДСН, чем непосредственным риском ВСС, а вклад ИКД в улучшение прогноза не реализуется. Сложившаяся ситуация может отчасти объясняться успехами современной медикаментозной терапии ХСН, основанной на нейро-гуморальном подходе, который приводит к обратному ремоделированию миокарда и снижению риска развития жизнеугрожающих аритмий. Так, известно 44-процентное снижение риска ВСС на фоне медикаментозного лечения, что превосходит эффективность ИКД-терапии [1, 10]. Также были получены данные о большей медико-социальной эффективности сакубитрила/валсартана в виде лучшей выживаемости при меньших затратах по сравнению с ИКД [11]. По существующим данным, такая ситуация наблюдается во всем мире, так, зарубежные регистры показывают, что пациенты с ИКД относятся к группе неблагоприятного прогноза с летальностью в течение 5 лет до 19,6% [12]. Все эти результаты нисколько не умаляют значение ИКД для профилактики ВСС, однако свидетельствуют о необходимости проведения новых рандомизированных клинических исследований для оптимизации показаний к ИКД-терапии и совершенствовании подходов к стратификации риска ВСС.
В данном контексте остро встает вопрос об обоснованности затрат на ИКД-терапию в качестве метода первичной профилактики ВСС и необходимости оценки индивидуального риска неблагоприятного отдаленного исхода и неаритмической смерти.
Многочисленные исследования показывают, что комплексы простых клинических предикторов способны прогнозировать риски развития неблагоприятных исходов при ХСН, в т. ч. и у пациентов с уже имплантированным ИКД [10][13-17]. Однако, несмотря на многообразие существующих способов прогнозирования у пациентов с ХСН, они ориентированы на прогнозирование риска развития аритмической или неаритмической смерти, а не ОДСН, и не учитывают наличие ИКД [14][15]. Известные способы оценки риска неблагоприятных исходов у пациентов с ИКД в основном нацелены на определение риска развития желудочковых нарушений ритма, вероятности развития мотивированных или немотивированных шоков [16][17]. В литературе обсуждаются риски прогрессирования ХСН при наличии ИКД, но в аспекте влияния внутрижелудочкового электрода на процессы ремоделирования миокарда [10, 13]. Таким образом, практически нет ни одной модели, которая бы позволила определить риск развития ОДСН у пациента с ИКД.
Проведенный анализ факторов, оказывающих влияние на риск ОДСН, не только подтвердил очевидную прогностическую значимость комплекса структурных изменений миокарда — толщины межжелудочковой перегородки, низкой ФВ ЛЖ и повышенного систолического давления в легочной артерии, но и убедительно продемонстрировал очень существенный вклад отсутствия ОМТ ХСН, и особенно, приема блокатора РААС.
Результаты настоящего исследования показали, что особенностями реальной клинической практики ведения пациентов с СНнФВ является отсутствие полноценного наблюдения у кардиолога и очень низкая приверженность к лечению. В условиях амбулаторного наблюдения не происходит никакой оптимизации медикаментозной терапии, а напротив, количество пациентов на ОМТ снижается. Полученные данные подтверждают известный факт, что, если ОМТ не была назначена в стационаре, вероятность ее инициации на амбулаторном этапе крайне низка [18][19]. Такие проблемы существуют не только в Кузбассе, но и во всей РФ. Так, по данным регистрового исследования ЭПОХА-ХСН, в 2017г комбинации базисных лекарственных препаратов для лечения ХСН NYHA III-IV в РФ включали в себя все три рекомендуемых группы препаратов лишь у 14,4%, два препарата получали 46,3%, на монотерапии находились 34,5% и вообще без лечения — 4,6% [6]. Между тем, согласно метаанализу основных исследований, проведенных при СНнФВ, ОМТ по сравнению с двойной терапией ингибитором РААС и БАБ сопровождается снижением риска смерти от всех причин на 47% и от сердечно-сосудистых причин — на 50% [20]. Общая смертность пациентов в настоящем исследовании составила 25,3%, что сопоставимо с данными, полученными в целом по РФ среди пациентов без ИКД, выписанных после эпизода ОДСН [3][6].
Следует отметить, что полученные данные локального регистрового исследования, оценивающие реальную клиническую практику применения ИКД, позволят более эффективно планировать мероприятия по первичной профилактике ВСС и оптимизации ведения пациентов с СНнФВ. Полученные результаты также свидетельствуют о необходимости дальнейших исследований по изучению преимуществ ИКД у различных категорий пациентов с СНнФВ и могут служить предпосылкой для пересмотра стратегий стратификации риска ВСС, основанных только на величине ФВ ЛЖ, в пользу разработки комбинированных моделей оценки риска ВСС с использованием многопараметрического подхода [21][22].
Заключение
Для обеспечения максимальной пользы от ИКД-терапии, перед принятием решения об имплантации ИКД пациенту с низкой ФВ ЛЖ необходимо учитывать факторы, повышающие вероятность ОДСН как основной причины неблагоприятного прогноза и смерти в этой когорте. Особенное внимание следует уделять обязательной ОМТ ХСН как основному модифицируемому фактору риска ОДСН.
Отношения и деятельность: все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье.
1 Лебедева Н. Б., Джун И. Е., Кашталап В. В., Мамчур С. Е. Регистр пациентов в имплантированным кардиовертером-дефибриллятором. Свидетельство о государственной регистрации программы ЭВМ, рег. № 2020662410 от 13.10.2020. М.: Роспатент, 2020.
2 Лебедева Н. Б., Талибуллин И. В., Иванов В. И. Калькулятор расчета риска прогрессирования и декомпенсации хронической сердечной недостаточности у пациентов с имплантированным кардиовертером-дефибриллятором: программа для ЭВМ. Свидетельство о государственной регистрации № 2022662718 от 20.07.2022. М.: Роспатент, 2022.
Список литературы
1. Boriani G, De Ponti R, Guerra F, et al. Sinergy between drugs and devices in the fight against sudden cardiac death and heart failure. Eur J PrevCardiol. 2021;28(1):110-23. doi:10.1093/eurjpc/zwaa015.
2. Богачевская С. А., Богачевский А. Н. Развитие хирургической и интервенционной аритмологии в России за 10 лет. Особенности функционирования службы в дальневосточном регионе. Социальные аспекты здоровья населения. 2017;1(53):2.
3. Виноградова Н. Г., Поляков Д. С., Фомин И. В. Анализ смертности у пациентов с ХСН после декомпенсации при длительном наблюдении в условиях специализированной медицинской помощи и в реальной клинической практике. Кардиология. 2020;60(4):91-100. doi:10.18087/cardio.2020.4.n1014.
4. Rizzello V. Selection of patients eligible for implantable cardioverter defibrillator: beyond left ventricular ejection fraction. European Heart Journal Supplements. 2022;24(1):1139-42. doi:10.1093/eurheartjsupp/suac087.
5. Терещенко С. Н., Галявич А. С., Ускач Т. М. и др. Хроническая сердечная недостаточность. Клинические рекомендации 2020. Российский кардиологический журнал. 2020;25(11):4083. doi:10.15829/1560-4071-2020-4083.
6. Поляков Д. С., Фомин И. В., Беленков Ю. Н. и др. Хроническая сердечная недостаточность в Российской Федерации: что изменилось за 20 лет наблюдения? Результаты исследования ЭПОХА-ХСН. Кардиология. 2021;61(4):4-14. doi:10.18087/cardio.2021.4.n1628.
7. Рычков А. Ю., Кузнецов В. А., Дюрягина Е. Л. и др. Частота мотивированных срабатываний имплантированных кардиовертеров-дефибрилляторов у пациентов с хронической сердечной недостаточностью. Вестник аритмологии. 2015;(81):10-4.
8. Илов Н. Н., Пальникова О. В., Нечепуренко А. А. и др. Пациенты с высоким риском внезапной сердечной смерти: жизнь после имплантации кардиовертера-дефибриллятора (одноцентровое обсервационное исследование) Клин. и эксперимент. хир. Журн. им. акад. Б. В. Петровского. 2018;6(3):98-106. doi:10.24411/2308-1198-2018-13011.
9. Камалиев М. А., Альмуханова А. Б., Бапаева М. и др. Медицинская эффективность после имплантации кардиовертер-дефибриллятора. Вестник Казахского Национального медицинского университета. 2018;3:283-4.
10. Zabel M, Willems R, Lubinski A, et al. Clinical effectiveness of primary prevention implantable cardioverter-defibrillators: results of the EU-CERT-ICD controlled multicentre cohort study. Eur Heart J. 2020;41:3437-47. doi:10.1093/eurheartj/ehaa226.
11. Zacà V. Sacubitril/valsartan or an implantable cardioverter-defibrillator in heart failure with reduced ejection fraction patients: a cost-effectiveness analysis. J CardiovascMed (Hagerstown). 2018;19(10):597-605. doi:10.2459/JCM.0000000000000708.
12. Al-Khatib SM, Mi X, Wilkoff BL, et al. Follow-up of patients with new cardiovascular implantable electronic devices: are experts' recommendations implemented in routine clinical practice? Circ. Arrhythm. Electrophysiol. 2013;6(1):108-16. doi:10.1161/CIRCEP.112.974337.
13. Matsuzoe H, Tanaka H, Matsumoto K, et al. Left ventricular dyssynergy and dispersion as determinant factors of fatal ventricular arrhythmias in patients with mildly reduced ejection fraction. Eur Heart J Cardiovasc Imaging. 2016;17(3):334-42. doi:10.1093/ehjci/jev172.
14. Frolov AV, Vaikhanskaya TG, Melnikova ОР, et al. Risk stratification personalised model for prediction of life-threatening ventricular tachyarrhythmias in patients with chronic heart failure. Kardiologia Polska. 2017;75(7):682-8. doi:10.5603/KP.a2017.0060.
15. Naksuk N, Akkaya M, Adabag S. Application of the Multicenter Automatic Defibrillator Implantation Trial II risk score in a nontrial setting. Am J Cardiol. 2013;112(4):530-2. doi:10.1016/j.amjcard.2013.04.019.
16. Levy WC, Mozaffarian D, Linker DT, et al. The Seattle Heart Failure Model: prediction of survival in heart failure. Circulation. 2006;113(11):1424-33. doi:10.1161/CIRCULATIONAHA.105.584102.
17. Younis A, Goldberger JJ, Kutyifa V, et al. Predicted benefit of an implantable cardioverter-defibrillator: the MADIT-ICD benefit score. Eur Heart J. 2021;42(17):1676-84. doi:10.1093/eurheartj/ehaa1057.
18. Al‐Majed NS, McAlister FA. Meta‐analysis: cardiac resynchronization therapy for patients with less symptomatic heart failure. Ann Intern Med. 2011;154(6):401‐12. doi:10.7326/00034819154620110315000313.
19. Greene SJ, Butler J, Fonarow GC. Simultaneous or Rapid Sequence Initiation of quadruple medical therapy for heart failure-optimizing therapy with the need for speed. JAMA Cardiol. 2021;6(7):743-4. doi:10.1001/jamacardio.2021.0496.
20. Vaduganathan M, Claggett BL, Jhund PS, et al. Estimating lifetime benefits of comprehensive disease-modifying pharmacological therapies in patients with heart failure with reduced ejection fraction: a comparative analysis of three randomised controlled trials. Lancet. 2020;396(10244):121-8. doi:10.1016/S0140-6736(20)30748-0.
21. Van der Bijl P, Bax JJ. Imaging for risk stratification of sudden cardiac death. Herzschrittmacherther Elektrophysiol. 2022;33(3):261-7. doi:10.1007/s00399-022-00884-6.
22. Kammoun I, Bennour E, Laroussi L, et al. Risk stratification for sudden cardiac death in patients with heart failure: Emerging role of imaging parameters. Herz. 2021;46(6):550-7. doi:10.1007/s00059-021-05032-3.
Об авторах
Н. Б. ЛебедеваРоссия
Наталия Борисовна Лебедева — д. м. н., доцент, в. н. с. лаборатории реабилитации.
Кемерово
Конфликт интересов:
нет
И. В. Талибуллин
Россия
Иляс Вильямович Талибуллин — врач-кардиолог.
Кемерово
Конфликт интересов:
нет
П. Г. Парфенов
Россия
Павел Геннадьевич Парфенов — м. н. с. лаборатории фиброзирования миокарда.
Кемерово
Конфликт интересов:
нет
А. П. Егле
Россия
Альберт Павлович Егле — ординатор по кардиологии.
Кемерово
Конфликт интересов:
нет
О. Л. Барбараш
Россия
Ольга Леонидовна Барбараш — д. м. н., профессор, член-корр. РАН, директор.
Кемерово
Конфликт интересов:
нет
Дополнительные файлы
- У пациентов с низкой фракцией выброса левого желудочка и имплантированным кардиовертером-дефибриллятором прогноз во многом определяется риском развития острой декомпенсации сердечной недостаточности.
- Необходим персонифицированный подход для определения потребности в имплантации кардиовертера-дефибриллятора с учетом индивидуального риска неаритмической смерти.
- На основе комплекса рутинных клинико-анамнестических факторов, определяемых до имплантации кардиовертера-дефибриллятора, создана новая прогностическая модель риска развития острой декомпенсации сердечной недостаточности, удобная для практического применения.
Рецензия
Для цитирования:
Лебедева Н.Б., Талибуллин И.В., Парфенов П.Г., Егле А.П., Барбараш О.Л. Факторы, связанные с риском прогрессирования и декомпенсации хронической сердечной недостаточности у пациентов с имплантированным кардиовертером-дефибриллятором. Российский кардиологический журнал. 2024;29(3):5619. https://doi.org/10.15829/1560-4071-2024-5619. EDN: YUEMYV
For citation:
Lebedeva N.B., Talibullin I.V., Parfenov P.G., Egle A.P., Barbarash O.L. Factors associated with the risk of progression and decompensation of heart failure in patients with an implantable cardioverter-defibrillator. Russian Journal of Cardiology. 2024;29(3):5619. (In Russ.) https://doi.org/10.15829/1560-4071-2024-5619. EDN: YUEMYV
JATS XML

















































