Перейти к:
Особенности инфаркта миокарда с подъемом сегмента ST при наличии метаболически-ассоциированной жировой болезни печени
https://doi.org/10.15829/1560-4071-2023-5552
EDN: UOQYSP
Аннотация
Цель. Оценка особенностей инфаркта миокарда с подъемом сегмента ST (ИМпST) у пациентов с метаболическим синдромом (МС) при наличии и отсутствии метаболически-ассоциированной жировой болезни печени (МАЖБП).
Материал и методы. 144 пациента с ИМпST при наличии МС, поступившие для выполнения первичной коронароангиографии и чрескожного коронарного вмешательства (ЧКВ), из них 71 с МАЖБП (1 группа, возраст 62,9 (59,9;66,0) лет, женщин 17 человек), контрольная группа (73 человека без МАЖБП, возраст 63,2 (59,1;66,8) лет, женщин 17 человек) формировалась по правилу наибольшего уравновешивания 1 группы по критериям МС. В программу обследования входило проведение фиброэластометрии печени, определение кардиоспецифичного тропонина I (cTnI) при поступлении (cTnI-1) и через 24 ч (cTnI-24), среднего объема тромбоцитов (MPV), трансаминаз, гаммаглутамилтрансферазы, концентрации фрагментов цитокератина-18 (ФЦК-18).
Результаты. Больных ИМпST в сочетании с МАЖБП отличает преобладание высокой тромботической нагрузки (TIMI thrombus grade 5, р=0,048), требующей проведения двухэтапного ЧКВ (р=0,018), рост числа тромбоцитов и показателя MPV, снижение степени разрешения элевации ST после первичного ЧКВ, больший уровень трансаминаземии и маркеров печеночной дисфункции; главным условием данных различий служит стеатогепатит, определяющий значительную тропонинемию (р<0,01) и являющийся предиктором высокой тромботической нагрузки (р=0,016), повышенного MPV (р=0,044) и фактором неблагоприятных событий в ближайшие 18 мес. после развития острого коронарного синдрома (р=0,00035). Включение в многомерную модель критерия ФЦК-18 позволяет улучшить качество исходной клинической модели прогноза последующих коронарных событий в случае сочетания ИМпST-МАЖБП с увеличением площади под кривой ROC с 0,788 (95% доверительный интервал (ДИ): 0,69-0,89) до 0,648 (95% ДИ: 0,52-0,78), тест DeLong’s, p=0,044.
Заключение. МАЖБП у больных с ИМпST сочетается с увеличением выраженности коронарного тромбоза и сложности в проведении первичного ЧКВ, главным условием которых, как и неблагоприятных событий после острого коронарного синдрома, является стеатогепатит.
Для цитирования:
Третьякова В.А., Ермилов О.В., Алферов П.К., Чернявская В.Ю., Писанкина Д.И., Третьяков А.Ю. Особенности инфаркта миокарда с подъемом сегмента ST при наличии метаболически-ассоциированной жировой болезни печени. Российский кардиологический журнал. 2023;28(12):5552. https://doi.org/10.15829/1560-4071-2023-5552. EDN: UOQYSP
For citation:
Tretyakova V.A., Ermilov O.V., Alferov P.K., Chernyavskaya V.Yu., Pisankina D.I., Tretyakov A.Yu. ST-segment elevation myocardial infarction in the presence of metabolic-associated fatty liver disease. Russian Journal of Cardiology. 2023;28(12):5552. (In Russ.) https://doi.org/10.15829/1560-4071-2023-5552. EDN: UOQYSP
Метаболически-ассоциированная жировая болезнь печени (МАЖБП), прежде обозначаемая как неалкогольная жировая болезнь, относится к независимым факторам риска сердечно-сосудистой патологии [1-5]. По данным метаанализа, распространенность ишемической болезни сердца при МАЖБП составляет 44,6%, возрастая по мере увеличения тяжести стеатоза (С) [6].
Среди больных с острым коронарным синдромом (ОКС) МАЖБП диагностируется у 60%, сочетается с более значительным поражением коронарных артерий, повышает риск осложнений инфаркта миокарда (ИМ) и внутригоспитальную летальность [7-10].
Критериями диагностики МАЖБП является наличие стеатоза печени (СП), подтвержденного с помощью одной из визуализационных методик или гистологического исследования при отсутствии значительного потребления алкоголя (30 г/сут. этанола для мужчин и 20 г/сут. для женщин) и конкурирующих причин СП, включая сопутствующие хронические заболевания печени [11][12].
Цель исследования состояла в оценке клинических особенностей ИМ с подъемом сегмента ST (ИМпST) у пациентов, поступивших для проведения первичного чрескожного коронарного вмешательства (ЧКВ), страдающих МАЖБП.
Материал и методы
В работу включены 144 больных с ИМпST в сочетании с метаболическим синдромом (МС), поступившие для выполнения первичной коронароангиографии (лучевой доступ) и ЧКВ, из них 71 с МАЖБП (1 группа, возраст 62,9 (59,9;66,0) лет, женщин 17 человек, 23,9%). МАЖБП диагностировалась в соответствии с критериями AASLD и EASL: 1) наличие СП, подтвержденного с помощью одной из визуализационных методик (в нашей работе фиброэластометрии печени) или гистологического исследования, 2) отсутствие значительного потребления алкоголя (30 г/сут. этанола для мужчин и 20 г/сут. для женщин), 3) отсутствие конкурирующих причин СП и сопутствующих хронических заболеваний печени [11][12]. Алкогольный генез заболевания исключали на основании нормальных значений уровня гаммаглутамилтрансферазы (ГГТ), отсутствия стигм хронической алкогольной интоксикации, сообщения самим больным или его родственников об отсутствии факта избыточного употребления алкоголя, отрицательного результата опросника CAGE. Дополнительными критериями исключения являлись асцит, отечный синдром, в т. ч. на фоне хронической сердечной недостаточности, терминальная стадия хронической почечной недостаточности, злокачественные образования. Остальные больные без патологии печени (73 человек) составили контрольную группу, 63,2 (59,1;66,8) лет (женщин 17 человек, 23,3%), формирование которой осуществлялось таким образом, чтобы не только уравновесить демографические характеристики 1 группы, но как можно больше соответствовать ей по критериям МС — величине индекса массы тела, окружности талии, степени артериальной гипертензии, уровню дислипидемии и гипергликемии [13].
До поступления в стационар все пациенты получали ацетилсалициловую кислоту 300 мг, клопидогрел 600 мг, нефракционированный гепарин (60-70 Ед/кг), анальгетическую терапию. Инфаркт-ответственной артерией (ИОА) считался сосуд с острой тромботической (полной или субтотальной) окклюзией. У 133 человек (62 пациента основной, 87,3% и 69 контрольной группы, 94,5%) выполнено экстренное стентирование (стент "Калипсо"). У 11 больных с массивным тромбозом (7,6%), имеющих высокую вероятность развития феномена "no-reflow", проведено первичное двухэтапное ЧКВ: в начале осуществлялось восстановление кровотока способом механической реканализации проводником в сочетании с баллонной дилатацией, дополненной или независимо исполненной аспирацией тромба, после чего назначалась инфузия блокаторов IIb/ IIIa гликопротеиновых рецепторов; далее при сохранении гемодинамически значимого (≥75%) стеноза в ИОА через 5 сут. имплантировался стент.
Для описания сосудистых поражений в прогнозировании успеха и осложнений коронарной ангиопластики использована шкала SYNTAX. Ангиографическая оценка коронарного тромбоза проведена по шкале TIMI trombus grade (ТТG) [14]. Рассчитывался процент разрешения подъема сегмента ST (РПС-ST): отношение разницы суммарного значения подъема точки J во всех отведениях с элевацией ST до и через 90 мин после ЧКВ к сумме исходной величины ее подъема в этих отведениях ×100 (РПС-ST=Σ↑J[до]-Σ↑J[после]/Σ↑J[до]×100). Всем больным проведена фиброэластометрия печени (Fibroscan FS-502 Touch, Echosens, Франция) с функцией САР (Controlled Attenuation Parameter). Показатель плотности печени (ПП), характеризуемый килопаскалями (кПа), определялся как среднее значение всех измерений. Фиброз (Ф) устанавливали при значениях >5,9 кПа, стадии Ф определялись согласно шкале METAVIR: Ф0 ≤5,8 кПа — отсутствие Ф печени; Ф1 — 5,9-7,2 кПа — начальный Ф; Ф2 — 7,3-9,5 кПа — умеренный Ф; Ф3 — 9,6-12,5 кПа — выраженный Ф; Ф4 — ≥12,6 кПа — цирроз печени. Для оценки выраженности С применяли параметр затухания ультразвуковой волны, измеряемый в децибелах/ метр (дБ/м), коррелирующий со степенью С: С0 — нет С — <215 дБ/м; С1 — минимальный С (≤5% гепатоцитов со С) — 215-251 дБ/м; С2 — умеренный С (6-32% гепатоцитов со С) — 252-295 дБ/м; С3 — выраженный С (33-100% гепатоцитов со С) — ≥296 дБ/м. Для исключения конгестивного фактора в повышении ПП при градации Killip ≥II острой сердечной недостаточности суждение об истинных значениях ПП выносили спустя 72 ч после ее купирования.
Кардиоспецифичный тропонин I (cTnI ELISA, США) определяли при поступлении (cTnI-1) и через 24 ч (cTnI-24). В программу обследования входила оценка уровня аспартатаминотрансферазы (АСТ), аланинаминотрансферазы (АЛТ), ГГТ, холестерина липопротеинов высокой плотности, триглицеридов, глюкозы натощак, билирубина, креатинина с расчетом скорости клубочковой фильтрации по Кокрофту-Голту. Для неинвазивной оценки стеатогепатита (СГ) использовали тест, включающий изучение уровня фрагментов цитокератина-18 (ФЦК-18, TPS ELISA, Biotech, Швеция) в сочетании с показателем ПП >8,5 кПа и концентрацией АСТ >40 Ед/л [15]. В общем анализе крови определяли уровень тромбоцитов и их средний объем (MPV).
Различия между двумя группами для непрерывных переменных, выраженных медианой, 25 и 75 квартилем, рассчитаны по U-критерию Манна-Уитни, при сравнении трех групп использован критерий Н (Крускала-Уоллиса), категориальные переменные сравнивались с использованием критерия χ². В связи с выполнением ЧКВ несколькими операторами рассчитывались значения каппы (κ) Коэна для всех ангиографических показателей. Для изучения влияния переменных на формирование особенностей и неблагоприятного прогноза ИМпST при МАЖБП использовались однофакторные и многофакторные модели логистической регрессии (результаты выражались в виде отношения шансов (ОШ) c 95% доверительным интервалом (ДИ)). Переменные с p<0,150 в одномерном анализе были введены как ковариаты в многомерный анализ. Для получения пороговых значений концентрации ФЦК-18 при ИМпST в сочетании с МАЖБП использован метод логистической регрессии с построением ROC-кривой. Аналогичное построение далее выполнено для оценки результативности прогнозирования неблагоприятного течения ИМ при наличии СГ в многофакторной модели с учетом клинических данных возраста, концентрации АСТ (непрерывные переменные) параметра ПП: >8,5 или ≤8,5 кПа (категориальная переменная). На втором этапе проведена проверка возможности повышения качества этой модели путем внесения в нее дополнительной характеристики — концентрации ФЦК-18 в крови (непрерывная переменная); площади под ROC-кривой исходной и улучшенной модели сравнены с применением теста Делонга. Оптимальное пороговое значение во всех случаях задано с условием баланса между чувствительностью (Se) и специфичностью (Sp) — Se~Sp. Использовалась регрессионная модель Кокса наступления одного из неблагоприятных событий в течение 18 мес. с коррекцией на исходное наличие СГ у пациентов: повторный ИМ, повторное ЧКВ, стенокардии. Статистический анализ выполнен с программным обеспечением RStudio 4.3.0 и Statistica 12.0 для Windows.
Исследование было выполнено в соответствии со стандартами надлежащей клинической практики (Good Clinical Practice) и принципами Хельсинкской декларации.
Все участники дали информированное согласие.
Результаты
Структура тяжести С и Ф по данным эластометрии печени при ИМпST у пациентов с МАЖБП представлена в таблице 1.
Таблица 1
Структура тяжести С и Ф по данным эластометрии печени
при ИМпST в сочетании с МАЖБП
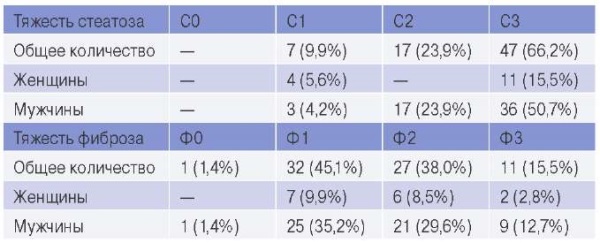
Сокращения: С — стеатоз, Ф — фиброз.
Основным клиническим проявлением ИМ в опытной и контрольной группах являлся ангинозный синдром: 63 человека (88,7%) с МАЖБП, из них у 54,9% (39 человек) появившийся первично, у остальных ставший условием к обращению в силу увеличения интенсивности (15 человек, 21,1%), длительности (7 человек, 9,9%) или появления дополнительных симптомов (2 человека, 2%); у 8 пациентов (11,3%) причинами вызова бригады скорой помощи (БСП) являлось сердцебиение, изменение артериального давления или слабость. В контроле ангинозный приступ имелся у 64 больных (87,7%): первично возник у 42 пациентов (57,5%), увеличил интенсивность — у 18 человек (24,7%), длительность — у 4 (5,5%); еще у 5 больных (6,8%) причиной вызова БСП была тошнота или рвота, изменения артериального давления (3 случая, 4,1%) и слабость (1 человек, 1,4%).
Средние значения времени от появления симптомов до решения о вызове БСП, как и общее время от возникновения симптомов до поступления в стационар, не имели межгрупповых различий и составляли для пациентов с МАЖБП соответственно 60 (40;120) и 155 (100;210) мин (в контроле — 60 (40;90) и 150 (100;180) мин, р>0,05). Тактика терапии ИМ на догоспитальном этапе между группами также совпадала. Исключением явилось более частое использование при МАЖБП метоклопрамида в связи тошнотой или рвотой после внутривенного введения наркотических анальгетиков (9 человек, χ²=4,68; р=0,031), а амбулаторное лечение, практикуемое до развития ИМ, здесь отличалось большим числом пациентов, использовавших "гепатопротекторы" (12 человек, χ²=7,21; р=0,007).
Преобладающей локализацией ИМ являлась передняя стенка левого желудочка (ЛЖ) (47,9% в 1-й и 49,3% во 2 группе), включая вариант новой/предположительно новой блокады левой ножки пучка Гиса (БЛНПГ) с электрокардиографической (ЭКГ) картиной Sgarbossa Е, et al. (1996) [16] либо в дополнении критериями Smith S, et al. (2012) [17] с вариантом дискордантной элевации ST в V1-3 или симптомами Hands M, et al. (1988) [18] (табл. 2).
Таблица 2
Основные клинические, инструментальные и лабораторные характеристики ИМпST
при наличии и отсутствии МАЖБП

Сокращения: АГ — артериальная гипертензия, АЛТ — аланинаминотрансфераза, АСТ — аспартатаминотрансфераза, БЛНПГ — блокада левой ножки пучка Гиса, ГГТ — гаммаглутамилтрансфераза, ДАД — диастолическое артериальное давление, ИМ — инфаркт миокарда, ИМТ — индекс массы тела, ЛНА — левая нисходящая артерия, МАЖБП — метаболически-а ссоциированная жировая болезнь печени, ОТ — окружность талии, ПКА — правая коронарная артерия, САД — систолическое артериальное давление, СКФ — скорость клубочковой фильтрации, ТГ — триглицериды, ХС ЛВП — холестерин липопротеинов высокой плотности, ЧКВ — чрескожное коронарное вмешательство, ЧСС — частота сердечных сокращений, cTnI — кардиоспецифичный тропонин I, при поступлении (cTnI-1), через 24 ч (cTnI-24), MPV — средний объем тромбоцитов, ТТG — шкала TIMI thrombus grade.
При наличии картины повреждения нижней стенки ЛЖ на момент госпитализации (особенно с элевацией ST III>II) всегда проводился целенаправленный поиск признаков повреждения правого желудочка с обязательной регистрацией дополнительных правых грудных отведений, что позволило у 2 пациентов с МАЖБП (2,8%) и в 1 случае контроля (1,4%) установить данный вид патологии (р>0,05). Следует отметить, что клинически показательной гемодинамической нестабильности или брадикардии здесь зафиксировано не было, а у 1 пациента с МАЖБП на повторной ЭКГ, выполненной до проведения ЧКВ, элевация ST в V4R больше не обнаружена. ЭКГ-дебют ОКС с полной БЛНПГ регистрировался одинаково часто у пациентов с наличием и отсутствием МАЖБП (р>0,05).
Известно, что ТnI является суррогатным маркером степени распространенности некроза миокарда. Для ИМ при МАЖБП тропонинемия фиксировалась на значительно большем уровне, чем в группе сравнения на момент госпитализации (в среднем на 26,7%) и через 24 ч (в среднем на 22,6%) (р<0,05).
В связи с выполнением ЧКВ несколькими операторами рассчитывались значения κ Cohen's, которые для всех ангиографических показателей составляли от 0,68 до 0,79. Во всех случаях ИМ преобладало поражение левой коронарной артерии. Для группы с МАЖБП таких было 40 человек, 56,3% (из них с проксимальной локализацией в левой нисходящей артерии или огибающей артерии 57,1%), а в контроле 46 человек, 63,0% (из них в проксимальном отделе левой нисходящей артерии и огибающей артерии — 52,8%). У 14 человек (19,7%) 1 группы и 18 человек без патологии печени (24,6%) окклюзия была неполной (TIMI I или II, р>0,05). Сравнительный анализ характеристик рентгенморфологии бляшки и иных сосудистых нарушений (извитость, кальциноз, признаки коллатерального кровотока) не позволил выявить существенных различий среди пациентов с наличием и отсутствием МАЖБП; потому итоговые значения шкалы Syntax также совпадали. Наоборот, по критерию TTG 5 у пациентов с МАЖБП зафиксировано преобладающее число клинических ситуаций, требовавших отсроченного стентирования для недопущения развития феномена "no-reflow" (р<0,05). Данные ангиографические нарушения сочетались у этих больных с ростом на 5,4% уровня тромбоцитов и на 7,1% MPV (р<0,05).
В ходе оценки уровня печеночных трансаминаз отмечено, что не всегда присутствие эластометрических маркеров С и Ф дополняется повышением уровня АЛТ. Таких примеров в группе с МАЖБП было 12,7% (9 человек). В контрольной группе подобные случаи встречались закономерно чаще (52 человека, χ²=17,27; р<0,001), однако и здесь не исключались ситуации превышения пороговой величины для данного показателя. Наоборот, по характеристике частоты встречаемости нормальных значений АСТ подобная межгрупповая разница отсутствовала. При парном сравнении значений АЛТ отмечен прогнозируемый (почти двукратный) рост ферментемии у пациентов с патологией печени (р<0,001). Аналогичная картина отмечена и для АСТ: у пациентов с ИМ без МАЖБП медиана показателя была ниже на 6,6%.
Подобным образом формировались различия по критериям концентрации ГГТ и общего билирубина, где у пациентов с МАЖБП соответствующие значения на 61,3% и 26,1% превосходили данные в контрольной группе.
Результативность ЧКВ при ИМпST по критерию восстановления потока в ИОА в двух группах оказалась различной в связи с преобладанием при МАЖБП случаев с отсроченной постановкой стента. В итоге степень РПС-ST при исключении ситуаций ИМ с БЛНПГ среди пациентов с МАЖБП для инфаркта передней (1), нижней (2) и боковой (3) стенки ЛЖ составляла, соответственно, 54 (40;63), 63 (10;78) и 43 (10;50), отличаясь от показателей контрольной группы на 8,3 (р1=0,021), 13,7 (р2=0,009) и 3,3% (р3=0,144).
МАЖБП объединяет СП и СГ, являющихся градациями тяжести болезни. Золотым стандартом диагностики СГ служит гистологическая оценка, однако в клинике (особенно при ОКС) чаще используются неинвазивные валидированные методы. Потому отдельно рассмотрены случаи ИМ при МАЖБП с высокой вероятностью СГ, где главным критерием считалось значение ПП >8,5 кПа в сочетании с уровнем АСТ >40 Ел/л (Konerman MA, et al. 2017). Таких в работе было 27 человек. Оказалось, что СГ ассоциирован с высокой тромботической нагрузкой (TTG 5, однофакторное ОШ 0,07, 95% ДИ: 0,01-0,59; р=0,016). Наоборот, СП был связан с существенно меньшей градацией тромбоза — TTG 1 (ОШ 18,0 (95% ДИ: 2,15-150,42), р=0,008) и TTG 2 (ОШ 4,37 (95% ДИ: 1,26-15,09), р=0,02). В этой связи здесь зафиксирован лишь один случай двухэтапного ЧКВ, тогда как при СГ оно требовалось 8 больным (29,6%, χ²=8,40; р=0,0038).
Дополнительно прослежена связь наличия СГ и величины MPV (ОШ 0,66 (95% ДИ: 0,44-0,99), р=0,044), а уровень сТnI-1 и сТnI-24 существенно превышал не только контрольные значения, но и величину среди пациентов со С (табл. 3). Аналогичная разница при ИМ со СГ установлена и для показателя трансаминаземии.
Таблица 3
Ангиографические и лабораторные характеристики ИМ
в зависимости от наличия СГ или СП
у пациентов с МАЖБП и в контрольной группе
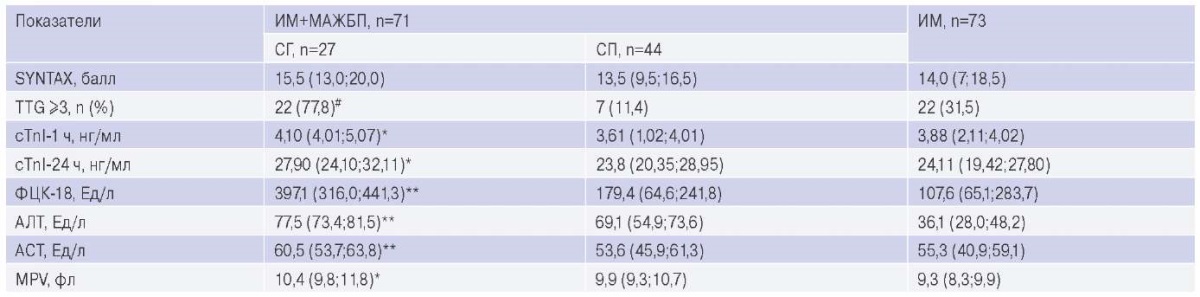
Примечание: * — р<0,01, ** — р<0,001, # — χ²=8,41, р=0,015.
Сокращения: АЛТ — аланинаминотрансфераза, АСТ — аспартатаминотрансфераза, ИМ — инфаркт миокарда, МАЖБП — метаболически-ассоциированная жировая болезнь печени, СГ — стеатогепатит, СП — стеатоз печени, ФЦК-18 — фрагменты цитокератина-18, cTnI — кардиоспецифичный тропонин I, при поступлении (cTnI-1), через 24 ч (cTnI-24), MPV — средний объем тромбоцитов, ТТG — шкала TIMI thrombus grade.
Хроническое воспаление с гибелью гепатоцитов в результате апоптоза определяет рост концентрации второго маркера СГ — ФЦК-18. Медиана и межквартильный интервал показателя при ИМ с наличием и отсутствием МАЖБП составляли 242,6 (100,2;358,6) и 107,6 (65,1;283,7) Ед/л, р=0,004, причем наибольший уровень ФЦК-18 регистрировался среди больных СГ (критерий Н=40,03).
Изучен 18-мес. катамнез больных. При использовании регрессионной модели Кокса с коррекцией на исходное наличие СГ установлено повышение в 8,52 раза риска наступления одного из неблагоприятных событий в этот срок у таких пациентов (рис. 1).
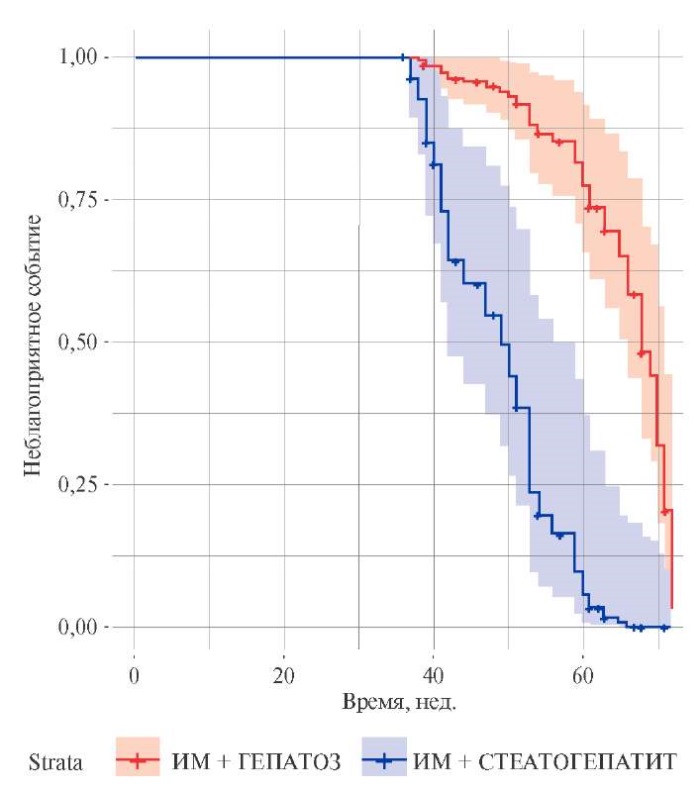
Рис. 1. Кривые регрессионной модели Кокса
для пациентов с ИМпST при наличии и отсутствии СГ.
Сокращение: ИМ — инфаркт миокарда.
Построение ROC-кривой было выполнено для определения наилучшего порогового значения показателя ФЦК-18 при сочетании МАЖБП и ИМ. Установлено, что наилучшее значение отсечения при ИМпST в случае сопутствующего СГ составляет 427 Ед/л с характеристикой Se этого отсечения 81,7% (95% ДИ: 79,0-96,3), Sp — 44,2% (95% ДИ: 41,9-95,1), положительная прогностическая ценность, отрицательная прогностическая ценность и значение точности (аccuracy), соответственно, равнялись 86,0% (95% ДИ: 79,1-98,1), 95,0% (95% ДИ: 88,3-100) и 91,0% (95% ДИ: 87,0-98,0) с площадью под кривой ROC 94,5 (95% ДИ: 88,7-99,5).
Результаты однофакторной и многофакторной логистической регрессии, анализирующие предикторы неблагоприятного прогноза ИМ, представлены в таблице 4.
Таблица 4
Предикторы неблагоприятного прогноза ИМпST при МАЖБП
в однофакторной и многофакторной логистической регрессии
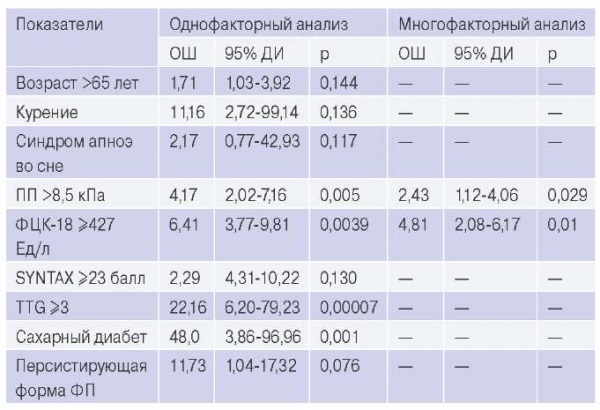
Сокращения: ДИ — доверительный интервал, ОШ — отношение шансов, ПП — плотность печени, ФП — фибрилляция предсердий, ФЦК-18 — фрагменты цитокератина-18, ТТG — шкала TIMI thrombus grade.
При однофакторном анализе показало, что возраст >65 лет, курение, синдром апноэ во сне, балл SYNTAX ≥23, персистирующая форма фибрилляции предсердий в анамнезе, TTG ≥3, ПП >8,5 кПа, ФЦК-18 ≥427 Ед/л и сахарный диабет были связаны с ростом вероятности наступления неблагоприятного события за 18-мес. период наблюдения. В многофакторном анализе роль независимых предикторов при сочетании ИМ-МАЖБП после поправки на другие переменные имели показатели ПП >8,5 кПа и ФЦК-18 ≥427 Ед/л.
Для прогнозирования высокой вероятности неблагоприятных событий в ближайшие 18 мес. у пациентов с ИМ на фоне МАЖБП использована клиническая модель, включающая показатель возраста, АСТ и ПП и вариант с введением дополнительно показателя ФЦК-18. Кривые ROC исходной и улучшенной модели в данном прогнозировании представлены на рисунке 2.
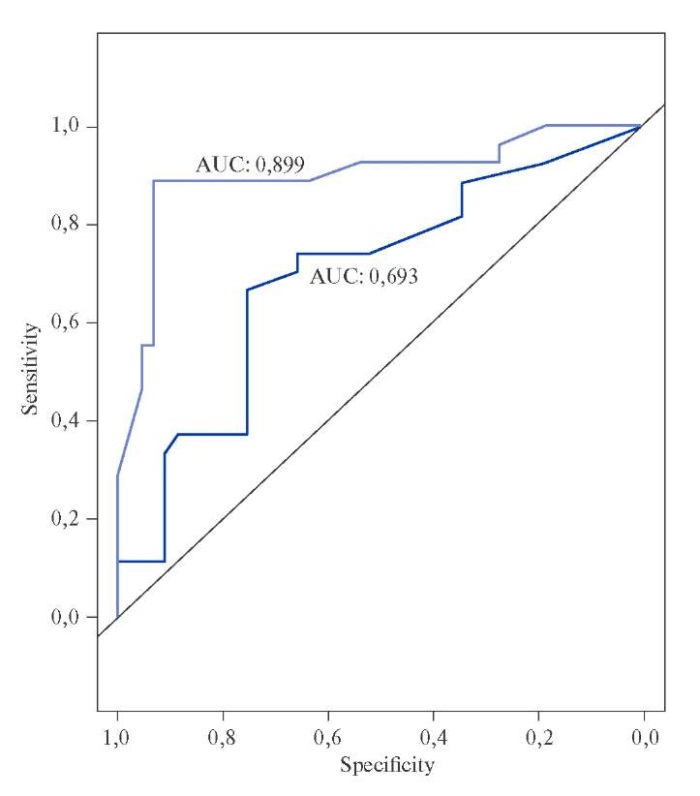
Рис. 2. Точность прогнозирования неблагоприятных коронарных событий после ОКС
при сочетании ИМ и СГ в клинической модели (синяя ROC-кривая)
и при интеграции в нее показателя ФЦК-18 (голубая ROC-кривая).
Примечание: цветное изображение доступно в электронной версии журнала.
Привнесение в модель критерия ФЦК-18 существенно улучшает дискриминационные значения указанного прогнозирования: площадь под кривой 89,9 (95% ДИ: 81,0-98,3) в сравнении с 69,3 (95% ДИ: 56,2-82,0), тест DeLong’s — z-показатель =-3,4, p=0,0007.
Обсуждение
МАЖБП редко встречается у лиц с нормальным индексом массы тела, преимущественно становясь дополнением неразрывного процесса метаболической дисфункции организма и предполагаемого условия повышения сердечно-сосудистого риска [19-22]. Для уточнения такой роли МАЖБП был использован подход оценки особенностей ИМпST при МС, когда в структуре последнего обнаруживается либо отсутствует названная патология печени. В свою очередь, точность диагностики данной малосимптомной нозологии, — часто исключающей выполнение гистологического анализа, особенно при ОКС, — во многом зависит от разрешающей возможности неинвазивного метода. К наиболее совершенным из них сейчас относятся эластометрия печени и магнитно-резонансная томография, при том что эластометрия более проста в использовании в практике кардиологических стационаров, включая отделения неотложной кардиологи. Кроме того, оперируя показателями ПП и уровня ФЦК-18, появляется возможность различать морфологические формы МАЖБП — СП и СГ [23][24]. Цитокератин-18 является промежуточным филаментным белком I типа, на его долю приходится 5% от общего белка гепатоцитов и холангиоцитов; хроническое воспаление с апоптотической гибелью этих клеток повышает концентрацию расщепляемых каспазой фрагментов цитокератина-18, коррелирующих с тяжестью СГ [25][26].
Установлено, что при ИМпST с МС и МАЖБП фиксируется более высокий уровень сТнl-1. Причем, если повышение относительно групп без МАЖБП значений сТnI-24 можно трактовать в т. ч. и в связи с более частым отказом здесь от выполнения стентирования в первые 24 ч по причине массивного коронарного тромбоза, то факт преимущественного увеличения сТnI-1 только у больных со СГ требует анализа возможных механизмов тромботической нагрузки. Действительно, сТnI является суррогатным маркером распространенности некроза миокарда. Сохранение ишемии вследствие двухэтапного ЧКВ с отсроченным стентированием среди пациентов с МАЖБП закономерно увеличивает средние цифры сТnI-24. Но, как установлено в работе, лишь СГ выступает в качестве предиктора TTG 5, тогда как у больных со СП TTG 5 встречается существенно реже (χ²=7,18; р=0,0074). СП, наоборот, служит предиктором наименьшей в данном исследовании градации тромбоза — TTG 1 и 2 (р<0,05). Именно с этим, вероятно, связано, что концентрация сТnI-1 при СГ превосходит не только значения у лиц без МАЖБП, но и уровень у больных со СП.
Более выраженный коронарный тромбоз при МАЖБП в отличие от контрольной группы сопровождается ростом количества тромбоцитов и их среднего объема, что согласуется с данными других исследований [27][28]. В дополнение следует указать на факт, установленный в нашей работе, — преимущественный рост MPV регистрируется только при СГ. Итогом высокой тромботической нагрузки с двухэтапным ЧКВ является меньшая степень разрешения элевации ST в основной группе. Ранее показано, что причиной повышенной тромботической реакции при МАЖБП служит еще системная гиперкоагуляция и нарушение фибринолиза [29][30]. Нами не были выявлены различия между группами с наличием и отсутствием МАЖБП по остальным традиционным ангиографическим критериям. В то же время в предыдущих работах обращается внимание на преобладание при МАЖБП/неалкогольной жировой болезни печени многососудистого поражения и кальцификации коронарных артерий [10][31], что противоречит иным результатам, где MAЖБП достоверно коррелировала, наоборот, с некальцифицированными и смешанными бляшками, а количество пораженных сосудов оказывалось сопоставимым с картиной ОКС без патологии печени [9][32]. Такие расхождения обусловлены несколькими причинами, среди которых главными следует считать, по-видимому, рассмотрение в названных исследованиях МАЖБП как однородной патологии с отсутствием детализации различных форм болезни — СГ и СП при ОКС. Кроме того, заключение строилось на основе традиционной коронароангиографической методики, уступающей в точности регистрации кальциноза, к примеру, методом мультиспиральной компьютерной томографии.
Исследования последних лет свидетельствуют о самостоятельной патогенетической роли МАЖБП в отношении ОКС и ИМ. Доказано, что для развития неалкогольного СГ достоверно больше факторов риска атеросклероза и ИМ [33], а причина дестабилизации бляшки заключается в высокой концентрации медиаторов воспаления и активности эффекторных клеток звена врожденного иммунитета: хроническая гибель гепатоцитов, перегруженных каплями триглицеридов, вызывает высвобождение продуктов группы DAMP (Damage-associated molecular patterns, молекулярные паттерны, связанные с повреждением), которые запускают активацию макрофагов, увеличение количества последних, включая клетки Купфера, приводит к росту циркулирующих системных маркеров воспаления (интерлейкинов-1, -6 и -20), потенцируя атерогенез [32][34]. Клиническим итогом этого служит преобладание в группе МАЖБП случаев осложнений в острый период ИМ и рост внутригоспитальной летальности [35].
Следует подчеркнуть важность раздельного рассмотрения составляющих МАЖБП при ИМ. Именно больных со СГ, как показано в настоящей работе, отличает высокий риск неблагоприятных событий в ближайшие 18 мес. Для чего рационально не только выделять пациентов с высокой вероятностью СГ на основании значений показателя ПП (>8,5 кПа) и цифр АСТ, но и по возможности повышать точность диагностики гепатита, включая оценку уровня ФЦК-18.
Заключение
Больных с ИМпST на фоне МС в сочетании с МАЖБП отличает преобладание значительного тромбоза (ТТG5) и случаев, требующих двухэтапного ЧКВ, рост числа тромбоцитов и показателя MPV, снижение степени РПС-ST после первичного ЧКВ и закономерно больший уровень трансаминаземии и маркеров печеночной дисфункции (билирубина и ГГТ). Условием высокой тромботической нагрузки и фактором неблагоприятных событий после ОКС в ближайшие 18 мес. наблюдения является СГ. В его диагностике при сочетании ИМпST с МАЖБП целесообразно выполнение эластометрии печени с дополнением оценки концентрации ФЦК-18.
Отношения и деятельность: все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье.
Список литературы
1. Драпкина О.М., Корнеева О.Н. Континуум неалкогольной жировой болезни печени: от стеатоза печени до сердечно-сосудистого. Рациональная Фармакотерапия в Кардиологии. 2016;12(4):424-9. doi:10.20996/1819-6446-2016-12-4-424-429.
2. Драпкина О.М., Яфарова А. А. Неалкогольная жировая болезнь печени с сердечно-сосудистый риск: состояние проблемы. Рациональная Фармакотерапия в Кардиологии. 2017;13(5):645-50. doi:10.20996/1819-6446-2017-13-5-645-650.
3. Нелидова А. В., Ливзан М.А., Николаев Н.А. и др. Сердечно-сосудистые заболевания и неалкогольная жировая болезнь печени: связь и патогенетические аспекты фармакотерапии. Рациональная Фармакотерапия в Кардиологии. 2021;17(6):880-8. doi:10.20996/1819-6446-2021-12-14.
4. Герасименко О.Н., Сергеева Я.С., Горбунова А. М. Метаболические и нутритивные аспекты неалкогольной жировой болезни печени. Атеросклероз. 2022;18(2):180-5. doi:10.52727/2078-256X-2022-18-2-180-185.
5. Soares Sturzeneker MC, Montemezzo M, Precoma DB, et al. The relationship between non-alcoholic fatty liver disease and acute coronary syndrome severity: is non-alcoholic fatty liver disease a risk marker of coronary atherosclerotic disease? European Heart Journal. 2021;42(1):ehab724-1449. doi:10.1093/eurheartj/ehab724.1449.
6. Toh J, Pan X, Tay P, et al. A Meta-Analysis on the Global Prevalence, Risk factors and Screening of Coronary Heart Disease in Nonalcoholic Fatty Liver Disease. Clinical Gastroenterology and Hepatology. 2022;20:2462-73. doi:10.1016/j.cgh.2021.09.021.
7. Montemezzo M, Turki A, Stahlschmidt F, еt al. Nonalcoholic Fatty Liver Disease and Coronary Artery Disease: Big Brothers in Patients with Acute Coronary Syndrome. The Scientific World Journal. 2020:1-5. doi:10.1155/2020/8489238.
8. Белая И.Е. Оптимизация лечения больных с инфарктом миокарда, сочетанным с неалкогольной жирововой болезнью печени. Российский кардиологический журнал. 2017;(11):47-55. doi:10.15829/1560-4071-2017-11-47-55.
9. Noda T, Kamiya K, Hamazaki N, et al. The prevalence of metabolic dysfunction-associated fatty liver disease and its association with physical function and prognosis in patients with acute coronary syndrome. J.Clin. Med. 2022;11(7):1847. doi:10.3390/jcm11071847.
10. Ismaiel A, Popa SL, Dumitrascu DL. Acute coronary syndromes and nonalcoholic fatty liver disease: "Un Affaire de Coeur". Canadian Journal of Gastroenterology and Hepatology. 2020:8825615. doi:10.1155/2020/8825615.
11. Chalasani N, Younossi Z, Lavine JE, et al. The diagnosis and management of nonalcoholic fatty liver disease: practice guidance from the American Association for the Study of Liver Diseases. Hepatology. 2018;67(1):328-57. doi:10.1002/hep.29367.
12. Eslam M, Sanyal AJ, George J, et al. MAFLD: a consensus-driven proposed nomenclature for metabolic associated fatty liver disease. Gastroenterology. 2020;158(7):1999-2014.
13. Беленков Ю.Н., Привалова Е. В., Каплунова В.Ю. и др. Метаболический синдром: история развития, основные критерии диагностики. Рациональная Фармакотерапия в Кардиологии. 2018;14(5):757-64. doi:10.20996/1819-6446-2018-14-5-757-764.
14. Gibson CM, de Lemos JA, Murphy SA, et al. Combination Therapy With Abciximab Reduces Angiographically Evident Thrombus in Acute Myocardial Infarction. A TIMI 14 Substudy. Circulation. 2001;103(21):2550-4. doi:10.1161/01.cir.103.21.2550.
15. Konerman MA, Jones JC, Harrison SA. Pharmacotherapy for NASH: Current and emerging. Journal of Hepatology. 2018;68(2):362-75. doi:10.1016/j.jhep.2017.10.015.
16. Sgarbossa EB, Pinski SL, Barbagelata A, et al. Electrocardiographic diagnosis of evolving acute myocardial infarction in the presence of left bundle-branch block. New England Journal of Medicine. 1996;334(8):481-7. doi:10.1056/NEJM199602223340801.
17. Smith SW, Dodd KW, Henry TD, et al. Diagnosis of ST-elevation myocardial infarction in the presence of left bundle branch block with the ST-elevation to S-wave ratio in a modified Sgarbossa rule. Annals of emergency medicine. 2012;60(6):766-76. doi:10.1016/j.annemergmed.2012.07.119.
18. Hands ME, Cook EF, Stone PH, et al. Electrocardiographic diagnosis of myocardial infarction in the presence of complete left bundle branch block. American heart journal. 1988;116(1):23-31. doi:10.1016/0002-8703(88)90245-1.
19. Olubamwo OO, Virtanen JK, Voutilainen A, et al. Association of fatty liver index with the risk of incident cardiovascular disease and acute myocardial infarction. European Journal of Gastroenterology & Hepatology. 2018;30(9):1047-54. doi:10.1097/MEG.0000000000001183.
20. Labenz C, Huber Y, Michel M, et al. Impact of NAFLD on the Incidence of Cardiovascular Diseases in a Primary Care Population in Germany. Digestive Diseases and Sciences. 2020;65:2112-9. doi:10.1007/s10620-019-05986-9.
21. Kim JH, Moon JS, Byun SJ, et al. Fatty liver index and development of cardiovascular disease in Koreans without pre-existing myocardial infarction and ischemic stroke: a large population-based study. Cardiovascular Diabetology. 2020;19(1):1-9. doi:10.1186/s12933-020-01025-4.
22. Tsutsumi T, Eslam M, Kawaguchi T, et al. MAFLD better predicts the progression of atherosclerotic cardiovascular risk than NAFLD: generalized estimating equation approach. Hepatology Research. 2021;51(11):1115-28. doi:10.1111/hepr.13685.
23. Tada T, Saibara T, Ono M, et al. Predictive value of cytokeratin-18 fragment levels for diagnosing steatohepatitis in patients with nonalcoholic fatty liver disease. European Journal of Gastroenterology & Hepatology. 2020;33(11):1451-8. doi:10.1097/MEG.0000000000002176.
24. Wu G, Li H, Fang Q, et al. Complementary Role of Fibroblast Growth Factor 21 and Cytokeratin 18 in Monitoring the Different Stages of Nonalcoholic Fatty Liver Disease. Sci Rep. 2017;7:5095. doi:10.1038/s41598-017-05257-5.
25. Tajima S, Yamamoto N, Masuda S.Clinical prospects of biomarkers for the early detection and/or prediction of organ injury associated with pharmacotherapy. Biochemical Pharmacology. 2019;170:113664. doi:10.1016/j.bcp.2019.113664.
26. Uhlén M, Fagerberg L, Hallström BM, et al. Tissue-based map of the human proteome. Science. 2015;347(6220):1260419. doi:10.1126/science.1260419.
27. Chao YL, Wu PY, Huang JC, et al. Hepatic steatosis is associated with high white blood cell and platelet counts. Biomedicines. 2022;10(4):892. doi:10.3390/biomedicines10040892.
28. Alkhouri N, Kistangari G, Campbell C, et al. Mean platelet volume as a marker of increased cardiovascular risk in patients with nonalcoholic steatohepatitis. Hepatology. 2011;55(1):331. doi:10.1002/hep.24721.
29. Tripodi A, Lombardi R, Primignani M, et al. Hypercoagulability in patients with non-alcoholic fatty liver disease (NAFLD): causes and consequences. Biomedicines. 2022;10(2):249. doi:10.3390/biomedicines10020249.
30. Eriksen PL, Thomsen KL, Sørensen M, et al. Impaired fibrinolysis without hypercoagulability characterises patients with non-alcoholic fatty liver disease. Thrombosis Research. 2022;213:9-15. doi:10.1016/j.thromres.2022.02.023.
31. Park HE, Kwak MS, Kim D, et al. Nonalcoholic fatty liver disease is associated with coronary artery calcification development: a longitudinal study. The Journal of Clinical Endocrinology & Metabolism. 2016;101(8):3134-43. doi:10.1210/jc.2016-1525.
32. Zhang Z, Zheng M, Lei H, et al. A clinical study of the correlation between metabolic-associated fatty liver disease and coronary plaque pattern. Scientific Reports. 2023;13(1):7224. doi:10.1038/s41598-023-34462-8.
33. Lin SY, Lin CL, Lin CC, et al. Risk of acute coronary syndrome and peripheral arterial disease in chronic liver disease and cirrhosis: a nationwide population-based study. Atherosclerosis. 2018;270:154-9.
34. Alisi A, Carsetti R, Nobili V. Pathogen-or damage-associated molecular patterns during nonalcoholic fatty liver disease development. Hepatology. 2011;54(5):1500-2. doi:10.1002/hep.24611.
35. Khokhlov L, Thapa U, Hussain F, et al. Patients admitted with acute coronary syndrome and a history of non-alcoholic fatty liver disease have greater risk of mortality and worse clinical outcomes. J. Am. Coll. Cardio. 2023;81(8):1238. doi:10.1016/S0735-1097(23)01682-0.
Об авторах
В. А. ТретьяковаРоссия
Третьякова Виктория А. — аспирант кафедры внутренних болезней с курсом кардиологии и функциональной диагностики им. В.С. Моисеева Медицинского института
Москва
Конфликт интересов:
Нет
О. В. Ермилов
Россия
Ермилов Олег Владимирович — ассистент, кафедра госпитальной терапии, Медицинский институт ФГАОУ ВО НИУ БелГУ; врач-пульмонолог, пульмонологическое отделение ОГБУЗ Белгородская ОКБ Святителя Иоасафа
Белгород
Конфликт интересов:
Нет
П. К. Алферов
Россия
Алферов Петр К. — к. м. н., доцент, кафедра госпитальной терапии, Медицинский институт ФГАОУ ВО НИУ БелГУ; врач-кардиолог, заведующий кардиологическим отделением № 1 ОГБУЗ Белгородская ОКБ Святителя Иоасафа
Белгород
Конфликт интересов:
Нет
В. Ю. Чернявская
Россия
Чернявская Виктория Ю. — врач-кардиолог, кардиологическое отделение № 1
Белгород
Конфликт интересов:
Нет
Д. И. Писанкина
Россия
Писанкина Дарья И. — студентка 6 курса Медицинского института
Белгород
Конфликт интересов:
Нет
А. Ю. Третьяков
Россия
Третьяков Андрей Ю. — д. м. н., профессор, кафедра семейной медицины, Медицинский институт
Белгород
Конфликт интересов:
Нет
Дополнительные файлы
- Больных с инфарктом миокарда с подъемом сегмента ST в сочетании с метаболически-ассоциированной жировой болезнью печени отличает преобладание высокой тромботической нагрузки, больший уровень трансаминаземии и маркеров печеночной дисфункции.
- Главным условием данных различий служит стеатогепатит, определяющий значительную тропонинемию и являющийся предиктором высокой тромботической нагрузки.
Рецензия
Для цитирования:
Третьякова В.А., Ермилов О.В., Алферов П.К., Чернявская В.Ю., Писанкина Д.И., Третьяков А.Ю. Особенности инфаркта миокарда с подъемом сегмента ST при наличии метаболически-ассоциированной жировой болезни печени. Российский кардиологический журнал. 2023;28(12):5552. https://doi.org/10.15829/1560-4071-2023-5552. EDN: UOQYSP
For citation:
Tretyakova V.A., Ermilov O.V., Alferov P.K., Chernyavskaya V.Yu., Pisankina D.I., Tretyakov A.Yu. ST-segment elevation myocardial infarction in the presence of metabolic-associated fatty liver disease. Russian Journal of Cardiology. 2023;28(12):5552. (In Russ.) https://doi.org/10.15829/1560-4071-2023-5552. EDN: UOQYSP
JATS XML

















































