Перейти к:
Связь типов структурного ремоделирования левого желудочка с дефицитом фибронектина у пациентов с многососудистым поражением коронарных артерий
https://doi.org/10.15829/1560-4071-2023-5532
EDN: EXONNW
Аннотация
Цель. Оценить сывороточный уровень фибронектина у пациентов с многососудистым поражением коронарных артерий и выявить связь уровня фибронектина с фибрилляцией предсердий (ФП), развившейся на госпитальном этапе после операции коронарного шунтирования (КШ), и типами структурного ремоделирования левого желудочка (ЛЖ).
Материал и методы. Проспективное наблюдательное исследование 80 пациентов, которым в плановом порядке была проведена операция КШ на базе Кардиохирургического отделения № 1 ГБУЗ "НИИ СП им. Н.В. Склифосовского ДЗМ" в период с октября 2020г по май 2022г. Группы были разделены в зависимости от развития ФП после операции КШ (19 больных с развившейся ФП на госпитальном этапе после операции КШ (до 10 сут.), 61 пациент — группа контроля). Всем пациентам провели общеклиническое обследование и трансторакальную эхокардиографию, с расчетом типа ремоделирования ЛЖ, определяли уровень фибронектина в сыворотке крови методом иммуноферментного анализа реактивом Fibronectin (Technozym, Австрия).
Результаты. По результатам проведенного иммуноферментного анализа медиана значений фибронектина в группе с ФП составила 110,10 [86,86; 134,00] мкг/мл vs 120,90 [92,01; 161,50] мкг/мл группы сравнения, р=0,19. У обследованной выборки пациентов с ФП наблюдались следующие геометрические модели ЛЖ: нормальная геометрия ЛЖ (НГЛЖ) — у 1 пациента (5,26%), концентрическое ремоделирование ЛЖ (КРЛЖ) — у 3 пациентов (15,79%), концентрическая гипертрофия ЛЖ (КГЛЖ) — у 10 пациентов (52,63%), эксцентрическая гипертрофия ЛЖ (ЭГЛЖ) — у 5 пациентов (26,32%). В группе без ФП у 25 пациентов (40,98%) выявлена НГЛЖ, у 26 пациентов (42,62%) — КРЛЖ, у 6,56% (n=4) диагностирована КГЛЖ, ЭГЛЖ — у 6 пациентов (9,84%). Различия по типам геометрии между группами оказались статистически значимыми (р<0,0001). После выполнения многофакторного анализа c поправкой на пол, возраст, длительность использования ИК предсказательная ценность сохранилась для КГЛЖ — отношение шансов (ОШ) 15,83 (95% доверительный интервал (ДИ): 4,082-1,442,00; р=0,0001) и ЭГЛЖ — ОШ 5,17 (95% ДИ: 1,365-19,573; р=0,015). В ходе дальнейшего исследования показано, что концентрация фибронектина <116,496 мкг/мл c чувствительностью 78% и специфичностью 53% ассоциирована с КГЛЖ (р=0,006) у пациентов обеих групп.
Заключение. Фибронектин в концентрации <116,496 мкг/мл ассоциирован с ремоделированием миокарда по типу КГЛЖ у пациентов с многососудистым поражением коронарных артерий (чувствительность 78%, специфичность 53%; р=0,006).
Ключевые слова
Для цитирования:
Мингалимова А.Р., Гуманова Н.Г., Бикбова Н.М., Джиоева О.Н., Покровская М.С., Ефимова И.А., Серебрянская З.З., Богданова Н.Л., Борисова А.Л., Драпкина О.М. Связь типов структурного ремоделирования левого желудочка с дефицитом фибронектина у пациентов с многососудистым поражением коронарных артерий. Российский кардиологический журнал. 2023;28(12):5532. https://doi.org/10.15829/1560-4071-2023-5532. EDN: EXONNW
For citation:
Mingalimova A.R., Gumanova N.G., Bikbova N.M., Dzhioeva O.N., Pokrovskaya M.S., Efimova I.A., Serebryanskaya Z.Z., Bogdanova N.L., Borisova A.L., Drapkina O.M. Association of left ventricular structural remodeling types with fibronectin deficiency in patients with multivessel coronary artery disease. Russian Journal of Cardiology. 2023;28(12):5532. (In Russ.) https://doi.org/10.15829/1560-4071-2023-5532. EDN: EXONNW
Послеоперационная фибрилляция предсердий (ФП) является самым частым осложнением операции коронарного шунтирования (КШ), развивается в 18-50% случаев и сопряжена с высоким риском развития различных осложнений, увеличением продолжительности госпитализации и, что самое важное, летальности [1]. Патогенетические механизмы возникновения и развития послеоперационной ФП имеют сложный характер и до сих пор до конца не изучены, однако в ряде исследований по выявлению возможных предикторов возникновения аритмии отмечено, что причины периоперационных нарушений ритма носят полиэтиологический характер, а их влияние на возникновение ФП является противоречивым и неоднозначным [2].
Различные патофизиологические процессы потенциально могут быть вовлечены в аритмогенез ФП, включая миокардиальное ремоделирование и ишемию, фиброз, нейрогуморальную активацию, электролитный и гормональный дисбаланс [3]. Интенсивность ремоделирования сердца зависит от реактивности соединительнотканного компонента сердца — внеклеточного матрикса (ВКМ).
Фибронектин как главный адгезивный гликопротеин фибробласта и ВКМ участвует в процессе гемостаза и репарации тканей [4], что позволяет предположить чрезвычайно большое значение этого гликопротеина в процессе ремоделирования как сосудистой стенки, так и миокарда у пациентов с хроническим коронарным синдромом (ХКС). Также с возрастом изменяется количественный и качественный состав ВКМ сердца: увеличивается содержание коллагенов и фибронектина, и снижается — протеогликанов/глюкозаминогликанов и матрицеллюлярных белков, что способствует развитию интерстициального фиброза [5].
В литературе представлены лишь немногочисленные сведения о связи сывороточного уровня фибронектина с ФП, не ассоциированной с хирургическим вмешательством [6][7]. Однако работ, описывающих ассоциацию сывороточной концентрации фибронектина с риском развития послеоперационной ФП, в современной литературе не представлено. Потому актуальным направлением является изучение компонентов ВКМ, результаты которого помогут расширить представление о характере и выраженности ремоделирования миокарда у пациентов с ХКС и оценить взаимосвязь протеинов ВКМ и ФП после операции КШ.
Цель: оценить сывороточный уровень фибронектина у пациентов с многососудистым поражением коронарных артерий, выявить связь уровня фибронектина с ФП, развившейся на госпитальном этапе после операции КШ, и типами ремоделирования левого желудочка (ЛЖ).
Материал и методы
Исследование носило наблюдательный проспективный характер. Были включены 80 пациентов (71 мужчина) с многососудистым поражением коронарного русла, перенесших операцию КШ на фоне клинической картины стенокардии напряжения 3-4 функционального класса в кардиохирургическом отделении № 1 НИИ СП им. Н. В. Склифосовского в период с декабря 2020г по май 2022г.
Критерии включения в исследование: клиническая картина стенокардии напряжения 2-3 функционального класса, возраст старше 18 лет, выполнение операции КШ в плановом порядке.
В исследование не включали пациентов с заболеваниями щитовидной железы, любой формой ФП в анамнезе, клинической или инструментально-лабораторной картиной острого коронарного синдрома и хронической сердечной недостаточности со сниженной фракцией выброса ЛЖ по данным эхокардиографии (ЭхоКГ), с сахарным диабетом 2 типа.
Исследование было выполнено в соответствии со стандартами Надлежащей клинической практики, протокол исследования был одобрен локальным этическим комитетом ФГБУ "НМИЦ ТПМ" Минздрава России № 02-04/20 от 19.03.2020. При поступлении в стационар все пациенты подписывали информированное согласие на лечение и участие в исследовании.
В рамках предоперационной подготовки всем пациентам выполнялся стандартный объем предоперационных инструментальных и лабораторных обследований, включающий электрокардиографию (ЭКГ) (WelchAllyn CP 200, США), ЭхоКГ с применением ультразвукового сканера Vivid E9 (США) c секторным датчиком 3,5 МГц в положении лежа на левом боку (количественно оценивались размеры камер сердца, масса и функция желудочков).
Тип геометрии ЛЖ определялся на основании расчетов отношения массы миокарда ЛЖ (ММЛЖ) к площади поверхности тела (ППТ) и относительной толщины стенок (ОТС) ЛЖ, в зависимости от пола. Расчет ОТС ЛЖ производили по формуле: 2 × толщина задней стенки ЛЖ (мм)/конечный диастолический размер ЛЖ (мм). Выделяли следующие типы геометрии ЛЖ: нормальная геометрия ЛЖ (НГЛЖ): нормальное отношение ММЛЖ/ППТ (≤95 г/м² для женщин и ≤115 г/м² для мужчин) и ОТС ≤0,42; концентрическое ремоделирование ЛЖ (КРЛЖ): нормальное отношение ММЛЖ/ППТ и ОТС >0,42; концентрическая гипертрофия ЛЖ (КГЛЖ): увеличение отношения ММЛЖ/ППТ (>95 г/м² для женщин и >115 г/м² для мужчин) и ОТС >0,42; эксцентрическая гипертрофия ЛЖ (ЭГЛЖ): увеличение отношения ММЛЖ/ППТ и ОТС ≤0,42 [8].
Забор венозной крови из периферической вены, с целью биобанкирования и последующего иммуноферментного анализа, также производился в ходе предоперационной подготовки. Для количественного определения интактного (не расщепленного) фибронектина (составляющего 2/3 общего фибронектина плазмы) в цитратной плазме пациентов обеих групп был использован набор реактивов Fibronectin (Technozym, Австрия) с диапазоном измерений от 0,13 до 2 мкг/мл и заявленной чувствительностью 0,1 мкг/мл.
Операция КШ во всех случаях выполнялась по общепринятой методике.
Диагноз ФП после операции КШ выставлялся при диагностике пароксизма ФП, продолжающегося не менее 30 сек, зарегистрированного в условиях кардиохирургической реанимации (1-2 сут. после операции КШ) на прикроватном кардиомониторе; на участке записи ЭКГ при появлении клинических симптомов ФП (до 10 сут. после операции); на 24-ч мониторировании ЭКГ на 7-10 сут. после операции КШ (с целью диагностики бессимптомной ФП).
Статистический анализ проводили с помощью прикладных программ Excel 2016 ("Microsoft", США) и MedCalc statistical software. Минимальный объем выборки оценивался по формуле Лера (при использовании стандартного отклонения показателя фибронектина минимальный объем выборки составил 30 человек). Для описания количественных показателей с нормальным распределением использовались показатели среднего значения и стандартного отклонения в формате "M±SD", для описания показателей с ненормальным распределением — медиана и межквартильный размах "Me [Q25%; Q75%]". Для качественных показателей определялась частота выявления признака (%). Достоверность различий между изучаемыми группами для непрерывных переменных определялась с помощью критерия U Манна-Уитни, для качественных показателей — критерия χ² Пирсона или точного критерия Фишера для малых выборок.
Для изучения возможной связи между определенными факторами и наличием признаков был использован анализ в модели бинарной логистической регрессии. Для оценки качества прогностической модели, определения отрезных точек был проведен ROC-анализ. Нулевая гипотеза об отсутствии различий отклонялась, если вероятность ошибочно ее отвергнуть не превышала 5% (р<0,05).
Результаты
Основные характеристики пациентов в изучаемых группах представлены в таблице 1. В основную группу вошли 19 пациентов, ранний послеоперационный период которых осложнился развитием ФП, в среднем на 2,0 [ 2,0; 3,6] сут. Группу сравнения составил 61 пациент, ранний послеоперационный период которых не осложнился развитием ФП. Пациенты в группе с ФП были значимо старше (р=0,03) и меньшим индексом массы тела (р=0,04). В анамнезе у пациентов основной группы чаще встречалась хроническая обструктивная болезнь легких (p=0,03). Концентрация фибронектина в сыворотке крови в группе с ФП и группе без ФП была эквивалентна (р=0,19) и не ассоциировалась с развитием аритмии в послеоперационном периоде.
Таблица 1
Основные характеристики изучаемых пациентов
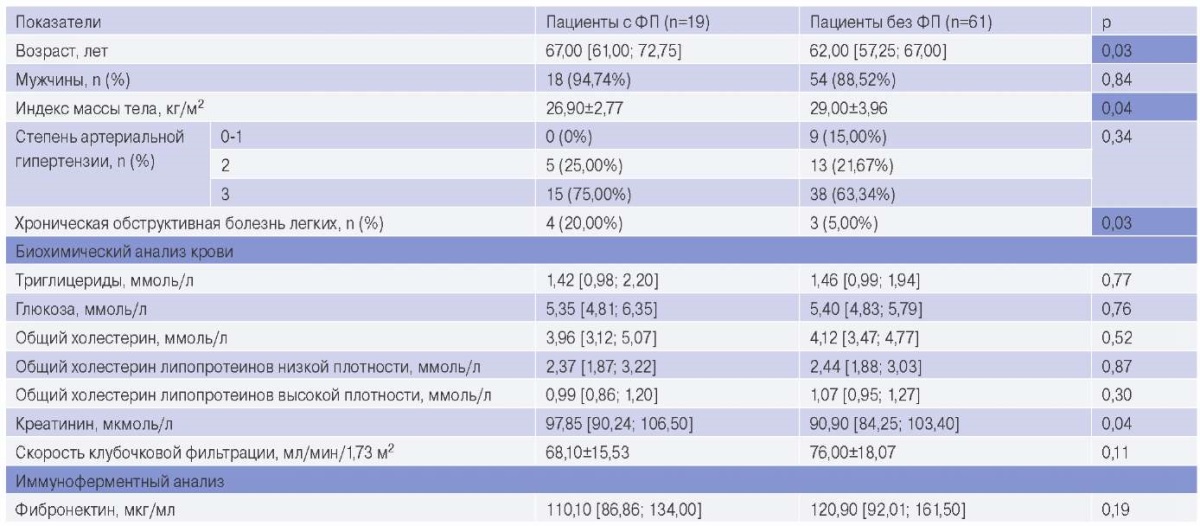
Сокращение: ФП — фибрилляция предсердий.
В таблице 2 представлены результаты сравнения показателей ЭхоКГ до операции КШ у пациентов обеих групп. Отмечено, что в группе с ФП чаще регистрировалась дилатация левого предсердия (ЛП), согласно значениям отношения объема ЛП/ППТ (p=0,008) и гипертрофия ЛЖ, в соответствии с расчетными показателями ММЛЖ (p=0,01) и отношением ММЛЖ/ППТ (p=0,0006). По типам структурно-функционального ремоделирования ЛЖ группы распределились следующим образом: в основной группе у пациентов чаще фиксировались гипертрофические формы ремоделирования ЛЖ (КГЛЖ и ЭГЛЖ), в то время как в группе без ФП большинство пациентов (83,60%) имели НГЛЖ и КРЛЖ.
Таблица 2
Характеристика ЭхоКГ перед операцией КШ у пациентов с ФП и без ФП
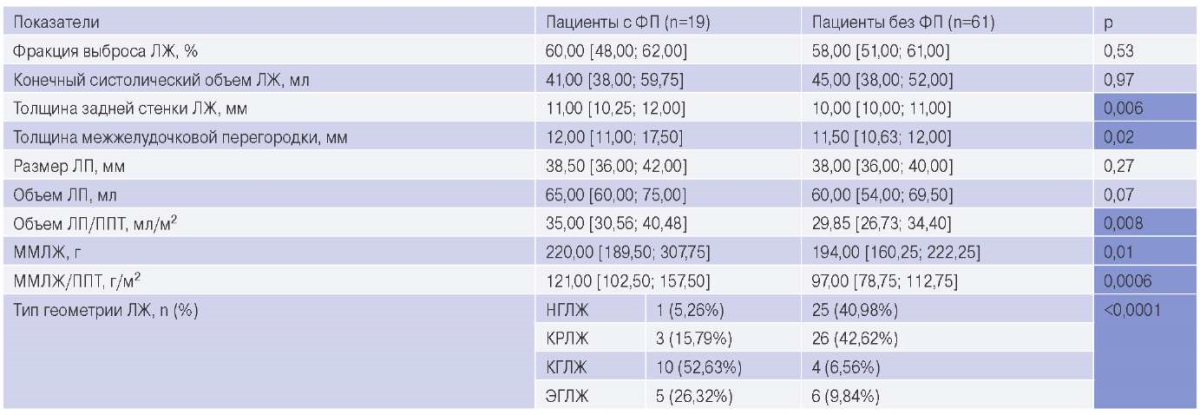
Сокращения: ЛЖ — левый желудочек, ЛП — левое предсердие, КГЛЖ — концентрическая гипертрофия левого желудочка, КРЛЖ — концентрическое ремоделирование левого желудочка, ММЛЖ — масса миокарда левого желудочка, НГЛЖ — нормальная геометрия левого желудочка, ППТ — площадь поверхности тела, ФП — фибрилляция предсердий, ЭГЛЖ — эксцентрическая гипертрофия левого желудочка.
После проведения однофакторного анализа методом бинарной логистической регрессии, типами ремоделирования ЛЖ, увеличивающими шансы развития ФП на госпитальном этапе после операции КШ, стали КГЛЖ — отношение шансов (ОШ) 15,83 (95% доверительный интервал (ДИ): 4,08-61,44, р=0,0001) и ЭГЛЖ — ОШ 5,17 (95% ДИ: 1,36-19,57, р=0,015). Для НГЛЖ ОШ составило 0,074 (95% ДИ: 0,0090,58, р=0,01), для КРЛЖ — ОШ 0,15 (95% ДИ: 0,030,74, р=0,02), рисунок 1.
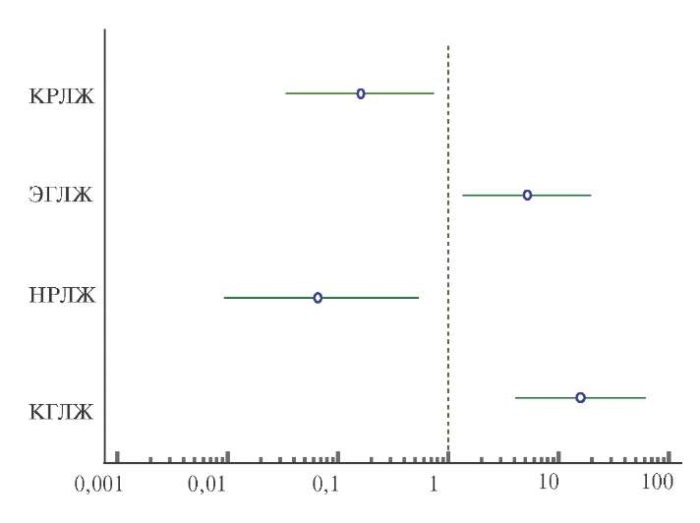
Рис. 1. Однофакторный анализ ассоциации типов геометрии ЛЖ с ФП,
развившейся на госпитальном этапе после операции КШ.
Сокращения: КГЛЖ — концентрическая гипертрофия левого желудочка,
КРЛЖ — концентрическое ремоделирование левого желудочка,
НГЛЖ — нормальная геометрия левого желудочка,
ЭГЛЖ — эксцентрическая гипертрофия левого желудочка.
После проведения многофакторного анализа (с поправкой на пол, возраст и время искусственного кровообращения), структурное ремоделирование миокарда ЛЖ по типу концентрической гипертрофии стало независимым предиктором, увеличивающим шансы развития ФП в 21,58 раз (95% ДИ: 3,39171,23, р=0,003).
Следующим этапом был проведен ROC-анализ, по результатам которого отмечено, что концентрация фибронектина <116,49 мкг/мл c чувствительностью 78% и специфичностью 53% ассоциирована с КГЛЖ (р=0,006), рисунок 2.
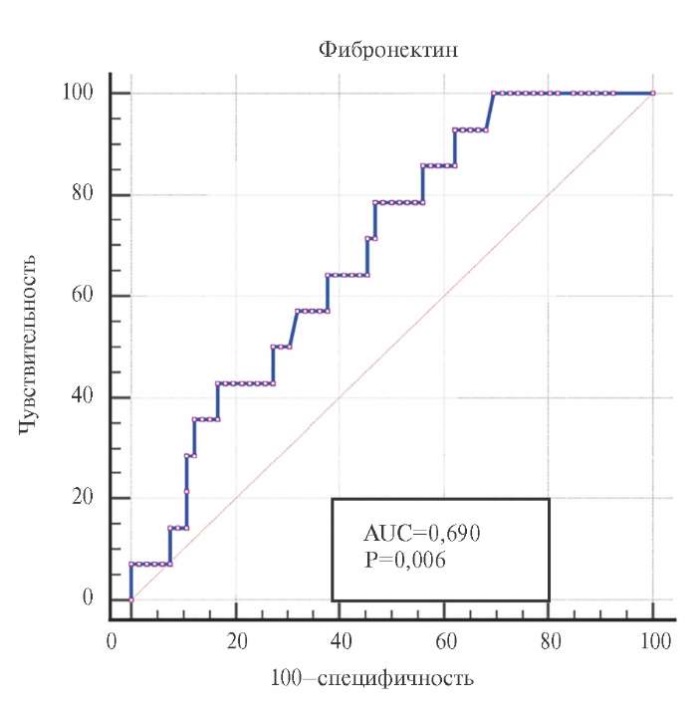
Рис. 2. Характеристическая кривая зависимости КГЛЖ
от уровня фибронектина в сыворотке крови.
Площадь под ROC-кривой =0,690 с 95% ДИ: 0,521-0,743.
Обсуждение
В результате проведенного обследования, у 80 больных с многососудистым поражением коронарных артерий концентрация фибронектина составила 110,10 [ 86,86; 134,00] мкг/мл в основной группе vs 120,90 [ 92,01; 161,50] мкг/мл в группе контроля, и не ассоциировалась с ФП, зарегистрированной на госпитальном этапе после операции КШ (р=0,19).
В настоящее время имеются лишь немногочисленные сведения об ассоциации уровня сывороточного фибронектина с риском возникновения ФП. В исследовании Canpolat U, et al. были представлены данные о том, что содержание плазменной формы фибронектина статистически значимо выше у пациентов с пароксизмальной формой ФП, чем у здоровых лиц (331,90 [ 213,40; 504,70] пг/мл vs 182,10 [ 144,10; 214,30] пг/мл в группе без ФП, р<0,001) и коррелировало с отношением объема ЛП/ППТ, мл/м², согласно результатам однофакторного регрессионного анализа — ОШ 1,003 (95% ДИ: 1,001-1,005, p=0,03). Высказано предположение, что фибронектин является предиктором структурного ремоделирования ЛП [6].
В экспериментальном исследовании с монокроталин-индуцированным фиброзом миокарда предсердий уровень фибронектина был статистически значимо выше в основной группе, частота развития ФП также была выше в группе животных с индуцированным фиброзом миокарда предсердий [7].
Относительно ассоциации фибронектина и ХКС исследования сообщают о противоречивых результатах. Так, в двух отдельных небольших исследованиях [9][10] сообщалось, что сывороточная концентрация фибронектина была повышена у пациентов с ангиографически подтвержденной ишемической болезнью сердца, однако в самом крупном исследовании Zhang Y, et al. [11] с участием 232 человек отмечено, что уровень фибронектина был значительно ниже у пациентов с ХКС.
Следует полагать, что концентрация плазменного фибронектина у пациентов с многососудистым поражением коронарных артерий может быть связана с повышенным расходованием компонентов ВКМ в фазу позднего постинфарктного ремоделирования миокарда ЛЖ, в связи с чем по результатам ROC-анализа концентрация фибронектина <116,49 мкг/мл c чувствительностью 78% и специфичностью 53% ассоциировалась с КГЛЖ (р=0,006) у пациентов обеих групп.
Структурное ремоделирование ЛЖ по типу КГЛЖ, в свою очередь, стало независимым предиктором развития ФП в госпитальном периоде после операции КШ, увеличивающим шансы развития аритмии в 15,83 раз (95% ДИ: 4,08-61,44, р=0,0001). Сопоставимые результаты были получены в исследовании Гаджиевой Л. Х. и др., в котором при анализе нарушений ритма у больных пожилого и старческого возраста в зависимости от типов ремоделирования ЛЖ также выявлено преобладание частоты встречаемости наджелудочковой, желудочковой экстрасистолии и ФП среди пациентов с КГЛЖ (р<0,001) [12]. В то время как в работе Гизатулиной Т. П. и др. структурное ремоделирование ЛЖ по типу эксцентрической гипертрофии стало независимым предиктором выраженного (>35%) фиброза ЛП у пациентов с неклапанной ФП [13].
В заключение стоит отметить, исследование молекулярных основ структурно-функциональной реорганизации ВКМ сердца может позволить составить целостное представление о механизмах ремоделирования миокарда при ХКС, и в т. ч. помочь верифицировать пациентов с повышенным риском развития ФП после операции КШ, требующих своевременной пред- и интраоперационной профилактики аритмии.
Результаты нашего исследования показали, что уровень фибронектина в сыворотке крови обладает достаточно высокой чувствительностью (78%) в отношении развития КГЛЖ у пациентов с многососудистым поражением коронарных артерий, что может быть основой для дальнейших научных изысканий в этом направлении.
Заключение
Таким образом, различий в уровне фибронектина в плазме крови между пациентами с послеоперационной ФП и пациентами с синусовым ритмом выявлено не было. Фибронектин в концентрации <116,496 мкг/мл ассоциирован с ремоделированием миокарда по типу КГЛЖ у пациентов с многососудистым поражением коронарных артерий (чувствительность 78%, специфичность 53%; р=0,006).
Отношения и деятельность: все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье.
Список литературы
1. Кадырова М., Степано ва Ю.А., Гринберг М.С. и др. Предикторы возникновения послеоперационной фибрилляции предсердий. Медицинская визуализация. 2021;25(1):94-116. doi:10.24835/1607-0763-937.
2. Ревишвили А. Ш., Попов В.А., Коростелев А. Н. и др. Предикторы развития фибрилляции предсердий после операции аортокоронарного шунтирования. Вестник аритмологии. 2018;94:11-6. doi:10.25760/VA-2018-94-11-16.
3. Григорян С. В., Азарапетян Л. Г., Адамян К.Г. Миокардиальный фиброз и фибрилляция предсердий. Российский кардиологический журнал. 2018;(9):71-6. doi:10.15829/1560-4071-2018-9-71-76.
4. Васильев С.А., Горгидзе Л.А., Ефремов Е. Е. и др. Фибронектин: структура, функции, клиническая значимость (обзор). Атеротромбоз. 2022;12(1):138-58. doi:10.21518/2307-1109-2022-12-1-138-158.
5. Путятина А. Н., Ким Л.Б. Внеклеточный матрикс сердца и постинфарктный репаративный фиброз (часть 1). Журнал медико-биологических исследований. 2016;4. doi:10.17238/issn2308-3174.2016.4.54.
6. Canpolat U.Association of Plasma Fibronectin Level with Left Atrial Electrical and Structural Remodelling in Lone Paroxysmal Atrial Fibrillation: A cross-sectional study. Turk Kardiyol. Dernegi Arsivi-Arch. Turk. Soc. Cardiol. 2015;43(3):32-8. doi:10.5543/tkda.2015.83893.
7. Hiram R, Naud P, Xiong F, et al. Right Atrial Mechanisms of Atrial Fibrillation in a Rat Model of Right Heart Disease. J.Am. Coll. Cardiol. 2019;74(10):1332-47. doi:10.1016/j.jacc.2019.06.066.
8. Рекомендации по количественной оценке структуры и функции камер сердца. Российский кардиологический журнал. 2012;(4s4):1-27.
9. Orem C, Durmuş I, Kilinç K, et al. Plasma fibronectin level and its association with coronary artery disease and carotid intima-media thickness. Coronary Artery Disease. 2003;14(3):219-24. doi:10.1097/01.mca.0000066454.28270.fb.
10. Ekmekci H, Ekmekci OB, Sonmez H, et al. Evaluation of fibronectin, vitronectin, and leptin levels in coronary artery disease: impacts on thrombosis and thrombolysis. Clinical and Applied Thrombosis/Hemostasis. 2005;11(1):63-70. doi:10.1177/107602960501100107.
11. Zhang Y, Zhou X, Krepinsky JC, et al. Association study between fibronectin and coronary heart disease. Clinical Chemistry and Laboratory Medicine. 2006;44(1):37-42. doi:10.1515/CCLM.2006.008.
12. Гаджиева Л.Х., Масуев К.А., Ибрагимова М.И. Типы ремоделирования левого желудочка у больных гипертонической болезнью пожилого и старческого возраста. Российский кардиологический журнал. 2013;(1):70-4. doi:10.15829/1560-4071-2013-1-70-74.
13. Гизатулина Т. П., Мартьянова Л. У., Павлов А. В. и др. Предикторы выраженного фиброза левого предсердия у пациентов с неклапанной фибрилляцией предсердий. Кардиология. 2020;60(2):47-53. doi:10.18087/cardio.2020.2.n850.
Об авторах
А. Р. МингалимоваРоссия
Мингалимова Альфия Рависовна — врач-кардиолог, н. с. фундаментальных и прикладных аспектов ожирения
Москва
Конфликт интересов:
Нет
Н. Г. Гуманова
Россия
Гуманова Надежда Георгиевна — к. б. н., в. н. с. отдела изучения биохимических маркеров хронических неинфекционных заболеваний
Москва
Конфликт интересов:
Нет
Н. М. Бикбова
Россия
Бикбова Наталья Марсовна — врач ультразвуковой диагностики, н. с. отделения неотложной коронарной хирургии.
Москва
Конфликт интересов:
Нет
О. Н. Джиоева
Россия
Джиоева Ольга Николаевна — д. м. н., в. н. с., руководитель лаборатории кардиовизуализации, вегетативной регуляции и сомнологии
Москва
Конфликт интересов:
Нет
М. С. Покровская
Россия
Покровская Мария Сергеевна — в. н. с., руководитель лаборатории "Банк биологического материала"
Москва
Конфликт интересов:
Нет
И. А. Ефимова
Россия
Ефимова Ирина Александровна — ведущий эксперт лаборатории "Банк биологического материала"
Москва
Конфликт интересов:
Нет
З. З. Серебрянская
Россия
Серебрянская Зарина Зитоселовна — лаборант лаборатории "Банк биологического материала".
Москва
Конфликт интересов:
Нет
Н. Л. Богданова
Россия
Богданова Наталья Леонидовна — м. н. с. отдела изучения биохимических маркеров риска хронических неинфекционных заболеваний
Москва
Конфликт интересов:
Нет
А. Л. Борисова
Россия
Борисова Анна Львовна — ведущий инженер лаборатории "Банк биологического материала"
Москва
Конфликт интересов:
Нет
О. М. Драпкина
Россия
Драпкина Оксана Михайловна — д. м. н., профессор, академик РАН, директор
Москва
Конфликт интересов:
Нет
Дополнительные файлы
- Послеоперационная фибрилляция предсердий (ФП) является самым частым осложнением после операции коронарного шунтирования (КШ).
- Патогенетические механизмы возникновения и развития послеоперационной ФП имеют сложный характер и до сих пор до конца не изучены.
- Изучение компонентов внеклеточного матрикса (ВКМ) поможет расширить представление о характере и выраженности ремоделирования миокарда у пациентов с многососудистым поражением коронарных артерий и оценить взаимосвязь протеинов ВКМ и ФП после операции КШ.
Рецензия
Для цитирования:
Мингалимова А.Р., Гуманова Н.Г., Бикбова Н.М., Джиоева О.Н., Покровская М.С., Ефимова И.А., Серебрянская З.З., Богданова Н.Л., Борисова А.Л., Драпкина О.М. Связь типов структурного ремоделирования левого желудочка с дефицитом фибронектина у пациентов с многососудистым поражением коронарных артерий. Российский кардиологический журнал. 2023;28(12):5532. https://doi.org/10.15829/1560-4071-2023-5532. EDN: EXONNW
For citation:
Mingalimova A.R., Gumanova N.G., Bikbova N.M., Dzhioeva O.N., Pokrovskaya M.S., Efimova I.A., Serebryanskaya Z.Z., Bogdanova N.L., Borisova A.L., Drapkina O.M. Association of left ventricular structural remodeling types with fibronectin deficiency in patients with multivessel coronary artery disease. Russian Journal of Cardiology. 2023;28(12):5532. (In Russ.) https://doi.org/10.15829/1560-4071-2023-5532. EDN: EXONNW
JATS XML

















































