Перейти к:
Распространенность миокардита и его вклад в течение заболевания у пациентов с синдромом первичной гипертрофии миокарда
https://doi.org/10.15829/1560-4071-2023-5528
EDN: VNCLSL
Аннотация
Цель. Оценить частоту миокардита у пациентов с синдромом первичной гипертрофии миокарда и изучить его вклад в течение заболевания.
Материал и методы. В исследование вошли 100 пациентов с первичной гипертрофией миокарда левого желудочка, 52 мужчины и 48 женщин, средний возраст 51,5±15,7 лет, срок наблюдения 10,4 [2,1; 36,1] мес. Всем пациентам выполнены: электрокардиография, суточное мониторирование электрокардиограммы, эхокардиография, а также ДНК-диагностика (n=96), морфологическое исследование миокарда (n=29), магнитно-резонансная томография сердца (n=31), мультиспиральная компьютерная томография сердца (n=26), определение титров антикардиальных антител (n=43), количественное определение свободных лёгких цепей иммуноглобулинов в сыворотке крови и в моче методом иммунофиксации (n=10); сцинтиграфия миокарда с 99mTcпирофосфатом (n=5); биопсия слизистой прямой кишки и/или подкожной жировой клетчатки на амилоид (n=9).
Результаты. У 68% была диагностирована истинная (саркомерная) гипертрофическая кардиомиопатия (ГКМП), у 16% — амилоидоз с поражением сердца, у 10% — болезни накопления, у 3% — нейромышечные заболевания, у 2% гипертрофия миокарда сочеталась с выраженной рестрикцией (смешанный фенотип), а у 1% — синдром LEOPARD. Сопутствующий миокардит диагностирован у 30% больных. При ГКМП миокардит выявлен в 31% случаев, у этих пациентов были достоверно выше функциональный класс сердечной недостаточности (хроническая сердечная недостаточность, 3 [2; 3] vs 2 [1; 3], p=0,026) и смертность (33,3% vs 6,4%, р=0,01). При амилоидозе частота миокардита составила 31,3%, у этих пациентов достоверно чаще наблюдалась желудочковая тахикардия: 80,0% vs 18,2%, р=0,036. Частота сопутствующего миокардита в подгруппе болезней накопления составила 30%: у 2 пациентов с болезнью Фабри и у 1 пациентки с болезнью Данона. Из трех пациентов с нейромышечными заболеваниями миокардит был диагностирован у 1, а в подгруппах с рестриктивным фенотипом и синдромом LEOPARD случаев миокардита зафиксировано не было. Лечение миокардита позволяло стабилизировать состояние пациентов.
Заключение. Наличие сопутствующего миокардита приводило к прогрессированию сердечной недостаточности, усугублению желудочковых нарушений ритма и как следствие увеличению риска внезапной сердечной-смерти, а также повышало вероятность летального исхода. Необходимо активно диагностировать и лечить миокардит у пациентов с синдромом первичной гипертрофии миокарда и в состоянии декомпенсации.
Ключевые слова
Для цитирования:
Лутохина Ю.А., Благова О.В., Коган Е.А., Нартов А.А., Нартова В.Р., Заклязьминская Е.В., Дземешкевич С.Л. Распространенность миокардита и его вклад в течение заболевания у пациентов с синдромом первичной гипертрофии миокарда. Российский кардиологический журнал. 2023;28(11):5528. https://doi.org/10.15829/1560-4071-2023-5528. EDN: VNCLSL
For citation:
Lutokhina Yu.A., Blagova O.V., Kogan E.A., Nartov A.A., Nartova V.R., Zaklyazminskaya E.V., Dzemeshkevich S.L. Prevalence of myocarditis and its contribution to the course of primary myocardial hypertrophy. Russian Journal of Cardiology. 2023;28(11):5528. (In Russ.) https://doi.org/10.15829/1560-4071-2023-5528. EDN: VNCLSL
В профессиональном сообществе кардиологов в последние годы активно обсуждается роль воспаления в формировании клинической картины у пациентов с различными кардиомиопатиями. Существуют две основных концепции, описывающие механизм формирования фенотипа у пациентов с сочетанием миокардита и кардиомиопатий. Первая говорит о том, что миокардит является триггером, который запускает реализацию аномальной генетической программы и приводит к развитию кардиомиопатии [1]. Эти сведения в первую очередь основаны на анализе пациентов с аритмогенной и дилатационной кардиомиопатией. Вторая концепция, напротив, предполагает, что генетически измененный миокард при первичных кардиомиопатиях становится благоприятным фоном для присоединения вирусной инфекции или аутоиммунной агрессии с последующим развитием вторичного миокардита [2][3]. В этом случае характер манифестации и путь развития заболевания во многом зависит от эпигенетических факторов. Среди ученых до сих пор нет единого мнения, что является первичным в случае сочетания миокардита и кардиомиопатии, однако общепринятым считается тот факт, что наличие миокардита ведет к увеличению площади фиброзной ткани и как следствие к появлению или прогрессированию симптомов сердечной недостаточности (СН) и/или возникновению или увеличению выраженности нарушений ритма. В литературе преимущественно встречаются данные о сочетании миокардита с аритмогенной кардиомиопатией правого желудочка (ПЖ), некомпактным миокардом (НКМ) левого желудочка (ЛЖ) или дилатационной кардиомиопатией [1][4][5].
Данные о сочетании с миокардитом гипертрофической кардиомиопатии (ГКМП) и других некоронарогенных заболеваний миокарда, ассоциированных с гипертрофическим фенотипом, представлены единичными публикациями [6][7], что делает изучение такой ассоциации особенно актуальным.
Целью данной работы было оценить частоту миокардита у пациентов с синдромом первичной гипертрофии миокарда и изучить его вклад в течение заболевания.
Материал и методы
В исследование вошло 100 пациентов с первичной гипертрофией миокарда ЛЖ (ГЛЖ), 52 мужчины и 48 женщин, средний возраст 51,5±15,7 лет. Набор пациентов осуществлялся в период с октября 2008г по декабрь 2022г. Протокол исследования был одобрен локальным этическим комитетом Сеченовского университета (№ протокола 10-22 от 19.05.2022). Все пациенты подписали информированное согласие на участие в исследовании.
Критерии включения в исследование: возраст от 18 лет и старше; согласие пациента на участие в исследовании; наличие синдрома гипертрофии миокарда (от 14 мм) в отсутствие значимой гемодинамической перегрузки (пороков сердца, гипертонии), которая могла бы привести к такому фенотипу.
Методы обследования пациентов. Всем пациентам проводились тщательный сбор жалоб и анамнеза, физический осмотр, стандартный объем лабораторного обследования. Обязательное инструментальное обследование включало в себя проведение стандартной электрокардиографии (ЭКГ), суточного мониторирования ЭКГ по Холтеру, трансторакальной эхокардиографии (ЭхоКГ). Магнитно-резонансная томография сердца (МРТ) была выполнена 31 пациенту, мультиспиральная компьютерная томография сердца (МСКТ) — 26 пациентам.
Морфологическое исследование миокарда проведено 29 больным: эндомиокардиальная биопсия (ЭМБ, n=17), интраоперационная биопсия во время операции расширенной миоэктомии (n=8) или аортокоронарного шунтирования (n=1); исследование эксплантированного сердца после ранее выполненной ЭМБ (n=1); аутопсия (n=3). ЭМБ выполнялась по стандартному протоколу доступом через бедренную вену биопсийными щипцами Cordis STANDARD 5.5 F 104 FEMORAL c забором 3-5 фрагментов миокарда. Биоптаты исследовались при помощи световой микроскопии с применением окрасок гематоксилинэозином, по Ван Гизону, Мэссону, Перлсу, конго красным, ШИК-реактивом, а также методом полимеразной цепной реакции на геном кардиотропных вирусов (аденовирусы, Herpes Simplex Virus Type 2, Cytomegalovirus, Herpes Simplex Virus Type 1, EpsteinBarr virus, Varicella zoster virus, Parvovirus B19, Human Herpes Virus 6, Human Herpes Virus 8). Для постановки диагноза миокардита при морфологическом исследовании миокарда использовались Далласские критерии, дополненные иммуногистохимическим исследованием с использованием антител к маркерам Т-лимфоцитов (CD45+ и CD3+), макрофагов (CD68+), В-лимфоцитов (CD20+) [8][9].
Неинвазивная диагностика миокардита. Пациентам, которым не проводилась биопсия миокарда, диагноз миокардита ставился при помощи комплексного алгоритма диагностики, разработанного на основании оценки чувствительности и специфичности различных диагностических критериев в сопоставлении с морфологическим исследованием миокарда у ста пациентов [10]. В рамках данного алгоритма оценивались компоненты анамнестической триады (острое начало заболевания, связь декомпенсации с инфекцией, давность декомпенсации менее года), наличие системных иммунных проявлений. Определялись титры антикардиальных антител в крови методом непрямой иммунофлуоресценции (в лабораториях ФНЦ трансплантологии, МОНИКИ им. М.Ф. Владимирского или НИИ педиатрии им. Ю.Е. Вельтищева по единой методике, n=43): антитела к антигенам ядер кардиомиоцитов или специфический антинуклеарный фактор (АНФ), гладкой мускулатуры, эндотелия, кардиомиоцитов и волокон проводящей системы. Кроме того, учитывалось наличие Lake Louise критериев миокардита при МРТ и субэпикардиального/трансмурального отсроченного накопления контрастного вещества при МСКТ сердца.
Подавляющее большинство пациентов (n=96) было проконсультировано генетиком с последующим выполнением ДНК-диагностики. Пациентам с изолированной ГКМП выполнялось NGSсеквенирование панели 10 генов, кодирующих белки саркомеров (ACTC1, LDB3, MYBPC3, MYH7, MYL2, MYL3, TAZ, TNNI3, TNNT2 и TPM1), на платформе IonTorrent PGMTM (ThermoFisherScientific, США), последующей верификацией находок капиллярным секвенированием (генетический анализатор 3500 AppliedByosystem, ThermoFisherScientific, США).
Пациентам с указанием на синдромный характер ГЛЖ выполнялось капиллярное секвенирование кодирующей последовательности целевых генов (GLA, LAMP2, TTR, FXN, PTPN11 и др.) (3500 AppliedByosystemTM, ThermoFisherScientific, USA) или полноэкзомное секвенирование (NextSeq550Dx, Illumina, США). Пяти пациентам выполнялось полноэкзомное секвенирование.
Пациентам с подозрением на AL-амилоидоз выполнялось количественное определение свободных лёгких цепей иммуноглобулинов в сыворотке крови и в моче методом иммунофиксации (n=10). Для диагностики TTR-амилоидоза использовались ДНК-диагностика (ген TTR, n=7), а также сцинтиграфия миокарда с 99mTc-пирофосфатом (n=5). Ряду пациентов для верификации отложения в тканях проводились биопсия слизистой прямой кишки и подкожной жировой клетчатки на амилоид (n=9), окраска конго красным.
Расчетный риск внезапной сердечной смерти (ВСС) всем пациентам, независимо от этиологии гипертрофии миокарда, оценивался при помощи калькулятора HCM Risk-SC D.
Динамическое наблюдение за пациентами. Средний срок наблюдения за пациентами составил 10,4 [ 2,1; 36,1] мес., размах от 1 мес. до 20 лет. На протяжении всего срока наблюдения оценивались первичные (смерть, трансплантация сердца) и вторичные конечные точки (синкопальные состояния, возникновение устойчивой желудочковой тахикардии (ЖТ), адекватные срабатывания кардиовертерадефибриллятора (ИКД)). Суточное мониторирование ЭКГ в динамике было оценено 35 пациентам, а ЭхоКГ — 39 пациентам.
Статистическая обработка данных. Статистическая обработка выполнена с использованием программы IBM SPSS Statistics v.26. Дискретные данные отражены в виде абсолютных значений и процентов. Непрерывные данные представлены в виде среднего арифметического ± среднеквадратичное отклонение в случае, если распределение значений было нормальным, если распределение отличалось от нормального, данные представлялись в виде квартилей 50 [ 25; 75]. Сравнение пациентов проводилось при помощи χ2 или точного теста Фишера для категориальных дихотомических переменных, а для непрерывных — при помощи U-теста Манна-Уитни, поскольку данные сравнивались по группам, размер которых был <50 наблюдений. Для оценки различий при повторных измерениях использовался критерий Уилкоксона. Статистически значимыми считались различия при p<0,05.
Результаты
По результатам комплексного обследования пациентов с синдромом первичной гипертрофии миокарда у 68% была диагностирована истинная (саркомерная) ГКМП, у 16% — амилоидоз с поражением сердца, у 10% — болезни накопления, у 3% — нейромышечные заболевания, у 2% гипертрофия миокарда сочеталась с выраженной рестрикцией (смешанный фенотип), а у 1% — синдром LEOPARD (рис. 1). Сопутствующий миокардит диагностирован у 30% больных. В связи с высокой гетерогенностью выборки отдельно была проанализирована каждая нозологическая группа пациентов.
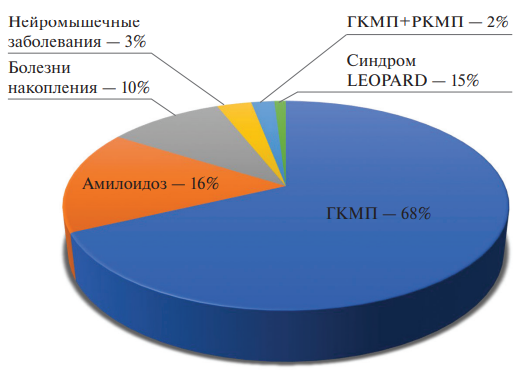
Рис. 1. Структура этиологии синдрома первичной гипертрофии миокарда.
Сокращения: ГКМП — гипертрофическая кардиомиопатия, РКМП — рестриктивная кардиомиопатия.
Гипертрофическая кардиомиопатия. ГКМП была выявлена у 68 пациентов. Средний возраст составил 47,5±14,1 лет, 45,6% — мужчины. У 15 (22,1%) пациентов ГКМП сочеталась с НКМ, у 4 (5,9%) диагностирована апикальная форма ГКМП. Морфологическое исследование миокарда в этой подгруппе было выполнено 20 пациентам.
Миокардит в подгруппе ГКМП был выявлен у 31% пациентов (n=21), из них у 7 (33,3%) выявлен геном кардиотропных вирусов в миокарде (рис. 2).
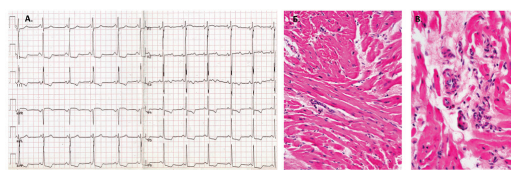
Рис. 2. Результаты обследования пациентки З. с сочетанием ГКМП и миокардита.
Примечание: А.Электрокардиограмма в покое. Признаки гипертрофии левого предсердия и левого желудочка. Нарушение внутрижелудочковой проводимости. Неглубокие несимметричные отрицательные зубцы Т с депрессией сегмента ST до 2 мм в отв. II, III, aVF, V3-V6, подъем сегмента ST до 1 мм в отв. aVR, V1-V2. Б, В. Эндомиокардиальная биопсия, окраска гематоксилином и эозином (Б — малое увеличение; В — большое увеличение). Изменения миокарда в виде причудливой формы ветвящихся кардиомиоцитов, мелкоочагового кардиосклероза с неоангиогенезом и лимфогистиоцитарным инфильтратом в очагах склероза.
Практически у двух третей больных (n=13) с миокардитом отмечалось острое нарастание симптомов СН или усугубление нарушений ритма, а также связь декомпенсации с перенесенной инфекцией, что позволило заподозрить этот диагноз (табл. 1). У пациентов с сочетанием ГКМП и миокардита обращало на себя внимание повышение титров антител кардиомиоцитов, остальные титры антикардиальных антител достоверно не отличались от таковых у пациентов без миокардита. У пациентов с миокардитом чаще выявлялись патогенные мутации (28,6% vs 17,0%), хотя различия и не достигали статистического уровня достоверности. В подгруппе с миокардитом мутации были идентифицированы у 6 пациентов (у 3 в MYH7, у 3 в MyBPC3); среди пациентов без миокардита преобладали мутации в MyBPC3 (n=6), еще у двоих были обнаружены мутации в гене MYH7 (рис. 3). Кроме того, у одного больного были зафиксированы варианты с неясным клиническим значением (VUCs) в генах ACTC1 и MyBPC3, однако мы не учитывали варианты III класса патогенности при подсчете пациентов с мутациями.
Таблица 1
Характеристики пациентов с ГКМП в зависимости от наличия или отсутствия миокардита
Признак | Есть миокардит | Нет миокардита p | |
N (%) | 21 (30,9) | 47 (69,1) | — |
Возраст, лет | 44,6±12,9 | 48,8±14,5 | н/д |
Острое начало, n (%) | 13 (61,9) | 2 (4,3) | <0,001 |
Связь с инфекцией, n (%) | 13 (61,9) | 1 (2,1) | <0,001 |
Морфологическое исследование миокарда, n (%) | 11 (52,4) | 9 (19,1) | 0,009 |
Вирусный геном в миокарде, n (% от пациентов с морфологическим исследованием миокарда) | 7 (63,6) | 5 (55,6) | н/д |
АтКМЦ, титр | 1:80 [ 1:80; 1:80-1:160] | 1:80 [ 1:40; 1:80] | 0,017 |
Патогенные мутации, n (%) | 6 (28,6) | 8 (17,0) | н/д |
ФВ ЛЖ (ЭхоКГ), % | 51,9±16,3 | 57,8±11,2 | н/д |
ФВ ЛЖ (ЭхоКГ) <45%, n (%) | 8 (38,1) | 7 (14,9) | 0,032 |
Гипертрофия ПЖ, n (%) | 4 (19) | 2 (4,3) | 0,059 |
Максимальная толщина стенок ЛЖ (МСКТ), мм | 18,0±3,0 | 23,1±6,5 | 0,038 |
Стадия ХСН | IIА [IIА; IIA] | IIA [I; IIA] | н/д |
ФК ХСН (NYHA) | 3 [ 2; 3] | 2 [ 1; 3] | 0,026 |
Наличие ФП, % | 6 (28,6) | 25 (53,2) | 0,044 |
ЖЭС в сутки, шт. | 289 [ 14; 3513] | 63 [ 10; 404] | н/д |
Наличие ЖТ, % | 11 (52,4) | 23 (48,9) | н/д |
Риск ВСС, % | 3,9 [ 2,4; 6,2] | 4 [ 2,1; 6] | н/д |
Имплантация ИКД, n (%) | 6 (28,6) | 11 (23,4) | н/д |
Смерть, n (%) | 7 (33,3) | 3 (6,4) | 0,01 |
Сокращения: АтКМЦ — антитела к кардиомиоцитам, ВСС — внезапная сердечная смерть, ЖТ — желудочковая тахикардия, ЖЭС — желудочковая экстраси- столия, ИКД — имплантируемый кардиовертер-дефибриллятор, МСКТ — мультиспиральная компьютерная томография, ЛЖ — левый желудочек, ПЖ — правый желудочек, ФВ — фракция выброса, ФК — функциональный класс, ФП — фибрилляция предсердий, ХСН — хроническая сердечная недостаточность, ЭхоКГ — эхокардиография.

Рис. 3. Структура патогенных мутаций у пациентов с изолированной ГКМП и ГКМП в сочетании с миокардитом.
Сокращение: ГКМП — гипертрофическая кардиомиопатия.
Фракция выброса (ФВ) ЛЖ в подгруппах с миокардитом и без достоверно не различалась, однако у больных с сочетанием миокардита и ГКМП ФВ достоверно чаще была <45% (38,1% vs 14,9%, p=0,032).
Интересно, что в подгруппе пациентов с миокардитом толщина миокарда по данным МСКТ сердца была достоверно меньше (18±3 vs 23,1±6,5, p=0,038), у них практически в 2 раза реже встречалась мерцательная аритмия (28,6 vs 53,2, p=0,044), однако при этом функциональный класс (ФК) СН у этих больных был достоверно выше: 3 [ 2; 3] vs 2 [ 1; 3], p=0,026. По риску ВСС, выраженности желудочковых нарушений ритма и частоте имплантации ИКД пациенты не отличались, однако в подгруппе с сочетанием мио кардита и ГКМП обращает на себя внимание значительно более высокая смертность: 33,3% vs 6,4%, р=0,01 (рис. 4). В подгруппе с миокардитом 3 пациента умерли от прогрессирующей хронической СН (ХСН), один вследствие неконтролируемых желудочковых нарушений ритма по типу электрического шторма, два — от острого нарушения мозгового кровообращения, в одном случае точная причина смерти неизвестна. В подгруппе без миокардита один пациент умер внезапно, один — от инфаркта миокарда, один — от инсульта. Двум пациенткам с сочетанием ГКМП и НКМ (одна больная с миокардитом, вторая — без) была выполнена трансплантация сердца по поводу рефрактерной СН. Пациентка с миокардитом в последующем умерла от геморрагического инсульта на фоне тромбоцитопении после трансплантации сердца.
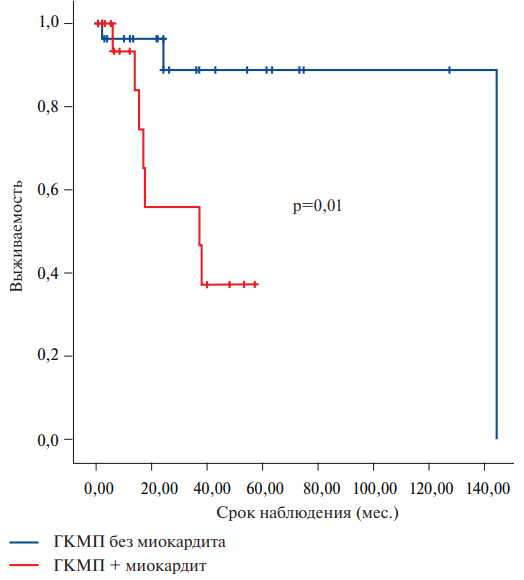
Рис. 4. Кривые Каплан-Майера, характеризующие выживаемость пациентов с ГКМП с миокардитом и без миокардита.
Сокращение: ГКМП — гипертрофическая кардиомиопатия.
Отдельно нами была проанализирована подгруппа с сочетанием ГКМП и НКМ. Частота миокардита в этой подгруппе составила 40% (6 из 15 пациентов). Пациенты с сочетанием ГКМП, НКМ и миокардита были тяжелее по целому ряду параметров в сопоставлении с пациентами с ГКМП и миокардитом без синдрома НКМ (табл. 2).
У всех пациентов с миокардитом и сочетанием ГКМП и НКМ прослеживалась связь декомпенсации с перенесенной инфекцией, а у 2/3 обращал на себя внимание отягощенный по кардиомиопатиям семейный анамнез. Мутации были выявлены у половины пациентов с сочетанием ГКМП, НКМ и миокардита (MyBPC3 у двоих, а у одной больной сочетание мутации в MyBPC3 с двумя мутациями в MYH7) по сравнению с 20% при "чистой" ГКМП с миокардитом (MyBPC3 одного пациента и MYH7 у двоих).
У пациентов с НКМ за счет некомпактного слоя были значительно хуже эхокардиографические параметры, характеризующие ЛЖ: достоверно больший конечный диастолический размер и существенно более низкая ФВ. Кроме того, у половины пациентов с сочетанием ГКМП, НКМ и миокардита отмечалась гипертрофия ПЖ. Обращали на себя внимание агрессивные желудочковые нарушения ритма: расчетный риск ВСС был достоверно выше в подгруппе ГКМП в сочетании с НКМ и миокардитом (6 [ 4,7; 8,9] vs 2,6 [ 2,0; 4,5], p=0,017), ЖТ исходно присутствовала у всех пациентов по сравнению с 1/3 при ГКПМ с миокардитом, а в динамике, несмотря на антиаритмическую терапию, ЖТ сохранялась у половины пациентов с НКМ, в то время как при ГКМП без НКМ она была успешно подавлена у всех пациентов. Количество желудочковых экстрасистол (ЖЭС) также было достоверно выше у пациентов с НКМ на всех этапах наблюдения: исходно, на фоне антиаритмической терапии в первую госпитализацию и при оценке в динамике. В подгруппе с сочетанием НКМ, ГКМП и миокардита умерла половина пациентов в сравнении с четвертью в подгруппе с ГКМП и миокардитом, однако из-за небольшого количества наблюдений различия были статистически недостоверны.
Иммуносупрессивную терапию (ИСТ) миокардита получали 10 (47,6%) пациентов с ГКМП и миокардитом. В половине случаев это был метилпреднизолон (средняя доза 24 [ 14; 40] мг/сут.), в т.ч. у 1 пациента в сочетании с микофенолата мофетилом (2 г/сут.); 3 пациента получали гидроксихлорохин (200-400 мг/сут.); двое — азатиоприн 100-200 мг/сут. Пациенты, получавшие ИСТ миокардита, были исходно достоверно тяжелее практически по всем основным параметрам (табл. 3): у них была выше иммунологическая активность миокардита, что отражали большие титры АНФ, худшая систолическая функция ЛЖ, большие размеры ЛЖ и как следствие более тяжелая СН, а также большее количество ЖЭС, в связи с чем чаще требовалось прибегать к назначению амиодарона.
Несмотря на то, что пациенты, получавшие ИСТ, были достоверно тяжелее по исходным параметрам, у них отмечена тенденция к снижению ФК ХСН. Кроме того, только в этой подгруппе отмечалась достоверная положительная динамика в отношении снижения количества ЖЭС при наблюдении за пациентами в динамике: 1122 [ 164; 10000] vs 1025 [ 85; 3138], p=0,043. В группе ГКМП с миокардитом, не получавшей ИСТ, достоверной положительной динамики по количеству ЖЭС в отдаленному периоде не получено: 14 [ 6; 1249] vs 55 [ 3; 930], p=0,18. По размерам камер сердца и ФВ ЛЖ достоверной динамики в отдаленном периоде не отмечалось ни среди пациентов, получавших ИСТ, ни в подгруппе без ИСТ. Значимых различий по смертности также не выявлено.
Таблица 2
Характеристики пациентов с ГКМП и миокардитом в зависимости от наличия или отсутствия НКМ
Признак | ГКМП + НКМ + миокардит | ГКМП + миокардит | p |
N | 6 | 15 | — |
Связь с инфекцией, % | 6 (100) | 7 (46,7) | 0,044 |
Патогенные мутации, n (%) | 3 (50) | 3 (20) | н/д |
Отягощенный семейный анамнез, n (%) | 4 (66,7) | 3 (20) | 0,038 |
КДР ЛЖ (ЭхоКГ), см | 5,7±0,8 | 4,8±0,8 | 0,032 |
ФВ ЛЖ (ЭхоКГ), % | 38,3±9,3 | 57,4±15,3 | 0,008 |
ФВ ЛЖ (ЭхоКГ) <45%, n (%) | 5 (83,3) | 3 (20) | 0,018 |
Гипертрофия ПЖ, n (%) | 3 (50) | 1 (6,7) | 0,037 |
Риск ВСС, % | 6 [ 4,7; 8,9] | 2,6 [ 2,0; 4,5] | 0,017 |
ЖЭС в сутки (исходно), шт. | 4756 [ 1772; 10000] | 54 [ 8; 305] | 0,004 |
ЖЭС в сутки (лечение), шт. | 661 [ 182; 908] | 24,5 [ 6; 162] | 0,013 |
ЖЭС в сутки (динамика), шт. | 1747 [ 1025; 1747] | 63,5 [ 8; 138] | 0,034 |
Наличие ЖТ (исходно), n (%) | 6 (100) | 5 (33,3) | 0,012 |
Наличие ЖТ (динамика), n (%) | 3 (50) | 0 | 0,014 |
Смерть, n (%) | 3 (50) | 4 (26,7) | н/д |
Сокращения: ВСС — внезапная сердечная смерть, ЖТ — желудочковая тахикардия, ЖЭС — желудочковая экстрасистолия, КДР — конечный диастолический размер, ЛЖ — левый желудочек, ПЖ — правый желудочек, ФВ — фракция выброса, ЭхоКГ — эхокардиография.
Таблица 3
Характеристики пациентов с ГКМП и миокардитом, получавших и не получавших ИСТ миокардита
Признак | ИСТ+ | ИСТ- p | |
N | 10 | 11 | — |
Стадия ХСН | IIА-IIБ [IIА; IIБ] | IIА [I; IIА] | 0,004 |
АНФ, титр | 1:80 [нет; 1:320] | нет [нет; 1:40-1:80] | 0,046 |
ЖЭС в сутки, шт. | 1123 [ 163; 10000] | 14 [ 6; 1249] | 0,027 |
Назначение амиодарона, % | 6 (60) | 1 (9,1) | 0,029 |
ФВ ЛЖ исходно (ЭхоКГ), % | 41,2±14,1 | 60,5±12,6 | 0,006 |
ФВ ЛЖ (ЭхоКГ) <45%, n (%) | 7 (70) | 1 (9,1) | 0,003 |
ПЖ исходно (ЭхоКГ), см | 2,9±0,4 | 2,5±0,3 | 0,047 |
КДР ЛЖ (ЭхоКГ) в динамике, см | 5,7±0,7 | 4,4±0,14 | 0,040 |
КДО ЛЖ (ЭхоКГ) в динамике, мл | 137,8±41,4 | 69,5±5,0 | 0,044 |
ФВ ЛЖ (ЭхоКГ) в динамике, % | 39,7±16,2 | 64,5±5,0 | 0,055 |
ПЖ (ЭхоКГ) в динамике, см | 3,1±0,4 | 2,3±0,4 | 0,056 |
ТР (ЭхоКГ) в динамике, ст. | 1 [0,5; 1] | 0 | 0,03 |
Смерть, n (%) | 4 (40) | 2 (18,2) | 0,268 |
Сокращения: АНФ — антинуклеарный фактор, ЖЭС — желудочковая экстрасистолия, ИСТ — иммуносупрессивная терапия, КДО — конечный диастолический объем, КДР — конечный диастолический размер, ЛЖ — левый желудочек, ПЖ — правый желудочек, ТР — трикуспидальная регургитация, ФВ — фракция выброса, ХСН — хроническая сердечная недостаточность, ЭхоКГ — эхокардиография.
Амилоидоз с поражением сердца. Амилоидоз был диагностирован у 16 пациентов с синдромом первичной гипертрофии миокарда (AL-амилоидоз: n=8; TTR-амилоидоз (мутантный тип): n=6; TTRамилоидоз без мутаций: n=2). Средний возраст пациентов составил 62,8±12,9 лет, мужчины — 62,5% (n=10). Морфологическое исследование миокарда было проведено 4 больным (3 с AL- и 1 с TTRамилоидозом).
Миокардит был диагностирован у 5 (31,3%) пациентов в этой подгруппе (у 4 пациентов с ALамилоидозом, в т.ч. 1 морфологически верифицированный (рис. 5), и у 1 пациента с TTR-амилоидозом).
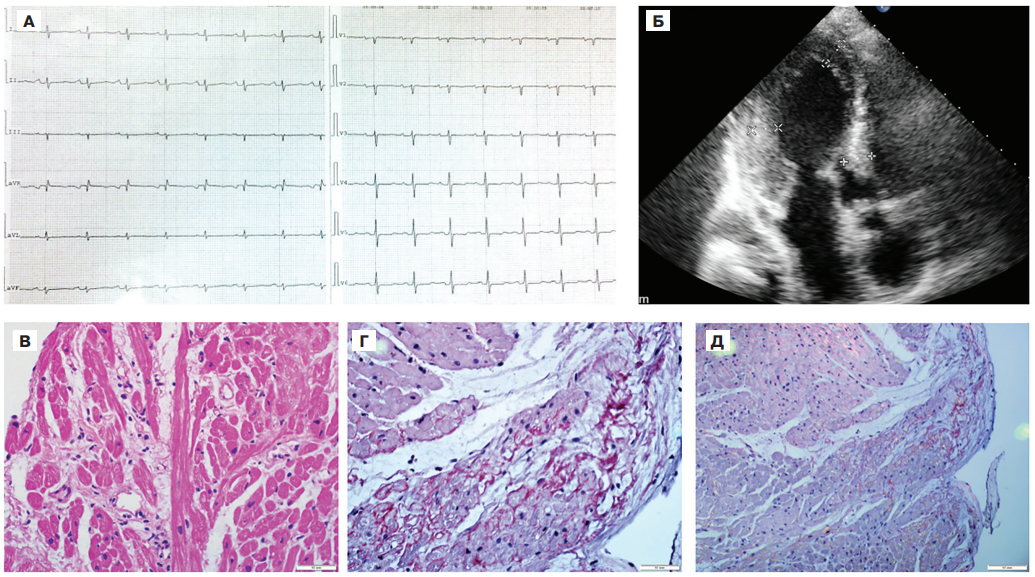
Рис. 5. Результаты обследования пациента Ш. с сочетанием амилоидоза и миокардита.
Примечание: А.Электрокардиограмма в покое. Обращают на себя внимание низкий вольтаж в отведениях от конечностей, недостаточное нарастание зубцов R в грудных отведениях, отсутствие признаков гипертрофии миокарда. Б.Эхокардиография. Симметричная гипертрофия миокарда левого желудочка, миокард неоднородный по эхоплотности, гиперэхогенный. В, Г, Д — в биоптатах миокарда присутствуют лимфоцитарная инфильтрация (В, окраска гематоксилином и эозином), а также отложение гомогенных конгофильных масс в стенках сосудов и стромальных септах (Г, окраска Конго красным), которые дают двойное лучепреломление с яблочно-зеленым оттенком (Д, микроскопия в поляризованном свете). Цветное изображение доступно в электронной версии журнала.
У пациентов с амилоидозом в сочетании с миокардитом чаще отмечалось острое начало заболевания, у всех больных, по сравнению с 18,2% пациентов с амилоидозом без миокардита, прослеживалась четкая связь декомпенсации или дебюта заболевания с перенесенной инфекцией, причем в 60% это была новая коронавирусная инфекция (COVID-19). По титрам антикардиальных антител достоверной разницы между подгруппами с миокардитом и без миокардита получено не было.
У больных с сочетанием амилоидоза и миокардита обращал на себя внимание достоверно более широкий комплекс QRS, что является отражением нарушений внутрижелудочковой проводимости. Кроме того, у пациентов с миокардитом достоверно чаще регистрировалась ЖТ (80,0% vs 18,2%, р=0,036), расчетный риск ВСС также был в 2 раза выше в подгруппе с миокардитом, хотя различия по этому параметру не достигали статистически значимой достоверности (рис. 6).
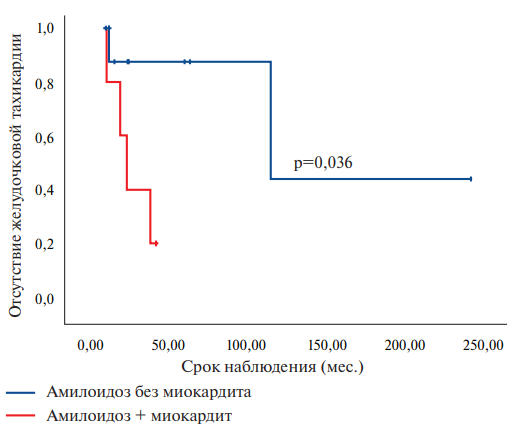
Рис. 6. Кривые Каплан-Майера, характеризующие период, свободный от ЖТ, у пациентов с амилоидозом сердца с миокардитом и без миокардита.
Достоверных различий по ЭхоКГ параметрам также не отмечено, что, вероятно, связано с малым объемом выборки. Тем не менее следует отметить, что в подгруппе с миокардитом отмечалась тенденция к дилатации правых отделов и ЛЖ. Вместе с тем стадия и ФК СН были выше у пациентов с амилоидозом сердца без миокардита.
Поскольку большинство случаев миокардита отмечалось у пациентов с AL-амилоидозом, мы сравнили между собой больных с AL-амилоидозом с миокардитом и без миокардита (табл. 4). Пациентов с миокардитом отличал достоверно более широкий комплекс QRS, у всех на ЭКГ присутствовали комплексы QS и регистрировалась ЖТ при суточном мониторинге ЭКГ. При этом летальность вне зависимости от миокардита была высокой и составила 75% в обеих подгруппах.
Таблица 4
Характеристики пациентов с амилоидозом с поражением сердца в зависимости от наличия или отсутствия миокардита
Признак | Есть миокардит | Нет миокардита p | |
N (%) | 5 | 11 | — |
Возраст, лет | 62,4±12 | 62,9±13,8 | 0,827 |
Острое начало, n (%) | 4 (80) | 2 (18,2) | 0,063 |
Связь с инфекцией, n (%) | 5 (100) | 2 (18,2) | 0,01 |
COVID-19 в анамнезе, n (%) | 3 (60) | 1 (9,1) | 0,25 |
Комплекс QRS, мс | 120 [ 100; 130] | 90 [ 80; 103] | 0,029 |
ФВ ЛЖ (ЭхоКГ), % | 54,4±20,8 | 50±10,2 | 0,61 |
МЖП (ЭхоКГ), мм | 15 [ 13; 15,5] | 15 [ 12; 17] | 0,913 |
КДР ЛЖ (ЭхоКГ), мм | 4,9±0,8 | 4,5±0,7 | 0,569 |
КДО ЛЖ (ЭхоКГ), мл | 98,5±35 | 76,7±23,8 | 0,296 |
ПЖ (ЭхоКГ), см | 3,4±0,7 | 2,8±0,6 | 0,089 |
ЛП (ЭхоКГ), мл | 82,4±10,5 | 86,4±25,3 | 0,865 |
ПП (ЭхоКГ), мл | 89,2±27,5 | 74,6±28,3 | 0,308 |
СДЛА (ЭхоКГ), мм рт.ст. | 30,8±9,7 | 42±10,6 | 0,073 |
Стадия ХСН | IIА [IIА; IIБ] | IIБ [IIБ; IIБ] | 0,037 |
ФК ХСН (NYHA) | 2 [ 2; 2-3] | 3 [ 3; 3] | 0,032 |
Наличие ЖТ, % | 4 (80) | 2 (18,2) | 0,036 |
Риск ВСС, % | 2,65 [ 1,33; 3,11] | 1,32 [ 1,17; 1,85] | 0,394 |
Смерть, n (%) | 3 (60) | 5 (45,5) | 0,5 |
Сокращения: ВСС — внезапная сердечная смерть, ЖТ — желудочковая тахи- кардия, КДО — конечный диастолический объем, КДР — конечный диастоличе- ский размер, ЛЖ — левый желудочек, ЛП — левое предсердие, МЖП — межже- лудочковая перегородка, ПЖ — правый желудочек, ПП — правое предсердие, СДЛА — систолическое давление в легочной артерии, ФВ — фракция выброса, ФК — функциональный класс, ХСН — хроническая сердечная недостаточность, ЭхоКГ — эхокардиография, COVID-19 — новая коронавирусная инфекция.
Все пациенты с сочетанием амилоидоза и миокардита получали ИСТ. Больному с TTR-амилоидозом была назначена мягкая ИСТ гидроксихлорохином 200 мг/сут. Лечение пациентов с AL-амилоидозом было агрессивнее: одна пациентка получала метилпреднизолон 16 мг/сут. с последующим снижением дозы до 4 мг/сут., а затем переходом на гидроксихлорохин 200 мг/сут., а потом на азатиоприн 100 мг/сут., остальные трое получали этиотропное лечение ALамилоидоза, которое включало в себя дексаметазон, циклофосфамид и бортезомиб. В результате лечения миокардита удалось добиться некоторой стабилизации состояния пациентов. Не отмечено достоверной отрицательной динамики ни по ФК ХСН, ни по ЭхоКГ-параметрам, за исключением тенденции к нарастанию систолического давления в легочной артерии. Положительная динамика отмечена и в отношении желудочковых нарушений ритма, хотя различия из-за малого количества наблюдения статистически не достоверны.
Частота летальных исходов была выше у пациентов с сочетанием амилоидоза и миокардитом (60% vs 45,5%). В подгруппе с миокардитом 2 пациента умерли от прогрессирующей СН, а 1 — внезапно. В подгруппе без миокардита декомпенсация ХСН стала причиной смерти в 4 случаях, а один больной умер внезапно.
Болезни накопления. В нашей выборке присутствует 10 пациентов с болезнями накоплениями: 4 случая болезни Данона, 4 — болезни Фабри и еще 2 пациента с болезнями накопления, точную природу которых установить не удалось. Морфологическое исследование миокарда было выполнено 4 пациентам в этой группе.
Частота сопутствующего миокардита в данной группе составила 30%: миокардит был диагностирован у 2 пациентов с болезнью Фабри и у 1 пациентки с болезнью Данона (в последнем случае миокардит верифицирован морфологически, рис. 7).
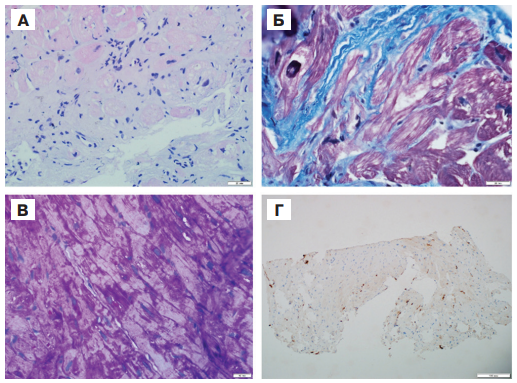
Рис. 7. Результаты биопсии миокарда пациентки К. с болезнью Данона и миокардитом.
Примечание: А.Окраска гематоксилином и эозином. Кардиомиоциты неравномерно гипертрофированы с фокусами лизиса цитоплазмы и лизиса ядер в отдельных клетках, интерстиций неравномерно расширен, набухший, содержит лимфо-гистиоцитарные элементы (более 14 лимфоцитов при большом увеличении). Б.Окраска трихромом по Массону. Выраженный перимускулярный склероз и склероз стенок капилляров. В. PAS реакция. Очаговые скопления гликогена в цитоплазме кардиомиоцитов. Г.Иммуногистохимическое исследование (CD45+: 27 клеток на 1 мм2).
У пациентов с миокардитом отмечалось значительное повышение титра АНФ, что ассоциировано с высокой иммунологической активностью сопутствующего миокардита (табл. 5). При ЭхоКГ в этой подгруппе обращало на себя внимание отсутствие значимой гипертрофии ПЖ, что может являться отражением того факта, что, как и в группе ГКМП, причиной декомпенсации стал именно миокардит, а не прогрессирование основного заболевания. Остальные ЭхоКГ-параметры достоверно не отличались, равно как и выраженность клинических проявлений СН. Не отмечено негативного влияния миокардита при болезнях накопления на желудочковые аритмии, напротив, в подгруппе без миокардита был выше риск ВСС, чаще выполнялась имплантация ИКД и у 2 из 3 пациентов с ИКД в период наблюдения были отмечены адекватные срабатывания. В обеих подгруппах умерло по одному пациенту (в подгруппе с миокардитом от инсульта, в подгруппе без миокардита причина смерти больного доподлинно не известна). Одной пациентке с болезнью Данона без сопутствующего миокардита была выполнена трансплантация сердца в связи с прогрессирующей СН.
Таблица 5
Характеристики пациентов с болезнями накопления в зависимости от наличия или отсутствия миокардита
Признак | Есть миокардит | Нет миокардита p | |
N (%) | 3 | 7 | — |
Патогенная мутация, n (%) | 3 (100) | 4 (57,1) | н/д |
АНФ, титр | 1:160 [ 1:40; 1:160] | нет [нет; 1:40] | 0,042 |
ФВ ЛЖ (ЭхоКГ), % | 62±15,4 | 60,6±9,3 | н/д |
КДР ЛЖ (ЭхоКГ), см | 5,0±0,3 | 4,7±0,6 | н/д |
КДР ПЖ (ЭхоКГ), см | 3,1±0,8 | 3±0,2 | н/д |
Гипертрофия ПЖ, n (%) | 0 | 5 (71,4) | 0,048 |
ЛП (ЭхоКГ), мл | 80,5 [ 76; 80,5] | 138 [ 67; 260] | н/д |
ПП (ЭхоКГ), мл | 67,5 [ 50; 67,5] | 91 [ 43; 175] | н/д |
Наличие ЖТ, n (%) | 1 (33,3) | 4 (57,1) | н/д |
Риск ВСС, % | 4,41 [ 4,41; 4,41] | 12,7 [ 5,2; 26,2] | н/д |
Имплантация ИКД, n (%) | 0 | 3 (42,9) | н/д |
Адекватные срабатывания ИКД | 0 | 2/3 | н/д |
Стадия ХСН | IIA [I; IIA] | IIA [I-IIA; IIБ] | н/д |
ФК ХСН (NYHA) | 2 [ 1; 3] | 2,5 [ 2; 3] | н/д |
Смерть, n (%) | 1 (33,3) | 1 (14,3) | н/д |
Сокращения: АНФ — антинуклеарный фактор, ВСС — внезапная сердечная смерть, ЖТ — желудочковая тахикардия, ИКД — имплантируемый кардиовер- тер-дефибриллятор, КДР — конечный диастолический размер, ЛЖ — левый желудочек, ЛП — левое предсердие, ПЖ — правый желудочек, ПП — правое предсердие, ФВ — фракция выброса, ФК — функциональный класс, ХСН — хроническая сердечная недостаточность, ЭхоКГ — эхокардиография.
Поражение сердца в рамках нейромышечных заболеваний. У 3 пациентов в ходе обследования были выявлены нейромышечные заболевания: один случай генетически верифицированной атаксии Фридрейха с поражением сердца, один случай миопатии, обусловленной мутацией в гене ANO5, которая объясняет как неврологическую симптоматику, так и изменения со стороны сердца (ГЛЖ до 14 мм, фибрилляция предсердий, СН), а также один пациент с недифференцированным нейромышечным заболеванием (прослеживается семейный характер заболевания, однако в саркомерной панели и в гене TTR мутаций не обнаружено, продолжается ДНК-диагностика).
Миокардит был обнаружен у одного пациента в данной группе. Это больной с ANO5-ассоциированной миопатией. Заболевание дебютировало в возрасте 50 лет с минимальных проявлений СН, позднее появились нарушения ритма и неврологическая симптоматика (слабость в дистальных группах мышц, нарушение мелкой моторики пальцев рук, повышение креатинфосфокиназы, типичные для первичной миопатии изменения при биопсии мышцы голени), однако значительное ухудшение состояния связано с перенесенной COVID-19, что, в совокупности со значительным повышением титров антикардиальных антител, повышением уровня тропонина и изменениями на МРТ (картина миоперикардита), позволило говорить о постковидном миокардите, фоном для которого стал генетически неполноценный миокард.
Гипертрофия миокарда с рестриктивным фенотипом. У 2 пациентов гипертрофия миокарда сочеталась с ярко выраженными рестриктивными изменениями по данным ЭхоКГ, в связи с чем эти пациенты были выделены в отдельную группу. В обоих случаях состояние было расценено как смешанный фенотип: первичная рестриктивная кардиомиопатия (РКМП) и ГКМП, в т.ч. у одного пациента была выявлена характерная для РКМП мутация в гене DES. Данных за сопутствующий миокардит не получено ни в одном из этих случаев (в т.ч. по данным ЭМБ у одного из пациентов).
Синдром LEOPARD. Наконец, у одного больного было диагностировано заболевание из группы РАСопатий (заболеваний, обусловленных мутациями в генах, кодирующих компоненты и регуляторы RAS/MAPC-сигнального пути). В эту группу, помимо синдрома LEOPARD, который был диагностирован у нашего пациента, входят синдромы Костелло, Нунан, Легиуса, кардиофациокожный синдром, а также синдромы капиллярной и артериовенозной мальформации [11]. У пациента при ЭхоКГ отмечались признаки, характерные для обструктивной ГКМП, были диагностированы интермиттирующий феномен Вольфа-Паркинсона-Уайта и аксональная моторно-сенсорная полинейропатия с проявлениями периферической вегетативной недостаточности, кроме того, обращали на себя внимание особенности строения лицевого отдела черепа. Были исключены амилоидоз и болезни накопления. Пациент проконсультирован генетиком: заподозрен синдром LEOPARD. При ДНК-диагностике обнаружена характерная для данного фенотипа мутация в гене PTPN11. Признаков миокардита у данного больного выявлено не было.
Таким образом, миокардит был выявлен у трети пациентов с синдромом гипертрофии миокарда. Отдельно в группах ГКМП, амилоидоза с поражением сердца, болезней накопления и нейромышечных заболеваний миокардит присутствовал также примерно у трети пациентов. Его частота была выше в подгруппах ГКМП в сочетании с НКМ (40%), AL-амилоидоза (50%) и болезни Фабри (50%). У пациентов с РКМП и синдромом LEOPARD пока не зафиксировано случаев сопутствующего миокардита (рис. 8).
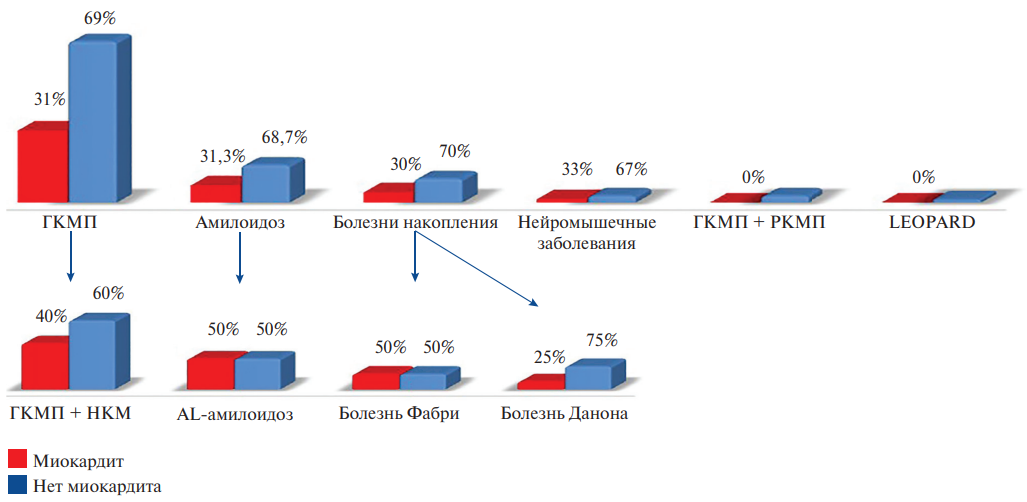
Рис. 8. Частота миокардита при различных причинах синдрома гипертрофии миокарда.
Сокращения: ГКМП — гипертрофическая кардиомиопатия, НКМ — некомпактный миокард, РКМП — рестриктивная кардиомиопатия.
Обсуждение
В группе ГКМП в нашей когорте миокардит был обнаружен у трети пациентов. Этих пациентов отличали от пациентов с изолированной ГКМП связь декомпенсации с перенесенной инфекцией и повышение титров антител к антигенам кардиомиоцитов, что, вероятно, обусловлено большой массой миокарда, которая является мишенью для аутоиммунной агрессии. У пациентов с сочетанием ГКМП и миокардита чаще наблюдалась гипертрофия ПЖ, что может быть отражением более патогенной генетической основы. Патогенные мутации действительно чаще встречались в подгруппе с миокардитом, хотя различия по этому параметру и не достигают статистического уровня достоверности (последнее, скорее всего, связано с относительно небольшим размером анализируемых подгрупп). Вместе с тем толщина миокарда ЛЖ в подгруппе с миокардитом была достоверно меньше и у этих пациентов достоверно реже встречалась фибрилляция предсердий, но у них достоверно чаще отмечалось снижение ФВ ЛЖ <45%, а ФК СН был выше. Это указывает на то, что причиной декомпенсации у этих пациентов является именно присоединившийся миокардит, а не прогрессирование основного заболевания. По выраженности желудочковых нарушений ритма, расчетному риску ВСС и потребности в имплантации ИКД различий между подгруппами ГКМП с миокардитом и без миокардита не было, однако смертность в подгруппе с миокардитом была выше более чем в 3 раза, что подчеркивает вклад миокардита в неблагоприятный исход.
Одной из немногих работ, где активно обсуждается роль миокардита при ГКМП, является исследование, опубликованное группой итальянских ученых под руководством A.Frustaci [6]. В исследование вошло 119 пациентов с ГКМП, 77 из которых были клинически стабильны, а 42 находились в состоянии декомпенсации, обусловленной прогрессированием симптомов ХСН (n=20) или агрессивными желудочковыми аритмиями (n=22). Всем пациентам была выполнена ЭМБ, по результатам которой ни у одного клинически стабильного больного признаков миокардита обнаружено не было, в то время как в группе с декомпенсацией сопутствующий миокардит был выявлен у 2/3 пациентов. Таким образом, суммарная распространенность миокардита в данной выборке составила 23,5%. В качестве группы контроля были отобраны больные с митральным стенозом, которым проводилась интраоперационная биопсия миокарда во время протезирования митрального клапана, по данным которой признаки миокардита отсутствовали у всех пациентов. Результаты этого исследования вызвали отклик в профессиональной среде, и другая группа специалистов в области ГКМП выразила сомнение относительно столь большой доли пациентов с декомпенсацией, в связи с чем они ставят под сомнение репрезентативность выборки и как следствие высокую частоту миокардита при ГКМП [7].
В нашей работе распространенность миокардита получилась несколько выше, чем по данным A.Frustaci [6]. Это связано с тем, что пациенты госпитализировались в стационар преимущественно по поводу ухудшения состояния, поэтому доля пациентов с декомпенсацией в нашей когорте была выше. В целом наши данные согласуются с тем, что миокардит является одной из важных причин декомпенсации у пациентов с ГКМП наряду с прогрессированием основного заболевания.
При анализе отдельной подгруппы пациентов с сочетанием ГКМП, миокардита и НКМ, в сопоставлении с пациентами с ГКМП и миокардитом без НКМ мы продемонстрировали значительный вклад некомпактного слоя в клиническую картину болезни. Частота миокардита у пациентов с сочетанием НКМ и ГКМП составила 40%. У половины пациентов были обнаружены патогенные мутации. Помимо того, что у пациентов с НКМ были ожидаемо достоверно хуже параметры, характеризующие ЛЖ, у половины больных отмечалась гипертрофия ПЖ, что, вероятно, связано с проявлением особенностей мутаций в гене MyBPC3, приведших к комбинированному фенотипу. Кроме того, этих больных на всех этапах наблюдения отличали агрессивные желудочковые нарушения ритма и как следствие достоверно более высокий расчетный риск ВСС, а также практически вдвое более высокая смертность (50% vs 26,7%). Ранее нами было показано аналогичное влияние НКМ на клиническую картину и прогноз у пациентов с аритмогенной кардиомиопатией ПЖ: у пациентов с НКМ, по сравнению с больными с изолированной аритмогенной кардиомиопатией, наблюдались изменения не только со стороны правых, но и со стороны левых отделов, их отличали чрезмерно агрессивные и резистентные к антиаритмической терапии желудочковые нарушения ритма и высокий риск ВСС, а частота сопутствующего миокардита в этой группе пациентов составила 88,9% [12]. Обращает на себя внимание тот факт, что у всех пациентов с сочетанием ГКМП и НКМ и положительными результатами ДНК-диагностики, независимо от наличия или отсутствия миокардита, были обнаружены мутации именно в гене MyBPC3, что дает основание думать о его этиологической роли в развитии данного комбинированного фенотипа. Таким образом, наличие некомпактного слоя при ГКМП требует обязательного исключения миокардита и особо тщательного подхода к назначению антиаритмической терапии и тактике профилактики ВСС.
На сегодняшний день в литературе полностью отсутствуют данные о результатах лечения сопутствующего миокардита у пациентов с ГКМП. В нашей когорте пациентов ИСТ получало чуть меньше половины пациентов с сочетанием ГКМП и миокардита. Эти пациенты были существенно тяжелее тех, кто не получал ИСТ, по всем параметрам, что затрудняет оценку эффективности ИСТ у этой категории пациентов. Тем не менее, даже несмотря на это ограничение, при оценке пациентов в динамике только у больных, получавших ИСТ, отмечено достоверное улучшение в отношении выраженности желудочковых нарушений ритма. ФВ ЛЖ и размеры камер сердца у пациентов, получавших ИСТ, несмотря на исходную тяжесть состояния, оставались стабильными, а уровень смертности в подгруппах достоверно не отличался. Косвенно можно расценить отсутствие отрицательной динамики именно как результат лечения сопутствующего миокардита.
Второй по частоте причиной синдрома гипертрофии миокарда в нашей выборке стал амилоидоз с поражением сердца. Соотношение AL- и TTRамилоидоза составило 1:1, хотя по данным литературы самым частым вариантом амилоидоза с поражением сердца является AL-амилоидоз и на его долю приходится порядка 67% [13]. Тем не менее размер этой подгруппы относительно небольшой (n=16), что вполне объясняет такое смещение. Миокардит выявлен, как и при ГКМП, приблизительно в трети случаев. Обращает на себя внимание тот факт, что миокардит был обнаружен у 4 пациентов с AL-амилоидозом и лишь 1 больного с TTRамилоидозом. Это может быть связано с тем, что при AL-амилоидозе дополнительный вклад в развитие миокардита вносит прямое токсическое воздействие легких цепей на миокард, что приводит к развитию вторичного воспаления [14]. Если отдельно оценить частоту миокардита в подгруппе с AL-амилоидозом, то в нашей выборке она составит 50%. Схожие данные есть и в литературе, где описана высокая частота воспаления у пациентов с AL-амилоидозом (47%) и обсуждается негативное влияние воспалительного процесса на прогноз [15].
У наших пациентов с сочетанием амилоидоза и миокардита обращали на себя внимание большая частота ЖТ, нарушения внутрижелудочковой проводимости и наличие QS-комплексов на ЭКГ, что указывает на более глубокое поражение миокарда. Смертность также была выше в подгруппе с миокардитом (60% vs 45,5%), хотя различия по этому показателю не достигали уровня статистической достоверности (вероятно, из-за анализа малых подгрупп). Лечение миокардита позволило в некоторой степени стабилизировать состояние пациентов, т.к. при динамическом наблюдении за больными достоверной отрицательной динамики по ЭхоКГ параметрам не отмечалось, уменьшалось бремя желудочковых аритмий. В то же время достоверных различий по стадии СН и частоте летальных исходов в подгруппе с миокардитом и без миокардита не было, что связано с тяжестью поражения сердца в рамках основного заболевания.
Следует отдельно отметить, что из 8 пациентов с AL-амилоидозом в нашей выборке умерло 6, в то время как из 8 пациентов с TTR-амилоидозом — только 2. Такая статистика согласуется с данными литературы относительно крайне неблагоприятного прогноза при AL-амилоидозе по сравнению с TTRамилоидозом [16]. Таким образом, миокардит при AL-амилоидозе приводит к более тяжелым клиническим проявлениям заболевания, однако достоверно не влияет на исходы из-за быстропрогрессирующего характера основного заболевания. Еще один интересный аспект — связь дебюта болезни или декомпенсации СН с COVID-19, которая отмечена у 60% пациентов с сочетанием амилоидоза и миокардита. Во всех случаях это были пациенты с AL-амилоидозом. Во-первых, SARS-Cov-2 мог стать триггером развития миокардита [17]. Во-вторых, сейчас активно обсуждается вклад COVID-19 в развитие процесса амилоидоза за счет особых свойств S, E и N-белков вируса SARS-CoV-2, в которых присутствуют амилоидогенные области [18, 19]. Таким образом, при поражении сердца, возникшем после COVID-19, следует рассматривать возможные миокардит, ALамилоидоз или их сочетание.
При болезнях накопления миокардит, как и в предыдущих группах, был диагностирован в трети случаев. Сравнение происходило в малых подгруппах, что позволяет говорить скорее о тенденциях. У пациентов с миокардитом обращало на себя внимание значительное повышение АНФ, что косвенно позволяет говорить о высокой иммунологической активности миокардита. Кроме того, в подгруппе с миокардитом ни у одного больного не было выявлено значительной гипертрофии ПЖ, в то время как у пациентов без миокардита она наблюдалась более чем в 70% случаев. По аналогии с группой ГКМП, где у пациентов с миокардитом была меньшая толщина миокарда ЛЖ, эту особенность можно трактовать как отражение того, что в подгруппе пациентов с болезнями накопления в сочетании с миокардитом причиной декомпенсации СН стало воспаление, в то время как в подгруппе без миокардита — прогрессирование основного заболевания.
У больных без миокардита обращают на себя внимание агрессивные желудочковые нарушения ритма, потребовавшие имплантации ИКД с последующими адекватными срабатываниями устройства. Тем не менее смертность была выше в подгруппе с миокардитом, что может говорить о том, что наличие воспаления повышает вероятность летального исхода. В нашей выборке миокардит был выявлен у двух из четырех пациентов с болезнью Фабри и у одной из четырех с болезнью Данона. При болезни Фабри на данный момент активно обсуждается центральная роль воспаления при поражении сердца наряду с накоплением гликосфинголипидов [20]. Последние являются антигенами и приводят к активации NKпопуляции Т-лимфоцитов, а также продукции фактора некроза опухолей β [21]. Кроме того, есть данные, что гликосфинголипиды способны активировать Toll-like рецепторы 4 типа, что также запускает каскад воспалительных реакций [22]. Группой итальянских ученых под руководством A. Frustaci было проведено исследование, направленное на оценку частоты миокардита у пациентов с болезнью Фабри с поражением сердца: ЭМБ была выполнена 78 пациентам с этим заболеванием, признаки активного миокардита были обнаружены у 56% больных. У всех пациентов с миокардитом отмечались повышение титров антикардиальных антител и отсутствие вирусного генома в миокарде, что подчеркивает иммунную природу воспаления [23]. Этой же группой исследователей был отдельно описан случай крайне тяжелого миокардита, приведшего к трансплантации сердца, у пациентки с болезнью Фабри, получавшей заместительную ферментативную терапию без эффекта [24].
Что касается миокардита при болезни Данона, в литературе преимущественно встречаются описания отдельных клинических случаев. Так, представлен случай высокоактивного миокардита в эксплантированном сердце у матери пробанда с болезнью Данона. Позднее у пациентки была идентифицирована патогенная мутация в LAMP2, таким образом, у больной имело место быть сочетание болезни Данона и миокардита. Причем именно последний привел к трансплантации сердца [25]. Интересно, что в нашей выборке миокардит также был морфологически верифицирован именно у матери пациента с синдромом Данона, у которой в дальнейшем было подтверждено наличие патогенной мутации. Немецкими учеными описан еще один случай сочетания болезни Данона и миокардита: это также была женщина, у которой изначально диагностировали миокардит, проводилась ИСТ с эффектом, что было подтверждено при повторной ЭМБ, однако обращала на себя внимание гипертрофия кардиомиоцитов и феномен disarray, в связи с чем была проведена ДНК-диагностика, при которой обнаружена мутация, характерная для болезни Данона [26]. Таким образом, у всех троих женщин на первое место в клинической картине выходили именно проявления миокардита, в то время как проявления болезни Данона за счет женского пола пациенток относительно поздно дебютировали и были выражены умеренно. Кроме того, при болезни Данона есть данные об отеке миокарда при МРТ у пациентов со значительно сниженной ФВ ЛЖ, что может косвенно быть расценено как наличие миокардита [27].
Среди 3 пациентов с гипертрофией миокарда в рамках нейромышечных заболеваний миокардит был выявлен у одного больного, фенотип которого был обусловлен мутацией в ANO5. В литературе при мутации в ANO5 описано поражение сердца в виде дилатационной кардиомиопатии [28], однако достоверных данных за гипертрофический фенотип и тем более сопутствующий миокардит не обнаружено. При этой мутации описана лишь гипертрофия мышц голеней [29]. Вместе с тем нашему больному выполнялось полноэкзомное секвенирование, при котором не было обнаружено иных известных мутаций, которые могли бы привести к гипертрофии миокарда. Чаще всего в рамках нейромышечных заболеваний миокардит встречается при миопатии Дюшена. Есть данные, что у 6 из 20 пациентов с миопатией Дюшена были выявлены признаки миокардита по МРТ (в т.ч. у 4 из них миокардит был морфологически верифицирован). Пациентов наблюдали 2 года, и у тех, у кого был миокардит, отмечалось появления и быстрое прогрессирование СН, в отличие от пациентов без миокардита [30]. Тем не менее гипертрофии миокарда у этой группы пациентов не описано. Гипертрофия миокарда при нейромышечных заболеваниях встречается у пациентов с атаксией Фридрейха и является характерным признаком этого заболевания наряду с неврологической симптоматикой [31]. Первые случаи миокардита при атаксии Фридрейха были описаны еще в 1940-х годах [32][33]. В 2015г международной группой исследователей изучалось поражение сердца в рамках атаксии Фридрейха: при оценке материала аутопсии признаки миокардита, соответствующие Далласским критериям, были обнаружены у всех 15 пациентов, в связи с чем сделан вывод, что воспаление является важным фактором прогрессирования кардиомиопатии в рамках атаксии Фридрейха [34].
РКМП — одна из самых редких кардиомиопатий, однако и при ней есть сведения о присоединении миокардита. В нашу выборку 2 упомянутых выше пациента с РКМП были включены потому, что, наряду с выраженной рестрикцией, у них отмечалась гипертрофия миокарда, соответствующая критериям включения, представленным выше. В исследовании, анализировавшем результаты ЭМБ у пациентов с необъяснимой ХСН, из 286 пациентов с фенотипом РКМП у 19 (6,6%) был обнаружен миокардит [35]. Есть и данные, полученные обратным образом: у 7% больных с морфологически подтвержденным миокардитом при ЭхоКГ были выявлены признаки РКМП [36]. Такая небольшая частота миокардита при РКМП объясняет его отсутствие среди двух наших пациентов с сочетанием РКМП и гипертрофии миокарда.
Наконец, при синдроме LEOPARD, относящемся к разряду редких заболеваний, сведений о сопутствующем миокардите в литературе обнаружить не удалось.
К ограничениям исследования можно отнести гетерогенность выборки, что потребовало проведения анализа отдельных, в т.ч. и небольших подгрупп, что могло привести к ошибке второго рода. Кроме того, не во всех подгруппах удалось детально проанализировать результаты лечения миокардита, поскольку пациенты, получавшие ИСТ, зачастую были исходно тяжелее по всем параметрам, чем больные без ИСТ. Вместе с тем эти пациенты как минимум оставались стабильными, а по ряду параметров отмечалась положительная динамика. Необходима дальнейшая работа в направлении оценки эффективности ИСТ у пациентов с синдромом гипертрофии миокарда любой этиологии в сочетании с миокардитом, поскольку в литературе эти сведения полностью отсутствуют. Еще одним ограничением исследования может считаться тот факт, что морфологическая верификация диагноза была выполнена 29,4% пациентов с ГКМП, а в остальных случаях проводилась при помощи алгоритма неинвазивной диагностики [10]. Частота миокардита исключительно среди пациентов с морфологической верификацией составила 60%, в то время как среди всей когорты больных она была ниже и составила 30,9%. С одной стороны, это может быть связано с тем, что морфологическое исследование миокарда выполнялось более тяжелым больным с большей вероятностью миокардита, однако это позволяет говорить и о том, что применение алгоритма неинвазивной диагностики не завышало частоты миокардита. Применение этого алгоритма подразумевает комплексный подход к диагностике миокардита и не ограничивается только наличием анамнестической триады или только повышением титров антикардиальных антител. Надо отметить, что в зарубежных исследованиях последних лет стали достаточно активно опираться на неинвазивную диагностику миокардита. Даже в Европейском регистре миокардитов и кардиомиопатий (CMY-LT Registry, EORP) миокардит был верифицирован морфологически лишь у 38,2% (n=222), а в остальных случаях диагноз был установлен клинически и/или на основании МРТ. При разработке критериев включения больных с миокардитом в данный регистр опирались на рекомендации Европейского общества кардиологов (ESC) 2013г, в котором морфологическая верификация считается обязательной, однако представлены клинические признаки, которые позволяют заподозрить миокардит [37]. Последние и были использованы как критерии включения в CMY-LT Registry для пациентов без ЭМБ. В нашем исследовании в группе без морфологической верификации диагноза мы также активно использовали МРТ сердца, оно выполнено 31 пациенту и является одним из малых критериев диагностики миокардита в алгоритме неинвазивной диагностики. Примечательно, что в европейских рекомендациях 2013г определение миокардита включает в себя его обязательную морфологическую верификацию, в то время как в отечественных рекомендациях 2020г к этому вопросу подходят несколько мягче и в определении миокардита как нозологии эти указания отсутствуют [9].
Заключение
При обследовании пациентов с синдромом первичной гипертрофии миокарда наиболее часто диагностировалась ГКМП (68%, в т.ч. в 15% случаев ГКМП в сочетании с НКМ), на втором месте по частоте находится амилоидоз с поражением сердца (16%, из них 8% AL- и 8% TTR-амилоидоз), а на третьем — болезни накопления (10%). Сопутствующий миокардит выявлен у трети (31%) пациентов с синдромом первичной гипертрофии миокарда. Его частота максимальна при ГКМП в сочетании с НКМ (40%) и AL-амилоидозе (50%). Наличие сопутствующего миокардита приводило к прогрессированию СН, усугублению желудочковых нарушений ритма и, как следствие, увеличению риска ВСС, а также повышало вероятность летального исхода (33,3% vs 6,4%, р=0,01). Наибольшее влияние миокардита на течение заболевания и прогноз отмечено при ГКМП, особенно в сочетании с НКМ, а также при амилоидозе с поражением сердца. Необходимо активно диагностировать миокардит у пациентов с синдромом первичной гипертрофии миокарда и декомпенсацией и назначать ИСТ при его наличии, поскольку лечение миокардита позволяет стабилизировать состояние пациентов.
Отношения и деятельность: все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье.
Список литературы
1. Cannata A, Artic J, Gentile P, et al. Myocarditis evolving in cardiomyopathy: when genetics and offending causes work together. European Heart Journal Supplements: Journal of the European Society of Cardiology. 2019;21(Suppl B),B90-B95. doi:10.1093/EURHEARTJ/SUZ033.
2. Campuzano O, Fernández-Falgueras A, Sarquella-Brugada G, et al. A Genetically Vulnerable Myocardium May Predispose to Myocarditis. J Am Coll Cardiol. 2015;66(25):2913-4. doi:10.1016/j.jacc.2015.10.049.
3. Arbustini E, Giuliani L, Di Toro A, et al. Genetic Basis of Myocarditis: Myth or Reality? Myocarditis. 2020:45-89. doi:10.1007/978-3-030-35276-9_4.
4. Nakamura M, Imamura T, Fukui T, et al. Arrhythmogenic Right Ventricular Cardiomyopathy Accompanied by Chronic Myocarditis. Intern Med. 2022;61(20):3063-7. doi:10.2169/internalmedicine.8911-21.
5. Karaca O, Cakal B, Cakal SD, et al. Which one is Worse? Acute Myocarditis and Co-existing Non-compaction Cardiomyopathy in the Same Patient. J Clin Diagn Res. 2015;9(6):OJ01. doi:10.7860/JCDR/2015/11774.6033.
6. Frustaci A, Verardo R, Caldarulo M, et al. Myocarditis in hypertrophic cardiomyopathy patients presenting acute clinical deterioration. Eur Heart J. 2007;28(6):733-40. doi:10.1093/eurheartj/ehl525.
7. Maron BJ, Basso C. Myocarditis in hypertrophic cardiomyopathy. Eur Heart J. 2007;28(13):1663-4; author reply 1664. doi:10.1093/eurheartj/ehm135.
8. Габрусенко С.А., Гудкова А.Я., Козиолова Н.А. и др. Гипертрофическая кардиомиопатия. Клинические рекомендации 2020. Российский кардиологический журнал. 2021;26(5):4541. doi:10.15829/1560-4071-2021-4541.
9. Арутюнов Г.П., Палеев Ф.Н., Моисеева О.М. и др. Миокардиты у взрослых. Клинические рекомендации 2020. Российский кардиологический журнал. 2021;26(11):4790. doi:10.15829/1560-4071-2021-4790.
10. Благова О.В., Осипова Ю.В., Недоступ А.В. и др. Клинические, лабораторные и инструментальные критерии миокардита, установленные в сопоставлении с биопсийным исследованием миокарда (алгоритм неинвазивной диагностики). Терапевтический архив. 2017;89(9):30-40. doi:10.17116/terarkh201789930-40.
11. Rauen KA. The RASopathies. Annu Rev Genomics Hum Genet. 2013;14:355-69. doi:10.1146/annurev-genom-091212-153523.
12. Лутохина Ю.А., Благова О.В., Шестак А.Г. и др. Сочетание аритмогенной дисплазии правого желудочка и некомпактного миокарда левого желудочка как особая форма кардиомиопатии: клиника, диагностика, генетическая природа, течение. Вестник Российской академии медицинских наук. 2020;75(6):594-604. doi:10.15690/vramn1245.
13. Rapezzi C, Merlini G, Quarta CC, et al. Systemic cardiac amyloidoses: disease profiles and clinical courses of the 3 main types. Circulation. 2009;120(13):1203-12. doi:10.1161/CIRCULATIONAHA.108.843334.
14. Liao R, Jain M, Teller P, et al. Infusion of light chains from patients with cardiac amyloidosis causes diastolic dysfunction in isolated mouse hearts. Circulation. 2001;104(14):1594-7. Erratum in: Circulation. 2013;128(11):e174.
15. Siegismund CS, Escher F, Lassner D, et al. Intramyocardial inflammation predicts adverse outcome in patients with cardiac AL amyloidosis. Eur J Heart Fail. 2018;20(4):751-7. doi:10.1002/ejhf.1039.
16. Badar T, Cornelison AM, Shah ND, et al. Outcome of patients with systemic light chain amyloidosis with concurrent renal and cardiac involvement. Eur J Haematol. 2016;97(4):342-7. doi:10.1111/ejh.12736.
17. Blagova O, Lutokhina Y, Kogan E, et al. Chronic biopsy proven post‐COVID myoendocarditis with SARS‐Cov‐2 persistence and high level of antiheart antibodies. Clin Cardiol. 2022;45:952‐9. doi:10.1002/clc.23886.
18. Seth P, Sarkar N. A comprehensive mini-review on amyloidogenesis of different SARSCoV-2 proteins and its effect on amyloid formation in various host proteins. 3 Biotech. 2022;12(11):322. doi:10.1007/s13205-022-03390-1.
19. Aksenova AY, Likhachev IV, Grishin SY, et al. The Increased Amyloidogenicity of Spike RBD and pH-Dependent Binding to ACE2 May Contribute to the Transmissibility and Pathogenic Properties of SARS-CoV-2 Omicron as Suggested by In Silico Study. Int J Mol Sci. 2022;23(21):13502. doi:10.3390/ijms232113502.
20. Pieroni M, Moon JC, Arbustini E, et al. Cardiac Involvement in Fabry Disease: JACC Review Topic of the Week, Journal of the American College of Cardiology. 2021;77(7):922-36. doi:10.1016/j.jacc.2020.12.024.
21. Sanchez-Niño MD, Carpio D, Sanz AB, et al. Lyso-Gb3 activates Notch1 in human podocytes. Hum Mol Genet. 2015;24(20):5720-32. doi:10.1093/hmg/ddv291.
22. Rozenfeld P, Feriozzi S. Contribution of inflammatory pathways to Fabry disease pathogenesis. Mol Genet Metab. 2017;122(3):19-27. doi:10.1016/j.ymgme.2017.09.004.
23. Frustaci A, Verardo R, Grande C, et al. Immune-Mediated Myocarditis in Fabry Disease Cardiomyopathy. J Am Heart Assoc. 2018;7(17):e009052. doi:10.1161/JAHA.118.009052.
24. Frustaci A, Scarpa M, Maria da Riol R, et al. Fabry cardiomyopathy: Gb3-induced autoreactive panmyocarditis requiring heart transplantation. ESC Heart Fail. 2020;7(3):1331-7. doi:10.1002/ehf2.12723.
25. Lines MA, Hewson S, Halliday W, et al. Danon Disease Due to a Novel LAMP2 Microduplication. JIMD Rep. 2014;14:11-6. doi:10.1007/8904_2013_277.
26. Popa MA, Klingel K, Hadamitzky M, et al. An unusual case of severe myocarditis in a genetic cardiomyopathy: a case report. Eur Heart J Case Rep. 2020;4(4):1-7. doi:10.1093/ehjcr/ytaa124.
27. Etesami M, Gilkeson RC, Rajiah P.Utility of late gadolinium enhancement in pediatric cardiac MRI. Pediatr Radiol. 2016;46(8):1096-113. doi:10.1007/s00247-015-3526-2.
28. Wahbi K, Béhin A, Bécane HM, et al. Dilated cardiomyopathy in patients with mutations in anoctamin 5. Int J Cardiol. 2013;168(1):76-9. doi:10.1016/j.ijcard.2012.09.070.
29. Penttilä S, Palmio J, Suominen T, et al. Eight new mutations and the expanding phenotype variability in muscular dystrophy caused by ANO5. Neurology. 2012;78(12):897-903. doi:10.1212/WNL.0b013e31824c4682. Erratum in: Neurology. 2013;80(2):226.
30. Mavrogeni S, Papavasiliou A, Spargias K, et al. Myocardial inflammation in Duchenne Muscular Dystrophy as a precipitating factor for heart failure: a prospective study. BMC Neurol. 2010;10:33. doi:10.1186/1471-2377-10-33.
31. Hanson E, Sheldon M, Pacheco B, et al. Heart disease in Friedreich’s ataxia. World J Cardiol. 2019;11(1):1-12. doi:10.4330/wjc.v11.i1.1.
32. Russell DS. Myocarditis in Friedreich’s ataxia. J Pathol Bacteriol. 1946;58(4):739-48. doi:10.1002/path.1700580414.
33. Hejtmancik MR, Bradfield JY Jr, Miller GV. Myocarditis and Friedreich’s ataxia; a report of two cases. Am Heart J. 1949;38(5):757-65, illust. doi:10.1016/0002-8703(49)90532-3.
34. Koeppen AH, Ramirez RL, Becker AB, et al. The Pathogenesis of Cardiomyopathy in Friedreich Ataxia. PLoS ONE. 2015;10(3):e0116396. doi:10.1371/journal.pone.0116396.
35. Bennett MK, Gilotra NA, Harrington C, et al. Evaluation of the role of endomyocardial biopsy in 851 patients with unexplained heart failure from 2000-2009. Circ Heart Fail. 2013;6(4):676-84. doi:10.1161/CIRCHEARTFAILURE.112.000087.
36. Pinamonti B, Alberti E, Cigalotto A, et al. Echocardiographic findings in myocarditis. Am J Cardiol. 1988;62(4):285-91. doi:10.1016/0002-9149(88)90226-3.
37. Caforio AL, Pankuweit S, Arbustini E, et al. European Society of Cardiology Working Group on Myocardial and Pericardial Diseases. Current state of knowledge on aetiology, diagnosis, management, and therapy of myocarditis: a position statement of the European Society of Cardiology Working Group on Myocardial and Pericardial Diseases. Eur Heart J. 2013;34(33):2636-48. doi:10.1093/eurheartj/eht210.
Об авторах
Ю. А. ЛутохинаРоссия
Лутохина Юлия Александровна — кандидат медицинских наук, ассистент кафедры факультетской терапии № 1 института клинической медицины
Москва
О. В. Благова
Благова Ольга Владимировна — доктор медицинских наук, профессор кафедры факультетской терапии № 1 института клинической медицины
Москва
Е. А. Коган
Коган Евгения Алтаровна — доктор медицинских наук, профессор, зав. кафедрой патологической анатомии им. акад. А. И. Струкова института клинической медицины им. Н. В. Склифосовского
Москва
А. А. Нартов
Нартов Андрей Андреевич — студент института клинической медицины им. Н. В. Склифосовского
Москва
В. Р. Нартова
Нартова Валерия Романовна — студент института клинической медицины им. Н. В. Склифосовского
Москва
Е. В. Заклязьминская
Заклязьминская Елена Валерьевна — доктор медицинских наук, заведующий лабораторией медицинской генетики
Москва
С. Л. Дземешкевич
Дземешкевич Сергей Леонидович — доктор медицинских наук, профессор, главный научный сотрудник отделения хирургического лечения дисфункций миокарда и сердечной недостаточности
Москва
Дополнительные файлы
- У трети пациентов с синдромом первичной гипертрофии миокарда диагностирован сопутствующий миокардит.
- Частота сопутствующего миокардита максимальна при AL-амилоидозе (50%) и гипертрофической кардиомиопатии в сочетании с некомпактным миокардом левого желудочка (40%).
- Наличие сопутствующего миокардита приводит к прогрессированию сердечной недостаточности, усугублению желудочковых нарушений ритма и увеличению риска внезапной сердечной смерти.
- Назначение иммуносупрессивной терапии миокардита позволяет стабилизировать состояние пациентов с синдромом первичной гипертрофии миокарда.
Рецензия
Для цитирования:
Лутохина Ю.А., Благова О.В., Коган Е.А., Нартов А.А., Нартова В.Р., Заклязьминская Е.В., Дземешкевич С.Л. Распространенность миокардита и его вклад в течение заболевания у пациентов с синдромом первичной гипертрофии миокарда. Российский кардиологический журнал. 2023;28(11):5528. https://doi.org/10.15829/1560-4071-2023-5528. EDN: VNCLSL
For citation:
Lutokhina Yu.A., Blagova O.V., Kogan E.A., Nartov A.A., Nartova V.R., Zaklyazminskaya E.V., Dzemeshkevich S.L. Prevalence of myocarditis and its contribution to the course of primary myocardial hypertrophy. Russian Journal of Cardiology. 2023;28(11):5528. (In Russ.) https://doi.org/10.15829/1560-4071-2023-5528. EDN: VNCLSL
JATS XML

















































