Перейти к:
Взаимосвязь маркеров апоптоза с выраженностью атеросклеротического поражения коронарных артерий и клинико-инструментальными характеристиками пациентов с ишемической болезнью сердца
https://doi.org/10.15829/1560-4071-2023-5518
EDN: RVEQTN
Аннотация
Цель. Определение маркеров апоптоза в сыворотке крови в зависимости от выраженности атеросклеротического поражения коронарных артерий (КА); изучение связи с клинико-инструментальными характеристиками пациентов с ишемической болезнью сердца (ИБС).
Материал и методы. В исследование включены 176 человек (105 мужчин и 71 женщина), из них 150 — пациенты с установленным диагнозом ИБС, 26 — здоровые добровольцы (группа контроля). Больные были разделены на следующие группы: 1 группа — с атеросклеротическим поражением КА без явных стенотических сужений (17 человек); 2 группа — с гемодинамически невыраженным ("стенозы <50%") атеросклерозом КА (21 человек); 3 группа — с гемодинамически значимым ("стенозы >50%") атеросклеротическим поражением КА (112 человек). Группа 4 была представлена здоровыми добровольцами (26 человек). Пациентам была выполнена коронароангиография с использованием шкалы SYNTAX; эхокардиографическое исследование; дуплексное ультразвуковое сканирование внечерепных отделов брахиоцефальных артерий. У всех испытуемых проведено исследование уровня маркеров апоптоза Bcl-2, Bax, Bcl-2/Bax, TRAIL и p53 в сыворотке крови. Статистическую обработку полученных результатов осуществляли с использованием программного обеспечения "Statistica 10.0"; достоверными считали различия при р<0,05.
Результаты. Отмечена сильная корреляционная связь очень высокой значимости между показателями Bcl-2 (r=-0,84; p<0,001), Bax (r=0,83; p<0,001), Bcl-2/Bax (r=-0,86; p<0,001), p53 (r=0,80; p<0,001), TRAIL (r=-0,78; p<0,001) и выраженностью атеросклеротического поражения КА. Выявлена корреляционная связь разной силы и значимости между значениями данных маркеров апоптоза — и рядом клинико-инструментальных характеристик пациентов. Также необходимо отметить достоверность различий (p<0,001) показателей Bcl-2, Bax, Bcl2/Bax, p53 и TRAIL между группами пациентов с мультифокальным атеросклерозом, рестенозами после ранее проведенной реваскуляризации и наличием инфаркта миокарда в анамнезе в сравнении с пациентами без данных признаков.
Заключение. Выявленные нами корреляционные связи между лабораторными признаками апоптоза и поражением КА, клинико-инструментальными характеристиками пациентов, а также обнаруженная достоверность различий между группами с мультифокальным атеросклерозом, рестенозами КА и инфарктом миокарда в анамнезе, позволяют рассматривать данные биомаркеры как показатели выраженности атеросклеротических процессов, а также могут лечь в основу формирования новых лечебно-диагностических стратегий.
Для цитирования:
Захарьян Е.А., Фомочкина И.И. Взаимосвязь маркеров апоптоза с выраженностью атеросклеротического поражения коронарных артерий и клинико-инструментальными характеристиками пациентов с ишемической болезнью сердца. Российский кардиологический журнал. 2023;28(11):5518. https://doi.org/10.15829/1560-4071-2023-5518. EDN: RVEQTN
For citation:
Zakharyan E.A., Fomochkina I.I. Relationship between apoptosis markers and the severity of coronary atherosclerosis and clinical and paraclinical characteristics of patients with coronary artery disease. Russian Journal of Cardiology. 2023;28(11):5518. (In Russ.) https://doi.org/10.15829/1560-4071-2023-5518. EDN: RVEQTN
Ишемическая болезнь сердца (ИБС) является основной причиной смерти от сердечно-сосудистых заболеваний [1]. В основе ее патогенеза лежит дисфункция как сосудистых, так и миокардиальных процессов, которые индуцируются и усугубляются ишемией, гипоксией, окислительным стрессом, воспалением и различными типами гибели клеток [1]. На сегодняшний день известны такие варианты клеточной смерти, как апоптоз, некроз, некроптоз, пироптоз, ферроптоз и аутофагия [1-3]. Поскольку миокард обладает крайне ограниченной способностью к регенерации, механизмы регулируемой гибели клеток, включая апоптоз, являются наиболее значимыми для современных исследований из-за их потенциальной обратимости. Более того, по данным ряда авторов, апоптоз считается одним из ключевых звеньев процессов атерогенеза [2][4-6]. Известно, что в результате воздействия перечисленных триггерных факторов, во всех клетках атеромы обнаруживаются морфологические признаки апоптоза, что впоследствии может приводить к нестабильности атеросклеротической бляшки с увеличением риска тромбообразования и разрыва [2].
Существует три классических сигнальных пути апоптоза: внешний (через рецепторы смерти), внутренний (митохондриальный) и путь напряжения эндоплазматического ретикулума. Активируя один или несколько из вышеперечисленных путей, различные стимулы могут индуцировать апоптоз [7].
Апоптоз, инициируемый внешним путем, запускается трансмембранными рецепторами смерти, которые являются членами семейства фактора некроза опухоли и содержат "домен смерти". Ряд лигандов и соответствующих рецепторов, включающих лиганд фрагмента, стимулирующего апоптоз FasL/FasR, фактор некроза опухоли-альфа (TNF-α)/рецептор фактора некроза опухоли (TNFR1), TRAIL, TRAIL/ DR4 и TRAIL/DR5 (DR от англ. death receptors — рецепторы клеточной смерти), могут способствовать передаче сигналов смерти с поверхности клетки на внутриклеточные пути через домен смерти [2].
Внутренний сигнальный путь (также известный как митохондриальный) индуцируется митохондриями и также может запускать апоптоз. Такие стимулы, как гипоксия, гипертермия и др., способствуют росту проницаемости внешней мембраны митохондрий и, таким образом, ускоряют высвобождение проапоптотических белков (цитохром С и фактор, индуцирующий апоптоз) из межмембранного пространства в цитозоль. Происходит активация фактора апоптотической протеазы 1 ((Apaf-1), клеточный цитозольный белок, инициирующий апоптоз), а также прокаспазы и впоследствии каспазы-9, которая, в свою очередь, стимулирует каспазу-3 и каспазу-7. Примечательно, что вышеупомянутые митохондриально-инициируемые события регулируют белки семейства В-клеточной лимфомы-2 (Bcl-2), которые находятся во внешней мембране митохондрий. Функционально они могут быть классифицированы на проапоптотические и антиапоптотические. К первым относятся Bad, Bax, Bak, Bid, Bim, PUMA (от англ. p53 upregulated modulator of apoptosis — проапоптотический белок из семейства Bcl-2, активирующийся при помощи транскрипционного фактора p53) и BNIP3 (от англ. BCL2 interacting protein 3 — белок семейства Bcl-2, участвующий в регуляции апоптоза); в то время как последние включают Bcl-2, Bcl-x, Bcl-XL и BAG. Среди белков семейства Bcl-2, Bax может усиливаться белком-супрессором опухоли p53 либо в ядре, либо в митохондриях (np53 или mp53); в то время как Bcl-2 или Bcl-ХL могут блокировать np53 или mp53-опосредованный апоптоз. Известно о существовании взаимодействия между внешними и внутренними путями, что подтверждается возможностью Fas-опосредованного апоптоза инициировать повреждение митохондрий посредством расщепления Bid каспазой-8 [2]. Одним из ведущих направлений по изучению процессов апоптоза при ИБС является исследование маркеров, индуцирующих апоптоз, а также его ингибирующих, их соотношения, в сыворотке либо плазме крови пациентов. В связи с вышеизложенным представляется актуальным изучение концентрации маркеров апоптоза у пациентов с различной выраженностью атеросклеротического поражения коронарных артерий (КА), в т.ч. в рамках клинических особенностей течения ИБС.
Целью исследования явилось определение маркеров апоптоза в сыворотке крови в зависимости от выраженности атеросклеротического поражения КА, а также изучение их связи с клинико-инструментальными характеристиками пациентов с ИБС.
Материал и методы
Критерием включения больных было наличие ИБС, подтвержденное специфическими жалобами, данными анамнеза, ишемией при проведении электрокардиографического исследования либо холтеровского мониторирования электрокардиограммы, а также присутствием коронарного атеросклероза при проведении коронарографии. Критериями невключения были: перенесенные <6 нед. назад инфаркт миокарда (ИМ) либо острое нарушение мозгового кровообращения, любое острое воспалительное заболевание, хроническая болезнь почек ≥III стадии (скорость клубочковой фильтрации <60 мл/ мин/1,73 м2), потребность в гемодиализе или перитонеальном диализе, сахарный диабет обоих типов в стадии декомпенсации (уровень гликированного гемоглобина >11% или уровень глюкозы в течение суток ≥11,0 ммоль/л), гипертрофическая или дилатационная кардиомиопатия, онкологические заболевания, заболевания крови и иммунной системы, беременность или период кормления.
В исследование включены 176 человек (105 мужчин и 71 женщина), из них 150 — пациенты с установленным диагнозом ИБС, 26 — здоровые добровольцы (группа контроля).
Больные были разделены на следующие группы: 1 группа — с атеросклеротическим поражением КА без явных стенотических сужений (17 человек); 2 группа — с гемодинамически невыраженным (стенозы <50%) атеросклерозом КА (21 человек); 3 группа — с гемодинамически значимым (стенозы >50%) атеросклеротическим поражением КА (112 человек). Среди пациентов с ИБС были выделены подгруппы больных с рестенозами после ранее перенесенной коронарной реваскуляризации миокарда в сроки от 4 мес. до 6 лет (25 человек), мультифокальным атеросклерозом (МФА) (35 человек), наличием ИМ в анамнезе (80 человек). Группа 4 была представлена здоровыми добровольцами, у которых сердечно-сосудистая патология исключалась на основании отсутствия клинических, анамнестических и электрокардиографических признаков заболевания сердца (26 человек). Все группы были сопоставимы по возрасту и полу.
Проведенное исследование было одобрено этическим комитетом ФГАОУ ВО "КФУ им. В.И. Вернадского" (протокол № 5 от 19.05.2022). Пациенты дали добровольное информированное согласие на участие в исследовании.
Пациентам из 1, 2 и 3 групп была выполнена коронароангиография с использованием радиального или трансфеморального доступов в условиях рентгеноперационной на ангиографической установке "General Electric Optima IGS 330". Для объективной количественной оценки тяжести атеросклероза КА использована шкала SYNTAX в виде онлайн калькулятора (https://officialsyntaxscore.com).
Эхокардиографическое исследование (ЭхоКГ) проводили с помощью ультразвукового сканера "Samsung Accuvix A30" методом двухмерной ЭхоКГ, допплер-ЭхоКГ в импульсном режиме и режиме непрерывной волны, цветным допплеровским сканированием. Оценивали стандартные структурные параметры желудочков, сократительную и диастолическую функцию левого желудочка (ЛЖ), состоятельность клапанного аппарата.
МФА представляет собой гемодинамически значимое атеросклеротическое поражение нескольких магистральных сосудистых бассейнов, таких как брахиоцефальный и бассейн артерий нижних конечностей, а также наличие утолщения комплекса интима-медиа сонных артерий. Известно, что МФА зачастую определяет тяжесть состояния пациентов и дальнейший прогноз. В настоящем исследовании толщина комплекса интима-медиа (ТИМ), выраженность стеноза сонных артерий исследовались с помощью дуплексного ультразвукового сканирования внечерепных отделов брахиоцефальных артерий с помощью ультразвукового сканера "Samsung UGEO H60"; увеличением комплекса считали его значения, равные или превышающие 0,9 мм.
Также нами проведено исследование уровня маркеров апоптоза Bcl-2 (внутриклеточный белковый фактор — регулятор апоптоза, основной представитель семейства Bcl-2), Bax (белок-регулятор апоптоза, кодируемый геном BAX), Bcl-2/Bax, TRAIL (цитокин семейства факторов некроза опухоли, лиганд, вызывающий апоптоз, продукт гена TNFSF10) и p53 (продукт гена-супрессора опухоли TP53, транскрипционный фактор, регулирующий клеточный цикл) в сыворотке крови. Для этого до проведения коронарографии проводился забор венозной крови натощак; кровь в вакуумной пробирке была выдержана при комнатной температуре 30 мин, после центрифугирования в течение 15 мин при 2500 об./мин сыворотку крови аликвотировали для дальнейшего замораживания (при -70 C). Использовали микропланшетный фотометр Multiskan FC Thermo Fisher Scientific (США), автоматический микропланшетный вошер W600 Sinnowa (Китай), термошейкер для планшетов PST-60HL Biosan (Латвия). Уровень Bcl-2 (нг/мл) определяли с помощью прямого иммуноферментного анализа с использованием аналитического набора "Human Bcl-2 ELISA Kit" (Cloud Clone Corp., Китай), Bax (нг/мл) — с использованием "Human ELISA Kit for Bcl2 associated X protein (Bax)" (Cloud Clone Corp., Китай), p53 (нг/мл) — "Human p53 ELISA Kit" (RayBiotech, Inc., США), TRAIL (пг мл) — "Human TRAIL ELISA Kit" (RayBiotech, Inc., США) согласно инструкциям производителя.
Статистическую обработку полученных результатов осуществляли с использованием программного обеспечения "Statistica 10.0". Для данных, выраженных в дихотомической шкале, в качестве описательных статистик использовали абсолютные и относительные частоты. Для данных, представленных в порядковой или количественной шкалах, в качестве описательных статистик использовали медиану (Me) и интерквартильный размах (Q25; Q75). Для оценки статистической значимости различий между двумя группами по каким-либо параметрам использовали критерий Манна-Уитни. Для оценки статистической связи между двумя признаками использовали коэффициент ранговой корреляции Спирмена с оценкой его значимости. Достоверными считали различия при р<0,05.
Исследование выполнено за счет гранта Российского научного фонда № 22-25-20053, https://rscf.ru/project/22-25-20053/.
Результаты
Клинико-анамнестическая характеристика пациентов, включенных в исследование, представлена в таблице 1.
В результате проведенного исследования отмечена сильная корреляционная связь очень высокой значимости между показателями Bcl-2 (r=-0,84; p<0,001), Bax (r=0,83; p<0,001), Bcl-2/Bax (r=-0,86; p<0,001), p53 (r=0,80; p<0,001), TRAIL (r=-0,78; p<0,001) и выраженностью атеросклеротического поражения КА (табл. 2).
Также выявлена корреляционная связь разной силы и значимости между показателями Bcl-2, Bax, Bcl-2/Bax, p53 и TRAIL — и рядом клинико-инструментальных характеристик пациентов с ИБС (табл. 3).
Необходимо отметить полученную достоверность различий (p<0,001) показателей Bcl-2, Bax, Bcl2/Bax, p53 и TRAIL между группами пациентов с МФА — и пациентами с поражением только КА, с рестенозами после ранее проведенной реваскуляризации — и с проходимыми стентами в КА, а также между группами пациентов с наличием ИМ и без острых коронарных событий в анамнезе (табл. 4).
Таблица 1
Клинико-инструментальная характеристика пациентов
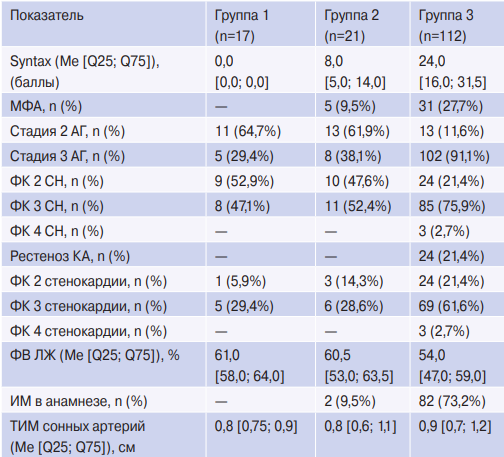
Сокращения: АГ — артериальная гипертензия, ИМ — инфаркт миокарда, КА — коронарные артерии, МФА — мультифокальный атеросклероз, ФВ ЛЖ — фракция выброса левого желудочка, ФК СН — функциональный класс сердечной недостаточности согласно классификации Нью-Йоркской ассоциации сердца, ФК стенокардии — функциональный класс стенокардии согласно классификации Канадского кардиологического общества, ТИМ — толщина комплекса интима-медиа.
Таблица 2
Значения маркеров апоптоза в сыворотке крови в зависимости от выраженности атеросклеротического поражения КА
Показатель, Me [Q25; Q75] | Группа 1 (n=17) | Группа 2 (n=21) | Группа 3 (n=112) | Группа 4 (n=26) |
Bcl-2, нг/мл | 4,80 [ 4,50; 5,00]* | 3,85 [ 3,60; 3,95]* | 2,60 [ 2,20; 2,90]* | 5 [ 4,40; 5,40]* |
Bax, нг/мл | 20,30 [ 20,00; 21,70]* | 28,80 [ 25,25; 31,00]* | 35,10 [ 33,30; 36,30]* | 15,60 [ 15,00; 16,20]* |
p53, нг/мл | 5,36 [ 4,74; 5,90]* | 6,80 [ 6,11; 7,50]* | 8,62 [ 7,96; 9,26]* | 2,91 [ 2,20; 3,25]* |
TRAIL, пг/мл | 833,50 [ 648,30; 912,50]* | 532,90 [ 451,70; 591,90]* | 311,90 [ 222,10; 411,26]* | 1749,60 [ 982,50; 2300,10]* |
Bcl-2/Bax | 0,23 [ 0,20; 0,25]* | 0,13 [ 0,12; 0,15]* | 0,07 [ 0,06; 0,09]* | 0,32 [ 0,28; 0,36]* |
Примечание: * — все группы продемонстрировали достоверность различий по всем показателям p<0,001 при сравнении между собой.
Таблица 3
Оценка статистической связи между клинико- инструментальными показателями и значениями маркеров апоптоза с помощью коэффициента ранговой корреляции Спирмена
Показатель | Bcl-2 | Bax | Bcl-2/Bax | р53 | TRAIL |
Возраст | -0,37*** | 0,48*** | -0,42*** | 0,45*** | -0,41*** |
SYNTAX | -0,63*** | 0,69*** | -0,68*** | 0,78*** | -0,71*** |
ТИМ | -0,63*** | 0,54*** | -0,65*** | 0,43** | 0,11 |
ИМ в анамнезе | -0,58*** | 0,58*** | -0,60*** | 0,55*** | -0,55*** |
ФК стенокардии | -0,56*** | 0,53*** | -0,57*** | 0,47*** | -0,49*** |
ФК СН | -0,17* | 0,24** | -0,19* | 0,18* | -0,29** |
ФВ ЛЖ | 0,21* | -0,23** | 0,23** | -0,24** | 0,20* |
Стадия АГ | -0,45*** | 0,48*** | -0,49*** | 0,43*** | -0,37*** |
МФА | -0,26*** | 0,32*** | -0,30*** | 0,41*** | -0,39*** |
Рестенозы КА | -0,22* | 0,35*** | -0,27** | 0,24** | -0,33*** |
Уровень глюкозы | -0,23* | 0,27* | -0,25** | 0,20* | -0,26* |
Примечание: уровень статистической значимости корреляционной связи * — p<0,05, ** — р<0,01, *** — р<0,001.
Сокращения: АГ — артериальная гипертензия, ИМ — инфаркт миокарда, КА — коронарные артерии, МФА — мультифокальный атеросклероз, ФВ ЛЖ — фракция выброса левого желудочка, ФК СН — функциональный класс сердечной недостаточности согласно классификации Нью-Йоркской ассоциа- ции сердца, ФК стенокардии — функциональный класс стенокардии согласно классификации Канадского кардиологического общества, ТИМ — толщина комплекса интима-медиа.
Таблица 4
Маркеры апоптоза у пациентов в зависимости от наличия МФА, рестенозов и ИМ в анамнезе
Показатель, Me [Q25; Q75] | Пациенты с МФА (n=35) | Пациенты без МФА (n=115) | Пациенты с рестенозом КА (n=25) | Пациенты без рестенозов КА (n=125) | Пациенты с ИМ в анамнезе (n=80) | Пациенты без ИМ в анамнезе (n=70) |
Bcl-2, нг/мл | 2,5 [ 2,2; 3,1]* | 3,1 [ 2,5; 4,35] | 2,6 [ 2,4; 2,9]* | 3,0 [ 2,5; 4,1] | 2,55 [ 2,2; 2,9]* | 3,9 [ 2,9; 4,9] |
Bax, нг/мл | 35,7 [ 32,7; 37,0]* | 25,81 [ 20,3; 35,2] | 36,1 [ 34,7; 37,0]* | 31,9 [ 22,3; 35,5] | 35,35 [ 33,5; 36,25]* | 25,3 [ 17,0; 33,0] |
Bcl-2/Bax | 0,07 [ 0,06; 0,09]* | 0,09 [ 0,07; 0,22] | 0,07 [ 0,07; 0,08]* | 0,09 [ 0,07; 0,19] | 0,07 [ 0,06; 0,09]* | 0,15 [ 0,09; 0,27] |
p53, нг/мл | 9,12 [ 7,97; 9,9]* | 7,65 [ 5,26; 8,58] | 8,41 [ 8,0; 9,22]* | 7,78 [ 5,68; 8,9] | 8,66 [ 7,97; 9,26]* | 6,19 [ 3,97; 8,09] |
TRAIL, пг/мл | 279,1 [ 185,71; 379,2]* | 451,7 [ 310,6; 845,1] | 297,2 [ 199,2; 364,81]* | 439,12 [ 301,6; 712,2] | 311,85 [ 251,9; 389,75]* | 605,75 [ 415,55; 945,88] |
Примечание: * — достоверность различий при значениях p<0,001.
Сокращения: ИМ — инфаркт миокарда, КА — коронарные артерии, МФА — мультифокальный атеросклероз.
Обсуждение
В 1972г австрийский патологоанатом Дж.Ф. Керр в сотрудничестве с шотландскими коллегами А.Х. Уайли и А.Р. Карри ввели понятие "апоптоз" (от древнегреческого ἀπόπτωσις — опадение листьев) для описания морфологически стереотипной формы клеточной гибели, характеризующейся уменьшением объема цитоплазмы, конденсацией хроматина и маргинализацией, сморщиванием ядра (кариопикноз), фрагментацией ядра (кариорексис), вздутием мембран и образованием отдельных апоптотических телец с неповрежденной клеточной мембраной [7].
Согласно современной биохимической классификации Номенклатурного комитета по клеточной смерти, апоптоз считается одним из морфологических признаков, характерных для различных типов регулируемой гибели клеток [8]. Важное значение в понимании процессов апоптоза при ИБС имеют проапоптотические и антиапоптотические белки семейства BCL-2. При этом соотношение Bcl-2/Bax является своего рода "реостатом", регулирующим гибель клеток в зависимости от баланса между Bcl-2 и Bax. Апоптоз кардиомиоцитов является известным ведущим процессом при развитии ишемии. При ингибировании апоптоза соотношение Bcl-2/Bax увеличивается, что способствует выживанию кардиомиоцитов в периинфарктной области. Предыдущие исследования выявили значительную роль аномальной экспрессии Bcl-2 в модуляции апоптоза кардиомиоцитов при реперфузионном повреждении [9][10].
Нами обнаружена обратная сильная очень высоко значимая корреляционная связь между концентрацией антиапоптотических маркеров Bcl-2 (r=- 0,84, p<0,001) и Bcl-2/Bax (r=-0,86, p<0,001), прямая сильная очень высоко значимая корреляционная связь между значениями проапоптотического показателя Bax (r=0,83, p<0,001) — и выраженностью атеросклеротического поражения КА, а также статистически значимые различия показателей в группах с МФА, рестенозами и ИМ в анамнезе (p<0,001) в сравнении с пациентами без указанных признаков. Схожие тенденции наблюдаются при рассмотрении значений ТИМ, баллов по шкале SYNTAX, функционального класса (ФК) стенокардии, ФК сердечной недостаточности (СН), фракции выброса (ФВ) ЛЖ и стадии артериальной гипертензии (АГ): нами выявлена корреляционная связь различной силы и значимости между уровнем Bcl-2, Bax, Bcl-2/Bax и указанными клинико-инструментальными показателями. Полученные данные свидетельствуют об активации процессов апоптоза, что, вероятно, может быть обусловлено действием провоспалительных цитокинов, гипоксии и явлений окислительного стресса у данных категорий пациентов.
Существует ряд исследований, подтверждающих роль апоптоза в развитии ремоделирования ЛЖ и СН после ИМ [2][10]. Более того, апоптоз коррелирует с прогрессированием параметров ремоделирования, что сопровождается увеличением Bax в месте инфаркта [10]. Экспериментальные исследования показали, что индуцированный ИМ апоптоз кардиомиоцитов связан с путем CHIP-p53 (от англ. carboxy-terminus of Hsc70 interacting protein — Hsp-ассоциированная Е3-убиквитин-лигаза); при подавлении р53 апоптоз миокарда и ремоделирование желудочков останавливаются [11].
Аномальный апоптоз сосудистых эндотелиальных клеток, макрофагов и гладкомышечных клеток (ГМК) сосудов является распространенным патогенетическим этапом атерогенеза, в т.ч. способствующим нестабильности атеросклеротических бляшек. Так, апоптоз эндотелиальных клеток КА вызывает повреждения самого эндотелия, что лежит в основе развития атеросклероза. Апоптоз макрофагов опосредуется через путь CHOP-Bax (CHOP — транскрипционный фактор, гомологичный CCAAT-энхансер-связывающему белку) во время стресса эндоплазматического ретикулума, что приводит к разрыву атеросклеротической бляшки и, таким образом, повышает риск развития острого коронарного синдрома (ОКС). Наряду с гибелью макрофагов имеет место апоптоз ГМК сосудов, вероятно, индуцируемый макрофагами посредством взаимодействий лиганда смерти с соответствующими рецепторами смерти, что может быть центральным событием в разрыве бляшки. Апоптоз ГМК приводит к прогрессированию атерогенеза: способствует кальцификации, вызывает признаки медиальной дегенерации, включая атрофию, фрагментацию эластина [2][12].
Исследования in vitro продемонстрировали способность p53 дифференцированно регулировать пролиферацию и апоптоз макрофагов и ГМК [11][12]. Нами получены данные, демонстрирующие повышение концентрации p53 в сыворотке крови при увеличении выраженности атеросклеротического поражения КА (r=0,80; p<0,001), а также статистически значимо более высокие его значения в группах с МФА, рестенозами и ИМ в анамнезе (p<0,001) в сравнении с пациентами без указанных признаков. Обнаружена прямая умеренная корреляционная связь показателей р53 со значениями ТИМ (p<0,01), ФК стенокардии (p<0,001) и стадией АГ (p<0,001), слабая обратная корреляционная связь с ФВ ЛЖ (р<0,01), прямая очень слабая корреляционная связь с ФК СН (p<0,05). Выявленные закономерности подтверждают усиление апоптотических процессов у пациентов при прогрессировании атеросклероза и подчеркивают роль р53 как одного из маркеров неблагоприятного течения ИБС.
Важно подчеркнуть взаимосвязь воспалительных и апоптотических механизмов формирования и эволюции атеросклеротической бляшки, поскольку есть доказательства задержки, дефектного фагоцитоза и активного выделения провоспалительных медиаторов, сигнальных молекул при гиперлипидемии. По-видимому, при атеросклерозе имеет место "порочный круг", включающий в себя первичное воспаление, активацию проапоптотических сигнальных путей, чрезмерный апоптоз эндотелиальных клеток, макрофагов и ГМК, который, в свою очередь, сопровождается высвобождением провоспалительных цитокинов (интерлейкина-1, интерлейкина-1β), что в итоге приводит к прогрессированию воспаления, апоптоза и атеросклеротического повреждения [12]. В качестве доказательства от противного можно привести исследование, которое продемонстрировало ингибирующий апоптоз ГМК сосудов по пути JAK2- STAT3 (JAK — от англ. Janus Kinase — семейство ассоциированных с рецепторами киназ; STAT — от англ. Signal Transducer and Activator of Transcription — активатор транскрипции, участвующий в передаче сигнала) эффект противовоспалительного интерлейкина-10 [2].
Поскольку атеросклеротическая бляшка представлена гетерогенными популяциями клеток, стоит отметить, что их изменения не всегда носят однонаправленный характер. Индуцирует ли апоптоз воспаление, зависит от происхождения клеток: например, ГМК-подобные клетки, имеющие костномозговое происхождение, уже имеют провоспалительный фенотип, и их апоптоз уменьшает воспаление [13].
В связи с вышеописанным особенный интерес в качестве потенциальных мишеней терапевтического воздействия и диагностического поиска имеют некоторые сигнальные молекулы, которые принимают участие в регуляции процессов воспаления и апоптоза. Так, исследования предполагают, что TNF-α также имеет прогностическое значение у пациентов с острым ИМ. Однако клиническое исследование с применением антагониста TNF-α у данной категории больных не продемонстрировало положительного терапевтического эффекта. Эти результаты свидетельствуют о том, что значение TNF-α в развитии ИБС представляется сложным и включает в себя широкий спектр биологических процессов. Эта концепция подтверждается противоречивостью роли TRAIL в развитии атеросклероза и прогрессировании ИБС. После связывания с рецепторами TRAIL-R1 и TRAIL-R2, TRAIL инициирует внутриклеточный сигнальный каскад, приводящий к апоптотической гибели клеток. Однако точный молекулярный механизм действия TRAIL продолжает оставаться предметом научных дискуссий и инициации исследований. В ряде экспериментальных работ показана протекторная активность TRAIL. Так, у мышей с сахарным диабетом прямое введение TRAIL снижало развитие кардиомиопатии и имело антиатеросклеротическую активность. В нескольких клинических исследованиях сообщалось, что уровни TRAIL оказались обратно пропорциональны тяжести ИБС, ОКС и частоте сердечно-сосудистых осложнений после острого ИМ. По данным авторов, сывороточные уровни TRAIL были значительно снижены у пациентов с острым ИМ исходно (по сравнению с контрольной группой) и были связаны с увеличением частоты сердечной смерти и СН в течение 12 мес. наблюдения, даже после корректировки демографических и клинических параметров риска, а также оказались наиболее значимым и независимым предиктором комбинированной конечной точки смерти и госпитализации по поводу СН в течение 6 мес. после ОКС [1][2][14]. Низкие уровни TRAIL могут предсказывать худший прогноз также у пациентов с хронической СН и у пожилых пациентов с сердечно-сосудистыми заболеваниями [1].
Это согласуется с полученными нами статистически значимо меньшими значениями концентрации TRAIL в сыворотке крови в группах пациентов с МФА, рестенозами и ИМ в анамнезе (p<0,001) в сравнении с пациентами без данных признаков, а также с обнаруженной обратной сильной очень высоко значимой корреляционной связью с выраженностью атеросклеротического поражения КА (r=-0,78; p<0,001), обратной очень высоко значимой связью умеренной силы с ФК стенокардии (r=-0,49, p<0,001) и стадией АГ (r=-0,37, p<0,001), обратной слабой высоко значимой корреляционной связью с ФК СН (r=-0,29, p<0,01), обратной слабой корреляционной связью с ФВ ЛЖ (r=-0,20, p<0,05).
Необходимо отметить, что остается неясным, является ли снижение уровня TRAIL результатом уменьшения продукции, либо является отражением увеличения его потребления: так, в исследовании in vitro было показано, что металлопротеиназа 2 типа, уровень которой повышен у пациентов с ОКС, способна расщеплять TRAIL [15]. Лучшее понимание точного молекулярного механизма TRAIL может стать новой мишенью для разработки новых терапевтических стратегий.
Ограничения исследования. Включение в работу пациентов, которым на основании клиникоанамнестических признаков был выставлен диагноз ИБС, однако при проведении коронарографии стенотических сужений КА выявлено не было. Вероятно, это может быть связано с наличием таких форм, как вазоспастическая либо микрососудистая стенокардия, что требует в дальнейшем более детального определения критериев включения пациентов в исследование.
Заключение
В последние годы внимание многих ученых сосредоточено на процессе апоптоза при различных заболеваниях сердечно-сосудистой системы в связи с потенциальной возможностью его контроля. Изучение маркеров апоптоза в сыворотке крови является многообещающим направлением в исследованиях атерогенеза и ИБС в связи с технической простотой получения материала и высокой информативностью результатов. Однако при изучении данных показателей отсутствует единое мнение: ряд исследователей рассматривают их с точки зрения возможной кардиопротекции, другие — как одни из звеньев патогенетического механизма. В нашей работе при изучении комплекса про- и антиапоптотических факторов продемонстрировано статистически значимое увеличение уровня Bax, p53 и снижение Bcl-2, Bcl-2/Bax и TRAIL в сыворотке крови по мере нарастания выраженности атеросклеротического поражения КА, а также выявлены корреляционные связи различной силы между лабораторными маркерами и рядом клинико-инструментальных показателей у пациентов с ИБС. Полученные данные позволяют предположить возможное использование показателей апоптоза в качестве маркеров выраженности атеросклеротических процессов, а также могут явиться плацдармом для разработки новых лечебнодиагностических подходов.
Отношения и деятельность. Исследование выполнено за счет гранта Российского научного фонда № 22-25-20053, https://rscf.ru/project/22-25-20053/.
Список литературы
1. Teringova E, Tousek P.Apoptosis in ischemic heart disease. J Transl Med. 2017;15(1):87. doi:10.1186/s12967-017-1191-y.
2. Dong Y, Chen H, Gao J, et al. Molecular machinery and interplay of apoptosis and autophagy in coronary heart disease. J Mol Cell Cardiol. 2019;136:27-41. doi:10.1016/j.yjmcc.2019.09.001.
3. Ji N, Qi Z, Wang Y, et al. Pyroptosis: A New Regulating Mechanism in Cardiovascular Disease. J Inflamm Res. 2021;14:2647-66. doi:10.2147/JIR.S308177.
4. Del Re DP, Amgalan D, Linkermann A, et al. Fundamental Mechanisms of Regulated Cell Death and Implications for Heart Disease. Physiol Rev. 2019;99(4):1765-817. doi:10.1152/physrev.00022.2018.
5. Singh R, Letai A, Sarosiek K.Regulation of apoptosis in health and disease: the balancing act of BCL-2 family proteins. Nat Rev Mol Cell Biol. 2019;20(3):175-93. doi:10.1038/s41580-018-0089-8.
6. Pahlavani HA. Exercise-induced signaling pathways to counteracting cardiac apoptotic processes. Front Cell Dev Biol. 2022;10:950927. doi:10.3389/fcell.2022.950927.
7. Kerr JF, Wyllie AH, Currie AR. Apoptosis: a basic biological phenomenon with wide-ranging implications in tissue kinetics. Br J Cancer. 1972;26(4):239-57. doi:10.1038/bjc.1972.33.
8. Galluzzi L, Vitale I, Aaronson SA, et al. Molecular mechanisms of cell death: recommendations of the Nomenclature Committee on Cell Death 2018. Cell Death Differ. 2018;25(3):486-541. doi:10.1038/s41418-017-0012-4.
9. Калинин Р.Е., Сучков И.А., Климентова Э.А. и др. К вопросу о роли апоптоза в развитии атеросклероза и рестеноза зоны реконструкции. Новости хирургии. 2020;28(4):418-27. doi:10.18484/2305-0047.2020.4.418.
10. Korshunova AY, Blagonravov ML, Neborak EV, et al. BCL2-regulated apoptotic process in myocardial ischemia-reperfusion injury (Review). Int J Mol Med. 2021;47(1):23-36. doi:10.3892/ijmm.2020.4781.
11. Glukhov AI, Gryzunova GK, Usai LI, et al. The Role of Apoptosis in the Pathogenic Mechanism of Critical States (Review). General Reanimatology. 2019;15(2):79-98. doi:10.15360/1813-9779-2019-2-79-98.
12. Clarke M, Talib S, Figg N, et al. Vascular smooth muscle cell apoptosis induces IL-1- directed inflammation; effects of hyperlipidemia-mediated inhibition of phagocytosis. Circ Res. 2010;106:363-72.
13. Yu H, Stoneman V, Clarke M, et al. Bone Marrow-Derived Smooth Muscle-Like Cells Are Infrequent in Advanced Primary Atherosclerotic Plaques but Promote Atherosclerosis. Arterioscler Thromb Vasc Biol. 2011;31:1291-9.
14. Xu X, Lai Y, Hua ZC. Apoptosis and apoptotic body: disease message and therapeutic target potentials. Biosci Rep. 2019;39(1):BSR20180992. doi:10.1042/BSR20180992.
15. Obeng E.Apoptosis (programmed cell death) and its signals — A review. Braz J Biol. 2021;81(4):1133-43. doi:10.1590/1519-6984.228437
Об авторах
Е. А. ЗахарьянРоссия
Захарьян Елена Аркадьевна — кандидат медицинских наук, доцент кафедры внутренней медицины №1
Симферополь
И. И. Фомочкина
Россия
Фомочкина Ирина Ивановна — доктор медицинских наук, профессор кафедры общей и клинической патофизиологии
Симферополь
Дополнительные файлы
Что известно о предмете исследования?
- Апоптоз считается одним из морфологических признаков, характерных для различных типов регулируемой гибели клеток.
- Апоптоз кардиомиоцитов является ведущим процессом в развитии ишемии.
- В результате воздействия триггерных факторов во всех клетках атеромы обнаруживаются морфологические признаки апоптоза, что впоследствии может приводить к нестабильности атеросклеротической бляшки с увеличением риска тромбообразования и разрыва.
Что добавляют?
- Изучение связи маркеров апоптоза Bax, Bcl-2, Bcl-2/Bax, p53, TRAIL с выраженностью атеросклеротического поражения коронарных артерий и клинико-инструментальными характеристиками демонстрирует преобладание процессов апоптоза у пациентов с ишемической болезнью сердца и может создать перспективы в создании новых лечебно диагностических стратегий.
Рецензия
Для цитирования:
Захарьян Е.А., Фомочкина И.И. Взаимосвязь маркеров апоптоза с выраженностью атеросклеротического поражения коронарных артерий и клинико-инструментальными характеристиками пациентов с ишемической болезнью сердца. Российский кардиологический журнал. 2023;28(11):5518. https://doi.org/10.15829/1560-4071-2023-5518. EDN: RVEQTN
For citation:
Zakharyan E.A., Fomochkina I.I. Relationship between apoptosis markers and the severity of coronary atherosclerosis and clinical and paraclinical characteristics of patients with coronary artery disease. Russian Journal of Cardiology. 2023;28(11):5518. (In Russ.) https://doi.org/10.15829/1560-4071-2023-5518. EDN: RVEQTN
JATS XML

















































