Перейти к:
Влияние характеристик ишемического повреждения на систолическую функцию левого желудочка у пациентов с острым инфарктом миокарда
https://doi.org/10.15829/1560-4071-2023-5516
EDN: HBCFIR
Аннотация
Цель. Изучить особенности лабораторных показателей и характеристики зоны инфаркта по данным магнитно-резонансной томографии (МРТ) в зависимости от глобальной систолической функции левого желудочка (ЛЖ) у пациентов с острым инфарктом миокарда (ОИМ) после реваскуляризации.
Материал и методы. Включено 78 пациентов с первичным ОИМ. На 7-10 сут. выполняли МРТ сердца с контрастированием. В крови анализировали мозговой натрийуретический пептид (BNP). С помощью МРТ сердца определяли характеристики рубцовой ткани, периинфарктной гетерогенной зоны (ПГЗ), микрососудистой обструкции (МСО) и интрамиокардиального кровоизлияния (ИМК), индекс глобального контрастирования.
Результаты. По результатам МРТ пациентов разделили на группы: 1-я — с фракцией выброса (ФВ) ЛЖ ≥50% (n=50), 2-я — с ФВ ЛЖ 40-49% (n=21), 3-я — с ФВ ЛЖ <40% (n=7).
Показатель BNP в 1 группе оказался равен 106,8 (37,5; 248) нг/мл, во 2 группе — 232,6 (170,1; 337,7) нг/мл, в 3 — 548,5±236,4 нг/мл (р1-3<0,05). Масса рубцовой ткани была минимальной в 1 группе — 10,3 (2,4; 20,0) г, промежуточные значения отмечены во 2 группе — 34,7±21,3 г, максимальные (59,4±37,6 г) — в 3 группе (р1-2, 3<0,01). По характеристикам ПГЗ различия выявлены только между пациентами с сохраненной и умеренно сниженной ФВ. МСО диагностирована у 26% пациентов с ФВ ≥50%, у 47,6% больных с ФВ 40-49% и 85,7% с ФВ <40% (р1-3<0,01). Частота выявления ИМК преобладала во 2 группе (33,3%) по сравнению с 1 группой (12%) (р1-2<0,05). Индекс глобального контрастирования был наименьшим в 1 группе (14,7 (8,8; 27,9)%), промежуточные значения выявлены во 2 группе (33,3±12,6%), наиболее высокие — в 3 группе (54,2±19,5%) (р1-2, 3; 2-3<0,05).
Заключение. Выявлены факторы риска снижения систолической функции ЛЖ у больных ОИМ после реваскуляризации: размеры рубцовой ткани, ПГЗ, характеристики МСО и ИМК, индекс глобального контрастирования, уровень BNP.
Ключевые слова
Для цитирования:
Олейников В.Э., Салямова Л.И., Донецкая Н.А., Вдовкин А.В. Влияние характеристик ишемического повреждения на систолическую функцию левого желудочка у пациентов с острым инфарктом миокарда. Российский кардиологический журнал. 2023;28(8):5516. https://doi.org/10.15829/1560-4071-2023-5516. EDN: HBCFIR
For citation:
Oleinikov V.E., Salyamova L.I., Donetskskaya N.A., Vdovkin A.V. Effect of ischemic injury characteristics on left ventricular systolic function in patients with acute myocardial infarction. Russian Journal of Cardiology. 2023;28(8):5516. (In Russ.) https://doi.org/10.15829/1560-4071-2023-5516. EDN: HBCFIR
Хроническая сердечная недостаточность (ХСН) является одним из основных осложнений острого инфаркта миокарда (ОИМ) и закономерным исходом сердечно-сосудистого континуума, влияющим на инвалидизацию и смертность населения во всем мире. Результаты исследования ЭПОХА-ХСН продемонстрировали увеличение роли перенесенного инфаркта миокарда как причины ХСН, что отчасти обусловлено значительными успехами в лечении острой стадии заболевания [1].
Фракция выброса (ФВ) остается основной характеристикой контрактильной функции левого желудочка (ЛЖ), определяющей прогноз пациентов в постинфарктном периоде [2]. Частота систолической дисфункции у пациентов с острым коронарным синдромом варьирует от 12,6 до 36,6% в зависимости от способа определения и сроков оценки состояния ЛЖ [3]. Снижение ФВ <40% ассоциировано с высоким риском смертности и повторных госпитализаций, а также ухудшением качества жизни больных ОИМ [4].
Трансторакальная эхокардиография (ЭхоКГ) остается методом выбора для первоначальной идентификации ишемического повреждения, систолической и диастолической дисфункции ЛЖ [5]. Альтернативой ЭхоКГ является магнитно-резонансная томография (МРТ) сердца с контрастированием. Метод позволяет с высокой точностью определять объемы и функции желудочков. К преимуществам МРТ сердца также можно отнести возможность количественно охарактеризовать рубцовую и периинфарктную зоны, участки отека, микрососудистую обструкцию (МСО) и интрамиокардиальное кровоизлияние (ИМК) (рис. 1). Этот метод визуализации не только позволяет обнаружить и оценить размер инфаркта, но и выявить дополнительные характеристики рубцовой ткани, имеющие прогностическое значение [6].
Цель настоящего исследования заключалась в изучении особенностей лабораторных показателей и МРТ-характеристик зоны инфаркта в зависимости от глобальной систолической функции ЛЖ у пациентов с ОИМ после реваскуляризации.

Рис. 1. Паттерн ишемического поражения по данным МРТ сердца (собственное наблюдение): А — отсроченное контрастирование; Б — постобработка; В — схематичное изображение. Зоны инфаркта: 1. некроз; 2. МСО; 3. гетерогенная зона; 4. непораженный миокард.
Примечание: цветное изображение доступно в электронной версии журнала.
Материал и методы
В исследование включено 78 пациентов с ОИМ, госпитализированных в отделение неотложной кардиологии. Локальный этический комитет одобрил протокол исследования и индивидуальную регистрационную карту. До включения в исследование у всех участников было получено письменное информированное согласие.
Критерии включения: возраст от 30 до 70 лет; первичный ОИМ с подъемом или без подъема сегмента ST, подтвержденный электрокардиограммой, диагностически значимым повышением тропонина I; наличие инфаркт-связанной артерии по данным коронароангиографии.
Критерии исключения: повторный или рецидивирующий ОИМ, гемодинамически значимый стеноз ствола левой коронарной артерии >30%, тяжелые сопутствующие заболевания, наличие в анамнезе ХСН III-IV функционального класса.
Всем пациентам выполняли коронароангиографию. Первичное чрескожное коронарное вмешательство (ЧКВ) на инфаркт-связанной артерии проведено 51 больному, фармакоинвазивная стратегия использовалась у 27 человек.
Больные получали медикаментозное лечение по поводу ОИМ в соответствии с актуальными клиническими рекомендациями.
На 7-10 сут. от начала заболевания пациентам выполняли МРТ сердца с контрастированием на томографе GE SIGNA Voyager (GE HealthCare) c напряженностью магнитного поля 1,5 Тл. В качестве внутривенного контрастного вещества использовали парамагнитный контрастный препарат Кларискан (гадотеровая кислота, GE Healthcare AS). Бесконтрастная часть протокола сканирования включала анатомические срезы, кино-режимы по длинной оси ЛЖ в 2- и 4-камерной проекциях, по короткой оси ЛЖ; программы Т1-, Т2- и Т2*-картирования. В соответствии с постконтрастной частью исследования проводили сканирование программой 2D MDE на 7-й мин по короткой оси и на 10-12-й мин по длинной оси в 2- и 4-камерной проекциях; на 15-й мин постконтрастное Т1-картирование в последовательности 2D MOLLI, на 20-й мин сканирование программой MDE FIESTA по короткой оси. Обработку изображений выполняли с использованием программы CVI42 (Circle Cardiovascular Imaging Inc.). Определяли следующие показатели ЛЖ: индексы конечного диастолического (иКДО) и систолического (иКСО) объемов, индекс ударного объема (иУО), ФВ, индекс массы миокарда (иММЛЖ), индекс локальной сократимости (ИЛС). Паттерн ишемического повреждения анализировали по постишемическому отсроченному контрастированию, идентифицирующему рубцовую и периинфарктную гетерогенную зоны (ПГЗ); МСО и ИМК. Проводили количественную оценку массы и объема некроза, ПГЗ, их размер относительно массы миокарда ЛЖ; массу и объем МСО, ИМК, их размер относительно массы рубца. Трансмуральность поражения изучали по индексу глобального контрастирования [7].
По результатам коронароангиографии в соответствии со шкалой SYNTAX определяли тяжесть поражения коронарного русла.
Мозговой натрийуретический пептид (BNP) и высокочувствительный (вч) С-реактивный белок оценивали в крови на 7-9 сут. Вч тропонин I регистрировали в динамике трижды, в работе представлены максимальные значения показателя.
Статистический анализ данных осуществляли программой STATISTICA 13 (StatSoft). Количественные данные представляли как среднее значение и стандартное отклонение при нормальном распределении (M±SD) или как медиана и межквартильный размах при непараметрическом распределении (Me (Q25%; Q75%)). Значимость различий между параметрическими данными оценивали критерием Стьюдента, между непараметрическими — критерием Манна-Уитни. Качественные данные сравнивали с помощью критерия χ2. Логистический регрессионный анализ использовали для выявления переменных, предсказывающих снижение ФВ ЛЖ. Статистически значимыми различиями считалось значение p<0,05.
Результаты
По результатам МРТ сердца пациентов разделили на группы: 1-я — с ФВ ЛЖ ≥50% (n=50), 2-я — с умеренно сниженной ФВ ЛЖ 40-49% (n=21), 3-я — с низкой ФВ ЛЖ <40% (n=7). Сравниваемые группы не различались по полу, некоторым антропометрическим и анамнестическим данным (табл. 1). Больные 3 группы оказались старше по возрасту 1 группы.
По результатам коронароангиографии пациенты были сопоставимы по шкале SYNTAX. В 1 группе гемодинамически значимый стеноз одной коронарной артерии выявлен в 38% случаев, двух — в 34%, трех и более — в 28%; во 2 группе — в 33,3%, 42,9% и 23,8%; в 3 группе — в 28,6%, 14,3% и 57,1% случаев, соответственно (р1-2; 1, 2-3>0,05). Поражение передней нисходящей артерии (ПНА) в качестве инфаркт-связанной наблюдалось достоверно чаще в группе с низкой ФВ по сравнению с сохраненной ФВ. В свою очередь, атеротромбоз в правой коронарной артерии выявлен в 42% у 1 группы, в то время как в 3 группе ни у одного пациента. У больных с ФВ <40% в качестве реперфузионной терапии чаще использовалась фармакоинвазивная стратегия.
Сравниваемые группы различались по большинству анализируемых структурных и функциональных характеристик ЛЖ по данным МРТ сердца (табл. 2). При сопоставимом иКДО пациенты с ФВ ≥50% имели наименьшие значения иКСО, промежуточные значения зарегистрированы в группе ФВ 40-49%, наибольшие — у лиц с ФВ <40%. Уровень иУО был ниже во 2 и 3 группах по сравнению с 1. В свою очередь, иММЛЖ преобладал у больных с ФВ 40-49%. Снижение ФВ оказалось сопряжено с увеличением ИЛС.
При анализе паттерна ишемического повреждения выявлено ухудшение характеристик зоны инфаркта (табл. 2, рис. 2). Пациенты с ФВ 40-49% и <40% имели сопоставимо высокие значения массы и объема рубцового повреждения по сравнению с больными с ФВ ≥50%. При этом рубцовая ткань (в %) от общей массы миокарда оказалась минимальной в 1 группе, промежуточные значения отмечены во 2 группе, максимальные — в 3 группе. По характеристикам ПГЗ различия выявлены только между пациентами с сохраненной и умеренно сниженной ФВ. Зона инфаркта, включающая рубцовую ткань и ПГЗ, в группе ФВ ≥50% занимала в среднем 17,4% от общей массы миокарда, тогда как при ФВ 40-49% она оказалась в 2,4 раза больше, в группе ФВ <40% — в 2,8 раза.
В отличие от группы с сохраненной ФВ ЛЖ у большинства больных с низкой ФВ отмечалась МСО. Однако при анализе массы и объема МСО их значения оказались сопоставимо высокими во 2 и 3 группах по сравнению с 1. Частота выявления ИМК преобладала у больных с умеренно сниженной ФВ. По другим характеристикам данного параметра группы не различались.
Интересные результаты получены при анализе индекса глобального контрастирования. Наименьшие значения выявлены в 1 группе больных, промежуточные — во 2 группе, наиболее высокие — в 3 группе.
В раннем периоде ОИМ у пациентов с ФВ ≥50% вч тропонин I составил 13033,7 (2537; 38100) пг/мл, у больных с ФВ 40-49% — 35787,2 (7420,3; 90647,6) пг мл (р1-2=0,090), с ФВ <40% — 110718±80538 (р1- 3=0,003). Подобные различия отмечались и для BNP. В 1 группе показатель оказался равен 106,8 (37,5; 248) нг/ мл, во 2 группе — 232,6 (170,1; 337,7) нг/ мл, в 3 — 548,5±236,4 нг/мл (р1-3=0,026). По уровню вч С-реактивного белка группы не различались.
При однофакторном регрессионном анализе определены факторы риска снижения ФВ ЛЖ у больных ОИМ (табл. 3). Наиболее высокие значения коэффициента регрессии β (>0,500) отмечены для массы и объема рубцовой ткани, рубца (в %) в сочетании с общей зоной инфаркта (в %) от массы миокарда; массы и объема МСО, массы и объема ИМК, индекса глобального контрастирования и ИЛС. Менее выраженная связь наблюдалась для характеристик ПГЗ, наличия МСО и ее процента от массы рубца. Поражение ПНА в качестве симптом-связанной также оказалось ассоциировано с ухудшением систолической функции ЛЖ. Из лабораторных показателей только BNP продемонстрировал его независимую роль в снижении ФВ <50%.
Таблица 1
Сравнительная характеристика групп
|
Показатель |
ФВ ≥50% (n=50) |
ФВ 40-49% (n=21) |
ФВ <40% (n=7) |
р |
|
1 |
2 |
3 |
||
|
Возраст, лет |
54,7±8,2 |
58 (54; 64) |
61,1±5,8 |
р1-3=0,03 |
|
Мужчины/женщины, n (%) |
43/7 (86/14) |
21/0 (100/0) |
7/0 (100/0) |
нд |
|
Индекс массы тела, кг/м2 |
27,6±3,5 |
27,3±3,8 |
28,1±4,8 |
нд |
|
ИБС в анамнезе, n (%) |
11 (22) |
6 (28,6) |
2 (28,6) |
нд |
|
Артериальная гипертензия в анамнезе, n (%) |
45 (90) |
19 (90,5) |
5 (71,4) |
нд |
|
ИМпST/ИМбпST, n (%) |
46/4 (92/8) |
20/1 (95,2/4,8) |
7/0 (100/0) |
нд |
|
SYNTAX, баллы |
15,8±7,6 |
19,2±10,3 |
21,1±10,7 |
нд |
|
Инфаркт-связанная артерия: ПНА, n (%) ПКА, n (%) Другая артерия, n (%) |
17 (34) 21 (42) 12 (24) |
11 (52,4) 6 (28,6) 4 (19) |
6 (85,7) 0 (0) 1 (14,3) |
р1-3=0,009 р1-3=0,031 нд |
|
Фармакоинвазивная стратегия/первичное ЧКВ, n (%) |
13/37 (26/74) |
6/15 (28,6/71,4) |
6/1 (85,7/14,3) |
р1, 2-3<0,01 |
|
Время "боль-ТЛТ", мин |
100 (55; 120) |
117,1±65,8 |
206,7±135,3 |
нд |
|
Время "боль-ЧКВ", мин |
277,5 (185; 380) |
285 (185; 560) |
538,6±402 |
нд |
Примечание: данные представлены в виде M±SD при нормальном распределении, Me (Q 25%; Q 75%) — при непараметрическом, р — достоверность.
Сокращения: ИБС — ишемическая болезнь сердца, ИМбпST — инфаркт миокарда без подъема сегмента ST, ИМпST — инфаркт миокарда с подъемом сегмента ST, нд — недостоверные различия, ПКА — правая коронарная артерия, ПНА — передняя нисходящая артерия, ТЛТ — тромболитическая терапия, ФВ — фракция выброса, ЧКВ — чрескожное коронарное вмешательство.
Таблица 2
Показатели МРТ сердца в группах сравнения
|
Показатель |
ФВ ≥50% (n=50) |
ФВ 40-49% (n=21) |
ФВ <40% (n=7) |
р1-2 |
р1-3 |
р2-3 |
|
1 |
2 |
3 |
||||
|
Стандартные показатели МРТ сердца |
||||||
|
иКДО, мл/м2 |
75,1 (66,6; 84,9) |
78,7±15,2 |
89,9±25,8 |
0,610 |
0,253 |
0,313 |
|
иКСО, мл/м2 |
63,2 (56,1; 74,5) |
80,5±16,8 |
116,5±34,3 |
<0,001 |
<0,001 |
0,030 |
|
иУО, мл |
86,3±17,2 |
69,7±14,1 |
62,5±11,9 |
<0,001 |
0,001 |
0,313 |
|
иММЛЖ, г/м2 |
58,5 (49,6; 70,8) |
60,1 (56,7; 71,8) |
76,1±17,8 |
0,178 |
0,019 |
0,080 |
|
ФВ, % |
56,3 (52,6; 60,9) |
47,2 (44,1; 49,0) |
36,7 (32,8; 38,3) |
<0,001 |
<0,001 |
<0,001 |
|
ИЛС |
1,4 (1,1; 1,6) |
1,9±0,4 |
2,6±0,4 |
<0,001 |
<0,001 |
0,004 |
|
Параметры ишемического повреждения по данным МРТ сердца |
||||||
|
Масса рубца, г |
10,3 (2,4; 20,0) |
34,7±21,3 |
59,4±37,6 |
<0,001 |
0,001 |
0,080 |
|
Объем рубца, мл |
9,8 (2,3; 19,0) |
33,1±20,3 |
56,7±35,6 |
<0,001 |
0,001 |
0,080 |
|
Масса ПГЗ, г |
9,3 (3,8; 15,2) |
17,5±8,7 |
15,3±6,9 |
<0,001 |
0,060 |
0,633 |
|
Объем ПГЗ, мл |
8,9 (3,6; 14,5) |
16,7±8,3 |
14,6±6,6 |
<0,001 |
0,061 |
0,633 |
|
Масса МСО, г |
0,8 (0,5; 1,2) |
3,4±1,6 |
8,9±7,0 |
0,001 |
0,003 |
0,112 |
|
Объем МСО, мл |
0,81 (0,5; 1,2) |
3,3±1,5 |
8,5±6,6 |
0,001 |
0,001 |
0,112 |
|
Масса ИМК, г |
0,5 (0,5; 1,0) |
2,3±1,7 |
3,5±1,4 |
0,074 |
0,134 |
0,306 |
|
Объем ИМК, мл |
0,45 (0,4; 1,0) |
2,2±1,7 |
3,5±1,2 |
0,063 |
0,134 |
0,306 |
|
Индекс глобального контрастирования, % |
14,7 (8,8; 27,9) |
33,3±12,6 |
54,2±19,5 |
<0,001 |
<0,001 |
0,023 |
Примечание: данные представлены в виде M±SD при нормальном распределении, Me (Q 25%; Q 75%) — при непараметрическом, р — достоверность.
Сокращения: иКДО — индекс конечного диастолического объема, иКСО — индекс конечного систолического объема, ИЛС — индекс локальной сократимости, ИМК — интрамиокардиальное кровоизлияние, иММЛЖ — индекс массы миокарда, иУО — индекс ударного объема, МРТ — магнитно-резонансная томография, МСО — микрососудистая обструкция, ПГЗ — периинфарктная гетерогенная зона, ФВ — фракция выброса.
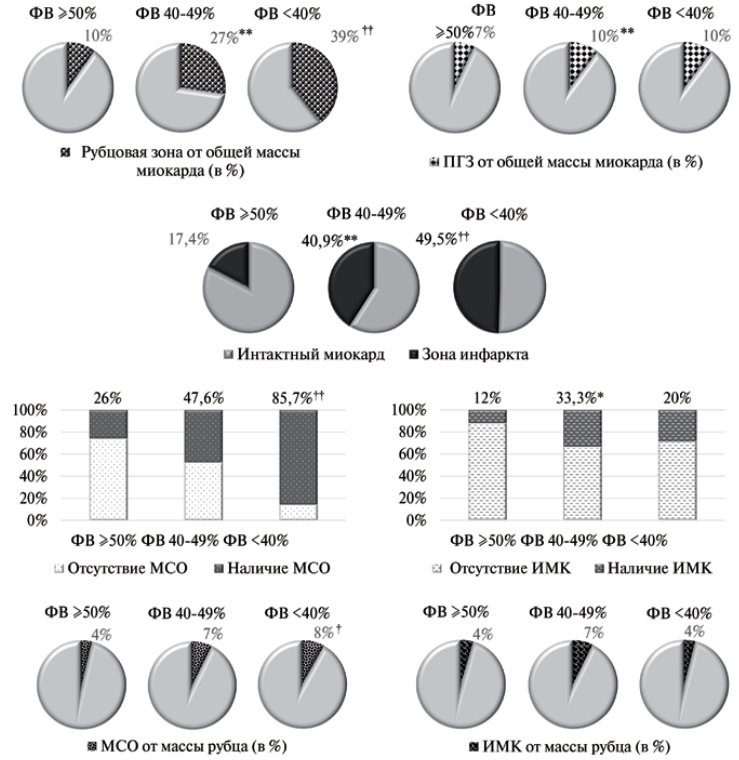
Рис. 2. Характеристики зоны инфаркта в группах сравнения.
Примечание: * — р<0,05, ** — р<0,01 — достоверные отличия между 1 и 2 группами, † — р<0,05, †† — р<0,01 — достоверные отличия между 1 и 3 группами.
Сокращения: ИМК — интрамиокардиальное кровоизлияние, МСО — микрососудистая обструкция, ПГЗ — периинфарктная гетерогенная зона, ФВ — фракция выброса.
Таблица 3
Факторы риска снижения ФВ ЛЖ <50% у больных ОИМ по данным однофакторного анализа
|
Показатель |
β |
В |
p |
|
Поражение ПНА в качестве инфаркт-связанной |
0,306 |
0,404 |
0,006 |
|
Масса рубца, г |
0,639 |
0,018 |
<0,001 |
|
Объем рубца, мл |
0,640 |
0,019 |
<0,001 |
|
Рубцовая зона от общей массы миокарда, в % |
0,621 |
0,025 |
<0,001 |
|
Масса ПГЗ, г |
0,366 |
0,029 |
0,001 |
|
Объем ПГЗ, мл |
0,366 |
0,030 |
0,001 |
|
ПГЗ от общей массы миокарда, в % |
0,270 |
0,027 |
0,017 |
|
Общая зона инфаркта от массы миокарда, в % |
0,581 |
0,019 |
<0,001 |
|
Наличие МСО |
0,345 |
0,470 |
0,002 |
|
Масса МСО, г |
0,678 |
0,122 |
<0,001 |
|
Объем МСО, мл |
0,685 |
0,130 |
<0,001 |
|
МСО от массы рубца, в % |
0,482 |
0,047 |
0,039 |
|
Масса ИМК, г |
0,544 |
0,236 |
0,036 |
|
Объем ИМК, мл |
0,565 |
0,253 |
0,028 |
|
Индекс глобального контрастирования, в % |
0,695 |
0,028 |
<0,001 |
|
ИЛС |
0,776 |
1,023 |
<0,001 |
|
BNP, пг/мл |
0,367 |
0,001 |
0,006 |
Примечание: β — коэффициент регрессии, В — угловой коэффициент, характеризующий величину, на которую в среднем изменится признак при увеличении переменной на единицу своего измерения, р — достоверность.
Сокращения: ИЛС — индекс локальной сократимости, ИМК — интрамиокардиальное кровоизлияние, МСО — микрососудистая обструкция, ПГЗ — периинфарктная гетерогенная зона, ПНА — передняя нисходящая артерия, BNP — мозговой натрийуретический пептид.
Обсуждение
Метод МРТ сердца является "золотым стандартом" оценки таких характеристик ЛЖ, как объемы, ФВ, масса миокарда. Его использование рекомендовано для диагностики ХСН у пациентов с неоптимальной визуализацией по данным трансторакальной ЭхоКГ. Превосходное разрешение МРТ позволяет проводить высокоточную и воспроизводимую количественную оценку вышеперечисленных параметров [5]. В настоящем исследовании у лиц с ФВ ЛЖ <40% снижение иУО и повышение иКСО, ИЛС являлись закономерным отображением снижения систолической функции ЛЖ, а гипертрофия миокарда не повышала его сократительную способность.
Среди методов визуализации постинфарктных изменений МРТ является наиболее многообещающим из-за уникальных характеристик ткани миокарда, высокого разрешения и возможности количественной оценки повреждения миокарда. У больных с ОИМ МРТ можно использовать для определения размера инфаркта и сохраненного миокарда, МСО, ИМК, т.е. основных прогностически значимых маркеров повреждения [6][7].
Визуализированные при МРТ размеры зон инфаркта вычислялись в граммах или в процентах от массы ЛЖ. Локальное контрастирование способно обнаруживать даже небольшие области некроза, что позволяет выявить субэндокардиальный инфаркт, составляющий по массе всего лишь 1 г [8]. В настоящем исследовании масса рубцовой ткани в группе лиц с ФВ 40-49% оказалась в 3,4 раза больше, а в группе ФВ <40% в 5,8 раз, чем у больных с сохраненной с ФВ.
Постишемическое повреждение миокарда является морфологически неоднородным. В его структуру помимо ядра инфаркта входит ПГЗ — участок, граничащий с неповрежденным миокардом, состоящий из некротизированных, ишемизированных и интактных кардиомиоцитов [9]. В настоящей работе пациенты с умеренно сниженной ФВ характеризовались более высокими значениями массы, объема ПГЗ, а также долей пораженной части от общей массы миокарда ЛЖ в отличие от 1 группы. По данным Jensch PJ, et al. (2022), объем ПГЗ >14 мл являлся предиктором серьезных неблагоприятных сердечных событий, таких как смерть, повторный инфаркт миокарда, застойная сердечная недостаточность в течение одного года после ОИМ. Таким образом, данный показатель является потенциальным маркером для стратификации риска у пациентов с инфарктом миокарда с подъемом сегмента ST (ИМпST) [10].
У больных ОИМ с ФВ ЛЖ >50%, перенесших первичное ЧКВ, наличие и выраженность МСО ассоциированы с развитием фатальных и нефатальных сердечно-сосудистых событий при 5-летнем наблюдении [11]. Примечательно, что объем MСO ≥2,6% от массы ЛЖ улучшил долгосрочную стратификацию риска неблагоприятного исхода после ИМпST по сравнению с такими традиционными показателями МРТ, как объемы и ФВ ЛЖ [12]. Комбинация МСО и ИМК является предиктором снижения ФВ ЛЖ у больных первичным ИМпST. Кроме того, по результатам корреляционного анализа выявлена взаимосвязь между площадью ИМК по МРТ и систолической дисфункцией ЛЖ по ЭхоКГ [13].
Согласно результатам настоящего исследования, пациенты с умеренно сниженной и низкой ФВ имели сопоставимо высокие значения МСО по сравнению с группой ФВ ≥50%. При этом МСО чаще отмечалась в 3 группе больных. При сравнении ИМК получены более скромные различия. В частности, ИМК чаще выявляли у пациентов с ФВ 40-49%. По количественным характеристикам данного параметра различий не зафиксировано.
При МРТ показателем пространственной распространенности инфаркта служит индекс глобального контрастирования [6]. В группе пациентов с высоким индексом глобального контрастирования отмечено увеличение частоты МСО и более высокие значения маркеров некроза миокарда [7]. В нашей работе выраженность систолической дисфункции ассоциировалась с прогрессирующим ухудшением данного параметра. В частности, ФВ <40% характеризовалась максимально высокими значениями индекса глобального контрастирования.
К числу ключевых диагностических биомаркеров, используемых в рутинной клинической практике у пациентов с различными формами ишемической болезни сердца, относятся кардиоспецифические изоформы тропонинов и натрийуретические пептиды. Тропонин I рекомендуется определять как для диагностики повреждения миокарда при остром коронарном синдроме, так и оценки риска неблагоприятных сердечно-сосудистых событий в общей популяции [14]. В исследовании Мочулы О. В. и др. (2022) выявлена положительная корреляция между глобальным размером повреждения ЛЖ по данным МРТ и уровнем тропонина I у больных ОИМ [7]. В популяции лиц, не имевших сердечно-сосудистых заболеваний на момент включения в исследование, исходно более высокий N-концевой промозговой натрийуретический пептид оказался связан со снижением ФВ ЛЖ и риском образования рубца в миокарде по МРТ через 10 лет наблюдения [15]. Вполне закономерно нами установлено преобладание как вч тропонина I, так и BNP в группе лиц с ФВ <40%.
Заключение
В настоящей работе наличие систолической дисфункции ЛЖ у пациентов с первичным ОИМ характеризовалось закономерным ухудшением структурных и объемных показателей, снижением эффективности сокращения сердца по данным МРТ.
У лиц с умеренно сниженной и низкой ФВ отмечено преобладание большинства параметров паттерна ишемического повреждения по сравнению с больными с ФВ ≥50%. Между группами с ФВ 40-49% и <40% зарегистрированы различия только по индексу глобального контрастирования, определяющему трансмуральное поражение.
Выявлены следующие факторы риска снижения систолической функции ЛЖ у больных первичным ОИМ после реваскуляризации: размеры рубцовой ткани, ПГЗ; процент общей зоны инфаркта от массы миокарда; наличие и размеры МСО; масса и объем ИМК, индексы глобального контрастирования и локальной сократимости, атеротромбоз ПНА, уровень BNP.
Отношения и деятельность. Исследование выполнено за счет средств гранта Российского научного фонда, проект № 23-25-00381.
Список литературы
1. Поляков Д. С., Фомин И. В., Беленков Ю. Н. и др. Хроническая сердечная недостаточность в Российской Федерации: что изменилось за 20 лет наблюдения? Результаты исследования ЭПОХА-ХСН. Кардиология. 2021;61(4):4-14. doi:10.18087/cardio.2021.4.n1628.
2. Крикунов П. В., Васюк Ю. А., Крикунова О. В. Прогностическая значимость эхокардиографии после острого инфаркта миокарда. Часть 1. Российский кардиологический журнал. 2017;(12):120-8. doi:10.15829/1560-4071-201712-120-128.
3. Kwok CS, Bachmann MO, Mamas MA, et al. Effect of age on the prognostic value of left ventricular function in patients with acute coronary syndrome: A prospective registry study. Eur Heart J Acute Cardiovasc Care. 2017;6(2):191-8. doi:10.1177/2048872615623038.
4. Yildiz I, Rencüzoğulları I, Karabağ Y, et al. Predictors of left ventricular ejection function decline in young patients with ST-segment elevation myocardial infarction. Rev Assoc Med Bras (1992). 2022;68(6):802-7. doi:10.1590/1806-9282.20220033.
5. Pozo E, Sanz J. Imaging Techniques in the Evaluation of Post-infarction Function and Scar. Rev Esp Cardiol. 2014;67(9):754-64. doi:10.1016/j.rec.2014.04.009.
6. Souto ALM, Souto RM, Teixeira ICR, et al. Myocardial Viability on Cardiac Magnetic Resonance. Arq Bras Cardiol. 2017;108(5):458-69. doi:10.5935/abc.20170056.
7. Мочула О. В., Сулейманова А. С., Сухарева А. Е. и др. Взаимосвязь степени повреждения миокарда по данным магнитнорезонансной томографии сердца с контрастированием и лабораторных данных у пациентов с острым инфарктом миокарда. Российский кардиологический журнал. 2022;27(11):5226. doi:10.15829/1560-4071-2022-5226.
8. Locca D, Bucciarelli-Ducci C, Ferrante G, et al. New universal definition of myocardial infarction applicable after complex percutaneous coronary interventions? JACC Cardiovasc Interv. 2010;3(9):950-8. doi:10.1016/j.jcin.2010.06.015.
9. Robbers LFHJ, Delewi R, Nijveldt R, et al. Myocardial infarct heterogeneity assessment by late gadolinium enhancement cardiovascular magnetic resonance imaging shows predictive value for ventricular arrhythmia development after acute myocardial infarction. European Heart Journal — Cardiovascular Imaging. 2013;14(12):1150-8. doi:10.1093/ehjci/jet111.
10. Jensch PJ, Stiermaier T, Reinstadler SJ, et al. Prognostic relevance of peri-infarct zone measured by cardiovascular magnetic resonance in patients with ST-segment elevation myocardial infarction. Int J Cardiol. 2022;347:83-8. doi:10.1016/j.ijcard.2021.11.017.
11. Galea N, Dacquino GM, Ammendola RM, et al. Microvascular obstruction extent predicts major adverse cardiovascular events in patients with acute myocardial infarction and preserved ejection fraction. Eur Radiol. 2019;29(5):2369-77. doi:10.1007/s00330018-5895-z.
12. Symons R, Pontone G, Schwitter J, et al. Long-Term Incremental Prognostic Value of Cardiovascular Magnetic Resonance After ST-Segment Elevation Myocardial Infarction: A Study of the Collaborative Registry on CMR in STEMI. JACC Cardiovasc Imaging. 2018;11(6):813-25. doi:10.1016/j.jcmg.2017.05.023.
13. Алексеева Я. В., Вышлов Е. В., Мочула О. В. и др. Анализ влияния геморрагического пропитывания миокарда на структурно-функциональные показатели миокарда по данным эхокардиографии у пациентов с первичным инфарктом миокарда с подъемом сегмента ST. Российский кардиологический журнал. 2020;25(12):4032. doi:10.15829/1560-4071-2020-4032.
14. Концевая А. В., Мырзаматова А. О., Драпкина О. М. Биомаркеры в прогнозировании сердечно-сосудистого риска: новые возможности тропонина I. Кардиоваскулярная терапия и профилактика. 2020;19(3):2584. doi:10.15829/1728-88002020-2584.
15. Rahsepar AA, Bluemke DA, Habibi M, et al. Association of Pro-B-Type Natriuretic Peptide With Cardiac Magnetic Resonance-Measured Global and Regional Cardiac Function and Structure Over 10 Years: The MESA Study. J Am Heart Assoc. 2021;10(8):e019243. doi:10.1161/JAHA.120.019243.
Об авторах
В. Э. ОлейниковРоссия
Валентин Эливич Олейников — доктор медицинских наук, профессор, заведующий кафедрой "Терапия".
Пенза
Конфликт интересов:
Конфликт интересов не заявляется
Л. И. Салямова
Россия
Людмила Ивановна Салямова — кандидат медицинских наук, доцент, доцент кафедры "Терапия".
Пенза
Конфликт интересов:
Конфликт интересов не заявляется
Н. А. Донецкая
Россия
Наталия Александровна Донецкая — заведующий отделением лучевой диагностики, главный внештатный специалист по лучевой и инструментальной диагностике Пензенской области, аспирант кафедры "Терапия".
Пенза
Конфликт интересов:
Конфликт интересов не заявляется
А. В. Вдовкин
Россия
Александр Валентинович Вдовкин — врач-рентгенолог отделения лучевой диагностики.
Пенза
Конфликт интересов:
Конфликт интересов не заявляется
Дополнительные файлы
Рецензия
Для цитирования:
Олейников В.Э., Салямова Л.И., Донецкая Н.А., Вдовкин А.В. Влияние характеристик ишемического повреждения на систолическую функцию левого желудочка у пациентов с острым инфарктом миокарда. Российский кардиологический журнал. 2023;28(8):5516. https://doi.org/10.15829/1560-4071-2023-5516. EDN: HBCFIR
For citation:
Oleinikov V.E., Salyamova L.I., Donetskskaya N.A., Vdovkin A.V. Effect of ischemic injury characteristics on left ventricular systolic function in patients with acute myocardial infarction. Russian Journal of Cardiology. 2023;28(8):5516. (In Russ.) https://doi.org/10.15829/1560-4071-2023-5516. EDN: HBCFIR
JATS XML

















































