Перейти к:
Значимость маркеров воспаления у пациентов с коронарной микроваскулярной дисфункцией на фоне необструктивного поражения коронарных артерий
https://doi.org/10.15829/1560-4071-2023-5399
EDN: MWBXXA
Аннотация
Цель. Изучить взаимосвязь коронарной микроваскулярной дисфункции (КМД) с уровнями про- и противовоспалительных биомаркеров у пациентов с сохраненной фракцией выброса и необструктивным поражением коронарных артерий (КА).
Материал и методы. В исследование включено 118 пациентов (70 мужчин, средний возраст 62,0 [58,0; 69,0] лет) с сохраненной фракцией выброса левого желудочка (62 [59; 64]%) и необструктивным поражением КА. Оценку сывороточных уровней N-концевого промозгового натрийуретического пептида (NT-proBNP), высокочувствительного С-реактивного белка (вчСРБ), интерлейкина (ИЛ)-1β, -6 и -10 выполняли исходно с помощью иммуноферментного анализа. Резерв коронарного кровотока (CFR) оценивали по данным динамической однофотонной эмиссионной компьютерной томографии. CFR ≤2 являлся маркером КМД.
Результаты. Пациенты были разделены на группы в зависимости от наличия КМД: группа 1 включала больных с КМД (n=45), а группа 2 составила группу контроля и включала больных без КМД (n=73). Концентрации вчСРБ были выше в 1,8 раз (р=0,011) в группе 1 по сравнению с группой 2. Уровни ИЛ-6 значимо не различались между группами (р=0,842), тогда как концентрации ИЛ-10 были ниже на 21,7% (р=0,048), а ИЛ-1β выше в 2,7 раз (р=0,046) в группе 1 по сравнению с группой 2. По данным ROC-анализа концентрации вчСРБ ≥4,8 г/л (AUС=0,655; р=0,012) и NT-proBNP ≥950,6 пг/мл (AUC=0,792; р<0,001) идентифицированы как маркеры, связанные с наличием КМД у больных с необструктивным поражением КА, тогда как уровни ИЛ-1β, 6 и 10 не показали диагностической значимости. Многофакторный регрессионный анализ показал, что наличие диастолической дисфункции (отношение шансов 3,27; 95% доверительный интервал 2,26-5,64; р<0,001) и гиперэкспрессии NT-proBNP ≥950,6 пг/мл (отношение шансов 2,07; 95% доверительный интервал 1,56-4,12; р=0,023) являлись независимыми факторами, связанными с КМД.
Заключение. Установлено, что у пациентов с необструктивным поражением КА наличие КМД связано с более высокой экспрессией провоспалительных маркеров и снижением экспрессии противовоспалительного маркера, что может подтверждать тот факт, что хроническое воспаление является одним из звеньев патогенеза развития КМД.
Ключевые слова
Для цитирования:
Копьева К.В., Мальцева А.Н., Мочула А.В., Гракова Е.В., Сморгон А.В., Гусакова А.М., Завадовский К.В. Значимость маркеров воспаления у пациентов с коронарной микроваскулярной дисфункцией на фоне необструктивного поражения коронарных артерий. Российский кардиологический журнал. 2023;28(6):5399. https://doi.org/10.15829/1560-4071-2023-5399. EDN: MWBXXA
For citation:
Kop’eva K.V., Maltseva A.N., Mochula A.V., Grakova E.V., Smorgon A.V., Gusakova А.M., Zavadovsky K.V. Significance of inflammation markers in patients with coronary microvascular dysfunction and non-obstructive coronary artery disease. Russian Journal of Cardiology. 2023;28(6):5399. (In Russ.) https://doi.org/10.15829/1560-4071-2023-5399. EDN: MWBXXA
Сердечная недостаточность с сохраненной фракцией выброса (СНсФВ) в настоящее время составляет примерно половину всех случаев хронической сердечной недостаточности (ХСН) [1]. Установлено, что развитие СНсФВ тесно связано с наличием коморбидной патологии, такой как ожирение, сахарный диабет (СД) 2 типа, синдром обструктивного апноэ сна, фибрилляция предсердий (ФП) и др. [2-4]. При этом клинические исходы при СНсФВ остаются зачастую неблагоприятными: частота госпитализаций по поводу декомпенсации ХСН составляет 12-24% в течение 1 года, а летальность после госпитализации — 7-12% [4][5].
В настоящее время СНсФВ все чаще признают системным синдромом, а не просто заболеванием, связанным с нарушением диастолической функции левого желудочка (ЛЖ) и ремоделированием сердца. Ученые отходят от традиционно описываемой модели чрезмерной постнагрузки, приводящей к диастолической дисфункции, к предложенной новой провоспалительной гипотезе, в основе патофизиологии которой лежит коронарная микроваскулярная дисфункция (КМД) [3]. Считается, что хронические сопутствующие заболевания вызывают системное провоспалительное состояние, приводящее к сердечной и экстракардиальной дисфункции эндотелия, связанной с нарушением вазодилатационной способности и КМД, что, в свою очередь, способствует последующему развитию и прогрессированию гипертрофии, фиброза и ригидности миокарда, а также дилатации левого предсердия (ЛП) и нарушению релаксации ЛЖ [4].
В экспериментальных моделях с перегрузкой давлением в гипертрофированном миокарде на фоне фиброза всегда обнаруживаются и признаки воспаления, при этом области фиброза и воспаления обычно совпадают и чем более выражено воспаление, тем более выражен и фиброз. Воспаление всегда предшествует формированию фиброза миокарда, и если удается подавить воспаление, то это позволяет предотвратить и фиброз [6]. Показано, что циркулирующие уровни маркеров воспаления, включая высокочувствительный C-реактивный белок (вчСРБ), фактор некроза опухоли-α, интерлейкины (ИЛ)-6 и 1, выше при СНсФВ, чем при ХСН со сниженной фракцией выброса (ФВ) ЛЖ. По данным обсервационных исследований показано, что биомаркеры воспаления являются лучшими предикторами тяжести и прогноза при СНсФВ [7]. Однако роль маркеров воспаления остается мало изученной проблемой при КМД, в частности, у больных с необструктивным поражением коронарных артерий (КА).
Целью данного исследования являлось изучение взаимосвязи КМД с уровнями про- и противовоспалительных биомаркеров у пациентов с сохраненной ФВ ЛЖ и необструктивным поражением КА.
Материал и методы
Этические аспекты исследования. Набор пациентов осуществлялся на базе Научно-исследовательского института кардиологии — Федерального государственного бюджетного научного учреждения "Томский национальный исследовательский медицинский центр Российской академии наук". Исследование было проведено в соответствии с положениями Хельсинкской декларации и одобрено локальным этическим комитетом данного научно-исследовательского института (протокол № 204 от 18 ноября 2020г). Информированное письменное согласие получено от всех пациентов до начала процедур исследования.
Исследуемая популяция. В исследование включено 118 пациентов (70 мужчин, средний возраст 62,0 [ 58,0; 69,0] лет) с сохраненной ФВ ЛЖ (62 [ 59; 64]%) и необструктивным поражением КА, соответствующих критериям включения/исключения.
Критерии включения: 1) необструктивное (<50%) поражение КА по данным коронарной компьютерной томографической ангиографии; 2) документированная по данным эхокардиографии (ЭхоКГ) ФВ ЛЖ ≥50%; 3) синусовый ритм; 4) подписанное информированное согласие.
Критерии исключения: 1) перенесенный ранее инфаркт миокарда; 2) планируемая коронарная реваскуляризация и/или предшествующая реваскуляризация КА; 3) систолическое артериальное давление >160 мм рт.ст.; 4) симптоматическая гипотензия со средним систолическим артериальным давлением <90 мм рт.ст.; 5) атриовентрикулярная блокада II-III степени, синдром слабости синусового узла; 6) персистирующая или хроническая форма ФП и/или трепетания предсердий; 7) недостаточность или стеноз клапанов сердца ≥2 степени; 8) гипертрофическая и дилатационная кардиомиопатии; 9) перенесенная ранее тромбоэмболия легочной артерии с высокой легочной гипертензией (систолическое давление в правом желудочке ≥45 мм рт.ст.); 10) тяжелая форма бронхиальной астмы и/или хроническая обструктивная болезнь легких (ХОБЛ); 11) патология щитовидной железы; 12) скорость клубочковой фильтрации (CKD-EPI) <50 мл/мин/м2; 13) печеночная недостаточность класса С по Чайлд-Пью; 14) острые и хронические воспалительные заболевания сердца; 15) уровень гемоглобина <100 г/дл; 16) инсульт или транзиторная ишемическая атака в течение 90 дней до включения в исследование; 17) индекс массы тела >35 кг/м2; 18) желудочковая экстрасистолия III-V градации (по Lown).
ЭхоКГ. Для выполнения двухмерной (2D, B-real time) трансторакальной ЭхоКГ использовали ультразвуковой сканер с улучшенной визуализацией Philips Affiniti 70. Все исследования были выполнены одним специалистом. Выявление диастолической дисфункции ЛЖ основывалось на оценке шести показателей: пик Е, отношение E/A, lateral e’, среднее отношение E/e’, индексированный объем ЛП и пиковая скорость трикуспидальной регургитации. Диастолическая дисфункция ЛЖ диагностировалась при наличии ≥3 анормальных значений показателей [8].
Динамическая однофотонная эмиссионная компьютерная томография. За 24 ч до исследования пациентам отменяли прием бета-адреноблокаторов, нитратов, антагонистов кальциевых каналов, кофеина и производных метилксантина. Исследования выполняли в утренние часы, натощак, на фоне синусового ритма, по двухдневному протоколу "покой-нагрузка" с использованием радиофармпрепарата 99mTc-метокси-изобутил-изотнитрил, который вводили внутривенно болюсно в дозировке 260-444 МБк. Для выполнения исследования в состоянии нагрузки использовали стресс-агент аденозинтрифосфат, который вводили внутривенно при помощи инфузомата в дозировке 160 мкг/кг/мин в течение 4 мин.
Для коррекции аттенюации выполняли низкодозовую компьютерную томографию органов грудной клетки. Все исследования были выполнены на гибридном компьютерном томографе Discovery NM/CT 570с (GE Healthcare, США), оснащенном гамма-камерой с высокочувствительными полупроводниковыми CZT-детекторами. Общая эффективная лучевая нагрузка исследования составила ~6,25 мЗв.
Полученные сцинтиграфические изображения обрабатывали на специализированной рабочей станции Xeleris II (GE Healthcare, Израиль). Определяли стандартные полуколичественные индексы нарушения миокардиальной перфузии: Summed Stress Score — сумма баллов при нагрузке, Summed Rest Score — сумма баллов в покое, Summed Difference Score — разница между нагрузкой и покоем, а также количественные показатели: Stress Myocardial Blood Flow (stress-MBF) — миокардиальный кровоток при нагрузке, Rest Myocardial Blood Flow (rest-MBF) — миокардиальный кровоток в покое, coronary flow reserve (CFR) — резерв коронарного кровотока. При отсутствии окклюзирующего поражения субэпикардиальных КА CFR ≤2 являлся маркером КМД.
Коронарная компьютерная томографическая ангиография. Подготовка к исследованию проводилась по стандартному протоколу, перед каждым сканированием оценивали частоту сердечных сокращений и артериальное давление. Все пациенты получали 0,5 мг нитроглицерина сублингвально. Для контрастного усиления использовали 70-90 мл неионогенного контрастного вещества (йопамидол 370 мг, Bracco Diagnostics, Италия), который вводили внутривенно через кубитальный катетер. Согласно модифицированной классификации Ассоциации кардиологов КА подразделялись на 16 сегментов [9].
Биохимический анализ. Забор крови осуществлялся путем венепункции, а образцы сыворотки, полученные после центрифугирования, хранились при температуре -24 C с одним циклом замораживания-оттаивания. Уровни N-концевого промозгового натрийуретического пептида (NT-proBNP), ИЛ-1β, 6 и 10, вчСРБ в сыворотке крови определяли с помощью иммуноферментного анализа (ИЛ 1β, 6 и 10 — Вектор-бест, Россия; NT-proBNP и вчСРБ — Biomedica, Австрия).
Статистический анализ. Статистическая обработка результатов исследования проводилась с помощью программ STATISTICA 10.0 и MedCalc 11.5.0.0. Для проверки статистических гипотез при сравнении двух независимых групп использовали критерий Манна-Уитни. При анализе качественных признаков проводили анализ таблиц сопряженности с использованием критерия χ2 Пирсона. Данные представляли в виде медианы (Me) и межквартильного интервала (Q — 25-й и 75-й процентили). Для выявления уровней биомаркеров для диагностики СНсФВ использовали ROC-анализ с построением характеристических кривых и расчетом AUC (площади под кривой). Однофакторный и многофакторный регрессионные анализы с расчетом отношения шансов (ОШ) с 95% доверительным интервалом (ДИ) использовали для оценки влияния параметров на риск развития КМД. В многофакторный регрессионный анализ были включены исходные параметры, которые являлись клинически значимыми или имели унивариантную взаимосвязь с КМД и не обладали высокой степенью коллинеарности (r≥0,7): пол, возраст, индекс массы тела, наличие СД, ХОБЛ, ФП, ХСН, значения скорости клубочковой фильтрации, NT-proBNP, С-реактивного белка, ИЛ, фибриногена, гликированного гемоглобина, калия, параметров липидного спектра, ФВ ЛЖ, конечные систолический и диастолический объемы, индексированный объем ЛП, пиковая скорость трикуспидальной регургитации, отношение E/e’. Критический уровень значимости p-value для всех используемых процедур анализа принимали равным 0,05.
Результаты
Пациенты были разделены на группы в зависимости от наличия КМД: группа 1 включала больных с КМД (CFR ≤2; n=45), а группа 2 составила группу контроля и включала больных без КМД (CFR >2; n=73). Исходно СНсФВ I-III функциональных классов (по NYHA) была диагностирована у 58 пациентов (49,2%) в соответствии с рекомендациями ESC 2021г по диагностике и лечению острой и ХСН [10]. У пациентов с КМД чаще диагностировалась ХСН (p<0,001), в анамнезе они имели СД 2 типа (р=0,007) и являлись курильщиками (р=0,009) чаще, чем пациенты без КМД. Остальные исходные клинико-демографические характеристики пациентов не различались между группами. Поскольку диагноз ХСН был установлен впервые, то на момент включения в исследование пациенты не получали оптимальной медикаментозной терапии: частота назначения β-блокаторов составляла 15,3%, ингибиторов ангиотензинпревращающего фермента/антагонистов ре- цепторов к ангиотензину II — 11,9%, статинов — 19,5%, диуретиков — 14,4% и антиаритмических препаратов — 5,6%. По частоте распределения назначаемых препаратов группы значимо не различались (табл. 1). В дальнейшем проводилась коррекция лечения и назначалась оптимальная медикаментозная терапия согласно клиническим рекомендациям.
Несмотря на то, что значения вчСРБ и ИЛ не превышали референсных интервалов, были выявлены различия в их уровнях в зависимости от значений CFR. Так, концентрации вчСРБ были выше в 1,8 раз (р=0,011) в группе 1 по сравнению с группой 2 (4,1 [ 3,0; 11,4] vs 2,3 [ 1,1; 8,7] г/л, соответственно). Уровни ИЛ-6 значимо не различались между группами (р=0,842), тогда как концентрации ИЛ-10 были ниже на 21,7% (р=0,048) у пациентов с КМД по сравнению с пациентами без нее (2,87 [ 2,58; 3,57] vs 3,67 [ 3,32; 4,04] пг/мл, соответственно), а ИЛ-1β выше в 2,7 раз (р=0,046) в группе 1 по сравнению с группой 2 (1,2 [ 0,74; 1,48] vs 3,19 [ 1,64; 5,47] пг/мл, соответственно) (табл. 1, рис. 1).
У пациентов с КМД частота и выраженность диастолической дисфункции была выше, чем у пациентов без нее. Значения lateral е’ были ниже в группе 1 (р=0,008) на 35%, чем в группе 2. Пиковая скорость трикуспидальной регургитации была больше на 12% (р=0,011), отношение Е/е’ на 21,4% (р=0,041) и индексированный объем ЛП на 51,2% (р=0,038) в группе 1, чем группа 2. Другие эхокардиографические параметры значимо не различались между группами (табл. 2).
Были проанализированы параметры CFR и MBF в зависимости от наличия КМД (табл. 3). У больных с КМД значения CFR были ниже на 48,3% (р<0,001), чем у больных без нее. В группе 1 rest-MBF был выше на 30,1% (р<0,001), а stress-MBF был ниже на 30,1% (p<0,001) по сравнению с группой 2. Стандартные полуколичественные индексы нарушения миокардиальной перфузии не отличались между группами.
По данным ROC-анализа концентрации вчСРБ ≥4,8 г/л (чувствительность 56,5%, специфичность 77,5%; AUС=0,655; р=0,012) и NT-proBNP ≥950,6 пг/мл (чувствительность 69%, специфичность 78%; AUC=0,792; р<0,001) были идентифицированы как маркеры, связанные с наличием КМД у больных с необструктивным поражением КА, тогда как уровни ИЛ-1β, 6 и 10 не показали диагностической значимости (рис. 2).
Уровни ИЛ-10 коррелировали со значениями CFR (r=0,511, p=0,005), rest-MBF (r=-0,432, p=0,045) и stress-MBF (r=0,317; p=0,012), тогда как уровни ИЛ-1β значимо коррелировали со значениями CFR (r=-0,371; p=0,046) и E/e’ (r=0,278; p=0,019), а концентрации вчСРБ — со значениями CFR (r=-0,412; p=0,019).
По данным однофакторного регрессионного анализа установлено, что наличие СД 2 типа (ОШ 1,43; 95% ДИ: 1,17-3,57; р=0,012), диастолической дисфункции (ОШ 3,18; 95% ДИ: 1,16-4,12; р<0,001), курения (ОШ 2,01; 95% ДИ: 0,99-2,43; p=0,043), гиперэкспрессии NT-proBNP ≥950,6 пг/мл (ОШ 1,98; 95% ДИ: 1,78-6,23; p=0,003) и вчСРБ ≥4,8 г/л (ОШ 1,87; 95% ДИ: 0,98-2,12; р=0,018) были связаны с КМД. Тогда как многофакторный регрессионный анализ показал, что наличие диастолической дисфункции (ОШ 3,27; 95% ДИ: 2,26-5,64; р<0,001) и гиперэкспрессии NT-proBNP ≥950,6 пг/мл (ОШ 2,07; 95% ДИ: 1,56-4,12; р=0,023) являлись независимыми факторами, связанными с КМД.
Таблица 1
Клинико-демографическая характеристика пациентов в зависимости от наличия КМД
|
Параметр |
Группа 1 (КМД+), n=45 |
Группа 2 (КМД-), n=73 |
p-value |
|
Возраст, годы |
61 (56; 68,5) |
61,5 (59; 67,5) |
0,123 |
|
Мужчины, n (%) |
26 (57,8) |
44 (60,3) |
0,901 |
|
ИМТ, кг/м2 |
29,9 (27,8; 31,9) |
30,2 (27,9; 32,1) |
0,276 |
|
АГ, n (٪) |
37 (82,2) |
46 (63,0) |
0,069 |
|
Сахарный диабет 2 типа, n (٪) |
11 (24,4) |
6 (8,2) |
0,007 |
|
COVID-19 в анамнезе, n (%) |
7 (15,6) |
12 (16,4) |
0,318 |
|
ХОБЛ, n (٪) |
7 (15,6) |
13 (17,8) |
0,723 |
|
Пароксизмальная форма ФП, n (%) |
7 (15,6) |
11 (15,1) |
0,769 |
|
ХСНсФВ, n (٪) |
34 (75,6) |
24 (32,9) |
<0,001 |
|
Курение, n (٪) |
11 (24,4) |
5 (6,8) |
0,009 |
|
СКФ (мл/мин/1,73 м2) |
77,2 (63,2; 81,2) |
77,0 (64,0; 85,0) |
0,543 |
|
Общий холестерин, ммоль/л |
4,635 (3,67; 5,25) |
4,33 (3,54; 4,98) |
0,898 |
|
ХС-ЛНП, ммоль/л |
3,12 (2,15; 3,51) |
2,87 (2,25; 3,87) |
0,456 |
|
ХС-ЛВП, ммоль/л |
1,05 (0,83; 1,32) |
1,05 (0,96; 1,26) |
0,887 |
|
Триглицериды, ммоль/л |
1,67 (1,23; 1,89) |
1,59 (1,22; 1,86) |
0,835 |
|
Гемоглобин, г/дл |
134 (121; 143) |
137 (128; 142) |
0,464 |
|
Калий, ммоль/л |
4,64 (4,12; 5,01) |
4,81 (4,43; 5,21) |
0,517 |
|
Фибриноген, г/л |
3,27 (3,14; 3,14) |
3,10 (2,86; 3,43) |
0,767 |
|
HbA1c, % |
5,9 (5,1; 6,9) |
5,8 (5,1; 6,4) |
0,098 |
|
NT-proBNP, пг/мл |
404,2 (249,5; 1533,4) |
156,3 (135,26; 274,7) |
0,004 |
|
Интерлейкин-10, пг/мл (<10 пг/мл) |
2,87 (2,58; 3,57) |
3,67 (3,32; 4,04) |
0,048 |
|
Интерлейкин-1β, пг/мл (<11 пг/мл) |
3,19 (1,64; 5,47) |
1,2 (0,74; 1,48) |
0,046 |
|
Интерлейкин-6, пг/мл (<31 пг/мл) |
2,65 (1,98; 3,98) |
2,48 (1,87; 3,76) |
0,842 |
|
вчСРБ, г/л (1-12 г/л) |
4,1 (3,0; 11,4) |
2,3 (1,1; 8,7) |
0,011 |
|
Медикаментозная терапия, абс. (%) — β-блокаторы — иАПФ/БРА — диуретики — статины — амиодарон — АМКР |
8 (17,8) 5 (11,1) 3 (6,7) 8 (17,8) 2 (4,4) 2 (4,4) |
10 (13,7) 9 (12,0) 8 (10,9) 15 (20,5) 5 (6,8) 4 (5,5) |
0,876 0,879 0,546 0,547 0,358 0,269 |
Сокращения: АГ — артериальная гипертензия, АМКР — антагонисты минералокортикоидных рецепторов, БРА — блокаторы рецепторов ангиотензина II, вчСРБ — высокочувствительный С-реактивный белок, ГБ — гипертоническая болезнь, ИМТ — индекс массы тела, иАПФ — ингибиторы ангиотензинпревращающего фермента, КМД — коронарная микроваскулярная дисфункция, СКФ — скорость клумбочкой фильтрации, ХС-ЛВП — холестерин липопротеидов высокой плотности, ХС-ЛНП — холестерин липопротеидов низкой плотности, ХСН — хроническая сердечная недостаточность, ХСНсФВ — хроническая сердечная недостаточность с сохраненной фракцией выброса, ХОБЛ — хроническая обструктивная болезнь легких, ФП — фибрилляция предсердий, COVID-19 — новая коронавирусная инфекция, HbA1c — гликированный гемоглобин, NT-proBNP — N-концевой промозговой натрийуретический пептид.
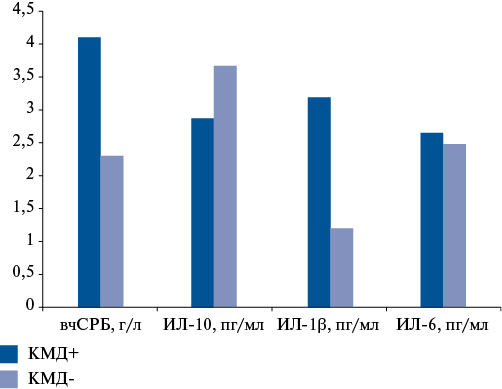
Рис. 1. Уровни провоспалительных и противовоспалительных биомаркеров в зависимости от наличия КМД.
Сокращения: вчСРБ — высокочувствительный С-реактивный белок, ИЛ — интерлейкин, КМД — коронарная микроваскулярная дисфункция.
Таблица 2
Эхокардиографические параметры в зависимости от наличия КМД
|
Параметр |
Группа 1 (КМД+), n=45 |
Группа 2 (КМД-), n=73 |
p-value |
|
Фракция выброса левого желудочка, % |
62 (58,5; 65,0) |
63 (61; 66) |
0,183 |
|
Конечно-систолический размер, мм |
40 (38; 43) |
38,5 (36,5; 41,5) |
0,524 |
|
Конечно-диастолический размер, мм |
51,0 (48,7; 53,0) |
50,5 (47,5; 52,5) |
0,307 |
|
ИММЛЖ, г/м2 |
98,0 (88,5; 114,5) |
92 (85,5; 106,5) |
0,276 |
|
Отношение Е/А |
1,04 (0,79; 1,3) |
0,97 (0,74; 1,2) |
0,516 |
|
Lateral e’, см/с |
5,56 (4,78; 6,45) |
8,56 (8,01; 9,14) |
0,009 |
|
ПСТР, м/с |
2,99 (2,95; 3,01) |
2,63 (2,3; 2,76) |
0,011 |
|
Отношение E/e’ |
14 (13,5; 15,0) |
11 (10; 12) |
0,041 |
|
ЛПОИ, мл/м2 |
38,3 (35,7; 51,1) |
29,7 (27,5; 47,9) |
0,038 |
|
Диастолическая дисфункция, n (%) |
37 (88,1) |
26 (37,1) |
<0,001 |
Сокращения: ИММЛЖ — индекс массы миокарда левого желудочка, КМД — коронарная микроваскулярная дисфункция, ЛПОИ — индексированный объем левого предсердия, ПСТР — пиковая скорость трикуспидальной регургитации, E/A — отношение максимальной скорости потока крови в фазу быстрого наполнения к максимальной скорости потока в систолу предсердий, E/e’ — отношение трансмитрального Е пика к тканевому миокардиальному допплеровскому е’, Lateral e’ — ранняя диастолическая скорость движения боковой стенки левого желудочка.
Таблица 3
Параметры резерва коронарного кровотока и миокардиального кровотока в зависимости от наличия КМД
|
Параметр |
Группа 1 (КМД+), n=45 |
Группа 2 (КМД-), n=73 |
p-value |
|
Показатели динамической ОФЭКТ |
|||
|
Stress-MBF, мл/мин/г |
1,14 (0,67; 1,49) |
1,63 (1,19; 1,83) |
<0,001 |
|
Rest-MBF, мл/мин/г |
0,75 (0,54; 0,99) |
0,52 (0,40; 0,69) |
<0,001 |
|
CFR |
1,39 (1,11; 1,96) |
2,69 (2,15; 3,78) |
<0,001 |
|
Стандартные полуколичественные индексы нарушения миокардиальной перфузии |
|||
|
SSS |
3 (0,5; 4) |
2,5 (0; 5) |
0,753 |
|
SRS |
2 (0; 3) |
1 (0; 2) |
0,537 |
|
SDS |
2 (0; 3) |
2 (0; 4) |
0,975 |
Сокращения: КМД — коронарная микроваскулярная дисфункция, CFR — резерв коронарного кровотока, MBF — миокардиальный кровоток, SDS — разница между нагрузкой и покоем, SSS — сумма баллов при нагрузке, SRS — сумма баллов в покое.
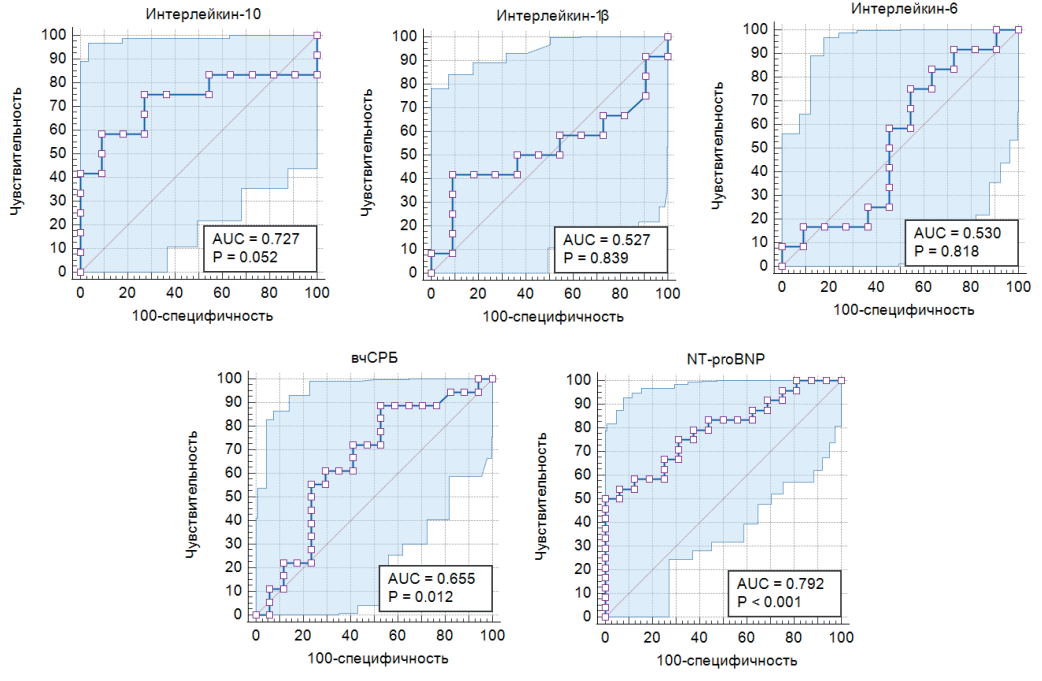
Рис. 2. Чувствительность и специфичность уровней биомаркеров в диагностике СНсФВ у больных с необструктивным поражением КА.
Сокращения: вчСРБ — высокочувствительный С-реактивный белок, NT-proBNP — N-концевой промозговой натрийуретический пептид.
Обсуждение
Подобно СНсФВ, КМД сама по себе является гетерогенным заболеванием со сложными лежащими в ее основе патофизиологическими механизмами, которые остаются не до конца изученными [10]. При этом наличие КМД может способствовать развитию и прогрессированию СНсФВ, в т.ч. у бессимптомных пациентов (например, у больных с СД 2 типа, артериальной гипертензией и т.д.) [11]. В крупном перекрестном исследовании, включавшем пациентов с СД 2 типа и факторами риска ХСН (n=336), распространенность КМД (CFR <2,5 по данным допплер-ЭхоКГ) составляла 59% [12]. Еще 76 пациентам было проведено дополнительное фенотипирование с рядом маркеров эндотелиальной дисфункции, воспаления и диастолической дисфункции. 17 воспалительных биомаркеров отрицательно коррелировали с CFR, а 15 — положительно с E/e’. И CFR, и E/e’ коррелировали только в подгруппе пациентов с КМД и признаками повышенного давления наполнения (E/e’ >10; p=0,012), что указывает на возможную связь между воспалением и КМД при СНсФВ, ассоциированной с СД 2 типа [12]. При этом средние значения ИЛ-1β составляли 7,53 пг/мл, а ИЛ-6 — 13,49 пг/мл, что было выше медианы уровней данных биомаркеров, полученных в нашем исследовании. Вероятнее всего, это связано с наличием СД 2 типа у всех включенных пациентов, в отличие от данного наблюдения, где доля больных с СД 2 типа составляла 14,4%. Однако, несмотря на то, что значения биомаркеров не превышали референсных интервалов, выявлены различия в концентрациях вчСРБ, ИЛ-10 и 1β в зависимости от наличия КМД. Так, концентрации вчСРБ были выше в 1,8 раз (р=0,011), ИЛ-10 ниже на 21,7% (р=0,048), а ИЛ-1β выше в 2,7 раз (р=0,046) у пациентов с КМД по сравнению с пациентами без нее, а уровни ИЛ-1β и 10, и вчСРБ коррелировали с резервом коронарного кровотока (p<0,05). Эти данные, вероятно, свидетельствуют о наличии хронического неактивного воспалительного процесса как одного из патогенетических паттернов КМД.
В другом ретроспективном исследовании, включавшем 201 пациента с необструктивным поражением КА без ХСН, но с такими факторами риска, как СД 2 типа, ожирение и гипертония, развитие СНсФВ было зарегистрировано у 36 пациентов в течение 4 лет наблюдения, при этом КМД, выявленная по данным позитронной эмиссионной томографии (CFR <2), диагностировалась у 54% пациентов [13]. Данные результаты о нарушении резерва коронарного кровотока при сопутствующих состояниях, тесно связанных с СНсФВ еще до ее развития, согласуются с КМД, лежащей в основе различных фенотипов СНсФВ. В нашем исследовании также подтверждается вклад коморбидной патологии в патогенез КМД, так пациенты с КМД в анамнезе чаще имели СД 2 типа (р=0,007) и являлись курильщиками (р=0,009), чем пациенты без КМД. При этом частота встречаемости СНсФВ среди больных с КМД была значимо выше (p<0,001), чем у больных без нее.
С одной стороны, развитие СНсФВ на фоне КМД возникает в результате сочетания микрососудистых структурных изменений, эндотелиальной дисфункции и/или дисфункции гладкой мускулатуры сосудов [14]. Установлено, что оксид азота играет ключевую роль для поддержания функции эндотелия и гладкой мускулатуры, тогда как нарушение функции эндотелия приводит к повышенному микрососудистому кровотоку в покое и реактивности NO-синтазы, и, как следствие, к почти максимальному вазодилататорному состоянию в покое и ослаблению реакций на стресс [15]. С другой стороны, хроническое системное воспаление запускает процессы фиброзирования, на фоне которых кровоток в покое может повышаться из-за диффузного фиброза миокарда и компенсаторного эндотелий-зависимого увеличения периферического сосудистого сопротивления, а реакция на стресс снижаться за счет периваскулярного фиброза [10]. Данные нашего исследования не расходятся с ранее полученными результатами. Так, у пациентов с КМД значения CFR были ниже на 48,3% (р<0,001), rest-MBF был выше на 30,1% (р<0,001), а stress-MBF был ниже на 30,1% (p<0,001), чем у больных без КМД.
Системное воспалительное состояние, вызванное такими сопутствующими заболеваниями, как СД 2, ожирение и ХОБЛ, может привести к увеличению продукции эндотелиальных активных форм кислорода. Реакция между кофакторами активных форм кислорода и eNOS снижает продукцию и биодоступность оксида азота. В результате снижение доступности оксида азота снижает уровень протеинкиназы G, которая необходима для фосфорилирования титина, цитоскелетного белка, ответственного за диастолическую функцию и растяжимость миокарда [14]. Следовательно, нарушение фосфорилирования титина из-за нарушения регуляции по оси "оксид азота — протеинкиназа G" может способствовать снижению диастолического резерва. Показано, что пациенты с СНсФВ имели большее микрососудистое разрежение и более выраженный фиброз миокарда, а также более низкую плотность микрососудов по сравнению с контрольной группой сопоставимого возраста, при этом авторы предположили, что именно микроваскулярное эндотелиальное воспаление может являться триггером развития КМД и фиброза миокарда. В нашем исследовании, несмотря на полученные различия в уровнях ИЛ-1β и 10, вчСРБ и NT-proBNP, только уровни двух последних обладали диагностической значимостью в отношении выявления КМД у больных с необструктивным поражением КА. В то же время, многофакторный регрессионный анализ показал, что только наличие диастолической дисфункции (ОШ 3,27; 95% ДИ: 2,26-5,64; р<0,001) и гиперэкспрессии NT-proBNP ≥950,6 пг/мл (ОШ 2,07; 95% ДИ: 1,56-4,12; р=0,023) являлись независимыми факторами, ассоциированными с КМД. Вероятно, это связано с тем, что почти у половины пациентов (49,2%) на момент включения в исследование сформировалась ХСН, а значит, процессы периваскулярного фиброза и ремоделирования экстрацеллюлярного матрикса вышли на первый план, поэтому хроническая воспалительная реакция уже не являлась настолько выраженной. К сожалению, мы не оценивали стаж СД 2 типа, гипертонической болезни и других сопутствующих патологий, которые могли повлиять на уровни воспалительных и провоспалительных маркеров, а в проанализированной литературе нами не была обнаружена данная информация. Однако наличие открытых в данной области вопросов подчёркивает ее актуальность и необходимость проведения дальнейших исследований с включением большего количества больных и анализом дополнительных факторов в отношении развития КМД. Изучение патогенетических механизмов формирования СНсФВ позволит открыть двери для новых методов профилактики и терапии, а значит снизить затраты на лечение данного социально значимого заболевания.
Ограничения исследования. Основными ограничениями исследования являлись: 1) относительно небольшая и неоднородная выборка больных; 2) отсутствие данных в отношении стажа СД 2 типа, гипертонической болезни и других сопутствующих патологий, которые также могли повлиять на уровни воспалительных и провоспалительных маркеров.
Заключение
Таким образом, установлено, что у пациентов с необструктивным поражением КА наличие КМД связано с более высокой экспрессией ИЛ-1β (р=0,046) и вчСРБ (р=0,011), а также снижением экспрессии ИЛ-10 (р=0,048), что может подтверждать тот факт, что хроническое воспаление является одним из звеньев патогенеза развития КМД. По данным ROC-анализа концентрации вчСРБ ≥4,8 г/л (AUС=0,655; р=0,012) и NT-proBNP ≥950,6 пг/мл (AUC=0,792; р<0,001) были идентифицированы как маркеры, связанные с наличием КМД у больных с необструктивным поражением КА, тогда как уровни ИЛ не показали диагностической значимости.
Отношения и деятельность. Грант Президента Российской Федерации № MK-4257.2022.3.
Список литературы
1. Roger VL. Epidemiology of Heart Failure. A Contemporary Perspective. Circulation Research. 2021;128:1421-34. doi:10.1161/CIRCRESAHA.121.318172.
2. Borlaug BA. Evaluation and management of heart failure with preserved ejection fraction. Nat Rev Cardiol. 2020;17:559-73. doi:10.1038/s41569-020-0363-2.
3. Paulus WJ, Tschope C. A novel paradigm for heart failure with preserved ejection fraction: comorbidities drive myocardial dysfunction and remodeling through coronary microvascular endothelial inflammation. J Am Coll Cardiol. 2013;62:263-71. doi:10.1016/j.jacc.2013.02.092.
4. Bilak JM, Alam U, Miller CA, et al. Microvascular Dysfunction in Heart Failure with Preserved Ejection Fraction: Pathophysiology, Assessment, Prevalence and Prognosis. Card Fail Rev. 2022;8:e24. doi:10.15420/cfr.2022.12.
5. Cheng RK, Cox M, Neely ML, et al. Outcomes in patients with heart failure with preserved, borderline, and reduced ejection fraction in the Medicare population. Am Heart J. 2014;168:721-30. doi:10.1016/j.ahj.2014.07.008.
6. Овчинников А. Г., Арефьева Т. И., Потехина А. В. и др. Молекулярные и клеточные механизмы, ассоциированные с микрососудистым воспалением в патогенезе сердечной недостаточности с сохраненной фракцией выброса. Acta Naturae. 2020;12(2):40-51. doi:10.32607/actanaturae.10990.
7. Mochula AV, Kopeva KV, Maltseva AN, et al. The myocardial flow reserve in patients with heart failure with preserved ejection fraction. Heart Vessels. 2023;38(3):348-60. doi:10.1007/s00380-022-02161-5.
8. Nagueh SF, Smiseth OA, Appleton CP. Recommendations for the evaluation of left ventricular diastolic function by echocardiography: an update from the American Society of Echocardiography and the European Association of Cardiovascular Imaging. Eur Heart J Cardiovasc Imaging. 2016;17:1321-60. doi:10.1016/j.echo.2016.01.011.
9. Austen WG, Edwards JE, Frye RL, et al. A reporting system on patients evaluated for coronary artery disease. Report of the Ad Hoc Committee for Grading of Coronary Artery Disease, Council on Cardiovascular Surgery, American Heart Association. Circulation. 1975;51:5-40. doi:10.1161/01.cir.51.4.5.
10. Sinha A, Rahman H, Webb A, et al. Untangling the pathophysiologic link between coronary microvascular dysfunction and heart failure with preserved ejection fraction. Eur Heart J. 2021;42(43):4431-41. doi:10.1093/eurheartj/ehab653.
11. Gulsin GS, Swarbrick DJ, Athithan L, et al. Effects of low-energy diet or exercise on cardiovascular function in working-age adults with type 2 diabetes: a prospective, randomized, open-label, blinded end point trial. Diabetes Care. 2020;43(6):1300-10. doi:10.2337/dc20-0129.
12. Suhrs HE, Schroder J, Bove KB, et al. Inflammation, non-endothelial dependent coronary microvascular function and diastolic function — are they linked? PLoS One. 2020;15:e0236035. doi:10.1371/journal.pone.0236035.
13. Taqueti VR, Solomon SD, Shah AM, et al. Coronary microvascular dysfunction and future risk of heart failure with preserved ejection fraction. Eur Heart J. 2018;39:840-9. doi:10.1093/eurheartj/ehx721.
14. Franssen C, Chen S, Unger A, et al. Myocardial microvascular inflammatory endothelial activation in heart failure with preserved ejection fraction. JACC Heart Fail. 2016;4:312-24. doi:10.1016/j.jchf.2015.10.007.
15. Rahman H, Demir OM, Khan F, et al. Physiological stratification of patients With angina due to coronary microvascular dysfunction. J Am Coll Cardiol. 2020;75(20):2538-49. doi:10.1016/j.jacc.2020.03.051.
Об авторах
К. В. КопьеваРоссия
Кристина В. Копьева — кандидат медицинских наук, научный сотрудник отделения патологии миокарда.
Томск
Конфликт интересов:
нет
А. Н. Мальцева
Россия
Алина Николаевна Мальцева — аспирант лаборатории радионуклидных методов исследования.
Томск
Конфликт интересов:
нет
А. В. Мочула
Россия
Андрей Викторович Мочула — кандидат медицинских наук, старший научный сотрудник лаборатории радионуклидных методов исследования.
Томск
Конфликт интересов:
нет
Е. В. Гракова
Россия
Елена Викторовна Гракова — доктор медицинских наук, ведущий научный сотрудник отделения патологии миокарда.
Томск
Конфликт интересов:
нет
А. В. Сморгон
Россия
Андрей Владимировч Сморгон — младший научный сотрудник отделения ультразвуковой диагностики.
Томск
Конфликт интересов:
нет
А. М. Гусакова
Россия
Анна Михайловна Гусакова — кандидат фарм. наук, научный сотрудник отделения клинической лабораторной диагностики.
Томск
Конфликт интересов:
нет
К. В. Завадовский
Россия
Константин Валерьевич Завадовский — доктор медицинских наук, заведующий отделом лучевой диагностики.
Томск
Конфликт интересов:
нет
Дополнительные файлы
Рецензия
Для цитирования:
Копьева К.В., Мальцева А.Н., Мочула А.В., Гракова Е.В., Сморгон А.В., Гусакова А.М., Завадовский К.В. Значимость маркеров воспаления у пациентов с коронарной микроваскулярной дисфункцией на фоне необструктивного поражения коронарных артерий. Российский кардиологический журнал. 2023;28(6):5399. https://doi.org/10.15829/1560-4071-2023-5399. EDN: MWBXXA
For citation:
Kop’eva K.V., Maltseva A.N., Mochula A.V., Grakova E.V., Smorgon A.V., Gusakova А.M., Zavadovsky K.V. Significance of inflammation markers in patients with coronary microvascular dysfunction and non-obstructive coronary artery disease. Russian Journal of Cardiology. 2023;28(6):5399. (In Russ.) https://doi.org/10.15829/1560-4071-2023-5399. EDN: MWBXXA
JATS XML

















































