Перейти к:
Влияние комбинированной гиполипидемической терапии на уязвимость атеросклеротической бляшки у пациентов с острым коронарным синдромом (Combi-LLT ACS): протокол рандомизированного исследования
https://doi.org/10.15829/1560-4071-2022-5282
Аннотация
Цель. Изучить влияние высокодозной комбинированной гиполипидемической терапии (статины + эзетимиб vs статины + ингибиторы пропротеинконвертазы субтилизин/кексин типа 9 (иPCSK9)) на характеристики уязвимости атеросклеротических бляшек, оцененных с помощью мультимодальной визуализации (мультиспиральной компьютерной томографии (МСКТ) коронарных артерий и оптической когерентной томографии, а также биомаркеров у пациентов, перенесших острый коронарный синдром (ОКС)).
Материал и методы. В открытое проспективное рандомизированное одноцентровое исследование планируется включить 120 пациентов, поступивших в экстренном порядке с клиникой ОКС. Всем пациентам будет выполнено чрескожное коронарное вмешательство инфаркт-связанной артерии, а также проведена интракоронарная визуализация с помощью оптической когерентной томографии одной-двух не-инфаркт-связанных артерий. В период госпитализации пациенты будут получать стандартную терапию ОКС согласно клиническим рекомендациям, при этом статины исходно будут назначены в максимальной дозировке аторвастатин 80 мг/розувастатин 40 мг в сут. Пациенты, показавшие высокую комплаентность и не достигшие целевых значений холестерина липопротеидов низкой плотности (ХС-ЛНП) (≤1,4 ммоль/л) спустя 1 мес. после развития инфаркта миокарда/нестабильной стенокардии, на втором визите будут рандомизированы на две группы. Группа 1 — прием иPCSK9 (алирокумаб в дозе 150 мг путем подкожной инъекции 1 раз в 2 нед. или эволокумаб 140 мг путем подкожной инъекции 1 раз в 2 нед.) в дополнение к статинотерапии в максимальной дозировке (аторвастатин 80 мг/ розувастатин 40 мг). Группа 2 — прием эзетимиба в дозе 10 мг в комбинации с максимальной дозой статинов. Кроме этого, на втором визите пациентам будет проведена МСКТ коронарных артерий, оценка индекса CAVI и лабораторное исследование (общий анализ крови (нейтрофильно-лимфоцитарное отношение (NLR)), липидный профиль, аланинаминотрансфераза (АЛТ), аспартатаминотрансфераза (АСТ), Tропонин I, Galectin-3, высокочувствительный С-реактивный белок (всч-СРБ), металлопротеиназа-9 (MMP-9), тканевый ингибитор металопротеиназы 1 типа (TIMP-1), липокалин, ассоциированный с нейтрофильной желатиназой (NGAL)). Общая длительность наблюдения составит 52 нед., согласно графику визитов. На финальном визите пациентам будет проводиться МСКТ коронарных артерий, оценка индекса CAVI и лабораторного статуса (NLR, липидный профиль, АЛТ, АСТ, Tропонин I, Galectin-3, всч-СРБ, MMP-9, TIMP-1, NGAL).
Первичная конечная точка: уменьшение проявлений уязвимости атеросклеротической бляшки по данным МСКТ в не-инфаркт-связанных коронарных артериях.
Вторичные конечные точки: смерть, тромбоз/рестеноз стента, нефатальный инфаркт миокарда, повторные госпитализации с клиникой прогрессирующей стенокардии, повторная реваскуляризация; динамика липидного спектра (общий холестерин, ХС-ЛНП, холестерин липопротеидов высокой плотности, триглицериды) на фоне максимальной комбинированной терапии статин + иPCSK9 или статин + эзетимиб; динамика биомаркеров миокардиального повреждения (Tропонин I), воспаления (NLR, вcч-СРБ, NGAL, Galectin-3) и матриксного ремоделирования (MMР-9, TIMP-1).
Заключение. Наше исследование позволит впервые сравнить и оценить влияние иPCSK9 и эзетимиба в комбинации с высокими дозами статинов на уменьшение проявлений уязвимости атеросклеротической бляшки по данным МСКТ в не-инфаркт-связанных коронарных артериях у пациентов с ОКС, подвергнувшихся чрескожному коронарному вмешательству, а также оценить диагностическую ценность биомаркеров воспаления (NLR, вcч-СРБ, NGAL, Galectin-3) и матриксного ремоделирования (MMP-9, TIMP-1).
Ключевые слова
Для цитирования:
Ковальская А.Н., Бикбаева Г.Р., Дупляков Д.В. Влияние комбинированной гиполипидемической терапии на уязвимость атеросклеротической бляшки у пациентов с острым коронарным синдромом (Combi-LLT ACS): протокол рандомизированного исследования. Российский кардиологический журнал. 2022;27(4S):5282. https://doi.org/10.15829/1560-4071-2022-5282
For citation:
Kovalskaya A.N., Bikbaeva G.R., Duplyakov D.V. Effect of combined lipid-lowering therapy on atherosclerotic plaque vulnerability in patients with acute coronary syndrome (Combi-LLT ACS): randomized trial protocol. Russian Journal of Cardiology. 2022;27(4S):5282. https://doi.org/10.15829/1560-4071-2022-5282
В основе развития ишемической болезни сердца лежит, как правило, атеросклероз. Большой липидный пул, тонкая фиброзная покрышка и выраженная воспалительная клеточная инфильтрация — важные характеристики атеросклеротических бляшек, указывающих на склонность к разрыву и высокий риск развития фатальных коронарных событий. За дестабилизацию бляшек отвечает не только изменение их липидного состава, но и инфильтрация иммуновоспалительными клетками и деградация внеклеточного матрикса сосудистой стенки, а также активная воспалительная реакция и неоваскуляризация бляшки [1][2]. Немаловажна роль в этом процессе маркеров матриксного ремоделирования (матриксная металлопротеиназа-9 (MMP-9), тканевый ингибитор металлопротеиназы 1 типа (TIMP-1)), миокардиального фиброза и воспаления сосудистой стенки (галектин 3 (GAL-3), высокочувствительный С-реактивный белок (всч-СРБ), нейтрофильно-лимфоцитарное отношение (NLR), липокалин, ассоциированный с нейтрофильной желатиназой (NGAL)) [3-14]. В последние годы активно развивается направление кардиоваскулярной визуализации — внутрисосудистый ультразвук, магнитный резонанс высокого разрешения, позитронно-эмиссионная томография-компьютерная томография, оптическая когерентная томография (ОКТ), которые позволяют получать представление об характеристиках уязвимых бляшек in vivo [15].
Лечение дислипидемии как основного фактора развития атеросклероза является ключевым компонентом первичной и вторичной профилактики сердечно-сосудистых заболеваний. На сегодняшний день активно используются 3 группы препаратов для снижения уровня холестерина липопротеидов низкой плотности (ХС-ЛНП): ингибиторы 3-гидрокси3-метил-глутарил-КоА редуктазы (статины) как препараты первой линии, блокатор всасывания молекул холестерина в тонком кишечнике (эзетимиб) применяется в качестве терапии второй линии у пациентов, которые либо не переносят статины, либо не могут достичь желаемого снижения уровня ХС-ЛНП, несмотря на максимально переносимую терапию статинами. Если требуется дальнейшее снижение уровня ХС-ЛНП, рекомендуется поэтапный подход с использованием ингибиторов пропротеинконвертазы субтилизин/кексин типа 9 (иPCSK9) — алирокумаба или эволокумаба на основании результатов исследований FOURIER и ODYSSEY OUTCOMES [16][17].
Цель исследования — изучить влияние высокодозной комбинированной гиполипидемической терапии (статины + эзетимиб vs статины + иPCSK9) на характеристики уязвимости атеросклеротических бляшек, оцененных с помощью мультимодальной визуализации (мультиспиральной компьютерной томографии (МСКТ) коронарных артерий и ОКТ), а также биомаркеров у пациентов, перенесших острый коронарный синдром (ОКС).
Материал и методы
Дизайн исследования. В открытое проспективное рандомизированное одноцентровое исследование планируется включить 120 пациентов, поступивших в экстренном порядке с клиникой ОКС (рис. 1). Всем пациентам будет выполнено чрескожное коронарное вмешательство (ЧКВ) инфаркт-связанной артерии (ИСА), а также проведена интракоронарная визуализация с помощью ОКТ одной-двух не-ИСА. В период госпитализации пациенты будут получать стандартную терапию ОКС согласно клиническим рекомендациям, при этом статины исходно будут назначены в максимальной дозировке, аторвастатин 80 мг/розувастатин 40 мг. Пациенты, показавшие высокую комплаентность и не достигшие целевых значений ХС-ЛНП (>1,4 ммоль/л) спустя 1 мес. после развития инфаркта миокарда (ИМ)/нестабильной стенокардии, на 2 визите будут рандомизированы на 2 группы. Группа 1 — прием иPCSK9 (алирокумаб в дозе 150 мг путем подкожной инъекции 1 раз в 2 нед. или эволокумаб 140 мг путем подкожной инъекции 1 раз в 2 нед.) в дополнение к статинотерапии в максимальной дозировке. Группа 2 — прием эзетимиба в дозе 10 мг в комбинации с максимальной дозой статинов.
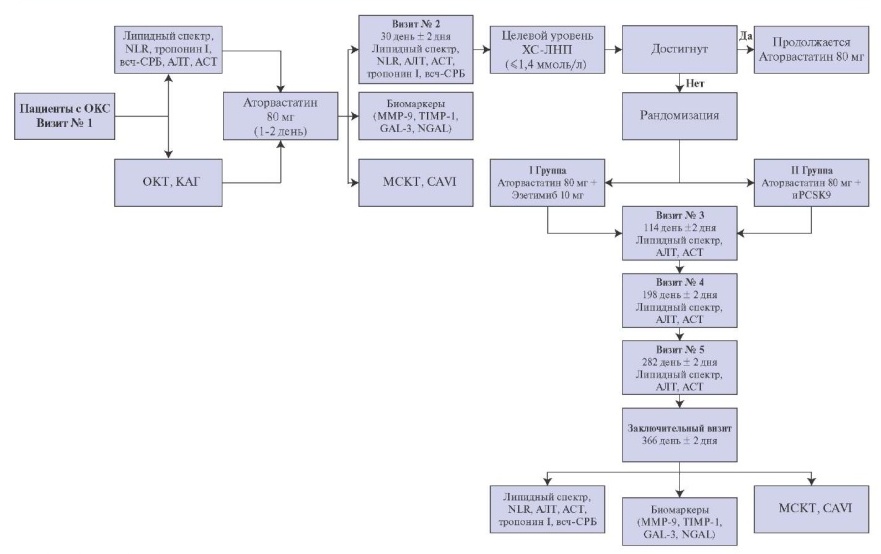
Рис. 1. Дизайн исследования.
Сокращения: АЛТ — аланинаминотрансфераза, АСТ — аспартатаминотрансфераза, всч-СРБ — высокочувствительный С-реактивный белок, иPCSK9 — ингибиторы пропротеинконвертазы субтилизин/кексин типа 9, КАГ — коронарография, МСКТ — мультиспиральная компьютерная томография, ОКС — острый коронарный синдром, ОКТ — оптическая когерентная томография, ХС-ЛНП — холестерин липопротеидов низкой плотности, CAVI — сердечно-лодыжечный сосудистый индекс, GAL-3 — галектин 3, MMP-9 — матриксная металлопротеиназа-9, NGAL — липокалин, ассоциированный с нейтрофильной желатиназой, NLR — нейтрофильно-лимфоцитарное отношение, ТIMP-1 — тканевый ингибитор металлопротеиназы 1 типа.
Исследование соответствует стандартам надлежащей клинической практики (Good Clinical Practice) и этическим аспектам Хельсинкской Декларации Всемирной медицинской ассоциации, п. 15 ст. 37 ФЗ "Об основах охраны здоровья граждан в Российской Федерации" от 21.11.2011 № 323-ФЗ. Протокол исследования был одобрен локальным этическим комитетом, зарегистрирован на ClinicalTrials.gov.
Критерии включения. Пол (любой); возраст 18-75 лет; острые формы ишемической болезни сердца (нестабильная стенокардия или ИМ) по крайней мере с одним стенозом коронарной артерии, требующим проведения ЧКВ; давность ИМ до 24 ч; одна-две не-ИСА (диаметр просвета коронарной артерии по данным коронарографии <50% и отсутствие необходимости в реваскуляризации в течение следующих 6 мес. по мнению исследователя); отсутствие приема статинов в течение не <3 (6) мес. до индексного ОКС; отсутствие целевого уровня ХС-ЛНП на первом визите; не достижение целевого уровня ХСЛНП ≤1,4 ммоль/л на втором визите; подписанное информированное согласие.
Критерии невключения: перенесенный ранее ИМ; реваскуляризация в анамнезе (ЧКВ/аортокоронарное шунтирование); наличие стенозов не-ИСА ≥50%; многососудистое поражение, в т.ч. значимый стеноз ствола левой коронарной артерии, фракция выброса по Симпсону <40%; Killip III-IV ст.; хроническая сердечная недостаточность III-IV функционального класса по NYHA; значительная кальцификация или извитость коронарных артерий; ограничивающие проведение ОКТ; тяжелая почечная и печеночная недостаточность; аллергические реакции на йодсодержащие контрастные вещества; непереносимость статинов, аспирина, блокаторов P2Y12; пациенты, которые ранее получали ингибиторы PCSK9 и/или эзетимиб; лечение системными стероидами или системным циклоспорином в течение последних 3 мес.; коллагенозы и воспалительные заболевания; онкологические заболевания в течение последних 5 лет; запланированное оперативное вмешательство в течение 3 мес.; лица, страдающие психическими расстройствами; беременность; период грудного вскармливания.
Включение в исследование. Всем пациентам, поступившим в экстренном порядке с ОКС, в первые сутки будут выполнены общеклинические анализы крови, мочи, в т.ч. кровь на аланинаминотрансферазу (АЛТ), аспартатаминотрансфераза (АСТ), тропонин I, вcч-CРБ, липидный спектр, будет проведена коронарография с последующим ЧКВ-ИСА, а также возможно проведение интракоронарной визуализации с помощью ОКТ одной-двух не-ИСА. В период госпитализации и далее во время всего периода наблюдения пациенты будут получать стандартную терапию ИМ/нестабильной стенокардии согласно клиническим рекомендациям, при этом статины исходно будут назначены в максимальной дозировке аторвастатин 80 мг/розувастатин 40 мг.
На этапе отбора в исследование пациенту, который соответствует критериям включения/исключения, описывается цель и задачи исследования, подробно разъясняются все риски и польза от участия. В случае согласия участвовать в исследовании, пациент подписывает 2 экземпляра информированного согласия и получает один из них на руки. Данные каждого участника исследования заносятся в специально разработанные индивидуальные регистрационные карты пациента.
Рандомизация. Пациенты, показавшие высокую комплаентность и не достигшие целевых значений ХС-ЛНП (≤1,4 ммоль/л) спустя 1 мес. после развития ИМ/нестабильной стенокардии, на 2 визите будут рандомизированы методом случайных чисел на две группы по 50-60 пациентов каждая. Группа 1 — прием иPCSK9 (алирокумаб в дозе 150 мг путем подкожной инъекции 1 раз в 2 нед. или эволокумаб 140 мг путем подкожной инъекции 1 раз в 2 нед.) в дополнение к статинотерапии в максимальной дозировке (аторвастатин 80 мг/розувастатин 40 мг). Группа 2 — прием эзетимиба в дозе 10 мг в комбинации с максимальной дозой статинов. Кроме этого, на 2 визите пациентам будет проведено МСКТ коронарных артерий, оценка сердечно-лодыжечного сосудистого индекса (CAVI) и лабораторное исследование (кровь на липидный профиль, АЛТ, АСТ, тропонин I, GAL3, MMP-9, TIMP-1, всч-СРБ, NGAL, NLR) [18][19].
Конечные точки. Первичная конечная точка: уменьшение проявлений уязвимости атеросклеротической бляшки по данным МСКТ в не-ИСА коронарных артериях. Вторичные конечные точки: смерть, тромбоз/рестеноз стента, нефатальный ИМ, повторные госпитализации с клиникой прогрессирующей стенокардии, повторная реваскуляризация; динамика липидного спектра (общий холестерин, ХС-ЛНП, ХС-ЛВП, триглицериды) на фоне максимальной комбинированной терапии статин + иPCSK9 или статин + эзетимиб; динамика биомаркеров миокардиального повреждения (Tропонин I), воспаления (NLR, всч-СРБ, NGAL, GAL-3) и матриксного ремоделирования (MMР-9, TIMP-1).
Наблюдение в отдалённом периоде. Общая длительность наблюдения — 52 нед., согласно графику визитов (каждый месяц с пациентом будет проводиться телемедицинская консультация, визит с целью контроля эффективности и безопасности запланирован каждые 3 мес., где будет проводиться анализ крови на липидный спектр, АЛТ, АСТ, ОАК (NLR); у пациентов, получающих иPCSK9 промежуточный контроль — каждые 2 нед. во время инъекции препарата). На финальном визите спустя 12 мес. пациентам будет проводиться МСКТ, оценка индекса CAVI и лабораторного статуса (липидный профиль, тропонин I, GAL-3, MMP-9, TIMP-1, всч-СРБ, NGAL, NLR).
Будут проанализированы следующие нежелательные явления при приеме препаратов: в группе эзетимиба — головная боль, боли в животе, диарея, запор, тошнота, миалгии, повышение АЛТ и/или АСТ >3 верхних границ нормы (ВГН), креатинфосфокиназа (>5 ВГН), тромбоцитопения; в группе иPCSK9 — реакции в месте инъекции (сухость, эритема, гематома, кровоизлияние, отек, боль), аллергические реакции — крапивница, нейрокогнитивные нарушения: нарушение внимания, ухудшение памяти, дезориентация, инфекции верхних дыхательных путей (назофарингит), боли в спине, артралгия, миалгия, головная боль, головокружение, диарея, боли в животе, инфекции мочевыводящих путей, повышение АЛТ и/или АСТ >3 ВГН.
Статистический анализ. Предполагается оценка сопоставимого влияния двух подходов терапии в уменьшении проявлений уязвимости бляшек в неИСА. Для обработки полученных результатов планируется использование пакетов SPSS, Statistica. В анализе будут использованы параметрические и непараметрические методы статистики. Для оценки значимости независимых предикторов планируется использовать модель логистической регрессии. Категориальные переменные будут указаны как абсолютные числа и проценты. Относительные риски и 95% доверительные интервалы будут вычисляться с помощью метода таблиц "два на два" с использованием логарифмического приближения. Непрерывные переменные будут отображаться как среднее ± стандартное отклонение или медианный и межквартильный интервал. За уровень статистической достоверности будет принято р<0,05.
Текущий статус исследования. В настоящее время идет набор пациентов в исследование. Протокол исследования зарегистрирован на ClinicalTrials.gov.
Обсуждение. Уязвимые бляшки являются основной причиной ОКС и внезапной смерти. К уязвимым бляшкам относятся любые типы бляшек с высокой вероятностью тромботических осложнений и быстрым прогрессированием, которые характеризуются тонкой фиброзной покрышкой, большим липидным пулом, инфильтрацией воспалительных клеток (особенно макрофагов), ремоделированием внеклеточного матрикса, неоваскуляризацией и кровоизлиянием в бляшку [1].
Одним из вероятных механизмов предотвращения неблагоприятных сердечно-сосудистых событий может быть стабилизация и/или регрессия существующих бляшек в коронарных сосудах. Оценить толщину фиброзной покрышки можно посредством ОКТ. Исследования Lipid Rich Plaque и PROSPECT II подтвердили взаимосвязь уязвимых атеросклеротических бляшек с будущими ишемическими сердечно-сосудистыми событиями. Помимо различных способов визуализации, были предложены биомаркеры воспаления (NLR, всч-СРБ, GAL-3, NGAL) и матриксного ремоделирования (MMP-9, TIMP-1) для выявления уязвимых бляшек.
Одной из наиболее изучаемых воспалительных молекул является С-реактивный белок, продуцируемый печенью в ответ на инфекцию или повреждение ткани. Сывороточный уровень CРБ <1,0 мг/л в исходном состоянии повышается в 1 тыс. раз в острой фазе иммунного ответа. CРБ может связываться с окисленным или деградированным ЛНП, активирующим комплемент, и индуцировать экспрессию адгезионных молекул, поглощение ХС-ЛНП макрофагами и продукцию хемокинов, привлекающих моноциты и другие иммуновоспалительные клетки к артериальной стенке. Повышенный уровень всч-СРБ в сыворотке отражает тенденцию к разрыву бляшки и высокую атеросклеротическую нагрузку [2][10].
NLR является воспалительным маркером, увеличение которого ассоциировано с повышенным риском развития сердечно-сосудистых событий. В норме значение NLR, как правило, не превышает 3,0. NLR является важным маркером для оценки прогноза пациентов с сердечно-сосудистыми заболеваниями, потому что он мало подвержен влиянию физиологических состояний, вследствие чего предоставляет возможность проверить баланс или дисбаланс иммунных путей воспаления (количество нейтрофилов), а также реакцию организма на стресс (количество лимфоцитов). Одной из гипотез относительного механизма увеличения соотношения NLR является уменьшение количества лимфоцитов после запрограммированной гибели клеток (апоптоза) или перемещение лимфоцитов из периферической крови в сердечную ткань с последующей ее инфильтрацией, что было обнаружено у пациентов с острыми формами ишемической болезни сердца. Увеличение NLR связано с прогрессированием атеросклероза, поскольку нейтрофилы и макрофаги усиливают фагоцитоз и деградацию ткани сосудов [8].
GAL-3 представляет собой плейотропный лектин, связывающийся с бета-галактозидами, высвобождаемый во внеклеточный матрикс активированными сердечными макрофагами и регулирующий апоптоз, пролиферацию, воспаление и фиброз. Была предложена потенциальная роль GAL-3 как медиатора атеросклероза. Многие исследования показали, что GAL-3 способствует дифференцировке макрофагов, образованию пенистых клеток, эндотелиальной дисфункции и пролиферации, и миграции гладкомышечных клеток сосудов при атерогенезе [5][6].
MMP-9 секретируется различными клетками, включая кардиомиоциты, эндотелиальные клетки, нейтрофилы, макрофаги и фибробласты и коррелирует с концентрациями интерлейкина-6, СРБ и фибриногена в плазме, что указывает на то, что MMP-9 может прогнозировать неблагоприятные сердечно-сосудистые исходы независимо от связи с воспалительными маркерами. MMP-9 играет роль в стабильности атеросклеротических бляшек, поскольку противодействует утолщению интимы. Также MMP приводят к разрушению основных компонентов внеклеточного матрикса, что вызывает разрыв бляшки [3][4].
ММP эндогенно ингибируются ТIMP, которые состоят из четырех членов, ТIMP-1, -2, -3 и -4. ТIMP-1 ингибирует с высоким сродством MMP-9. ТIMP продуцируются и секретируются фибробластами, эпителиальными и эндотелиальными клетками и распределяются среди тканей. Активность ММP жестко регулируется эндогенными ТIMP, а нарушение регуляции активности способствует ремоделированию внеклеточного матрикса. Дисбаланс между уровнями MMP и TIMP приводит к нарушению регуляции протеолитической активности и обычно неблагоприятному ремоделированию внеклеточного матрикса и связан с прогрессированием и нестабильностью атеросклеротических бляшек в коронарных артериях наряду с неблагоприятным постинфарктным фиброзом и последующей сердечной недостаточностью. Однако до настоящего времени отсутствуют достоверные данные о возможности использования указанных биомаркеров с целью долгосрочного контроля за уязвимыми бляшками [3-14].
Согласно рекомендациям Европейского общества кардиологов целевым уровнем ХС-ЛНП группы пациентов очень высокого риска является показатель ≤1,4 ммоль/л и его снижение на 50% от исходного значения. Однако на высокоинтенсивной монотерапии статинами только 32% пациентов достигают требуемого диапазона. В связи с этим крайне актуальным является внедрение в реальную клиническую практику эффективных медикаментозных технологий интенсификации липидснижающей терапии, обеспечивающих высокую приверженность пациентов к назначенному лечению. Назначение высокоинтенсивной терапии статинами при ОКС в максимально ранние сроки (1-4 день от начала заболевания) является доказанным обоснованным подходом для улучшения прогноза этих больных. У таких пациентов целесообразно в более ранние сроки обсуждать назначение двойной и тройной комбинированной терапии. Исследования IMPROVE-IT и PRECISEIVUS показали, что эзетимиб может быть использован в качестве препарата второй линии в комбинации со статинами [20-22].
Полученные в исследовании ODYSSEY OUTCOMES результаты свидетельствуют о пользе инициации терапии иPCSK9 в первые 3 мес. у пациентов после перенесенного ОКС. В исследовании PACMAN-AMI было показано, что интенсивная терапия статинами, а также иPCSK9 способствует замедлению прогрессирования коронарной атеромы и может благоприятно влиять на состав бляшки за счет снижения содержания липидов в бляшке и увеличения толщины ее фиброзной покрышки [10][21][23][24].
Инициация терапии иPCSK9 согласно действующим клиническим рекомендациям является целесообразной при неэффективности двойной схемы липидснижающей терапии (высокодозовый статин в максимально переносимой дозе + эзетимиб) в течение 4-6 нед. приема, а также при исходно тяжелых нарушениях липидного обмена и очень высоком сердечно-сосудистом риске (ХС-ЛНП >4,9 ммоль/л) [24].
Поскольку отдельные биомаркеры не обладают достаточной дискриминирующей способностью, чтобы влиять на принятие клинических решений, необходим "многомаркерный подход" с целью улучшения диагностики уязвимости атеросклеротических бляшек. Проблема биомаркеров заключается в том, что они часто влияют друг на друга, т.е. если уровень одного из них повышается, то возможно повышение и других.
В оценке уязвимости бляшки по данным МСКТ могут быть использованы следующие показатели: увеличение объема бляшки, приводящее к относительному расширению диаметра коронарной артерии — положительное ремоделирование; наличие в бляшке участка низкой плотности (<30 HU*); точечные кальцинаты в составе бляшки; кольцевидное усиление рентгеновской плотности по периферии бляшки, не превышающее 130 HU, или феномен "кругового свечения", неровный контур бляшки или наличие разрыва, но единой трактовки в настоящее время не предложено [15].
Сопоставление инструментальных методов исследования (ОКТ, МСКТ, индекс CAVI) и биомаркерной панели позволит контролировать прогрессирование коронарного атеросклероза, оптимизировать методы профилактики сердечно-сосудистых рисков и корректировать оптимальную медикаментозную терапию у пациентов с острыми формами ишемической болезни сердца [18][19].
Заключение
Исследование позволит впервые сравнить и оценить влияние ингибиторов PCSK9 и эзетимиба в комбинации с высокими дозами статинов на уменьшение проявлений уязвимости атеросклеротической бляшки по данным МСКТ в не-ИСА коронарных артериях у пациентов с ОКС, перенесших ЧКВ, а также оценить диагностическую ценность биомаркеров воспаления (GAL-3, всч-СРБ, NLR, NGAL) и матриксного ремоделирования (MMP-9, TIMP-1).
Отношения и деятельность: все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье.
Список литературы
1. Kumric M, Borovac JA, Martinovic D, et al. Circulating Biomarkers Reflecting Destabilization Mechanisms of Coronary Artery Plaques: AreWe Looking for the Impossible? Biomolecules. 2021;11:881. doi:10.3390/biom11060881.
2. Щербак С. Г., Камилова Т. А., Лебедева С. В. и др. Биомаркеры каротидного стеноза. Физическая и реабилитационная медицина, медицинская реабилитация. 2021;3(1): 104-30. doi:10.36425/rehab64286.
3. Li T, Li X, Feng Y, et al. The Role of Matrix Metalloproteinase-9 in Atherosclerotic Plaque Instability. Mediators Inflamm. 2020;2020:3872367. doi:10.1155/2020/3872367.
4. Cabral-Pacheco GA, Garza-Veloz I, Castruita-De la Rosa C, et al. The Roles of Matrix Metalloproteinases and Their Inhibitors in Human Diseases. Int J Mol Sci. 2020; 21(24):9739. doi:10.3390/ijms21249739.
5. Hara A, Niwa M, Noguchi K, et al. Galectin-3 as a Next-Generation Biomarker for Detecting Early Stage of Various Diseases. Biomolecules. 2020;10(3):389. doi:10.3390/biom10030389.
6. Cheng Z, Cai K, Xu C, et al. Prognostic Value of Serum Galectin-3 in Chronic Heart Failure: A Meta-Analysis. Front Cardiovasc Med. 2022;9:783707. doi:10.3389/fcvm.2022.783707.
7. Blum A. HMG-CoA reductase inhibitors (statins), inflammation, and endothelial progenitor cells-New mechanistic insights of atherosclerosis. Biofactors. 2014;40(3):295-302. doi:10.1002/biof.1157.
8. Чаулин А. М., Григорьева Ю. В., Павлова Т. В., Дупляков Д. В. Диагностическая ценность клинического анализа крови при сердечно-сосудистых заболеваниях. Российский кардиологический журнал. 2020;25(12):3923. doi:10.15829/1560-4071-2020-3923.
9. Шальнев В. И. Острый коронарный синдром: как снизить остаточный воспалительный риск? Российский кардиологический журнал. 2020;25(2):3720. doi:10.15829/1560-4071-2020-2-3720.
10. Уткина Е. А., Афанасьева О. И., Покровский С. Н. С-реактивный белок: патогенетические свойства и возможная терапевтическая мишень. Российский кардиологический журнал. 2021;26(6):4138. doi:10.15829/1560-4071-2021-4138.
11. DeLeon-Pennell KY, Meschiari CA, Jung M, Lindsey ML. Matrix Metalloproteinases in Myocardial Infarction and Heart Failure. Prog Mol Biol Transl Sci. 2017;147:75-100. doi:10.1016/bs.pmbts.2017.02.001.
12. Kook H, Jang DH, Kim JH, et al. Identification of plaque ruptures using a novel discriminative model comprising biomarkers in patients with acute coronary syndrome. Scientifc Reports. 2020;10:20228. doi:10.1038/s41598-020-77413-3.
13. Cruz DN, Gaiao S, Maisel A, et al. Neutrophil gelatinase-associated lipocalin as a biomarker of cardiovascular disease: a systematic review. Clin Chem Lab Med. 2012;50(9):1533-45. doi:10.1515/cclm-2012-0307.
14. Olejarz W, Łacheta D, Kubiak-Tomaszewska G. Matrix Metalloproteinases as Biomarkers of Atherosclerotic Plaque Instability. Int J Mol Sci. 2020;21(11):3946. doi:10.3390/ijms21113946.
15. Mushenkova NV, Summerhill VI, Zhang D, et al. Current Advances in the Diagnostic Imaging of Atherosclerosis: Insights into the Pathophysiology of Vulnerable Plaque. Int J Mol Sci. 2020;21(8):2992. doi:10.3390/ijms21082992.
16. Российское кардиологическое общество (РКО). Острый инфаркт миокарда с подъемом сегмента ST электрокардиограммы. Клинические рекомендации 2020. Российский кардиологический журнал. 2020;25(11):4103. doi:10.15829/29/1560-4071-2020-4103.
17. Барбараш О. Л., Федорова Н. В., Седых Д. Ю. и др. Применение ингибиторов PCSK9 на госпитальном этапе лечения пациентов с острым коронарным синдромом и тяжелыми нарушениями липидного обмена. Российский кардиологический журнал. 2020;25(8):4010. doi:10.15829/1560-4071-2020-4010.
18. Birudaraju D, Cherukuri L, Kinninger A, et al. Relationship between cardio-ankle vascular index and obstructive coronary artery disease. Coron Artery Dis. 2020;31(6):550-5. doi:10.1097/MCA.0000000000000872.
19. Matsushita K, Ding N, Kim ED, et al. Cardio-ankle vascular index and cardiovascular disease: Systematic review and meta-analysis of prospective and cross-sectional studies. J Clin Hypertens (Greenwich). 2019;21(1):16-24. doi:10.1111/jch.13425.
20. Недогода С. В., Чумачек Е. В., Саласюк А. С. Обоснование применения алирокумаба при остром коронарной синдроме с клиникоэкономической точки зрения. Клин фармакол тер. 2019;28(2):99-104. doi:10.32756/0869-5490-2019-2-99-104.
21. Ахмеджанов Н. М., Везикова Н. Н., Воевода М. И. и др. Улучшение прогноза у пациентов после острого коронарного синдрома: роль ингибиторов PCSK9. Резолюция Национального научного совета экспертов. Кардиология. 2019;59(5S):58-64. doi:10.18087/cardio.n308.
22. Седых Д. Ю., Кашталап В. В., Хрячкова О. Н. и др. Интенсификация липидснижающей терапии у пациентов очень высокого риска: возможности комбинации с ингибиторами PCSK9. Российский кардиологический журнал. 2022;27(6):5030. doi:10.15829/1560-4071-2022-5030. EDN YASTYM.
23. Räber L, Ueki Y, Otsuka T, et al. Effect of Alirocumab Added to High-Intensity Statin Therapy on Coronary Atherosclerosis in Patients With Acute Myocardial Infarction: The PACMAN-AMI Randomized Clinical Trial. JAMA. 2022;327(18):1771-81. doi:10.1001/jama.2022.5218.
24. Кудина Е. В., Самкова И. А., Ларина В. Н. Гиполипидемическая терапия: доказанная эффективность и новые перспективы. Consilium Medicum. 2020;22(10):55-60. doi:10.26442/20751753.2020.10.200292.
Об авторах
А. Н. КовальскаяРоссия
врач-кардиолог, аспирант кафедры пропедевтической терапии
Самара
Г. Р. Бикбаева
Россия
врач-кардиолог кардиологического отделения № 5
Самара
Д. В. Дупляков
Россия
д.м.н., профессор, зам. главного врача по медицинской части, зав. кафедрой пропедевтической терапии
Самара
Дополнительные файлы
Рецензия
Для цитирования:
Ковальская А.Н., Бикбаева Г.Р., Дупляков Д.В. Влияние комбинированной гиполипидемической терапии на уязвимость атеросклеротической бляшки у пациентов с острым коронарным синдромом (Combi-LLT ACS): протокол рандомизированного исследования. Российский кардиологический журнал. 2022;27(4S):5282. https://doi.org/10.15829/1560-4071-2022-5282
For citation:
Kovalskaya A.N., Bikbaeva G.R., Duplyakov D.V. Effect of combined lipid-lowering therapy on atherosclerotic plaque vulnerability in patients with acute coronary syndrome (Combi-LLT ACS): randomized trial protocol. Russian Journal of Cardiology. 2022;27(4S):5282. https://doi.org/10.15829/1560-4071-2022-5282
JATS XML

















































