Перейти к:
Сравнительная оценка экспрессии ферментов пути синтеза церамидов de novo в жировой ткани сердца и сосудов пациентов с сердечно-сосудистыми заболеваниями
https://doi.org/10.15829/1560-4071-2022-5281
Аннотация
Цель. Оценить в сравнительном аспекте экспрессию ферментов биосинтеза церамидов по пути de novo в жировой ткани (ЖТ) сердца и сосудов пациентов с ишемической болезнью сердца (ИБС) и приобретенными пороками сердца.
Материал и методы. В исследование включено 20 пациентов с ИБС и 18 пациентов с аортальным стенозом/недостаточностью. Биоптаты подкожной, эпикардиальной, периваскулярной ЖТ (подкожная ЖТ (ПЖТ), эпикардиальная ЖТ (ЭЖТ), периваскулярная ЖТ (ПВЖТ), соответственно) получены во время оперативного вмешательства. Методом количественной ПЦР оценена экспрессия генов ферментов синтеза церамидов de novo (серинпальмитоилтрансферазы субъединицы С1 и С2: SPTLC1, SPTLC2; церамидсинтазы 1-6: СERS1-6; дигидроцерамиддесатуразы: DEGS1). Статистический анализ результатов проводили в программе GraphPad Prism 8 (GraphPad Software).
Результаты. Пациенты с ИБС характеризовались более высоким уровнем мРНК SPTLC1 в ПЖТ и ЭЖТ, SPTLC2, СERS1, продуцирующей церамиды С18, СERS5 и СERS6, генерирующих церамиды С14-С16 в ЭЖТ, СERS2 — в ПЖТ, продуцирующей длинноцепочечные церамиды С20-С24, СERS4, синтезирующей очень длинноцепочечные церамиды С18-С20. В ПВЖТ выявлена высокая экспрессия СERS4 и СERS3, синтезирующей очень длинноцепочечные церамиды С26 и выше. Экспрессия DEGS1 была максимальной в ПЖТ и ЭЖТ. У пациентов с пороками сердца отмечалась высокая экспрессия СERS3 в ПВЖТ, СERS4 в ЭЖТ и ПВЖТ, DEGS1 в ЭЖТ. Уровень мРНК SPTLC1 в ПЖТ и ЭЖТ, SPTLC2 в ЭЖТ, СERS2 во всех исследуемых ЖТ, СERS4 и 5 в ЭЖТ, DEGS1 в ПЖТ и ЭЖТ среди пациентов с ИБС был выше, чем в группе сравнения.
Заключение. Региональные жировые депо сердца отличались по уровню экспрессии ферментов биосинтеза церамидов de novo. Полученные результаты свидетельствуют об активации синтеза церамидов по этому пути в адипоцитах преимущественно эпикардиальной локализации при коронарогенной патологии, что может способствовать накоплению длинноцепочечных церамидов в ЖТ этой локализации.
Ключевые слова
Для цитирования:
Груздева О.В., Дылева Ю.А., Белик Е.В., Учасова Е.Г., Понасенко А.В., Горбатовская Е.Е., Фанаскова Е.В., Иванов С.В., Стасев А.Н., Зинец М.Г., Барбараш О.Л. Сравнительная оценка экспрессии ферментов пути синтеза церамидов de novo в жировой ткани сердца и сосудов пациентов с сердечно-сосудистыми заболеваниями. Российский кардиологический журнал. 2022;27(12):5281. https://doi.org/10.15829/1560-4071-2022-5281
For citation:
Gruzdeva O.V., Dyleva Yu.A., Belik E.V., Uchasova E.G., Ponasenko A.V., Gorbatovskaya E.E., Fanaskova E.A., Ivanov S.V., Stasev A.N., Zinets M.G., Barbarash O.L. Comparative evaluation of the expression of enzymes of the ceramide de novo synthesis pathway in cardiac adipose tissue and blood vessels of cardiovascular patients. Russian Journal of Cardiology. 2022;27(12):5281. (In Russ.) https://doi.org/10.15829/1560-4071-2022-5281
Жировая ткань (ЖТ) является активным эндокринным органом, который ассоциирован с патофизиологией ишемической болезни сердца (ИБС) [1]. Особенно тесную связь с атерогенезом имеют эпикардиальный и периваскулярный компартменты ЖТ [2][3]. В настоящее время широко признано, что эти компартменты чрезвычайно активны, продуцируют широкий спектр биологически активных веществ, среди которых церамиды (сфинголипиды) занимают особенное место. Церамиды являются не только важными структурными компонентами мембран клеток, но и выполняют роль вторичного мессенджера (участвуют во внутриклеточной и межклеточной передаче сигналов), регулируют многие важные физиологические процессы: рост, дифференцировку, пролиферацию, миграцию, апоптоз клеток, активность киназ и фосфатаз, модулируют метаболизм глюкозы и липидов [4][5]. За последние 20 лет интенсивные популяционные, когортные и экспериментальные, в т.ч. генетические, исследования убедительно продемонстрировали взаимосвязь церамидов и факторов сердечно-сосудистого риска (пол, возраст, артериальная гипертензия, курение, ожирение) [6-8]. В многочисленных исследованиях, носящих экспериментальный характер, показана роль церамидов в формировании атеросклеротических бляшек [9][10]. Исследования липидома плазмы человека позволили выявить определенные виды церамидов, которые являются независимыми предикторами будущих фатальных и нефатальных сердечно-сосудистых событий [11][12]. Вместе с тем должного внимания проблеме аккумуляции церамидов в ЖТ сердца и сосудов при ИБС и их роли в атерогенезе не уделялось. В то время как церамиды ЖТ посредством паракринного высвобождения могут выступать в качестве атерогенных медиаторов.
Основным источником церамидов в адипоцитах является путь de novo [13]. Благодаря скоординированному действию ферментов (серинпальмитоилтрансферазы, 3-кетодигидросфингозинредуктазы, церамидсинтазы, дигидроцерамиддесатуразы) в результате четырех последовательных реакций генерируется до 80% клеточных церамидов. Наличие 6 изоформ фермента церамидсинтазы (CerS1-CerS6), присоединяющей ацильную цепь жирной кислоты к каркасу сфинганина, обеспечивает большое видовое разнообразие церамидов [13]. Так CerS1, CerS5 и CerS6 присоединяют жирные кислоты с более короткой длиной углеводородной цепи (C14-C18) к сфинганину, в то время как CerS2, CerS3 и CerS4 добавляют более длинноцепочечные жирные кислоты (C18-C26 и более). Дисбаланс CerS в клетке будет приводить к увеличению определенных церамидов, нарушая гомеостаз клетки [14], однако механизмы нарушения соотношений и значения этих соотношений до конца не изучены, необходимы дополнительные исследования.
На сегодняшний день недостаточно и данных, касающихся особенности экспрессии ферментов пути de novo в ЖТ, в особенности сердечной локализации. Работы носят в основном экспериментальный характер, и результаты зачастую противоречивы [5][8][15][16]. Между тем, изменение активности ферментов синтеза в ЖТ сердца может приводить к избыточному синтезу и накоплению церамидов не только в ЖТ, но и в кардиомиоцитах. Избыточная аккумуляция церамидов, в свою очередь, может индуцировать целый ряд патологических процессов, ассоциированных с атерогенезом [17].
В связи с этим, целью исследования явилось оценить в сравнительном аспекте экспрессию ферментов биосинтеза церамидов по пути de novo в ЖТ сердца и сосудов пациентов с ИБС и приобретенными пороками сердца.
Материалы и методы
В исследование включено 38 пациентов, среди которых было 20 пациентов с ИБС (основная группа). Группу сравнения составили 18 пациентов с некоронарогенными патологиями сердца — дегенеративные приобретенные неревматические пороки сердца (аортальный стеноз/недостаточность) и показаниями для проведения открытой операции на клапанах сердца, сопоставимых по полу и возрасту с основной группой. Все пациенты имели показания для проведения открытого вмешательства на сердце — прямой реваскуляризации миокарда методом коронарного шунтирования или операции на клапанах сердца.
Критериями включения явились возраст пациента до 75 лет; согласие пациента на исследование. Критерии исключения: возраст пациента >75 лет; наличие сахарного диабета 1 и 2 типа в анамнезе и/ или выявленного при обследовании в период госпитализации; инфаркт миокарда (ИМ); клинически значимые сопутствующие заболевания (анемия, почечная и печеночная недостаточность, онкологические и инфекционно-воспалительные заболевания в период обострения, аутоиммунные заболевания); отказ пациента от проведения исследования.
Клинико-анамнестическая характеристика представлена таблице 1. Критерии включения для пациентов группы сравнения: верифицированный приобретенный порок сердца, согласие на проведения исследования.
Среди пациентов с ИБС преобладали лица мужского пола (60%), средний возраст которых составил 64,9 (47,8; 69,5) лет, индекс массы тела (ИМТ) — 26,4 (22,5; 30,2) кг/м2 (табл. 1). В анамнезе чаще фиксировались артериальная гипертензия, курение, стенокардия, отягощенная наследственность по сердечно-сосудистой патологии. У 14 (70%) пациентов в анамнезе был ИМ, у 2 (10%) человек — инсульт. Пациенты с приобретенными пороками сердца были сопоставимы по полу, возрасту и ИМТ с основной группой. Средний возраст пациентов составил 59,3 (43,7; 62,1) лет. Пациенты с пороками сердца чаще страдали хронической сердечной недостаточностью II-III функционального класса и имели сниженную фракцию выброса в сравнении с группой ИБС.
В течение госпитального периода все пациенты получали стандартную медикаментозную терапию в соответствии с рекомендациями Министерства Здравоохранения РФ (2020) и Европейского общества кардиологов (2020), включая гепарин, клопидогрел, аспирин, ингибиторы ангиотензинпревращающего фермента, β-адреноблокаторы, блокаторы кальциевых каналов, нитраты, ингибиторы ГМГ-КоА-редуктазы (статины). Пациенты с пороками сердца получали варфарин, β-адреноблокаторы, ингибиторы ангиотензинпревращающего фермента, ингибиторы ГМГ-КоАредуктазы (статины), антагонисты Са (дигидропиридиновые), нитраты, диуретики.
Биоптаты ЖТ подкожной, эпикардиальной и периваскулярной локализации (3-5 г) были получены у пациентов во время оперативного вмешательства (коронарного шунтирования или коррекции пороков сердца). Источник подкожной ЖТ (ПЖТ) — подкожная клетчатка нижнего угла средостенной раны, эпикардиальной ЖТ (ЭЖТ) — зоны ее наибольшего присутствия — правые отделы сердца (правое предсердие и правый желудочек), периваскулярной ЖТ (ПВЖТ) — из области правой коронарной артерии. Образцы ЖТ подвергались криогенной заморозке жидким азотом с последующим хранением при температуре -1500 С.
Экспрессия генов ферментов синтеза церамидов пути de novo
Выделение и синтез нуклеиновых кислот. Выделение рибонуклеиновой кислоты (РНК) из ЖТ проводили с помощью набора Fatty Tissue RNA Purification Kit (Norgen Biotek Corp., Канада), основным преимуществом которого является быстрое выделение и высокая степень очистки тотальной РНК из тканей с высоким содержанием липидов. Количество и чистоту выделенной РНК определяли на спектрофотометре NanoDrop 2000 (Thermo Scientific, США). Для проведения обратной транскрипции и синтеза комплементарной ДНК на основе образцов РНК использовали реагенты High-Capacity cDNA Reverse Transcription Kit with RNase Inhibitor (AB, США) и хранили при -200 C в течение 2 дней до момента постановки полимеразной цепной реакции (ПЦР).
Оценка генной экспрессии. Для измерения экспрессии генов ферментов синтеза церамидов пути de novo использовался метод количественной ПЦР с праймерами, синтезированными ЗАО "Евроген" (г. Москва, Россия), на амплификаторе ViiA 7 (Applied Biosystems, США). Структура праймеров представлена в таблице 2.
Таблица 1
Клиническая характеристика пациентов с ИБС и пороками сердца
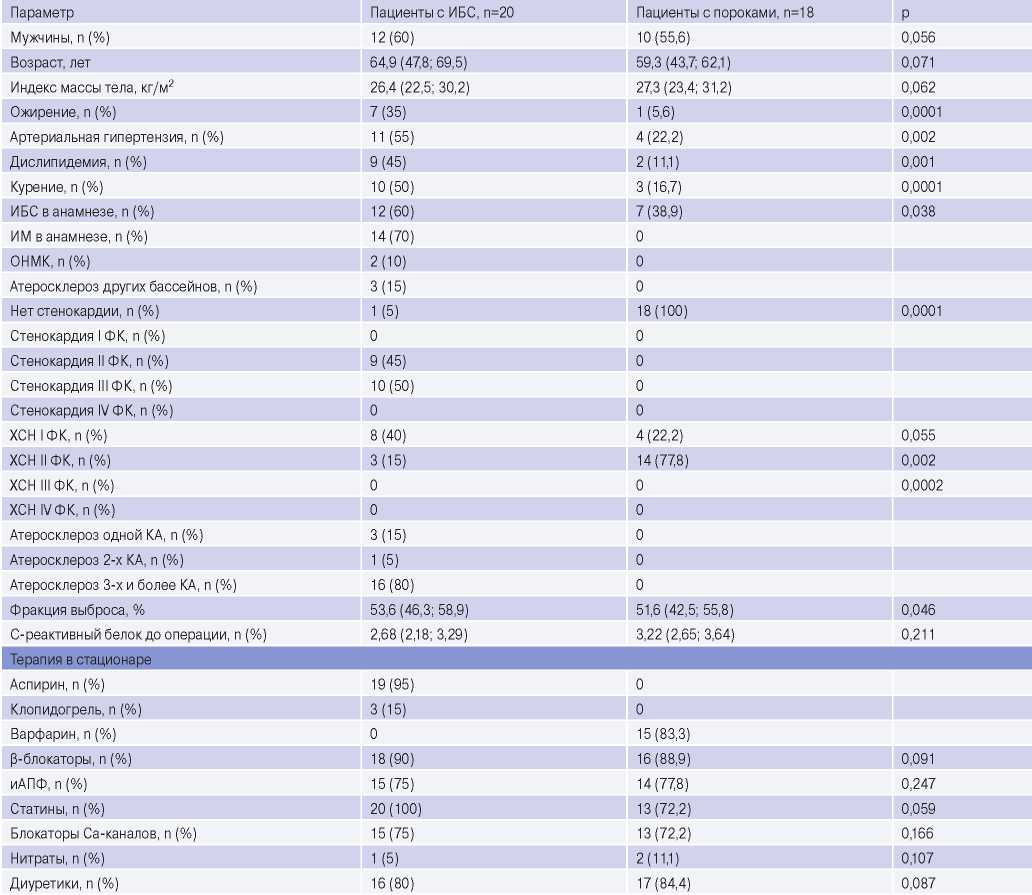
Сокращения: иАПФ — ингибиторы ангиотензинпревращающего фермента, ИБС — ишемическая болезнь сердца, ИМ — инфаркт миокарда, ОНМК — острое нарушения мозгового кровообращения, КА — коронарная артерия, ФК — функциональный класс, ХСН — хроническая сердечная недостаточность.
Таблица 2
Праймеры, используемые для оценки генной экспрессии ферментов синтеза церамидов
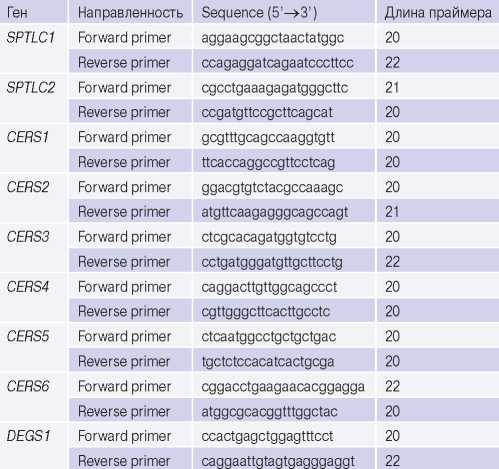
Сокращения: SPTLC1 — ген серинпальмитоилтрансферазы субъединицы С1, SPTLC2 — ген серинпальмитоилтрансферазы субъединицы С2, СERS1-6 — гены церамидсинтазы 1-6, DEGS1 — ген дигидроцерамиддесатуразы 1.
Для проведения ПЦР с интеркалирующим красителем SYBR Green использовали реакционную смесь мастер-микс БиоМастер UDG HS-qPCR LoROX SYBR (2×) (ООО "Биолабмикс", Россия) согласно протоколу производителя. Количественная ПЦР осуществлялась с помощью амплификатора CFX-96 Rial-Time System (Bio-Rad, США). Для расчета относительной величины экспрессии использовали метод ΔCT (вариант метода Ливака), основанный на определении разницы между значениями CT референсных генов и целевых значений CT для каждого образца. Нормирование результатов ПЦР проводилось с помощью референсных генов ACTB (β-актин), GAPDH (глицеральдегид-3-фосфатдегидрогеназа), B2M (бета-2-микроглобулин).
Статистический анализ
Статистический анализ полученных результатов проводили в программе GraphPad Prism 8 (GraphPad Software). Данные представлены в виде медианы, 25- го и 75-го процентилей. Для анализа межгрупповых различий использовали непараметрические критерии. Сравнение 3 независимых групп проводили с использованием критерия Краскела-Уоллиса с последующим попарным сравнением с применением U-критерия Манна-Уитни. Сравнение 2 независимых групп проводили с использованием U-критерия Манна-Уитни. Категориальные переменные, выраженные в процентах, сравнивали с использованием критерия хиквадрат или точного критерия Фишера. Значения р<0,05 считались статистически значимыми.
Результаты
Для получения информации об особенности экспрессии генов ферментов пути синтеза церамидов de novo в ЖТ были оценены уровни микро-РНК (мРНК) генов ферментов SPT, СERS и DEGS1 с использованием количественной ПЦР в реальном времени. С учетом того, что SPT состоит как минимум из двух субъединиц, был оценен уровень экспрессии мРНК SPTLC1 и мРНК SPTLC2.
Среди пациентов с ИБС обнаружена более высокая экспрессия субъединицы С1 в образцах ПЖТ и ЭЖТ в сравнении с ЖТ периваскулярной локализации (р=0,0002, р=0,010, соответственно). В отличие от субъединицы С1, уровень экспрессии субъединицы C2 был выше только в образцах ЭЖТ в сравнении с ПЖТ и ПВЖТ (р=0,012, р=0,013, соответственно) (табл. 3).
Генная экспрессия церамидсинтаз в ЖТ пациентов с ИБС имела тканевые особенности. ПЖТ характеризовалась максимальной экспрессией гена СERS2, продуцирующей длинноцепочечные церамиды С20-С24 (рис. 1), ЭЖТ — экспрессией СERS1, продуцирующей церамиды С18 и высоким уровнем мРНК СERS5, СERS5 и СERS6, генерирующих церамиды С14-С16. В ПВЖТ, аналогично ЭЖТ, выявлена максимальная экспрессия СERS4, а также СERS3, отвечающих за синтез очень длинноцепочечных церамидов С18-С20 и С26, соответственно.
Уровень мРНК DEGS1, фермента завершающей стадии синтеза церамидов, был максимальным в образцах эпикардиальной и периваскулярной ЖТ в сравнении с ПЖТ (р=0,010, р=0,012, соответственно).
В группе пациентов с пороками сердца образцы ЖТ не отличались по уровню мРНК SPTLC1, SPTLC2 и СERS1, 2, 5 и 6, в то время как отмечалась высокая экспрессия СERS3 в периваскулярных адипоцитах (р=0,004) и СERS4 в ЭЖТ (р=0,011) и ПВЖТ (р=0,024) (рис. 1). Генная экспрессия DEGS1 в образцах ЭЖТ была максимальной в сравнении с подкожными и периваскулярными адипоцитами (р=0,014 и р=0,011, соответственно) (табл. 3).
Оценка межнозологических различий в экспрессии генов ферментов пути синтеза церамидов de novo в ЖТ показала, что пациенты с ИБС, в отличие от пациентов с пороками сердца, характеризовались более высокой экспрессией SPTLC1 в ЖТ подкожной и эпикардиальной локализации (р=0,00003, р=0,0022, соответственно), SPTLC2 в образцах ЭЖТ (р=0,039) (табл. 3). Среди пациентов с ИБС также отмечалась более высокая экспрессия СERS2 в образцах всех исследуемых тканей (ПЖТ, р=0,0001, ЭЖТ, р=0,003, ПВЖТ, р=0,0013), СERS4 и 5 в эпикардиальных адипоцитах (р=0,022, р=0,017) (рис. 1). Генная экспрессия СERS6 не имела межгрупповых различий. Уровень мРНК DEGS1 среди пациентов с ИБС был выше в адипоцитах независимо от локализации (в ПЖТ, р=0,029; ЭЖТ, р=0,035; в ПВЖТ, р=0,030) (табл. 3).
Таким образом, региональные жировые депо сердца отличались по уровню экспрессии ферментов биосинтеза церамидов de novo. Полученные результаты свидетельствуют об активации синтеза церамидов по пути de novo в адипоцитах преимущественно эпикардиальной локализации при коронарогенной патологии, что может способствовать накоплению длинноцепочечных церамидов в ЖТ этой локализации.
Таблица 3
Экспрессия генов основных ферментов синтеза церамидов пути de novo в ЖТ сердца различной локализации пациентов с сердечно-сосудистыми заболеваниями
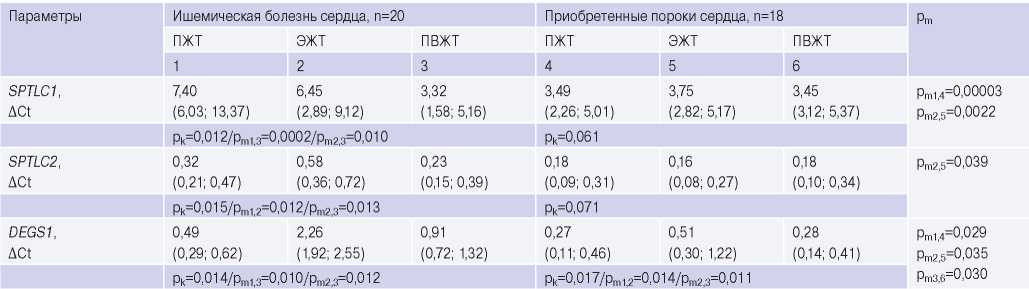
Сокращения: ПВЖТ — периваскулярная жировая ткань, ПЖТ — подкожная жировая ткань, ЭЖТ — эпикардиальная жировая ткань, рk — уровень статистической значимости при сравнении трех групп методом Kruskal-Wallis, рm — уровень статистической значимости при сравнении двух групп методом Mann-Whitney, SPTLC1 — ген серинпальмитоилтрансферазы субъединицы С1, SPTLC2 — ген серинпальмитоилтрансферазы субъединицы С2, DEGS1 — ген дигидроцерамиддесатуразы 1.
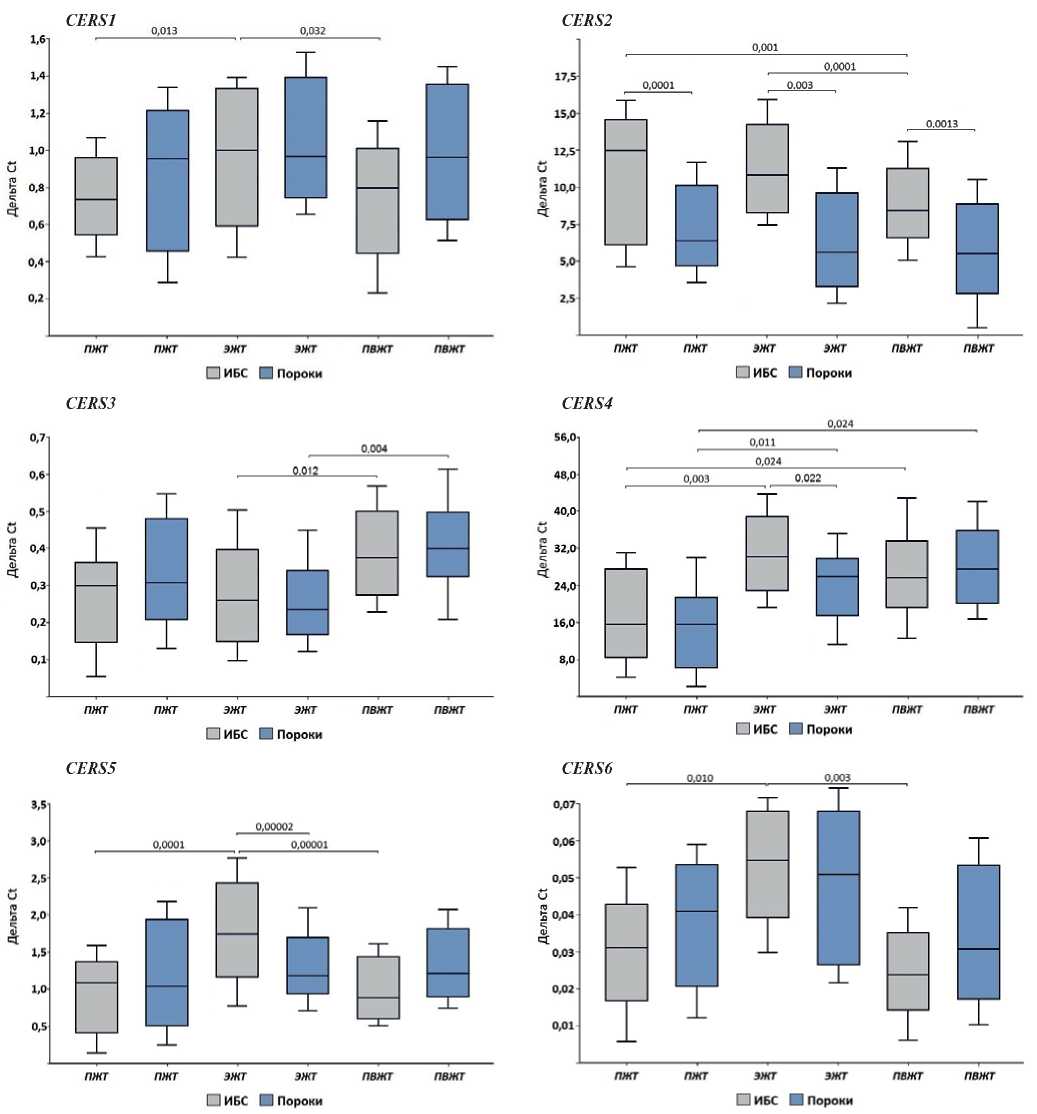
Рис. 1. Экспрессия генов церамидсинтаз в ЖТ сердца различной локализации пациентов с сердечно-сосудистыми заболеваниями.
Сокращения: ИБС — ишемическая болезнь сердца, ПВЖТ — периваскулярная жировая ткань, ПЖТ — подкожная жировая ткань, ЭЖТ — эпикардиальная жировая ткань.
Обсуждение
Экспериментальные и клинические исследования показали связь между церамидами и развитием атеросклероза [17]. Особый интерес вызывает накопление церамидов в жировых депо сердца и сосудов, поскольку ЭЖТ и ПВЖТ локализованы в непосредственной близости к очагу атеросклеротического поражения. Первым этапом исследования явилась оценка экспрессии гена ключевого фермента синтеза церамидов de novo серинпальмитоилтрансферазы в ЖТ подкожной и сердечной локализации. Установлено, что у пациентов с ИБС в ЭЖТ экспрессия SPTLC1 и SPTLC2 превышала аналогичные показатели в группе пороков сердца. Максимальные значения мРНК SPTLC1 также наблюдались в группе пациентов с ИБС. Можно предположить, что при ИБС усиление экспрессии SPT, ключевого фермента пути синтеза церамидов de novo в адипоцитах ПЖТ и ЭЖТ могло быть обусловлено наличием избыточной массы тела у обследованных пациентов. Ранее проведенные клинические исследования подтверждают такую точку зрения. Так, Błachnio-Zabielska AU, et al. (2012) продемонстрировали значительное увеличение мРНК обеих субъединиц SPT (SPTLC1 и SPTLC2) в образцах ПЖТ брюшной полости у лиц с ожирением (ИМТ >30) по сравнению с контрольной группой без ожирения (ИМТ <25). Активность фермента, оцененная с использованием радиоактивно меченного субстрата, [3H]-L-серина (Moravek Biochemicals), также была повышена [18]. Однако следует принять во внимание отсутствие различий по ИМТ с группой пациентов с пороками сердца, которые имели более низкие значения экспрессии гена SPTLC1. С другой стороны, ишемия/гипоксия миокарда, обусловленная атеросклерозом коронарных артерий, могла также спровоцировать усиление экспрессии SPT в адипоцитах. Экспериментально показано, что адаптация к хронической гипоксии регулируется дифференциальным транскрипционным профилем, включающим активацию экспрессии SPT, направленным на метаболическое перепрограммирование клетки. Синтез церамидов с участием жирных кислот поначалу может носить приспособительный характер, однако по мере накопления церамидов в клетке наблюдается замедление ключевых клеточных и физиологических процессов, напротив, активируется запрограммированная гибель клетки. Важным аспектом также является индуцированное гипоксией усиление провоспалительной активности ЖТ. Считается, что гипоксия, развивающаяся в областях ЖТ, приводит к выработке адипоцитами провоспалительного фактора некроза опухоли, который, в свою очередь, усиливает экспрессию SPT [19].
Следующим этапом анализа явилась оценка профиля экспрессии генов CERS1-6, кодирующих ферменты церамидсинтазы, со специфической субстратной специфичностью по отношению к жирным кислотам с разной длиной цепи. У млекопитающих длина ацильной цепи церамида колеблется от средней (12-14С), длинной (16-20С), очень длинной (22- 26С) до сверхдлинной (>26С) цепи жирных кислот. Экспериментально показано, что активирование/ блокировка церамидсинтаз может иметь широкий спектр функциональных и тканеспецифических эффектов [20]. Результаты настоящего исследования свидетельствуют о том, что в ЖТ подкожной, эпикардиальной и периваскулярной локализации экспрессируются все 6 ферментов церамидсинтаз независимо от наличия коронарогенной или некоронарогенной нозологии. Экспрессия гена CERS4 и CERS2 была максимальной, а CERS6 самой минимальной (независимо от локализации ЖТ). Наличие коронарогенной патологии (ИБС) сопровождалось наиболее высокими значениями экспрессии СERS2 в ПЖТ, ЭЖТ, ПВЖТ, СERS4 и 5 в ЭЖТ. Имеющиеся на сегодняшний день данные экспериментальных и клинических исследований не позволяют однозначно трактовать полученные результаты. Так, отсутствует однозначное мнение о протективной или негативной роли изученных нами церамидсинтаз. Согласно данным Kim YR, et al. (2019), ингибирование экспрессии CERS4 улучшает метаболический профиль печени у мышей [21]. С другой стороны, CERS4 может генерировать С20 и С22 церамиды, обладающие защитной функцией при развитии сердечной недостаточности [22]. СERS2 синтезирует церамиды с длиной цепи С22-С24. Отличительной особенностью гена СERS2 является его организация, характерная для гена "домашнего хозяйства" и расположение в хромосомных областях, которые реплицируются на ранних стадиях клеточного цикла [23]. В физиологии клеток, в т.ч. адипоцитов, СERS2 имеет ключевое значение, поскольку нокдаун CERS2 приводит к нарушению цитокинеза [24]. Гомозиготные мыши с нокаутом CERS2 отличались высокой восприимчивостью к дезадаптивным метаболическим нарушениям при диете, вызывающей ожирение. Следует отметить, что сверхэкспрессия CERS2 была защитной при стрессовой реакции эндоплазматического ретикулума, индуцированной пальмитатом, предположительно потому, что она предотвращала индукцию CERS6, приводящую к усилению липогенеза в печени [21]. Другие исследования свидетельствуют о негативной роли CERS2. Так, избыточная экспрессия CERS2 (и накопление церамидов C20-C24) вызывает окислительный стресс и митохондриальную дисфункцию посредством липидной перегрузки, что в конечном итоге приводит к апоптозу кардиомиоцитов [25]. Некоторые авторы полагают, что CERS2-зависимое повреждение митохондрий клеток может являться объединяющим другие патологические состояния — инсулинорезистентность, окислительный стресс, усиление аутофагии и митофагии — патофизиологическим механизмом, приводящим в конечном итоге к гибели кардиомиоцитов. Показано также, что CERS2 синергично усиливает экспрессию CERS5, для которой однозначно показано участие в индукции окислительного стресса и апотоза [25]. Мыши с нулевым CERS5 жизнеспособны, фертильны, не имеют каких-либо очевидных морфологических и фенотипических изменений при нормальном питании [26]. Однако при диете с высоким содержанием жиров потеря CERS5 была ассоциирована со снижением прибавки в весе, улучшением общего состояния, уменьшением воспалительной активации белой ЖТ и снижением уровня лептина по сравнению с животными дикого типа [26].
Завершающим этапом работы была оценка экспрессии гена десатуразы, заключительного фермента пути de novo. Последняя стадия пути de novo считается не менее важной, поскольку именно церамиды, а не дигидроцерамиды, являются конечными продуктами, которые обладают разными профилями метаболической и клеточной активности. Результаты проведенного исследования свидетельствуют о более высоком уровне мРНК DEGS1 в ЭЖТ у пациентов с ИБС. Ранее проведенные исследования не обнаружили подобных различий, более того, отмечена более высокая экспрессия DEGS1 в образцах ЖТ подкожных адипоцитов по сравнению с адипоцитами медиастинального депо у пациентов с избыточной массой тела (ИМТ 29,4±4,9 кг/м2, n=10), направленных на плановую операцию на аортальном клапане и/или на восходящей грудной аорте [27]. Обращает на себя внимание тот факт, что у пациентов с ИБС значения уровня мРНК DEGS1 в ПЖТ были существенно меньше, чем значения мРНК первого фермента пути de novo SPT. Напротив, значения мРНК DEGS1 в ЭЖТ были сопоставимы с экспрессией фермента SPT. Возможным объяснением избыточной экспрессии десатуразы в ЭЖТ является нивелирование патологических эффектов гипоксии, некоторые исследователи рассматривают DES1 в качестве клеточных сенсоров кислорода [28].
Заключение
Таким образом, ЖТ сердца при коронарогенной патологии характеризуются активацией синтеза церамидов по пути de novo, преимущественно в эпикардиальной локализации, что может приводить к аккумуляции церамидов, потенцируя многие патологические процессы, ассоциированные с атеросклерозом. Управление биосинтезом церамидов за счет ингибирования ферментов пути de novo является привлекательной терапевтической стратегией по снижению уровня церамидов не только в плазме, но и в периферических тканях, в т.ч. в сердце и сосудах, и имеет огромные перспективы для лечения широкого спектра сердечно-сосудистых патологий.
Отношения и деятельность. Исследование выполнено за счет гранта Российского научного фонда № 22-15-20007 "Церамидный профиль локальных жировых депо сердца: клинико-патогенетическое значение и терапевтический потенциал" https://rscf.ru/project/22-15-20007/ и средств Министерства науки и высшего образования Кузбасса.
Список литературы
1. Iacobellis G. Epicardial adipose tissue in contemporary cardiology. Nat Rev Cardiol. 2022;19(9):593-606. doi:10.1038/s41569-022-00679-9.
2. Брель Н. К., Груздева О. В., Коков А. Н. и др. Взаимосвязь кальциноза коронарных артерий и локальных жировых депо у пациентов с ишемической болезнью сердца. Комплексные проблемы сердечно-сосудистых заболеваний. 2022;11(3):51-63. doi:10.17802/2306-1278-2022-11-3-51-6.
3. Gruzdeva OV, Dyleva YA, Belik EV, et al. Relationship between Epicardial and Coronary Adipose Tissue and the Expression of Adiponectin, Leptin, and Interleukin 6 in Patients with Coronary Artery Disease. J Pers Med. 2022;12(2):129. doi:10.3390/jpm12020129.
4. Chatham JC, Young ME. Metabolic remodeling in the hypertrophic heart: fuel for thought. Circ. Res. 2012;111:666-8. doi:10.1161/circresaha.112.277392.
5. Summers SA, Chaurasia B, Holland WL. Metabolic Messengers: Ceramides. Nat. Metab. 2019;1(11):1051-8. doi:10.1038/s42255-019-0134-8.
6. Mielke MM, Bandaru VV, Han D, et al. Factors affecting longitudinal trajectories of plasma sphingomyelins: the Baltimore Longitudinal Study of Aging. Aging Cell. 2015;14(1):112-21. doi:10.1111/acel.12275.
7. Middlekauff HR, William KJ, Su B, et al. Changes in lipid composition associated with electronic cigarette use. J Transl Med. 2020;18:379. doi:10.1186/s12967-020-02557-9.
8. Turpin SM, Nicholls HT, Willmes DM, et al. Obesity-induced CerS6-dependent C16:0 ceramide production promotes weight gain and glucose intolerance. Cell Metab. 2014;20(4):678-86. doi:10.1016/j.cmet.2014.08.002.
9. Chathoth S, Ismail MH, Alghamdi HM, et al. Insulin resistance induced by de novo pathway-generated C16-ceramide is associated with type 2 diabetes in an obese population. Lipids Health Dis. 2022;21:24. doi:10.1186/s12944-022-01634-w.
10. Park TS, Rosebury W, Kindt EK, et al. Serine palmitoyltransferase inhibitor myriocin induces the regression of atherosclerotic plaques in hyperlipidemic ApoE-deficient mice. Pharmacol Res. 2008;58(1):45-51. doi:10.1016/j.phrs.2008.06.005.
11. McGurk KA, Keavney BD, Nicolaou A, et al. Circulating ceramides as biomarkers of cardiovascular disease: Evidence from phenotypic and genomic studies. Atherosclerosis. 2021;327:18-30. doi:10.1016/j.atherosclerosis.2021.04.021.
12. Mantovani A, Bonapace S, Lunardi G, et al. Associations between specific plasma ceramides and severity of coronary-artery stenosis assessed by coronary angiography. Diabetes Metab. 2020;46(2):150-7. doi:10.1016/j.diabet.2019.07.006.
13. Li Y, Talbot CL, Chaurasia B. Ceramides in Adipose Tissue. Front. Endocrinol. 2020;11:407. doi:10.3389/fendo.2020.00407.
14. Tidhar R, Zelnik ID, Volpert G, et al. Eleven residues determine the acyl chain specificity of ceramide synthases. J. Biol. Chem. 2018;287:3197-206. doi:10.1074/jbc.RA118.001936.
15. Shah C, Yang G, Lee I, et al. Protection from high fat diet-induced increase in ceramide in mice lacking plasminogen activator inhibitor 1. J Biol Chem. 2008;283(20):13538-48. doi:10.1074/jbc.M709950200.
16. Chaurasia B, Kaddai VA, Lancaster GI, et al. Adipocyte Ceramides Regulate Subcutaneous Adipose Browning, Inflammation, and Metabolism. Cell Metab. 2016;24(6): 820-34. doi:10.1016/j.cmet.2016.10.002.
17. Choi RH, Tatum SM, Symons JD, et al. Ceramides and other sphingolipids as drivers of cardiovascular disease. Nat Rev Cardiol. 2021;18(10):701-11. doi:10.1038/s41569-021-00536-1.
18. Błachnio-Zabielska AU, Baranowski M, Hirnle T, et al. Increased bioactive lipids content in human subcutaneous and epicardial fat tissue correlates with insulin resistance. Lipids. 2012;47(12):1131-41. doi:10.1007/s11745-012-3722-x.
19. Goossens GH. The role of adipose tissue dysfunction in the pathogenesis of obesity-related insulin resistance. Physiol Behav. 2008;94:206-18. doi:10.1016/j.physbeh.2007.10.010.
20. Ginkel C, Hartmann D, vom Dorp K, et al. Ablation of neuronal ceramide synthase 1 in mice decreases ganglioside levels and expression of myelin-associated glycoprotein in oligodendrocytes. J Biol Chem. 2012;287(50):41888-902. doi:10.1074/jbc.M112.413500.
21. Kim YR, Lee EJ, Shin KO, et al. Hepatic triglyceride accumulation via endoplasmic reticulum stress-induced SREBP-1 activation is regulated by ceramide synthases. Exp Mol Med. 2019;51(11):1-16. doi:10.1038/s12276-019-0340-1.
22. Goldenberg JR, Carley AN, Ji R, et al. Preservation of Acyl Coenzyme A Attenuates Pathological and Metabolic Cardiac Remodeling Through Selective Lipid Trafficking. Circulation. 2019;139(24):2765-77. doi:10.1161/CIRCULATIONAHA.119.039610.
23. Laviad EL, Albee L, Pankova-Kholmyansky I, et al. Characterization of ceramide synthase 2: tissue distribution, substrate specificity, and inhibition by sphingosine 1-phosphate. J biol chem. 2008;283:5677-84. doi:10.1074/jbc.M707386200.
24. Atilla-Gokcumen GE, Muro E, Relat-Goberna J, et al. Dividing cells regulate their lipid composition and localization. Cell. 2014;156(3):428-39. doi:10.1016/j.cell.2013.12.015.
25. Law BA, Liao X, Moore KS, et al. Lipotoxic very-long-chain ceramides cause mitochondrial dysfunction, oxidative stress, and cell death in cardiomyocytes. FASEB J. 2018;32(3):1403-16. doi:10.1096/fj.201700300R.
26. Gosejacob D, Jäger PS, Vom Dorp K, et al. Ceramide Synthase 5 Is Essential to Maintain C16:0-Ceramide Pools and Contributes to the Development of Diet-induced Obesity. The Journal of biological chemistry. 2016;291(13):6989-7003. doi:10.1074/jbc.M115.691212.
27. Kolak M, Gertow J, Westerbacka J, et al. Expression of ceramide-metabolising enzymes in subcutaneous and intra-abdominal human adipose tissue. Lipids Health Dis. 2012;11: 115. doi:10.1186/1476-511X-11-115.
28. Devlin CM, Lahm T, Hubbard WC, et al. Dihydroceramide-based response to hypoxia. J Biol Chem. 2011;286(44):38069-78. doi:10.1074/jbc.M111.297994.
Об авторах
О. В. ГруздеваРоссия
Груздева Ольга В. — доктор медицинских наук, доцент, профессор РАН, заведующий лабораторией исследований гомеостаза отдела экспериментальной медицины.
Кемерово
Конфликт интересов:
нет конфликта интересов
Ю. А. Дылева
Россия
Дылева Юлия А. — кандидат медицинских наук, старший научный сотрудник лаборатории исследований гомеостаза отдела экспериментальной медицины.
Кемерово
Конфликт интересов:
нет конфликта интересов
Е. В. Белик
Россия
Екатерина Владимировна Белик — кандидат медицинских наук, научный сотрудник лаборатории исследований гомеостаза отдела экспериментальной медицины.
Кемерово
Конфликт интересов:
нет конфликта интересов
Е. Г. Учасова
Россия
Учасова Евгения Г. — кандидат медицинских наук, старший научный сотрудник лаборатории исследований гомеостаза отдела экспериментальной медицины
Кемерово
Конфликт интересов:
нет конфликта интересов
А. В. Понасенко
Россия
Понасенко Анастасия В. — кандидат медицинских наук, заведующий лабораторией геномной медицины отдела экспериментальной медицины
Кемерово
Конфликт интересов:
нет конфликта интересов
Е. Е. Горбатовская
Россия
Горбатовская Евгения Е. — лаборант-исследователь лаборатории исследований гомеостаза отдела экспериментальной медицины
Кемерово
Конфликт интересов:
нет конфликта интересов
Е. В. Фанаскова
Россия
Фанаскова Елена В. — кандидат медицинских наук, заведующий трансфузиологическим кабинетом
Кемерово
Конфликт интересов:
нет конфликта интересов
С. В. Иванов
Россия
Иванов Сергей В. — доктор медицинских наук, ведущий научный сотрудник лаборатории реконструктивной хирургии мультифокального атеросклероза
Кемерово
Конфликт интересов:
нет конфликта интересов
А. Н. Стасев
Россия
Стасев Александр Н. — кандидат медицинских наук, научный сотрудник лаборатории пороков сердца.
Кемерово
Конфликт интересов:
нет конфликта интересов
М. Г. Зинец
Россия
Зинец Максим Г. — врач-кардиохирург отделения кардиохирургии, лаборатория рентген-эндоваскулярной и реконструктивной хирургии сердца и сосудов.
Кемерово
Конфликт интересов:
нет конфликта интересов
О. Л. Барбараш
Россия
Барбараш Ольга Л. — доктор медицинских наук, профессор, академик РАН, директор ФГБНУ.
Кемерово
Конфликт интересов:
нет конфликта интересов
Дополнительные файлы
Рецензия
Для цитирования:
Груздева О.В., Дылева Ю.А., Белик Е.В., Учасова Е.Г., Понасенко А.В., Горбатовская Е.Е., Фанаскова Е.В., Иванов С.В., Стасев А.Н., Зинец М.Г., Барбараш О.Л. Сравнительная оценка экспрессии ферментов пути синтеза церамидов de novo в жировой ткани сердца и сосудов пациентов с сердечно-сосудистыми заболеваниями. Российский кардиологический журнал. 2022;27(12):5281. https://doi.org/10.15829/1560-4071-2022-5281
For citation:
Gruzdeva O.V., Dyleva Yu.A., Belik E.V., Uchasova E.G., Ponasenko A.V., Gorbatovskaya E.E., Fanaskova E.A., Ivanov S.V., Stasev A.N., Zinets M.G., Barbarash O.L. Comparative evaluation of the expression of enzymes of the ceramide de novo synthesis pathway in cardiac adipose tissue and blood vessels of cardiovascular patients. Russian Journal of Cardiology. 2022;27(12):5281. (In Russ.) https://doi.org/10.15829/1560-4071-2022-5281
JATS XML

















































