Перейти к:
Профибротические генетические полиморфизмы как возможные факторы риска развития диастолической дисфункции у больных с эпикардиальным ожирением
https://doi.org/10.15829/1560-4071-2022-5208
Аннотация
Цель. Определить наличие ассоциаций вариабельных сайтов генов фиброгенеза с риском развития диастолической дисфункции (ДД) левого желудочка (ЛЖ) у пациентов с эпикардиальным ожирением (ЭО).
Материал и методы. В исследование включен 101 мужчина с общим ожирением (Алтайский край) без сердечно-сосудистых заболеваний, сахарного диабета и диагностированной ДД ЛЖ, из которых после определения толщины эпикардиального жира (тЭЖТ) сформировано 2 группы: с ЭО (ЭО+), тЭЖТ ≥7 мм, n=70 и 2 группа без ЭО (ЭО-), тЭЖТ <7 мм, n=31. Контрольная группа сформирована из жителей Кемеровской области соответствующего пола и возраста без сердечно-сосудистых заболеваний в анамнезе и без общего ожирения. Всем пациентам с помощью полимеразной цепной реакции определялись полиморфные варианты генов MMP9 rs17576, TGFB1 rs1800469, MMP3 rs6796620, MMP3 rs626750, MMP1 rs514921, LOC101927143 rs4290029, TIMP2 rs2277698. Спустя 4,7±0,3 лет всем пациентам с общим ожирением проводилась повторно эхокардиография для оценки ДД ЛЖ.
Результаты. Выявлено, что в группе с ЭО для rs626750 MMP3 в 2 раза чаще встречается носительство аллеля Т в гомозиготном состоянии (рецессивная модель наследования, р=0,0022). Через 4,7±0,3 лет ДД ЛЖ зарегистрирована у 18 пациентов в группе ЭО+ и у 2 из группы ЭО-. При проведении анализа моделей наследования, а также сравнения генотипов в группах пациентов с ЭО с развившейся ДД ЛЖ (n=20) и без ДД ЛЖ (n=78) выявлено, что у пациентов с ЭО и развившейся ДД ЛЖ в 3,4 раза чаще встречается носительство аллеля Т в гомозиготном состоянии (рецессивная модель наследования, р=0,02) для rs1800469 TGFB1.
Заключение. У пациентов с ЭО и развившейся ДД ЛЖ чаще встречается носительство аллеля Т rs1800469 TGFB1, что, вероятно, вносит вклад в формирование кардиофиброза и в развитие ДД ЛЖ по рецессивной модели наследования.
Для цитирования:
Гриценко О.В., Чумакова Г.А., Груздева О.В., Понасенко А.В., Барбараш О.Л. Профибротические генетические полиморфизмы как возможные факторы риска развития диастолической дисфункции у больных с эпикардиальным ожирением. Российский кардиологический журнал. 2022;27(10):5208. https://doi.org/10.15829/1560-4071-2022-5208
For citation:
Gritsenko O.V., Chumakova G.A., Gruzdeva O.V., Ponasenko A.V., Barbarash O.L. Profibrotic genetic polymorphisms as possible risk factors for the development of diastolic dysfunction in patients with epicardial adiposity. Russian Journal of Cardiology. 2022;27(10):5208. (In Russ.) https://doi.org/10.15829/1560-4071-2022-5208
На протяжении длительного времени сердечная недостаточность (СН) воспринималась врачами как клинический синдром, обусловленный нарушением сократительной (систолической) функции левого желудочка (ЛЖ), когда он не в состоянии обеспечить должную величину минутного объема крови, необходимую для адекватного функционирования органов и систем в покое и при физической нагрузке [1]. Однако в настоящее время пришло понимание, что в патогенезе развития СН лежит не только нарушение гемодинамики, а снижение систолической функции ЛЖ не является приоритетным предиктором развития клинической картины СН. Одной из причиной развития СН является нарушение диастолической функции ЛЖ. Известно, что СН многофакторное заболевание. Помимо кардиомиоцит-ориентированного представления о СН, в настоящее время принято считать, что изменения в экстрацеллюлярном матриксе и коронарной микроциркуляции также играют важную роль в развитии патологического структурного ремоделирования миокарда и фиброза, которое патофизиологически определяет механизм развития СН [2]. При этом отсутствуют данные о генетической основе формирования приобретенной СН, но имеются представления о роли генетических факторов для многих семейных кардиомиопатий, наследование которых соответствует менделевскому. Кроме того, в действующих рекомендациях отсутствуют алгоритмы по ведению пациентов с СН. Таким образом, понимание не только молекулярных, но и генетических механизмов формирования фиброза миокарда позволит разработать новую стратегию ведения пациентов с кардиофиброзом. Данных о вкладе конкретного генетического полиморфного варианта в риск развития фиброза миокарда у пациентов с ожирением, в т.ч. с висцеральным, в литературе крайне мало.
Таким образом, целью настоящего исследования является определить наличие ассоциаций вариабельных сайтов генов фиброгенеза с риском развитием диастолической дисфункции (ДД) ЛЖ у пациентов с эпикардиальным ожирением (ЭО).
Материал и методы
В рамках когортного исследования, проведенного с 2016 по 2017гг на базе КГБУЗ "Алтайский краевой кардиологический диспансер", последовательно включен 101 мужчина с общим ожирением. При обращении в диспансер пациенты предъявляли жалобы на боли в грудной клетке, однако при детальном исследовании каких-либо сердечно-сосудистых заболеваний диагностировано не было.
Исследование было выполнено в соответствии со стандартами надлежащей клинической практики (Good Clinical Practice) и принципами Хельсинкской декларации. Протокол исследования одобрен Локальным этическим комитетом учреждения. До включения в исследование у всех пациентов получено письменное информированное согласие.
Основным критерием включения пациентов в исследование являлось наличие общего ожирения (индекс массы тела ≥30 кг/м2). Критериями исключения пациентов из исследования было наличие какой-либо сердечно-сосудистой патологии и наличие ДД ЛЖ по результатам трансторакальной эхокардиографии (ЭхоКГ). С целью исключения артериальной гипертензии (в т.ч. маскированных форм) проводилось суточное мониторирование артериального давления. Для исключения атеросклеротического поражения коронарных артерий по показаниям проводилась либо мультиспиральная компьютерная томография коронарных артерий, либо коронароангиография.
ЭхоКГ выполнена с помощью ультразвуковой системы VIVID Е95 (GE, Healthcare, США) секторным фазированным датчиком М5Sс 1,5-4,5 МГц. С целью изучения ДД ЛЖ определяли следующие параметры ЭхоКГ: скорость продольного удлинения ЛЖ в ранней диастоле по скорости движения митрального кольца, e’, отношение скорости E трансмитрального диастолического потока к средней скорости движения митрального кольца E/e’, индекс объема левого предсердия и максимальную скорость трикуспидальной регургитации, индекс массы ЛЖ и относительную толщину ЛЖ [3]. Все показатели были получены в соответствии с рекомендациями Европейской ассоциации эхокардиографии и Американского общества эхокардиографии 2016г [4].
Контрольная группа была сформирована лицами соответствующего пола (все мужчины) и возраста (средний возраст — 52,9±7,5 лет) без сердечно-сосудистых заболеваний в анамнезе и без ожирения (n=295). Пациенты с общим ожирением — население Алтайского края, контрольная — население Кемеровской области. Все участники из контрольной и опытной групп относились к славянскому населению.
С помощью трансторакальной ЭхоКГ у пациентов оценивалось наличие висцерального ожирения по толщине эпикардиальной жировой ткани (тЭЖТ). Линейную тЭЖТ измеряли перпендикулярно свободной стенке правого желудочка в конце систолы, учитывали среднее значение трех сердечных циклов для каждого ЭхоКГ-изображения. В качестве анатомического ориентира использовалось кольцо аорты. ЭхоКГ-исследование тЭЖТ проводилось из парастернальной позиции по длинной оси [5].
С учетом проведенного ЭхоКГ-исследования из лиц опытной группы с общим ожирением (n=101) выделены: 1 группа с ЭО (ЭО+), тЭЖТ ≥7 мм, n=70 и 2 группа без ЭО (ЭО-), тЭЖТ <7 мм, n=31. Спустя 4,7±0,3 лет пациентам проводилась повторно ЭхоКГ для оценки диастолической функции ЛЖ. Выявлено, что у 20 пациентов с ЭО имеется нарушение диастолической функции ЛЖ, из них 18 пациентов в группе ЭО+, а 2 — пациенты из группы ЭО-.
Генотипирование проводили из материала всех включенных в исследование лиц по семи полиморфным (SNV) сайтам (MMP9 rs17576, TGFB1 rs1800469, MMP3 rs6796620, MMP3 rs626750, MMP1 rs514921, LOC101927143 rs4290029, TIMP2 rs2277698). Данные SNV, локализованные в генах MMP9, TGFB1, MMP3, MMP1, LOC101927143, TIMP2, выбраны в связи с тем, что ранее было показано изменение их экспрессии при заболеваниях, связанных с фиброзом различных органов и тканей, в т.ч. миокарда [6]. В качестве материала для исследования использовалась выделенная из венозной крови ДНК. ДНК выделяли методом фенол-хлороформной экстракции по стандартному протоколу. До проведения генотипирования ДНК хранили при температуре -20° С. Молекулярно-генетическое исследование проводили методом полимеразной цепной реакции, которую проводили с использованием термоциклера с детекцией флуоресценции амплификации нуклеиновых кислот в режиме "реального времени" CFX96 Optics Module (Bio-Rad Laboratories, Сингапур). Наборы зондов для генотипирования в режиме "реального времени" произведены компанией "ДНК-Синтез" (Россия). Для исключения ошибок генотипирования 10% случайно выбранных образцов повторно тестировали, при этом сотрудник лаборатории не располагал информацией о тестируемых образцах.
Статистический анализ проводили с помощью пакета программ для научно-технических расчетов STATISTICA версии 13.0 (StatSoft, Inc., США) и SNPStats. Для подтверждения независимого распределения аллелей в изучаемых полиморфизмах проверяли его на соответствие закону Харди-Вайнберга. Проводилось сравнение изучаемых групп по пяти возможным моделям наследования (кодоминантной, доминантной, рецессивной, сверхдоминантной и логаддитивной), отражающим различные варианты сравнения генотипов. При наименьшем значении информационного критерия Акаике определялась наиболее вероятная модель наследования для каждого конкретного случая. Возможное влияние генотипа на признак оценивали, определяя отношение шансов и 95% доверительные интервалы. Критическое значение уровня значимости принимали равным 0,05.
Исследование выполнено за счет гранта Российского научного фонда № 22-15-00305 "Патофизиологические особенности формирования остеосаркопенического ожирения при мультифокальном атеросклерозе как маркера биологического старения".
Результаты
Клиническая характеристика пациентов, включенных в исследование, представлена в таблице 1. Пациенты выделенных групп ЭО+ и ЭОне имели отличий по возрасту, индексу массы тела, уровню систолического и диастолического давления, окружности талии и окружности бедер. При этом в группе с ЭО тЭЖТ была статистически значимо больше, чем в группе без ЭО в 1,8 раза, р<0,0001.
Таблица 1
Клиническая характеристика пациентов, включенных в исследование
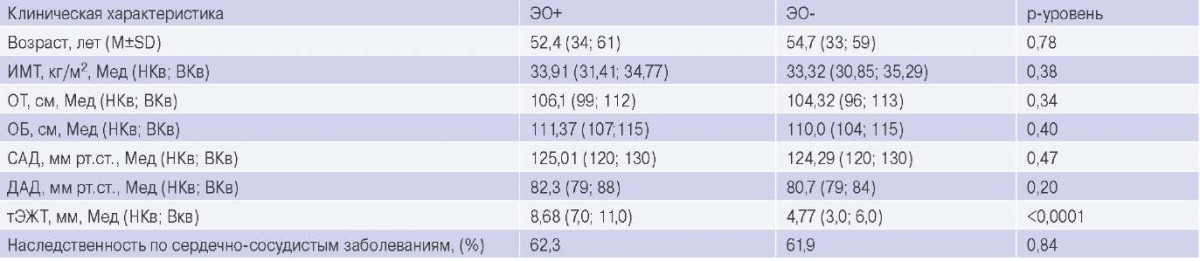
Сокращения: ДАД — диастолическое артериальное давление, ИМТ — индекс массы тела, ОБ — окружность бедер, ОТ — окружность талии, САД — систолическое артериальное давление, тЭЖТ — толщина эпикардиальной жировой ткани, ЭО — эпикардиальное ожирение.
В проведенных ранее исследованиях нами показано, что висцеральное ожирение характеризуется значимыми метаболическими нарушениями, происходит изменение уровней адипоцитокиновых факторов, участвующих в формировании липотоксического поражения миокарда, и существенно меняется профибротический статус [7]. Также у этих пациентов имеются нарушения механики ЛЖ как проявление раннего нарушения диастолической функции ЛЖ (при отсутствии ДД ЛЖ по данным трансторакальной ЭхоКГ с определением традиционных показателей) [8]. В связи с этим в данном исследовании нами проводился поиск ассоциаций полиморфных вариантов генов фиброгенеза с риском развития ДД ЛЖ именно у пациентов с ЭО.
Не выявлено отклонений в распределении аллелей и генотипов исследуемых полиморфизмов от равновесия Харди-Вайнберга в группе сравнения. У пациентов с ЭО равновесие Харди-Вайнберга для всех полиморфизмов не соблюдалось, что не являлось технической ошибкой, а характеризует данную выборку.
Проведен анализ распространенности генотипов и моделей наследования в группе с ЭО (n=70) в сравнении с контрольной группой (n=295). Результаты данного анализа представлены в таблице 2. Выявлено, что в группе с ЭО в 2 раза чаще встречается носительство гомозиготного генотипа Т/Т (рецессивная модель наследования, р=0,002) в позиции rs626750 MMP3 в группе с ЭО.
Таблица 2
Анализ распространенности генотипов профибротических полиморфных вариантов генов и моделей наследования в группе с ЭО в сравнении с контрольной группой
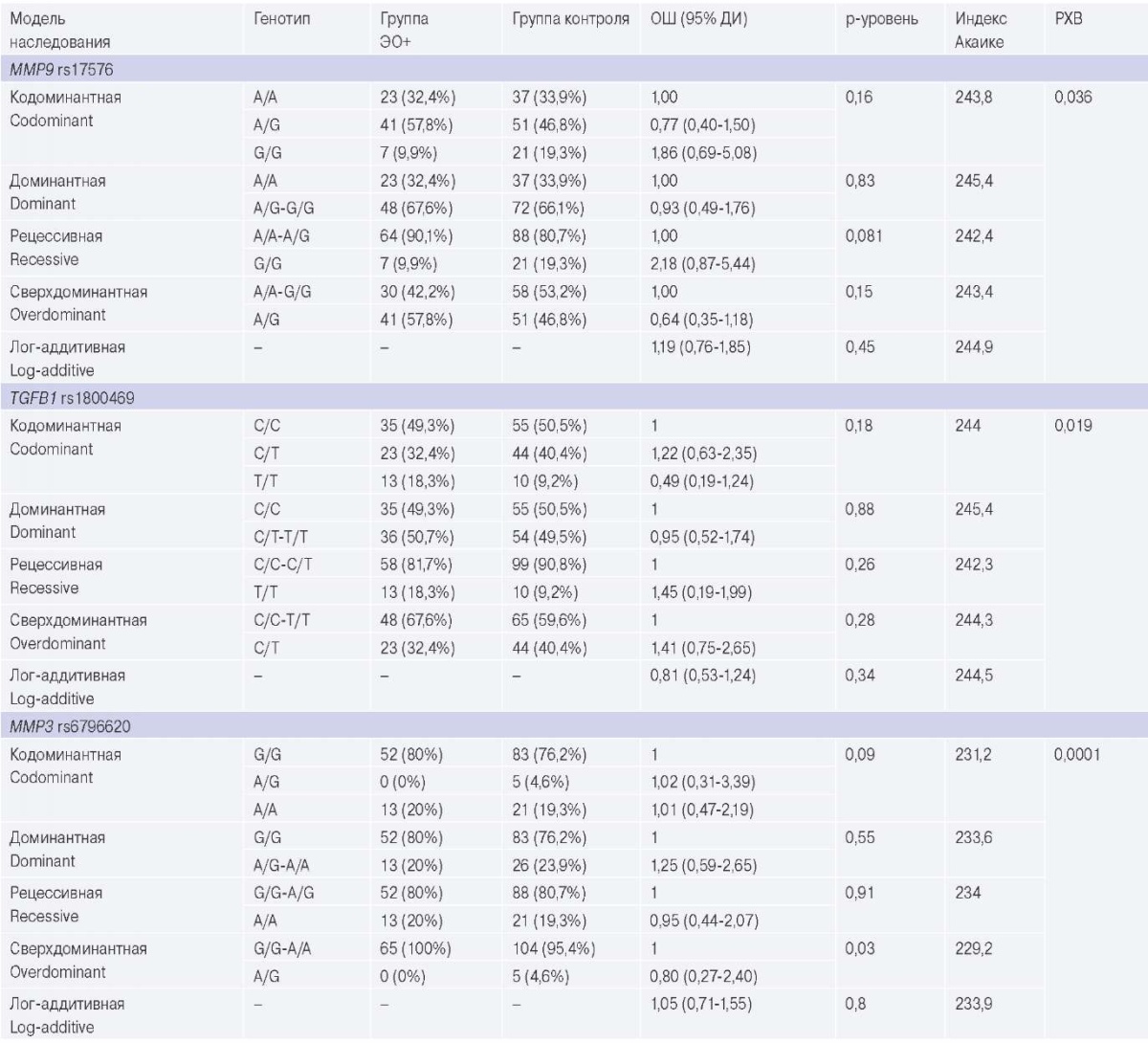

Сокращения: ДИ — доверительный интервал, ОШ — отношение шансов, РХВ — равновесие Харди-Вайнберга, ЭО — эпикардиальное ожирение.
Затем через 4,7±0,3 года пациентам с общим ожирением была проведена ЭхоКГ для повторной оценки диастолической функции ЛЖ. В динамике ЭхоКГ не проведена трем пациентам по причине выбытия пациентов из исследования. По результатам ЭхоКГ выявлено: индекс объема левого предсердия 35,04 [ 33,0; 39,7] мл/м2, Е 0,89 [ 0,98; 0,84] м/с, e’ 0,09 [ 0,09; 0,11] см/с, E/e’ 9,19 [ 10,0; 8,18] усл. ед., максимальная скорость трикуспидальной регургитации 2,66 [ 2,35; 2,88] м/с. У 20 пациентов зарегистрировано нарушение диастолической функции ЛЖ, из них 18 пациентов в группе с ЭО, 2 пациента из группы без ЭО.
При проведении анализа моделей наследования, а также сравнении генотипов в группах пациентов с ЭО с развившейся ДД ЛЖ (n=18) и без ДД ЛЖ (n=52) выявлено, что у пациентов с ЭО и развившейся ДД ЛЖ в 3,4 раза чаще встречается носительство аллеля Т в гомозиготном состоянии (рецессивная модель наследования, р=0,02) rs1800469 TGFB1, таблица 3.
Таблица 3
Сравнительный анализ моделей наследования и сравнение вариантов генотипов в группах ЭО+ и ЭО-
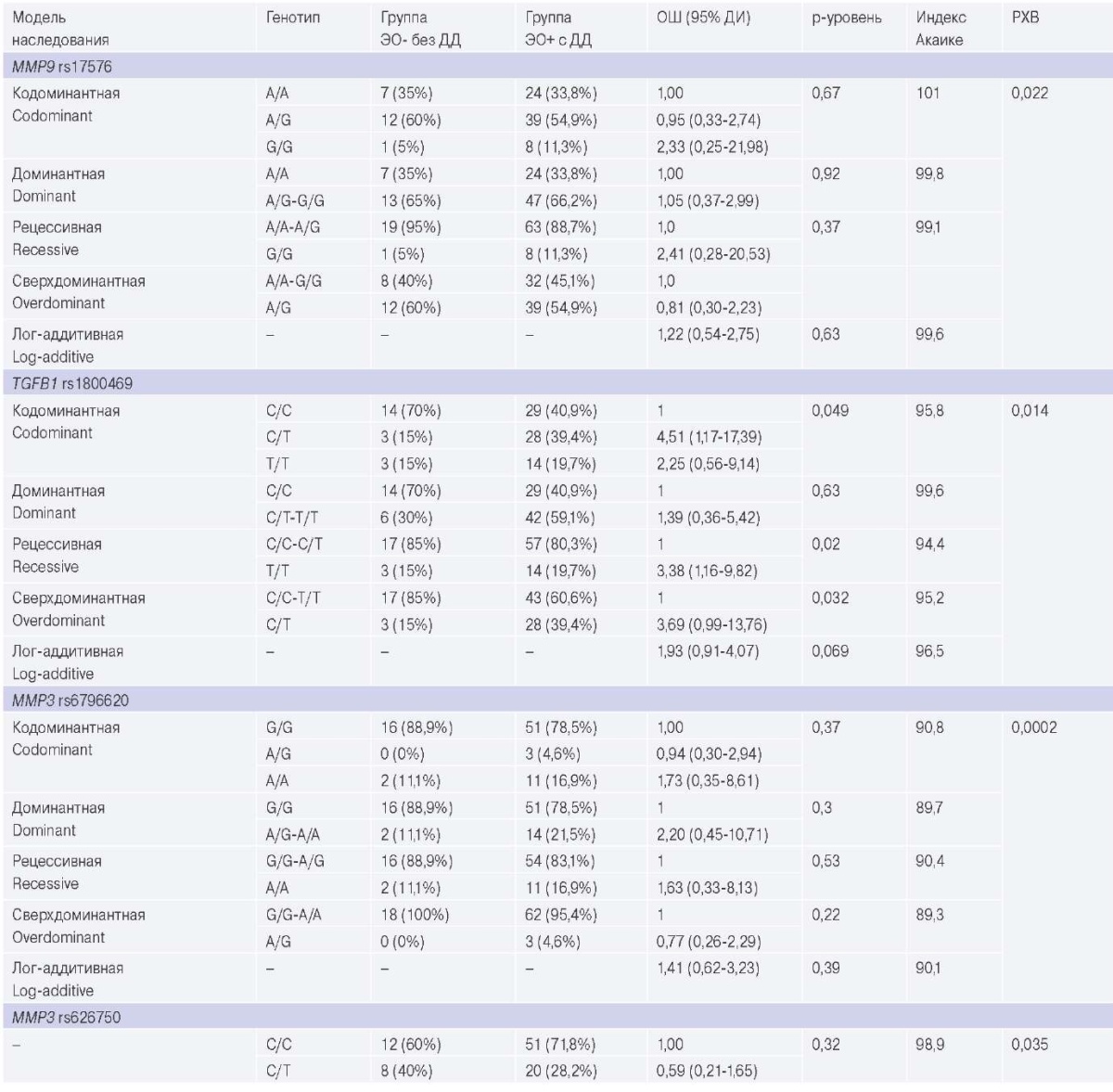
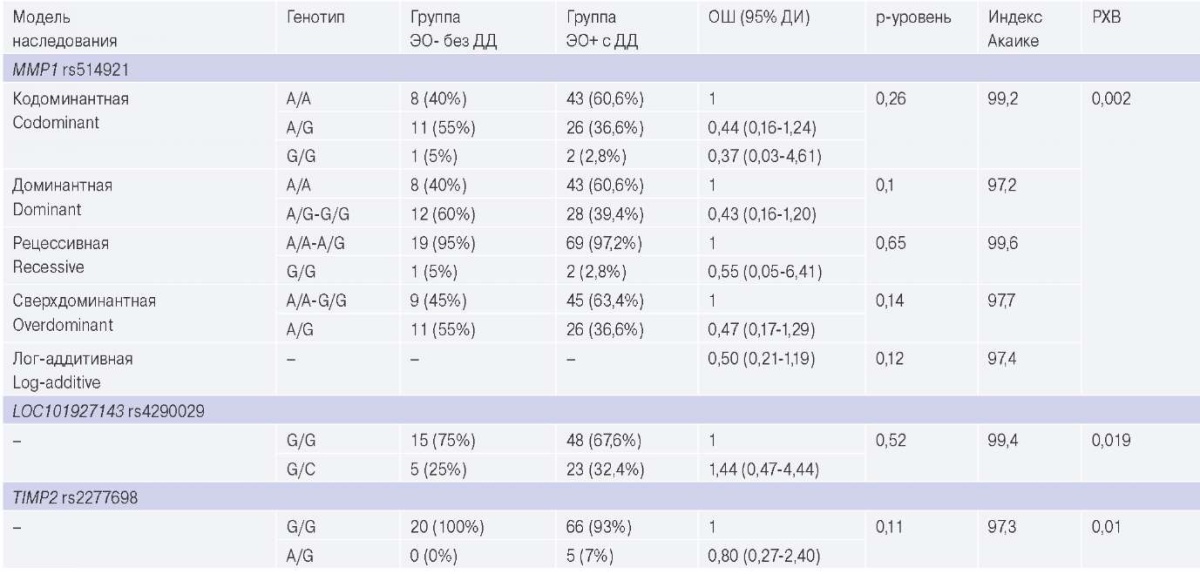
Сокращения: ДД — диастолическая дисфункция, ДИ — доверительный интервал, ОШ — отношение шансов, РХВ — равновесие Харди-Вайнберга, ЭО — эпикардиальное ожирение.
Обсуждение
Исследования генетических ассоциаций СН были весьма противоречивыми; может иметь место взаимодействие или синергизм нескольких генетических вариантов, которые вместе приводят к конечному патологическому фенотипу для СН. Понимание роли, которую генетические варианты играют в развитии СН, имеет важное значение для индивидуальных профилактических и терапевтических стратегий.
В данном исследовании выявлено, что у пациентов с ЭО для гена MMP3 в сайте rs626750 в 2 раза чаще встречается носительство аллеля Т в гомозиготном состоянии (рецессивная модель наследования, р=0,0022). Имеются данные об однонуклеотидных полиморфизмах, которые происходят в областях промотора MMP, которые связаны с общими уровнями MMP и влияют на сердечно-сосудистые исходы [9]. Полиморфный вариант MMP-3 считается регулятором в развитии инфаркта миокарда и исходов СН [10]. Изучалось влияние MMP-3 на выживаемость у пациентов с СН с ишемической и неишемической кардиомиопатией, и выявлено, что оно различается. Аллель 6A MMP-3 является независимым предиктором сердечной смертности у пациентов с неишемической СН. Напротив, нет доказательств какого-либо влияния генотипа сайта -1171 на сердечные события у пациентов с ишемической кардиомиопатией [10].
В динамике через 4,7±0,3 года ДД ЛЖ выявлена у 18 пациентов в группе с ЭО и у 2 в группе без ЭО. При анализе моделей наследования, а также сравнении генотипов в группах пациентов с ЭО с развившейся ДД ЛЖ (n=18) и у пациентов без ЭО и без ДД ЛЖ (n=52) выявлено, что у пациентов с ЭО и развившейся ДД ЛЖ в 3,4 раза чаще встречается носительство аллеля Т в гомозиготном состоянии (рецессивная модель наследования, р=0,02) для rs1800469 TGFB1, что вносит вклад в формирование профибротического статуса с последующим развитием кардиофиброза и ДД ЛЖ. Данных о влиянии полиморфизма TGFB1 на развитие фиброза миокарда крайне мало, имеются лишь единичные данные, полученные на ограниченных выборках. Так, в одном из исследований, проведенном на смешанной популяции западной части России, проанализирована генетическая предрасположенность к фиброзу миокарда у реципиентов трансплантата сердца, и обнаружены значимые ассоциации между этим признаком и носительством минорного аллеля TGFB1 s1800470 [11].
Дальнейшие исследования на большем количестве пациентов позволят получить более подробные характеристики влияния полиморфизмов одного нуклеотида на формирование фиброза у пациентов с ожирением.
Ограничения исследования. Потенциальные ограничения настоящего исследования при оценке ассоциаций полиморфных вариантов генов фиброгенеза с развитием ДД ЛЖ у пациентов с ожирением включают ограниченную выборку пациентов, включением пациентов только мужского пола, проведением исследования в одном центре.
Заключение
В настоящем исследовании выявлены различия во встречаемости носительства аллеля Т в гомозиготном состоянии (рецессивная модель наследования) для rs626750 MMP3 у пациентов с ЭО в сравнении с контрольной группой. Также выявлено, что у пациентов с ЭО, у которых развилась ДД ЛЖ, чаще встречается носительство аллеля Т (рецессивная модель наследования) гена TGFB1 rs1800469, что, вероятно, вносит вклад в формирование кардиофиброза и развития ДД ЛЖ.
Отношения и деятельность. Исследование выполнено за счет гранта Российского научного фонда № 22-15-00305 "Патофизиологические особенности формирования остеосаркопенического ожирения при мультифокальном атеросклерозе как маркера биологического старения".
Список литературы
1. Гаврюшина С.В., Агеев Ф.Т. Сердечная недостаточность с сохраненной фракцией выброса левого желудочка: эпидемиология, "портрет" больного, клиника, диагностика. Кардиология. 2018;58(4S):55-64. doi:10.18087/cardio.2467.
2. Печерина Т.Б., Кутихин А.Г. Биомаркеры фиброза миокарда и их генетическое регулирование у пациентов с сердечной недостаточностью. Российский кардиологический журнал. 2020;25(10):3933. doi:10.15829/1560-4071-2020-3933.
3. Pieske B, Tschöpe C, de Boer RA. How to diagnose heart failure with preserved ejection fraction: the HFA-PEFF diagnostic algorithm: a consensus recommendation from the Heart Failure Association (HFA) of the European Society of Cardiology (ESC). Eur Heart J. 2019;40(40):3297-317. doi:10.1093/eurheartj/ehz641.
4. Mitchell C, Rahko PS, Blauwet LA. ASE Guidelines for Performing a Comprehensive Transthoracic Echocardiographic Examination in Adults: Recommendations from the American Society of Echocardiography. J Am Soc Echocardiogr. 2019;32(1):1-64. doi:10.1016/j.echo.2018.06.004.
5. Iacobellis G, Willens HJ. Echocardiographic Epicardial Fat: A Review of Research and Clinical Applications. JASE. 2009;22(12):1311-9. doi:10.1016/j.echo.2009.10.013.
6. Гончарова И.А., Печерина Т.Б., Марков А.В. и др. Роль генов фиброгенеза в формировании подверженности к коронарному атеросклерозу. Кардиология. 2018;58(8):33-44. doi:10.18087/cardio.2018.8.10160.
7. Гриценко О.В., Чумакова Г.А., Груздева О.В., Шевляков И.В. Взаимосвязь эпикардиального ожирения и уровней маркеров фиброза миокарда. Российский кардиологический журнал. 2019;(4):13-9. doi:10.15829/1560-4071-2019-4-13-19.
8. Гриценко О.В., Чумакова Г.А., Трубина Е.В. Возможности ранней диагностики фиброза миокарда у больных с эпикардиальным ожирением. Российский кардиологический журнал. 2021;26(3):4281. doi:10.15829/1560-4071-2021-4281.
9. Li T, Lv Z, Jing JJ, et al. Matrix metalloproteinase family polymorphisms and the risk of aortic aneurysmal diseases: A systematic review and meta-analysis. Clin Genet. 2018;93(1):15-32. doi:10.1111/cge.13050.
10. Velho FM, Cohen CR, Santos KG, et al. Polymorphisms of matrix metalloproteinases in systolic heart failure: Role on disease susceptibility, phenotypic characteristics, and prognosis. J Card Fail. 2011;17(2):115-21. doi:10.1016/j.cardfail.2010.09.017.
11. Gichkun OE, Shevchenko OP, Kurabekova RM, et al. The rs1800470 Polymorphism of the TGFB1 Gene Is Associated with Myocardial Fibrosis in Heart Transplant Recipients. Acta Naturae. 2021;13(4):42-6. doi:10.32607/actanaturae.11469.
Об авторах
О. В. ГриценкоРоссия
Гриценко Олеся Валерьевна — кандидат медицинских наук, младший научный сотрудник лаборатории исследований гомеостаза отдела экспериментальной медицины
Кемерово, Барнаул
Г. А. Чумакова
Чумакова Галина Александровна — доктор медицинских наук, профессор, профессор кафедры терапии и общей врачебной практики
Барнаул
О. В. Груздева
Груздева Ольга Викторовна — доктор медицинских наук, профессор, заведующий лабораторией исследований гомеостаза отдела экспериментальной медицины
Кемерово
А. В. Понасенко
Понасенко Анастасия Валериевна — кандидат медицинских наук, заведующий лабораторией геномной медицины отдела экспериментальной медицины
Кемерово
Конфликт интересов:
заведующая лабораторией геномной медицины отдела экспериментальной медицины, к.м.н.
О. Л. Барбараш
Барбараш Ольга Леонидовна — доктор медицинских наук, академик РАН, директор
Кемерово
Конфликт интересов:
директор
Дополнительные файлы
Рецензия
Для цитирования:
Гриценко О.В., Чумакова Г.А., Груздева О.В., Понасенко А.В., Барбараш О.Л. Профибротические генетические полиморфизмы как возможные факторы риска развития диастолической дисфункции у больных с эпикардиальным ожирением. Российский кардиологический журнал. 2022;27(10):5208. https://doi.org/10.15829/1560-4071-2022-5208
For citation:
Gritsenko O.V., Chumakova G.A., Gruzdeva O.V., Ponasenko A.V., Barbarash O.L. Profibrotic genetic polymorphisms as possible risk factors for the development of diastolic dysfunction in patients with epicardial adiposity. Russian Journal of Cardiology. 2022;27(10):5208. (In Russ.) https://doi.org/10.15829/1560-4071-2022-5208
JATS XML

















































