Перейти к:
Эффективность и безопасность имплантации окклюзирующих устройств ушка левого предсердия у больных с фибрилляцией предсердий и высоким тромбоэмболическим и геморрагическим риском
https://doi.org/10.15829/1560-4071-2022-5182
Аннотация
Цель. Сопоставить частоту тромбоэмболических и геморрагических событий после имплантации окклюдера ушка левого предсердия (УЛП) или при отсутствии профилактики тромбоэмболических осложнений (ТЭО) в ходе проспективного наблюдения за больными с фибрилляцией предсердий (ФП) и высоким риском ишемического инсульта (ИИ), имеющими противопоказания к длительной антикоагулянтной терапии.
Материал и методы. В исследование было включено 134 пациента с ФП, высоким риском ИИ и противопоказаниями к продленному приему антикоагулянтов. Пациенты были разделены на 2 группы: в первую группу были включены пациенты, которым была выполнена имплантация окклюдера УЛП (n=74), во вторую — пациенты, не получающие какой-либо профилактики ТЭО (n=60). Период наблюдения составил 3 года. В качестве первичной конечной точки эффективности была принята кумулятивная частота общей смертности, ИИ, транзиторных ишемических атак (ТИА), системных эмболий (СЭ). Первичная конечная точка безопасности включала в себя большие кровотечения по критериям регистра GARFIELD. Результаты. В течение периода наблюдения частота комбинированной конечной точки эффективности в группе имплантации окклюдера УЛП была достоверно ниже, чем в группе без профилактики ТЭО, составив 5,2 vs 17,4 на 100 пациенто-лет (скорректированное отношение шансов (ОШ) 4,08; 95% доверительный интервал (ДИ): 1,7-9,5; p=0,001). Частота больших кровотечений достоверно не различалась: 2,4 в группе имплантации окклюдера УЛП vs 1,3 на 100 пациенто-лет в группе без профилактики ТЭО (скорректированное ОШ 0,55; 95% ДИ: 0,1-3,09; p=0,509). Кроме того, частота событий чистой клинической выгоды (общая смертность + ИИ/ТИА/СЭ + большие кровотечения) в группе имплантации окклюдера УЛП достигалась достоверно реже, чем в группе отсутствия профилактики ТЭО, составив 5,9 vs 18,2 на 100 пациентолет (скорректированное ОШ 3,0; 95% ДИ: 1,47-6,36; p=0,003).
Заключение. Среди пациентов с ФП и противопоказаниями к длительной антикоагулянтной терапии через 3 года наблюдения имплантация окклюдера УЛП продемонстрировала достоверное снижение кумулятивной частоты смертности от всех причин и нефатальных ТЭО. При этом частота больших кровотечений оказалась сопоставимой между группами, даже с учетом кровотечений в месте доступа и ассоциированных с послеоперационной антитромботической терапией в группе окклюдера. Требуются дальнейшие рандомизированные клинические исследования для подтверждения данных наблюдений.
Ключевые слова
Для цитирования:
Певзнер Д.В., Семенова А.А., Кострица Н.С., Меркулова И.А., Комаров А.Л., Меркулов Е.В. Эффективность и безопасность имплантации окклюзирующих устройств ушка левого предсердия у больных с фибрилляцией предсердий и высоким тромбоэмболическим и геморрагическим риском. Российский кардиологический журнал. 2022;27(8):5182. https://doi.org/10.15829/1560-4071-2022-5182
For citation:
Pevzner D.V., Semenova A.А., Kostritsa N.S., Merkulova I.A., Komarov A.L., Merkulov E.V. Efficacy and safety of left atrial appendage closure in patients with atrial fibrillation and high thromboembolic and bleeding risk. Russian Journal of Cardiology. 2022;27(8):5182. (In Russ.) https://doi.org/10.15829/1560-4071-2022-5182
Фибрилляция предсердий (ФП) — одна из наиболее распространенных форм нарушений ритма сердца. Высокий риск тромбоэмболических осложнений (ТЭО) определяет необходимость антикоагулянтной терапии (АКТ) у большинства больных с данной патологией. Оптимизация контроля международного нормализованного отношения в эпоху терапии антагонистами витамина К и преимущественное использование в настоящее время прямых пероральных антикоагулянтов (ПОАК) не решили всех проблем защиты от тромбоэмболий. Приходится констатировать тот факт, что на практике не менее 10% больных, имеющих показания к антикоагулянтам, не получают такого лечения [1]. В большинстве случаев ограничения АКТ связаны с перенесенными кровотечениями или неприемлемо высоким риском их развития.
Факт невозможности приема АКТ у больных ФП способствовал разработке концепции “закрытия” окклюзирующими устройствами ушка левого предсердия (УЛП) как основного источника кардиоэмболий. Предполагалось, что окклюзия УЛП обеспечит возможность безопасного отказа от длительной АКТ. Действительно, опыт проспективных исследований PROTECT AF и PREVAIL [2][3] и последующих регистров CAP и CAP 2 [4], включивших в общей сложности 2406 больных ФП, продемонстрировал относительную низкую частоту кардиоэмболических осложнений после имплантации окклюзирующих устройств, сопоставимую с таковой у больных контрольной группы — не подвергавшихся вмешательству и получавших “стандартную” АКТ. Упомянутые исследования имели ряд отличий от реальной клинической практики. Так, подавляющее большинство включенных больных имело относительно невысокий риск инсульта и кровотечений. Кроме того, варфарин был единственным используемым антикоагулянтом (ПОАК не назначались). В мультицентровом рандомизированном исследовании PRAGUE-17 [5] и в крупном многоцентровом регистре EWOLUTION [6][7], которые включали в себя наиболее тяжелых с точки зрения коморбидного статуса пациентов, было продемонстрировано, что окклюзия УЛП не уступает ПОАК ни в плане эффективности профилактики ишемических событий, ни в плане рисков развития геморрагических осложнений.
Невзирая на все ограничения доказательной базы, эксперты Европейского общества кардиологов сочли разумным рассмотреть окклюзию УЛП у больных ФП, имеющих противопоказания к длительной терапии АКТ [8][9]. Заметим, что данная рекомендация, не претерпевшая каких-либо изменений в течение последних 10 лет, не носит обязательного характера (Класс IIb). С формальной точки зрения допускается возможность оставления обсуждаемой категории больных без какой бы то ни было защиты от инсульта.
В отличие от хорошо организованных исследований (см. выше), реальный контингент пациентов, у которых может обсуждаться окклюзия УЛП, закономерно характеризуется множеством сопутствующих заболеваний и высоким риском любых прогнозопределяющих негативных исходов, включая периоперационные осложнения, а также кровотечения в период обязательного назначения антикоагулянтов после вмешательства. К сожалению, исследования (регистры) реальной практики, в которых изучалась “чистая клиническая выгода” различных стратегий ведения больных ФП, имеющих противопоказания к длительной АКТ, немногочисленны, и вопрос о целесообразности имплантации окклюдера УЛП попрежнему остается открытым.
Цель нашего исследования — в рамках трехлетнего проспективного наблюдения за больными с ФП и высоким риском ишемического инсульта (ИИ), имеющими противопоказания к длительной АКТ, сопоставить частоту тромботических и геморрагических осложнений при имплантации окклюдера УЛП и при отсутствии профилактики кардиоэмболических осложнений.
Материал и методы
В период с 2011 по 2019гг в исследование включено 134 пациента старше 40 лет с ФП неклапанной этиологии и высоким риском ИИ, определяемым с использованием шкалы CHA2DS2-VASc. Протокол нашего исследования, форма информированного согласия одобрены Независимым этическим комитетом клинических исследований ФГБУ “НМИЦ кардиологии” МЗ РФ, протокол № 253 от 27.01.2020, исследование проводилось в соответствии с предусмотренными Хельсинкской Декларацией этическими принципами; все больные были осведомлены о порядке проведения исследования, после чего подписали информированное согласие.
Критериями включения в настоящее исследование были: документированный эпизод ФП длительностью не менее 30 сек, индекс CHA2DS2-VASc ≥3 для женщин, ≥2 для мужчин; согласие на проведение имплантации окклюдера УЛП, противопоказания к длительному приему антикоагулянтов или отказ пациента от такой терапии для подгруппы имплантации окклюзирующего УЛП устройства; информированное согласие на участие в исследовании.
Критерии невключения пациентов были следующие: проксимальный тромбоз глубоких вен правой нижней конечности, тромбоз УЛП (для подгруппы имплантации окклюдера), наличие механических протезов клапанов сердца, митрального стеноза выраженной или умеренной степени. Все включенные в исследование пациенты были обследованы согласно существующим стандартам. Проводились общеклиническое обследование (сбор анамнеза, физикальное обследование); рутинные клинические и биохимические лабораторные исследования, инструментальные исследования: электрокардиограмма; трансторакальная эхокардиография; суточное мониторирование электрокардиограммы по Холтеру. В рамках стратификации рисков использовались общепризнанные шкалы CHA2DS2-VASc и HAS-BLED, также осуществлялась оценка коморбидности с помощью индекса Чарлсона. Исходно пациенты были нами разделены на 2 группы:
1. Основная группа, в которую было включено 74 пациента, которым имплантация окклюдера была проведена ввиду наличия противопоказаний к приему АКТ. 2. Пациенты, не получающие профилактику ТЭО ни АКТ, ни с помощью изоляции УЛП (n=60). В данную группу включались пациенты как с противопоказаниями к АКТ и технической невозможностью имплантации окклюдера УЛП (n=24), так и пациенты, отказавшиеся от терапии вовсе (n=36).
В обеих группах частота различных противопоказаний была сопоставимой. Главенствующие позиции в структуре причин, ограничивающих прием АКТ (рис. 1) в исследуемых группах, занимают рецидивирующие малые кровотечения, приводившие к отказу больных от дальнейшей терапии АКТ — 37,6% и 33,7%, соответственно. Вторым по частоте в структуре противопоказаний явилось перенесенное ранее острое нарушение мозгового кровообращения по геморрагическому типу, частота которого в группе имплантации окклюдера составила 19,9%, в группе без профилактики ТЭО — 22,1%. Частота развития желудочно-кишечных кровотечений в группах прослеживалась в 16,3% и 18,5%, соответственно.
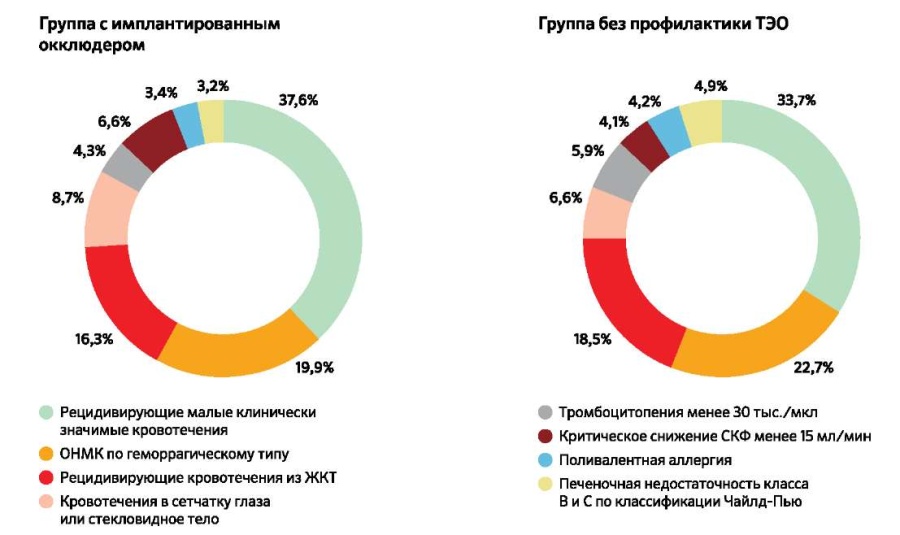
Рис. 1. Основные противопоказания к приему АКТ в исследуемых группах.
Сокращения: ЖКТ — желудочно-кишечный тракт, ОНМК — острое нарушение мозгового кровообращения, СКФ — скорость клубочковой фильтрации, ТЭО — тромбоэмболические осложнения.
В нашей работе были применены два вида окклюзирующих устройств — Watchman (Boston Scientific, Natwick, США) и Amplatzer Cardiac Plug в модификации Amulet (St Jude Medical, Plymouth, США). Технические аспекты и особенности вмешательства, периоперационного обследования подробно изложены в ранее опубликованной нами работе [10].
Режим антитромботической терапии (АТТ) после вмешательства устанавливался лечащим врачом в соответствии с клиническими данными пациента, в т.ч. риском развития кровотечений и типом имплантированного устройства. Структура АТТ для исследуемых групп представлена в таблице 1.
Таблица 1
Структура АТТ в группах с имплантированным окклюдером и без профилактики ТЭО
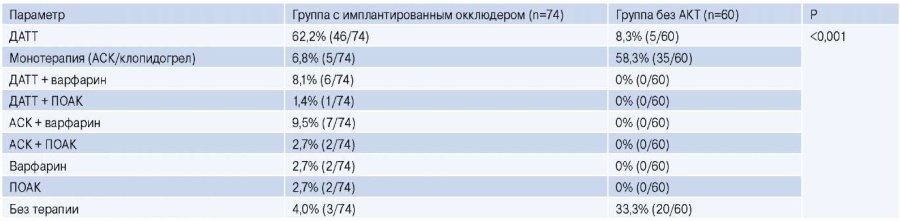
Сокращения: АКТ — антикоагулянтная терапия, АСК — ацетилсалициловая кислота, ДАТТ — двойная антитромботическая терапия, ПОАК — прямые пероральные антикоагулянты.
Нам представляется важным отразить как менялся за время наблюдения характер АТТ. Так, спустя 6 мес. после имплантации окклюдера, большинство пациентов получали двойную АТТ (ДАТТ) — 56,9% и монотерапию ацетилсалициловой кислотой (АСК) — 29,17%. Терапию ПОАК в сочетании с ДАТТ, комбинацию варфарина с ДАТТ получали 8,33% и 4,17%, соответственно. На момент последнего визита через 3 года 75% пациентов получали монотерапию АСК, 5,8% — комбинацию ПОАК с АТТ, 19,2% — не получали какой-либо АТТ. Характер АТТ после имплантации окклюдера на протяжении периода наблюдения представлен на рисунке 2.
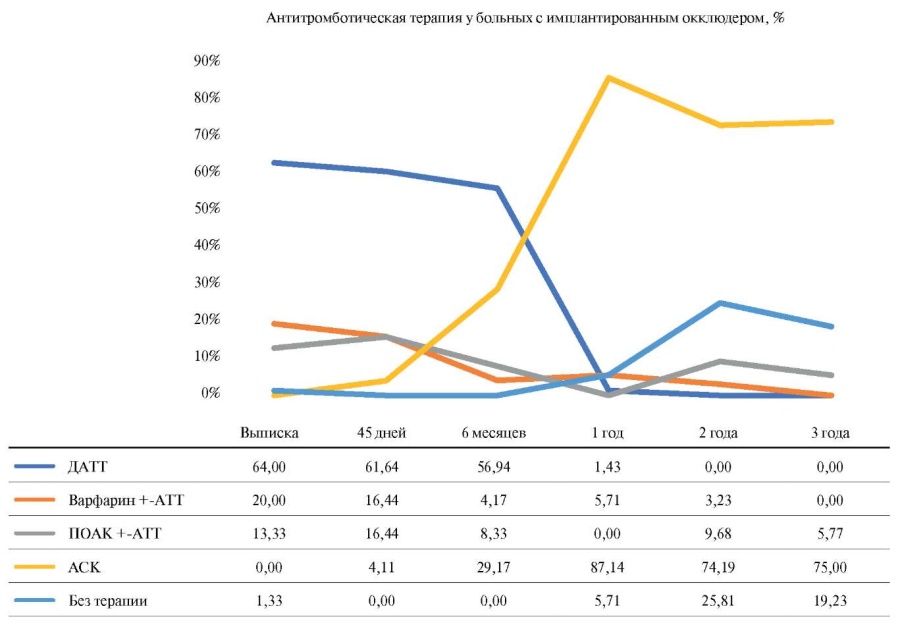
Рис. 2. Изменения АТТ на протяжении 3 лет наблюдения у пациентов с имплантированным окклюдером.
Сокращения: АСК — ацетилсалициловая кислота, АТТ — антитромботическая терапия, ДАТТ — двойная антитромботическая терапия, ПОАК — прямые пероральные антикоагулянты.
Медиана периода наблюдения — 130 нед. [ 104; 156]. Оценивались следующие события: ИИ/транзиторная ишемическая атака (ТИА)/системная эмболия (СЭ), кровотечения по критериям регистра GARFIELD, тампонада сердца, смерть от любых причин, а в группе имплантации окклюдера дополнительно — местные осложнения в области сосудистого доступа (гематомы, кровотечения, артерио-венозные фистулы, псевдоаневризмы), воздушная эмболия, повреждения пищевода.
Оценка неблагоприятных исходов проводилась в течение периода госпитализации, а также через 45 сут., 6 мес., 1 год, 2 года и 3 года от момента включения в исследование. В группе имплантации окклюдера регистрация событий осуществлялась на очных визитах через 45 сут. и через 6 мес. с оценкой результатов установки устройства посредством чреспищеводной эхокардиографии, а в группе сравнения — путем телефонных звонков, которые выполнялись каждые 6 мес. в обеих группах.
Статистическая обработка материала нашей работы осуществлялась посредством пакета программ IBM SPSS Statistics, версия 26. Для определения типа распределения количественных переменных использовали критерий Колмогорова-Смирнова с поправкой Лиллиефорса при n>50 и методом Шапиро-Уилка при n<50. Количественные переменные описывались в виде медианы и интерквартильного размаха. Сравнение количественных показателей проводилось с использованием критерия Манна-Уитни. При анализе номинальных показателей использовался критерий χ2. Для анализа зависимых совокупностей для непараметрических данных применялся критерий Вилкоксона. Кривые выживаемости построены с использованием метода Каплана-Мейера, а различия между группами оценены с помощью лог-ранк критерия Мантеля-Кокса. Различия считались статистически значимыми при уровне значимости p<0,05. Влияние различных клинических факторов риска (ФР) было скорректировано посредством построения модели пропорциональных рисков методом регрессии Кокса.
Результаты
Главной целью нашей работы являлся сравнительный анализ исходов двух групп больных с наличием противопоказаний к АКТ, которым имплантировался окклюдер УЛП (группа I), и пациентов без какой-либо профилактики ТЭО (группа II). Клинико-анамнестические данные пациентов представлены в таблице 2.
Таблица 2
Клинико-анамнестические данные пациентов групп I и II
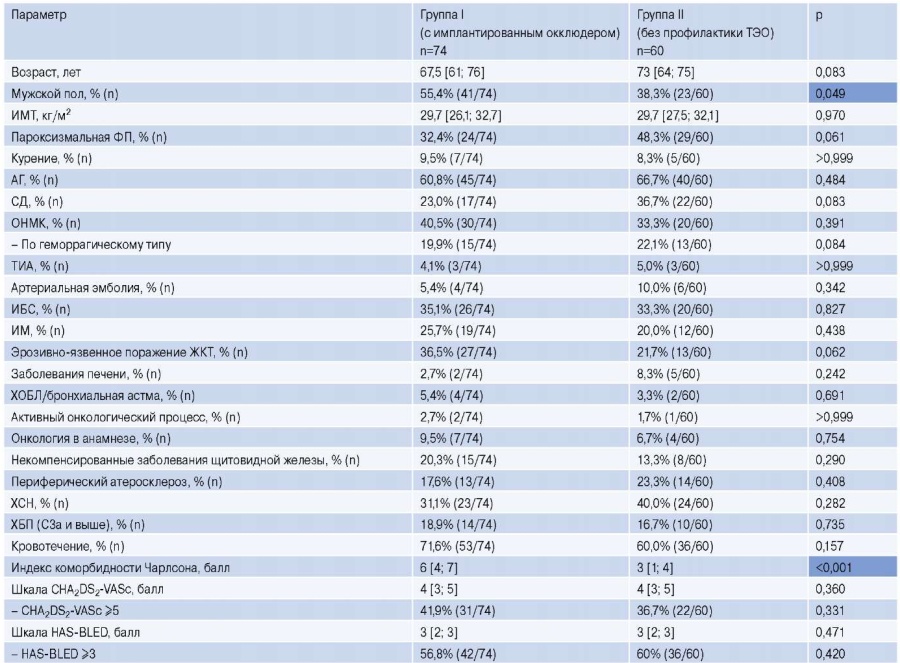
Сокращения: АГ — артериальная гипертензия, БА — бронхиальная астма, ЖКТ — желудочно-кишечный тракт, ИБС — ишемическая болезнь сердца, ИМ — инфаркт миокарда, ИМТ — индекс массы тела, ОНМК — острое нарушение мозгового кровообращения, СД — сахарный диабет, ТИА — транзиторная ишемическая атака, ТЭО — тромбоэмболические осложнения, ХБП — хроническая болезнь почек, ХОБЛ — хроническая обструктивная болезнь легких, ХСН — хроническая сердечная недостаточность, ФП — фибрилляция предсердий.
Пациенты обеих исследуемых групп имели высокий риск развития ишемических событий. Так, средний балл по шкале CHA2DS2-VASc составил 4 балла (Q1-Q3: 3-5); CHA2DS2-VASc ≥5, характеризующий крайне высокий риск ТЭО, наблюдался у 41,9% в группе I и у 36,7% в группе II. Обе группы имели высокий риск геморрагических событий, оцениваемый по шкале HAS-BLED в среднем в 3 балла (Q1-Q3: 2-3). При этом доля пациентов с высоким риском геморрагических осложнений (HAS-BLED ≥3 баллов) в группах окклюдера и без профилактики ТЭО составила 56,8% и 60%, соответственно. Важно помнить, что широко используемая, в т.ч. и в нашей работе, шкала HAS-BLED не является универсальной и учитывает не все ценные в контексте развития геморрагических событий ФР.
Сравнительный анализ исходных клинико-анамнестических характеристик групп позволил выявить следующие статистически значимые различия между группами: в группе I наблюдалось большее число пациентов мужского пола (р<0,049), выше былa частота кровотечений в анамнезе (р<0,001), а также индекс коморбидности Чарлсона (р<0,001). Различия между группами по частоте встречаемости таких факторов, как курение, сахарный диабет, ТИА, артериальная эмболия, ишемическая болезнь сердца, инфаркт миокарда, эрозивно-язвенное поражение желудочно-кишечного тракта, заболевания печени, обструктивные заболевания легких, онкологические заболевания, заболевания щитовидной железы, периферический атеросклероз, хроническая сердечная недостаточность и хроническая болезнь почек, не достигли статистической значимости.
Было имплантировано 50 устройств типа Watchman и 24 устройства типа Amplatzer Amulet. Технический успех был достигнут в 74 случаях (74/74, 100%). После имплантации окклюдера в группе I оценивалась частота развития осложнений в течение внутригоспитального периода. Суммарная частота внутригоспитальных осложнений достигала 12%. Наиболее часто отмечались периоперационные осложнения, связанные с местом доступа. Частота ассоциированных с процедурой кровотечений достигала 5,4%. При этом было зарегистрировано лишь одно большое кровотечение из места доступа, значимость которого определялась снижением гемоглобина на 2 единицы от исходного значения. У 4% (3/74) наблюдалась гематома в месте пункции, в одном из случаев — пульсирующая. Частота инфекционных осложнений, проявившихся развитием внутрибольничной пневмонии, составила 2,7% (2/74). Случаев инсульта, инфаркта миокарда, дислокации окклюдера, девайс-ассоциированного тромбоза, воздушной эмболии, гемоперикарда зарегистрировано не было.
В качестве первичной конечной точки рассматривалась комбинированная конечная точка (ККТ), включающая общую смертность, ИИ/ТИА/СЭ в течение периода наблюдения. Частота развития первичной ККТ за весь период наблюдения в группе окклюдера при сопоставлении с группой без профилактики ТЭО была достоверно ниже (более чем в 3 раза), составив 5,2 vs 17,4 на 100 пациенто-лет (скорректированное отношение шансов (ОШ) 4,08; 95% доверительный интервал (ДИ): 1,7-9,5, p=0,001). Анализ выживаемости Каплана-Майера (рис. 3) также позволил установить, что в группе имплантации окклюдера суммарная частота событий первичной ККТ была достоверно реже (12,2%), чем в группе без профилактики ТЭО (41,7%), p<0,001.
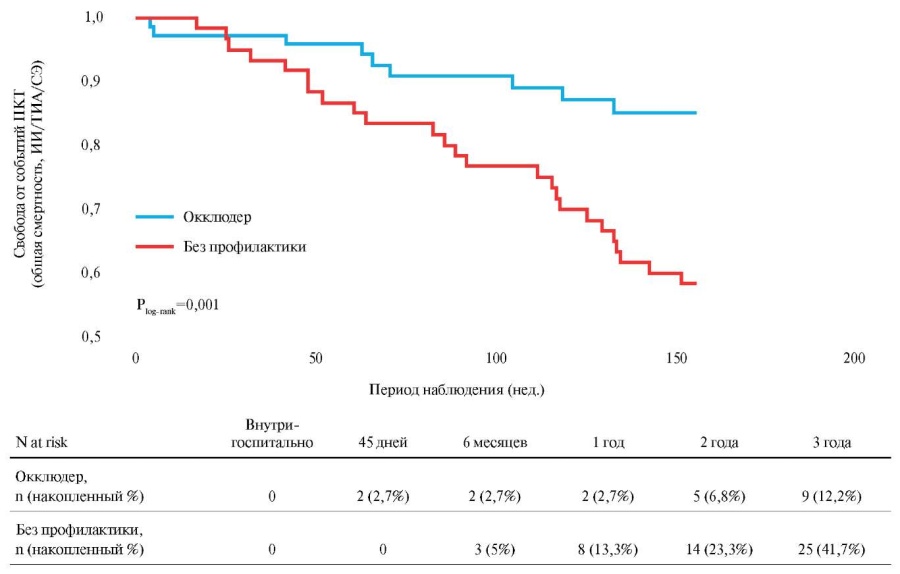
Рис. 3. Кривая Каплана-Мейера. Кумулятивная свобода от событий, составивших ККТ (общая смертность, ИИ/ТИА/СЭ).
Сокращения: ИИ — ишемический инсульт, ПКТ — первичная конечная точка, СЭ — системные эмболии, ТИА — транзиторная ишемическая атака.
При анализе первичной конечной точки безопасности, выражающейся в частоте развития больших кровотечений (по критериям регистра GARFIELD), продемонстрировано: в группе с имплантацией окклюдера частота развития больших кровотечений составила 2,4 vs 1,3 на 100 пациенто-лет в группе без профилактики ТЭО (скорректированное ОШ 0,55; 95% ДИ: 0,1-3,09; p=0,509), что свидетельствует об отсутствии достоверных различий между популяциями и также подтверждается анализом кривых Каплана-Майера (рис. 4).
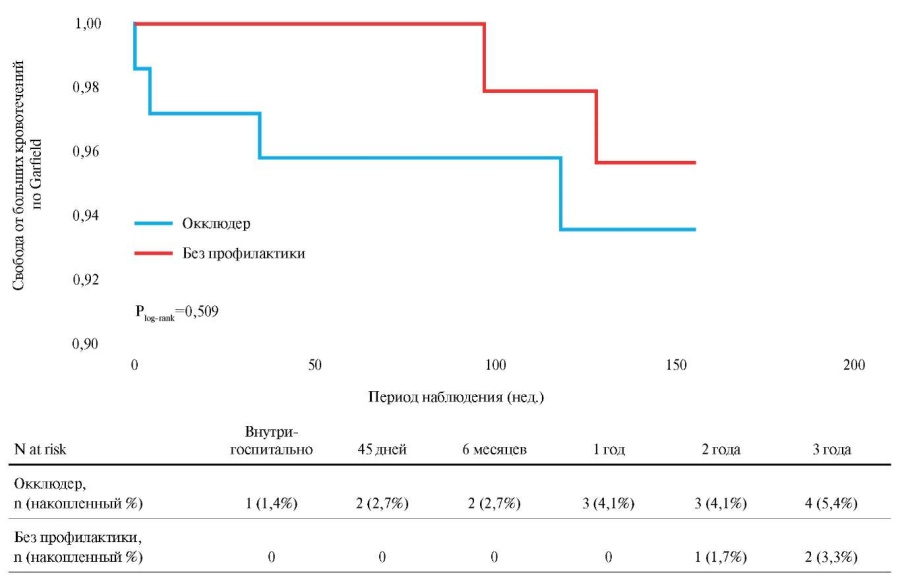
Рис. 4. Кривая Каплана-Мейера. Кумулятивная свобода от больших кровотечений по Garfield.
Принимая во внимание тот факт, что сравниваемые группы отличались по исходному количеству кровотечений в анамнезе, при оценке конечной точки безопасности нами также применялся регрессионный анализ Кокса с поправкой на клинические ФР, подтвердивший отсутствие статистически значимых различий в отношении частоты достижения больших кровотечений (скорректированное ОШ 0,546; 95% ДИ: 0,103-3,088; p=0,509).
Анализ кривых Каплана-Мейера подтвердил ожидаемое преимущество имплантации окклюдера по сравнению с отсутствием профилактики эмболических осложнений в отношении частоты достижения событий, определяющих чистую клиническую выгоду (рис. 5).
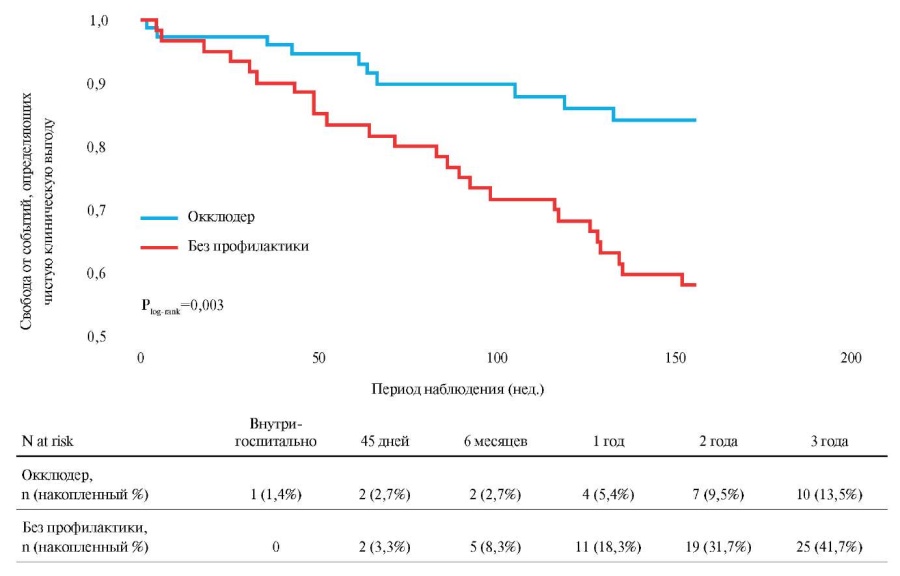
Рис. 5. Кривая Каплана-Мейера. Кумулятивная свобода от событий, составляющих чистую клиническую выгоду (общая смертность + ИИ/ТИА/СЭ + большие кровотечения).
Преимущество имплантации окклюдера в плане достижения событий, вошедших в определение “чистой клинической выгоды” (общая смертность + ИИ/ТИА/СЭ + большие кровотечения), было подтверждено и результатами многофакторного анализа. Обусловлено оно тем, что в группе имплантации окклюдера частота событий, отражающих чистую клиническую выгоду, наблюдалась достоверно реже и составила 5,9 vs 18,2 на 100 пациенто-лет (скорректированное ОШ 3,0; 95% ДИ: 1,47-6,36, p=0,003).
Чтобы оценить дополнительное влияние факторов, значимых в отношении частоты достижения событий чистой клинической выгоды, мы построили многофакторную регрессионную модель (табл. 3), включавшую в себя высокий риск тромбоэмболических событий по шкале CHA2DS2-VASc, оцениваемый в 5 баллов и более, анамнестически известный факт наличия острого нарушения мозгового кровообращения, высокий индекс по Charlson ≥4 и факт имплантации окклюдера. Для каждого из включенных ФР была продемонстрирована статистическая значимость, как и для самой модели в целом.
Таблица 3
Предикторы развития событий, составляющих чистую клиническую выгоду. Регрессионная модель
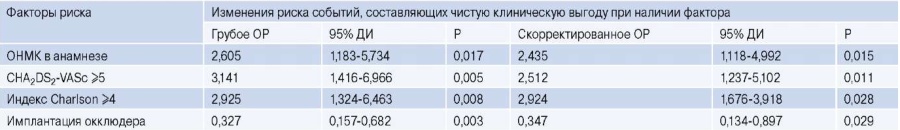
Сокращения: ДИ — доверительный интервал, ОНМК — острое нарушение мозгового кровообращения, ОР — отношение рисков.
Таким образом, имплантация окклюдера явилась единственным фактором со статистически достоверным вкладом в снижение вероятности событий, определяющих чистую клиническую выгоду.
Отдельный анализ компонентов ККТ эффективности показал, что в группе окклюдера частота развития ИИ/ТИА/CЭ была практически в 7 раз ниже, чем в группе без профилактики ТЭО, составив 1,7 vs 11,9 на 100-пациенто-лет, что носило статистически достоверный характер (p<0,001). Аналогичные результаты получены и в отношении показателей общей и сердечно-сосудистой смертности: частота развития данных событий в группе имплантации окклюдера была достоверно ниже и составила 4,5 vs 13,2 на 100 пациенто-лет (скорректированное ОШ 1,4; 95% ДИ: 1,08-1,87, p=0,012) и 3,4 vs 11,2 на 100 пациенто-лет (скорректированное ОШ 3,2; ДИ: 1,281,87, p=0,013), соответственно.
Обсуждение
Использование антикоагулянтов для профилактики тромбоэмболических событий у больных с ФП занимает главенствующую позицию в официальных документах, соответствуя рекомендации I класса [11]. Несмотря на доказанную клиническую эффективность, назначение АКТ в ряде случаев не представляется возможным, как из-за абсолютных противопоказаний к длительной АКТ, так и из-за отказа от терапии, обусловленного в первую очередь низкой комплаентностью пациентов.
Невзирая на невысокий класс рекомендаций, присваиваемый на сегодняшний день окклюдерам УЛП, применение последних являет собой весьма эффективную и перспективную стратегию лечения у пациентов с ФП с высоким риском ишемических событий, особенно актуальную для категории больных, остающихся без медикаментозной профилактики ТЭО ввиду разных причин.
Наше проспективное наблюдательное исследование включало в себя больных ФП с высоким риском ТЭО, в отношении которых лечащие врачи сочли невозможным длительное назначение антикоагулянтов. Около половины больных имели абсолютные/ существенные противопоказания к АКТ, связанные, в частности, с перенесенным спонтанным геморрагическим инсультом или рецидивирующими кровотечениями другой локализации (в большинстве случаев — желудочно-кишечного кровотечения), источник которых не мог быть адекватно контролирован или устранен. В отношении остальных пациентов (прежде всего, с рецидивирующими кровотечениями, не достигавшими критериев крупных) формальных препятствий для АКТ не было. В реальной клинической практике подобные кровотечения являются одной из ведущих причин отказа от длительной АТТ, что было подтверждено и нами в рамках настоящей работы. Однако помимо упомянутых нами объективных предпосылок к неназначению АКТ, существуют и другие факторы, препятствующие эффективной АКТ. Речь идет о несоблюдении предписанного режима АТТ, обусловленного разными причинами (плохая приверженность, связанная с недостаточной критикой в оценке заболевания и его осложнений, деменция и др.), которые, несмотря на кажущуюся корригируемость, создают серьезную проблему для врача. Так, по данным многоцентрового немецкого регистра LAARGE, включавшего 641 пациента, у 79% из которых отмечался высокий риск тяжелого кровотечения, в 20% случаев именно отказ пациентов от АКТ предшествовал проведению закрытия УЛП, обусловив при этом довольно благоприятные исходы: частота развития ИИ/ТИА и крупного кровотечения в течение года наблюдения составили 1,3% и 1,6%, соответственно [12].
Как и ожидалось, контингент больных, включенных в наше исследование, значительно отличался от ранних исследований имплантации окклюдеров УЛП. Так, в упомянутые нами ранее исследования PROTECT AF и PREVAIL [2][13] включались менее тяжелые пациенты, в т.ч. больные с низким риском ишемических событий. Невзирая на очевидные различия в дизайнах, тяжести включенных пациентов, нами получены вполне сопоставимые результаты как в отношении госпитальных исходов, так и в отношении долгосрочного прогноза.
Мы считаем необходимым обратить внимание на тяжесть включенных нами пациентов обеих групп, имевших и высокий риск развития кардиоэмболических осложнений (средний балл по шкале CHA2DS2-VASc составил 4 балла; CHA2DS2-VASc ≥5 у 41,9% в группе I и у 36,7% в группе II) и высокий риск развития кровотечений (доля пациентов, у которых HAS-BLED ≥3 баллов, в группах I и II составила 56,8% и 60%, соответственно). С практической точки зрения представляется важным акцентировать внимание на безопасность имплантации окклюдера у подобных пациентов. В первую очередь, хочется сказать о том, что наши результаты демонстрируют достижение технического успеха в 100% случаев, что соответствует данным ряда крупных регистров последних лет. Не менее обнадеживающие результаты получены при анализе первичной конечной точки безопасности: частота развития больших кровотечений, оцениваемых по критериям регистра GARFIELD, в группе имплантации окклюдера не превышала достоверно частоту развития таковых в сопоставляемой группе, составив 2,4 vs 1,3 на 100 пациенто-лет. Наши данные, отражающие частоту развития больших кровотечений, фактически идентичны результатам многоцентрового регистра EWOLUTION, в котором частота крупных кровотечений составила 2,7 на 100 пациенто-лет [6]. Важно, что включенные в данный регистр пациенты были сопоставимы с нашими пациентами с точки зрения высоких как тромбоэмболических, так и геморрагических рисков (CHA2DS2-VASc =4,5±1,6; HAS-BLED =2,3±1,2). Примечательно то, что тяжесть включенных как в наше исследование, так и в регистр EWOLUTION больных, казалось бы, должна была увеличить риски и количество периоперационных осложнений, но подобного не наблюдалось. В 98,5% случаев достигнут технический успех, а число осложнений в интра-, периоперационном периоде составило 2,8% [7], что отражает больший уровень безопасности вмешательства, чем в ранее упомянутом исследовании PROTECT AF, и указывает на факт повышения опыта операторов.
Напомним, что наши больные получали различные комбинации АТТ при выписке, большая часть из них — ДАТТ (64%), что предписано современными клиническими рекомендациями [14]. Однако спустя 45 сут. и 6 мес. интенсивность терапии закономерно снижалась. Подобное краткосрочное назначение антикоагулянта и/или двойной антитромбоцитарной терапии оказалось безопасным. Так, все геморрагические осложнения у больных с имплантированным окклюдером развивались только в течение внутригоспитального периода, причем не было зарегистрировано ни одного фатального кровотечения за весь период наблюдения. Заметим также, что последующий переход на монотерапию АСК или полный отказ от АТТ не был ассоциирован с увеличением частоты тромботических осложнений.
До недавнего времени было не совсем ясно, способны ли окклюдеры УЛП обеспечить адекватную длительную защиту от ИИ у больных ФП высокого ишемического риска. Наше исследование, включавшее именно таких пациентов, показало, что частота достижения событий ККТ, как и частота развития отдельных ее компонентов в группе имплантации окклюдера, была достоверно ниже, чем в сопоставляемой группе. Так, частота событий первичной ККТ составила 5,2 на 100 пациенто-лет; частота развития ИИ/ТИА/CЭ была практически в 7 раз ниже, чем в группе без профилактики ТЭО, составив 1,7 на 100 пациенто-лет. Сопоставимые результаты были продемонстрированы в упоминавшемся нами выше регистре EWOLUTION (частота развития ИИ/ТИА/ СЭ =2 на 100 пациенто-лет). В регистровом исследовании Amulet, также включавшем больных с высокими рисками ТЭО и кровотечений, частота ИИ по результатам наблюдения в течение года составила 2,2% [15]. Проведенный в последующем сравнительный анализ исходов у пациентов из данного регистра и подобранных из Датского регистра больных [16], принимающих ПОАК, показал, что ККТ, включавшая в себя те же события, что и в нашей работе, наблюдалась значительно реже в группе окклюдера (ОШ 0,57; 95% ДИ 0,49-0,67), при этом чаcтота ИИ была cопоcтавима (ОШ 1,11; 95% ДИ 0,71-1,75).
Эффективность и безопасность стратегии окклюзии УЛП убедительно продемонстрированы в многоцентровом рандомизированном исследовании PRAGUE-17 [5], включавшем больных ФП с высоким риском ТЭО (CHA2DS2-VASc — 4,7±1,5 баллов), сопоставимым с таковым у наших больных. Пациенты были рандомизированы для получения ПОАК (n=201) или проведения закрытия УЛП (n=201). В течение периода наблюдения (19,9 мес.) частота достижения первичной ККТ (ИИ/ТИА/СЭ + сердечно-сосудистая смертность + клинически значимые кровотечения и осложнения, связанные с процедурой) в группах УЛП и ПОАК была сопоставимой (11 vs 13 на 100 пациенто-лет), что было справедливо и в отношении частоты развития ИИ/ТИА (относительный риск 1,00; 95% ДИ: 0,40-2,51).
В мультицентровом проспективном исследовании ASAP [17], отличающемся от ранее перечисленных тем, что в него включались пациенты с абсолютными противопоказаниями к АКТ, частота ИИ составила 2,3% в год, в то время как ожидаемая годовая частота ИИ на основании шкалы CHADS2 — 6,6% в год, что свидетельствует о весьма высокой эффективности закрытия УЛП, что перекликается с нашими данными, согласно которым частота ИИ у больных с окклюдером составляла <2% в год. Как и в нашем исследовании, назначение ДАТТ после имплантации окклюдера оказалось довольно безопасным и эффективным.
Важной особенностью нашей работы являлось наличие “группы контроля”, включавшей пациентов без какой-либо профилактики ТЭО. Как мы уже отмечали, в исследованиях реальной практики подобное отношение к мерам профилактики весьма типично в отношении наиболее тяжелых больных ФП. Есть основания полагать, что польза от имплантации окклюдера окажется максимальной именно у подобных пациентов. Действительно, по нашим данным, инвазивное вмешательство приводило к достоверному снижению суммы всех прогноз-определяющих негативных исходов (смерть, тромботические события и кровотечения). Важно, что “чистая клиническая выгода” от имплантации окклюдера УЛП сохранялась и в многофакторной модели Кокса, включавшей такие ключевые ФР, как острое нарушение мозгового кровообращения в анамнезе, высокий балл CHA2DS2-VASc ≥5, а также высокий индекс коморбидности Charlson ≥4.
Таким образом, можно вполне уверенно обсуждать более жесткие, нежели, чем в современных экспертных документах Европейского общества кардиологов, показания к имплантации окклюдера УЛП при невозможности назначения АКТ у больных ФП. Очевидно, что потенциальная польза применения окклюзирующих УЛП устройств не исчерпывается категорией пациентов с наличием противопоказаний к АКТ, что нашло отражение в важном консенсусном документе [18]. Помимо категории пациентов, для которых пролонгированная АКТ невозможна ввиду риска развития тяжелых/фатальных кровотечений, а также имеющих важнейшие ФР развития кровотечений (тяжелая хроническая болезнь почек, онкологический процесс, тромбоцитопения и др.), консенсус допускает рассмотрение имплантации окклюдера для больных, категорически отказывающихся принимать антикоагулянты, несоблюдающих предписанный режим АКТ; для больных с доказанной неэффективностью АКТ (инсульт на фоне АКТ), с электрически изолированным УЛП после радиочастотной аблации.
Весьма активно продолжается уточнение перспективы стратегии “окклюдер против ПОАК” в таких исследованиях, как ASAP-TOO (NCT02928497), STROKECLOSE (NCT02830152), SAFE-LAAC (NCT03445949), CLOSURE-AF (NCT03463317). Не меньший интерес представляет изучение комбинированного подхода “окклюдер + АКТ”, который представляется наиболее эффективным и несущим в себе особую клиническую ценность для пациентов с ИИ на фоне применения АКТ.
Ограничения исследования. Ключевыми ограничениями нашего исследования представляются небольшой объем выборки пациентов и одноцентровый характер исследования.
Заключение
Наше наблюдение показало, что кумулятивная частота всех оцениваемых нами неблагоприятных событий первичных конечных точек эффективности и безопасности, чистой клинической выгоды в группе имплантации окклюдера достигалась достоверно реже по сравнению с группой, не получавшей профилактики ТЭО. Нам удалось убедительно продемонстрировать, что эндоваскулярная изоляция УЛП являет собой весьма надежную и безопасную альтернативу в ряде клинических ситуаций, связанных не только с невозможностью приема АКТ.
Отношения и деятельность: все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье.
Список литературы
1. Bassand JP, Apenteng PN, Atar D, et al. GARFIELD-AF: a worldwide prospective registry of patients with atrial fibrillation at risk of stroke. Future Cardiol. 2021;17(1):19-38. doi:10.2217/fca-2020-0014.
2. Holmes DR, Reddy VY, Turi ZG, et al. PROTECT AF Investigators. Percutaneous closure of the left atrial appendage versus warfarin therapy for prevention of stroke in patients with atrial fibrillation: a randomised non-inferiority trial. Lancet. 2009;374(9689):534-42. doi:10.1016/S0140-6736(09)61343-X.
3. Reddy VY, Holmes D, Doshi SK, et al. Safety of percutaneous left atrial appendage closure: results from the Watchman Left Atrial Appendage System for Embolic Protection in Patients with AF (PROTECT AF) clinical trial and the Continued Access Registry. Circulation. 2011;123(4):417-24. doi:10.1161/CIRCULATIONAHA.110.976449.
4. Holmes DR Jr, Reddy VY, Gordon NT, et al. Long-Term Safety and Efficacy in Continued Access Left Atrial Appendage Closure Registries. J Am Coll Cardiol. 2019;74(23):2878-89. doi:10.1016/j.jacc.2019.09.064.
5. Osmancik P, Herman D, Neuzil P, et al. PRAGUE-17 Trial Investigators. Left Atrial Appendage Closure Versus Direct Oral Anticoagulants in High-Risk Patients With Atrial Fibrillation. J Am Coll Cardiol. 2020;75(25):3122-35. doi:10.1016/j.jacc.2020.04.067.
6. Boersma LV, Ince H, Kische S, et al. EWOLUTION Investigators. Efficacy and safety of left atrial appendage closure with WATCHMAN in patients with or without contraindication to oral anticoagulation: 1-Year follow-up outcome data of the EWOLUTION trial. Heart Rhythm. 2017;14(9):1302-8. doi:10.1016/j.hrthm.2017.05.038.
7. Boersma LV, Schmidt B, Betts TR, et al. EWOLUTION investigators. Implant success and safety of left atrial appendage closure with the WATCHMAN device: peri-procedural outcomes from the EWOLUTION registry. Eur Heart J. 2016;37(31):2465-74. doi:10.1093/eurheartj/ehv730.
8. Calkins H, Kuck KH, Cappato R, et al. 2012 HRS/EHRA/ECAS Expert Consensus Statement on Catheter and Surgical Ablation of Atrial Fibrillation: recommendations for patient selection, procedural techniques, patient management and follow-up, definitions, endpoints, and research trial design. Europace. 2012;14(4):528-606. doi:10.1093/europace/eus027.
9. Camm AJ, Lip GY, De Caterina R, et al. ESC Committee for Practice Guidelines (CPG). 2012 focused update of the ESC Guidelines for the management of atrial fibrillation: an update of the 2010 ESC Guidelines for the management of atrial fibrillation. Developed with the special contribution of the European Heart Rhythm Association. Eur Heart J. 2012;33(21):2719-47. doi:10.1093/eurheartj/ehs253.
10. Певзнер Д. В., Меркулов Е. В., Арутюнян Г. К. и др. Использование различных типов окклюдеров для эндоваскулярной гемодинамической изоляции ушка левого предсердия у пациентов с фибрилляцией предсердий. Вестник аритмологии. 2021;28(3):45-54. doi:10.35336/VA-2021-3-45-54.
11. January CT, Wann LS, Calkins H, et al. 2019 AHA/ACC/HRS Focused Update of the 2014 AHA/ACC/HRS Guideline for the Management of Patients With Atrial Fibrillation: A Report of the American College of Cardiology/American Heart Association Task Force on Clinical Practice Guidelines and the Heart Rhythm Society. J Am Coll Cardiol. 2019;74(1):104-32. doi:10.1016/j.jacc.2019.01.011.
12. Brachmann J, Lewalter T, Akin I, et al. Interventional occlusion of left atrial appendage in patients with atrial fibrillation. Acute and long-term outcome of occluder implantation in the LAARGE Registry. J Interv Card Electrophysiol. 2020;58(3):273-80. doi:10.1007/s10840-019-00635-7.
13. Holmes DR Jr, Kar S, Price MJ, et al. Prospective randomized evaluation of the Watchman Left Atrial Appendage Closure device in patients with atrial fibrillation versus long-term warfarin therapy: the PREVAIL trial. J Am Coll Cardiol. 2014;64(1):1-12. doi:10.1016/j.jacc.2014.04.029.
14. Hindricks G, Potpara T, Dagres N, et al. ESC Scientific Document Group. 2020 ESC Guidelines for the diagnosis and management of atrial fibrillation developed in collaboration with the European Association for Cardio-Thoracic Surgery (EACTS): The Task Force for the diagnosis and management of atrial fibrillation of the European Society of Cardiology (ESC) Developed with the special contribution of the European Heart Rhythm Association (EHRA) of the ESC. Eur Heart J. 2021;42(5):373-498. doi:10.1093/eurheartj/ehaa612.
15. Landmesser U, Tondo C, Camm J, et al. Left atrial appendage occlusion with the AMPLATZER Amulet device: one-year follow-up from the prospective global Amulet observational registry. EuroIntervention. 2018;14(5):e590-e597. doi:10.4244/EIJ-D-1800344.
16. Nielsen-Kudsk JE, Korsholm K, Damgaard D, et al. Clinical Outcomes Associated With Left Atrial Appendage Occlusion Versus Direct Oral Anticoagulation in Atrial Fibrillation. JACC Cardiovasc Interv. 2021;14(1):69-78. doi:10.1016/j.jcin.2020.09.051.
17. Reddy VY, Möbius-Winkler S, Miller MA, et al. Left atrial appendage closure with the Watchman device in patients with a contraindication for oral anticoagulation: the ASAP study (ASA Plavix Feasibility Study With Watchman Left Atrial Appendage Closure Technology). J Am Coll Cardiol. 2013;61(25):2551-6. doi:10.1016/j.jacc.2013.03.035.
18. Glikson M, Wolff R, Hindricks G, et al. ESC Scientific Document Group. EHRA/EAPCI expert consensus statement on catheter-based left atrial appendage occlusion — an update. Europace. 2020;22(2):184. doi:10.1093/europace/euz258.
Об авторах
Д. В. ПевзнерРоссия
Дмитрий Вольфович Певзнер — кандидат медицинских наук, зав. блоком интенсивной терапии отдела неотложной кардиологии.
Москва
Конфликт интересов:
нет
А. А. Семенова
Россия
Алина Аслановна Семенова — аспирант отдела неотложной кардиологии.
Москва
Конфликт интересов:
нет
Н. С. Кострица
Россия
Наталья Сергеевна Кострица — ординатор отдела неотложной кардиологии.
Москва
Конфликт интересов:
нет
И. А. Меркулова
Россия
Ирина Алексеевна Меркулова — врач-кардиолог палаты реанимации и интенсивной терапии, лаборант-исследователь отдела неотложной кардиологии.
Москва
Конфликт интересов:
нет
А. Л. Комаров
Россия
Андрей Леонидович Комаров — доктор медицинских наук, ведущий научный сотрудник лаборатории отдела клинических проблем атеротромбоза.
Москва
Конфликт интересов:
нет
Е. В. Меркулов
Россия
Евгений Владимирович Меркулов — доктор медицинских наук, старший научный сотрудник, зав. 1-м отделением рентгенхирургических методов диагностики и лечения.
Москва
Конфликт интересов:
нет
Дополнительные файлы
Рецензия
Для цитирования:
Певзнер Д.В., Семенова А.А., Кострица Н.С., Меркулова И.А., Комаров А.Л., Меркулов Е.В. Эффективность и безопасность имплантации окклюзирующих устройств ушка левого предсердия у больных с фибрилляцией предсердий и высоким тромбоэмболическим и геморрагическим риском. Российский кардиологический журнал. 2022;27(8):5182. https://doi.org/10.15829/1560-4071-2022-5182
For citation:
Pevzner D.V., Semenova A.А., Kostritsa N.S., Merkulova I.A., Komarov A.L., Merkulov E.V. Efficacy and safety of left atrial appendage closure in patients with atrial fibrillation and high thromboembolic and bleeding risk. Russian Journal of Cardiology. 2022;27(8):5182. (In Russ.) https://doi.org/10.15829/1560-4071-2022-5182
JATS XML

















































