Перейти к:
Артериальная гипертензия в условиях вахты в Арктике: особенности взаимосвязей жесткости артерий с маркерами воспаления и некоторыми метаболическими факторами риска
https://doi.org/10.15829/1560-4071-2023-5167
Аннотация
Цель. Определить наличие и особенности взаимосвязей артериальной жесткости, маркеров воспаления, некоторых метаболических факторов риска, в т.ч. в гендерном аспекте, у пациентов с артериальной гипертонией (АГ) в условиях арктической вахты.
Материал и методы. В заполярном поселке Ямбург (68о 21’ 40" северной широты) на базе МСЧ ООО ЯГД одномоментно обследовано 99 мужчин (М) и 81 женщина (Ж) с АГ 1, 2 степени (61 М и 44 Ж) и нормотензивных лиц (АГ0). Пациенты с АГ были сопоставимы по возрасту (р=0,68), числу лет работы вахтой (р=0,7701), уровню офисного систолического АД (р=0,473), диастолического АД (р=0,6992), индексу массы тела (р=0,465). Проведено суточное мониторирование артериального давления; ультразвуковое исследование общих сонных артерий с определением расчетных показателей локальной жесткости (коэффициента растяжимости, индекса жесткости, модуля эластичности Петерсона (Ep), модуля упругости Юнга (Eу); исследована скорость пульсовой волны (СПВ); биохимическое исследование крови с определением высокочувствительного С-реактивного белка, гомоцистеина, С-пептида, инсулина, кортизола, предсердного натрийуретического пептида, интерлейкинов (IL-1β, IL-6, IL-8, IL-10), фактора некроза опухоли (ФНО-α).
Результаты. В группах М и Ж с АГ в сравнении с АГ0 выявлены более высокие значения показателей, характеризующих жесткость сосудистой стенки: пульсового АД (р=0,018), толщины комплекса "интима-медиа" (р=0,0077), СПВ (р<0,00001), Eу (р=0,0314) у Ж; в гр. М: СПВ (р=0,0004), Eу (р=0,0024) и снижения деформации общих сонных артерий (р=0,0131). У М с АГ в сравнении с Ж с АГ были выше показатели толщины комплекса "интима-медиа" (р=0,0008), индекса жесткости (р=0,0368), Ep (р=0,051). СПВ у М и Ж с АГ определялась значимо выше, чем у лиц с нормальным АД (р=0,0007; р=0,0001). Корреляционный анализ выявил взаимосвязи СПВ с показателями суточного мониторирования артериального давления у М и Ж с АГ. Увеличение СПВ на единицу измерения у Ж повышает вероятность АГ в 1,7 раза, у М — в 1,4 раза. У М и Ж с АГ в сравнении с АГ0 были значимо выше уровни С-пептида (р=0,032), инсулина (р=0,035), IL-1β (р=0,025), кортизола (р=0,031) у М; в гр. Ж — значимо выше уровни С-пептида (р=0,015), инсулина (р=0,012), IL-6 (р=0,021), ФНО-α (р=0,047). Результаты пошагового логистического регрессионного анализа независимых параметров, влияющих на шанс наличия АГ, определили у М: СПВ, отношение шансов (ОШ) 1,554 (95% доверительный интервал (ДИ): 1,058-2,281, р=0,025); С-пептид, ОШ 1,186 (95% ДИ: 1,004-1,588, р=0,022); IL-1β, ОШ 1,464 (95% ДИ: 0,936-2,291, р=0,099). Статистически значимо увеличивали шанс наличия АГ у Ж: СПВ, ОШ 2,015 (95% ДИ: 1,319-3,078, р=0,001); С-пептид, ОШ 2,133 (95% ДИ: 1,236-3,680, р=0,006); IL-6, ОШ 2,101 (95% ДИ: 1,003-4,400, р=0,049) и уменьшал уровень ФНО-α, ОШ 0,801 (95% ДИ: 0,668-0,959, р=0,016).
Заключение. В условиях арктической вахты высокие значения показателей, характеризующих жесткость сосудистой стенки, независимо от половой принадлежности, связаны с наличием АГ. У мужчин независимо от уровня АД показатели сосудистой жесткости были выше, однако более сильная связь сосудистой ригидности с риском АГ прослеживалась у женщин. У пациентов с АГ в арктическом регионе выявлена ассоциация сосудистой жесткости с факторами неспецифического иммунного воспаления, более выраженная у женщин. В модели "северной" АГ помимо жесткости сосудистой стенки и провоспалительных цитокинов, входит продукт расщепления проинсулина С-пептид, являющийся модулятором атеросклеротического процесса.
Ключевые слова
Для цитирования:
Шуркевич Н.П., Ветошкин А.С., Симонян А.А., Гапон Л.И., Карева М.А. Артериальная гипертензия в условиях вахты в Арктике: особенности взаимосвязей жесткости артерий с маркерами воспаления и некоторыми метаболическими факторами риска. Российский кардиологический журнал. 2023;28(4):5167. https://doi.org/10.15829/1560-4071-2023-5167
For citation:
Shurkevich N.P., Vetoshkin A.S., Simonyan A.A., Gapon L.I., Kareva M.A. Hypertension in individuals working in the Arctic on a rotating basis: relationship of arterial stiffness with inflammatory markers and some metabolic risk factors. Russian Journal of Cardiology. 2023;28(4):5167. (In Russ.) https://doi.org/10.15829/1560-4071-2023-5167
Артериальная гипертония (АГ) сохраняет свою актуальность и является ведущим фактором риска развития инфаркта миокарда, инсульта, хронической сердечной недостаточности, цереброваскулярных и почечных заболеваний [1]. Патогенез АГ сложный и до конца неизвестный. Наиболее важными звеньями формирования являются активация симпатоадреналовой, ренин-ангиотензин-альдостероновой системы, повышение продукции альдостерона, дисфункция эндотелия с преобладанием продукции вазоконстрикторных субстанций [2]. В итоге формируются структурные изменения сосудистой стенки артерий мышечного и эластического типов, повышение жесткости крупных сосудов и повышение артериального давления (АД) [3][4].
Исследования показывают, что иммунная система, воспаление и АГ связаны друг с другом. Врожденная и адаптивная система иммунитета запускает воспалительный процесс, при котором может повышаться АД, стимулируя повреждение органов [5]. Ранее в нашей работе [6] у пациентов с АГ в условиях арктической вахты были выявлены признаки симпатикотонии, которые могут способствовать метаболическим нарушениям. Известно также, что вегетативная дисфункция может влиять на активность иммунных клеток [7]. Роль факторов, ассоциированных с АГ с позиций иммунной системы, провоспалительных цитокинов и некоторых метаболических факторов риска у лиц, работающих в условиях арктической вахты, ранее не изучалась.
Цель исследования: определить наличие и особенности взаимосвязей жесткости сосудистой стенки с циркулирующими маркерами неспецифического воспаления, некоторыми метаболическими факторами риска, в т.ч. в гендерном аспекте, у лиц с АГ в условиях вахты в Арктическом регионе.
Материал и методы
В заполярном поселке Ямбург (68º 21’ 40" северной широты) на базе МСЧ ООО ЯГД одномоментно в течение 6 дней сентября 2019г во время экспедиционного выезда обследовано 99 мужчин (М) и 81 женщина (Ж). В результате опроса, анализа объективных данных и амбулаторных карт обследованные М и Ж были разделены на пациентов с АГ, сопоставимых по возрасту (р=0,68), числу лет работы вахтой (р=0,7701), уровню офисного систолического АД (САД) (р=0,4730), диастолического АД (ДАД) (р=0,6992), индексу массы тела (ИМТ) (р=0,4650) (табл. 1) и нормотензивных М и Ж, которые значимо различались между собой по ИМТ (р=0,0102) (Ж>М), уровням САД (р=0,0023) и ДАД (р=0,0159) (М>Ж).
Таблица 1
Клиническая характеристика обследованных групп
|
Нормотензивные группы (n=38/37) |
|||
|
Показатель |
Мужчины |
Женщины |
Р |
|
Возраст (лет) |
45,5 (8,3); 42,7-48,2 |
47,2 (7,3); 44,7-49,6 |
0,3141 |
|
Стаж вахты (лет) |
14,9 (8,8); 12-17,8 |
13,7 (8,4); 10,9-16,5 |
0,4329 |
|
ИМТ (кг/м2) |
27,7 (3,1); 26,7-28,7 |
29,9 (4,5); 28,4-31,4 |
0,0102 |
|
САД (мм рт.ст.) |
124,6 (9,1); 121,6-127,6 |
118,4 (10,6); 114,9-122 |
0,0023 |
|
ДАД (мм рт.ст.) |
82,1 (5,8); 80,2-84 |
77,7 (8,3); 75-80,5 |
0,0159 |
|
Пациенты с АГ (n=61/44) |
|||
|
Возраст (лет) |
50,9 (7,8); 48,9-52,9 |
51,9 (6,2); 50-53,8 |
0,6800 |
|
Р* |
0,0026 |
0,0058 |
– |
|
Стаж вахты (лет) |
17,7 (8,2); 15,6-19,7 |
18,4 (9); 15,7-21,2 |
0,7701 |
|
Р* |
0,1223 |
0,0243 |
– |
|
ИМТ (кг/м2) |
27,9 (4); 26,9-28,9 |
28,7 (4,6); 27,3-30,1 |
0,4650 |
|
Р* |
0,9055 |
0,2538 |
– |
|
САД (мм рт.ст.), оф. |
136,4 (14,8); 132,6-140,2 |
138 (17,1); 132,8-143,2 |
0,4730 |
|
Р* |
<0,00001 |
<0,00001 |
– |
|
ДАД (мм рт.ст.), оф. |
88,8 (9,4); 86,4-91,2 |
89,5 (9,7); 86,6-92,5 |
0,6992 |
|
Р* |
0,0001 |
<0,00001 |
– |
Примечание: в скобках указано стандартное отклонение (SD); далее 95% ДИ. В оглавлении в скобках указано число обследованных в формате М/Ж; Р — уровень значимости различий между группами М/Ж; Р* — уровень значимости различий между группами лиц с АГ и нормотензией (использован непараметрический Mann-Whitney U Test).
Сокращения: АГ — артериальная гипертония, ДИ — доверительный интервал, ДАД — диастолическое артериальное давление, ДАД оф. — диастолическое артериальное давление офисное, Ж — группа "женщины", ИМТ — индекс массы тела, М — группа "мужчины", САД — систолическое артериальное давление, САД оф. — систолическое артериальное давление офисное.
Степени АГ устанавливались в соответствии с рекомендациями РМОАГ и РКО, действующими на момент исследования [8]. По распределению частот применения антигипертензивной терапии препаратами разных групп обследованные М и Ж с АГ значимо не различались (табл. 2). В группе М с АГ только 50% (31 из 61 человек) контролировали (измеряли) свое АД самостоятельно или на приеме у врача, Ж незначимо чаще — 68% (30 из 44), Рχ2=0,3632. Из числа обследованных, знавших о наличии у себя АГ, 40 М (66%) и 23 (53%) Ж не принимали антигипертензивную терапию (Рχ2=0,3412), мотивируя отказ от приема малосимптомным течением АГ или редкими эпизодами повышения АД. Из обследованных пациентов с АГ 14 М (23%) и 14 Ж (32%) лечились регулярно (Рχ2=0,4428) с достижением целевого уровня АД, согласно рекомендациям по АГ, действующими на период обследования. Наиболее часто пациенты с АГ принимали ингибиторы ангиотензинпревращающего фермента и сартаны. В целом М значимо чаще, чем Ж, принимали более двух лекарственных средств (Рχ2=0,0336).
Таблица 2
Сравнительный анализ частот применяемой медикаментозной терапии обследованных лиц с АГ препаратами различных групп
|
Препарат |
М (n=61) |
Ж (n=44) |
Рχ2 |
Всего |
|
иАПФ |
19 (31%) |
10 (23%) |
0,4707 |
29 |
|
ААТII |
8 (13%) |
5 (11%) |
0,8121 |
13 |
|
AK |
4 (7%) |
2 (5%) |
0,6785 |
6 |
|
БАБ |
5 (8%) |
6 (14%) |
0,4206 |
11 |
|
ФК ЛС |
5 (8%) |
4 (9%) |
0,8823 |
9 |
|
Статины |
18 (30%) |
6 (14%) |
0,1251 |
24 |
|
ЛС других групп |
4 (7%) |
3 (7%) |
0,9606 |
7 |
|
Без приема ЛС |
28 (46%) |
18 (41%) |
0,7498 |
46 |
|
Монотерапия |
14 (23%) |
17 (39%) |
0,2033 |
31 |
|
Прием двух ЛС |
9 (15%) |
8 (18%) |
0,6901 |
17 |
|
Более 2 препаратов |
10 (17%) |
1 (2%) |
0,0336 |
11 |
Сокращения: ААТII — антагонисты ангиотензиновых рецепторов, AK — антагонисты кальция, БАБ — бета-адреноблокаторы, Ж — группа "женщины", иАПФ — ингибиторы ангиотензинпревращающего фермента, ЛС — лекарственные средства, М — группа "мужчины", ФК — фиксированные комбинации.
Исследование проводили в соответствии с этическими стандартами Хельсинкской декларации и правилами клинической практики в Российской Федерации (2005) ("Good Clinical Practice", Надлежащая клиническая практика, ГОСТ Р 52379-2005). Протокол исследования одобрен Этическим комитетом Тюменского кардиологического научного центра № 149 от 03.06.2019. У всех лиц перед обследованием взято информированное согласие на участие в исследовании. Условия включения в исследование: возраст: 35-60 лет, режим вахты 1:1 (1 мес. работы — 1 мес. отдыха), вахтовые перемещения в пределах одного часового пояса, из городов (Тюмень или Уфа). Факторы невключения: ожирение >1 степени; хроническая ишемическая болезнь сердца, инфаркт миокарда, нарушение мозгового кровообращения в анамнезе; клапанная болезнь сердца; фибрилляция предсердий; сахарный диабет.
Проведено суточное мониторирование АД с помощью регистраторов фирмы BPLab по стандартной методике. Исследована скорость пульсовой волны (СПВ) на аппарате VaSeraVS-1000 (Fukuda Denshi, Япония) с автоматическим определением показателей. Расчет данных показателей осуществлялся на основе регистрации плетизмограмм 4 конечностей, электрокардиографии, фонокардиограммы с использованием специального алгоритма для расчетов. Выполнено ультразвуковое исследование общих сонных артерий (ОСА) с определением утолщения комплекса "интима-медиа" (ТКИМ). С целью оценки состояния сосудистой стенки ОСА были использованы следующие расчетные показатели. Коэффициент растяжимости (distensibility coefficient, DC): DC=2×∆D/∆P/D (10-3/кПа), где D — диаметр артерии; ∆D — изменение диаметра артерии в течение сердечного цикла; ∆P — пульсовое артериальное давление, характеризует эластические свойства стенки артерии и определяется как изменение поперечного сечения сосуда на единицу давления (в норме равен 36,8±13,1 (10-3×мм рт.ст.-1)). Индекс жесткости (stiffness index, β): β=log(САД/ДАД)/(∆D/D), где D — диаметр артерии, а ∆D — изменение диаметра артерии в течение сердечного цикла, определяет способность артериальной стенки к сопротивлению деформации 3,9±1,5 (усл. ед.). Модуль эластичности Петерсона (Ep) — оценивает способность сосудистой стенки возвращаться к исходному состоянию: Ep=(∆Р×Dd)/∆D. Оценивает изменение давления, которое потребуется для растяжения стенки сосуда на 100% при фиксированной длине сосуда (378±155 мм рт.ст.). Модуль упругости Юнга (Eу) — характеризует напряжение артериальной стенки, необходимое на 1 см2 толщины стенки, требуемое для увеличения диаметра на 100%, дает прямую информацию о внутренних эластических свойствах сосудистой стенки независимо от геометрии сосуда (Young’s incremental elastic modulus). Увеличение данного показателя свидетельствует о ригидности стенки артерии (732±403 мм рт.ст./мм). Коэффициент податливости (compliance coefficient — CC) — согласованная с АД пропускная способность артериального русла. Рассчитывается как отношение приращения объема крови в сосуде к увеличению развиваемого при этом давления, определяет величину пульсового давления и скорость достижения среднего давления (0,17±0,07 мм2/мм рт.ст.). Деформация ОСА (strain) — показатель, отражающий изменения диаметра сосуда в течение систолы желудочков: strain=∆D/DS, где ∆D — изменение диаметра, DS — диаметр сосуда в систолу [9][10]. Проведено биохимическое исследование крови с определением концентрации высокочувствительного С-реактивного белка (иммунотурбидиметрическим методом с использованием аналитических наборов "C-reactive protein hs" (BioSystem, Испания) на полуавтоматическом анализаторе открытого типа "Clima MC-15" (Испания)); гомоцистеина на анализаторе "IMMULITE 1000" (Siemens Diagnostics, США) методом непрямого конкурентного твердофазного хемилюминисцентного иммуноферментного анализа с помощью аналитического набора "Homocystein" (Siemens, США); С-пептида, инсулина, N-концевого промозгового натрийуретического пептида (NT-proBNP), интерлейкинов (IL-1β, IL-6, IL-8, IL-10), фактора некроза опухоли (ФНО-α) методом твердофазного хемилюминесцентного иммуноферментного анализа ("сэндвич") на анализаторе — IMMULINE 1000, IMMULITE 2000. Для расчета ИМТ использована формула: масса тела, кг/(рост, м)2. Значения оценены по критерию International Obesity Task Force (IOTF). Нормой считали ИМТ <25 кг/м2; избыточной массой тела — 25-29 кг/м2; ожирением >30 кг/м2.
Статистический анализ. Данные проанализированы в программах Statistica 8,0 (Stat Soft, США) и IBM SPSS 23 (США). Для оценки количественных переменных использованы методы параметрического и непараметрического анализа в зависимости от типа распределения данных. При нормальном распределении — t-критерий Стьюдента для независимых групп, при отсутствии нормальности распределения — непараметрический Mann-Whitney U-тест. Для выявления корреляционных связей применен непараметрический метод Спирмена (Spearmen Ranc R). Для анализа категориальных переменных применен критерий хи-квадрат. Для анализа взаимосвязи признаков и построения моделей — логистическая регрессия с пошаговым исключением факторов и расчетом отношения шансов (ОШ) и 95% доверительного интервала (ДИ). Для оценки качества модели, определения ее чувствительности и специфичности применен ROC-анализ. Ковариаты, включались в многофакторный регрессионный анализ при наличии значимых различий средних или при значимых корреляционных связях. Различия групп считались значимыми при двухстороннем уровне р<0,05.
Результаты
Исследования показывают, что жесткость артериальной стенки способствует повышению АД: в группе (гр.) М и Ж с АГ минимальный и максимальный расчетный возраст артерий был значимо выше, чем у лиц с нормальным АД (табл. 3). В группах М и Ж с АГ, в сравнении с нормотензивными лицами, определялись более высокие значения показателей, характеризующих жесткость сосудистой стенки: пульсовое АД (р=0,018), ТКИМ (р=0,0077), СПВ (р<0,00001), Eу (р=0,0314), определяющего более высокую ригидность стенки артерии, у Ж; в гр. М с АГ — значимо более высокие показатели СПВ (р=0,0004), Eу (р=0,0024) и значимо сниженную деформацию ОСА (р=0,0131). Следует отметить, что у М с АГ, в сравнении с Ж с АГ, выявлена значимо более выраженная локальная жесткость сосудистой стенки ОСА: выше значения ТКИМ (р=0,0008), индекса жесткости (р=0,009) и Ep (р=0,051). СПВ у М и Ж с АГ определялась значимо выше, чем у лиц с нормальным АД (р=0,0007 и р=0,0001, соответственно). Вместе с тем межгрупповых отличий по СПВ у М и Ж не получено (р=0,293).
Таблица 3
Сравнительный анализ показателей состояния стенок ОСА у обследованных лиц с АГ и нормотензивных лиц
|
Показатель |
АГ |
М (n=61/38) |
Ж (n=44/37) |
Р |
|
ПАД (мм рт.ст.) |
1 |
49,4 (8,1); 47,3-51,5 |
48,9 (10,1); 45,9-52 |
0,5966 |
|
0 |
46,4 (7,3); 44-48,8 |
44,8 (5,5); 42,9-46,6 |
0,1310 |
|
|
Р’ |
0,1236 |
0,0180 |
– |
|
|
ТКИМ (мм) |
1 |
0,75 (0,18); 0,71-0,8 |
0,65 (0,16); 0,61-0,7 |
0,0008 |
|
0 |
0,71 (0,13); 0,67-0,76 |
0,58 (0,1); 0,55-0,61 |
<0,00001 |
|
|
Р’ |
0,5361 |
0,0077 |
– |
|
|
СПВ (м/с) |
1 |
14,1 (1,5); 13,7-14,5 |
14,7 (2,6); 13,9-15,5 |
0,1940 |
|
0 |
12,8 (1,9); 12,1-13,4 |
12,1 (1,9); 11,5-12,7 |
0,0209 |
|
|
Р’ |
0,0004 |
<0,00001 |
– |
|
|
РВА (min, лет) |
1 |
54,1 (9,4); 51,7-56,5 |
55,3 (10,5); 52,1-58,5 |
0,6102 |
|
0 |
47,8 (10,3); 44,4-51,1 |
44,3 (13,1); 40-48,7 |
0,2591 |
|
|
Р’ |
0,0031 |
0,0002 |
– |
|
|
РВА (max, лет) |
1 |
58 (9,2); 55,6-60,3 |
66,5 (46,4); 52,4-80,6 |
0,3284 |
|
0 |
51,9 (9,7); 48,7-55,1 |
48,4 (13,2); 44-52,8 |
0,2546 |
|
|
Р’ |
0,0032 |
0,0001 |
– |
|
|
Strain (мм) |
1 |
0,11 (0,05); 0,1-0,13 |
0,13 (0,05); 0,12-0,15 |
0,2668 |
|
0 |
0,14 (0,04); 0,13-0,15 |
0,14 (0,04); 0,13-0,15 |
0,9662 |
|
|
Р’ |
0,0131 |
0,1973 |
– |
|
|
DC (10-3/кПа) |
1 |
16,1 (7,8); 14,1-18,1 |
17,09 (6,65); 15,07-19,11 |
0,6729 |
|
0 |
16,5 (5,4); 14,7-18,3 |
16,3 (5,8); 14,4-18,3 |
0,8322 |
|
|
Р’ |
0,5895 |
0,7616 |
– |
|
|
Ep (мм рт.ст.) |
1 |
421,1 (225,3); 363,4-478,8 |
382,2 (181,4); 327,1-437,4 |
0,0516 |
|
0 |
353,9 (159,4); 301,5-406,2 |
325,7 (139,9); 279,1-372,4 |
0,3734 |
|
|
Р’ |
0,1785 |
0,1782 |
– |
|
|
Eу (мм рт.ст./мм) |
1 |
751,8 (510,9); 620,9-882,6 |
705,5 (312,6); 610,4-800,5 |
0,6262 |
|
0 |
514,8 (245,5); 434,1-595,5 |
617,4 (386,6); 488,5-746,3 |
0,1998 |
|
|
Р’ |
0,0024 |
0,0314 |
– |
|
|
SI |
1 |
2,43 (1,25); 2,11-2,75 |
2,19 (1,09); 1,86-2,52 |
0,0368 |
|
0 |
2,43 (0,82); 2,16-2,7 |
2,04 (0,72); 1,8-2,28 |
0,1767 |
|
|
Р’ |
0,6452 |
0,9924 |
– |
|
|
СС (мм2/мм рт.ст.) |
1 |
0,18 (0,09); 0,16-0,21 |
0,18 (0,08); 0,15-0,21 |
0,8000 |
|
0 |
0,2 (0,07); 0,18-0,23 |
0,18 (0,07); 0,15-0,2 |
0,1683 |
|
|
Р’ |
0,1904 |
0,7616 |
– |
Примечание: данные представлены в виде М(SD), 95% ДИ. АГ — "1" — группа пациентов с АГ, "0" — нормотензивные обследованные.
Сокращения: АГ — артериальная гипертония, Ж — группа "женщины", М — группа "мужчины", ПАД — пульсовое артериальное давление, РВА — расчетный возраст артерии, СПВ — скорость пульсовой волны, ТКИМ — толщина комплекса "интима-медиа", CC — compliance coefficient — коэффициент податливости, DC — distensibility coefficient — коэффициент растяжимости, Ep — модуль эластичности Петерсона, Eу — модуль упругости Юнга, SI — stiffness index — индекс жесткости, Strain — деформация общих сонных артерий.
Проведенный корреляционный анализ выявил взаимосвязи СПВ с показателями суточного мониторирования артериального давления в гр. М с АГ: с уровнем офисного САД (r=0,408, р=0,0001) и ДАД (r=0,270, р=0,007); ночным индексом времени гипербарической нагрузки ДАД: (r=0,315, p=0,038); ночной вариабельностью ДАД (r=0,265, p=0,045) и САД (r=0,307, p=0,044). В гр. Ж: с уровнем офисных САД (r=0,507, p=0,0001) и ДАД (r=0,508, р=0,0001); ночного САД (r=0,344, р=0,021); суточным индексом САД (r=0,382, p=0,041); суточный индекс ДАД (r=0,410, p=0,0001); среднесуточным САД (r=0,523, р=0,001), что подтверждает взаимосвязь СПВ с риском АГ.
По данным анализа пошаговой логистической регрессии шанс наличия АГ прямо зависел от показателей СПВ. Увеличение СПВ на единицу измерения у Ж повышало вероятность АГ в 1,7 раза, у М — в 1,4 раза. Хотя сама по себе гендерная принадлежность обследованных на вероятность АГ влияния практически не оказывала (табл. 4). Это подтверждает ROC-анализ с оценкой AUC (рис. 1), который позволил визуально оценить более сильную связь СПВ с риском АГ у Ж, у которых площадь под кривой составила 0,791.
Таблица 4
Формула модели вероятности АГ у мужчин и женщин в зависимости от показателей состояния сосудистой стенки (данные пошаговой логистической регрессии)
|
Показатель |
B (SD) |
Exp(B) |
95% ДИ для Exp(B) |
P |
|
СПВ (мужчины) |
0,328 (0,142) |
1,389 |
1,050-1,836 |
0,0200 |
|
СПВ (женщины) |
0,538 (0,146) |
1,713 |
1,287-2,281 |
<0,0001 |
|
ТКИМ |
2,899 (0,838) |
1,991 |
1,274-5,5900 |
0,0080 |
|
DC |
0,314 (0,144) |
1,3690 |
1,032-1,8150 |
0,0290 |
|
Eр |
-0,035 (0,014) |
0,966 |
0,9400-0,9920 |
0,0110 |
|
Eу |
0,022 (0,008) |
1,122 |
1,007-1,237 |
0,0050 |
|
SI |
2,072 (1,822) |
1,126 |
1,004-4,476 |
0,0255 |
|
Пол |
0,300 (0,123) |
1,350 |
0,744-2,540 |
0,3240 |
|
ИМТ |
0,228 (0,117) |
1,256 |
0,9990-1,581 |
0,052 |
|
Возраст |
0,0220 (0,082) |
0,978 |
0,834-1,148 |
0,787 |
|
Константа |
-6,884 (1,905) |
0,001 |
– |
<0,0001 |
Сокращения: ДИ — доверительный интервал, ИМТ — индекс массы тела, СПВ — скорость пульсовой волны, ТКИМ — толщина комплекса "интима-медиа", DC — distensibility coefficient — коэффициент растяжимости, Ep — модуль эластичности Петерсона, Exp(B) — отношение шансов, Eу — модуль упругости Юнга, SI — stiffness index — индекс жесткости.
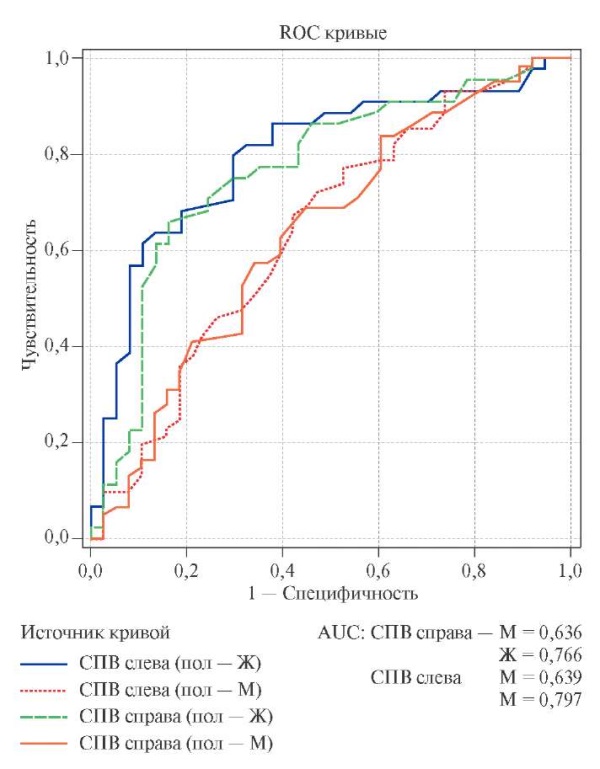
Рис. 1. График ROC-анализа риска АГ и СПВ с оценкой AUC у мужчин и женщин.
Примечание: AUC — площадь под кривой.
Сокращения: СПВ — скорость пульсовой волны, СРБ — С-реактивный белок.
Кроме того, ОШ наличия АГ (с учетом поправки ИМТ и возраста обследованных) увеличивали такие показатели состояния сосудистой стенки, как ТКИМ (ОШ 1,4), коэффициент растяжимости (ОШ 1,4), Еу (ОШ 1,12) и индекс жесткости (ОШ 1,126). Таким образом, в условиях арктической вахты, увеличение жесткости и ригидности сосудистой стенки, сопровождаемое увеличением СПВ (выше популяционной нормы, равной <9 м/с), достаточно четко увеличивают шанс АГ. Чувствительность полученной модели составила 80,5%, специфичность — 77,8%. Общий процент правильно предсказанных результатов — 88,9%.
Из таблицы 5 следует, что в группах М и Ж с АГ в сравнении с нормотензивными обследованными были значимо выше уровни С-пептида (р=0,032), инсулина (р=0,035), IL-1β (р=0,025), кортизола (р=0,031) у М; в группе Ж — значимо выше уровни С-пептида (р=0,015), инсулина (р=0,012), IL-6 (р=0,021), ФНО-α (р=0,047). В гр. М с АГ был выше уровень гомоцистеина (р=0,001), IL-6 (р=0,051), чем в гр. Ж с АГ, но значимо ниже IL-6 (р=0,047) и NT-proBNP (р=0,005).
Таблица 5
Сравнительный анализ биохимических показателей в группах мужчин и женщин с АГ и нормотензивных лиц
|
Показатель |
Группа |
Мужчины |
Женщины |
Р |
|
Гомоцистеин, мкмоль/л |
АГ |
16,1 (14,54-17,65) |
13,7 (11,98-14,07) |
0,001 |
|
N |
14,2 (12,28-19,25) |
11,8 (10,87-12,87) |
0,004 |
|
|
P’ |
0,164 |
0,146 |
– |
|
|
Инсулин, мкМЕ/мл |
АГ |
13,2 (8,6-19,8) |
11,41 (5,19-17,95) |
0,820 |
|
N |
8,24 (5,34-11,14) |
7,87 (2,7-13,2) |
0,036 |
|
|
P’ |
0,035 |
0,012 |
– |
|
|
С-пептид, нг/м |
АГ |
3,48 (2,87-4,09) |
3,82 (3,05-4,61) |
0,876 |
|
N |
2,45 (2,61-3,43) |
2,81 (1,65-3,99) |
0,034 |
|
|
P’ |
0,032 |
0,015 |
– |
|
|
IL-1β, пг/мл |
АГ |
2,84 (2,57-3,25) |
2,12 (2,01-2,63) |
0,051 |
|
N |
2,12 (2,19-2,31) |
2,3 (2,24-2,78) |
0,812 |
|
|
P’ |
0,025 |
0,2173 |
– |
|
|
IL-6, пг/мл |
АГ |
2,3 (2,14-2,74) |
2,7 (2,47-2,96) |
0,047 |
|
N |
2,0 (1,91-2,39) |
2,11 (2,12-2,27) |
0,145 |
|
|
P’ |
0,135 |
0,021 |
– |
|
|
IL-8, пг/мл |
АГ |
10,6 (10,3-13,4) |
10,2 (9,24-13,08) |
0,606 |
|
N |
10,55 (9,52-13,48) |
9,1 (8,8-12,31) |
0,556 |
|
|
P’ |
0,804 |
0,633 |
– |
|
|
ФНО-α, пг/мл |
АГ |
6,51 (2,35-10,67) |
7,85 (6,22-9,68) |
0,964 |
|
N |
6,25 (3,03-9,47) |
5,35 (5,01-6,11) |
0,348 |
|
|
P’ |
0,737 |
0,047 |
– |
|
|
IL-10, пг/мл |
АГ |
4,12 (3,85-4,43) |
4,12 (3,87-4,44) |
0,656 |
|
N |
4,19 (3,89-4,48) |
4,29 (4,02-4,62) |
0,488 |
|
|
P’ |
0,659 |
0,591 |
– |
|
|
Кортизол, нмоль/л |
АГ |
268,7 (244,4-291,6) |
229,1 (216,4-279,5) |
0,242 |
|
N |
226,5 (212,3-244,8) |
222,3 (207,1-278,3) |
0,488 |
|
|
P’ |
0,031 |
0,803 |
– |
|
|
NT-proBNP (пг/мл) |
АГ |
83,4 (67,1-99,6) |
121,5 (96,6-146,3) |
0,005 |
|
N |
69,9 (52,6-87,2) |
125,3 (98,1-152,5) |
0,001 |
|
|
P’ |
0,310 |
0,733 |
– |
|
|
вчСРБ (мг/л) |
АГ |
4,88 (3,03-6,73) |
5,28 (4,04-6,53) |
0,102 |
|
N |
3,75 (2,59-4,91) |
5,40 (3,47-7,34) |
0,173 |
|
|
P’ |
0,891 |
0,659 |
– |
Примечание: данные представлены в виде М(SD), 95% ДИ. Р — уровень значимости различий в группах мужчин и женщин; Р’ — уровень значимости различий в группах мужчин и женщин с АГ и без (Mann-Whitney U Test). АГ — группа обследованных с АГ, N — группа нормотензивных обследованных.
Сокращения: АГ — артериальная гипертония, вчСРБ — высокочувствительный С-реактивный белок, ДИ — доверительный интервал, ФНО-α — фактор некроза опухоли альфа, IL — интерлейкин, NT-proBNP — N-концевой промозговой натрийуретический пептид.
Получены корреляции СПВ в группе М с уровнем IL-1β (r=0,373, р=0,047); IL-6 (r=0,277, р=0,024); кортизолом (r=0,271, р=0,040), в гр. Ж с уровнем фолликулостимулирующего гормона (r=0,385, р=0,0001), ФНО-α (r=0,335, р=0,030), что косвенно свидетельствует о взаимосвязи СПВ с иммунным воспалением у обоих полов, дисгормональными нарушениями у Ж и риском АГ.
В таблице 6 показаны результаты пошагового логистического регрессионного анализа независимых параметров, влияющих на шанс наличия АГ у М. Показаны β-коэффициенты, включенные в уравнение регрессии. Вклад каждой переменной оценивался по ОШ, показывающему во сколько раз изменится шанс наличия АГ при изменении изучаемого фактора на единицу его измерения. Уровень кортизола незначительно влиял на риск АГ в гр. М (ОШ 1,006, р=0,155). В то же время увеличение СПВ увеличивало шанс АГ 1,5 раза; С-пептида — в 1,2 раза; IL-1β — в 1,5 раза. Довольно существенную роль в увеличении шанса АГ у мужчин сыграла ИМТ (в 1,2 раза, р=0,006). В целом модель показала достаточно высокую чувствительность (69,6%) и специфичность (72,4%).
Таблица 6
Результаты пошагового логистического регрессионного анализа независимых параметров, влияющих на шанс АГ у мужчин
|
Показатель |
В |
Р |
Exp(B) |
±95% ДИ |
AUC |
±95% ДИ* |
|
СПВ |
0,441 |
0,025 |
1,554 |
1,058-2,281 |
0,635 |
0,522-0,748 |
|
С-пептид |
0,208 |
0,022 |
1,186 |
1,004-1,588 |
0,603 |
0,404-0,641 |
|
IL-1β |
0,381 |
0,099 |
1,464 |
0,936-2,291 |
0,568 |
0,456-0,680 |
|
Кортизол |
0,006 |
0,155 |
1,006 |
1,000-1,012 |
0,561 |
0,447-0,676 |
|
Возраст |
0,046 |
0,090 |
1,047 |
0,993-1,103 |
0,577 |
0,463-0,691 |
|
ИМТ |
0, 740 |
0,006 |
1,190 |
1,051-1,348 |
0,664 |
0,552-0,775 |
Примечание: * — ДИ AUC. AUC — вычислялась для каждого ковариата.
Сокращения: ДИ — доверительный интервал, ИМТ — индекс массы тела, СПВ — скорость пульсовой волны, В — коэффициент, Exp(B) — отношение шансов, IL — интерлейкин, Р — уровень значимости влияния фактора.
Шанс АГ в гр. Ж (табл. 7) также прямо зависел от показателя СПВ (ОШ 2,0); Уровень С-пептида увеличивал шанс АГ в 2,1 раза, IL-6 — в 2,1 раза. Уровень ФНО-α имел обратную зависимость, снижая шанс АГ при своем повышении в 0,8 раза. По данным классификатора чувствительность и специфичность модели (72,1% и 74,4%, соответственно).
Таблица 7
Результаты пошагового логистического регрессионного анализа независимых параметров, влияющих на шанс АГ у женщин
|
Показатель |
В |
Р |
Exp(B) |
±9 5% ДИ |
AUC |
±95% ДИ* |
|
СПВ |
0,701 |
0,001 |
2,015 |
1,319-3,078 |
0,7910 |
0,690-0,893 |
|
С-пептид |
0,758 |
0,006 |
2,133 |
1,236-3,680 |
0,6240 |
0,500-0,749 |
|
IL-6 |
0,742 |
0,049 |
2,101 |
1,003-4,400 |
0,6110 |
0,487-0,735 |
|
ФНО-α |
-0,222 |
0,016 |
0,801 |
0,668-0,959 |
0,4150 |
0,288-0,543 |
|
Возраст |
0,078 |
0,140 |
1,081 |
0,975-1,200 |
0,684 |
0,569-0,800 |
|
ИМТ |
0,117 |
0,109 |
1,124 |
0,974-1,297 |
0,623 |
0,500-0,746 |
Примечание: * — ДИ AUC. AUC — вычислялась для каждого ковариата.
Сокращения: ДИ — доверительный интервал, ИМТ — индекс массы тела, СПВ — скорость пульсовой волны, ФНО-α — фактор некроза опухоли альфа, В — коэффициент, Exp(B) — отношение шансов, IL — интерлейкин, Р — уровень значимости влияния фактора.
Обсуждение
АГ имеет множество причин и сложную патофизиологию, важным звеном в формировании заболевания является эндотелиальная дисфункция, которая способствует структурным изменениям сосудистой стенки и повышает жесткость крупных сосудов [2]. Наше исследование показало значимое повышение СПВ у пациентов с АГ и ее взаимосвязь с офисными и среднесуточными уровнями АД. Причем, по данным ROC-анализа с оценкой AUC данная взаимосвязь у Ж была более сильная, чем у М, что совпадает с данными [11], показавшими прогностически более важное для Ж старение сосудистой стенки в развитии сердечно-сосудистого заболевания.
В последние годы активно изучается роль хронической гиперактивации иммунных клеток, стимулирующих выработку провоспалительных цитокинов, который проявляется на самых ранних стадиях АГ и заканчивается повреждением органов-мишеней [12]. Учитывая приоритет персонализированной медицины, важным становится понимание механизмов АГ, опосредованной иммунитетом, специфичных для пола и их динамики в течение жизни М и Ж.
Проведен анализ данных пошаговой логистической регрессии, включающий жесткость сосудистой стенки, биохимические показатели крови, в т.ч. воспалительных цитокинов, с построением математических моделей АГ у обоих полов. Шанс наличия АГ у М прямо зависел от уровня IL-1β (ОШ 1,667). Все больше данных свидетельствует о том, что IL-1β играет значительную роль в патогенезе АГ. В работе Melton E, et al. (2021), показано, что IL-1β не только участвует в провоспалительной реакции в сосудах, но также влияет на фенотип и функцию гладкомышечных клеток сосудов, ремоделирование сосудов при различных типах АГ, участвует в регуляции воспаления [13].
Наиболее существенный вклад в увеличение шанса наличия АГ у Ж вносит IL-6 (ОШ 2,172), влияние ФНО-α оказалось менее значительно (ОШ 0,830). Известно, что различные цитокины (IL-6, ФНО-α), высвобождаемые из иммунных клеток различных подтипов, способствуют старению сосудов и деградации эластических пластинок, а также фиброзу и/или гипертрофии сердца, что приводит к структурным изменениям и дисфункции сердечно-сосудистой системы [12]. Следует отметить также, что у Ж с АГ значимо выше уровень предсердного натрийуретического пептида, чем у гипертензивных М. Роль различных гендероспецифических цитокинов в особенностях ремоделирования сердечно-сосудистой системы у пациентов с АГ в условиях Арктики нуждаются в нашем дальнейшем изучении.
В проспективных исследованиях [14][15] показано, что одно стандартное отклонение в исходной концентрации IL-6, С-реактивного белка или фибриногена было связано с повышением риска развития АГ на 20-40%. В работе Daniel W, et al. (2014) определена взаимосвязь симпатической нервной системы с иммунными клетками, выработкой цитокинов и, в конечном счете, к сосудистой дисфункции, способствующей усилению АГ, поэтому в наше исследование были включены и проанализированы некоторые показатели углеводного обмена [16].
Обращает внимание, что в модель ОШ наличия АГ у обоих полов входит С-пептид (ОШ 2,73 у М и ОШ 1,9 у Ж) во взаимосвязи с сосудистой жесткостью (СПВ). Полученные данные подтверждают, что эндогенная секреция С-пептида может играть важную роль в формировании и прогрессировании артериальной жесткости у пациентов с АГ, даже не страдающих диабетом [17][19]. Вместе с тем последние данные свидетельствуют о том, что повышенный уровень продукта расщепления проинсулина С-пептид может выполнять роль медиатора, являясь причиной атерогенеза, способствуя привлечению моноцитов и лимфоцитов в ранние атеросклеротические поражения и индуцируя пролиферацию гладкомышечных клеток сосудов [19]. Полученные результаты могут свидетельствовать о том, что формирование АГ и атеросклеротическое поражение сосудов у вахтовиков в Арктике формируются одновременно.
Заключение
В условиях арктической вахты высокие значения показателей, характеризующих жесткость сосудистой стенки, независимо от половой принадлежности, связаны с наличием АГ. У мужчин независимо от уровня АД показатели сосудистой жесткости были выше, однако более сильная связь сосудистой ригидности с риском АГ прослеживалась у женщин. У пациентов с АГ в арктическом регионе выявлена ассоциация сосудистой жесткости с факторами неспецифического иммунного воспаления, более выраженная у женщин. В модели "северной" АГ помимо жесткости сосудистой стенки и провоспалительных цитокинов, входит продукт расщепления проинсулина С-пептид, являющийся модулятором атеросклеротического процесса.
Отношения и деятельность: все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье.
Список литературы
1. Муромцева Г. А., Концевая А. В., Константинов В. В. и др. Распространенность факторов риска неинфекционных заболеваний в российской популяции в 2012-2013 гг. Результаты исследования ЭССЕ-РФ. Кардиоваскулярная терапия и профилактика. 2014;13(6):4-11. doi:10.15829/1728-8800-2014-6-4-11.
2. Grassi G, Ram SV. Evidence for a critical role of the sympathetic nervous system in hypertension. J Am Soc Hypertens. 2016;10(5):457-66. doi:10.1016/j.jash.2016.02.015.
3. Niiranen TJ, Kalesan B, Hamburg NM, et al. Relative Contributions of Arterial Stiffness and Hypertension to Cardiovascular Disease: The Framingham Heart Study. J Am Heart Assoc. 2016;26;5(11). pii:e004271.
4. Aroor AR, Jia G, Sowers JR. Cellular mechanisms underlying obesity-induced arterial stiffness. Am J Physiol Regul Integr Comp Physiol. 2018;314(3):R387-R398. doi:10.1152/ajpregu.00235.2016.
5. McMaster GW, Kirabo A, Madhur SM, et al. Inflammation, immunity, and hypertensive end-organ damage. Circ Res. 2015;116(6):1022-33. doi:10.1161/CIRCRESAHA.116.303697.
6. Гапон Л. И., Шуркевич Н. П., Ветошкин А. С. и др. Артериальная гипертония в условиях Крайнего Севера. Десинхроноз и гиперактивность организма как факторы формирования болезни. Москва: Мед. книга, 2009. p. 207. ISBN: 978-5-86093-277-4.
7. Winklewski PJ, Radkowski M, Demkow U. Relevance of Immune-Sympathetic Nervous System Interplay for the Development of Hypertension. Adv Exp Med Biol. 2016;884:3743. doi:10.1007/5584_2015_169.
8. Чазова И. Е., Ощепкова Е. В., Жернакова Ю. В. от имени экспертов. Диагностика и лечение артериальной гипертонии. Системные гипертензии. 2019;1:6-31. doi:10.26442/2075082X.2019.1.190179.
9. Laurent S, Cockcroft J, Bortel LV. Expert consensus document on arterial stiffness: methodological issues and clinical applications on behalf of the European Network for Non-invasive Investigation of Large Arteries. European Heart Journal. 2006;27:2588-605. doi:10.1093/eurheartj/ehl254.
10. Лелюк В. Г., Лелюк С. Э. Ультразвуковая ангиология. 3-е изд., доп. и перераб. М.: Реал Тайм; 2007 р. 416.
11. Ji H, Kim A, Ebinger JE, et al. Sex Differences in Blood Pressure Trajectories Over the Life Course. JAMA Cardiol. 2020;5(3):19-26. doi:10.1001/jamacardio.2019.5306.
12. Rai A, Narisawa M, Li P, et al. Adaptive immune disorders in hypertension and heart failure: focusing on T-cell subset activation and clinical implications. J Hypertens. 2020;38(10):1878-89. doi:10.1097/HJH.0000000000002456.
13. Melton E, Qiu H. Interleukin-1β in Multifactorial Hypertension: Inflammation, Vascular Smooth Muscle Cell and Extracellular Matrix Remodeling, and Non-Coding RNA Regulation. Int J Mol Sci. 2021;22(16):8639. doi:10.3390/ijms22168639.
14. Blaha JM, DeFilippis PA. Multi-Ethnic Study of Atherosclerosis (MESA): JACC Focus Seminar 5/8. J Am Coll Cardiol. 2021;77(25):3195-216. doi:10.1016/j.jacc.2021.05.006.
15. Angeli F, Reboldi G, Verdecchia P. The Link Between Inflammation and Hypertension: Unmasking Mediators. Am J Гипертенз. 2021;34(7):683-5. doi:10.1093/ajh/hpab034.
16. Daniel W, Trott DW, Harrison DG. The immune system in hypertension. Adv Physiol Educ. 2014;38(1):20-4. doi:10.1152/advan.00063.2013.
17. Sun Y, Zhu Y, Zhang L, et al. Relationship between Insulin Secretion and Arterial Stiffness in Essential Hypertension. Int J Hypertens. 2021;2021:5015797.
18. Sokooti S, Kieneker LM, Borst MH. Plasma C-Peptide and Risk of Developing Type 2 Diabetes in the General Population. J Clin Med. 2020;9(9):3001. doi:10.3390/jcm9093001.
19. Walcher D, Marx N. C-Peptide in the vessel wall. Rev Diabet Stud. 2009;6(3):180-6. doi:10.1900/RDS.2009.6.180.
Об авторах
Н. П. ШуркевичРоссия
Шуркевич Нина Петровна — доктор медицинских наук, ведущий научный сотрудник отделения артериальной гипертонии и коронарной недостаточности научного отдела клинической кардиологии
Томск
А. С. Ветошкин
Россия
Ветошкин Александр Семенович — доктор медицинских наук, старший научный сотрудник отделения артериальной гипертонии и коронарной недостаточности научного отдела клинической кардиологии; врач функциональной и ультразвуковой диагностики
Томск, п. Ямбург
А. А. Симонян
Россия
Симонян Ани Арсеновна — врач-ординатор отделения артериальной гипертонии и коронарной недостаточности научного отдела клинической кардиологии
Томск
Л. И. Гапон
Россия
Гапон Людмила Ивановна — доктор медицинских наук, профессор, Заслуженный деятель науки Российской Федерации, руководитель научного отдела клинической кардиологии
Томск
М. А. Карева
Россия
Карева Мария Андреевна — врач-ординатор отделения артериальной гипертонии и коронарной недостаточности научного отдела клинической кардиологии
Томск
Дополнительные файлы
Рецензия
Для цитирования:
Шуркевич Н.П., Ветошкин А.С., Симонян А.А., Гапон Л.И., Карева М.А. Артериальная гипертензия в условиях вахты в Арктике: особенности взаимосвязей жесткости артерий с маркерами воспаления и некоторыми метаболическими факторами риска. Российский кардиологический журнал. 2023;28(4):5167. https://doi.org/10.15829/1560-4071-2023-5167
For citation:
Shurkevich N.P., Vetoshkin A.S., Simonyan A.A., Gapon L.I., Kareva M.A. Hypertension in individuals working in the Arctic on a rotating basis: relationship of arterial stiffness with inflammatory markers and some metabolic risk factors. Russian Journal of Cardiology. 2023;28(4):5167. (In Russ.) https://doi.org/10.15829/1560-4071-2023-5167
JATS XML

















































