Перейти к:
Подкожный кардиовертер-дефибриллятор, отбор пациентов, техника имплантации, послеоперационное ведение в ФЦССХ г. Красноярска
https://doi.org/10.15829/1560-4071-2022-5116
Аннотация
Статья описывает методику отбора пациентов для имплантации подкожного имплантируемого кардиовертера-дефибриллятора, технику имплантации и особенности послеоперационного наблюдения пациентов в стационаре и на амбулаторном этапе, ключевые особенности программирования на всех этапах лечения пациента.
Ключевые слова
Для цитирования:
Прокопенко А.В., Иваницкий Э.А. Подкожный кардиовертер-дефибриллятор, отбор пациентов, техника имплантации, послеоперационное ведение в ФЦССХ г. Красноярска. Российский кардиологический журнал. 2022;27(8):5116. https://doi.org/10.15829/1560-4071-2022-5116
For citation:
Prokopenko A.V., Ivanitskiy E.A. Subcutaneous cardioverter-defibrillator, patient selection, implantation, postoperative management in the Krasnoyarsk. Russian Journal of Cardiology. 2022;27(8):5116. (In Russ.) https://doi.org/10.15829/1560-4071-2022-5116
На сегодняшний день имплантируемые кардиовертеры-дефибрилляторы (ИКД) показали себя высокоэффективным средством в борьбе с внезапной сердечной смертью (ВСС) как в качестве первичной, так и в качестве вторичной профилактики ВСС. В России операции по имплантации ИКД проводятся с начала 1990-х годов, но количество операций не покрывает весь список нуждающихся. Потребность в ИКД на 1 млн населения составляет от 50 до 400 операций в год (по данным разных исследований), в 2006г в Российской Федерации было имплантировано 1,3 ИКД на 1 млн населения, в 2011г 9 ИКД на 1 млн населения, в 2013г чуть более 13 ИКД на 1 млн населения, в 2018г 18 ИКД на 1 млн населения [1].
На сегодняшний день в мире имплантировано 75 тыс. подкожных кардиовертеров-дефибрилляторов (S-ICD). S-ICD решает многие проблемы, обусловленные особенностями имплантации традиционных интравенозных систем ИКД, такие как эндокардиты, окклюзия верхней полой и подключичной вен, механическое повреждение трикуспидального клапана, сложности при имплантации интравенозных электродов не только при нестандартной анатомии, но и на оперированном ранее сердце (протезирование трикуспидального клапана, операция Mustard, Fonten и др.), трудности имплантации эпикардиально расположенных электродов, шоковой спирали, особенно с учетом анатомических особенностей детей [2], высокие риски осложнений при имплантации системы, такие как пневмоторакс, гемоторакс, гемоперикард, перфорация стенки сердца, повреждение хордального аппарата и сосочковых мышц, ограничение двигательной активности пациента, механическое повреждение электродов как следствие активных движений. Достойное положение S-ICD в одном ряду с традиционными интравенозными однокамерными ИКД доказали крупные многоцентровые исследования по применению S-ICD: завершенные IDE и EFFORTLESS (в последствии ставшим регистром), PRAETORIAN, UNTOUCHED и незавершенные PRAETORIAN-DFT, MADIT-SICD.
Конечно, как и каждая методика лечения, S-ICD не лишен определенных особенностей, ограничивающих его применение. Так, у S-ICD отсутствует возможность длительной стимуляции, кроме первых 30 сек после шока, имеются особенности экстракардиальной детекции сердечных сигналов, большие размеры корпуса и вес, по сравнению с трансвенозными ИКД [3], отсутствует возможность антитахистимуляции, по-прежнему имеют место инфицирование и пролежни ложа ИКД и электродов.
Цель исследования: описать особенности отбора пациентов для имплантации S-ICD, описать технику имплантации и программирования S-ICD в операционной и после операции, описать особенности ведения пациентов на амбулаторном этапе после выписки из стационара. Примеры клинических случаев при наблюдении за пациентами на опыте ФЦССХ г. Красноярска.
Материал и методы
Проведен анализ историй болезни, амбулаторных карт, протоколов программирования пациентов с имплантированными S-ICD в ФЦССХ г. Красноярска за 3 года (с 2018 по 2021гг).
Результаты
Описание методики отбора пациента, техники имплантации. Учитывая особенности в технике имплантации S-ICD, при отборе пациента необходимо выполнить рентгенограмму органов грудной клетки с оценкой анатомических особенностей расположения сердца, костных структур. А также обязательным пунктом при отборе пациента является тест на программаторе Boston Scientific, суть которого заключается в записи электрокардиограммы (ЭКГ), приближенной к подкожной. Электроды подключаются следующим образом: черный в любую область на поверхности грудной клетки или передней брюшной стенки (земля), зеленый в пятом межреберье по передней подмышечной линии, желтый на линии прикрепления мечевидного отростка к грудине по латеральному краю, красный на 14 см выше желтого, также по латеральному краю грудины соответственно стороне расположения сердца [4]. Затем на программаторе в основном меню запускается программа тестирования для S-ICD. Тест выполняется в положении лежа. Программатор выполняет запись трех образцов ЭКГ по трем векторам восприятия, затем таким же образом, но в положении сидя или в положении стоя. По итогу и первого и второго теста образец ЭКГ должен быть одобрен программой, хотя бы по одному из векторов.
Изначально в процедуре имплантации S-ICD применялась техника имплантации “трех разрезов”, затем, с опытом, в практике прижилась техника “двух разрезов” (рис. 1). Корпус S-ICD располагается в межмышечном кармане (первый кожный разрез), сформированном тупым способом между зубчатой и широчайшей мышцами спины, между передней и средней подмышечными линиями в области пятого межреберья. Как показала практика, чем дорсальнее расположен аппарат, тем меньше порог дефибрилляции. Подкожный дефибриллирующий электрод, отходя от корпуса S-ICD, формирует угол 90 градусов в области мечевидного отростка (второй кожный разрез) и укладывается вдоль латерального края грудины, соответственно стороне расположения сердца (рис. 2). Ключевым моментом при имплантации S-ICD является позиция сердца на рентгенограмме: сердце должно полностью оказаться в треугольнике, образовавшемся между тремя векторами, сформированными электродом и корпусом S-ICD (рис. 3). Так формируются 3 вектора восприятия сердечного сигнала (3 стороны треугольника). S-ICD воспринимает сердечный сигнал по одному из 3-х сформировавшихся векторов, выбирает он его автоматически, ориентируясь на максимальную амплитуду комплекса QRS и “чистоту” сигнала [5]. Первичное программирование S-ICD в условиях операционной включает в себя внесение паспортных данных пациента, информации об имплантируемом электроде, сбор образца подкожной ЭКГ, установку зоны желудочковой тахикардии (ЖТ)-фибрилляции желудочков (ФЖ), активацию шоковой терапии, дефибрилляционный тест с шоком 65 Дж, подтверждение запрограммированного вольтажа шока [6].
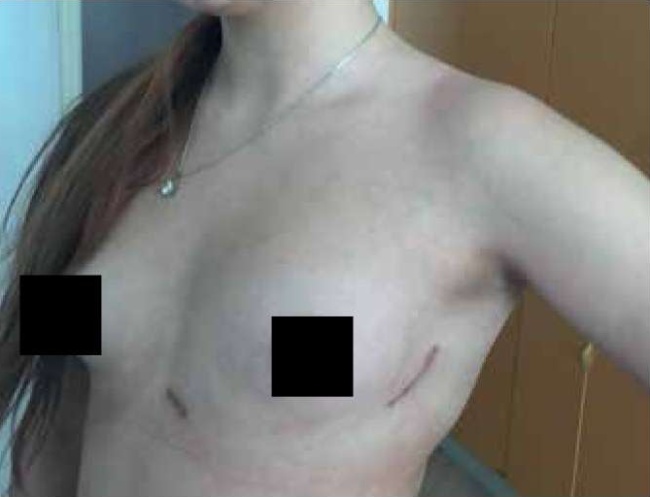
Рис. 1. Техника “двух разрезов”.
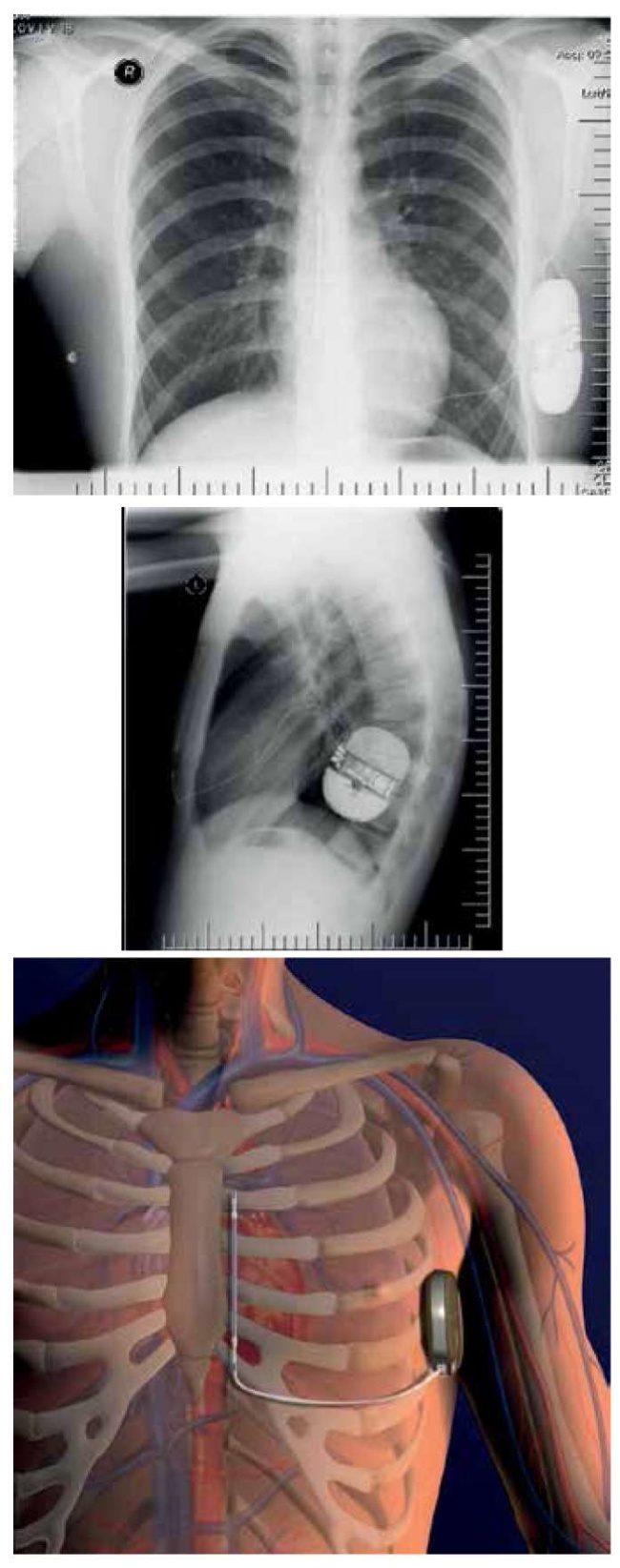
Рис. 2. Подкожный дефибриллирующий электрод, отходя от корпуса S-ICD, формирует угол 90 градусов в области мечевидного отростка (второй кожный разрез) и укладывается вдоль латерального края грудины, соответственно стороне расположения сердца.
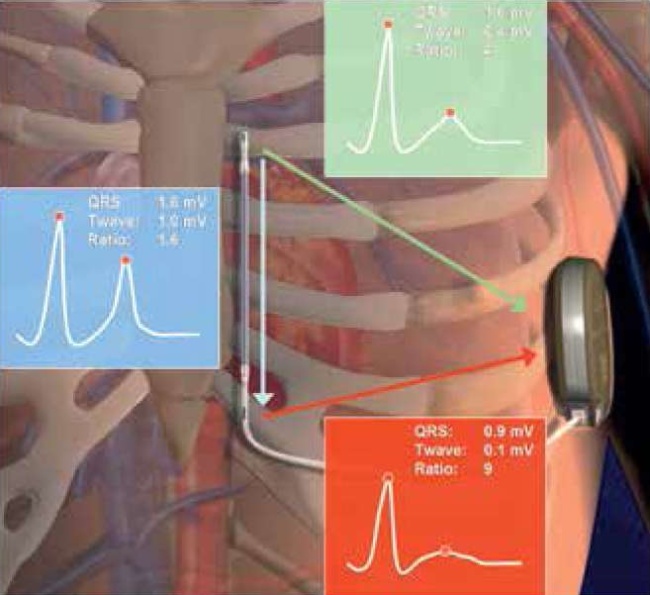
Рис. 3. Сердце должно полностью оказаться в треугольнике, образовавшемся между тремя векторами, сформированными электродом и корпусом S-ICD.
Ведение пациентов после имплантации S-ICD включает в себя несколько этапов. Программирование ИКД на следующий день после операции включает проверку корректности введенных паспортных данных пациента, корректность программы S-ICD, сбор образца подкожной ЭКГ, подтверждение активированной шоковой терапии в выбранных зонах. Через один месяц после операции в условиях поликлинического отделения на амбулаторном приеме (у нас это прием кардиолога с программированием имплантированного антиаритмического устройства) проводится сбор информации из записной книжки S-ICD о проведенных терапиях и зарегистрированных эпизодах нарушений ритма, тест на велоэргометре, направленный на подтверждение корректности восприятия S-ICD синусовой тахикардии при физических нагрузках и сбор образцов ЭКГ при синусовой тахикардии и, если имеет место, сбор образца ЭКГ с преходящей блокадой проведения импульса по миокарду желудочков (блокады ножек пучка Гиса) на фоне синусовой тахикардии, для исключения ошибок в детекции истинных ЖТ и ФЖ [7]. Контрольные follow-up 2 раза в год или после развившегося шока между контрольными визитами направлены на сбор информации из записной книжки S-ICD о имеющих место нарушениях ритма, оценки корректности детекции ЖТ/ФЖ и корректности нанесенной кардиоверсии на тахикардию, при необходимости коррекция настроек S-ICD, контроль за состоянием заряда батареи.
Опыт применения S-ICD в ФЦССХ г. Красноярска. На сегодняшний день в России имплантировано 175 S-ICD, 12 из них имплантированы в ФЦССХ г. Красноярска (11 S-ICD имплантировано взрослым пациентам, 1 S-ICD имплантирован ребенку 12-ти лет). С июня 2018г у наблюдаемых нами пациентов были выявлены: 1 случай ложной детекции Т-волны с развившимся шоком у пациентки 20 лет на второй год после имплантации S-ICD, 1 случай шока на крепитацию воздуха в области электрода в первые сутки после имплантации S-ICD, 2 эпизода ЖТ были успешно купированы первым шоковым разрядом; 1 эпизод ЖТ купировался спонтанно, 2 шока у одного пациента были нанесены на тахиформу фибрилляции предсердий, этому пациенту позже была выполнена радиочастотная изоляция легочных вен, 3 эпизода с развившейся ФЖ после ранней желудочковой экстрасистолии с эффективным первым шоком (рис. 4), последующим в этом же эпизоде рецидивом в трепетания желудочков, также купировавшимся с первого шока. Смещения электродов, неэффективных шоков, инфицирования ложа электрода или устройства за обозначенный период наблюдения пациентов выявлено не было.
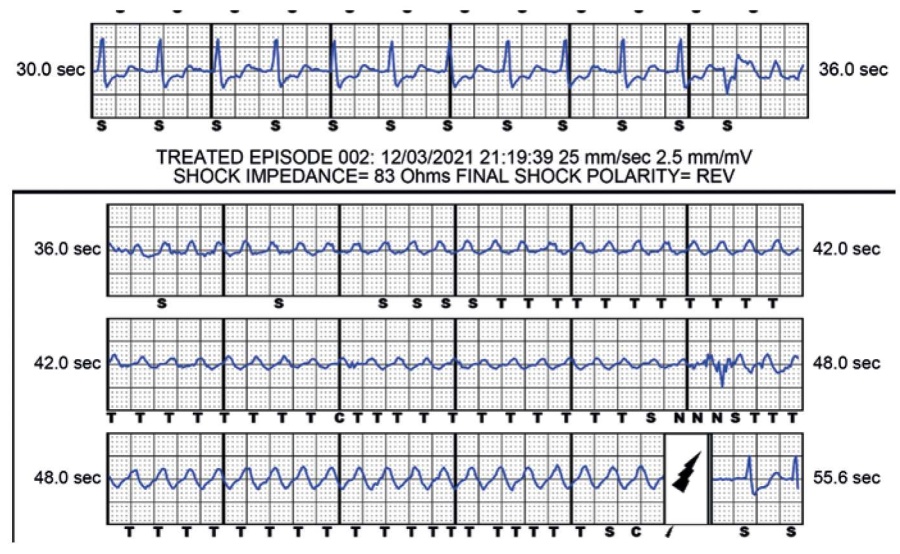
Рис. 4. Ранняя желудочковая экстрасистолия с эффективным первым шоком.
Обсуждение
Применение S-ICD в сравнении с интравенозным ИКД позволяет исключить или значимо снизить риски применения дефибриллирующих систем: ограничение двигательной активности пациента, механическое повреждение электрода (именно как следствие активных движений), эндокардиты, ассоциированные с внутрисердечной системой, окклюзию верхней полой и подключичной вен, механическое повреждение трикуспидального клапана, хордального аппарата и сосочковых мышц, пневмоторакс, гемоторакс, гемоперикард, перфорации стенки сердца, технические трудности при имплантации интравенозных электродов в условиях нестандартной анатомии сосудов пациента и на ранее оперированном сердце, трудности имплантации эпикардиальных электродов с шоковой спиралью, в частности с учетом анатомических особенностей детей. S-ICD показал себя ничуть не уступающим интравенозным системам ИКД в эффективности шоковой терапии, не менее корректно оценивал и тахиформу фибрилляции предсердий, и наджелудочковые тахикардии, корректно проводил дискриминацию Т-волны.
Заключение
Применение S-ICD на сегодняшний день приобретает все более широкое применение в клинической практике. S-ICD показали себя достойной альтернативой интравенозным системам при имплантации с целью первичной профилактики ВСС, когда пациенту не показана антитахистимуляция и антибрадистимуляция. Приведенные данные нашего клинического опыта применения S-ICD для первичной и вторичной профилактики ВСС показали, что S-ICD является достойной заменой интравенозным системам ИКД при условии грамотного отбора пациентов. Таким образом, можно сделать вывод, что S-ICD имеет значительные перспективы применения в клинической практике, особенно у пациентов, находящихся в высокой степени риска по развитию инфекционного эндокардита, а также у пациентов с оперированным сердцем по поводу врожденных пороков.
Отношения и деятельность: все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье.
Список литературы
1. Богачевская С. А., Богачевский А. Н. Развитие хирургической и интервенционной аритмологии в России за 10 лет. Особенности функциоирования службы в дальневосточном регионею. Электронный научный журнал Социальные аспекты здоровья населения. 2017г. doi:10.21045/2071-5021-2017-53-1-1.
2. Griksaitis MJ, Rosengarten JA, Gnanapragasam JP, et al. Implantable cardioverter defibrillator therapy in paediatric practice: a single-centre UK experience with focus on subcutaneous defibrillation. Europace. 2013;15(4):523-30. doi:10.1093/europace/eus388.
3. Khanra D, Hamid A, Patel P, et al. A real-world experience of subcutaneous and transvenous implantable cardiac defibrillators-comparison with the PRAETORIAN study. J Arrhythm. 2022;38(2):199-212. doi:10.1002/joa3.12687.
4. Sanghera R, Sanders R, Husby M, Bentsen JG. Development of the subcutaneous implantable cardioverter-defibrillator for reducing sudden cardiac death. Ann N Y Acad Sci. 2014;1329:1-17. doi:10.1111/nyas.12550.
5. Kamp NJ, Al-Khatib SM. The subcutaneous implantable cardioverter-defibrillator in review. Am Heart J. 2019;217:131-9. doi:10.1016/j.ahj.2019.08.010.
6. Köbe J, Reinke F, Meyer C, et al. Implantation and follow-up of totally subcutaneous versus conventional implantable cardioverter-defibrillators: a multicenter case-control study. Heart Rhythm. 2013;10(1):29-36. doi:10.1016/j.hrthm.2012.09.126.
7. Tachibana M, Nishii N, MorimotoY, Kawada S. Complete right bundle branch block and QRS-T discordance can be the initial clue to detect S-ICD ineligibility. Journal of Cardiology. 2017;70(1):23-8.
Об авторах
А. В. ПрокопенкоРоссия
Александра Викторовна Прокопенко — врач кардиолог КХО № 2.
Красноярск
Конфликт интересов:
конфликта интересов нет
Э. А. Иваницкий
Россия
Эдуард Алексеевич Иваницкий — доктор медицинских наук, заведующий отделением КХО № 2.
Красноярск
Конфликт интересов:
конфликта интересов нет
Дополнительные файлы
Рецензия
Для цитирования:
Прокопенко А.В., Иваницкий Э.А. Подкожный кардиовертер-дефибриллятор, отбор пациентов, техника имплантации, послеоперационное ведение в ФЦССХ г. Красноярска. Российский кардиологический журнал. 2022;27(8):5116. https://doi.org/10.15829/1560-4071-2022-5116
For citation:
Prokopenko A.V., Ivanitskiy E.A. Subcutaneous cardioverter-defibrillator, patient selection, implantation, postoperative management in the Krasnoyarsk. Russian Journal of Cardiology. 2022;27(8):5116. (In Russ.) https://doi.org/10.15829/1560-4071-2022-5116
JATS XML

















































