Перейти к:
Клинический случай диагностики болезни Фабри в аритмологической практике
https://doi.org/10.15829/1560-4071-2022-5080
Аннотация
Поражение сердца при болезни Фабри (БФ) является прогностически неблагоприятным проявлением и причиной смерти. Учитывая, что заболевание редко встречается в клинической практике, низкая осведомленность врачей о данной патологии приводит к поздней диагностике заболевания и отсутствию патогенетической терапии.
Цель. Представить клиническую картину кардиологического фенотипа БФ для повышения осведомленности врачей о данном заболевании.
Материал и методы. В клиническом случае наблюдали бессимптомное течение заболевания до 46 лет и манифестацию болезни в виде нарушения ритма сердца. По результатам эхокардиографии выявлена выраженная гипертрофия миокарда левого желудочка (ЛЖ) (индекс массы миокарда 214 г/м2) без признаков обструкции выводного отдела ЛЖ, а также выявлена дилатация левого предсердия (ЛП) (индексированный объем ЛП — 47 мл/м2). Оценена систолическая функция правого желудочка (ПЖ), ЛЖ с помощью технологии Speckle Tracking Imaging-2D Strain, установлена скрытая субклиническая систолическая дисфункция ПЖ и ЛЖ.
Результаты. По результатам ферментного анализа методом тандемной масс-спектрометрии выявлено резкое снижение активности альфа-галактозидазы — 0,03 мкмоль/л/ч (норма 0,80-15,00 мкмоль/л/ч), а также повышенная концентрация Lyso-GB3 — 95,18 нг/мл (норма 0,05-3,0 нг/мл). Проведено молекулярно-генетическое исследование образцов крови. Методом прямого автоматического секвенирования гена GLA был выявлен вариант нуклеотидной последовательности с.1229 С>T, приводящий к замене p.Thr4101le в гемизиготном состоянии.
Заключение. Данное наблюдение показывает возможность и целесообразность диагностики БФ в кардиологической практике у пациентов с гипертрофией миокарда ЛЖ неясной этиологии, при этом диагностировать атипичные варианты можно только путем молекулярно-генетического исследования.
Ключевые слова
Для цитирования:
Драгунова М.А., Кистенева И.В., Павлюкова Е.Н., Назаренко Л.П., Попов С.В. Клинический случай диагностики болезни Фабри в аритмологической практике. Российский кардиологический журнал. 2022;27(7):5080. https://doi.org/10.15829/1560-4071-2022-5080
For citation:
Dragunova M.A., Kisteneva I.V., Pavlyukova E.N., Nazarenko L.P., Popov S.V. Diagnostics of Fabry disease in arrhythmology practice: a case report. Russian Journal of Cardiology. 2022;27(7):5080. (In Russ.) https://doi.org/10.15829/1560-4071-2022-5080
Болезнь Фабри (БФ) — наследственное заболевание с X-сцепленным доминантным типом наследования с неполной пенетрантностью у женщин, относящееся к группе лизосомных болезней накопления. Первичным патогенетическим звеном является дефицит фермента α-галактозидазы А (α-Gal A), что приводит к внутриклеточному накоплению гликосфинголипидов, в частности глоботриаозилцерамида (Gb3) и глоботриаозилсфингозина (Lyso-Gb3) в лизосомах клеток различных органов и тканей, включая сердце [1][2].
Поражение сердца при БФ является прогностически неблагоприятным проявлением и причиной смерти [1][2]. В настоящее время в Российской Федерации выявлено всего ~350 пациентов с БФ, включая взрослых и детей, хотя этот показатель составляет, вероятно, не >15% от их истинного количества [3]. Учитывая, что заболевание редко встречается в клинической практике, низкая осведомленность врачей о данной патологии приводит к поздней диагностике заболевания и отсутствию патогенетической терапии [4][5].
Цель статьи — представление клинической картины кардиологического фенотипа БФ для повышения осведомленности врачей о данном заболевании.
Клинический случай
Пациент Т., 49 лет, был планово госпитализирован 06.04.2020 с жалобами на учащённое неритмичное сердцебиение, на одышку при умеренной физической нагрузке, быструю утомляемость. Из анамнеза известно, что нарушения ритма сердца (НРС) в виде фибрилляции предсердий (ФП) впервые документированы с апреля 2017г во время медицинского осмотра. Анамнестических данных за артериальную гипертензию (адаптирован к артериальному давлению (АД) 110-120/70-80 мм рт.ст.), ишемическую болезнь сердца, хронический миокардит не было. Ранее неоднократно проводилось эхокардиографическое исследование (ЭхоКГ): в 1993, в 2003 и 2011гг — значимых отклонений от нормы не выявлено (рис. 1). Гипертрофия миокарда левого желудочка (ГМЛЖ) по результатам ЭхоКГ впервые была документирована в 2014г.
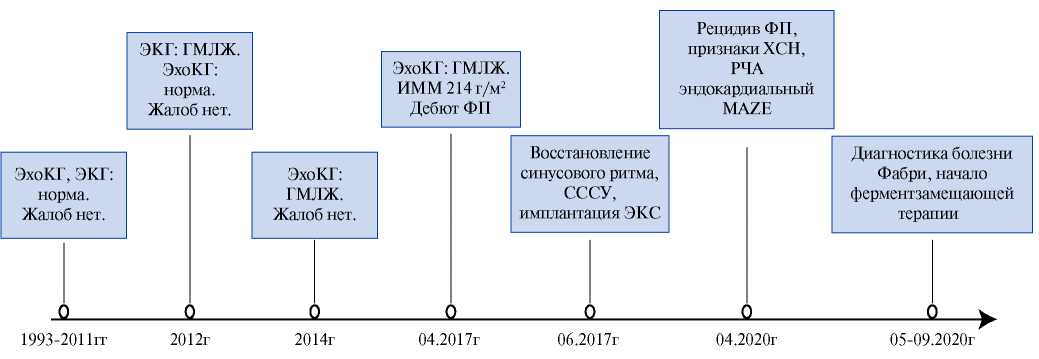
Рис. 1. Пациент Т.: хронология течения болезни, ключевые события.
Сокращения: ГМЛЖ — гипертрофия миокарда левого желудочка, ИММ — индекс массы миокарда, РЧА — радиочастотная аблация, ФП — фибрилляция предсердий, СССУ — синдром слабости синусового узла, ХСН — хроническая сердечная недостаточность, ЭКГ — электрокардиограмма, ЭКС — электрокардиостимулятор, ЭхоКГ — эхокардиография.
Для оценки кровоснабжения миокарда левого желудочка (ЛЖ) проведена сцинтиграфия миокарда с фармакологической нагрузочной пробой (аденозин), выявлено не более 5% гипоперфузии.
Проведено ультразвуковое исследование щитовидной железы — патологических изменений не выявлено, при лабораторном тесте сывороточный уровень тиреотропного гормона — 2,89 мкМЕ/мл (норма: 0,38-5,33 мкМЕ/мл).
В июне 2017г пациент поступал в кардиологическое отделение с персистирующей ФП для восстановления синусового ритма. Синусовый ритм был восстановлен электрической кардиоверсией, после возникла клинически значимая синусовая брадикардия с минимальной частотой сердечных сокращений (ЧСС) в дневное время 28 уд./мин (средняя ЧСС 38-40), она сопровождалась слабостью, головокружением. Была выявлена слабость синусового узла II типа. Проведена первичная имплантация двухкамерного электрокардиостимулятора (ЭКС).
Во время госпитализации по данным ЭхоКГ подтверждено наличие выраженной ГЛЖ (индекс массы миокарда 190 г/м2) без признаков обструкции выводного отдела ЛЖ (пиковый градиент 2 мм рт.ст.), а также выявлена дилатация левого предсердия (ЛП) (индексированный объем ЛП — 47 мл/ м2) — как наиболее вероятная причина развития НРС. Развитие ГЛЖ не было связано с повышенной нагрузкой на миокард (значимой клапанной патологии, артериальной гипертензии, регулярных тренирующих физических нагрузок в анамнезе не было). Для исключения коронарного атеросклероза проводилась коронарография — поражение крупных сосудов не выявлено. При выписке были рекомендованы амиодарон 200 мг/сут., варфарин 6,25 мг/сут., бисопролол 2,5 мг/сут., несмотря на регулярный прием препаратов, пациент постепенно стал отмечать снижение толерантности к физической нагрузке.
Пациент работает дозиметристом на химическом комбинате. Женат, имеет дочь и сына (от двух браков). Семейный анамнез по сердечно-сосудистым заболеваниям отягощен. Вредные привычки: курит в течение длительного времени (1/2 пачки/день).
При осмотре: состояние пациента удовлетворительное, кожные покровы обычной окраски, без патологических изменений. Рост 185 см, вес 72 кг, индекс массы тела 21 кг/м2. При аускультации дыхание везикулярное, хрипы не выслушиваются. Частота дыхания 16 в мин. SatO2 — 98%. Тоны сердца ясные, аритмичные, ЧСС 90-94 уд./мин. Дефицит пульса — 4 уд./мин. АД 125/70 мм рт.ст. Пульсация периферических артерий сохранена. Размеры печени по Курлову: 10×9×8 см. Симптом поколачивания отрицательный с обеих сторон. Периферических отеков нет.
На электрокардиограмме (ЭКГ) при поступлении: ФП, ЧСС 87-98 уд./мин, признаки ГЛЖ (рис. 2).
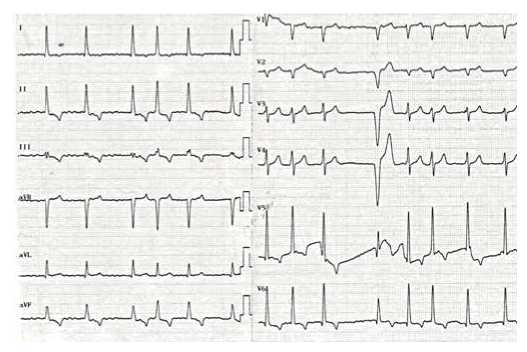
Рис. 2. ЭКГ пациента Т.
Проведены консультации окулиста, невролога, нефролога — патологии не выявлено.
По результатам ЭхоКГ выявлена дилатация обоих предсердий (объем ЛП 101 мл, 51,26 мл/м2; объем правого предсердия 93 мл, 47,2 мл/м2), утолщение межпредсердной перегородки. Стенки ЛЖ утолщены. Толщина межжелудочковой перегородки в выводном отделе ЛЖ в диастолу 19 мм, в систолу 19 мм. Индекс массы миокарда 214 г/м2. Фракция выброса ЛЖ (В-режим) — 60%. Диастолическая дисфункция (неопределенный вариант). Градиент давления в выводном отделе ЛЖ в покое 5,79/2,47 мм рт.ст., при пробе Вальсальвы — 4,02/2,13 мм рт.ст. Свободная стенка правого желудочка (ПЖ) гипертрофирована. Толщина свободной стенки ПЖ 9 мм. Выраженная гипертрофия папиллярных мышц (рис. 3).
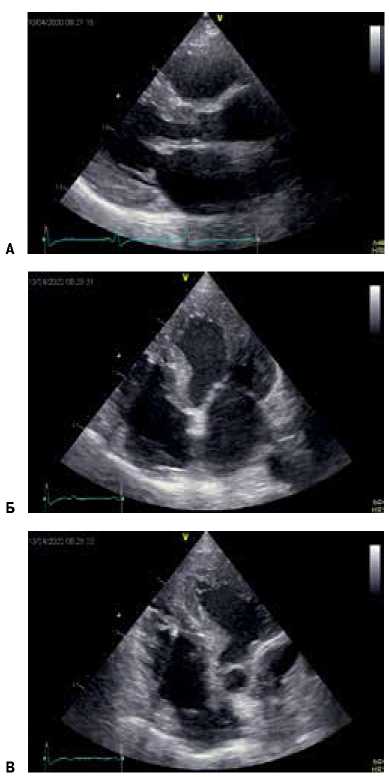
Рис. 3. ЭхоКГ больного Т.
Примечание: А — визуализация ЛЖ по длинной оси из парастернального доступа; Б — двухмерное изображение сердца на уровне 4 камер из апикальной позиции; В — двухмерная визуализация ПЖ и правого предсердия из апикальной позиции.
Сокращения: ЛЖ — левый желудочек, ПЖ — правый желудочек.
ЭхоКГ выполнено с применением технологии Speckle Tracking Imaging-2D Strain. Оценена глобальная деформация и деформации каждого из 18 сегментов ЛЖ в продольном направлении в систолу и в период изоволюмического расслабления (рис. 4).

Рис. 4. Полярные карты деформации (Strain) и постсистолической деформации (Post-Systolic Strain) сегментов по схеме “бычий глаз” и глобальная деформация ЛЖ больного Т.
Примечание: А — полярная карта деформации (Strain) сегментов по схеме “бычий глаз” и глобальная деформация ЛЖ больного Т; Б — полярная карта постсистолической деформации (Post-Systolic Strain) сегментов ЛЖ больного Т.
Сокращение: ЛЖ — левый желудочек.
Глобальная деформация ЛЖ в систолу снижена до -10,5% (при норме -18% в абсолютных значениях). В большей степени деформация снижена в базальных сегментах, присутствует их постсистолическая деформация (рис. 4).
При оценке систолической функции анализировались вращение и скручивание ЛЖ. Выявлено нарушение физиологического вращения ЛЖ, а именно, направление движения верхушки по часовой стрелке.
Проведена трехмерная визуализация в реальном масштабе времени и реконструкция полости ЛП, оценена деформация в продольном направлении и по окружности в период трех фаз функции ЛП. Зарегистрировано увеличение объема ЛП (98 мл), фракция выброса ЛП была снижена (29%), снижение деформации ЛП во все три фазы в продольном направлении и по окружности.
Оценена систолическая функция ПЖ с помощью технологии Speckle Tracking Imaging-2D Strain (рис. 5). Хотя фракция выброса ПЖ соответствовала норме — 50%, деформация ПЖ в продольном направлении была снижена. То есть у пациента имела место скрытая субклиническая систолическая дисфункция ПЖ.
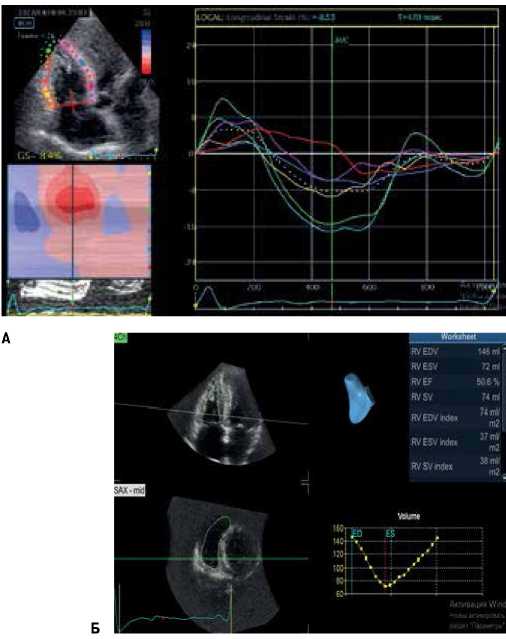
Рис. 5. Оценка систолической функции ПЖ больного Т. с помощью технологии Speckle Tracking Imaging-2D Strain.
Примечание: А — технология Speckle Tracking Imaging. Глобальная деформация (Strain) ПЖ в продольном направлении; Б — трехмерная визуализация в реальном масштабе времени ПЖ и трехмерная реконструкции его полости.
Кривая линия белого цвета — глобальная деформация ПЖ. Кривые желтого, голубого и зеленого цвета — деформация свободной стенки ПЖ, кривые красного, синего и розового цвета — деформация правой части межжелудочковой перегородки. Цветное изображение доступно в электронной версии журнала.
Сокращение: ПЖ — правый желудочек.
По данным лабораторных тестов отклонений от нормы не выявлено. Скорость клубочковой фильтрации по формуле CKD-EPI =71 мл/мин/1,73 м2, по формуле MDRD =68 мл/мин/1,73 м2.
Предварительный диагноз: Гипертрофическая кардиомиопатия, необструктивная форма. Персистирующая форма ФП. Синдром слабости синусового узла 2 типа. Первичная имплантация двухкамерного ЭКС Sorin Espirt DR (21.06.2017). Хроническая сердечная недостаточность (ХСН) II А, функциональный класс II.
08.04.2020 выполнено внутрисердечное электрофизиологическое исследование, а затем оперативное лечение — CARTO радиочастотная аблация эндокардиальный MAZE с использованием нефлюороскопической навигационной системы (EnSite Velocity) (рис. 6). Послеоперационный период протекал без осложнений, регистрировался синусовый ритм, интервал PQ 120 мс (рис. 7).
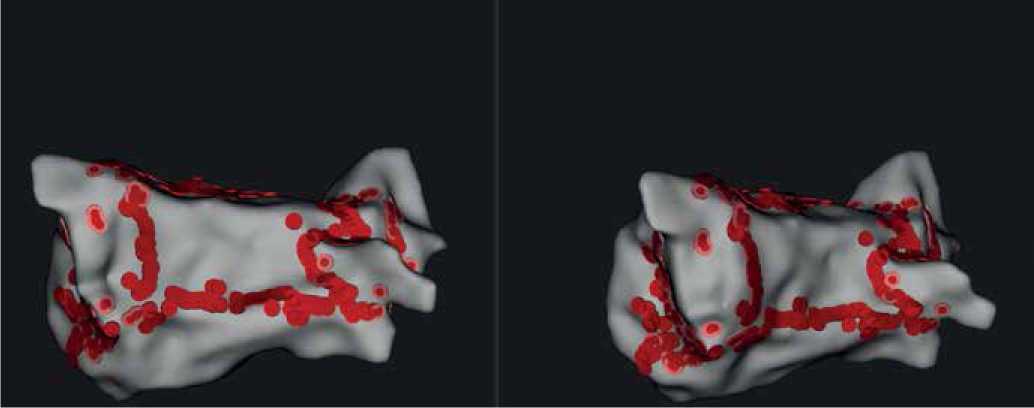
Рис. 6. Реконструкция ЛП и устьев легочных вен.
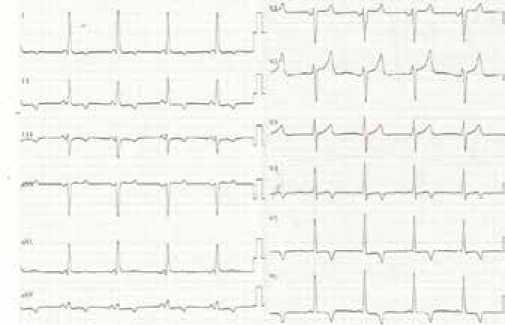
Рис. 7. ЭКГ пациента Т. в послеоперационный период.
С учётом эхоскопической структуры миокарда и короткого ЭхоКГ-анамнеза ГЛЖ (с 2014г), а также появления более ранних изменений на ЭКГ (амплитудных критериев ГЛЖ), одной из обсуждаемых причин гипертрофической кардиомиопатии была болезнь накопления. Во время госпитализации взяты пробы крови на БФ методом сухого пятна.
После выписки из стационара пациент продолжил прием антиаритмической (соталол 160 мг/сут.) и антикоагулянтной (ривароксабан 20 мг/сут.) терапии, терапии ХСН (спиронолактон 50 мг/сут.).
По результатам ферментного анализа методом тандемной масс-спектрометрии выявлено резкое снижение активности α-Gal A — 0,03 мкмоль/л/ч (норма 0,80-15,00 мкмоль/л/ч), а также повышенная концентрация Lyso-GB3 — 95,18 нг/мл (норма 0,05- 3,0 нг/мл). Проведено молекулярно-генетическое исследование образцов крови. Методом прямого автоматического секвенирования гена GLA был выявлен вариант нуклеотидной последовательности с.1229 С>T, приводящий к замене p.Thr4101le в гемизиготном состоянии, описанный в международной базе данных по мутациям HGMD (CM118194). Учитывая клинические проявления, а также биохимические и молекулярно-генетические данные, пациенту был установлен клинический диагноз: БФ, кардиологический фенотип. Персистирующая форма ФП (EHRA 2, CHA2DS2-VASc 1, HAS-BLED 0). CARTO радиочастотная аблация эндокардиальный MAZE (08.04.2020). Синдром слабости синусового узла 2 типа. Первичная имплантация двухкамерного ЭКС Sorin Espirt DR (21.06.2017). ХСН II А, функциональный класс II.
Проведено медико-генетическое консультирование, анализ родословной. Обследование с использованием биохимических и молекулярно-генетических тестов родной сестры пациента и двух её дочерей, не имеющих на момент обследования жалоб, также подтвердило у них наличие БФ. Обследование несовершеннолетней дочери пациента не проводилось, была проведена беседа с родителями о важности диагностики заболевания, однако мать дочери (ее официальный опекун после развода) была против и подписала информированный отказ от молекулярно-генетического исследования.
Пациент включен в региональный перечень редких заболеваний и в настоящее время получает ферментную замещающую терапию рекомбинантным препаратом Агалсидаза бета.
Обсуждение
Накопление гликосфинголипидов в клетках сердца начинается ещё в раннем возрасте. На ранней (асимптомной) стадии наблюдаются изменения на ЭКГ: изменения длины интервалов PQ и PR, брадикардия в покое, по данным ЭхоКГ — нарушение диастолического наполнения ЛЖ [1]. Затем при проведении ЭхоКГ выявляются ГМЛЖ без каких-либо клинических проявлений [4][6]. Уже поздние проявления: признаки ХСН, манифестация НРС (ФП, желудочковая тахикардия), внезапная сердечная смерть. Данные признаки отмечаются у 40-60% пациентов с БФ [1][2].
В представленном случае наблюдается бессимптомное течение заболевания до 46 лет и манифестация болезни в виде НРС. Хотя изменения на ЭКГ (амплитудные критерии ГМЛЖ документированы с 2012г) и ЭхоКГ (признаки ГЛЖ регистрировались с 2014г) в рамках диспансеризации выявлялись и ранее, однако дальнейший диагностический поиск в отношении этиологии данных изменений не проводился.
Кардиологический фенотип БФ имеет позднее начало (после среднего возраста), без каких-либо других признаков болезни [6-8]. Согласно данным регистров пациентов с БФ, у значительной части из них длительное время заболевание остается недиагностированным [3][4][7]. Ошибочные диагнозы и несвоевременная диагностика приводят к прогрессированию необратимых изменений в тканях [8][9].
Представленный клинический пример демонстрирует важность скрининга среди пациентов из групп риска, а также важность знания характерных симптомов, тщательного сбора анамнеза и настороженности врачей в отношении данного заболевания. Так, у пациентов с ГМЛЖ неясной этиологии целесообразно исключать БФ [8][9].
Важен и семейный скрининг. Подтверждение диагноза у одного нового пациента позволяет выявить в среднем 5 пациентов с БФ в этой же семье [2][5][8].
Заключение
Данное наблюдение показывает возможность и целесообразность диагностики БФ в кардиологической практике у пациентов с ГМЛЖ неясной этиологии, при этом диагностировать атипичные варианты можно только путем молекулярно-генетического исследования.
Прогноз
Регулярная ферментозаместительная терапия позволит остановить прогрессирование клинических проявлений БФ.
Информированное согласие
У пациента получено информированное согласие для публикации данного клинического случая.
Разрешения на перепубликацию, лицензирование
Авторы подтверждают, что каждый представленный в рукописи графический объект является авторским и не заимствован из других источников.
Отношения и деятельность: все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье.
Список литературы
1. Namdar M. Electrocardiographic Changes and Arrhythmia in Fabry Disease. Front Cardiovasc Med. 2016;24:3-7. doi:10.3389/fcvm.2016.00007.
2. Каровайкина Е. А., Моисеев А. С., Буланов Н. М. и др. Скрининг, диагностика и лечение болезни Фабри. Клиническая фармакология и терапия. 2019;28(3):68-74. doi:10.32756/0869-5490-2019-3-68-74.
3. Моисеев С. В., Тао Е. А., Моисеев А. С. и др. Клинические проявленияи исходы болезни Фабри у 150 взрослых пациентов. Клиническая фармакология и терапия. 2021;30(3):43-51. doi:10.32756/0869-5490-2021-3-43-51.
4. Yogasundaram H, Kim D, Oudit O, et al. Clinical features, diagnosis, and management of patients with anderson-fabry cardiomyopathy. Can J Cardiol. 2017;33:883-97. doi: 10.1016/j.cjca.2017.04.015.
5. Laney D, Peck D, Atherton A, et al. Fabry disease in infancy and early childhood: a systematic literature review. GenetMed. 2014;5(17):323-30. doi:10.1038/gim.2014.120.
6. Харлап М. С., Мясников Р. П., Павлунина Т. O. и др. Кардиологический фенотип болезни Фабри. Российский кардиологический журнал. 2018;(7):80-3. doi:10.15829/1560-4071-2018-7-80-83.
7. Germain DP, Brand E, Burlina A, et al. Phenotypic characteristics of the p.Asn215Ser (p.N215S) GLA mutation in male and female patients with Fabry disease: a multicenter Fabry Registry study. Mol Genet Genomic Med. 2018;6(4):492-503. doi:10.1002/mgg3.389.
8. Adalsteinsdottir B, Palsson R, Desnick RJ, et al. Fabry disease in families with hypertro - phic cardiomyopathy: clinical manifestations in the classic and later-onset phenotypes. Circ Cardiovasc Genet. 2017;10:e001639. doi:10.1161/CIRCGENETICS.116.001639.
9. Baig S, Vijapurapu R, Alharbi F, et al. Diagnosis and treatment of the cardiovascular consequences of Fabry disease. QJM: An International Journal of Medicine. 2019;112(1):39. doi:10.1093/qjmed/hcy120.
Об авторах
М. А. ДрагуноваРоссия
Марина Александровна Драгунова — кандидат медицинских наук, младший научный сотрудник отделения хирургического лечения сложных нарушений ритма сердца и электрокардиостимуляции.
Томск
Конфликт интересов:
нет
И. В. Кистенева
Россия
Ирина Валерьевна Кистенева — кандидат медицинских наук, врач-кардиолог отделения хирургического лечения сложных нарушений ритма сердца и электрокардиостимуляции.
Томск
Конфликт интересов:
нет
Е. Н. Павлюкова
Россия
Елена Николаевна Павлюкова — доктор медицинских наук, профессор, руководитель отделения атеросклероза и хронической ишемической болезни сердца.
Томск
Конфликт интересов:
нет
Л. П. Назаренко
Россия
Людмила Павловна Назаренко — доктор медицинских наук, профессор, зам. директора по научной и лечебной работе, руководитель лаборатории наследственной патологии.
Томск
Конфликт интересов:
нет
С. В. Попов
Россия
Сергей Валентинович Попов — доктор медицинских наук, профессор, академик РАН, руководитель отделения хирургического лечения сложных нарушений ритма сердца электрокардиостимуляции.
Томск
Конфликт интересов:
нет
Дополнительные файлы
Рецензия
Для цитирования:
Драгунова М.А., Кистенева И.В., Павлюкова Е.Н., Назаренко Л.П., Попов С.В. Клинический случай диагностики болезни Фабри в аритмологической практике. Российский кардиологический журнал. 2022;27(7):5080. https://doi.org/10.15829/1560-4071-2022-5080
For citation:
Dragunova M.A., Kisteneva I.V., Pavlyukova E.N., Nazarenko L.P., Popov S.V. Diagnostics of Fabry disease in arrhythmology practice: a case report. Russian Journal of Cardiology. 2022;27(7):5080. (In Russ.) https://doi.org/10.15829/1560-4071-2022-5080
JATS XML

















































