Перейти к:
Показатели клинического анализа крови, липидного спектра и их соотношений в прогнозировании обструктивного поражения коронарных артерий у больных с острым коронарным синдромом без подъема ST
https://doi.org/10.15829/1560-4071-2022-5079
Аннотация
Цель. Оценить предиктивный потенциал показателей клинического анализа крови (КАК), липидного спектра и их соотношений для прогнозирования обструктивного поражения коронарных артерий (ОПКА) у больных с острым коронарным синдромом без подъема сегмента ST (ОКСбпST).
Материал и методы. В исследование было включено 600 пациентов с ОКСбпST с медианой возраста 62 года, которым выполнялась инвазивная коронароангиография (КАГ). Среди обследованных было выделено 2 группы, первую из которых составили 360 (60%) больных с ОПКА (стеноз ≥50%), а вторую — 240 (40%) с сужением просвета коронарных артерий <50%. Клинико-функциональный статус больных до проведения КАГ оценивали по 33 параметрам, включающим показатели КАК, липидного спектра и их соотношения. Для статистической обработки и анализа данных использовали методы Манна-Уитни, Фишера, хи-квадрат, однофакторную логистическую регрессию (ЛР), а для разработки прогностических моделей — многофакторную ЛР (МЛР). Качество моделей оценивали по 4 метрикам: площадь под ROCкривой (AUC), чувствительность (Se), специфичность (Sp) и точность (Ac).
Результаты. Комплексный анализ показателей КАК и липидного спектра позволил выделить факторы, линейно и нелинейно связанные с ОПКА. С помощью однофакторной ЛР были определены их пороговые значения с наибольшим предиктивным потенциалом. Метрики качества лучшей прогностической модели, разработанной на основе МЛР, составили по AUC — 0,80, Sp — 0,79, Ac — 0,76, Se — 0,78. Ее предикторами были 8 показателей в категориальной форме: возраст >55 лет у мужчин и >65 лет — у женщин, содержание лимфоцитов (LYM) <19%, гематокрит >49%, иммуно-воспалительный индекс >1000 усл. ед., соотношения холестерина (ХС) липопротеидов высокой плотности (ЛВП) к ХС низкой плотности (ЛНП) <0,3 усл. ед., моноцитов (MON) к ХС ЛВП >0,8 усл. ед., нейтрофилов (NEUT) к ХС ЛВП >5,7 усл. ед. и NEUT/ LYM >3 усл. ед. Определен относительный вклад отдельных предикторов в реализацию конечной точки исследования.
Заключение. Прогностический алгоритм (модель 9), разработанный на основе МЛР, демонстрировал лучшее соотношение метрик качества, чем другие модели. Доминирующее влияние на прогноз ОПКА оказывали 3 фактора: ХС ЛВП/ХС ЛНП (38%), возраст больных (31%), MON/ХС ЛВП (14%). Влияние на риск ОПКА других факторов было менее заметным.
Ключевые слова
Для цитирования:
Циванюк М.М., Гельцер Б.И., Шахгельдян К.И., Вишневский А.А., Шекунова О.И. Показатели клинического анализа крови, липидного спектра и их соотношений в прогнозировании обструктивного поражения коронарных артерий у больных с острым коронарным синдромом без подъема ST. Российский кардиологический журнал. 2022;27(8):5079. https://doi.org/10.15829/1560-4071-2022-5079
For citation:
Tsivanyuk M.M., Geltser B.I., Shakhgeldyan K.I., Vishnevskiy A.A., Shekunova O.I. Parameters of complete blood count, lipid profile and their ratios in predicting obstructive coronary artery disease in patients with non-ST elevation acute coronary syndrome. Russian Journal of Cardiology. 2022;27(8):5079. (In Russ.) https://doi.org/10.15829/1560-4071-2022-5079
Ишемическая болезнь сердца (ИБС) является ведущей причиной заболеваемости и смертности населения в большинстве стран мира. Острый коронарный синдром (ОКС) относится к наиболее распространенным и опасным клиническим вариантам ИБС. Он может быть следствием как обострения хронической ИБС, так и первым признаком поражения коронарного русла [1]. ОКС без подъема сегмента ST (ОКСбпST) в отличие от ОКС с подъемом ST, встречается значительно чаще (72% vs 28%), а его развитие ассоциируется с более широким спектром патофизиологических механизмов [1][2]. К последним помимо неполной окклюзии эпикардиальных коронарных артерий (КА) относится их спазм, спонтанная диссекция, миокардиальные мостики, синдром такоцубо, микрососудистый спазм [3][4]. Результаты инвазивной коронароангиографии (КАГ) указывают на то, что среди больных с ОКСбпST случаи интактных КА или их необструктивное поражение (НПКА) имеют место у 13-58% больных [5-7]. Эти данные послужили основанием для совершенствования технологий претестовой диагностики обструктивного поражения КА (ОПКА), внедрение которых в клиническую практику позволяет ограничить случаи необоснованного применения КАГ, сократить неоправданные риски инвазивной процедуры и нерациональные расходы здравоохранения [8]. Одним из решений этой задачи является оценка предиктивного потенциала доступных в повседневной клинической практике клинико-лабораторных данных. Ранее была показана прогностическая ценность отдельных показателей клинического анализа крови (КАК) для оценки кардиоваскулярного риска в различных популяциях, в т.ч. среди больных с ОКС [9][10]. Данный подход базировался на известных представлениях о роли форменных элементов крови в реализации типовых патологических процессов, участвующих в атеросклеротическом ремоделировании КА [11][12]. Установлена, в частности, взаимосвязь между содержанием в крови лейкоцитов (WBC), шириной распределения эритроцитов (RDW), средним объемом тромбоцитов (MPV) с неблагоприятными исходами ИБС [10][13]. Показана прогностическая эффективность соотношения уровня нейтрофилов (NEUT) и концентрации холестерина (ХС) липопротеидов высокой плотности (ЛВП) для стратификации риска смертности у больных ОКС на 6-мес. горизонте наблюдения [14]. При хронической ИБС отношение моноцитов (MON) к ХС ЛВП являлось независимым предиктором неблагоприятных сердечно-сосудистых событий, включая острый инфаркт миокарда (ИМ) и нестабильную стенокардию [15]. Иммуно-воспалительный индекс (systemic immuneinflammation index — SII), рассчитанный как произведение концентрации тромбоцитов (PLT) и соотношения NEUT к лимфоцитам (LYM), имел преимущество перед традиционными факторами риска для прогнозирования сердечно-сосудистых осложнений у больных ИБС после чрескожных коронарных вмешательств [12]. Вместе с тем, имеются лишь единичные работы, в которых анализируется прогностический потенциал клинико-лабораторных показателей для оценки вероятности ОПКА у больных с ОКСбпST до проведения инвазивной КАГ [16].
Цель исследования состояла в оценке предиктивного потенциала показателей КАК, липидного спектра и их соотношений для прогнозирования ОПКА у больных с ОКСбпST.
Материал и методы
Исследование проведено по результатам анализа показателей базы данных “Прогностическая оценка обструктивного поражения коронарных артерий у больных с острым коронарным синдромом без подъема сегмента ST”1, в которой представлены сведения о 600 пациентах (374 мужчины и 226 женщин) в возрасте от 30 до 80 лет с медианой 61 год и 95% доверительным интервалом (ДИ) [ 60; 62], поступивших в 2017-2021гг в отделение неотложной кардиологии КГБУЗ “Владивостокская клиническая больница № 1” с ОКСбпST без доказанного некроза миокарда по результатам исследования высокочувствительного сердечного тропонина I на анализаторе RADIOMETER AQT90 FLEX (Дания). Оценку риска летального исхода в стационаре выполняли с помощью шкалы GRACE [3]. Низкий риск имел место у 238 (40%) больных, средний — у 332 (55%) и высокий — у 30 (5%). Всем пациентам была выполнена инвазивная КАГ на ангиографической системе TOSHIBA iNFX-8000V (Япония). Среди обследованной когорты было выделено 2 группы лиц. В 1-ю из них вошли 360 (60%) больных, имеющих по результатам КАГ гемодинамически значимое сужение КА (≥50%), во 2-ю — 240 (40%) пациентов с НПКА (<50%). Клинико-функциональный статус больных до проведения КАГ оценивали по 33 показателям. Исследование было выполнено в соответствии со стандартами надлежащей клинической практики (Good Clinical Practice) и принципами Хельсинкской декларации. Протокол исследования был одобрен локальным этическим комитетом Школы медицины Дальневосточного федерального университета. От всех участников было получено письменное информированное согласие.
Забор венозной крови у пациентов осуществлялся при поступлении в стационар с последующим исследованием на биохимическом анализаторе Mindray BS-800M (Китай). Определяли уровни общего ХС, ХС ЛВП, ХС липопротеидов низкой плотности (ЛНП) и триглицеридов (ТГ). КАК проводили на гематологическом анализаторе Sysmex XN550 (Япония). Определяли содержание гемоглобина (Hb), эритроцитов (RBC), WBC, NEUT, LYM, MON, PLT, скорость оседания RBC, гематокрит (HCT), тромбокрит, средний объем RBC (MCV), среднее содержание Hb в RBC (MCH), среднюю концентрацию Hb в эритроцитарной массе (MCHC), RDW, MPV, ширину распределения тромбоцитов (PDW). Рассчитывали соотношения NEUT/LYM, PLT/LYM, MON/ХС ЛВП, NEUT/ХС ЛВП, ХС ЛВП/ХС ЛНП, LYM/ХС ЛВП, ТГ/ХС ЛВП. Вычисляли SII по формуле PLT*(NEUT/LYM) [12].
Конечная точка исследования была представлена ОПКА в форме бинарного признака (“отсутствие” или “наличие”). Входные признаки — подгруппа потенциальных предикторов выражалась в форме непрерывных и категориальных переменных. Для обработки и анализа данных использовали методы математической статистики и машинного обучения. Первые из них были представлены тестами Фишера, Манна-Уитни, Хи-квадрат (χ2) и однофакторной логистической регрессией (ЛР). Вторые — многофакторной ЛР (МЛР). Разработка моделей выполнялась с использованием в их структуре только одной из коррелируемых переменных для исключения проблемы мультиколлинеарности.
Статистическая значимость признаков и проверка гипотез подтверждалась значением p-value <0,05. Качество моделей оценивали по 4 метрикам: площадь под ROC-кривой (AUC), точность (Ac), чувствительность (Se) и специфичность (Sp).
Дизайн исследования включал 4 этапа. На первом из них для выделения потенциальных предикторов, линейно связанных с ОПКА, в группах сравнения был проведен статистический анализ 33 факторов. Для непрерывных переменных использовали тест Манна-Уитни, а для категориальных — χ2. Отношение шансов (ОШ) и их 95% ДИ рассчитывали точным тестом Фишера. На втором этапе на основе ЛР выделяли пороговые значения факторов, обладающие наибольшим предиктивным потенциалом. Определение прогностически значимых диапазонов осуществляли с шагом тестирования 0,05-0,1 усл. ед. для различных показателей. Критериям отбора соответствовали границы значений факторов, p-value которых имели минимальную величину. На четвертом этапе с использованием МЛР на обучающей выборке (9/10 пациентов) были разработаны прогностические модели ОПКА с последующей кросс-валидацией методом K-Fold на тестовой выборке, которая выполнялась 10 раз на непересекающихся выборках по 60 человек (1/10) в каждой. Анализ данных и разработку моделей выполняли на языках R в среде R-studio и Python. Работа выполнена при частичной поддержке грантов РФФИ в рамках научных проектов № 1929-01077 и № 20-37-90081.
Результаты
Межгрупповой анализ 33 факторов, характеризующих клинико-функциональный статус больных, демонстрировал достоверность различий по 17 из них (табл. 1). При этом максимальный уровень статистической значимости фиксировался у показателей гендерной принадлежности (мужской пол), ХС ЛВП, а также соотношений NEUT/ХС ЛВП и ХС ЛВП/ХС ЛНП (p<0,0001). Высокой степенью достоверности отличались показатели WBC и NEUT (p=0,0002), ХС ЛНП (p=0,0003), соотношение MON/ ХС ЛВП (p=0,0002). Менее заметные, но статически значимые межгрупповые различия ассоциировались с процентным содержанием в крови LYM (p=0,01) и NEUT (p=0,03), отношением NEUT/LYM (p=0,02) и SII (p=0,02). По данным предварительного анализа возраст обследованных, Hb, RBC, PLT, скорость оседания эритроцитов, HCT, MCV, MCH, MCHC, RDW, MPV, PDW, тромбокрит, MON%, LYM, PLT/ LYM не имели линейных взаимосвязей с ОПКА.
Таблица 1
Показатели КАК, липидного спектра и их соотношений у больных с ОКСбпST в группах сравнения (Me, 95% ДИ)
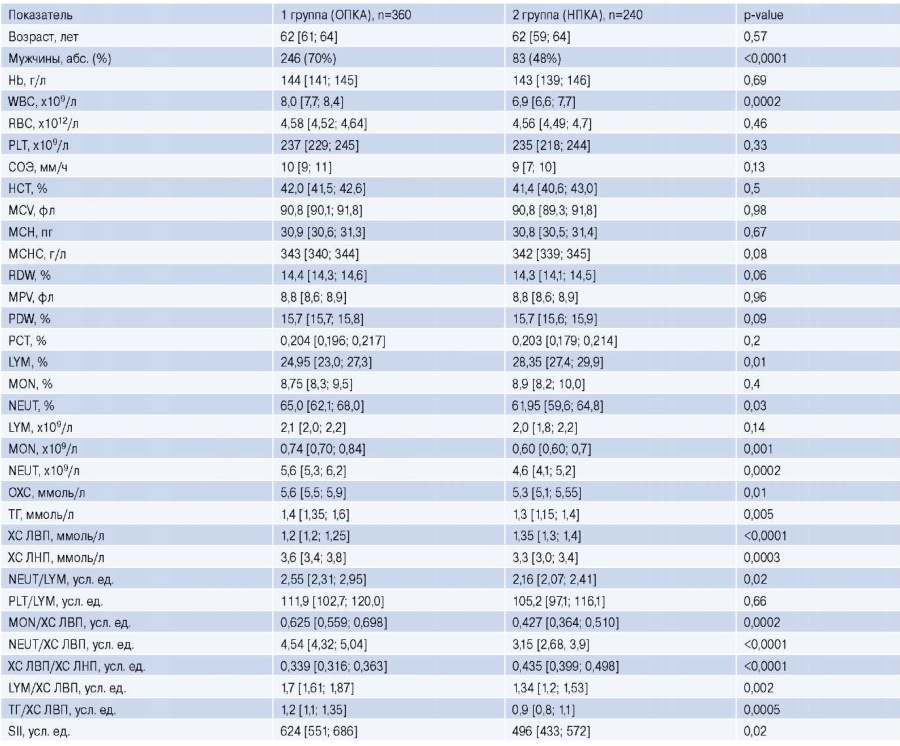
Сокращения: НПКА — необструктивное поражение коронарных артерий, ОПКА — обструктивное поражение коронарных артерий, ОХС — общий холестерин, СОЭ — скорость оседания эритроцитов, ТГ — триглицериды, ХС ЛВП — холестерин липопротеидов высокой плотности, ХС ЛНП — холестерин липопротеидов низкой плотности, Hb — гемоглобин, HCT — гематокрит, LYM — лимфоциты, MCH — среднее содержание гемоглобина в эритроците, MCHC — средняя концентрация гемоглобина в эритроцитарной массе, MCV — средний объем эритроцита, MON — моноциты, MPV — средний объем тромбоцита, NEUT — нейтрофилы, PCT — тромбокрит, PDW — ширина распределения тромбоцитов, PLT — тромбоциты, RBC — эритроциты, RDW — ширина распределения эритроцитов, SII — иммуно-воспалительный индекс (systemic immune-inflammation index), WBC — лейкоциты.
На втором этапе исследования с помощью однофакторной ЛР среди ранее отобранных 17 показателей выделяли пороговые значения, отклонение от которых приводило к повышению их предиктивного потенциала (табл. 2). Результаты анализа позволили выделить возрастные диапазоны у мужчин (>55 лет) и у женщин (>65 лет), принадлежность к которым повышала вероятность ОПКА (ОШ =1,7, p=0,01). Прогностически значимые критериальные границы были установлены также для отдельных показателей КАК. Так, у больных с WBC >10 x109/л вероятность обнаружения стенозирующего поражения КА возрастала более чем в 2 раза (ОШ =2,2, p=0,004), а содержание MON >0,63 x109/л повышало риск ОПКА в 3,2 раза (p<0,0001). При увеличении уровня NEUT >6,3 x109/л вероятность ОПКА возрастала в 2,3 раза (p=0,009), а при снижении LYM <19% — в 2,8 раза (p=0,009). Сопоставимый риск ОПКА ассоциировался с нарушениями липидного обмена, проявляющимися снижением уровня ХС ЛВП ≤1,1 ммоль/л (ОШ =2,4, p=0,0002), увеличением концентрации ХС ЛНП >3,5 ммоль/л (ОШ =2,1, p=0,0004), общий ХС ≥5,9 ммоль/л (ОШ =2,0, p=0,001), ТГ ≥1,6 ммоль/л (ОШ =1,75, p=0,006). Аналогичные значения ОШ были связаны с соотношениями ТГ/ ХС ЛВП ≥1,5 усл. ед. (ОШ =1,75, p=0,009), ХС ЛВП/ ХС ЛНП <0,3 усл. ед. (ОШ =2,5, p<0,0001). Риск ОПКА существенно возрастал при увеличении MON/ХС ЛВП >0,8 усл. ед. (ОШ =3,6, p=0,001), NEUT/ХС ЛВП >5,7 усл. ед. (ОШ =3,7, p=0,0007), LYM/ХС ЛВП >1,7 усл. ед. (ОШ =2,4, p=0,002) и SII ≥1000 усл. ед. (ОШ =2,8, p=0,02).
Таблица 2
Диапазон пороговых значений потенциальных предикторов ОПКА на основе однофакторных моделей ЛР
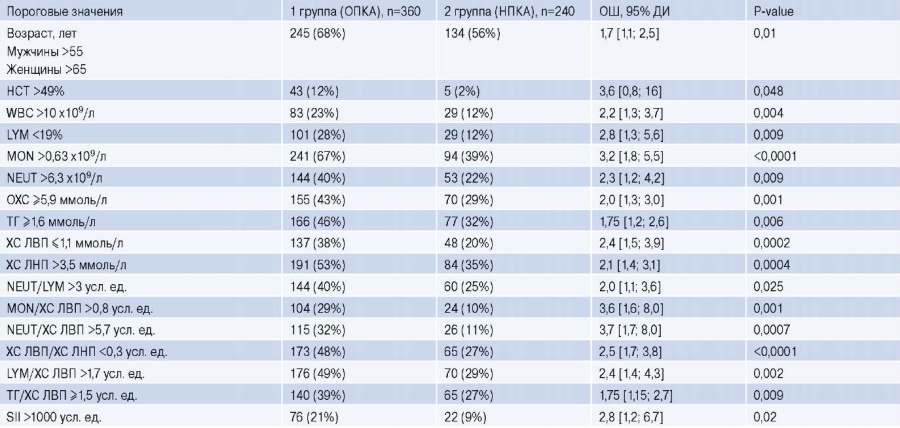
Сокращения: ДИ — доверительный интервал, НПКА — необструктивное поражение коронарных артерий, ОПКА — обструктивное поражение коронарных артерий, ОХС — общий холестерин, ОШ — отношение шансов, ТГ — триглицериды, ХС ЛВП — холестерин липопротеидов высокой плотности, ХС ЛНП — холестерин липопротеидов низкой плотности, AUC — площадь под ROC кривой, HCT — гематокрит, LYM — лимфоциты, MON — моноциты, NEUT — нейтрофилы, SII — иммуно-воспалительный индекс (systemic immune-inflammation index), WBC — лейкоциты.
На третьем этапе исследования на основе метода МЛР были разработаны прогностические модели для оценки вероятности ОПКА до выполнения инвазивной КАГ (табл. 3). При построении моделей применяли алгоритм отбора лучших подмножеств (Best Subset Selection), который позволил выделить комбинацию потенциальных предикторов ОПКА с наилучшим прогностическим потенциалом. Она включала 3 показателя в категориальной форме (возраст >55 лет для мужчин и >65 лет — для женщин, ХС ЛВП/ ХС ЛНП <0,3 усл. ед. и SII ≥1000 усл. ед.), которые использовались в качестве базовых предикторов во всех разработанных моделях. Пошаговое включение в их структуру других факторов приводило к увеличению или снижению только отдельных метрик качества. Их максимальный подъем фиксировался в модели (9) при комбинации 8 категориальных признаков, где помимо базовых предикторов использовались показатели LYM <19%, HCT >49%, MON/ ХС ЛВП >0,8 усл. ед., NEUT/ХС ЛВП >5,7 усл. ед. и NEUT/LYM >3 усл. ед. Эта модель имела наилучшее соотношение критериев качества: AUC — 0,80, Ac — 0,76, Se — 0,78 и Sp — 0,79. Прогностические алгоритмы, включающие комбинации других предикторов, обладали меньшей прогностической ценностью.
Таблица 3
Оценка точности прогностических моделей для верификации ОПКА
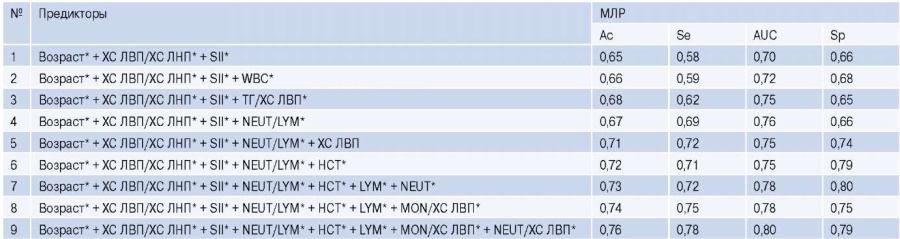
Примечание: * — обозначены значения показателей в категориальной форме.
Сокращения: МЛР — многофакторная логистическая регрессия, ТГ — триглицериды, ХС ЛВП — холестерин липопротеидов высокой плотности, ХС ЛНП — холестерин липопротеидов низкой плотности, Ac — accuracy (точность), AUC — площадь под ROC кривой, HCT — гематокрит, LYM — лимфоциты, MON — моноциты, NEUT — нейтрофилы, Se — sensitivity (чувствительность), SII — иммуно-воспалительный индекс (systemic immune-inflammation index), Sp — specificity (специфичность), WBC — лейкоциты.
Относительный вклад различных предикторов в реализацию конечной точки исследования определяли путем последовательного исключения отдельных факторов из структуры лучшей модели и ее повторного построения на оставшихся. При этом выраженность снижения критерия AUC указывала на прогностическую ценность удаленного предиктора (рис. 1). Так, при исключении из структуры модели показателя ХС ЛВП/ХС ЛНП ее точность по метрике AUC снижалась на 38%. Удаление фактора возраста ограничивало точность модели на 31%, MON/ХС ЛВП — на 14%, NEUT/ХС ЛВП — на 11%, LYM — на 8%, а последовательное исключение признаков SII, NEUT/LYM и HCT сокращало уровень AUC на 7%, 6% и 2%, соответственно. Таким образом, наибольший вклад в прогностическую точность верификации ОПКА ассоциировался с показателем ХС ЛВП/ ХС ЛНП <0,3 усл. ед.
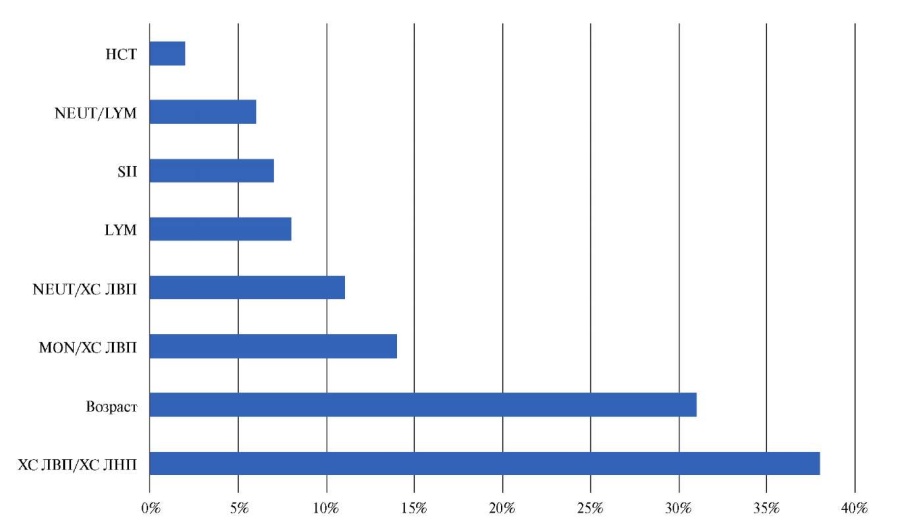
Рис. 1. Относительный вклад отдельных предикторов в реализацию конечной точки, (%).
Сокращения: ЛВП — липопротеиды высокой плотности, ЛНП — липопротеиды низкой плотности, ХС — холестерин, HCT — гематокрит, LYM — лимфоциты, MON — моноциты, NEUT — нейтрофилы, SII — иммуно-воспалительный индекс (systemic immune-inflammation index)
Обсуждение
Показатели КАК и липидного спектра относятся к наиболее доступным индикаторам функциональнометаболического статуса больных ИБС, которые могут быть получены в условиях типовой клинико-диагностической лаборатории. Оценка их предиктивной ценности все чаще используется для прогностических исследований в клинической медицине. В настоящей работе на основе комплексного анализа данных КАК, липидного спектра и их индексированных значений осуществлен отбор потенциальных предикторов для прогнозирования ОПКА у больных с ОКСбпST до проведения инвазивной КАГ. В результате анализа было установлено, что среди показателей КАК наибольшей предиктивной ценностью обладали 3 фактора в изолированной форме (MON, LYM, HCT) и соотношение NEUT/LYM. Комбинированные индексы с аналогичным предиктивным потенциалом были представлены соотношением липидных показателей (ХС ЛВП/ХС ЛНП) и их сочетанием с индикаторами КАК (NEUT/ХС ЛВП, MON/ХС ЛВП, LYM/ХС ЛВП) (табл. 2).
Известно, что развитие ИБС обусловлено атеросклеротическим ремоделированием КА, патофизиологическими детерминантами которого являются атерогенные нарушения липидного обмена, хроническое системное воспаление, окислительный стресс, эндотелиальная дисфункция, деградация внеклеточного матрикса, избыточный протеолиз и др. [10][12][14]. Повышение уровня WBC и дисбаланс в соотношении NEUT и LYM являются ключевыми индикаторами интенсивности воспалительного ответа при различных патологических состояниях, в т.ч. ОКС [12][17]. Соотношение NEUT/ LYM относится к наиболее известным индикаторам эндогенной интоксикации различного генеза и прогностическим маркером неблагоприятных событий при сердечно-сосудистых заболеваниях [17]. В недавно опубликованной работе показатели NEUT >4,3 x109/л (ОШ =13,44, p=0,037) и NEUT/LYM >3,5 усл. ед. (ОШ =2,21, p<0,001) были определены как предикторы смертности у больных ИБС после коронарного шунтирования [18]. В другом исследовании снижение уровня LYM до критериального значения <1,06 x109/л являлось предиктором летального исхода от любых причин у больных, находящихся в отделении интенсивной терапии (p<0,001) [19]. Одна из гипотез, объясняющих повышение индекса NEUT/ LYM у больных с патологией кровообращения, связана с транслокацией LYM из периферической крови в миокард с последующей инфильтрацией очагов некроза и воспаления, что было доказано на когортах больных с обширным ИМ и острой сердечной недостаточностью [10]. Прогностическое значение дисбаланса NEUT и LYM было установлено в отношении постперфузионных осложнений, в т.ч. для оценки риска острых повреждений легких у больных ИБС в послеоперационном периоде коронарного шунтирования с искусственным кровообращением [20]. В нашей работе уровни LYM <19%, NEUT >6,3 x109/л и NEUT/LYM >3 усл. ед. были предикторами ОПКА в моделях (4-8) и вошли в структуру прогностической модели (9) с лучшими метриками качества (табл. 3).
В последние годы опубликованы работы, в которых представлены данные о взаимосвязи функциональной активности PLT с неблагоприятными сердечно-сосудистыми исходами у больных ОКС [21]. При этом тромбоцитарно-лимфоцитарные взаимодействия относят к патофизиологическим детерминантам тромбообразования, воспаления и атерогенеза [17]. Увеличение PLT/LYM >150 усл. ед. ассоциируется с неблагоприятным прогнозом у больных с патологией кровообращения [10]. Показано, в частности, прогностическое значение этого индекса при оценке риска смертности после перенесенного ИМ и у больных с окклюзирующими заболеваниями периферических артерий. В нашем исследовании показатели PLT и PLT/LYM на I этапе отбора предикторов были статистически незначимыми (табл. 1). Однако PLT проявил свою прогностическую ценность при комбинации c NEUT и LYM в индексе SII (табл. 3). Показатель SII >953 усл. ед. (ОШ =3,26, p<0,001) был определен как предиктор неблагоприятных событий, включая ИМ и смерть на 5-летнем горизонте наблюдения у больных ИБС после коронарного шунтирования на работающем сердце [18]. В другом схожем по дизайну исследовании SII >694 усл. ед. обладал предиктивной ценностью для оценки вероятности фатальных осложнений после чрескожных коронарных вмешательств [12]. В нашей работе предиктивный потенциал SII в отношении ОПКА реализовался при его уровне >1000 усл. ед. в модели (9).
Увеличение вязкости цельной крови способствует снижению эндотелиальной скорости сдвига и повышению жесткости артерий, что, в свою очередь, ускоряет процессы их атеросклеротического ремоделирования [22]. Одним из предикторов избыточной вязкости крови является показатель HCT. В работе [22] HCT >44,3% был предиктором эндотелиальной дисфункции и ОПКА в группах больных с микроваскулярной стенокардией и ИБС с атеросклеротическим поражением эпикардиальных артерий (p<0,001). В нашем исследовании показатель HCT >49% имел тесную взаимосвязь с ОПКА (ОШ =3,6, p=0,048) и вошел в структуру лучшей прогностической модели (9).
Результаты ряда исследований указывают на то, что комбинированные индексы, включающие показатели КАК и липидного спектра, более точно отражают интенсивность процессов атерогенеза, чем изолированные индикаторы [23]. К наиболее изученным прогностическим маркерам неблагоприятных исходов у больных с ОКС относят соотношения NEUT/ХС ЛВП, LYM/ХС ЛВП, MON/ХС ЛВП, ХС ЛВП/ХС ЛНП и ТГ/ХС ЛВП [14-16][23]. Так, в работе [14] было показано, что показатель NEUT/ХС ЛВП ≥10,4 усл. ед. обладал лучшим прогностическим потенциалом по сравнению с другими индексами в предсказании смерти на горизонте 1,4 лет у пациентов с ОКС на фоне окклюзии одной из эпикардиальных КА (AUC=0,83, p<0,001). В другом исследовании NEUT/ХС ЛВП ≥5,74 усл. ед. (ОШ =3,2; p<0,001) и MON/ХС ЛВП ≥0,67 усл. ед. (ОШ =2,2; p=0,001) являлись предикторами смерти пациентов старше 65 лет с ИМ на 2-летнем горизонте наблюдения [23]. В нашей работе индексированные соотношения, включающие комбинацию показателей КАК и липидного обмена, были статистически значимыми на всех этапах отбора предикторов, а индексы NEUT/ХС ЛВП >5,7 усл. ед., MON/ХС ЛВП >0,8 усл. ед. вошли в модель (9) с лучшими метриками качества. При этом показатель ХС ЛВП/ХС ЛНП <0,3 усл. ед. являлся базовым предиктором этой модели, что иллюстрировалось его максимальным вкладом (38%) в реализацию конечной точки. Этот факт подтверждает ведущую роль индикаторов атерогенной дислипидемии в прогнозировании ОПКА у больных с ОКСбпST.
Ограничения исследования связаны с необходимостью валидации моделей ОПКА на независимых выборках.
Заключение
В настоящее время не существует общепринятых моделей, предсказывающих ОПКА у больных с ОКСбпST. Используемые для данной категории больных шкалы стратифицируют риск смерти и ИМ на различных горизонтах наблюдения (GRACE, TIMI, PURSUIT, HEART и др.). В рекомендациях Европейского общества кардиологов по диагностике и лечению хронического коронарного синдрома (2019) для определения претестовой вероятности ОПКА предлагается использовать шкалу Consortium CAD [24]. В нашем исследовании предпринята попытка прогнозирования выраженности атеросклеротического ремоделирования КА у больных с ОКСбпST до проведения инвазивной КАГ. Разработанный прогностический алгоритм ОПКА включал 8 предикторов: возраст больных, соотношения ХС ЛВП/ХС ЛНП, MON/ХС ЛВП, NEUT/ХС ЛВП и NEUT/LYM, а также иммуно-воспалительный индекс, содержание в крови лимфоцитов <19% и гематокрит >49%. Наибольший вклад в реализацию конечной точки исследования ассоциировался с 3 факторами: ХС ЛВП/ХС ЛНП, возраст больных и MON/ХС ЛВП. Влияние на риск ОПКА других факторов было менее заметным.
Отношения и деятельность. Работа выполнена при частичной поддержке грантов РФФИ в рамках научных проектов № 20-37-90081, № 19-29-01077.
1. Циванюк М. М., Гельцер Б. И., Шахгельдян К. И. ДВФУ. База данных “Прогностическая оценка обструктивного поражения коронарных артерий у больных с острым коронарным синдромом без подъема сегмента ST”. Св-во № 2022620797 РФ, заявка № 2022620608 от 01.04.2022; опубл. 15.04.2022, Бюл. № 4.
Список литературы
1. Барбараш О. Л., Дупляков Д. В., Затейщиков Д. А. и др. Острый коронарный синдром без подъема сегмента ST электрокардиограммы. Клинические рекомендации 2020. Российский кардиологический журнал. 2021;26(4):4449. doi:10.15829/1560-4071-2021-4449.
2. Российское кардиологическое общество (РКО). Острый инфаркт миокарда с подъемом сегмента ST электрокардиограммы. Клинические рекомендации 2020. Российский кардиологический журнал. 2020;25(11):4103. doi:10.15829/1560-40712020-4103.
3. Collet J, Thiele H, Barbato E, et al. ESC Scientific Document Group, 2020 ESC Guidelines for the management of acute coronary syndromes in patients presenting without persistent ST-segment elevation: The Task Force for the management of acute coronary syndromes in patients presenting without persistent ST-segment elevation of the European Society of Cardiology (ESC). European Heart Journal. 2021;42(14):1289-367. doi:10.1093/eurheartj/ehaa575.
4. Гельцер Б. И., Циванюк М. М., Котельников В. Н., Карпов Р. С. Вазо спастическая стенокардия: патофизиологические детерминанты и клиническое значение. Кардиоваскулярная терапия и профилактика. 2020;19(1):99-105. doi:10.15829/17288800-2020-1-2391.
5. Sucato V, Testa G, Puglisi S, et al. Myocardial infarction with non-obstructive coronary arteries (MINOCA): Intracoronary imaging-based diagnosis and management. J Cardiol. 2021;77(5):444-51. doi:10.1016/j.jjcc.2021.01.001.
6. Сумин А. Н. Оценка предтестовой вероятности в диагностики обструктивных поражений коронарных артерий: нерешенные вопросы. Российский кардиологический журнал. 2017;(11):68-76. doi:10.15829/1560-4071-2017-11-68-76.
7. Wang ZJ, Zhang LL, Elmariah S, et al. Prevalence and Prognosis of Nonobstructive Coronary Artery Disease in Patients Undergoing Coronary Angiography or Coronary Computed Tomography Angiography: A Meta-Analysis. Mayo Clin Proc. 2017;92(3):32946. doi:10.1016/j.mayocp.2016.11.016.
8. Гельцер Б. И., Циванюк М. М., Шахгельдян К. И. и др. Методы машинного обучения в оценке предтестовой вероятности обструктивных и необструктивных поражений коронарного русла. Российский кардиологический журнал. 2020;25(5):3802. doi:10.15829/1560-4071-2020-3802.
9. Qiu Z, Jiang Y, Jiang X, et al. Relationship between platelet to lymphocyte ratio and stable coronary artery disease: meta-analysis of observational studies. Angiology. 2020;000331972094381. doi:10.1177/0003319720943810.
10. Чаулин А. М., Григорьева Ю. В., Павлова Т. В. и др. Диагностическая ценность клинического анализа крови при сердечно-сосудистых заболеваниях. Российский кардиологический журнал. 2020;25(12):3923. doi:10.15829/1560-40712020-3923.
11. Мамедова В. Г. Некоторые особенности состава периферической крови у пациентов с ишемической болезнью сердца и артериальной гипертензией. Вестник Авиценны. 2020;22(3):383-9. doi:10.25005/2074-0581-2020-22-3-383-389.
12. Yang Y-L, Wu C-H, Hsu P-F, et al. Systemic immune-inflammation index (SII) predicted clinical outcome in patients with coronary artery disease. European journal of clinical investigation. 2020; e13230. doi:10.1111/eci.13230.
13. Haybar H, Pezeshki SMS, Saki N. Evaluation of complete blood count parameters in cardiovascular diseases: An early indicator of prognosis? Exp Mol Pathol. 2019;110:104267. doi:10.1016/j.yexmp.2019.104267.
14. Ozgeyik M, Ozgeyik MO. Long-term Prognosis after Treatment of Total Occluded Coronary Artery is well Predicted by Neutrophil to High-Density Lipoprotein Ratio: a Comparison Study. Kardiologiia. 2021;61(7):60-7. doi:10.18087/cardio.2021.7.n1637.
15. Zhang Y, Li S, Guo YL, et al. Is monocyte to HDL ratio superior to monocyte count in pre dicting the cardiovascular outcomes: evidence from a large cohort of Chinese patients undergoing coronary angiography. Ann Med. 2016;48(5):305-12. doi:10.3109/07853890.2016.1168935.
16. Гельцер Б. И., Циванюк М. М., Шахгельдян К. И. и др. Факторы кардиометаболического риска в прогнозировании обструктивного поражения коронарных артерий у больных с острым коронарным синдромом без подъема сегмента ST. Российский кардиологический журнал. 2021;26(11):4494. doi:10.15829/1560-4071-2021-4494.
17. Соколов Д. А., Каграманян М. А., Козлов И. А. Расчетные гематологические индексы как предикторы сердечно-сосудистых осложнений в некардиальной хирургии (пилотное исследование). Вестник анестезиологии и реаниматологии. 2022;19(2):14-22. doi:10.21292/2078-5658-2022-19-2-14-22.
18. Urbanowicz T, Michalak M, Olasińska-Wiśniewska A, et al. Neutrophil Counts, Neutrophilto-Lymphocyte Ratio, and Systemic Inflammatory Response Index (SIRI) Predict Mortality after Off-Pump Coronary Artery Bypass Surgery. Cells. 2022;11(7):1124. doi:10.3390/cells11071124.
19. Wu X, Luo Q, Su Z, et al. Neutrophil-to-lymphocyte ratio as a predictor of mortality in intensive care unit patients: a retrospective analysis of the Medical Information Mart for Intensive Care III Database. BMJ Open. 2021;11(11):e053548. doi:10.1136/bmjopen-2021-053548.
20. Сергеев Е. А., Гельцер Б. И., Саид Шох С. М. Х. и др. Оценка индикаторов легочной волемии и системной воспалительной реакции у пациентов с коморбидностью хронической обструктивной болезни лёгких и ишемической болезни сердца после коронарного шунтирования. Бюллетень физиологии и патологии дыхания. 2021;(80):8-17. doi:10.36604/1998-5029-2021-80-8-17.
21. Ломакин Н. В., Бурячковская Л. И., Сумароков А. Б. и др. Взаимосвязь функцио нальной Активности тромбоцитов с прогнозом неблагоприятных сердечнососудистых событий у больных острым коронарным синдромом. Результаты регистрового исследования. Кардиология. 2019;59(10):5-13. doi:10.18087/cardio.2019.10.n678.
22. Cekirdekci EI, Bugan B. Whole blood viscosity in microvascular angina and coronary artery disease: Significance and utility. Revista Portuguesa de Cardiol. 2020;39(1):17-23. doi:10.1016/j.repc.2019.04.008.
23. Huang JB, Chen YS, Ji HY, et al. Neutrophil to high-density lipoprotein ratio has a superior prognostic value in elderly patients with acute myocardial infarction: a comparison study. Lipids health dis. 2020;19(1):59. doi:10.1186/s12944-020-01238-2.
24. Knuuti J, Wijns W, Saraste A, et al. 2019 ESC Guidelines on the diagnosis and management of chronic coronary syndromes: The Task Force for diagnosis and management of chronic coronary syndromes of the European Society of Cardiology (ESC). Eur Heart J. 2019;1-71. doi:10.1093/eurheartj/ehz425.
Об авторах
М. М. ЦиванюкРоссия
Михаил Михайлович Циванюк — аспирант школы медицины, врач отделения рентгенохирургических методов диагностики и лечения, кардиолог.
Владивосток, SPIN-код 1491-3966
Конфликт интересов:
нет
Б. И. Гельцер
Россия
Борис Израйльевич Гельцер — доктор медицинских наук, профессор, член-корр. РАН, зам. директора Школы медицины по научной работе.
Владивосток
SPIN-код: 2216-4151
Конфликт интересов:
нет
К. И. Шахгельдян
Россия
Карина Иосифовна Шахгельдян — доктор технических наук, доцент, директор института Информационных технологий, зав. лабораторией анализа больших данных в биомедицине и здравоохранении Школы медицины.
Владивосток
SPIN-код: 3573-7894
Конфликт интересов:
нет
А. А. Вишневский
Россия
Андрей Александрович Вишневский — магистрант кафедры математики и моделирования.
Владивосток
Конфликт интересов:
нет
О. И. Шекунова
Россия
Ольга Ивановна Шекунова — кандидат медицинских наук, доцент Школы медицины.
Владивосток
Конфликт интересов:
нет
Дополнительные файлы
Рецензия
Для цитирования:
Циванюк М.М., Гельцер Б.И., Шахгельдян К.И., Вишневский А.А., Шекунова О.И. Показатели клинического анализа крови, липидного спектра и их соотношений в прогнозировании обструктивного поражения коронарных артерий у больных с острым коронарным синдромом без подъема ST. Российский кардиологический журнал. 2022;27(8):5079. https://doi.org/10.15829/1560-4071-2022-5079
For citation:
Tsivanyuk M.M., Geltser B.I., Shakhgeldyan K.I., Vishnevskiy A.A., Shekunova O.I. Parameters of complete blood count, lipid profile and their ratios in predicting obstructive coronary artery disease in patients with non-ST elevation acute coronary syndrome. Russian Journal of Cardiology. 2022;27(8):5079. (In Russ.) https://doi.org/10.15829/1560-4071-2022-5079
JATS XML

















































