Перейти к:
Количественная оценка исходной концентрации кальций-фосфатных бионов как скринингового маркера минерального гомеостаза крови у пациентов с сердечно-сосудистыми заболеваниями и у пациентов с хронической болезнью почек
https://doi.org/10.15829/1560-4071-2022-5064
Аннотация
Цель. Оценить исходную концентрацию кальций-фосфатных бионов (КФБ), являющихся скевенджерами избыточного кальция и фосфора, в крови у пациентов с сердечно-сосудистыми заболеваниями и у пациентов с хронической болезнью почек в сравнении с условно здоровыми донорами крови.
Материал и методы. В исследование было включено 308 субъектов: 1) 88 участников эпидемиологического исследования PURE, не имеющих гемодинамически значимого каротидного атеросклероза и симптоматического коронарного атеросклероза; 2) 88 пациентов с цереброваскулярной болезнью (ЦВБ), потребовавшей каротидной эндартерэктомии; 3) 88 пациентов с ишемической болезнью сердца (ИБС), потребовавшей чрескожного коронарного вмешательства или коронарного шунтирования; 4) 63 пациента с хронической болезнью почек 5 стадии (ХБП5). У пациентов в сыворотке определяли базовые биохимические показатели минерального гомеостаза (уровень общего и ионизированного кальция, фосфора, общего белка, альбумина и фетуина-А) и исходную концентрацию КФБ в сыворотке крови при помощи флюоресцентно меченного бисфосфоната OsteoSense 680EX методом проточной цитометрии.
Результаты. В сравнении со всеми остальными категориями пациентов условно здоровые доноры крови характеризовались наибольшей концентрацией КФБ в сыворотке (249 КФБ/мкл), что свидетельствует о сохранной способности крови к компенсации нарушений минерального гомеостаза путем агрегации избыточного кальция и фосфора с кислыми белками. Сниженная исходная концентрация КФБ у пациентов с ЦВБ (170 КФБ/мкл), ИБС (139 КФБ/мкл) и ХБП5 (193-203 КФБ/мкл) указывала на нарушение способности агрегировать избыточный кальций и фосфор, что также было отражено повышенным уровнем ионизированного кальция в крови.
Заключение. Пациенты с ЦВБ, ИБС и ХБП5 характеризуются сниженной исходной концентрацией КФБ в крови в сравнении с условно здоровыми донорами, что в сочетании с повышенным уровнем ионизированного кальция и сниженным уровнем альбумина позволяет предположить истощение кальций-связывающей способности сыворотки у пациентов с сердечно-сосудистыми и почечными заболеваниями.
Ключевые слова
Для цитирования:
Шишкова Д.К., Матвеева В.Г., Маркова В.Е., Хрячкова О.Н., Индукаева Е.В., Шабаев А.Р., Фролов А.В., Кутихин А.Г. Количественная оценка исходной концентрации кальций-фосфатных бионов как скринингового маркера минерального гомеостаза крови у пациентов с сердечно-сосудистыми заболеваниями и у пациентов с хронической болезнью почек. Российский кардиологический журнал. 2022;27(12):5064. https://doi.org/10.15829/1560-4071-2022-5064
For citation:
Shishkova D.K., Matveeva V.G., Markova V.E., Khryachkova O.N., Indukaeva E.V., Shabaev А.R., Frolov A.V., Kutikhin A.G. Quantification of the initial levels of calciprotein particles as a screening marker of mineral homeostasis in patients with cardiovascular disease and in patients with chronic kidney disease. Russian Journal of Cardiology. 2022;27(12):5064. (In Russ.) https://doi.org/10.15829/1560-4071-2022-5064
Нарушения минерального гомеостаза в зависимости от своей тяжести могут привести к повышению уровней ионизированного кальция и фосфора до "высоких нормальных" значений или даже к превышению их физиологической нормы. Эпидемиологические исследования показали, что "высокие нормальные" уровни ионизированного кальция и фосфора ассоциированы с повышенным риском развития инфаркта миокарда (ИМ) и ишемического инсульта (ИИ) [1], а также микрососудистой дисфункции [2], которая коррелирует с относительно высокой вероятностью острых сердечно-сосудистых событий, хронической сердечной недостаточности и смерти от сердечно-сосудистых заболеваний (ССЗ) [3].
Помимо системы кальциетропных и фосфотропных гормонов и их рецепторов, а также ионов магния, уровень ионизированного кальция в крови контролируется циркулирующими кислыми белками — так называемыми минеральными шаперонами [4], которые связывают положительно заряженные ионы кальция за счет отрицательно заряженных аминокислот в своей структуре. Основными минеральными шаперонами сыворотки крови человека являются альбумин (до 60% всех белков крови) и фетуин-А, который обладает чрезвычайно высокой емкостью связывания как ионов кальция, так и зарождающихся фосфорнокальциевых кластеров [5]. По аналогии с "высоким нормальным" уровнем кальция и фосфора, "низкий нормальный" уровень альбумина и фетуина-А также ассоциирован с повышенным риском развития ИМ, ИИ и сердечно-сосудистой смерти [6]. В результате связывания фетуина-А с фосфатом кальция происходит формирование кальципротеиновых мономеров и наноразмерных частиц — кальций-фосфатных бионов (КФБ), также называемых кальципротеиновыми частицами, агрегирующих избыточный ионизированный кальций и фосфат-анионы и выводящих их из кровотока [7]. Эксперименты по моделированию влияния КФБ на сосудистую стенку показали, что данные частицы интернализуются эндотелиальными клетками, вызывая их гибель посредством пермеабилизации лизосомальной мембраны [7] и способствуя формированию провоспалительного микроокружения, приводящего к развитию дисфункции эндотелия [8] и формированию неоинтимы [7][8]. Таким образом, КФБ, с одной стороны, выполняют жизненно важную функцию системных скевенджеров избыточного кальция и фосфора, а с другой — способствуют развитию дисфункции эндотелия, являющейся обязательным триггером развития атеросклероза.
В последние годы был разработан метод прямой детекции (определения исходной концентрации) КФБ в сыворотке или плазме крови при помощи связывания КФБ флюоресцентно меченым бисфосфонатом (OsteoSense 680EX) в сочетании с дифференциальным окрашиванием имеющих сходную размерность внеклеточных везикул липофильным мембранным красителем PKH67 [9]. Несмотря на активное использование этого метода у пациентов с требующей гемодиализа хронической болезнью почек (ХБП) [10][11], количественного измерения КФБ в сыворотке крови пациентов с ССЗ, тем более в контексте иных нарушений минерального гомеостаза, до настоящего времени проведено не было.
Материал и методы
В исследование было включено 308 субъектов: 1) 88 участников эпидемиологического исследования PURE (Prospective Urban Rural Epidemiology Study), обследованных на базе НИИ КПССЗ и не имеющих гемодинамически значимого каротидного атеросклероза (стеноз >50% просвета сосуда) по данным ультразвуковой допплерографии и симптоматического коронарного атеросклероза в анамнезе; 2) 88 пациентов с цереброваскулярной болезнью (ЦВБ), поступивших в нейрохирургическое отделение ГБУЗ КО "КОККД им. акад. Л.С. Барбараша" с потребовавшим проведения каротидной эндартерэктомии атеросклерозом сонных артерий (44 пациента с ИИ и 44 пациента с хронической ишемией головного мозга (ХИГМ)); 3) 88 пациентов с ишемической болезнью сердца (ИБС), потребовавшей чрескожного коронарного вмешательства (44 пациента с ИМ, поступивших в кардиологическое отделение ГБУЗ КО "КОККД им. акад. Л.С. Барбараша") или коронарного шунтирования (44 пациента с хроническим коронарным синдромом (ХКС), поступивших в кардиохирургическое отделение НИИ КПССЗ); 4) 63 пациента с ХБП 5 стадии (ХБП5) (определяемой как скорость клубочковой фильтрации <15 мл/ мин/1,73 м2 по формуле CKD-EPI), поступивших в Центр нефрологии и гемодиализа ГАУЗ "КОКБ им. С.В. Беляева". Исследование было выполнено в соответствии со стандартами надлежащей клинической практики (Good Clinical Practice) и принципами Хельсинкской декларации. Протокол исследования был одобрен локальным этическим комитетом НИИ КПССЗ (дата заседания 10.09.2018, протокол № 80/2018). До включения в исследование от всех пациентов было получено письменное информированное согласие. Гендерно-возрастные характеристики, коморбидные патологии и фармакологический анамнез включенных в исследование субъектов приведены в более ранней статье нашей группы [12].
У включенных в исследование пациентов при помощи автоматизированного биохимического анализатора (Konelab 60i, Thermo Scientific) были определены параметры, определяющие системный минеральный гомеостаз: уровень общего и ионизированного кальция, фосфора, а также концентрации общего белка и альбумина. Концентрацию фетуина-А в сыворотке крови определяли методом иммуноферментного анализа (RD191037100, BioVendor) согласно протоколу производителя на спектрофотометре Multiskan Sky (Thermo Scientific).
С целью прямой детекции КФБ в сыворотке крови использовали флюоресцентно меченный бисфосфонат OsteoSense 680EX (NEV10020EX, Perkin-Elmer), тропный к фосфату кальция, и липофильный флюоресцентный краситель PKH67 (MIDI67-1KT, SigmaAldrich), связывающийся с липидами, согласно авторской методике [9]. Такое сочетание красителей позволило надежно дифференцировать КФБ от внеклеточных мембранных везикул. Для проведения анализа сыворотку включенных в исследование пациентов после разморозки центрифугировали при 3500 × g в течение 5 мин (Microfuge 20R, Beckman Coulter) для осаждения криопреципитата. Затем в новую пробирку с номером исследуемого пациента было аликвотировано 50 мкл чистого надосадка, который был разведен в соотношении 1:5 в дважды отфильтрованном через поры диаметром 220 нм Tris-буферном растворе (TBS, pH 7,4, 252859, Sigma-Aldrich). Далее образцы были вновь центрифугированы для осаждения нецелевого крупного дебриса при 10000 × g в течение 15 мин при 40 C. Для дальнейшего окрашивания 200 мкл надосадка были смешаны с 250 мкл флюоресцентного меченного бисфосфоната OsteoSense 680EX (предварительно разведенного в соотношении 1:75 в вышеуказанном TBS) и инкубированы в течение 50 мин в темноте при 40 C. По истечении времени инкубации в пробирку было добавлено 25 мкл флюоресцентного красителя PKH67 (растворенного в специальном растворителе Diluent C в соотношении 1:100 согласно инструкции к набору), с дальнейшим ресуспендированием и инкубацией в темноте в течение 10 мин при 40 C.
Далее был проведен анализ образцов на проточном цитометре CytoFlex (Beckman Coulter). В качестве отмывочной жидкости была использована отфильтрованная через поры диаметром 220 нм бидистиллированная вода. Для детекции флюоресцентного красителя OsteoSense 680EX был применен лазер c длиной волны 638 нм (фильтр 712/25 BP), для детекции PKH67 — лазер c длиной волны 488 нм (фильтр 525/40 BP). В качестве положительного контроля для установки напряжения каналов флюоресценции были использованы искусственно синтезированные КФБ [8]. В качестве отрицательного контроля (холостые пробы) для установки напряжения каналов флюоресценции и ежедневной проверки сходимости показаний прибора были использованы рабочие растворы обоих указанных флюоресцентных красителей, смешанные с чистым TBS без внесения сыворотки пациентов, а также сыворотка пациентов без внесения флюоресцентных красителей. КФБ детектировались как OsteoSense 680EX-положительные PKH67-отрицательные события.
Для сбора событий была установлена минимально возможная скорость 10 мкл/мин, что позволяло минимизировать детекцию ложноположительных "засвеченных частиц". Для максимальной стабилизации сигнала начало записи событий осуществлялось через 30 сек после загрузки образца в проточный цитометр. Длительность регистрации событий в каждом образце составила 2 мин, для повышения точности анализа все измерения были проведены дважды. Для исключения кросс-контаминации между различными образцами после анализа каждого образца дважды выполнялась короткая промывка прибора.
Статистический анализ был выполнен в программе GraphPad Prism 8 (GraphPad Software). Сравнения между группами были проведены при помощи критерия Краскела-Уоллиса, при этом поправка на множественные сравнения была осуществлена посредством расчета средней доли ложных отклонений гипотез (FDR). Значения p<0,05 признавались статистически значимыми.
Работа выполнена при поддержке комплексной программы фундаментальных научных исследований СО РАН в рамках фундаментальной темы НИИ КПССЗ № 0419-2022-0001 "Молекулярные, клеточные и биомеханические механизмы патогенеза сердечно-сосудистых заболеваний в разработке новых методов лечения заболеваний сердечно-сосудистой системы на основе персонифицированной фармакотерапии, внедрения малоинвазивных медицинских изделий, биоматериалов и тканеинженерных имплантатов".
Результаты
При измерении молярной концентрации общего кальция в сыворотке крови было выявлено, что пациенты с ЦВБ (ХИГМ, ИИ), ИБС (ХКС, ИМ) и ХБП5 до гемодиализа характеризуются его сниженным уровнем в сравнении с условно здоровыми донорами крови, в то время как после гемодиализа, наоборот, регистрируется повышение уровня общего кальция вследствие использования кальций-содержащих фосфат-биндеров и временному перераспределению кальция из костной ткани в кровоток (рис. 1 А). Напротив, при измерении молярной концентрации ионизированного (физиологически активного, не связанного с белками или фосфором) кальция в сыворотке крови было обнаружено его повышение у пациентов с ЦВБ (ХИГМ, ИИ) и ИБС (ХКС, ИМ), а также у пациентов с ХБП5 после гемодиализа в сравнении с условно здоровыми донорами крови по описанным выше причинам (рис. 1 Б).
Наиболее вероятным объяснением повышенного уровня ионизированного кальция у пациентов с ЦВБ и ИБС может быть сниженная концентрация общего белка (рис. 2 А) и кальций-связывающего белка альбумина (рис. 2 Б). Стоит отметить гипопротеинемию и гипоальбуминемию у пациентов с ХБП5 до и ее частичную коррекцию после гемодиализа (рис. 2 Б), что указывает на техническую валидность выполненных измерений.
Молярная концентрация фосфора в сыворотке крови пациентов с ЦВБ и ИБС практически не отличалась от таковой у условно здоровых доноров крови (рис. 3 А). Выявленная гиперфосфатемия у пациентов с ХБП5 до гемодиализа и резкое снижение уровня фосфора в крови после проведения данной процедуры подтвердило техническую валидность выполняемых измерений (рис. 3 А). Измерение концентрации фетуина-А не выявило статистически значимых отличий между группами, практически у всех пациентов его концентрация находилась в пределах физиологической нормы (рис. 3 Б).
Далее была проведена оценка исходной концентрации КФБ в сыворотке крови методом проточной цитометрии с использованием флюоресцентных красителей OsteoSense 680EX и PKH67. Сперва было проведено измерение холостых проб и отрицательного контроля, что позволило оценить фоновую флюоресценцию контрольных образцов и показать отсутствие в них OsteoSense 680EX-положительных PKH67-отрицательных событий до специфического флюоресцентного окрашивания (гейт Q2-UL, рис. 4).
С целью установки напряжения фотоэлектронного умножителя для лазера c длиной волны 638 нм (фильтр 712/25 BP), детектирующего флюоресцентный краситель OsteoSense 680EX, в качестве положительного контроля были использованы искусственно синтезированные КФБ в серии разведений, успешная флюоресцентная детекция которых подтвердила техническую валидность примененного подхода к измерению концентрации КФБ (рис. 5).
Измерение концентрации КФБ в сыворотке крови пациентов методом проточной цитометрии выявило снижение концентрации КФБ (OsteoSense 680EX-положительных PKH67-отрицательных событий) в крови пациентов с ЦВБ, ИБС и ХБП5 в сравнении с условно здоровыми донорами крови. Медианная концентрация КФБ в сыворотке крови условно здоровых доноров составила 249 КФБ/мкл (межквартильный интервал (МКИ): 162-326), у пациентов с ЦВБ — 170 КФБ/мкл (МКИ: 117-213), у пациентов с ИБС — 139 КФБ/мкл (МКИ: 103-185), у пациентов с ХБП5 до гемодиализа — 203 КФБ/мкл (МКИ: 167-245), у пациентов с ХБП5 после гемодиализа — 193 КФБ/мкл (МКИ: 154-276) (рис. 6). Примеры репрезентативных гейтов (проточно-цитометрических карт) приведены на рисунке 7.
Независимо от течения ишемии, все категории пациентов (пациенты с ЦВБ (ХИГМ и ИИ) и ИБС (ХКС и ИМ)) характеризовались статистически значимо сниженной концентрацией КФБ в сыворотке в сравнении с условно здоровыми донорами крови. Медианная концентрация КФБ в сыворотке крови условно здоровых доноров составила 249 КФБ/мкл (МКИ: 162-326), у пациентов с ХИГМ — 167 КФБ/мкл (МКИ: 105-216), у пациентов с ИИ — 172 КФБ/мкл (МКИ: 118-208), у пациентов с ХКС — 118 КФБ/мкл (МКИ: 85-152), у пациентов с ИМ — 169 КФБ/мкл (МКИ: 128-299) (рис. 8). Примеры репрезентативных гейтов (проточно-цитометрических карт) приведены на рисунке 9.
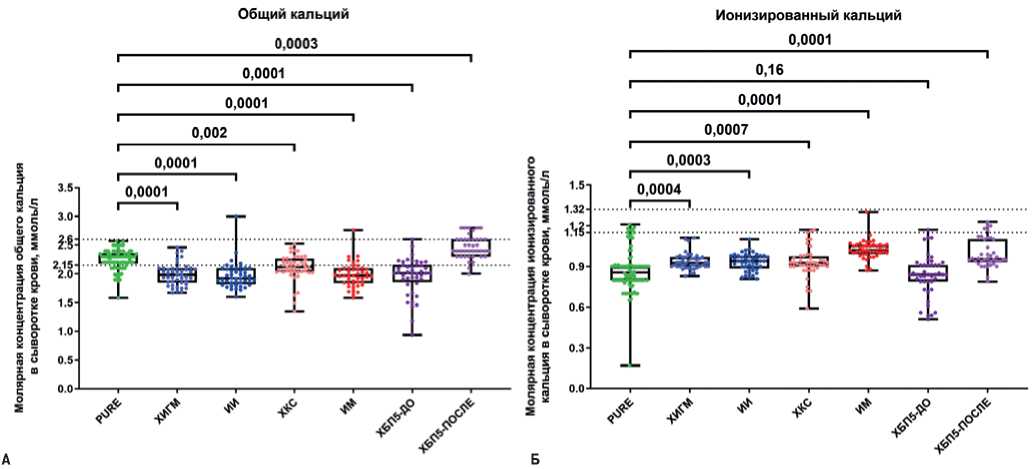
Рис. 1. Молярная концентрация общего и ионизированного кальция в сыворотке крови исследованных субъектов. Значения P указаны над графиками, пунктирные линии отражают нижнюю и верхнюю границы нормы. Каждая точка на графике отражает анализ по одному пациенту.
Сокращения: ИИ — ишемический инсульт, ИМ — инфаркт миокарда, ХБП5 — хроническая болезнь почек 5 стадии, ХИГМ — хроническая ишемия головного мозга, ХКС — хронический коронарный синдром.
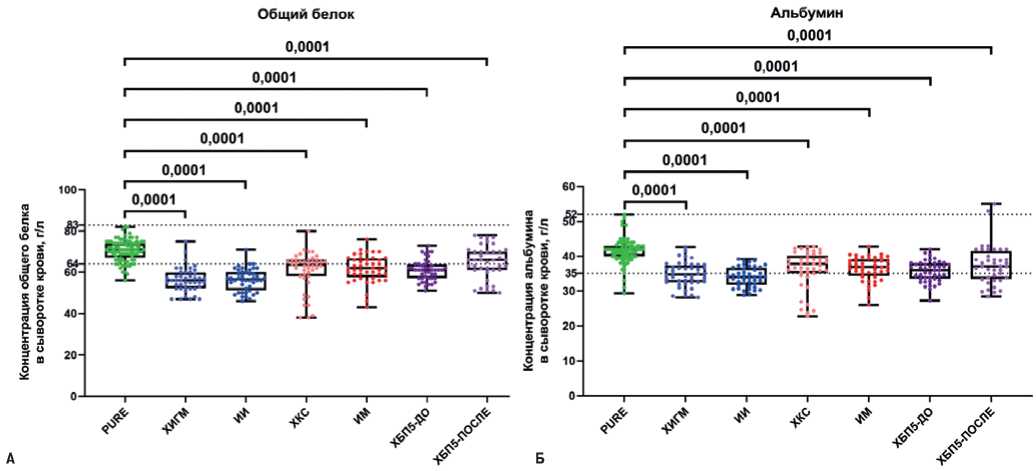
Рис. 2. Концентрация общего белка и альбумина в сыворотке крови исследованных субъектов. Значения P указаны над графиками, пунктирные линии отражают нижнюю и верхнюю границы нормы. Каждая точка на графике отражает анализ по одному пациенту.
Сокращения: ИИ — ишемический инсульт, ИМ — инфаркт миокарда, ХБП5 — хроническая болезнь почек 5 стадии, ХИГМ — хроническая ишемия головного мозга, ХКС — хронический коронарный синдром.
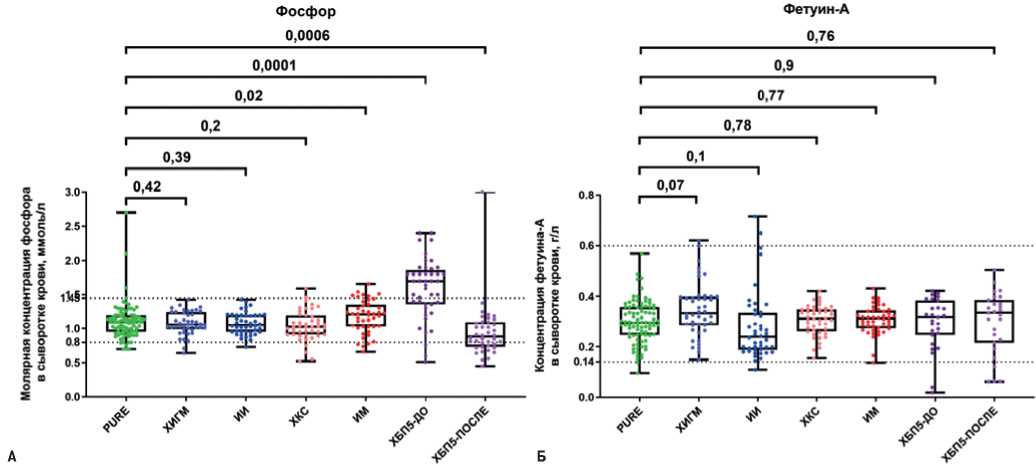
Рис. 3. Концентрация фосфора и фетуина-А в сыворотке крови исследованных субъектов. Значения P указаны над графиками, пунктирные линии отражают нижнюю и верхнюю границы нормы. Каждая точка на графике отражает анализ по одному пациенту.
Сокращения: ИИ — ишемический инсульт, ИМ — инфаркт миокарда, ХБП5 — хроническая болезнь почек 5 стадии, ХИГМ — хроническая ишемия головного мозга, ХКС — хронический коронарный синдром.
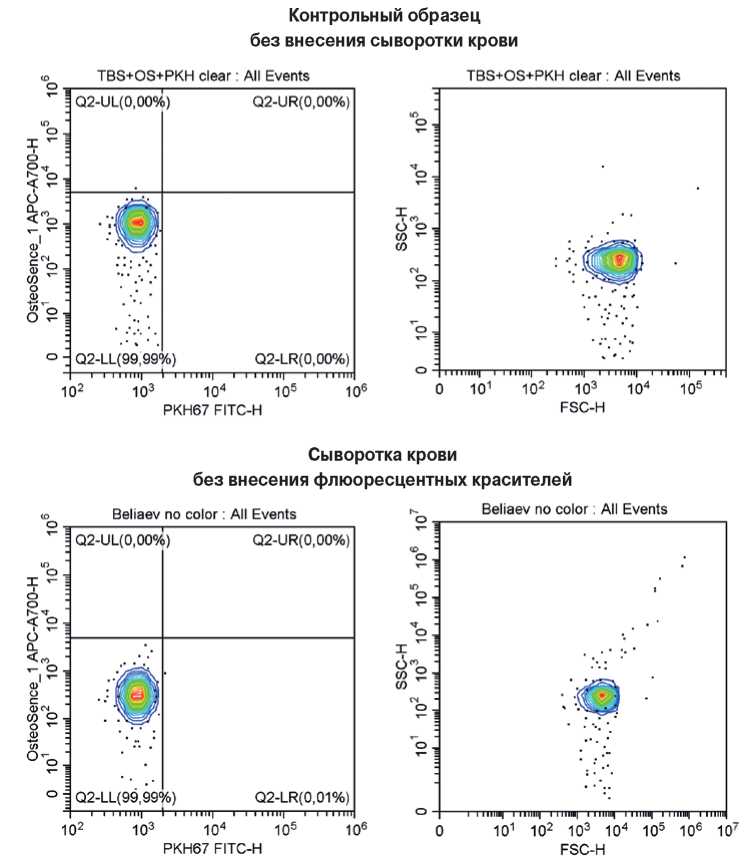
Рис. 4. Репрезентативные гейты, отражающие процент КФБ (OsteoSense 680EX-положительных PKH67-отрицательных событий, слева) и распределение размерности данных событий (справа). Холостая проба (TBS и флюоресцентные красители) без внесения сыворотки крови и сыворотка крови без внесения флюоресцентных красителей (отрицательный контроль).
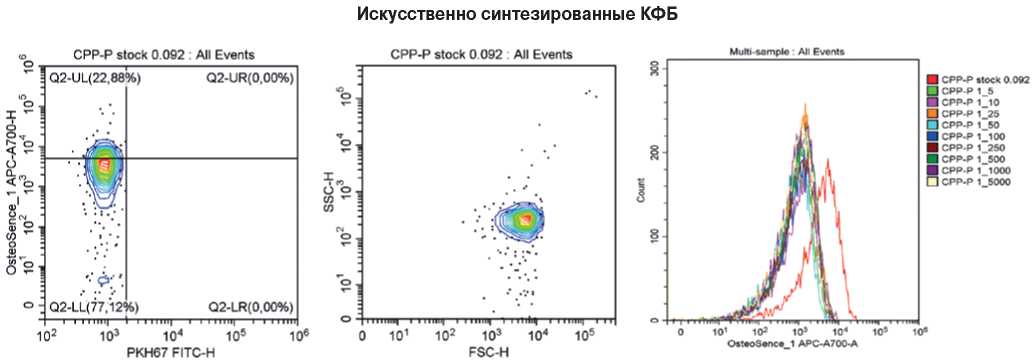
Рис. 5. Репрезентативные гейты, отражающие процент КФБ (OsteoSense 680EX-положительных PKH67-отрицательных событий, слева), распределение размерности данных событий (в центре) и стабильность детекции КФБ между образцами (справа). Искусственно синтезированные КФБ (положительный контроль).
Примечание: цветное изображение доступно в электронной версии журнала.
Сокращение: КФБ — кальций-фосфатные бионы.
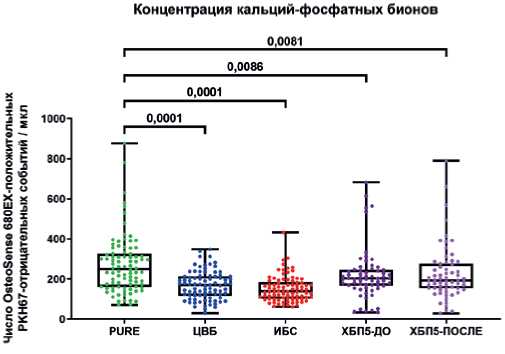
Рис. 6. Концентрация КФБ (OsteoSense 680EX-положительные PKH67-отрицательные события) в сыворотке крови исследованных субъектов. Значения P указаны над графиками. Каждая точка на графике отражает анализ по одному пациенту.
Сокращения: ИБС — ишемическая болезнь сердца, ХБП5 — хроническая бо - лезнь почек 5 стадии, ЦВБ — цереброваскулярная болезнь.
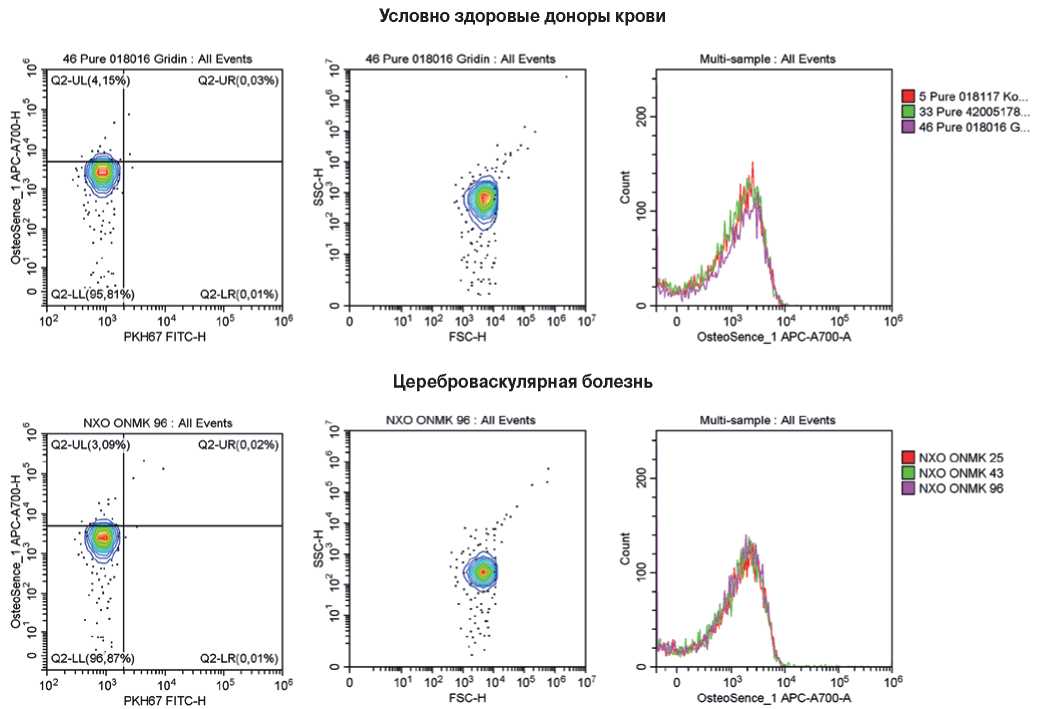
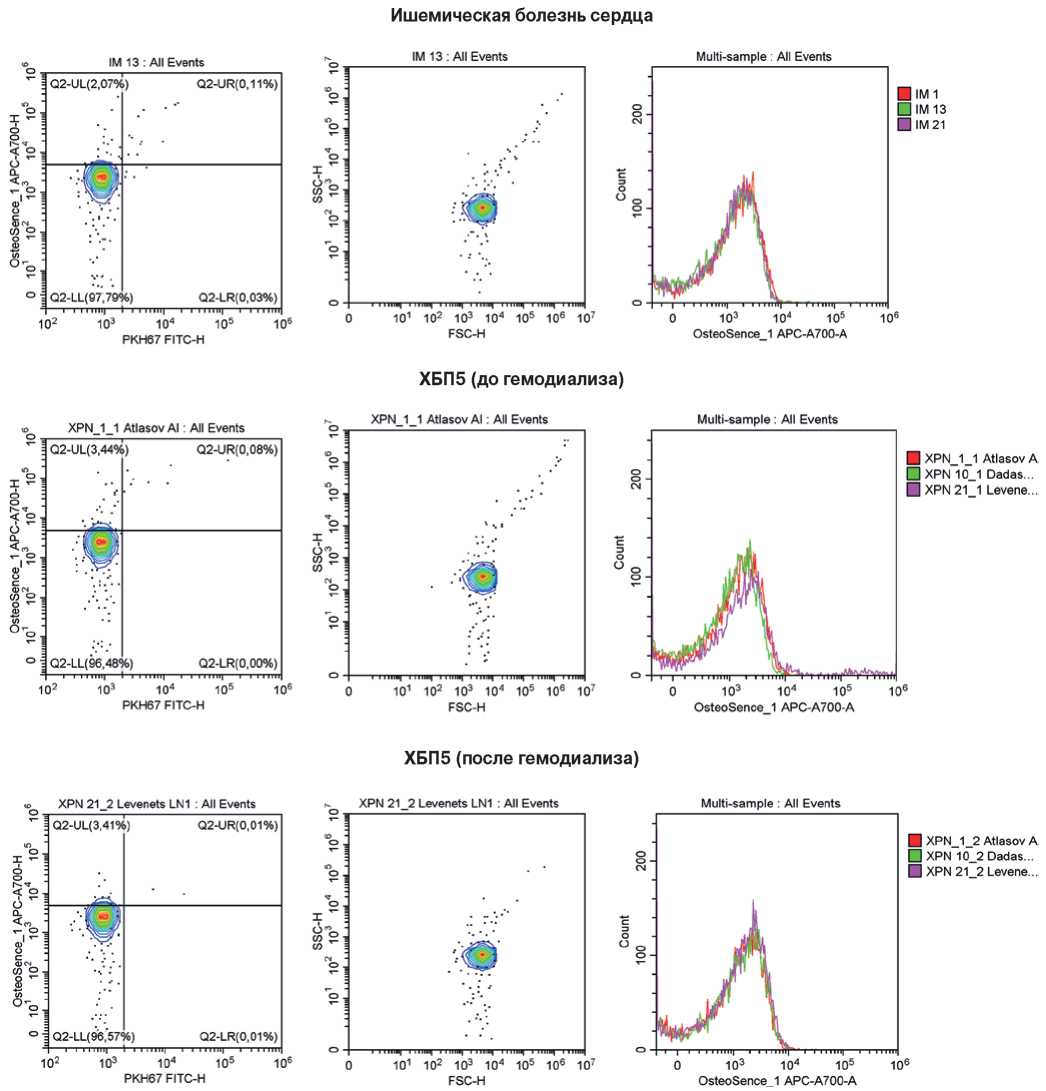
Рис. 7. Репрезентативные гейты, отражающие процент КФБ (OsteoSense 680EX-положительных PKH67-отрицательных событий, слева), распределение размерности данных событий (в центре) и стабильность детекции КФБ между образцами одной и той же группы (справа). Сыворотка крови исследованных пациентов.
Примечание: цветное изображение доступно в электронной версии журнала.
Сокращение: ХБП5 — хроническая болезнь почек 5 стадии.
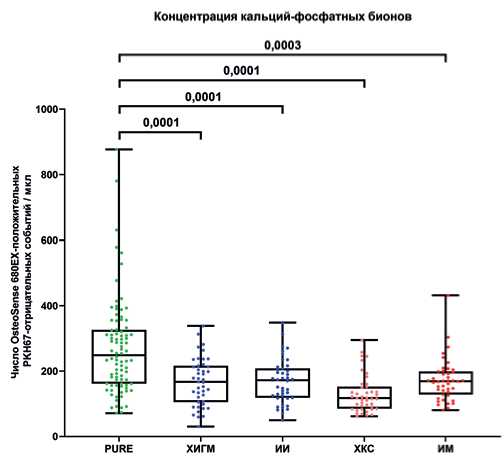
Рис. 8. Концентрация КФБ (OsteoSense 680EX-положительные PKH67-отри - цательные события) в сыворотке крови исследованных субъектов. Значения P указаны над графиком. Каждая точка на графике отражает анализ по одному пациенту.
Сокращения: ИИ — ишемический инсульт, ИМ — инфаркт миокарда, ХИГМ — хроническая ишемия головного мозга, ХКС — хронический коронарный синдром.
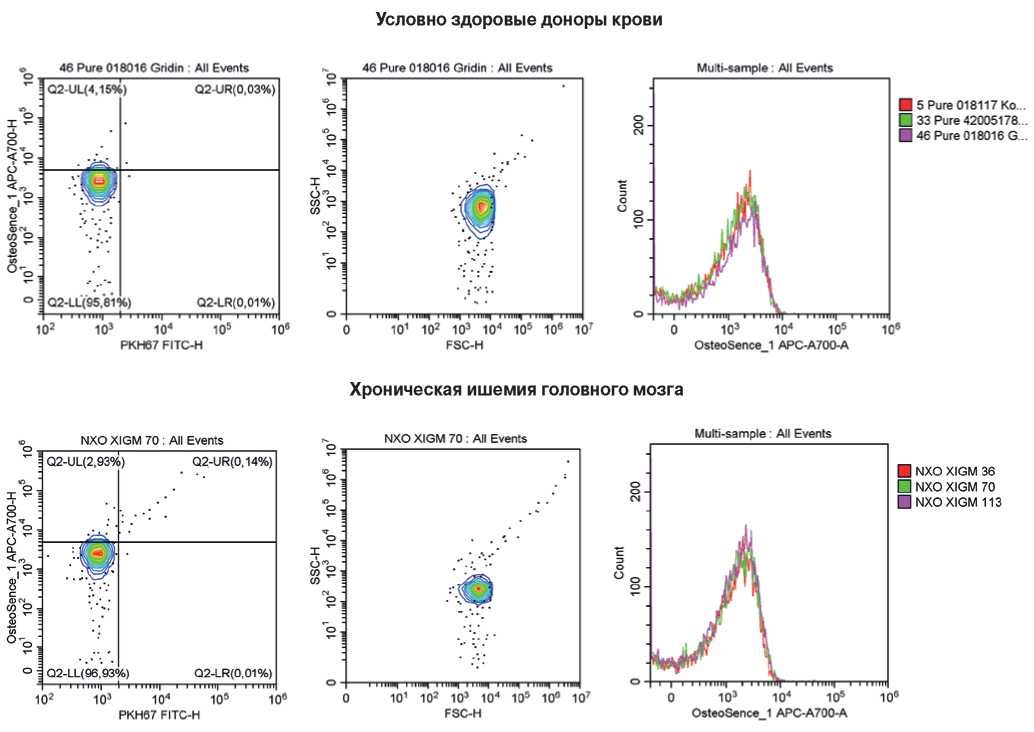
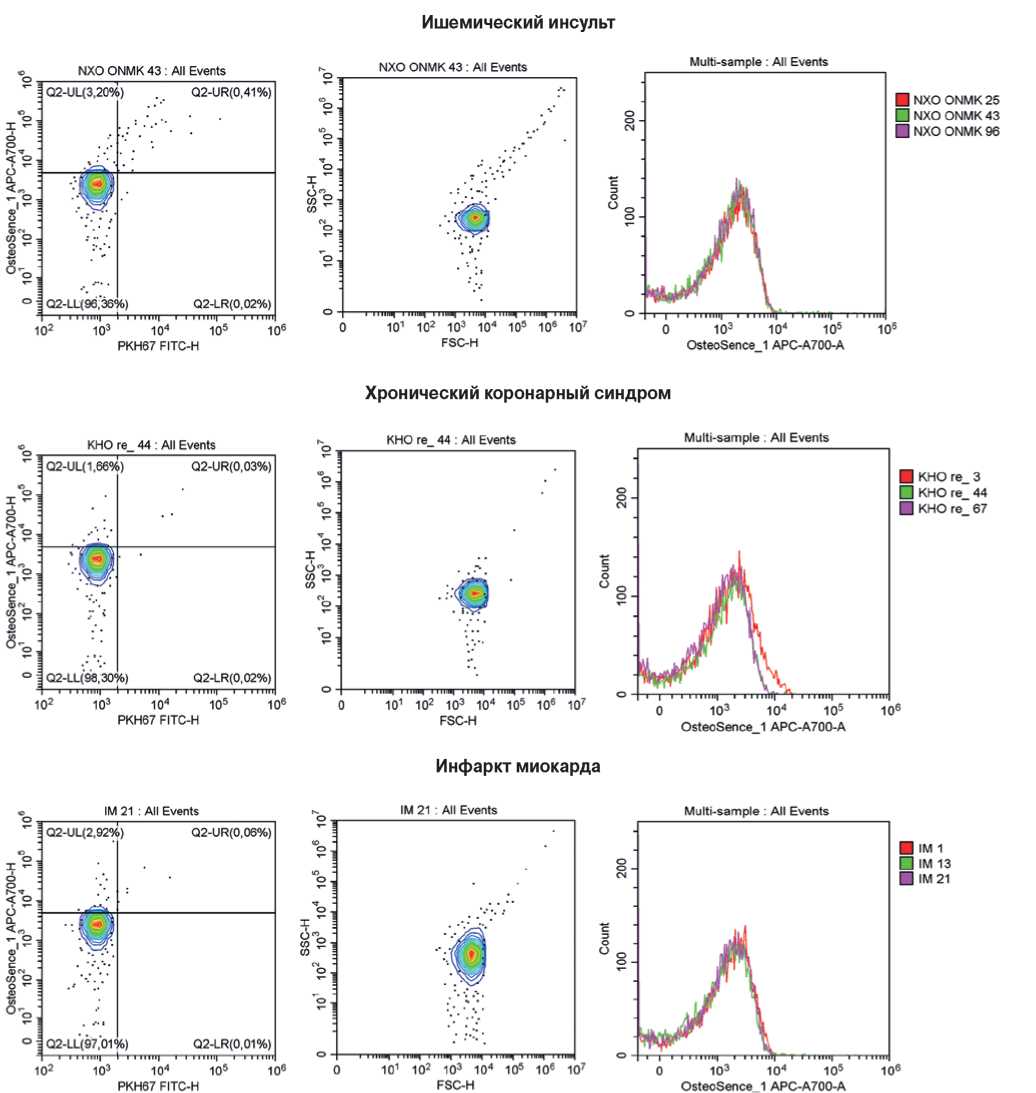
Рис. 9. Репрезентативные гейты, отражающие процент КФБ (OsteoSense 680EX-положительных PKH67-отрицательных событий, слева), распределение размерности событий (в центре) и стабильность детекции КФБ между образцами одной и той же группы (справа). Сыворотка крови исследованных пациентов.
Примечание: цветное изображение доступно в электронной версии журнала.
Обсуждение
Патофизиологическая значимость частиц-скевенджеров избыточного кальция и фосфора (КФБ) достаточно активно привлекает внимание физиологов, кардиологов и нефрологов, поскольку ускоренное формирование данных минерало-органических частиц в крови ассоциировано с развитием артериальной гипертензии, ИМ, ХИГМ, ИИ [7] и сердечно-сосудистой смертью [13] у субъектов без ХБП, а также с развитием заболеваний периферических артерий, ИМ и сердечно-сосудистой смертью у пациентов с ХБП5 (в т.ч. после трансплантации почки) [14]. Кроме того, было продемонстрировано, что ускоренное формирование КФБ в крови коррелирует с тяжестью и прогрессированием кальцификации коронарных артерий, а также развитием острых сердечно-сосудистых событий у пациентов с 2-4 стадиями ХБП [14].
Ранее нашей группой было показано, что сыворотка крови пациентов с ЦВБ и ИБС обладает повышенной склонностью к преципитации КФБ при создании сценария искусственного минерального стресса путем ее перенасыщения солевыми растворами кальция (CaCl2) и фосфора (Na2HPO4) в концентрации 2 ммоль/л на фоне сниженной концентрации общего белка и альбумина [12]. Было предположено, что у таких больных истощаются как наиболее мощное первичное депо ионов кальция — альбумин, так и вторичное депо — способность организма формировать КФБ, что в совокупности приводит к избыточности ионизированного кальция, являющегося химическим субстратом для преципитации КФБ при искусственном перенасыщении сыворотки фосфат-анионами.
Прямая проточно-цитометрическая детекция КФБ в сыворотке крови при помощи сочетания флюоресцентных красителей OsteoSense 680EX и PKH67 действительно выявила снижение исходной концентрации КФБ в крови пациентов с ЦВБ (ХИГМ и ИИ), ИБС (ХКС и ИМ) и ХБП5 в сравнении с условно здоровыми донорами крови. На основании этих экспериментов был сделан вывод о том, что сыворотка условно здоровых доноров крови обладает сохранной способностью к компенсации нарушений минерального гомеостаза путем агрегации избыточного кальция и фосфора с белками. Соответственно, сниженное формирование КФБ у пациентов с ССЗ и ХБП5 свидетельствует о нарушенной способности крови агрегировать избыточный кальций и фосфор (вероятно, вследствие сниженного уровня общего белка и альбумина), что также отражается повышенным уровнем ионизированного кальция в крови. Помимо нашей группы, другому научному коллективу также удалось успешно детектировать КФБ в сыворотке крови пациентов с ХБП5 [9]. В этом исследовании было выявлено, что количество КФБ в группе условно здоровых доноров крови составило от 350 до 1400 (медианное значение 1050) КФБ/ мкл, а у пациентов, находящихся на гемодиализе — от 300 до 9000 (медианное значение 1020) КФБ/мкл, а у пациентов, находящихся на перитонеальном диализе — от 400 до 30000 (медианное значение 1090) КФБ/мкл, соответственно [9]. Иные результаты также были получены в другом исследовании этой научной группы, где исходная концентрация КФБ у пациентов с ХБП5 в зависимости от приема кальцимиметика цинакальцета и трансплантации почки варьировала от 16200 КФБ/мкл (после трансплантации) до 32600 (в случае прекращения приема цинакальцета) [10]. Еще одно исследование с подобной методологией у пациентов с ХБП5 выявило исходную концентрацию КФБ в 720-900 частиц/мкл [11]. Существенные различия в показателях можно объяснить тем, что скорость потока для сбора событий (flow rate) в приведенных исследованиях [9-11] была в 5 раз выше (50 мкл/мин), чем в нашем исследовании (10 мкл/мин), что приводит к увеличению количества ложноположительных событий ("засвеченных частиц").
С клинической точки зрения представляет интерес возможность фармакологического воздействия на КФБ с целью их дезинтеграции до момента поглощения эндотелиальными клетками с параллельным выведением избыточных ионов кальция и фосфора из кровотока. Исследование EVOLVE показало, что назначение пациентам с ХБП кальцимиметика цинакальцета приводило к снижению вероятности сердечно-сосудистой смерти и острой сердечной недостаточности [15]. Перспективными подходами для проведения доклинических испытаний способов коррекции нарушений минерального гомеостаза представляются: 1) коррекция концентрации альбумина с "низкой нормальной" до "высокой нормальной"; 2) сапплементация донорами ионов магния, конкурирующими с ионами кальция за связывание с фосфат-анионом; 3) использование соединений с хелатирующим действием, которые позволяют дезинтегрировать уже сформированные КФБ и одновременно вывести высвобождающийся из них кальций и фосфор из кровотока.
Заключение
Проведенное исследование выявило высокую распространенность нарушений кальциевого гомеостаза у пациентов с ССЗ в сравнении с условно здоровым населением. Характерными особенностями таких нарушений у пациентов с ЦВБ и ИБС являются повышение молярной концентрации ионизированного кальция на фоне истощения кальций-связывающих депо (первичного — альбумина и вторичного — КФБ) и нормальном состоянии фосфорного звена минерального гомеостаза.
Отношения и деятельность: все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье.
Список литературы
1. Kobylecki CJ, Nordestgaard BG, Afzal S. Plasma Ionized Calcium and Risk of Cardiovascular Disease: 106 774 Individuals from the Copenhagen General Population Study. Clin Chem. 2021;67(1):265-75. doi:10.1093/clinchem/hvaa245.
2. Ginsberg C, Houben AJHM, Malhotra R, et al. Serum Phosphate and Microvascular Function in a Population-Based Cohort. Clin J Am Soc Nephrol. 2019;14(11):1626-33. doi:10.2215/CJN.02610319.
3. Campos-Obando N, Lahousse L, Brusselle G, et al. Serum phosphate levels are related to all-cause, cardiovascular and COPD mortality in men. Eur J Epidemiol. 2018;33(9):85971. doi:10.1007/s10654-018-0407-7.
4. Back M, Aranyi T, Cancela ML, et al. Endogenous Calcification Inhibitors in the Prevention of Vascular Calcification: A Consensus Statement From the COST Action EuroSoftCalcNet. Front Cardiovasc Med. 2019;5:196. doi:10.3389/fcvm.2018.00196.
5. Uedono H, Mori K, Ochi A, et al. Effects of fetuin-A-containing calciprotein particles on posttranslational modifications of fetuin-A in HepG2 cells. Sci Rep. 2021;11(1):7486. doi:10.1038/s41598-021-86881-0.
6. Xie WM, Ran LS, Jiang J, et al. Association between fetuin-A and prognosis of CAD: A systematic review and meta-analysis. Eur J Clin Invest. 2019;49(5):e13091. doi:10.1111/eci.13091.
7. Shishkova DK, Velikanova EA, Bogdanov LA, et al. Calciprotein Particles Link Disturbed Mineral Homeostasis with Cardiovascular Disease by Causing Endothelial Dysfunction and Vascular Inflammation. Int J Mol Sci. 2021;22(22):12458. doi:10.3390/ijms222212458.
8. Shishkova D, Markova V, Sinitsky M, et al. Calciprotein Particles Cause Endo thelial Dysfunction under Flow. Int J Mol Sci. 2020;21(22):8802. doi:10.3390/ijms21228802.
9. Smith ER, Hewitson TD, Cai MMX, et al. A novel fluorescent probe-based flow cytometric assay for mineral-containing nanoparticles in serum. Sci Rep. 2017;7(1):5686. doi:10.1038/s41598-017-05474-y.
10. Ruderman I, Smith ER, Toussaint ND, et al. Longitudinal changes in bone and mineral metabolism after cessation of cinacalcet in dialysis patients with secon dary hyperparathyroidism. BMC Nephrol. 2018;19(1):113. doi:10.1186/s12882-018-0910-9.
11. Bressendorff I, Hansen D, Pasch A, et al. The effect of increasing dialysate magnesium on calciprotein particles, inflammation and bone markers: post hoc analysis from a randomized controlled clinical trial. Nephrol Dial Transplant. 2021;36(4):713-21. doi:10.1093/ndt/gfz234.
12. Кутихин А. Г., Шишкова Д. К., Хрячкова О. Н. и др. Законо мерности формирования кальций-фосфатных бионов у пациентов с каротидным и коронарным атеросклерозом. Российский кардиологический журнал. 2020;25(12):3881. doi:10.15829/1560-4071-2020-3881.
13. Bojic M, Koller L, Cejka D, et al. Propensity for Calcification in Serum Associates With 2-Year Cardiovascular Mortality in Ischemic Heart Failure With Reduced Ejection Frac tion. Front Med (Lausanne). 2021;8:672348. doi:10.3389/fmed.2021.672348.
14. Bundy JD, Cai X, Scialla JJ, et al. Serum Calcification Propensity and Coronary Artery Calcification Among Patients With CKD: The CRIC (Chronic Renal Insufficiency Cohort) Study. Am J Kidney Dis. 2019;73(6):806-14. doi:10.1053/j.ajkd.2019.01.024.
15. Moe SM, Chertow GM, Parfrey PS, et al. Cinacalcet, Fibroblast Growth Factor-23, and Cardiovascular Disease in Hemodialysis: The Evaluation of Cinacalcet HCl Therapy to Lower Cardiovascular Events (EVOLVE) Trial. Circulation. 2015;132(1):27-39. doi:10.1161/CIRCULATIONAHA.114.013876.
Об авторах
Д. К. ШишковаРоссия
Дарья Кирилловна Шишкова — кандидат биологических наук, научный сотрудник лаборатории молекулярной, трансляционной и цифровой медицины.
Кемерово
Конфликт интересов:
нет
В. Г. Матвеева
Россия
Вера Геннадьевна Матвеева — кандидат медицинских наук, старший научный сотрудник лаборатории клеточных технологий отдела экспериментальной медицины.
Кемерово
Конфликт интересов:
нет
В. Е. Маркова
Россия
Виктория Евгеньевна Маркова — младший научный сотрудник лаборатории молекулярной, трансляционной и цифровой медицины.
Кемерово
Конфликт интересов:
нет
О. Н. Хрячкова
Россия
Оксана Николаевна Хрячкова — кандидат биологических наук, младший научный сотрудник лаборатории геномной медицины отдела экспериментальной медицины.
Кемерово
Конфликт интересов:
нет
Е. В. Индукаева
Россия
Елена Владимировна Индукаева — кандидат медицинских наук, старший научный сотрудник лаборатории эпидемиологии сердечно-сосудистых заболеваний отдела оптимизации медицинской помощи при сердечно-сосудистых заболеваниях.
Кемерово
Конфликт интересов:
нет
А. Р. Шабаев
Россия
Амин Рашитович Шабаев — младший научный сотрудник лаборатории клеточных технологий отдела экспериментальной медицины.
Кемерово
Конфликт интересов:
нет
А. В. Фролов
Россия
Алексей Витальевич Фролов — кандидат медицинских наук, младший научный сотрудник лаборатории рентгенэндоваскулярной и реконструктивной хирургии сердца и сосудов отдела хирургии сердца и сосудов.
Кемерово
Конфликт интересов:
нет
А. Г. Кутихин
Россия
Антон Геннадьевич Кутихин — кандидат медицинских наук, заведующий лабораторией молекулярной, трансляционной и цифровой медицины.
Кемерово
Конфликт интересов:
нет
Дополнительные файлы
Рецензия
Для цитирования:
Шишкова Д.К., Матвеева В.Г., Маркова В.Е., Хрячкова О.Н., Индукаева Е.В., Шабаев А.Р., Фролов А.В., Кутихин А.Г. Количественная оценка исходной концентрации кальций-фосфатных бионов как скринингового маркера минерального гомеостаза крови у пациентов с сердечно-сосудистыми заболеваниями и у пациентов с хронической болезнью почек. Российский кардиологический журнал. 2022;27(12):5064. https://doi.org/10.15829/1560-4071-2022-5064
For citation:
Shishkova D.K., Matveeva V.G., Markova V.E., Khryachkova O.N., Indukaeva E.V., Shabaev А.R., Frolov A.V., Kutikhin A.G. Quantification of the initial levels of calciprotein particles as a screening marker of mineral homeostasis in patients with cardiovascular disease and in patients with chronic kidney disease. Russian Journal of Cardiology. 2022;27(12):5064. (In Russ.) https://doi.org/10.15829/1560-4071-2022-5064
JATS XML

















































