Перейти к:
Частота семейной гиперхолестеринемии и гиперлипопротеидемии(а) у пациентов с ранней манифестацией острого коронарного синдрома
https://doi.org/10.15829/1560-4071-2022-5041
Аннотация
Цель. Оценить частоту семейной гиперхолестеринемии (СГХС) и гиперлипопротеидемии(а) (гиперЛп(а)) у больных с ранней манифестацией острого коронарного синдрома (ОКС).
Материал и методы. В исследование включено 120 пациентов с развитием ОКС до 60 лет (средний возраст 53±7 лет, 104 (87%) мужчины) и 44 человека из группы сравнения без атеросклеротических сердечно-сосудистых заболеваний и дислипидемии (средний возраст 48±11 лет, 19 (43%) мужчин). Всем больным с ОКС выполнена коронарная ангиография. Показатели липидного профиля и липопротеид(а) (Лп(а)) определяли у всех пациентов.
Результаты. Частота гиперЛп(а) у пациентов с преждевременной манифестацией ОКС составила 41% (n=49), потенциальной СГХС — 25% (n=30), сочетания СГХС и гиперЛп(а) — 13% (n=15). В группе сравнения повышенная концентрация Лп(а) выявлена у 14% (n=6). Согласно анализу кривых операционных характеристик, уровень Лп(а) ≥30 мг/дл обладал максимальной значимостью для оценки вероятности наличия ОКС с чувствительностью 40% и специфичностью 86% (площадь под кривой 0,6; 95% доверительный интервал (ДИ): 0,5-0,7, p<0,05), а уровень Лп(а) ≥15 мг/дл ассоциировался с поражением двух и более коронарных артерий с чувствительностью 67% и специфичностью 65% (площадь под кривой 0,7; 95% ДИ: 0,6-0,7, p<0,01). При логистическом регрессионном анализе возраст (отношение шансов (ОШ) 1,1; 95% ДИ: 1,0-1,2, <0,05), курение (ОШ 7,5; 95% ДИ: 2,5-22,0, р<0,001) и уровень Лп(а) ≥30 мг/дл (ОШ 6,7; 95% ДИ: 1,1-39,7, р<0,05) независимо связаны с ранним развитием ОКС. Только уровень Лп(а) ≥15 мг/дл ассоциировался с многососудистым поражением коронарных артерий у этих пациентов (ОШ 3,8; 95% ДИ: 1,52-9,74, р<0,01).
Заключение. Каждый четвертый пациент с ранней манифестацией ОКС имеет СГХС, почти каждый второй — гиперЛп(а), и каждый восьмой — сочетание СГХС и гиперЛп(а). ГиперЛп(а) ассоциирована с развитием ОКС до 60 лет и с наличием у этих больных многососудистого поражения коронарных артерий.
Для цитирования:
Чубыкина У.В., Ежов М.В., Афанасьева О.И., Клесарева Е.А., Тмоян Н.А., Покровский С.Н. Частота семейной гиперхолестеринемии и гиперлипопротеидемии(а) у пациентов с ранней манифестацией острого коронарного синдрома. Российский кардиологический журнал. 2022;27(6):5041. https://doi.org/10.15829/1560-4071-2022-5041
For citation:
Chubykina U.V., Ezhov M.V., Afanas’eva O.I., Klesareva E.A., Tmoyan N.A., Pokrovsky S.N. Prevalence of familial hypercholesterolemia and hyperlipoproteinemia(a) in patients with premature acute coronary syndrome. Russian Journal of Cardiology. 2022;27(6):5041. (In Russ.) https://doi.org/10.15829/1560-4071-2022-5041
Российская Федерация (РФ) относится к странам с высокими показателями сердечно-сосудистой заболеваемости (ССЗ) и смертности, что во многом обусловлено недооценкой значимости наследственных нарушений липидного обмена, таких как семейная гиперхолестеринемия (СГХС) и гиперлипопротеидемия(а) (гиперЛп(а)). СГХС и повышенный уровень липопротеида(а) (Лп(а)) являются генетически детерминированными нарушениями липидного обмена, которые связаны с повышенным риском развития ишемической болезни сердца (ИБС) [1]. Около 1,4 млрд человек во всем мире имеют уровень Лп(а) >50 мг/дл [2], ~30 млн лиц — СГХС [3] и не <10 млн — сочетание СГХС и гиперЛп(а). Учитывая анализ исследования ЭССЕРФ (Эпидемиология сердечно-сосудистых заболеваний и их факторов риска в регионах Российской Федерации), определяющего распространенность СГХС в 13 регионах РФ как 1:173 (95% доверительный интервал (ДИ): 1:208-1:145), можно предполагать, что число пациентов с СГХС в нашей стране может превышать 840 тыс. человек [4]. По данным консорциума BiomarCaRe, медиана Лп(а) в европейских исследованиях (7 когорт из 5 стран) составила 8,7 [ 3,9;19,1] мг/дл, средний уровень 15,8±18 мг/дл [5]. Субанализ исследования ЭССЕ-РФ показал, что в России медиана распределения выше и достигает 11,1 [ 4,8;26,8], средний уровень 22,4 мг/дл [6].
В соответствии с рекомендациями Европейского общества кардиологов, настороженность в отношении СГХС должен вызвать пациент с ранним развитием ИБС (моложе 55 лет для мужчин и 60 лет для женщин), при выявлении внешних проявлений в виде ксантом, высокого уровня холестерина липопротеидов низкой плотности (ХС ЛНП) (>5 ммоль/л у взрослых) и имеющий родственников с ранним развитием ССЗ [7]. Предполагаемый риск преждевременного ССЗ у пациентов с СГХС в 20 раз выше, чем в популяции, а развитие в течение жизни сердечно-сосудистых осложнений (ССО) в 4 раза более вероятно, чем у пациентов с аналогичными факторами риска (ФР), но без СГХС [8]. При ранней диагностике и лечении СГХС риск ССО снижается на 80% [9]. Несмотря на накопленные знания и достижения в диагностике и лечении, данные об истинной распространенности СГХС отсутствуют в 90% стран мира [3].
Повышенный уровень Лп(а) является независимым ФР ССЗ [1]. Лп(а) участвует в процессах атерогенеза, тромбоза и воспаления. Метаанализ 36 проспективных исследований (n=126634) выявил повышение риска развития нефатального инфаркта миокарда (ИМ) на 15-25% у лиц с повышенной кон - центрацией Лп(а) [10]. Наличие гиперЛп(а) в крови в сочетании с клиническим диагнозом СГХС ассоциируется с увеличением риска ИМ более чем в 5 раз [11]. В 2019г Европейское общество кардиологов представило рекомендации по диагностике и лечению дислипидемий, где приравнивает людей с уровнем Лп(а) >180 мг/дл к пациентам с гетерозиготной СГХС по риску развития атеросклеротических ССЗ [7]. Кроме того, рекомендовано измерение Лп(а) по меньшей мере 1 раз в жизни у каждого человека с целью выявления пациентов с очень высоким уровнем Лп(а) [7].
Таргетный (прицельный) скрининг направлен на поиск наследственных дислипидемий у взрослых с преждевременным развитием ССЗ. Исследования по оценке частоты СГХС и гиперЛп(а) у больных с развитием острого коронарного синдрома (ОКС) до 60 лет являются актуальными и направлены на решение задач по глобальному воздействию на ФР атеросклероза в России.
Материал и методы
В исследование включены 120 больных в возрасте от 18 до 60 лет, проходивших стационарное лечение в отделении интенсивной терапии “НМИЦ кардиологии им. акад. Е.И. Чазова” в период с 2017 по 2019гг, и 44 человека без атеросклеротических ССЗ и нарушений липидного обмена (группа сравнения). Критериями исключения являлись гипотиреоз с увеличением уровня тиреотропного гормона выше 2 верхних границ нормы, декомпенсированный сахарный диабет, печеночная недостаточность 2-4 стадии, снижение скорости клубочковой фильтрации <30 мл/мин/1,73 м2, хроническая сердечная недостаточность III-IV функционального класса.
У всех пациентов выполнены сбор анамнеза и объективное обследование с целью выявления классических ФР атеросклероза, ксантом, инструментальное обследование, включая коронарную ангиографию. Стенозирующим атеросклерозом являлось сужение просвета коронарных артерий (КА) ≥50% по диаметру в поперечном сечении сосуда.
Постановка диагноза нестабильной стенокардии и ИМ с и без подъемов сегментов ST проводилась в соответствии с текущими российскими клиническими рекомендациями по ведению пациентов с ОКС.
Для выявления пациентов с определенным и вероятным диагнозом СГХС были применены критерии голландских липидных клиник, описанные в последних Европейских рекомендациях по дислипидемии [7]. При постановке диагноза учитывались отягощенная наследственность по раннему развитию ССЗ и СГХС у близких родственников, персональная история заболевания (наличие и время возникновения атеросклеротических ССЗ), данные о наличиисухожильных ксантом и липоидной дуги роговицы, максимальный уровень ХС ЛНП. Пациенты, имеющие ≥9 баллов, соответствовали определенному диагнозу СГХС, от 6 до 8 баллов — вероятному диагнозу СГХС, от 3 до 5 баллов — возможному диагнозу СГХС.
Взятие образца венозной крови для проведения биохимического анализа выполняли при поступлении. Проводился общий клинический анализ крови, а также определение концентрации общего холестерина (ОХС), триглицеридов (ТГ), холестерина липопротеидов высокой плотности (ХС ЛВП) с использованием наборов (“Biocon”, Германия). Концентрация ХС ЛНП рассчитывалась по формуле Фридвальда: ХС ЛНП = ОХС — ХС ЛВП — ТГ / 2,2 (ммоль/л). Концентрацию Лп(а) измеряли методом иммуноферментного анализа с использованием моноспецифических поликлональных антител барана vs Лп(а) человека, валидированного относительно коммерческих наборов [12]. Концентрацию Лп(а) ≥30 мг/дл расценивали как гиперЛп(а). Уровень корригированного ХС ЛНП (ХС ЛНПкорр. Лп(а)), учитывающего холестерин, входящий в состав Лп(а), рассчитывали по модифицированной формуле Фридвальда [13]: ХС ЛНПкорр. Лп(а) (ммоль/л) = ХС ЛНП — 0,3 × Лп(а)(мг/дл) / 38,7.
Статистический анализ был выполнен с помощью пакета “MedCalc” (Бельгия). Описательная статистика непрерывных количественных переменных после анализа нормальности распределения представлена в виде среднего значения и стандартного отклонения при нормальном распределении данных или медианы [ 25%;75%]. Для определения нормальности распределения применяли тест Колмогорова-Смирнова. Аналитическую статистику выполняли с использованием t-критерия Стьюдента для количественных данных с нормальным распределением или теста Манна-Уитни/ Краскела-Уоллиса для количественных данных с распределением, отличным от нормального. Для сравнения частотных показателей между группами использовали точный критерий Фишера. Для анализа взаимосвязи исследуемых параметров использовали метод Спирмена. Пороговые значения различных биохимических маркеров рассчитывали методом анализа кривых операционных характеристик (ROC-анализ). При многофакторном анализе использовали метод логистической регрессии, в модель вводили ФР, продемонстрировавшие связь в однофакторном анализе. Пороговые значения Лп(а), определение их чувствительности и специфичности получены при построении кривых операционных характеристик. Различия считали статистически значимыми при p<0,05.
Результаты
В таблице 1 представлена сравнительная характеристика больных с ОКС до 60 лет и группы сравнения.
Таблица 1
Сравнительная характеристика пациентов с ранним развитием ОКС и группы сравнения

Примечание: данные представлены как M±SD, где М — среднее, SD — стандартное отклонение, и n (%), или медианы (интерквартильный интервал).
Сокращения: ОКС — острый коронарный синдром, ХС ЛВП — холестерин липопротеидов высокой плотности, ХС ЛНП — холестерин липопротеидов низкой плотности, ХС ЛНПкорр. Лп(а) — холестерин липопротеидов низкой плотности, корригированный по холестерину, входящему в липопротеид(а).
В группе ОКС было больше мужчин, и возраст был выше, чем в группе сравнения, чаще было курение, но реже ожирение. У больных с ОКС концентрации ОХС, ТГ, ХС ЛНП, Лп(а) и ХС ЛНПкорр. Лп(а) были выше, но ниже уровень ХС ЛВП. У пациентов с ранним развитием ОКС высокая гиперЛп(а) была в 2 раза чаще.
Среди 120 госпитализированных с ОКС в отделение интенсивной терапии больных, ранее перенесли ИМ 46 (38%) больных, 105 (88%) пациентам проведено эндоваскулярное лечение КА при поступлении, у 26 (22%) коронарное вмешательство была проведено ранее 2 и более раз. Диагноз нестабильной стенокардии установлен у 45 (37%) пациентов, у 33 (28%) больных диагностирован ИМ без подъёма сегмента ST, и 42 (35%) — ИМ с подъёмом сегмента ST.
При применении критериев голландских липидных клиник 30 (25%) пациентов соответствовали диагнозу потенциальной СГХС: возможная — 9%, вероятная — 14%, определенная — 2% (рис. 1).

Рис. 1. Распределение больных с развитием ОКС в зависимости от критериев СГХС (n=120).
При сравнении клинико-анамнестических характеристик пациентов с ОКС в зависимости от наличия СГХС пациенты не различались по полу, возрасту, классическим ФР атеросклероза (гипертония, сахарный диабет, курение, ожирение) и клиническому течению ОКС. Больные с СГХС чаще знали о наличии у них заболевания, имели отягощенный семейный анамнез по ССЗ и принимали статины (р<0,001 для всех). Уровни ОХС, ХС ЛНП были значимо выше у пациентов с СГХС (р<0,0001 для всех).
Среди пациентов без СГХС и ранее перенесенным ИМ 37 (79%) человек принимали статины, к моменту госпитализации уровень ХС ЛНП <1,4 ммоль/л был у 4 (10%) пациентов. Среди пациентов с СГХС и ранее перенесенным ИМ — 8 (67%) принимали статины, целевого уровня ХС ЛНП не достиг ни один больной.
В таблице 2 представлена характеристика больных в зависимости от наличия СГХС и гиперЛп(а) с ОКС, и 44 пациентов из группы сравнения в зависимости от уровня Лп(а).
Таблица 2
Характеристика больных в зависимости от наличия СГХС и гиперЛп(а)

Сокращения: СГХС — семейная гиперхолестеринемия, Лп(а) — липопротеид(а), ОКС — острый коронарный синдром.
Каждый четвертый больной с ранним развитием ОКС имел СГХС, почти каждый второй гиперЛп(а) и сочетание СГХС и гиперЛп(а) каждый восьмой больной. В группе сравнения только каждый седьмой пациент имел повышенную концентрацию Лп(а) (рис. 2).
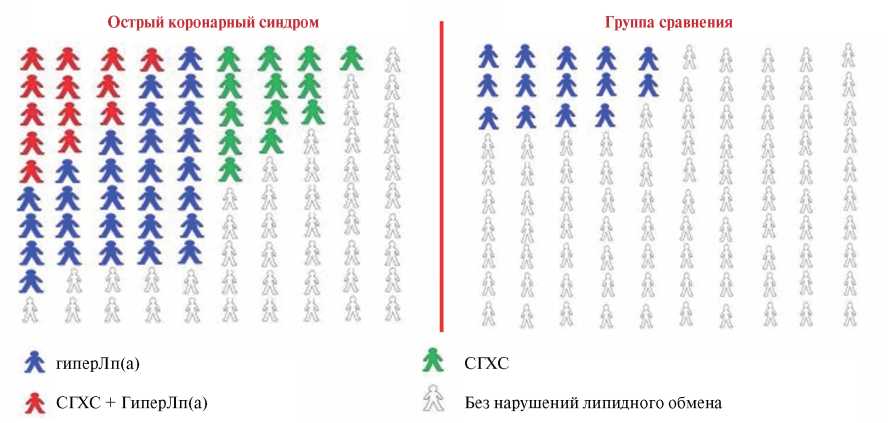
Рис. 2. Характеристика больных в зависимости от наличия СГХС и гиперЛп(а).
Сокращения: гиперЛп(а) — гиперлипопротеидемия(а), СГХС — семейная гиперхолестеринемия.
Согласно кривой операционных характеристик уровень Лп(а) ≥30 мг/дл обладал максимальной значимостью для оценки вероятности наличия ОКС с чувствительностью 40% и специфичностью 86% (рис. 3). При логистическом регрессионном анализе возраст, курение и уровень Лп(а) ≥30 мг/дл были независимо связаны с преждевременным развитием ОКС (рис. 3).

Рис. 3. А — кривая операционных характеристик концентрации Лп(а) для прогнозирования ОКС (площадь под кривой 0,6, 95% ДИ: 0,5-0,7, p<0,05). Б — факторы, ассоциированные с преждевременным развитием ОКС.
Сокращения: ДИ — доверительный интервал, Лп(а) — липопротеид(а), ОШ — отношение шансов, ХС ЛНПкорр. Лп(а) — холестерин липопротеидов низкой плотности, корригированный по холестерину, входящему в липопротеид(а).
Проведен сравнительный анализ клинических и биохимических характеристик пациентов с ОКС в зависимости от уровня Лп(а). ГиперЛп(а) выявлена у 49 (41%) пациентов, уровень Лп(а) <30 мг/дл имел 71 (59%) больной. Между группами не выявлено различий по частоте классических ФР атеросклероза, клиническом течении ОКС и виде реваскуляризации миокарда. У пациентов с уровнем Лп(а) <30 мг/дл сахарный диабет встречался чаще (23 (32%) в сравнении с 7 (14%), р<0,05). У пациентов с уровнем Лп(а) ≥30 мг/дл чаще встречалось многососудистое поражение КА (рис. 4).

Рис. 4. Связь гиперЛп(а) с тяжестью атеросклеротического поражения КА.
В таблице 3 представлена характеристика больных в зависимости от количества пораженных КА.
Таблица 3
Характеристика больных с одно- и многососудистым поражением КА (n=120)

Примечание: данные представлены как M±SD, где М — среднее, SD — стандартное отклонение, и n (%), или медианы (интерквартильный интервал).
Сокращения: ИБС — ишемическая болезнь сердца, ИМбпST — инфаркт миокарда без подъёма сегмента ST, ИМпST — инфаркт миокарда с подъёмом сегмента ST, Лп(а) — липопротеид(а), ОНМК/ТИА — острое нарушение мозгового кровообращения/транзиторная ишемическая атака, ХС ЛВП — холестерин липопротеидов высокой плотности, ХС ЛНП — холестерин липопротеидов низкой плотности, ХС ЛНПкорр. Лп(а) — холестерин липопротеидов низкой плотности, корригированный по холестерину, входящему в липопротеид(а), ЧКВ — чрескожное коронарное вмешательство.
Пациенты обеих групп были сопоставимы по полу и возрасту. Больные с многососудистым поражением КА чаще курили, имели ГХС, ранее перенесли ИМ, стентирование и шунтирование КА. У пациентов с однососудистым поражением КА уровень ОХС был выше, но они реже принимали статины.
С помощью анализа кривой операционных характеристик была проведена проверка чувствительности и специфичности уровня Лп(а) в отношении его связи с многососудистым поражением КА (рис. 5). Концентрация Лп(а) >15 мг/дл ассоциировалась с наличием поражения двух и более КА с чувствительностью 67% и специфичностью 65%. По данным логистического регрессионного анализа, лишь уровень Лп(а) >15 мг/дл ассоциировался с многососудистым поражением КА у пациентов с преждевременным ОКС (рис. 5).

Рис. 5. А — кривая операционных характеристик максимальной концентрации Лп(а) для прогнозирования многососудистого поражения КА у пациентов с преждевременным развитием ОКС (площадь под кривой 0,66; 95% ДИ: 0,6- 0,7; p<0,005). Б — факторы, ассоциированные с многососудистым поражением КА у больных с ОКС до 60 лет.
Сокращения: ДИ — доверительный интервал, Лп(а) — липопротеид(а), ОШ — отношение шансов, ХС ЛНПкорр. Лп(а) — холестерин липопротеидов низкой плотности, корригированный по холестерину, входящему в липопротеид(а).
Таким образом, у каждого четвертого больного с манифестацией ОКС до 60 лет встречается потенциальная СГХС, почти каждый второй имеет гиперЛп(а) и комбинацию этих нарушений липидного обмена каждый восьмой больной. Концентрация Лп(а) >29 мг/дл ассоциирована с преждевременным развитием ОКС, а уровень Лп(а) ≥15 мг/дл — с многососудистым поражением КА у пациентов с развитием ОКС до 60 лет.
Обсуждение
СГХС является второй наиболее распространенной моногенной причиной наследственных нарушений липидного обмена после гиперЛп(a). У пациентов с ИБС распространенность СГХС в 10 раз выше в сравнении с общей популяцией, и в 20 раз выше среди пациентов с преждевременной ИБС [3]. Высокая распространенность СГХС у пациентов с ИБС свидетельствует о целесообразности таргетного скрининга в отделениях интенсивной терапии [3]. Недавно проведен метаанализ 22 исследований [14] с целью оценки частоты вероятной и определенной СГХС у пациентов с ОКС. Вне зависимости от возраста частота вероятной/определенной СГХС среди пациентов с ОКС составила 4,7% (95% ДИ: 3,0-7,3%), у пациентов моложе 60 лет частота достигала 7,3% (95% ДИ: 5,3-10,0%) и увеличивалась до 13,7% (95% ДИ: 8,2-22,1%) у больных моложе 45 лет. Таким образом, из общего количества больных с ОКС у 1 из 21 имеется определенная/вероятная СГХС, в возрасте до 60 лет у 1 из 14 и в возрасте до 45 лет — у 1 из 7 [14]. Согласно полученным нами данным, каждый четвертый больной с ранней манифестацией ОКС имел потенциальный диагноз СГХС. По критериям голландских липидных клиник 30 (25%) пациентов соответствовали диагнозу потенциальной СГХС: возможная — 9%, вероятная — 14%, определенная — 2%. Выявленная в нашем исследовании частота определенной и вероятной СГХС (16%) у больных с ранним ОКС в 2 раза превышает данные из этого метаанализа (7,3%), что, вероятно, объяснимо большей распространенностью СГХС в РФ, чем в других популяциях [3][4].
Также в нашей работе изучалась эффективность прицельного скрининга на гиперЛп(а) у пациентов с преждевременным развитием ОКС (средний возраст 53±7 лет, 81% мужчины, 49 (41%) больных уровень Лп(а) был >30 мг/дл). В австралийское исследование [15] по оценке частоты СГХС и гиперЛп(а) было включено 316 пациентов (средний возраст 61 год, 70% мужчины), из них 163 (51,6%) больных имели преждевременное развитие ИБС. Уровень Лп(a) ≥50 мг/дл и СГХС были выявлены у 27,0% и 11,6% пациентов, соответственно, оба нарушения липидного обмена — у 4,4% больных. В нашем исследовании выявлена более высокая частота гиперЛп(а), СГХС и их сочетания, но средний возраст пациентов был моложе, чем в австралийском исследовании (53±7 vs 61±14 лет, соответственно), и за пороговое значение приняты более низкие концентрации Лп(а) (30 мг/дл vs 50 мг/дл в австралийском исследовании). Таким образом, таргетный скрининг пациентов на гиперЛп(а) и СГХС среди больных с ОКС является эффективным и позволяет выявить новых пациентов для дальнейшего проведения каскадного скрининга родственников.
В китайском исследовании, включившем 348 пациентов с ОКС (средний возраст 60±12 лет, 80% мужчины) и 531 больного со стабильной ИБС (средний возраст 61±10 лет, 75% мужчины), проанализировано влияние Лп(а) на клиническое течение ИБС и тяжесть атеросклеротического поражения КА у пациентов с ИБС [16]. Больные были разделены на группы с Лп(a) ≥30 мг/дл (n=191) и Лп(a) <30 мг/дл (n=340). Как и в нашем исследовании, в группах с Лп(a) <30 мг/дл и Лп(а) ≥30 мг/дл не выявлено различий по возрасту, полу, индексу массы тела, статусу курения, гипертонии. В модели логистического регрессионного анализа пол (отношение шансов (ОШ) 3,21, 95% ДИ: 1,41 7,31), возраст (ОШ 1,06, 95% ДИ: 1,03-1,09), уровни ХС ЛНП (ОШ 1,43, 95% ДИ: 1,02-2,01) и Лп(а) (ОШ 2,44, 95% ДИ: 1,21-4,95) были ассоциированы с ИБС. Пациенты с гиперЛп(а) имели более тяжелый атеросклероз согласно шкале Gensini, в сравнении с больными, у которых уровень Лп(а) был <30 мг/дл (52±35 vs 44±27 баллов) [16]. Нами показано, что уровень Лп(а) ≥15 мг/дл ассоциируется с многососудистым поражением КА у больных с ОКС. Таким образом, среди молодых пациентов с ОКС СГХС и гиперЛп(а) встречаются часто и связаны с тяжестью атеросклеротического поражения КА.
Заключение
В настоящее время имеется большое количество исследований, демонстрирующих связь СГХС и гиперЛп(а) с атеросклеротическими ССЗ. Однако, несмотря на глобальный призыв всех международных сообществ к выявлению пациентов с этими нарушениями липидного обмена, лишь малая доля больных идентифицирована и получает гиполипидемическую терапию.
В выполненной работе таргетный скрининг на СГХС и гиперЛп(а) продемонстрировал высокую распространенность этих нарушений липидного обмена у пациентов с преждевременной манифестацией ОКС, госпитализированных в отделения интенсивной терапии. Наличие значимой ассоциации между концентрацией Лп(а) с ИБС и многососудистым поражением КА, продемонстрированной в нашем исследовании, указывает на необходимость определения концентрации Лп(а) у всех больных. Уровень Лп(а) следует учитывать при разработке алгоритмов по ведению пациентов с ИБС, в особенности у пациентов с СГХС.
Отношения и деятельность: все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье.
Список литературы
1. Vuorio A, Watts GF, Schneider WJ, et al. Familial hypercholesterolemia and elevated lipoprotein(a): double heritable risk and new therapeutic opportunities. J Intern Med. 2020;287(1):2-18. doi:10.1111/joim.12981
2. Tsimikas S, Fazio S, Ferdinand KC, et al. NHLBI Working Group Recommendations to Reduce Lipoprotein(a)-Mediated Risk of Cardiovascular Disease and Aortic Stenosis. J Am Coll Cardiol. 2018;71(2):177-92. doi:10.1016/j.jacc.2017.11.014
3. Beheshti SO, Madsen CM, Varbo A, Nordestgaard BG. Worldwide Prevalence of Familial Hypercholesterolemia: Meta-Analyses of 11 Million Subjects. J Am Coll Cardiol. 2020;75(20):2553-66. doi:10.1016/j.jacc.2020.03.057.
4. Мешков А. Н., Ершова А. И., Шальнова С. А. и др. Кросс-секционное исследование по оценке распространенности семейной гиперхолестеринемии в отдельных регионах Российской Федерации: актуальность, дизайн исследования и исходные характеристики участников. Рациональная Фармакотерапия в Кардиологии. 2020;16(1):24-32. doi:10.20996/1819-6446-2020-02-175.
5. Waldeyer C, Makarova N, Zeller T, et al. Lipoprotein(a) and the risk of cardiovascular disease in the European population: results from the BiomarCaRE consortium. Eur Heart J. 2017;38(32):2490-8. doi:10.1093/eurheartj/ehx166.
6. Шальнова С. А., Ежов М. В., Метельская В. А. и др. Ассоциации липопротеида(а) с факторами риска атеросклероза в российской популяции (данные наблюдательного исследования ЭССЕ-РФ). Рациональная фармакотерапия в кардиологи. 2019;15(5):612-21. doi:10.20996/1819-6446-2019-15-5-612-621.
7. Mach F, Baigent C, Catapano AL, et al.; ESC Scientific Document Group. 2019 ESC/EAS Guidelines for the management of dyslipidaemias: lipid modification to reduce cardiovascular risk. Eur Heart J. 2020;41(1):111-88. doi:10.1093/eurheartj/ehz455.
8. Villa G, Wong B, Kutikova L, et al. Prediction of cardiovascular risk in patients with familial hypercholesterolaemia. Eur Heart J Qual Care Clin Outcomes. 2017;3(4):274-80. doi:10.1093/ehjqcco/qcx011.
9. Gidding SS, Champagne MA, de Ferranti SD, et al.; American Heart Association Atherosclerosis, Hypertension, and Obesity in Young Committee of Council on Cardiovascular Disease in Young, Council on Cardiovascular and Stroke Nursing, Council on Functional Genomics and Translational Biology, and Council on Lifestyle and Cardiometabolic Health. The Agenda for Familial Hypercholesterolemia: A Scientific Statement From the American Heart Association. Circulation. 2015;132(22):2167-92. doi:10.1161/CIR.0000000000000297.
10. Emerging Risk Factors Collaboration, Erqou S, Kaptoge S, Perry PL, et al. Lipoprotein(a) concentration and the risk of coronary heart disease, stroke, and nonvascular mortality. JAMA. 2009;302(4):412-23. doi:10.1001/jama.2009.1063.
11. Langsted A, Kamstrup PR, Benn M, et al. High lipoprotein(a) as a possible cause of clinical familial hypercholesterolaemia: a prospective cohort study. Lancet Diabetes Endocrinol. 2016;4(7):577-87. doi:10.1016/S2213-8587(16)30042-0.
12. Афанасьева О. И., Адамова И. Ю., Беневоленская Г. Ф., Покровский С. Н. Иммуноферментный метод определения липопротеида(а). Бюллетень экспериментальной биологии и медицины. 1995;120(10):398-401. doi:10.1007/bf02444976.
13. Dahlen GH. Incidence of Lp(a) lipoprotein among populations in “Lipoprotein(a)” ed. Scanu A. M. Academic Press. San Diego. 1990. С.151-75. ISBN-13:978-0126209907. ISBN-10: 0126209901.
14. Kramer AI, Trinder M, Brunham LR. Estimating the Prevalence of Familial Hypercholesterolemia in Acute Coronary Syndrome: A Systematic Review and Meta-analysis. Can J Cardiol. 2019;35(10):1322-31. doi:10.1016/j.cjca.2019.06.017.
15. Ellis KL, Pang J, Chieng D, et al. Elevated lipoprotein(a) and familial hypercholesterolemia in the coronary care unit: Between Scylla and Charybdis. Clin Cardiol. 2018;41(3):378-84. doi:10.1002/clc.22880.
16. Ma Y, Rao J, Long J, et al. Correlation of lipoprotein(a) with clinical stability and severity of coronary artery lesions in patients with coronary artery disease. Nan Fang Yi Ke Da Xue Xue Bao. 2019;39(2):235-40. Chinese. doi:10.12122/j.issn.1673-4254.2019.02.17.
Об авторах
У. В. ЧубыкинаРоссия
Чубыкина Ульяна Валериевна — кандидат медицинских наук, младший научный сотрудник лаборатории нарушений липидного обмена НИИ клинической кардиологии им. А.Л. Мясникова.
Москва.
Конфликт интересов:
Нет
М. В. Ежов
Россия
Ежов Марат Владиславович — доктор медицинских наук, главный научный сотрудник, руководитель лаборатории нарушений липидного обмена НИИ клинической кардиологии им. А.Л. Мясникова.
Москва.
Конфликт интересов:
Нет
О. И. Афанасьева
Россия
Афанасьева Ольга Ильинична — доктор биологических наук, ведущий научный сотрудник лаборатории проблем атеросклероза НИИ экспериментальной кардиологии им. В.Н. Смирнова.
Москва.
Конфликт интересов:
Нет
Е. А. Клесарева
Россия
Клесарева Елена A. — кандидат медицинских наук, научный сотрудник лаборатории проблем атеросклероза НИИ экспериментальной кардиологии им. В.Н. Смирнова.
Москва.
Конфликт интересов:
Нет
Н. А. Тмоян
Россия
Тмоян Нарек Арамаисович — кандидат медицинских наук, научный сотрудник, лаборатории нарушений липидного обмена НИИ клинической кардиологии им. А.Л. Мясникова.
Москва.
Конфликт интересов:
Нет
С. Н. Покровский
Россия
Покровский Сергей Николаевич — доктор биологических наук, руководитель лаборатории проблем атеросклероза НИИ экспериментальной кардиологии им. В.Н. Смирнова.
Москва.
Конфликт интересов:
Нет
Дополнительные файлы
Рецензия
Для цитирования:
Чубыкина У.В., Ежов М.В., Афанасьева О.И., Клесарева Е.А., Тмоян Н.А., Покровский С.Н. Частота семейной гиперхолестеринемии и гиперлипопротеидемии(а) у пациентов с ранней манифестацией острого коронарного синдрома. Российский кардиологический журнал. 2022;27(6):5041. https://doi.org/10.15829/1560-4071-2022-5041
For citation:
Chubykina U.V., Ezhov M.V., Afanas’eva O.I., Klesareva E.A., Tmoyan N.A., Pokrovsky S.N. Prevalence of familial hypercholesterolemia and hyperlipoproteinemia(a) in patients with premature acute coronary syndrome. Russian Journal of Cardiology. 2022;27(6):5041. (In Russ.) https://doi.org/10.15829/1560-4071-2022-5041

















































