Перейти к:
Электрокардиографические, эхокардиографические и липидные показатели в прогнозировании обструктивного поражения коронарных артерий у больных с острым коронарным синдромом без подъема сегмента ST
https://doi.org/10.15829/1560-4071-2022-5036
Аннотация
Цель. Оценить предиктивный потенциал электрокардиографических (ЭКГ), эхокардиографических (ЭхоКГ) и липидных показателей для прогнозирования обструктивного поражения коронарных артерий (ОПКА) у больных с острым коронарным синдромом без подъема сегмента ST (ОКСбпST) до проведения инвазивной коронароангиографии (КАГ).
Материал и методы. В проспективное обсервационное когортное исследование было включено 525 пациентов с ОКСбпST с медианой возраста 62 года, которым выполнялась инвазивная КАГ. Было выделено 2 группы, первую из которых составил 351 (67%) больной с ОПКА (стеноз 50%), а вторую — 174 (33%) без ОПКА (<50%). Клинико-функциональный статус больных до проведения КАГ оценивали по 40 показателям. Для обработки и анализа данных использовали методы Манна-Уитни, Фишера, хи-квадрат, однофакторную логистическую регрессию (ЛР), а для разработки прогностических моделей — многофакторную ЛР (МЛР), стохастический градиентный бустинг (XGBoost) и искусственные нейронные сети (ИНС). Качество моделей оценивали по 4 метрикам: площадь под ROC-кривой (AUC), чувствительность (Se), специфичность (Sp) и точность (Ac).
Результаты. Комплексный анализ показателей ЭКГ, ЭхоКГ и липидного спектра позволил выделить факторы, линейно и нелинейно связанные с ОПКА. Методами ЛР были определены их весовые коэффициенты и пороговые значения с наибольшим предиктивным потенциалом. Метрики качества лучшего прогностического алгоритма на основе МЛР составили по AUC — 0,81, Sp и Ac — 0,74, Se — 0,75. Предикторами данной модели были 4 показателя в категориальной форме (фракция выброса левого желудочка (ЛЖ) 42-60%, глобальная продольная систолическая деформация ЛЖ <19%, холестерин липопротеидов низкой плотности >3,5 ммоль/л, возраст >55 лет у мужчин и >65 лет — у женщин).
Заключение. Прогностическая модель, разработанная на основе МЛР, позволяет с высокой точностью верифицировать ОПКА у больных с ОКСбпST до проведения инвазивной КАГ. Модели на основе XGBoost и ИНС обладали меньшей предсказательной ценностью.
Ключевые слова
Для цитирования:
Циванюк М.М., Гельцер Б.И., Шахгельдян К.И., Емцева Е.Д., Завалин Г.С., Шекунова О.И. Электрокардиографические, эхокардиографические и липидные показатели в прогнозировании обструктивного поражения коронарных артерий у больных с острым коронарным синдромом без подъема сегмента ST. Российский кардиологический журнал. 2022;27(6):5036. https://doi.org/10.15829/1560-4071-2022-5036
For citation:
Tsivanyuk M.M., Geltser B.I., Shakhgeldyan K.I., Emtseva E.D., Zavalin G.S., Shekunova O.I. Electrocardiographic, echocardiographic and lipid parameters in predicting obstructive coronary artery disease in patients with non-ST elevation acute coronary syndrome. Russian Journal of Cardiology. 2022;27(6):5036. (In Russ.) https://doi.org/10.15829/1560-4071-2022-5036
Ишемическая болезнь сердца (ИБС) занимает одно из ведущих мест в структуре сердечно-сосудистых заболеваний в большинстве стран мира. В половине случаев ИБС дебютирует острым коронарным синдромом (ОКС), который является наиболее частой причиной экстренной госпитализации больных. ОКС может быть клиническим проявлением обострения хронической ИБС или первым признаком поражения коронарных артерий (КА) [1]. В Российской Федерации ежегодно фиксируется >500 тыс. случаев ОКС, из которых доля инфаркта миокарда (ИМ) составляет 36,4%, а нестабильной стенокардии (НС) — 63,6%. Принято выделять две формы ОКС: с подъемом сегмента ST (ОКСпST) и без подъема (ОКСбпST). В отличие от ОКСпST, морфологическим субстратом которого чаще всего является острая тромботическая окклюзия одной из эпикардиальных артерий, ОКСбпST отличается более широким спектром патофизиологических механизмов, ассоциированных с клиническими вариантами данного синдрома: ИМбпST и НС [1]. В последние годы среди лиц, направляемых на инвазивную коронароангиографию (КАГ), все чаще фиксируются случаи необструктивного поражения КА (НПКА). Так, наличие интактных КА или НПКА имеет место у 40% больных с подозрением на ИБС и у 25% — с ОКСбпST [2]. По данным ряда исследований в Российской Федерации при ежегодном увеличении числа КАГ примерно у 50% пациентов данная процедура не заканчивается реваскуляризацией миокарда, в большинстве случаев из-за отсутствия обструктивного поражения КА (ОПКА) [3]. К одной из причин ОКСбпST у лиц с НПКА относится спазм КА. Другими детерминантами этого синдрома являются микрососудистый спазм, спонтанная диссекция КА, миокардиальные мостики и кардиомиопатия такоцубо [4-8]. По данным ряда авторов, эпикардиальный и микрососудистый спазм КА у пациентов с ангинозными болями на фоне интактных КА фиксируется в 57% случаев [9]. По мнению большинства авторов, высокая распространенность НПКА среди больных с ОКС является поводом для совершенствования технологий претестовой диагностики стенотических поражений КА до проведения инвазивной КАГ, что может ограничить случаи ее необоснованного применения и сократить нерациональные расходы здравоохранения [10]. Методы машинного обучения (МО) все чаще используются в кардиологии в качестве дополнительного инструмента для диагностических и прогностических исследований [11][12]. Кроме того, их применение необходимо для разработки систем поддержки принятия врачебных решений, востребованных в повседневной клинической практике.
Цель исследования состояла в оценке предиктивного потенциала электрокардиографических (ЭКГ), эхокардиографических (ЭхоКГ) и липидных показателей для прогнозирования ОПКА у больных с ОКСбпST до проведения инвазивной КАГ.
Материал и методы
В проспективное обсервационное когортное исследование было включено 525 пациентов (329 мужчин и 196 женщин) в возрасте от 30 до 80 лет с медианой 62 года и 95% доверительным интервалом (ДИ) [ 60; 64], поступивших в 2017-2021гг в отделение неотложной кардиологии КГБУЗ “Владивостокская клиническая больница № 1” с ОКСбпST без доказанного некроза миокарда по результатам исследования высокочувствительного сердечного тропонина I (вч-сTнI) на анализаторе RADIOMETER AQT90 FLEX (Дания). Оценку риска летального исхода в стационаре выполняли с помощью шкалы GRACE. Низкий риск имел место у 163 (31%) больных, средний — у 332 (63%) и высокий — у 30 (6%). Всем пациентам была выполнена инвазивная КАГ на ангиографической системе TOSHIBA iNFX-8000V (Япония). Среди обследованной когорты было выделено 2 группы лиц. В 1-ю из них вошли 351 (67%) больных, имеющих по результатам КАГ гемодинамически значимое сужение КА (≥50%), во 2-ю — 174 (33%) пациента с НПКА (<50%). Исследование было выполнено в соответствии со стандартами надлежащей клинической практики (Good Clinical Practice) и принципами Хельсинкской декларации. Протокол исследования был одобрен локальным этическим комитетом школы медицины Дальневосточного федерального университета. От всех участников было получено письменное информированное согласие.
Забор венозной крови у пациентов осуществлялся при поступлении в стационар с последующим исследованием на биохимическом анализаторе Mindray BS-800M (Китай). Определяли уровни общего холестерина (ОХС), холестерина липопротеидов высокой (ХС ЛВП) и низкой (ХС ЛНП) плотности, триглицеридов (ТГ). Индекс инсулинорезистентности (ИИР) определяли по соотношению ТГ/ХС ЛВП, а индекс массы тела — по формуле Кетле.
ЭхоКГ-исследование проводили на аппарате GE Vivid S60 (США) по общепринятой методике. Определяли толщину межжелудочковой перегородки, индекс относительной толщины (ИОТ) задней стенки левого желудочка (ЛЖ) (ЗСЛЖ), индекс массы миокарда ЛЖ (ИММЛЖ). Выделяли группы с нормальной геометрией сердца (ИММЛЖ ≤115 г/м2 и ИОТ <0,42), концентрическим ремоделированием (ИММЛЖ ≤115 г/м2, ИОТ >0,42), концентрической гипертрофией (ИММЛЖ >115 г/м2, ИОТ >0,42) и эксцентрической гипертрофией (ИММЛЖ >115 г/м2 и ИОТ <0,42). Регистрировали конечный диастолический (КДО) и конечный систолический объемы (КСО) ЛЖ, объем левого предсердия и их индексированные значения (индекс КДО (КДИ), индекс КСО (КСИ), индексированный объем левого предсердия (ИЛП)). Рассчитывали ударный объем, фракцию выброса (ФВ), индекс глобальной функции (ИГФ) ЛЖ [13]. Для определения глобальной продольной систолической деформации (ГПСД) ЛЖ использовали данные апикальной 4-камерной позиции тканевых допплеровских изображений миокарда с помощью программного обеспечения аппарата Vivid S60.
По результатам ЭКГ-исследования оценивали продолжительность интервалов PQ, QT, QRS, амплитуду зубцов R в стандартных отведениях, наличие депрессии сегмента ST ≥0,1 мВ в 2 и более смежных отведениях, его элевацию ≥0,1 мВ в отведении aVR, инверсию зубца Т в грудных отведениях, наличие двухфазного зубца Т с начальной положительной фазой в V1-V6. Рассчитывали индексы Соколова-Лайона, Левиса, корнельское произведение. Конечная точка исследования была представлена ОПКА в форме бинарного признака (“отсутствие” или “наличие”). Входные признаки — подгруппа потенциальных предикторов выражалась в форме непрерывных и категориальных переменных. Для обработки и анализа данных использовали методы математической статистики и МО. Первые из них были представлены тестами Фишера, Манна-Уитни, Хи-квадрат (χ2) и однофакторной логистической регрессией (ЛР) с расчетом весовых коэффициентов по нормализованной выборке. Вторые — методами МО: многофакторной ЛР (МЛР), стохастическим градиентным бустингом (XGBoost) и искусственными нейронными сетями (ИНС). Статистическая значимость признаков и проверка гипотез подтверждалась значением p-value <0,05. Качество моделей оценивали по 4 метрикам: площадь под ROC-кривой (AUC), точность (Ac), чувствительность (Se) и специфичность (Sp).
Дизайн исследования включал 4 этапа. На первом из них для выделения потенциальных предикторов, линейно связанных с ОПКА, в группах сравнения был проведен анализ 40 факторов. Для непрерывных
переменных использовали тест Манна-Уитни, а для категориальных — χ2. Отношение шансов (ОШ) и их 95% ДИ рассчитывали тестом Фишера. На втором этапе с помощью однофакторных ЛР-моделей определяли весовые коэффициенты отдельных показателей. На третьем этапе на основе ЛР выделяли пороговые значения факторов, обладающие наибольшим предиктивным потенциалом. Определение прогностически значимых диапазонов осуществляли с шагом тестирования 0,05-0,1 усл. ед. для различных показателей. Критериям отбора соответствовали границы значений факторов, p-value которых имели минимальную, а весовые коэффициенты однофакторных моделей ЛР — максимальную величину. На четвертом этапе с использованием МЛР, XGBoost и ИНС были разработаны прогностические модели ОПКА. Архитектура моделей на основе ИНС включала 3 скрытых слоя с 7-10 нейронами в каждом. Для их построения использовали библиотеки Keras и Tensorflow. Модели были разработаны на обучающей выборке (9/10) пациентов и верифицированы на тестовой (1/10). Анализ данных и разработку моделей выполняли на языках R в среде R-studio и Python. Работа выполнена при частичной поддержке грантов РФФИ в рамках научных проектов № 19-29-01077 и № 20-37-90081.
Результаты
Межгрупповой анализ 40 факторов, характеризующих клинико-функциональный статус больных, показал наличие статистически значимых различий по 16 из них (табл. 1). При этом максимальный уровень достоверности фиксировался у показателей половой принадлежности (мужской пол) и ХС ЛВП (p<0,0001). Наибольшие значения ОШ были связаны с мужским полом (ОШ =2,5). Менее заметная, но статически значимая вероятность ОПКА ассоциировалась с элевацией STaVR (ОШ =1,7; p=0,014). По данным предварительного анализа возраст, индекс массы тела, наличие депрессии сегмента ST, отрицательного или двухфазного зубца T, продолжительность QRS, QT и PQ, амплитуда зубца R в I стандартном отведении, ЭКГ-признаки гипертрофии миокарда ЛЖ, толщина межжелудочковой перегородки и ЗСЛЖ, ИОТ ЗСЛЖ, типы ремоделирования миокарда, ИЛП не имели линейных взаимосвязей с ОПКА и не влияли на вероятность его развития.
Таблица 1
Клинико-функциональная характеристика больных с ОКСбпST (Me, 95% ДИ)

Примечание: ОШ рассчитывалось только для категориальных признаков.
Сокращения: ГПСД — глобальная продольная систолическая деформация, ДИ — доверительный интервал, ЗСЛЖ — задняя стенка левого желудочка, ИГФ — индекс глобальной функции, ИИР — индекс инсулинорезистентности, ИЛП — индексированный объем левого предсердия, ИММЛЖ — индекс массы миокарда левого желудочка, ИМТ — индекс массы тела, ИОТ — индекс относительной толщины, КГ — концентрическая гипертрофия, КДИ — индекс конечного диастолического объема, КДО — конечный диастолический объем, КДР — конечный диастолический размер, КР — концентрическое ремоделирование, КСИ — индекс конечного систолического объема, КСО — конечный систолический объем, ЛЖ — левый желудочек, МЖП — межжелудочковая перегородка, НГ — нормальная геометрия, НПКА — необструктивное поражение коронарных артерий, ОПКА — обструктивное поражение коронарных артерий, ОТС — относительная толщина стенок, ОХС — общий холестерин, ОШ — отношение шансов, ТГ — триглицериды, УО — ударный объем, ФВ — фракция выброса, ХС ЛВП — холестерин липопротеидов высокой плотности, ХС ЛНП — холестерин липопротеидов низкой плотности, ЭГ — эксцентрическая гипертрофия.
На втором этапе исследования были разработаны однофакторные модели ЛР с расчетом весовых коэффициентов, позволяющих оценить степень влияния ранее отобранных показателей на результирующую переменную. В процессе анализа было установлено, что статистически значимый уровень весовых коэффициентов имел место у 14 факторов (табл. 2). Их наибольшие значения ассоциировались с уровнем ХС ЛВП (-3,9; p=0,0007), КСО (3,8; p=0,004) и КСИ (3,34; p=0,005). Меньшими по величине, но сопоставимыми по уровню значимости были показатели ИГФ (-2,59), КДО (2,32), КДИ (2,24), ГПСД ЛЖ (2,17), ХС ЛНП (2,1), ОХС (1,9), КДР (1,71), ИММЛЖ (1,7), ИИР (1,6), ФВ ЛЖ (-1,45), мужской пол (0,9). При этом весовые коэффициенты таких факторов, как ТГ и элевация STaVR, были статистически недостоверными. В разработанных однофакторных моделях большинство весовых коэффициентов имели положительное значение, что указывало на увеличение вероятности ОПКА при наличии этих признаков или повышении их уровня. Напротив, отрицательные значения весовых коэффициентов ХС ЛВП и ФВ ЛЖ свидетельствуют о возрастании риска ОПКА при снижении уровня данных показателей.
Таблица 2
Весовые коэффициенты однофакторных ЛР-моделей для оценки вероятности ОПКА
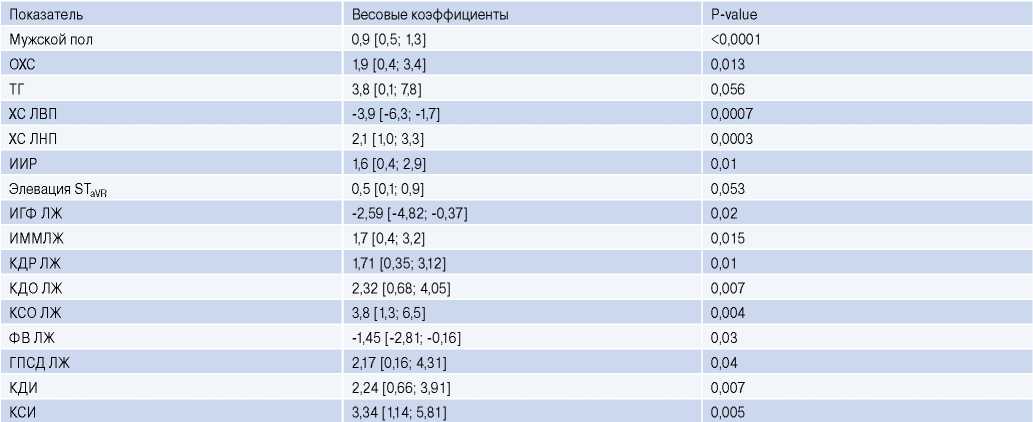
Сокращения: ГПСД — глобальная продольная систолическая деформация, ИГФ — индекс глобальной функции, ИИР — индекс инсулинорезистентности, ИММЛЖ — индекс массы миокарда левого желудочка, КДИ — индекс конечного диастолического объема, КДО — конечный диастолический объем, КДР — конечный диастолический размер, КСИ — индекс конечного систолического объема, КСО — конечный систолический объем, ЛЖ — левый желудочек, ОХС — общий холестерин, ТГ — триглицериды, ФВ — фракция выброса, ХС ЛВП — холестерин липопротеидов высокой плотности, ХС ЛНП — холестерин липопротеидов низкой плотности.
На третьем этапе исследования с помощью однофакторной ЛР среди анализируемых показателей выделяли пороговые значения, отклонение от которых приводило к повышению их предиктивного потенциала (табл. 3). Для реализации этой задачи показатели в непрерывной форме были преобразованы в категориальную. Результаты анализа позволили выделить возрастные диапазоны у мужчин (≥55 лет) и у женщин (≥65 лет), принадлежность к которым повышала вероятность ОПКА (ОШ =1,7, p=0,01). У мужчин с КСО ЛЖ ≥58 мл и у женщин — ≥51 мл вероятность обнаружения стенозирующего поражения КА возрастала более чем в 2 раза (p=0,008). Увеличение КДР ЛЖ ≥54 мм также повышало вероятность ОПКА вне зависимости от гендерной принадлежности обследуемых (ОШ =2,1, p=0,007). При КДИ ≥76 мл/м2 риск ОПКА возрастал в 2,5 раза (p=0,007), а при КСИ ≥31,2 мл/м2 — в 2,6 раза (p=0,01). Сопоставимые шансы наличия ОПКА ассоциировались с нарушением липидного обмена, проявляющимся снижением уровня ХС ЛВП ≤1,1 ммоль/л (ОШ =2,4, p=0,0002) и увеличением концентрации ХС ЛНП >3,5 ммоль/л (ОШ =2,1, p=0,0004), ОХС ≥5,9 ммоль/л (ОШ =2,0, p=0,001), ТГ ≥1,6 ммоль/л (ОШ =1,75, p=0,006). Аналогичные значения ОШ соотносились с ИИР ≥1,5 усл. ед. (ОШ =1,75, p=0,009). Риск ОПКА повышался при снижении ГПСД ЛЖ ≤19% (ОШ =2,3, p=0,027) и увеличении ИММЛЖ ≥115 г/м2 у мужчин и ≥105 г/м2 — у женщин (ОШ =1,7, p=0,009).
Таблица 3
Диапазон пороговых значений потенциальных предикторов ОПКА на основе однофакторных ЛР-моделей
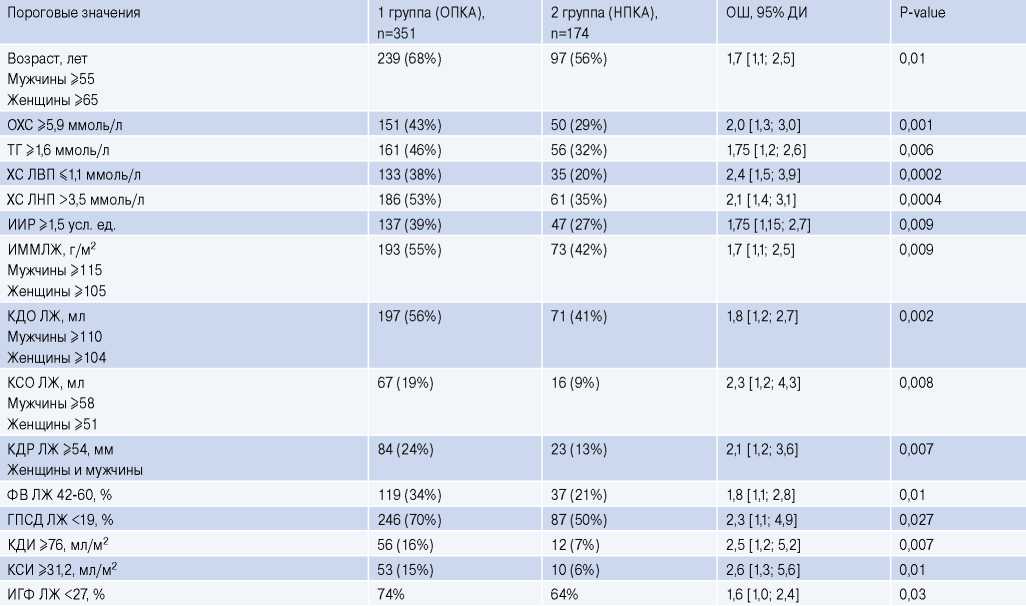
Сокращения: ГПСД — глобальная продольная систолическая деформация, ДИ — доверительный интервал, ИГФ — индекс глобальной функции, ИИР — индекс инсулинорезистентности, ИММЛЖ — индекс массы миокарда левого желудочка, КДИ — индекс конечного диастолического объема, КДО — конечный диастолический объем, КДР — конечный диастолический размер, КСИ — индекс конечного систолического объема, КСО — конечный систолический объем, ЛЖ — левый желудочек, НПКА — необструктивное поражение коронарных артерий, ОПКА — обструктивное поражение коронарных артерий, ОХС — общий холестерин, ОШ — отношение шансов, ТГ — триглицериды, ФВ — фракция выброса, ХС ЛВП — холестерин липопротеидов высокой плотности, ХС ЛНП — холестерин липопротеидов низкой плотности.
На четвертом этапе исследования на основе методов МЛР, XGBoost и ИНС были разработаны прогностические модели для оценки вероятности ОПКА до выполнения инвазивной КАГ (табл. 4). При построении моделей применяли алгоритм отбора лучших подмножеств (Best Subset Selection), который позволил выделить комбинацию потенциальных предикторов ОПКА с наилучшим прогностическим потенциалом. Она включала 3 показателя в категориальной форме (ФВ ЛЖ 42-60%, ГПСД ЛЖ ≤19% и ХС ЛНП >3,5 ммоль/л), которые использовались в качестве базовых предикторов во всех разработанных моделях. Пошаговое включение в их структуру других факторов приводило к увеличению или снижению только отдельных метрик качества. Их максимальный подъем фиксировался в модели МЛР (3) при комбинации 4 категориальных признаков: ФВ ЛЖ, ГПСД ЛЖ, ХС ЛНП и возраста >55 лет для мужчин и >65 лет — для женщин. Эта модель имела наилучшее соотношение критериев качества: AUC — 0,81, Ac — 0,74, Se — 0,75 и Sp — 0,74. Несколько меньший уровень критериев качества фиксировался в моделях (8) на основе МЛР (AUC — 0,80, Ac — 0,73; Se — 0,74; Sp — 0,72) и XGBoost (AUC — 0,80, Ac — 0,72; Se — 0,72; Sp — 0,74), структура которых дополнялась фактором ИГФ ЛЖ. Модели с использованием комбинаций других потенциальных предикторов обладали меньшей прогностической точностью.
Таблица 4
Оценка точности прогностических моделей для претестовой верификации ОПКА
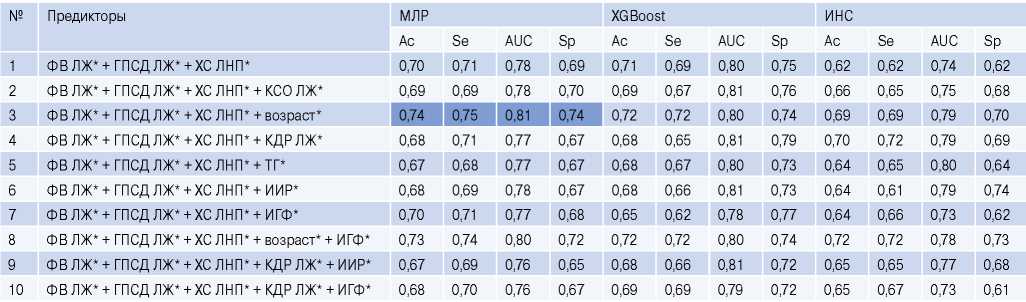
Примечание: * — обозначены значения показателей в категориальной форме.
Сокращения: ГПСД — глобальная продольная систолическая деформация, ИГФ — индекс глобальной функции, ИИР — индекс инсулинорезистентности, ИНС — искусственные нейронные сети, КДР — конечный диастолический размер, КСИ — индекс конечного систолического объема, КСО — конечный систолический объем, ЛЖ — левый желудочек, МЛР — многофакторная логистическая регрессия, ОХС — общий холестерин, ТГ — триглицериды, ФВ — фракция выброса, ХС ЛНП — холестерин липопротеидов низкой плотности, Ac — accuracy (точность), AUC — площадь под ROC кривой, Se — sensitivity (чувствительность), Sp — specificity (специфичность), XGBoost — стохастический градиентный бустинг.
Степень влияния различных предикторов на результирующую точку исследования определяли путем последовательного исключения отдельных факторов из структуры лучшей модели и ее повторного построения на оставшихся. При этом выраженность снижения критерия AUC указывала на прогностическую ценность удаленного предиктора (рис. 1). Так, при исключении из структуры модели показателя ХС ЛНП ее точность по метрике AUC снижалась на 30%. Удаление фактора ФВ ЛЖ ограничивало точность модели на 9%, а последовательное исключение признаков гендерной принадлежности и ГПСД ЛЖ сокращало уровень AUC на 6% и 8%, соответственно. Таким образом, наибольший вклад в прогностическую точность претестовой верификации ОПКА ассоциировался с показателем ХС ЛНП >3,5 ммоль/л.
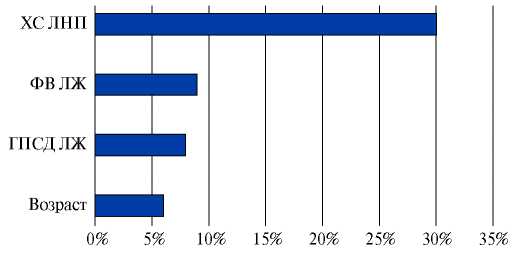
Рис. 1. Относительный вклад отдельных предикторов в реализацию конечной точки, (%).
Сокращения: ГПСД — глобальная продольная систолическая деформация, ЛЖ — левый желудочек, ФВ — фракция выброса, ХС ЛНП — холестерин липопротеидов низкой плотности.
Обсуждение
В последние годы в структуре госпитализаций в отделения неотложной кардиологии отмечается увеличение доли больных с ОКСбпST, большинство (63,6%) из которых приходится на НС. На госпитальном этапе трансформация НС в ИМ фиксируется у 8% пациентов, в течение года — у 14%, а на горизонте наблюдения в 6 лет у больных с низким и средним риском по шкале GRACE ИМ развивался в 15-18,6% случаев [14]. В нашем исследовании у всех больных с ОКСбпST диагноз ИМ был исключен по результатам определения вч-сTнI при поступлении в стационар и в динамике госпитального наблюдения, что указывало на клиническую картину НС. По данным инвазивной КАГ у 67% обследованных имели место ОПКА, а у 33% — НПКА. Различия в анатомическом статусе КА у обследованного нами контингента подтверждают известные представления о многофакторности патофизиологических механизмов ИБС и свидетельствуют о необходимости совершенствования диагностических технологий, позволяющих верифицировать патогенетические варианты ОКСбпST у конкретных пациентов. К ним относят инвазивные тесты для оценки резерва коронарного кровотока, микроциркуляторного сопротивления, вазоспастической активности КА и др. [4][5][15][16]. Вместе с тем в настоящее время отсутствуют общепринятые алгоритмы неинвазивного разграничения ОПКА и НПКА, что снижает эффективность претестовой диагностики клинических фенотипов ИБС, в т.ч. ОКСбпST [15]. В представленной работе предпринята попытка прогнозирования выраженности атеросклеротического ремоделирования КА у больных с ОКСбпST до проведения инвазивной КАГ. Для реализации этой задачи был проведен многоступенчатый анализ предиктивного потенциала электрокардиографических, эхокардиографических и липидных показателей у больных с ОПКА и НПКА. Для разработки прогностических моделей ОПКА были использованы современные алгоритмы МО, включающие элементы объяснимого искусственного интеллекта, позволяющие дать клиническую интерпретацию результатов моделирования. К последним относился этап выделения пороговых значений анализируемых факторов, отклонение от которых увеличивает их предиктивную ценность для определения вероятности ОПКА. На первом шаге исследования для подтверждения гипотезы о возможном неравенстве клинико-функциональных показателей у больных с ОПКА и НПКА были использованы методы математической статистики, применение которых демонстрировало достоверность отличий только у 16 из 40 входных признаков. При расчете весовых коэффициентов однофакторных моделей ЛР предиктивный потенциал сохранялся у 14 из них.
При сопоставлении ЭКГ-показателей в группах сравнения было установлено, что большинство из них не имеют статистически значимых различий. Исключение составил признак элевации сегмента STaVR, который встречался чаще у больных с ОПКА, чем с НПКА (43% vs 31%; ОШ =1,7, p=0,014). Однако дальнейший анализ не подтвердил прогностическую значимость этого фактора (табл. 1, 2). Таким образом, несмотря на ключевое значение ЭКГ в диагностике ОКС, в нашей работе ни один из ее показателей, включая индикаторы гипертрофии ЛЖ, не обладал достаточной прогностической ценностью для претестовой верификации ОПКА.
Известно, что морфофункциональный статус миокарда у больных ИБС часто ассоциируется с изменением объемных и линейных показателей ЛЖ. Перенесенный ИМ, преходящая или хроническая ишемия миокарда приводят к его ремоделированию, появлению зон гипокинезии даже при сохраненной ФВ. В нашем исследовании частота выявления лиц с нормальной геометрией сердца и различными типами его ремоделирования при ОПКА и НПКА не имела существенных различий. При этом ИММЛЖ в непрерывной и категориальной (>115 г/м2 — у мужчин и >105 г/м2 — у женщин) формах повышал вероятность ОПКА в 1,7 раза (p=0,009) (табл. 3). Клиническое значение гипертрофии миокарда ЛЖ у больных с ОКСбпST ассоциируется с ограничением резерва коронарного кровотока на фоне сокращения количества микрососудов на единицу ткани миокарда и увеличением интракардиального сосудистого сопротивления, что ухудшает прогноз заболевания. Кроме того, у больных с ОПКА по сравнению с пациентами без стенотических поражений КА имело место увеличение объемных и линейных показателей ЛЖ на фоне сохраненной, но достоверно меньшей ФВ (табл. 1). Прогностический потенциал этих факторов существенно возрастал при их отклонении от установленных в ходе исследования пороговых значений. В ряде работ доказана предиктивная ценность объемных и линейных показателей для прогнозирования неблагоприятных сердечнососудистых событий, связанных с ИМ или коронарным шунтированием [17]. Вместе с тем в литературе отсутствуют данные об их применении в качестве предикторов ОПКА при ОКСбпST. В нашем исследовании предиктивным потенциалом обладали показатели КСО ЛЖ (модель 2) и КДР ЛЖ (модели 4, 9, 10). Эти модели были разработаны методом XGBoost, а их прогностическая точность по метрике AUC варьировала от 0,79 до 0,81.
ИГФ ЛЖ является интегральным показателем ремоделирования ЛЖ и независимым предиктором развития сердечно-сосудистых осложнений ИБС [13]. Показано, в частности, что ИГФ ЛЖ <22,6% ассоциировался с неблагоприятными исходами ОКС. В нашем исследовании ИГФ ЛЖ <27% являлся предиктором ОПКА и входил в структуру моделей 7, 8, 10 на основе XGBoost (AUC 0,78, 0,80, 0,79, соответственно). К наиболее чувствительным маркерам дисфункции миокарда ЛЖ относят ГПСД, измеренную с помощью спекл-трекинг ЭхоКГ. В ряде исследований ГПСД ЛЖ была признана информативным индикатором ОПКА [18-20]. В рекомендациях Европейского общества кардиологов (ESC) по диагностике и лечению ОКСбпST (2020) [7] у пациентов с подозрением на ИБС с сохранной ФВ ЛЖ претестовую верификацию ОПКА предлагается дополнить определением ГПСД ЛЖ. В работе Schroeder J, et al. [19] ГПСД ЛЖ <18,8% демонстрировала высокую точность (AUC — 0,82), Se (86%) и Sp (73%) для прогнозирования ОПКА. В другом исследовании медианное значение ГПСД ЛЖ у больных ИБС с ОПКА составило 16,5% [ 15,8; 17,3], а с НПКА — 19,7% [ 18,8; 20,7] (ОШ =8,5, AUC — 0,81) [20]. В нашем исследовании показатель ГПСД ЛЖ на всех этапах отбора предикторов обладал статистической и прогностической значимостью и вошел в лучшую прогнозную модель ОПКА с пороговым значением <19% (ОШ =2,3; p=0,027; AUC — 0,81). Данная модель (3) была разработана на основе МЛР. При этом модели XGBoost и ИНС, включающие этот предиктор, обладали меньшей прогностической точностью (AUC 0,80 и 0,79, соответственно).
Дисбаланс липидного спектра с повышенной концентрацией ХС ЛНП и снижением уровня ХС ЛВП имеет доказанные причинно-следственные связи с атеросклеротическим ремоделированием КА. В недавно опубликованной работе индикаторы атерогенной дислипидемии демонстрировали высокий предиктивный потенциал в алгоритмах претестовой верификации ОПКА [21]. В настоящем исследовании прогностическая ценность липидных показателей для определения степени атеросклеротической нагруженности КА подтвердилась (табл. 1-3). При этом только ХС ЛНП проявлял свой предиктивный потенциал во всех разработанных моделях и вошел в лучшую из них (модель 3 на основе МЛР, табл. 4). Доминирующее влияние этого признака на прогноз ОПКА подтверждалось результатами анализа предиктивной ценности отдельных факторов и их сопряженностью с конечной точкой исследования (рис. 1). Одним из ведущих патогенетических факторов атеросклеротического ремоделирования КА является инсулинорезистентность, к суррогатным маркерам которой относят отношение ТГ/ХС ЛВП >1,32 усл. ед. [21]. В нашем исследовании ИИР >1,5 усл. ед. демонстрировал значимый предиктивный потенциал в отношении ОПКА в моделях 6 и 9 (AUC — 0,81), разработанных методом XGBoost. Вместе с тем другие метрики качества (Ac, Sp, Se) этих моделей были ниже, чем в модели (3) на основе МЛР.
Ограничения исследования могут быть связаны с недостаточным объемом выборки, ограниченным спектром анализируемых факторов и методов МО.
Заключение
Результаты исследования показали, что прогностические алгоритмы для претестовой верификации ОПКА у больных с ОКСбпST, разработанные на основе многоступенчатого анализа предиктивного потенциала ЭКГ, ЭхоКГ, липидных показателей и использования современных методов МО (МЛР, XGBoost и ИНС), обладают различной предсказательной ценностью. Модель на основе МЛР, в структуру которой входили предикторы ХС ЛНП >3,5 ммоль/л, ГПСД ЛЖ <19%, ФВ ЛЖ 42-60%, возраст >55 лет у мужчин и >65 лет у женщин, имеет лучшее соотношение метрик качества (AUC — 0,81, Ac и Sp — 0,74, Se — 0,75), чем другие модели. Перспективы внедрения результатов прогностических исследований в клиническую практику связаны с применением методов объяснимого искусственного интеллекта и разработкой интерпретируемых моделей МО. В настоящем исследовании осуществлена попытка реализации данного подхода.
Отношения и деятельность. Работа выполнена при частичной поддержке грантов РФФИ в рамках научных проектов № 20-37-90081, № 19-29-01077.
Список литературы
1. Барбараш О. Л., Дупляков Д. В., Затейщиков Д. А. и др. Острый коронарный синдром без подъема сегмента ST электрокардиограммы. Клинические рекомендации 2020. Российский кардиологический журнал. 2021;26(4):4449. doi:10.15829/1560-4071-2021-4449.
2. Sucato V, Testa G, Puglisi S, et al. Myocardial infarction with non-obstructive coronary arteries (MINOCA): Intracoronary imaging-based diagnosis and management. J Cardiol. 2021;77(5):444-51. doi:10.1016/j.jjcc.2021.01.001.
3. Сумин А. Н. Место клинической оценки в выявлении обструктивных поражений коронарных артерий при стабильной ишемической болезни сердца. Часть I. Российский кардиологический журнал. 2019;(5):95-100. doi:10.15829/1560-4071-2019-5-95-100.
4. Suzuki S, Kaikita K, Yamamoto E, et al. Role of acetylcholine spasm provocation test as a pathophysiological assessment in nonobstructive coronary artery disease. Cardiovasc Interv and Ther. 2021;36(1):39-51. doi:10.1007/s12928-020-00720-z.
5. Гельцер Б. И., Циванюк М. М., Котельников В. Н., Карпов Р. С. Вазоспастическая стенокардия: патофизиологические детерминанты и клиническое значение. Кардиоваскулярная терапия и профилактика. 2020;19(1):99-105. doi:10.15829/1728-8800-2020-1-2391.
6. Nakayama N, Kaikita K, Fukunaga T, et al. Clinical Features and Prognosis of Patients With Coronary Spasm-Induced Non-ST-Segment Elevation Acute Coronary Syndrome. Journal of the American Heart Association. 2014;3(3):e000795-e000795. doi:10.1161/jaha.114.000795.
7. Collet J, Thiele H, Barbato E, et al. ESC Scientific Document Group, 2020 ESC Guidelines for the management of acute coronary syndromes in patients presenting without persistent ST-segment elevation: The Task Force for the management of acute coronary syndromes in patients presenting without persistent ST-segment elevation of the European Society of Cardiology (ESC). European Heart Journal. 2021;42(14):1289-367. doi:10.1093/eurheartj/ehaa575.
8. Pal S, Broker M, Wagner H, et al. Stress (Takotsubo) Cardiomyopathy: A Review of Its Pathophysiology, Manifestations, and Factors That Affect Prognosis. Cardiol Rev. 2021;29(4):205-9. doi:10.1097/CRD.0000000000000309.
9. Matta A, Bouisset F, Lhermusier T, et al. Coronary Artery Spasm: New Insights. Journal of Interventional Cardiology, 2020; Article ID 5894586: 1-10. doi:10.1155/2020/5894586.
10. Гельцер Б. И., Циванюк М. М., Шахгельдян К. И. и др. Методы машинного обучения в оценке предтестовой вероятности обструктивных и необструктивных поражений коронарного русла. Российский кардиологический журнал. 2020;25(5):3802. doi:10.15829/1560-4071-2020-3802.
11. Johnson KW, Torres Soto J, Glicksberg BS, et al. Artificial Intelligence in Cardiology. Journal of the American College of Cardiology. 2018;71(23):2668-79. doi:10.1016/j.jacc.2018.03.521.
12. Quesada JA, Lopez‐Pineda A, Gil‐Guillen VF, et al. Machine learning to predict cardiovascular risk. International Journal of Clinical Practice. 2019;00:e13389. doi:10.1111/ijcp.13389.
13. Капустина А. Ю., Минушкина Л. О., Алёхин М. Н. и др. Индекс глобальной функции левого желудочка в качестве прогностического фактора сердечно-сосудистых осложнений у пациентов с острым коронарным синдромом. Кардиология. 2021;61(8):23-31. doi:10.18087/cardio.2021.8.n1508.
14. Бернс С. А., Шмидт Е. А., Клименкова А. В. и др. Возможности шкалы GRACE в долгосрочной оценке риска у больных с острым коронарным синдромом без подъема сегмента ST. Доктор.Ру. 2019;(2):12-8. doi:10.31550/1727-2378-2019-157-2-12-18.
15. Сумин А. Н. Проблема интактных коронарных артерий еще остается или близка к решению? Российский кардиологический журнал. 2021;26(2):4139. doi:10.15829/1560-4071-2021-4139.
16. Knuuti J, Wijns W, Saraste A, et al. ESC Scientific Document Group, 2019 ESC Guidelines for the diagnosis and management of chronic coronary syndromes: The Task Force for the diagnosis and management of chronic coronary syndromes of the European Society of Cardiology (ESC). European Heart Journal. 2020;41(3):407-77. doi:10.1093/eurheartj/ehz425.
17. Саушкин В. В., Завадовский К. В. Оценка точности вычисления показателей гемодинамики и массы миокарда левого желудочка по данным ЭКГ-синхронизированной перфузионной сцинтиграфии миокарда: сравнение с многосрезовой компьютерной томографией сердца. Вестник рентгенологии и радиологии. 2019;100(3):152-60. doi:10.20862/0042-4676-2019-100-3-152-160.
18. Moustafa S, Elrabat K, Swailem F, et al. The correlation between speckle tracking echocardiography and coronary artery disease in patients with suspected stable angina pectoris. Indian Heart Journal. 2018;70(3):379-86. doi:10.1016/j.ihj.2017.09.220.
19. Schroeder J, Hamada S, Gründlinger N, et al. Myocardial deformation by strain echocardiography identifies patients with acute coronary syndrome and non-diagnostic ECG presenting in a chest pain unit: a prospective study of diagnostic accuracy. Clinical Research in Cardiology. 2015;105(3):248-56. doi:10.1007/s00392-015-0916-2.
20. Liou K, Negishi K, Ho S, et al. Detection of Obstructive Coronary Artery Disease Using Peak Systolic Global Longitudinal Strain Derived by Two-Dimensional Speckle-Tracking: A Systematic Review and Meta-Analysis. Journal of the American Society of Echocardiography. 2016;29(8):724-35.e4. doi:10.1016/j.echo.2016.03.002.
21. Гельцер Б. И., Циванюк М. М., Шахгельдян К. И. и др. Факторы кардиометаболического риска в прогнозировании обструктивного поражения коронарных артерий у больных с острым коронарным синдромом без подъема сегмента ST. Российский кардиологический журнал. 2021;26(11):4494. doi:10.15829/1560-4071-2021-4494.
Об авторах
М. М. ЦиванюкРоссия
Циванюк Михаил Михайлович — аспирант школы медицины, врач отделения рентгенохирургических методов диагностики и лечения, кардиолог.
Владивосток.
SPIN-код 1491-3966
Конфликт интересов:
Нет
Б. И. Гельцер
Россия
Гельцер Борис Израйльевич — доктор медицинских наук, профессор, член-корреспондент РАН, заместитель директора по научной работе.
Владивосток.
SPIN-код: 2216-4151
Конфликт интересов:
Нет
К. И. Шахгельдян
Россия
Шахгельдян Карина Иосифовна — доктор технических наук, доцент, заведующий лабораторией анализа больших данных в биомедицине и здравоохранении.
Владивосток.
SPIN-код: 3573-7894
Конфликт интересов:
Нет
Е. Д. Емцева
Россия
Емцева Елена Дмитриевна — кандидат физико-математических наук, доцент института математики и компьютерных технологий.
Владивосток.
SPIN-код: 4767-7293
Конфликт интересов:
Нет
Г. С. Завалин
Россия
Завалин Георгий Сергеевич — магистрант кафедры математики и моделирования.
Владивосток.
Конфликт интересов:
Нет
О. И. Шекунова
Россия
Шекунова Ольга Ивановна — кандидат медицинских наук, доцент.
Владивосток.
Конфликт интересов:
Нет
Дополнительные файлы
Рецензия
Для цитирования:
Циванюк М.М., Гельцер Б.И., Шахгельдян К.И., Емцева Е.Д., Завалин Г.С., Шекунова О.И. Электрокардиографические, эхокардиографические и липидные показатели в прогнозировании обструктивного поражения коронарных артерий у больных с острым коронарным синдромом без подъема сегмента ST. Российский кардиологический журнал. 2022;27(6):5036. https://doi.org/10.15829/1560-4071-2022-5036
For citation:
Tsivanyuk M.M., Geltser B.I., Shakhgeldyan K.I., Emtseva E.D., Zavalin G.S., Shekunova O.I. Electrocardiographic, echocardiographic and lipid parameters in predicting obstructive coronary artery disease in patients with non-ST elevation acute coronary syndrome. Russian Journal of Cardiology. 2022;27(6):5036. (In Russ.) https://doi.org/10.15829/1560-4071-2022-5036
JATS XML

















































