Перейти к:
Продолжительность максимального времени между кардиоциклами при фибрилляции предсердий для оценки риска артериальных тромбоэмболических осложнений
https://doi.org/10.15829/1560-4071-2022-5007
Аннотация
Цель. Определить развитие тромбоэмболических осложнений при различных вариантах фибрилляции предсердий (ФП), отличающихся по максимальному времени между кардиоциклами.
Материал и методы. В исследование вошли 80 пациентов с постоянной формой ФП, контрольная группа — 88 человек без ФП. Выполнялись исследования: эхокардиография, суточное мониторирование электрокардиограммы; ультразвуковое исследование брахиоцефальных артерий, ветвей аорты, артерий нижних конечностей; сфигмография общей сонной и задней артерии голени. По показаниям — коронарография, панцеребральная ангиография, компьютерная томография головного мозга. На основании анализа суточного мониторирования электрокардиограммы все пациенты основной группы были разделены на 2 подгруппы (А и Б) в зависимости от максимального времени между кардиоциклами при ФП: подгруппа А (42) — больные с максимальным временем между кардиоциклами до 1,5 сек, подгруппа Б (38) — ≥1,5 сек. Наблюдение проводилось в течение 1 года. Во время периода наблюдения проводился анализ развития артериальных тромбоэмболических событий.
Результаты. По основным параметрам инструментальных, лабораторных методов исследования, а также по сопутствующей патологии пациенты были равнозначны. Однако при изучении отдаленных осложнений в течение 1 года мы наблюдали достоверно более частое развитие инсульта, транзиторной ишемической атаки, инфаркта миокарда и дистальных артериальных эмболий артерий нижних конечностей в подгруппе Б. При увеличении максимального времени между кардиоциклами при ФП происходило увеличение параметров гемодинамики артериальных сосудов как на проксимальных, так и на дистальных артериях. Аналогичная тенденция наблюдалась и при анализе параметров кинетики артерий.
Заключение. При оценке риска артериальных тромбоэмболических осложнений важен не только сам факт наличия у пациента ФП, но и то, какие особенности она имеет. Прогностически наиболее неблагоприятной является ФП с максимальной продолжительностью времени между кардиоциклами ≥1,5 сек. Рост показателей внутриартериальной гемодинамики после длительной паузы между сокращением желудочков при ФП без внутрисердечного тромбоза может стать ключевым моментом в развитии осложнений на уже имеющихся атеросклеротических бляшках, приводя к нарушению их целостности, что может стать источником дистальных эмболических осложнений различных локализаций.
Для цитирования:
Германова О.А., Германов А.В., Щукин Ю.В. Продолжительность максимального времени между кардиоциклами при фибрилляции предсердий для оценки риска артериальных тромбоэмболических осложнений. Российский кардиологический журнал. 2022;27(7):5007. https://doi.org/10.15829/1560-4071-2022-5007
For citation:
Germanova O.A., Germanov A.V., Shchukin Yu.V. Maximum time between cardiac cycles in atrial fibrillation for assessing the risk of arterial thromboembolism. Russian Journal of Cardiology. 2022;27(7):5007. (In Russ.) https://doi.org/10.15829/1560-4071-2022-5007
Инфаркт миокарда и инсульт прочно удерживают многолетнее лидерство среди причин смертности во всем мире, в России унося жизни 1 млн человек в год: до 48% причин всех летальных исходов. До 16% смертей приходится на инсульт [1-7]. При этом неблагоприятная статистика в нашей стране почти в 2 раза превышает показатели европейских стран. В связи с этим становится очевидным, насколько важны своевременная профилактика и лечение данной патологии.
В течение многих лет развивались представления о факторах риска и стратегиях профилактики кардиоцеребральных осложнений. Сумма накопленных результатов научных исследований, проводимых в области кардиологии и неврологии, создание специальных шкал прогнозирования позволяют с высокой точностью предсказать развитие тромбоэмболических осложнений (ТЭО) у каждого пациента. Однако частота осложнений остается очень высокой. Общепризнано, что фибрилляция предсердий (ФП) — один из основных факторов риска кардиоцеребральных осложнений, в т.ч. ишемического инсульта [1][3][8-10]. Подавляющее большинство ишемических инсультов имеют кардиоэмболическую природу. Поэтому в число профилактических мер кардиоцеребральных осложнений у пациентов с ФП входит обязательное назначение антикоагулянтной терапии.
Наиболее часто применяемая шкала по оценке риска развития ТЭО — CHA2DS2-VASc — учитывает лишь сам факт наличия у больного ФП, однако не проводится градация ФП по максимальному времени между кардиоциклами [11][13]. Каждый практикующий кардиолог или невролог в своей профессиональной деятельности знаком с ситуациями, когда на фоне назначения антикоагулянтной терапии и при отсутствии признаков внутрисердечного тромбоза у пациентов с ФП все же происходили кардиоцеребральные осложнения.
В связи с этим целью нашей работы является определить развитие ТЭО при различных вариантах ФП, отличающихся по максимальному времени между кардиоциклами.
Материал и методы
В исследование вошли 80 пациентов с постоянной формой ФП. Критерии включения: постоянная форма ФП; согласие на участие в исследовании. Критерии исключения: аневризмы сердца; аневризмы аорты; выявленный внутрисердечный тромбоз; новообразования сердца; наличие механических протезов клапанов сердца; хроническая сердечная недостаточность тяжелее NYHA II; сахарный диабет; хроническая обструктивная болезнь легких средней степени тяжести и выше; гематологические заболевания; стаж курильщика ≥7 лет; гемодинамически значимый стеноз каротидной бифуркации (≥70% по диаметру). В группу контроля мы включили 88 пациентов без ФП.
Исследование было выполнено в строгом соответствии с принципами Хельсинкской декларации и со стандартами Надлежащей клинической практики (Good Clinical Practice). Протокол исследования был одобрен этическим комитетом СамГМУ. До включения в исследование у всех участников было получено письменное информированное согласие.
Всем пациентам были проведены инструментальные методы исследования: чреспищеводная и трансторакальная эхокардиография, суточное мониторирование электрокардиограммы (ЭКГ) по Холтеру; ультразвуковая допплерография (УЗДГ) брахиоцефальных артерий, ветвей аорты, артерий нижних конечностей; сфигмография (СГ) общей сонной и задней артерии голени. При наличии показаний проводилась компьютерная томография головного мозга, коронарография, панцеребральная ангиография. При эхокардиографии обращали внимание на наличие внутрисердечного тромбоза, который был исключен у всех пациентов. С помощью сочетания методов УЗДГ и СГ нам удалось комплексно оценить основные показатели гемодинамики артериальных сосудов различных типов: эластического (общая сонная артерия) и мышечно-эластического (задняя артерия голени). Поскольку при ФП кардиоциклы имеют разную продолжительность, мы определяли параметры гемодинамики при минимальной, средней и максимальной паузе между пульсовыми волнами. Так, при УЗДГ общей сонной и задней артерии голени проводилось измерение линейной скорости кровотока, объемного кровотока. При СГ определяли кинетические параметры, характеризующие сосудистую стенку: скорость, ускорение, мощность, работу. Данные параметры мы также измеряли при минимальной, средней и максимальной паузе между пульсовыми волнами. При суточном мониторировании ЭКГ по Холтеру особое внимание уделяли значению максимального времени между кардиоциклами при ФП. В числе лабораторных методов исследования выполнялось определение уровня липидов крови, а также определялись основные показатели гемостазиограммы. Все пациенты получали стандартную терапию, рекомендованную при ФП, согласно действующим рекомендациям Европейского и Российского обществ кардиологов. В качестве антикоагулянтной терапии все пациенты получали пероральные антикоагулянты в дозировках, рекомендованных при постоянной форме ФП; варфарин не назначался. Приверженность терапии была высокой. Подбор противоаритмических препаратов у пациентов с постоянной формой ФП осуществлялся таким образом, чтобы достигнуть средней частоты желудочковых сокращений 60-90 в мин, т.е. нормосистолии. Однако у части больных были зарегистрированы паузы между кардиоциклами ≥1,5 сек, что и явилось основой для разделения изучаемой когорты пациентов на подгруппы А и Б.
На основании анализа суточного мониторирования ЭКГ по Холтеру, все пациенты основной группы были разделены на 2 подгруппы (А и Б) по принципу выявленного значения максимального времени между кардиоциклами при ФП. Так, в подгруппу А (42 человека) вошли больные с максимальным временем между кардиоциклами до 1,5 сек, в подгруппу Б (38 человек) — ≥1,5 сек. Пограничное значение 1,5 сек было взято за основу, поскольку в дальнейшем при статистическом анализе полученных данных именно это время оказало достоверное влияние на увеличение частоты развития ТЭО.
Наблюдение за пациентами проводилось в течение 1 года от момента первого визита. Основные контрольные точки — 6 и 12 мес. от начала исследования. Во время периода наблюдения проводился анализ развития артериальных тромбоэмболических событий (инфаркт миокарда, инсульт или транзиторная ишемическая атака, дистальные артериальные эмболии артерий нижних конечностей) путем опроса или, при повторной госпитализации, с помощью анализа данных историй болезни.
При статистическом анализе мы руководствовались принципами доказательной медицины. ANOVA — однофакторный дисперсионный анализ проводился для сравнения средних значений независимых групп (подгруппы А и Б, контроль) для каждого анализируемого параметра. При p≤0,05 данные считались статистически значимыми. При ANOVA, по данным УЗДГ, мы проанализировали параметры гемодинамики (линейная скорость кровотока, объемный кровоток), а по данным СГ — кинетики магистральных артерий (скорость, ускорение, мощность, работа) на общей сонной и задней артерии голени. Анализ Cox применялся для оценки развития артериальных тромбоэмболических событий в течение 1 года от начала наблюдения. Кроме того, рассчитывались показатели четырехпольной таблицы для установления связи между максимальным временем между кардиоциклами при ФП и развитием артериальных тромбоэмболических событий в течение 1 года.
Результаты
По основным параметрам инструментальных, лабораторных методов исследования, по сопутствующей патологии пациенты подгрупп А и Б, а также контрольной группы были равнозначны (табл. 1).
Таблица 1
Характеристика групп
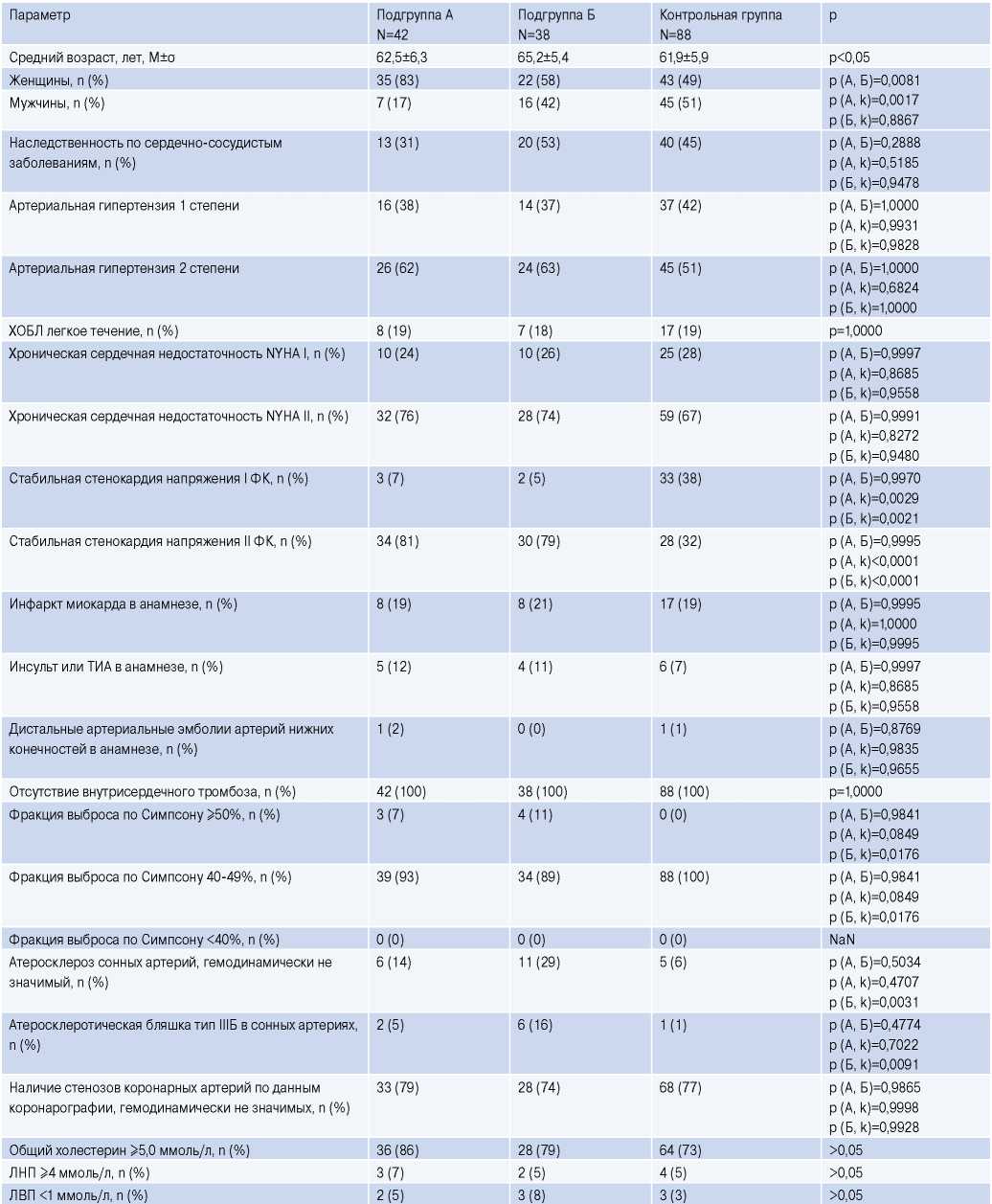
Сокращения: A — подгруппа А, Б — подгруппа Б, ЛВП — липопротеиды высокой плотности, ЛНП — липопротеиды низкой плотности, ТИА — транзиторная ишемическая атака, ФК — функциональный класс, ХОБЛ — хроническая обструктивная болезнь легких, k — контрольная группа, NYHA — классификация хронической сердечной недостаточности Нью-Йоркской ассоциации сердца.
Таблица 2
Артериальные ТЭО в течение 1 года в подгруппах А, Б и контрольной группе
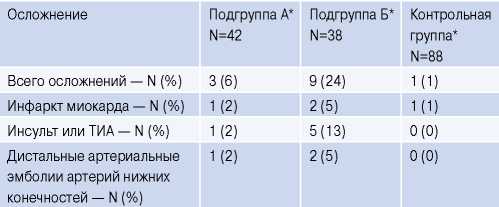
Примечание: * — p (А, Б)=0,0390, p (А, k)=0,0487, p (Б, k)<0,001.
Сокращение: ТИА — транзиторная ишемическая атака.
Таким образом, при использовании шкалы по оценке риска развития ТЭО CHA2DS2-VASc, подгруппы А и Б были равнозначны по сумме баллов. Важно подчеркнуть, что всем пациентам проводилась стандартная терапия, включая пероральные антикоагулянты. Однако при изучении отдаленных осложнений в течение 1 года мы наблюдали статистически достоверное более частое развитие инсульта, транзиторной ишемической атаки, инфаркта миокарда и дистальных артериальных эмболий артерий нижних конечностей в подгруппе Б (табл. 2, рис. 1). Таким образом, наблюдалась следующая закономерность: при ФП с максимальным временем между кардиоциклами ≥1,5 сек частота развития артериальных тромбоэмболических событий увеличивалась, несмотря на проводимую терапию антикоагулянтами. При анализе четырехпольной таблицы зависимость между данными признаками была относительно сильной (нормированное значение коэффициента Пирсона (C’) =0,438).
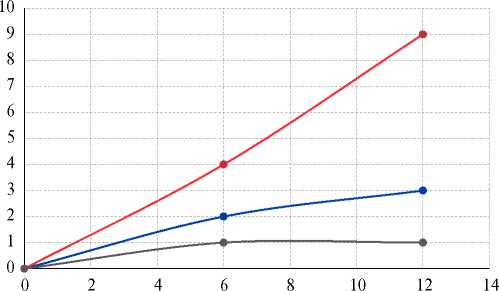
Рис. 1. Артериальные ТЭО в течение 1 года в подгруппах А, Б, контрольной группе (анализ Кокса).
Примечание: по оси абсцисс указан период в месяцах, по оси ординат — количество артериальных тромбоэмболических осложнений. Верхний график соответствует подгруппе Б, средний — подгруппе А, нижний — контрольной группе.
При этом мы обратили внимание, что по основным показателям гемодинамики, измеренным на артериях эластического и мышечно-эластического типа, при прохождении пульсовой волны после максимального времени между кардиоциклами, подгруппы статистически значимо различались между собой и с контрольной группой (табл. 3).
Таблица 3
Показатели гемодинамики по данным УЗДГ при распространении пульсовой волны после максимального времени между кардиоциклами в подгруппах А и Б и группе контроля
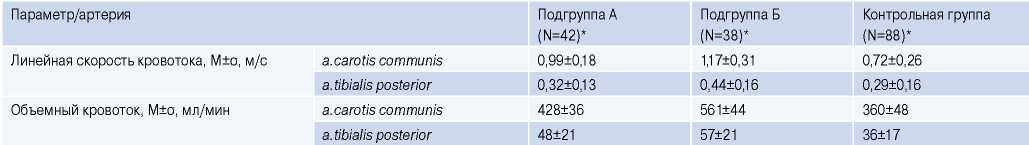
Примечание: * — p<0,05.
Таким образом, была выявлена следующая закономерность: при увеличении максимального времени между кардиоциклами при ФП происходило увеличение параметров гемодинамики артериальных сосудов как на проксимальных, так и на дистальных артериях. Аналогичная тенденция наблюдалась и при анализе параметров кинетики артерий. Так, в подгруппе Б было выявлено достоверное увеличение скорости, ускорения, мощности, работы (суммарная: в фазу преобладания притока над оттоком и оттока над притоком) при распространении пульсовой волны после длительного времени между кардиоциклами (≥1,5 сек) (рис. 2, 3).
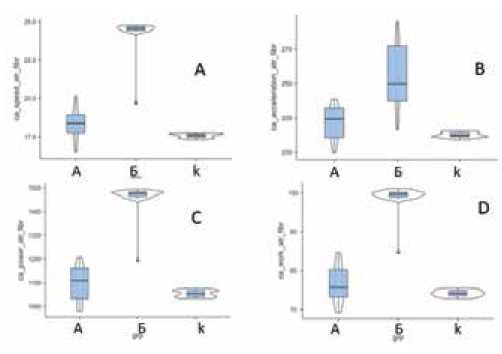
Рис. 2. Скорость (А), ускорение (B), мощность (C), работа (D) на общей сонной артерии по данным СГ при распространении пульсовой волны после длительного времени между кардиоциклами в подгруппах А, Б и контрольной группе.
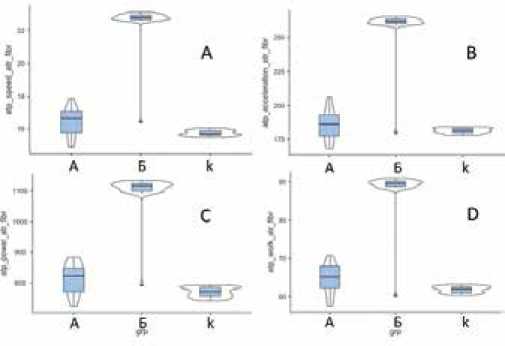
Рис. 3. Скорость (А), ускорение (B), мощность (C), работа (D) на задней артерии голени по данным СГ при распространении пульсовой волны после длительного времени между кардиоциклами в подгруппах А, Б и контрольной группе.
Обсуждение
Общепризнано, что среди традиционных факторов риска артериальных ТЭО один из самых опасных — это ФП [12][13]. При этом в используемых шкалах прогнозирования учитывается лишь само наличие данного нарушения ритма, нет его градации в зависимости от максимального времени между кардиоциклами. При постоянной форме ФП основные меры профилактики направлены на предупреждение внутрисердечного тромбоза, который может стать источником кардиоэмболических осложнений; пациентам с ФП назначаются антикоагулянты. При этом в ряде исследований отмечается необходимость поддержания средней частоты сердечных сокращений при ФП на определенном уровне [13]. Однако речь идет о том, чтобы избегать тахисистолии желудочков. Данных об опасности брадисистолии (особенно при ФП с максимальным временем между кардиоциклами) до сих пор в литературе нет. Впервые о различии в прогнозе ТЭО при различных вариантах ФП мы упоминали ранее в наших публикациях [14]. Возникает закономерный вопрос — с чем связана более высокая частота артериальных тромбоэмболических событий у данной категории пациентов? Каков возможный механизм их развития?
Отсутствие признаков внутрисердечного тромбоза, постоянная терапия антикоагулянтами позволяет утверждать, что кардиоэмболический механизм в данном случае маловероятен. При этом мы обратили внимание, что часть пациентов имела атеросклеротическое поражение (брахиоцефальных, коронарных артерий, а также артерий нижних конечностей). Более того, у некоторых пациентов был диагностирован IIIБ тип бляшки, который характеризуется признаками нестабильности (неровный контур, включение кальция и другие). Возможно ли существование такой ситуации, когда ввиду воздействия какого-то дополнительного пускового момента, не учтенного ранее, произошло нарушение целостности такой бляшки, которая впоследствии стала источником эмболии по ходу артериального сосуда?
При анализе внутриартериальной гемодинамики мы выяснили, что при ФП с максимальным временем между кардиоциклами (подгруппа Б) происходит возрастание линейной скорости кровотока, объемного кровотока, а также суммарной скорости, ускорения, мощности и работы артериальной сосудистой стенки как на артериях эластического (общая сонная), так и на артериях мышечно-эластического типов (задняя артерия голени). В данном случае, при наличии атеросклеротических бляшек, особенно, имеющих признаки нестабильности, воздействие механических факторов повреждения артериальной сосудистой стенки гемодинамическими факторами увеличенной пульсовой волны после длительного времени между кардиоциклами при ФП (≥1,5 сек), может стать тем самым дополнительным пусковым моментом, который приводит к появлению кардиоцеребральных осложнений. При этом даже одна такая длительная пауза при ФП может стать фатальной и вызвать неблагоприятные последствия.
Выявленные клинические закономерности были подтверждены нами экспериментальной работой с применением разработанного и запатентованного “Устройства для моделирования внутриартериального кровообращения” [15].
Заключение
При оценке риска артериальных ТЭО важен не только сам факт наличия у пациента ФП, но и то, какие особенности она имеет. Прогностически наиболее неблагоприятной является ФП с максимальной продолжительностью времени между кардиоциклами ≥1,5 сек.
Рост показателей внутриартериальной гемодинамики после длительной паузы между сокращением желудочков при ФП без внутрисердечного тромбоза может стать ключевым моментом в развитии осложнений на уже имеющихся атеросклеротических бляшках, приводя к нарушению их целостности, что может стать источником дистальных эмболических осложнений различных локализаций.
Отношения и деятельность: все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье.
Список литературы
1. Kleindorfer DO, Towfighi A, Chaturvedi S, et al. 2021. Guideline for the Prevention of Stroke in Patients With Stroke and Transient Ischemic Attack: A Guideline From the American Heart Association/American Stroke Association. Stroke. 2021;52(7):e364-e467. doi:10.1161/STR.0000000000000375. Erratum in: Stroke. 2021;52(7):e483-e484.
2. Virani SS, Alonso A, Benjamin EJ, et al.; on behalf of the American Heart Association Council on Epidemiology and Prevention Statistics Committee and Stroke Statistics Subcommittee. Heart disease and stroke statistics–2020 update: a report from the American Heart Association. Circulation. 2020;141:e139-e596. doi:10.1161/CIR.0000000000000757.
3. Bennett DA, Krishnamurthi RV, Barker-Collo S, et al.; Global Burden of Diseases, Injuries, and Risk Factors 2010 Study Stroke Expert Group. The global burden of ischemic stroke: findings of the GBD 2010 study. Glob Heart. 2014;9:107-12. doi:10.1016/j.gheart. 2014.01.001.
4. Béjot Y, Bailly H, Durier J, Giroud M. Epidemiology of stroke in Europe and trends for the 21st century. Presse Med. 2016; 45(12 pt 2):e391-e398. doi:10.1016/j.lpm.2016.10.003.
5. Mathers CD, Loncar D. Projections of global mortality and burden of disease from 2002 to 2030. PLoS Med. 2006;3:e442. doi:10.1371/journal.pmed.0030442.
6. Gardener H, Sacco RL, Rundek T, et al. Race and ethnic disparities in stroke incidence in the Northern Manhattan Study. Stroke. 2020;51:1064-9. doi:10.1161/STROKEAHA.119.028806.
7. Hart RG, Diener HC, Coutts SB, et al.; Cryptogenic Stroke/ESUS International Working Group. Embolic strokes of undetermined source: the case for a new clinical construct. Lancet Neurol. 2014;13:429-38. doi:10.1016/S1474-4422(13)70310-7.
8. Benjamin EJ, Muntner P, Alonso A, et al., American Heart Association Council on Epidemiology and Prevention Statistics Committee and Stroke Statistics Subcommittee. Heart disease and stroke statistics — 2019 update: a report from the American Heart Association. Circulation 2019;139:e56-e528.
9. Allan V, Honarbakhsh S, Casas JP, et al. Are cardiovascular risk factors also associated with the incidence of atrial fibrillation? A systematic review and field synopsis of 23 factors in 32 population-based cohorts of 20 million participants. Thromb Haemost. 2017;117:837-50.
10. Chao TF, Liu CJ, Tuan TC, et al. Lifetime risks, projected numbers, and adverse outcomes in Asian patients with atrial fibrillation: a report from the Taiwan Nationwide AF Cohort Study. Chest. 2018;153:453-66.
11. Delgado V, Biase LDi, Leung M, et al. Structure and function of the left atrium and left atrial appendage: AF and stroke implications. J Am Coll Cardiol. 2017;70:3157-72.
12. Chao TF, Lip GY, Liu CJ, et al. Validation of a modified CHA2DS2-VASc score for stroke risk stratification in Asian patients with atrial fibrillation: a nationwide cohort study. Stroke. 2016;47:2462-9.
13. Curry SJ, Krist AH, Owens DK, et al. Screening for atrial fibrillation with electrocardiography: US preventive services task force recommendation statement. JAMA. 2018;320:478-84.
14. Germanova O, Galati G, Germanov A, Stefanidis A. Atrial fibrillation: a new independent risk factor for thromboembolic events — hemodynamics and vascular consequence of long ventricular pauses. Minerva Cardiology and Angiology. 2022. doi:10.23736/S27245683.22.06000-8.
15. Germanova OA, Germanov AV, Shchukin YuV. Device for modeling of intra-arterial circulation: application in experimental cardiology. European Heart Journal. 2021;42:1.
Об авторах
О. А. ГермановаРоссия
Ольга Андреевна Германова — кандидат медицинских наук, директор Международного научно-образовательного центра кардиоваскулярной патологии и кардиовизуализации, доцент кафед ры пропедевтической терапии.
Самара
Конфликт интересов:
нет
А. В. Германов
Россия
Андрей Владимирович Германов — кандидат медицинских наук, доцент кафедры пропедевтической терапии.
Самара
Конфликт интересов:
нет
Ю. В. Щукин
Россия
Юрий Владимирович Щукин — доктор медицинских наук, профессор, заслуженный работник высшей школы РФ, заведующий кафедрой пропедевтической терапии.
Самара
Конфликт интересов:
нет
Дополнительные файлы
Рецензия
Для цитирования:
Германова О.А., Германов А.В., Щукин Ю.В. Продолжительность максимального времени между кардиоциклами при фибрилляции предсердий для оценки риска артериальных тромбоэмболических осложнений. Российский кардиологический журнал. 2022;27(7):5007. https://doi.org/10.15829/1560-4071-2022-5007
For citation:
Germanova O.A., Germanov A.V., Shchukin Yu.V. Maximum time between cardiac cycles in atrial fibrillation for assessing the risk of arterial thromboembolism. Russian Journal of Cardiology. 2022;27(7):5007. (In Russ.) https://doi.org/10.15829/1560-4071-2022-5007
JATS XML

















































