Перейти к:
Ассоциация полиморфизмов гена ACE с сердечно-сосудистыми осложнениями у пациентов, перенесших плановые чрескожные коронарные вмешательства
https://doi.org/10.15829/1560-4071-2022-4968
Аннотация
Цель. Выявить ассоциацию полиморфного варианта INS/DEL гена ангиотензинпревращающего фермента (ACE) с острыми и отдаленными осложнениями плановых чрескожных коронарных вмешательств (ЧКВ).
Материал и методы. В проспективное исследование включено 286 пациентов с хронической коронарной болезнью сердца, которым в соответствии с текущими рекомендациями была выполнена плановая эндоваскулярная реваскуляризация миокарда. У пациентов определяли полиморфный вариант INS/DEL (I/D) гена ACE с помощью полимеразной цепной реакции. Регистрировали острые перипроцедурные осложнения. Острое повреждение миокарда было выявлено у 30,4% пациентов. Острый инфаркт миокарда 4а типа развился у 3,1% пациентов. Существенное снижение скорости клубочковой фильтрации более чем на 30% от исходного значения в рамках острого перипроцедурного повреждения почек (ОПП) было диагностировано у 6,5% больных. Исходы плановых ЧКВ были оценены через 4 года посредством телефонного интервью. Смерть от сердечно-сосудистых причин составила 3,6%, смерть от любых причин — 5,1%. Острый коронарный синдром в течение периода наблюдения развился у 15,2%, острое нарушение мозгового кровообращения — у 5,4% пациентов. Тромбозы любых стентов (не только индексных) были выявлены у 10%, а рестенозы с сужением просвета сосуда ≥30% — у 21,8% пациентов. Статистический анализ проводился с помощью программы STATISTICA 10. Рассчитывали отношение шансов (ОШ) с 95% доверительным интервалом.
Результаты. При анализе связи варианта I/D гена ACE с острыми и отдаленными осложнениями процедуры ЧКВ оказалось, что присутствие аллеля I связано с риском перипроцедурного ОПП (р=0,017; ОШ 2,627 (1,161-5,947)), а также отдаленных сердечно-сосудистых осложнений, таких как острый коронарный синдром (р=0,045; ОШ 1,610 (1,007-2,573)) и тромбоз стентов (р=0,01; ОШ 2,073 (1,178-3,650)). Присутствие генотипа II еще более увеличивает риск ОПП (р=0,029; ОШ 5,138 (1,022-25,824)), риск любых острых клинических осложнений ЧКВ (р=0,041; ОШ 1,996 (1,024-3,980)), а также повышает риск тромбоза стентов (р=0,018; ОШ 3,498 (1,178-10,392)).
Заключение. У больных хронической ишемической болезнью сердца носительство аллеля I и генотипа II полиморфизма I/D гена ACE ассоциировано с риском развития острых клинических осложнений плановых ЧКВ, перипроцедурного острого почечного повреждения, а также риском тромбоза стентов и развитием острого коронарного синдрома при сроке наблюдения 4 года после индексного ЧКВ.
Ключевые слова
Для цитирования:
Налесник Е.О., Муслимова Э.Ф., Афанасьев С.А., Репин А.Н. Ассоциация полиморфизмов гена ACE с сердечно-сосудистыми осложнениями у пациентов, перенесших плановые чрескожные коронарные вмешательства. Российский кардиологический журнал. 2022;27(10):4968. https://doi.org/10.15829/1560-4071-2022-4968
For citation:
Nalesnik E.O., Muslimova E.F., Afanasiev S.A., Repin A.N. Association of ACE gene polymorphisms with cardiovascular events in patients after elective percutaneous coronary interventions. Russian Journal of Cardiology. 2022;27(10):4968. (In Russ.) https://doi.org/10.15829/1560-4071-2022-4968
Чрескожные коронарные вмешательства (ЧКВ) широко используются для плановой реваскуляризации миокарда. Острые осложнения процедуры, такие как острое повреждение миокарда (ОПМ) и перипроцедурное острое повреждение почек (ОПП), связаны с последующим прогнозом пациентов и остаются достаточно частыми, несмотря на активное медикаментозное сопровождение ЧКВ и постоянное техническое усовершенствование используемых устройств [1][2].
Не существует надежного метода, способного предсказать индивидуальный риск развития или исхода острых осложнений ЧКВ, а также их отдаленных результатов, т.к. клинические факторы объясняют только часть имеющегося риска [3]. В настоящее время генетические маркеры рассматриваются как потенциально ответственные за развитие и тяжесть острых и отдаленных сердечно-сосудистых осложнений плановых ЧКВ, что объясняет, почему только определенные пациенты более склонны к этим осложнениям и почему разные пациенты по-разному реагируют на лечение и вторичную профилактику [4].
Ангиотензин I-превращающий фермент (ACE) [ EC: 3.4.15.1] кодируется геном ACE (MIM 106180) [5], расположенным на длинном (q) плече хромосомы 17 (17q23.3). Всего было идентифицировано 78 молекулярных вариантов гена ACE [6]. Среди этих вариантов наиболее заметным является вставка или делеция (INS/DEL, I/D, rs1799752, rs4646994) последовательности длиной 287 п.н. в интроне 16.
На сегодняшний день, вероятно, единственным однозначным результатом большого числа исследований является связь между генотипом I/D и уровнем ACE в сыворотке. Сообщалось, что уровень ACE в сыворотке определяется полиморфизмом I/D гена ACE в следующем порядке: DD>ID>II. При этом I/D полиморфизм может определять 47% общей дисперсии фенотипа сывороточного ACE [7]. По данным ряда исследований генотипы DD и ID связаны с увеличением активности ACE в плазме на 50% и 20%, соответственно [8].
Тем не менее опубликованы работы, показывающие ассоциацию I/D варианта с различными сердечно-сосудистыми заболеваниями [9]. Обнаружено, что генотип DD является генетическим маркером, связанным с артериальной гипертензией человека [10], повышенным риском гипертрофии левого желудочка (ЛЖ) [11], началом или прогрессированием диабетической нефропатии при сахарном диабете 1 типа [12] и острым респираторным дистресс-синдром [13]. Напротив, генотип II, связанный с более низкой активностью ACE, индуцирует вазомоторные почечные изменения, а налогичные тем, которые обнаруживаются при длительном применении ингибиторов ACE, и, таким образом, может быть связан с повышенным риском ОПП у гемодинамически нестабильных пациентов в критическом состоянии [14].
Потенциальная роль генетического варианта I/D гена ACE как патогенетического фактора в возникновении серьезных неблагоприятных сердечных событий после ЧКВ представляет особый интерес, учитывая большое количество пациентов, пролеченных во всем мире с помощью ЧКВ, а также из-за доступности таргетных фармакологических средств в виде ингибиторов ACE. Однако влияние I/D варианта в целом на сердечно-сосудистые заболевания, и в частности на острые и отдаленные исходы плановых ЧКВ все ещё остается неясным и требует изучения в связи с неоднородностью получаемых результатов исследований и все более растущей когортой пациентов, наблюдающихся амбулаторно после эндоваскулярной или хирургической реваскуляризации миокарда.
Цель исследования: выявить ассоциацию полиморфных вариантов I/D гена ACE с острыми и отдаленными осложнениями плановых ЧКВ.
Материал и методы
В одноцентровое открытое проспективное когортное исследование было включено 286 пациентов, из них 63 (22%) составили женщины. Критерии включения: стабильная ишемическая болезнь сердца (ИБС), плановая госпитализация с целью выполнения эндоваскулярной реваскуляризации миокарда, подписанное информированное согласие на участие в исследование. Критерии исключения: отказ пациента от участия в исследовании. Исходы плановых ЧКВ были оценены через 4 года посредством телефонного интервью. Первичной конечной точкой была смерть от сердечно-сосудистых причин. Вторичными конечными точками была смерть от всех причин, острый коронарный синдром (ОКС), острое нарушение мозгового кровообращения, большие кровотечения, тромбоз и рестеноз любых стентов, в т.ч. и установленных ранее, клинически значимые нарушения ритма сердца, а также острые осложнения ЧКВ (технические и клинические, как общие, так и в месте пункции артерии). ОПМ диагностировалось при повышении кардиоспецифических ферментов (МВ фракции креатинфосфокиназы (КФК-МВ) и тропонина I) выше верхней границы нормы. Перипроцедурное ОПП диагностировалось на основании критериев KDIGO 2012г. Также была оценена частота выраженного снижения скорости клубочковой фильтрации (СКФ) от исходного значения (≥30%) в течение 48 ч после индексного ЧКВ.
Для проведения генетического исследования у пациентов забирали 1 мл венозной крови в вакутейнеры с ЭДТА. ДНК выделяли из лейкоцитов периферической крови с помощью коммерческого набора "Wizard Genomic DNA Purification Kit" (Promega, США). У пациентов определяли полиморфный вариант INS/DEL (I/D, rs1799752, rs4646994) гена ACE методом полимеразной цепной реакции с использованием коммерческого набора ООО НПФ "Литех" (Россия, http://www.lytech.ru/), включающего праймеры и необходимые для амплификации реактивы.
Для статистических расчетов использовалась программа STATISTICA 10. Для оценки характера распределения вариант применяли критерий Колмогорова-Смирнова с поправкой Лиллиефорса. Количественные данные представлены как M±SD, где M — среднее арифметическое, SD — стандартное отклонение, min — минимальное абсолютное значение показателя, max — максимальное абсолютное значение показателя, или в виде Me (Q1-Q3), где Me — медиана, Q1 и Q3 — нижний и верхний квартили. Для сравнения категориальных переменных мы использовали критерий хи-квадрат с поправкой на непрерывность, когда это было уместно, точный критерий Фишера для пропорций. Для сравнения количественных переменных — критерий Стьюдента или критерий Краскела-Уоллиса, когда это было необходимо. В онлайн-программе Tests for deviation from Hardy-Weinberg equilibrium and tests for association (электронный ресурс http://ihg.gsf.de/ihg/ snps.html; Institute of Human Genetics, German) при помощи Z-теста оценивали риск развития острых или отдаленных осложнений ЧКВ по показателю отношения шансов (ОШ) и проверяли распределение частот генотипов исследуемых полиморфизмов на соответствие равновесию Харди-Вейнберга при помощи критерия χ2 Пирсона. Критический уровень значимости p считали равным 0,05.
Исследование было выполнено в соответствии со стандартами надлежащей клинической практики (Good Clinical Practice) и принципами Хельсинкской декларации. Протокол исследования был одобрен этическими комитетами всех участвующих клинических центров. До включения в исследование у всех участников было получено письменное информированное согласие.
Результаты
Генотип II выявлен у 71 (24,8%) пациента, генотип ID — у 126 (44,1%), генотип DD — у 89 (31,1%) пациентов. Частоты аллелей I и D составили 47% и 53%, соответственно. Распределение частот генотипов соответствовало равновесию Харди-Вайнберга (p=0,051).
Клинико-анамнестическая характеристика пациентов в зависимости от полиморфизмов варианта I/D гена ACE представлена в таблице 1.
Таблица 1
Клинико-анамнестическая характеристика пациентов

Сокращения: АГ — артериальная гипертензия, АКШ — аорто-коронарное шунтирование, ИМТ — индекс массы тела, МКШ — маммаро-коронарное шунтирование, МФА — мультифокальный атеросклероз, ОНМК — острое нарушение мозгового кровообращения, ОТ — окружность талии, ПИКС — постинфарктный кардиосклероз, СД — сахарный диабет, ССЗ — сердечно-сосудистые заболевания, СКФ (CKD-EPI) — скорость клубочковой фильтрации, оцененная с помощью уравнения, разработанного Сотрудничеством по эпидемиологии хронического заболевания почек, ТИА — транзиторная ишемическая атака, ФП — фибрилляция предсердий, ХОБЛ — хроническая обструктивная болезнь легких, ФК — функциональный класс, ХСН — хроническая сердечная недостаточность, ЧКВ — чрескожные коронарные вмешательства, NYHA — стадии ХСН по функциональной классификации Нью-Йоркской ассоциации сердца.
Пациенты с генотипом II имели существенно меньшую окружность талии, чаще страдали сопутствующими хронической обструктивной болезнью легких, клинически значимым атеросклерозом сонных артерий и имели более высокие значения индекса коморбидности Чарлсона. Статистически значимых различий в сопутствующей терапии у пациентов с различными генотипами варианта I/D не было.
Характеристика поражения коронарных артерий по данным коронароангиографии, а также исходные показатели глобальной и локальной сократимости ЛЖ по данным трансторакального ультразвукового исследования сердца в зависимости от полиморфизмов варианта I/D гена ACE представлены в таблице 2.
Таблица 2
Характеристика поражения коронарных артерий и сократительной функции ЛЖ по данным коронароангиографии и эхокардиографии
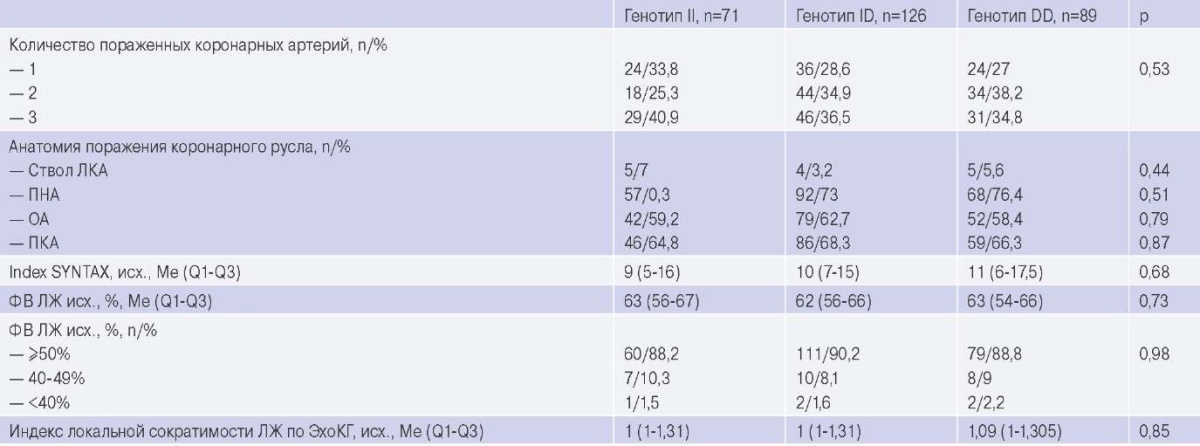
Сокращения: ЛЖ — левый желудочек, ЛКА — левая коронарная артерия, ОА — огибающая артерия, ПКА — правая коронарная артерия, ПНА — передняя нисходящая артерия, ФВ — фракция выброса, ЭхоКГ — эхокардиография.
Различий в распространенности поражения коронарных артерий и исходном состоянии сократимости ЛЖ между подгруппами пациентов с различными генотипами выявлено не было.
Характеристика выполненных ЧКВ представлена в таблице 3. Различий в объеме и характеристиках выполненных ЧКВ между подгруппами пациентов с различными генотипами не было.
Таблица 3
Характеристика ЧКВ
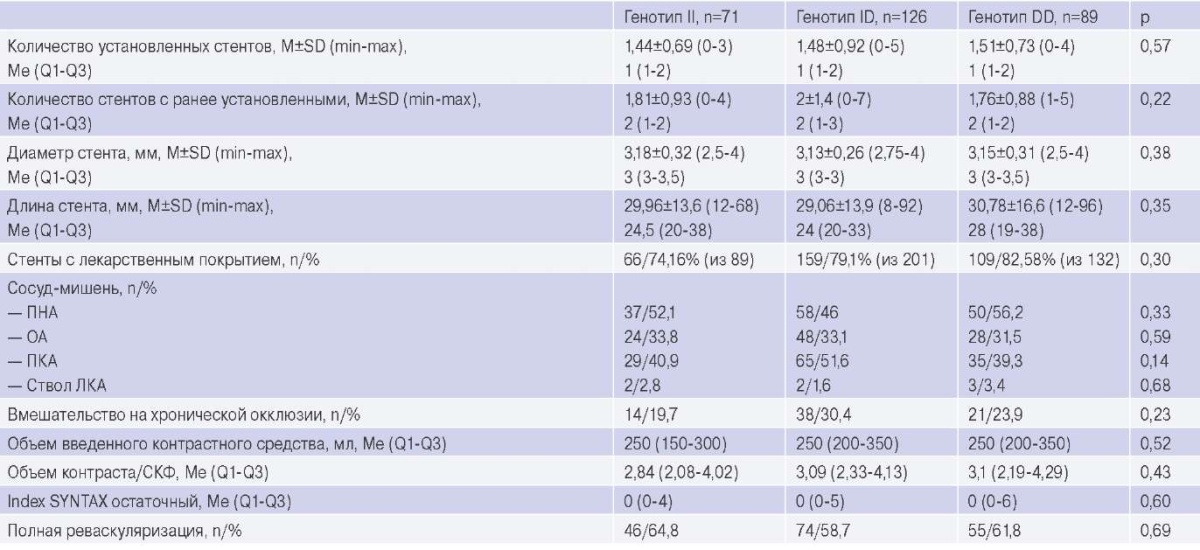
Сокращения: ЛКА — левая коронарная артерия, ОА — огибающая артерия, ПКА — правая коронарная артерия, ПНА — передняя нисходящая артерия, СКФ — скорость клубочковой фильтрации.
Были зарегистрированы следующие острые перипроцедурные осложнения. Интенсивные ангинозные боли во время выполнения ЧКВ, потребовавшие назначения антиангинальных препаратов, были зарегистрированы у 24,5% пациентов. Клинически значимое повышение артериального давления, потребовавшее назначения дополнительной гипотензивной терапии, произошло у 4,7% больных. ОПМ было выявлено у 30,4% пациентов. Острый инфаркт миокарда (ИМ) 4а типа развился у 3,1% пациентов. Существенное снижение СКФ (более чем на 30% от исходного значения) в рамках перипроцедурного ОПП было диагностировано у 6,5% больных. Через 4 года после индексного ЧКВ смерть от сердечно-сосудистых причин составила 3,6%, смерть от любых причин — 5,1%. ОКС в течение периода наблюдения развился у 15,2%, острое нарушение мозгового кровообращения — у 5,4% пациентов. Тромбозы стентов (не только индексных) были выявлены у 10%, а рестенозы с сужением просвета сосуда ≥30% — у 21,8% пациентов. Частота острых осложнений ЧКВ в зависимости от полиморфизма I/D гена ACE представлена в таблице 4.
Таблица 4
Острые осложнения плановых ЧКВ
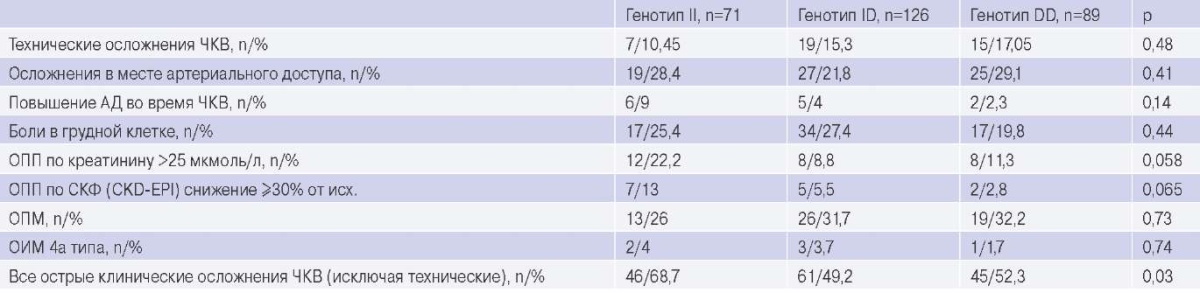
Сокращения: АД — артериальное давление, ОИМ — острый инфаркт миокарда, ОПМ — острое повреждение миокарда, ОПП — острое повреждение почек, СКФ (CKD-EPI) — скорость клубочковой фильтрации, оцененная с помощью уравнения, разработанного Сотрудничеством по эпидемиологии хронического заболевания почек, ЧКВ — чрескожное коронарное вмешательство.
Плановые ЧКВ у пациентов с генотипом II, включенных в наше исследование, чаще осложнялись развитием ОПП и вообще любыми острыми клиническими осложнениями, кроме технических, а также кроме ОПМ.
Отдаленные исходы, оцененные через 4 года после плановой эндоваскулярной реваскуляризации миокарда у пациентов с хроническим коронарным синдромом, представлены в таблице 5. По данным коронароангиографии у пациентов с генотипом II гена ACE значимо чаще выявлялся тромбоз стентов. В отношении других отдаленных осложнений плановых ЧКВ подгруппы пациентов с вариантами I/D гена ACE между собой существенно не различались.
Таблица 5
Отдаленные исходы (через 4 года) после индексного ЧКВ
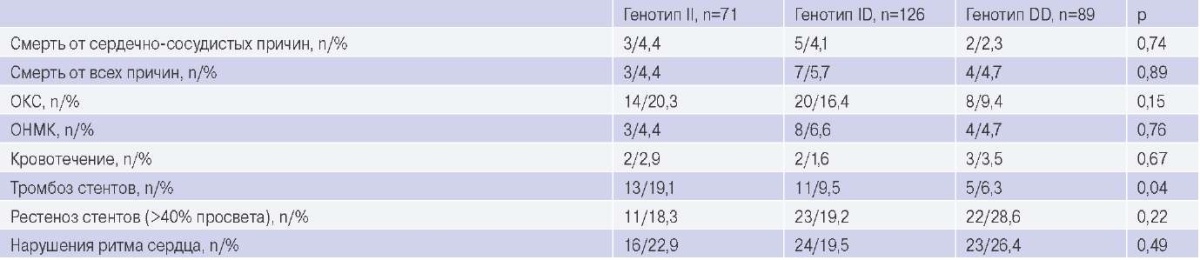
Сокращения: ОКС — острый коронарный синдром, ОНМК — острое нарушение мозгового кровообращения.
Влияние полиморфизма I/D гена ACE на развитие вторичных конечных точек после планового ЧКВ представлено в таблице 6. Оказалось, что присутствие аллеля I и генотипа II варианта I/D гена ACE ассоциировано с риском развития острых клинических осложнений плановых ЧКВ, перипроцедурного ОПП, а также риском тромбоза стентов и развитием ОКС при сроке наблюдения 4 года.
Таблица 6
Влияние полиморфизмов варианта I/D гена ACE на развитие вторичных конечных точек
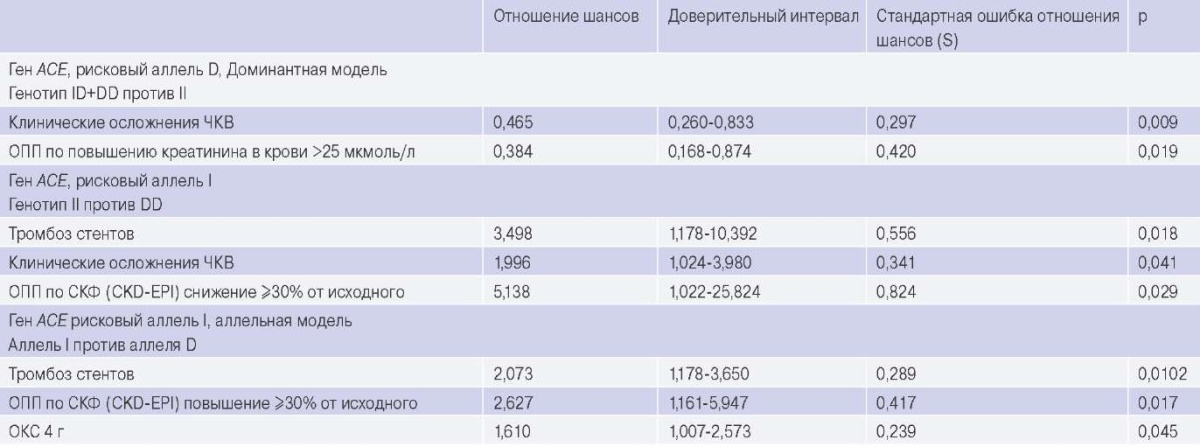
Сокращения: ОКС — острый коронарный синдром, ОПП — острое повреждение почек, СКФ (CKD-EPI) — скорость клубочковой фильтрации, оцененная с помощью уравнения, разработанного Сотрудничеством по эпидемиологии хронического заболевания почек, ЧКВ — чрескожные коронарные вмешательства.
Обсуждение
Частоты генотипов II (25%), ID (44%) и DD (31%) в нашем исследовании были пограничны по отношению к частотам, предсказанным равновесием Харди-Вайнберга (р=0,051). В этом смысле распределение генотипов, наблюдаемое в нашей выборке пациентов с хронической ИБС на фоне клинически значимых стенозов коронарных артерий, несколько отличалось от такового в опубликованной ранее популяции пациентов, пролеченных ЧКВ и протестированных на полиморфизм I/D гена ACE (II, 20%; ID, 51% и DD, 29% генотипов; p=0,28 — отсутствие отклонения от равновесия Харди-Вайнберга) [15]. Кроме того, распределение генотипов у женщин, включенных в наше исследование (р=0,004; II — 19 (30,2%), ID — 20 (31,7%), DD — 24 (38,1%)) отличается от распределения генотипов в популяции женщин, постоянно проживающих на территории среднеурбанизированного города Западной Сибири и не страдающих сердечно-сосудистыми заболеваниями, которое составило 37 (26,8%) для генотипа II, 66 (47,8%) ID, 35 (25,4%) DD, р=0,61 [16].
Анализ данных большинства Европейских исследований продемонстрировал почти равное распределение аллелей I и D гена ACE. В отличие от Европы, среди африканской популяции частота аллеля D была почти в 2 раза больше, чем аллеля I [17]. В США неиспаноязычное чернокожее население имеет более высокую частоту аллеля D по сравнению с белой неиспаноязычной и мексиканской популяциями. Частота аллеля D была увеличена по сравнению с аллелем I и в арабской популяции стран Ближнего Востока. Наоборот, повышенная частота аллеля I наблюдалась в выборочных популяциях Азии (Индия, Пакистан, Непал, Таджикистан и Шри-Ланка), Океании, Восточной Азии (Китай, Япония, Корея) и стран Южной Америки [18].
I/D-полиморфизм оказался тесно связан со многими наиболее серьезными и распространенными заболеваниями легких, включая хроническую обструктивную болезнь легких, легочную гипертензию, а стму, острое повреждение легких, рак легких, легочный саркоидоз, и недавно было показано, что он влияет на течение новой коронавирусной инфекции (COVID-19), а также восприимчивость к SARSCoV2 [19][20]. Наличие аллеля I в генотипе человека (II или ID) также сильно коррелирует с повышенным риском никотиновой зависимости при курении табака у мужчин, больных раком легких, у которых риск примерно в 5 раз выше, чем у носителей генотипа DD [21].
Кроме того, генотип ACE может быть связан с различиями в реакции на мышечную нагрузку. В исследовании 70 физически активных субъектов, выполняющих физические упражнения, самым сильным независимым фактором, определяющим пиковые уровни КФК-МВ, был генотип II, связанный с большим повышением уровня КФК-МВ (скорректированное ОШ 1,3; 95% доверительный интервал (ДИ): 1,03-1,64; p=0,02) [22]. По данным других авторов аллель D оказался связан с силовыми/спринтерскими характеристиками, а аллель I — со спортом на выносливость [23].
Таким образом, распространенность аллелей D и I в популяциях во всем мире предполагает, что они оба могли иметь разные преимущества в выживании. Аллель I может быть связан с улучшением выносливости и повышенным использованием кислорода как во время физических упражнений, так и во время болезни. Аллель D может давать преимущества, связанные непосредственно с силой как таковой, а также с увеличением мышечной массы в ответ на силовые тренировки или высокие нагрузки. Таким образом, генотип ACE влияет на множество фенотипов, которые могут оказывать влияние на эволюционный отбор, помимо тех, которые проявляются только через "фенотипы приспособленности".
Что касается связи сердечно-сосудистых заболеваний с полиморфизмом I/D, то опубликованные результаты исследований противоречивы. Проведен метаанализ 15 опубликованных исследований, содержащих 3394 случая острого ИМ и 5479 контролей [24]. Среднее ОШ развития ИМ для генотипов DD по сравнению с генотипами ID/II во всех исследованиях составило 1,26 (95% ДИ: 1,15-1,39; p<0,0001), а в японской популяции ОШ составило 2,55 (95% ДИ: 1,75-3,70), что подтвердило связь аллеля D с риском ИМ. Еще один метаанализ, в котором приняли участие >10 тыс. участников, пришел к выводу, что генотип DD увеличивает риск ИМ на 10% [25]. Однако исследование PROGRESS не выявило общей связи между ИМ и генотипом ACE. Авторы показали, что с учетом расового происхождения не обнаружено связи между генотипами ACE и историей цереброваскулярных заболеваний или сердечно-сосудистыми факторами риска, включая исходное артериальное давление. Генотип ACE не был связан с долгосрочными рисками инсульта, сердечных событий, смертности, деменции или снижения когнитивных функций. Точно так же не было доказательств того, что генотип ACE изменял относительные преимущества терапии на основе ингибиторов ACE по сравнению с плацебо [26]. Также результаты большого проспективного исследования не подтвердили роль генотипа ACE как маркера долгосрочного риска неблагоприятных событий у пациентов с установленной ИБС, нуждающихся в ЧКВ [15].
Нами выявлена ассоциация полиморфизма I/D с развитием ОКС в течение 4 лет после индексного ЧКВ. ОШ для рискового аллеля I составило 1,61 (95% ДИ: 1,007-2,573; p<0,045).
Далее, мы получили ассоциацию полиморфизма I/D с тромбозом стентов. Действительно в ряде работ была выявлена взаимосвязь этого варианта гена ACE с маркерами гемостаза и острыми геморрагическими или тромботическими осложнениями. Так, метаанализ 53 исследований подтвердил риск развития геморрагического инсульта из-за полиморфизма I/D гена ACE у взрослых, принадлежащих к азиатской этнической популяции. Кроме того, этот генотип также связан с риском развития внутримозгового кровоизлияния в азиатских популяциях. Таким образом, был сделан вывод, что генотип ACE и его полиморфизмы могут быть потенциальными биомаркерами при оценке риска геморрагического инсульта у взрослого азиатского населения [27].
Классический взгляд на ренин-ангиотензиновую систему (РАС) как на системный протеолитический каскад, ведущий к синтезу циркулирующего ангиотензина II (Аng II), существенно изменился за последние несколько десятилетий благодаря открытию локальной РАС в нескольких органах и тканях, включая почки [28]. Внутрипочечная экспрессия всех компонентов РАС и наблюдение, что внутриканальцевые уровни Аng II значительно превышают концентрацию в плазме, позволяют предположить, что синтез почечного Аng II происходит независимо от циркулирующих компонентов РАС [29]. ACE также широко экспрессируется во всем нефроне, включая гломерулярный эндотелий, мезангиальные клетки, подоциты. Щеточная кайма проксимального канальца является местом его наивысшей экспрессии в почках [30].
Существует прочная связь между внутрипочечным ACE и ОПП. На физиологическое действие ACE при развитии ОПП также влияют генетические варианты, регулирующие его уровни в плазме и тканях. Именно полиморфизмы вставки/делеции (I/D) гена ACE связаны с уязвимостью к развитию ОПП. Обнаружена значительная связь между аллелем D гена ACE и повышенным риском послеоперационного ОПП после аортокоронарного шунтирования [31]. И наоборот, в другом исследовании утверждается, что генотип II связан с более высокой уязвимостью к ОПП и заместительной почечной терапии [14]. Эти авторы показали, что повышенный риск ОПП, вызванный генотипом II, может быть связан со снижением внутриклубочкового давления, вторичным по отношению к снижению почечного кровотока. Это усугубляется более низким уровнем циркулирующего ACE, что приводит к сопутствующей вазодилатации эфферентной стороны клубочковой циркуляции. Таким образом, текущие исследования ассоциации полиморфизма I/D не могут предоставить окончательных выводов о связи генетических вариаций ACE с ОПП [32]. В нашем исследовании мы документировали ассоциацию аллеля I и генотипа II с более частым развитием перипроцедурного ОПП и с более выраженным снижением СКФ в постпроцедурный период.
Аллель D гена ACE является основным фактором риска рестеноза после коронарного стентирования [33]. Это заключение расходится с другими авторами, которые пришли к выводу, что полиморфизм I/D гена ACE не связан с рестенозом после установки коронарного стента [34]. Наконец, исследование PARIS продемонстрировано успешное предотвращение рестеноза стента за счет ингибирования ACE [35]. Нами также не выявлена ассоциация рестенозов стентов с полиморфизмом I/D гена ACE.
Неоднозначные результаты исследований подчеркивают концепцию о том, что другие важные факторы могут преодолеть общее влияние конкретного полиморфизма одного гена, такого как полиморфизм I/D гена ACE. В настоящее время в большинстве опубликованных исследований используется подход, основанный на отдельных генах-кандидатах, что существенно ограничивает интерпретацию результатов. В будущем исследования, способные анализировать тысячи полиморфизмов всего генома (GWAS) у большого количества людей, разного возраста, разных этнических групп и разных географических районов, помогут расширить имеющиеся знания о генетических фенотипах пациентов с хроническими неинфекционными заболеваниями.
Заключение
У больных хронической ИБС и выполненным плановым ЧКВ присутствие аллеля I и генотипа II варианта I/D гена ACE ассоциировано с риском развития острых клинических осложнений плановых ЧКВ, перипроцедурного ОПП, а также риском тромбоза стентов и развитием ОКС при сроке наблюдения 4 года после индексного ЧКВ.
Отношения и деятельность. Работа выполнена в рамках Государственного задания #122020300040-0.
Список литературы
1. Вершинина Е.О., Репин А.Н. Контраст-индуцированное острое повреждение почек при плановых эндоваскулярных вмешательствах на коронарных артериях. Клиническая медицина. 2017;95(12):1086-93. doi:10.18821/0023-2149-2017-95-12-1086-1093.
2. Вершинина Е.О., Репин А.Н. Отдаленные исходы плановых эндоваскулярных вмешательств на коронарных артериях. Кардиология. 2018;58(7):5-13. doi:10.18087/cardio.2018.7.10137.
3. Вершинина Е.О., Репин А.Н. Оценка риска отдалённых неблагоприятных сердечно-сосудистых событий после плановых чрескожных коронарных вмешательств. Кардиология. 2018;58(S5):45-53 doi:10.18087/cardio.2446.
4. Cardinal-Fernandez P, Ferruelo A, Martin-Pellicer A, et al. Genetic determinants of acute renal damage risk and prognosis: A systematic review. Med. Intensiva. 2012;36:626-33. doi:10.1016/j.medin.2012.02.002.
5. Soubrier F, Alhenc-Gelas F, Hubert C, et al. Two putative active centers in human angiotensin I-converting enzyme revealed by molecular cloning. Proc. Natl. Acad. Sci. USA. 1988;85:9386-90. doi:10.1073/pnas.85.24.9386.
6. Rieder MJ, Taylor SL, Clark AG, et al. Sequence variation in the human angiotensin converting enzyme. Nat Genet. 1999;22(1):59-62. doi:10.1038/8760.
7. Rigat B, Hubert C, Alhenc-Gelas F, et al. An insertion/deletion polymorphism in the angiotensin I-converting enzyme gene accounting for half the variance of serum enzyme levels. J Clin Invest. 1990;86(4):1343-6. doi:10.1172/JCI114844.
8. Agerholm-Larsen B, Tybjærg-Hansen A, Schnohr P, Nordestgaard BG. ACE gene polymorphism explains 30-40% of variability in serum ACE activity in both women and men in the population at large: the Copenhagen City Heart Study. Atherosclerosis. 1999;147:425-7. doi:10.1016/s0021-9150(99)00195-1.
9. Kato N, Tatara Y, Ohishi M, et al. Angiotensin-converting enzyme single nucleotide polymorphism is a genetic risk factor for cardiovascular disease: a cohort study of hypertensive patients. Hypertens. 2011;34(6):728-34. doi:10.1038/hr.2011.28.
10. Deng Y, Rapp JP. Cosegregation of blood pressure with angiotensin converting enzyme and atrial natriuretic peptide receptor genes using Dahl salt-sensitive rats. Nat Genet. 1992;1:267-72. doi:10.1038/ng0792-267.
11. Schunkert H, Hense HW, Holmer SR, et al. Association between a deletion polymorphism of the angiotensin-converting–enzyme gene and left ventricular hypertrophy. N Engl J Med. 1994;330:1634-8. doi:10.1056/NEJM199406093302302.
12. Hadjadj S, Belloum R, Bouhanick B, et al. Prognostic value of angiotensin-I converting enzyme I/D polymorphism for nephropathy in type 1 diabetes mellitus: A prospective study. J Am Soc Nephrol. 2001;12:541-9. doi:10.1681/ASN.V123541.
13. Marshall RP, Webb S, Bellingan GJ, et al. Angiotensin converting enzyme insertion/deletion polymorphism is associated with susceptibility and outcome in acute respiratory distress syndrome. Am J Respir Crit Care Med. 2002;166:646-50. doi:10.1164/rccm.2108086.
14. du Cheyron D, Fradin S, Ramakers M, et al. Angiotensin converting enzyme insertion/ deletion genetic polymorphism: Its impact on renal function in critically ill patients. Crit Care Med. 2008;36;12:3178-83. doi:10.1097/CCM.0b013e318186a299.
15. Hamon M, Fradin S, Denizet A, et al. Prospective evaluation of the effect of an angiotensin I converting enzyme gene polymorphism on the long-term risk of major adverse cardiac events after percutaneous coronary intervention. Heart. 2003;89:321-5. doi:10.1136/heart.89.3.321.
16. Муслимова Э. Ф, Реброва Т.Ю., Серебрякова В.Н. и др. Ассоциация полиморфизмов генов ACE, NOS3, ITGB3 и P2RY12 с уровнем общего холестерина и глюкозы у женщин трудоспособного возраста Западно-Сибирского региона. Дальневосточный медицинский журнал. 2015;2:78-84.
17. Staessen JA, Ginocchio G, Wang JG, et al. Genetic variability in the renin-angiotensin system: prevalence of alleles and genotypes. J Cardiovasc Risk. 1997;4:401-22.
18. Ned RM, Yesupriya A, Imperatore G, et al. The ACE I/D polymorphism in US adults: limited evidence of association with hypertension-related traits and sex-specific effects by race/ ethnicity. Am J Hypertens. 2012;25(2):209-15. doi:10.1038/ajh.2011.182.
19. Pabalan N, Tharabenjasin P, Suntornsaratoon P, et al. Ethnic and age-specific acute lung injury/acute respiratory distress syndrome risk associated with angiotensinconverting enzyme insertion/deletion polymorphisms, implications for COVID-19: A meta-analysis. Infect Genet Evol. 2021;88:104682. doi:10.1016/j.meegid.2020.104682.
20. Delanghe JR, Speeckaert MM, De Buyzere ML. The host’s angiotensin-converting enzyme polymorphism may explain epidemiological findings in COVID-19 infections. Clin Chim Acta. 2020;505:192-3. doi:10.1016/j.cca.2020.03.031.
21. Nadalin S, Flego V, Pavlić SD, et al. Association between the ACE-I/D polymorphism and nicotine dependence amongst patients with lung cancer. Biomed Rep. 2020;13(6):58. doi:10.3892/br.2020.1365.
22. Yamin C, Amir O, Sagiv M, et al. ACE ID genotype affects blood creatine kinase response to eccentric exercise. J Appl Physiol. 2007;103(6):2057-61. doi:10.1152/japplphysiol.00867.2007.
23. Tsianos G, Sanders J, Dhamrait S, et al. The ACE gene insertion/deletion polymorphism and elite endurance swimming. Eur J Appl Physiol. 2004;92(3):360-2. doi:10.1007/s00421-004-1120-7.
24. Samani NJ, Thompson JR, O’Toole L, et al. Ameta-analysis of the association of the deletion allele of the angiotensin-converting enzyme gene with myocardial infarction. Circulation. 1996;94(4):708-12. doi:10.1161/01.cir.94.4.708.
25. Keavney B, McKenzie C, Parish S, et al. Large-scale test of hypothesised associationsin between the angiotensin-converting-enzyme insertion/deletion polymorphism and myocardial infarction in about 5000 cases and 6000 controls. International Studies of Infarct Survival (ISIS) Collaborators. Lancet. 2000;355(9202):434-42. doi:10.1016/s0140-6736(00)82009-7.
26. Harrap SB, Tzourio С, Cambien F, et al. for the PROGRESS Collaborative Group. The ACE Gene I/D Polymorphism Is Not Associated With the Blood Pressure and Cardiovascular Benefits of ACE Inhibition. Hypertension. 2003;42:297-303. doi:10.1161/01.HYP.0000088322.85804.96.
27. Jablonski LK, Chonchol M. Recent advances in the management of hemodialysis patients: a focus on cardiovascular disease. F1000Prime Reports. 2014;6:72. doi:10.12703/P6-72.
28. Pontremoli R, Ravera M, Viazzi F, et al. Genetic polymorphism of the renin-angiotensin system and organ damage in essential hypertension. Kidney Int. 2000;57:561-9. doi:10.1046/j.1523-1755.2000.00876.x.
29. Corvol P, Williams TA, Soubrier F. Peptidyl dipeptidase A: angiotensin I-converting enzyme. Methods Enzymol. 1995;248:283-305. doi:10.1016/0076-6879(95)48020-x.
30. Gonzalez-Villalobos RA, Janjoulia T, Fletcher NK, et al. The absence of intrarenal ACE protects against hypertension. J. Clin. Invest. 2013;123:2011-23. doi:10.1172/JCI65460.
31. Isbir SC, Tekeli A, Ergen A, et al. Genetic polymorphisms contribute to acute kidney injury after coronary artery bypass grafting. Heart Surg. Forum. 2007;10:E439-E444. doi:10.1532/HSF98.20071117.
32. Vilander LM, Kaunisto MA, Pettila V. Genetic predisposition to acute kidney injury–a systematic review. BMC Nephrol. 2015;16:197. doi:10.1186/s12882-015-0190-6.
33. Amant C, Bauters C, Bodart JC, et al. D allele of the angiotensin I-converting enzyme is a major risk factor for restenosis after coronary stenting. Circulation. 1997;96(1):56-60. doi:10.1161/01.cir.96.1.56.
34. Koch W, Kastrati A, Mehilli J, et al. Insertion/deletion polymorphism of the angiotensin I-converting enzyme gene is not associatedwith restenosis after coronary stent placement. Circulation. 2000;102(2):197-202. doi:10.1161/01.cir.102.2.197.
35. Meurice T, Bauters C, Hermant X, et al. Effect of ACE inhibitors on angiographic restenosis after coronary stenting (PARIS): a randomised, double-blind, placebo-controlled trial. Lancet. 2001;357(9265):1321-4. doi:10.1016/s0140-6736(00)04518-9.
Об авторах
Е. О. НалесникРоссия
Налесник Елена Олеговна — кандидат медицинских наук, научный сотрудник отделения общеклинической кардиологии и эпидемиологии сердечно-сосудистых заболеваний
634012, г. Томск, ул. Киевская, 111а
Э. Ф. Муслимова
Россия
Муслимова Эльвира Фаритовна — кандидат медицинских наук, научный сотрудник лаборатории молекулярно-клеточной патологии и генодиагностики
634012, г. Томск, ул. Киевская, 111а
С. А. Афанасьев
Россия
Афанасьев Сергей Александрович — доктор медицинских наук, профессор, заведующий лабораторией молекулярно-клеточной патологии и генодиагностики
634012, г. Томск, ул. Киевская, 111а
А. Н. Репин
Россия
Репин Алексей Николаевич — доктор медицинских наук, профессор, заведующий отделением общеклинической кардиологии и эпидемиологии сердечно-сосудистых заболеваний
634012, г. Томск, ул. Киевская, 111а
Дополнительные файлы
Рецензия
Для цитирования:
Налесник Е.О., Муслимова Э.Ф., Афанасьев С.А., Репин А.Н. Ассоциация полиморфизмов гена ACE с сердечно-сосудистыми осложнениями у пациентов, перенесших плановые чрескожные коронарные вмешательства. Российский кардиологический журнал. 2022;27(10):4968. https://doi.org/10.15829/1560-4071-2022-4968
For citation:
Nalesnik E.O., Muslimova E.F., Afanasiev S.A., Repin A.N. Association of ACE gene polymorphisms with cardiovascular events in patients after elective percutaneous coronary interventions. Russian Journal of Cardiology. 2022;27(10):4968. (In Russ.) https://doi.org/10.15829/1560-4071-2022-4968
JATS XML

















































