Перейти к:
Роль активности эргорефлекса в патогенезе хронической сердечной недостаточности. Эффективность физической реабилитации
https://doi.org/10.15829/1560-4071-2022-4937
Аннотация
Цель. Оценить изменение активности эргорефлекса (ЭРф) у больных с хронической сердечной недостаточностью (ХСН) на фоне сниженной систолической функции левого желудочка в исследовании эффективности курса физических тренировок (ФТ), режим которых рассчитывали по оригинальной методике, по сравнению с ФТ, режим которых рассчитывали традиционно.
Материал и методы. Одноцентровое открытое исследование 297 пациентов с ХСН III функционального класса (ФК). Больных распределяли в две группы: основную (ОГ), пациентам которой интенсивность ФТ рассчитывали на основании определения лактатного порога (ЛП); и группу сравнения (ГС), пациентам которой расчет интенсивности нагрузки осуществляли согласно существующим рекомендациям, на основании 60% VO2peak. Выполнен анализ 1) активности ЭРф, 2) связи ЭРф с толерантностью к физической нагрузке (ТФН), рутинными маркерами системного воспаления, клиническими проявлениями ХСН, 3) ТФН на основании оценки поглощения кислорода на пике ФН (VO2peak).
Результаты. Увеличение скорости ходьбы на уровне ЛП после 3 мес. ФТ зарегистрировано у 94% (210 человек) ОГ. В ГС через 3 мес. режим ФТ пересчитывали по 60% VO2peak, увеличение скорости ходьбы на этом уровне после 3 мес. ФТ зарегистрировано у 70% больных ГС (35 человек). Выраженность ХСН уменьшилась в обеих группах, но динамика была более явной в ОГ, где II ФК достигли 75% пациентов (в ГС — 44%, р=0,003). В ОГ в большей степени, чем в ГС, увеличилась ТФН. Активность ЭРф (по ΔVE) снизилась на ≥15% у 230 (97%) больных ОГ и у 31 (63%) больного ГС. После завершения периода ФТ, когда у части пациентов ФК ХСН снизился до II (NYHA), была выявлена прямая ассоциация величины ЭРф (по ΔVE) с большей выраженностью ХСН (r=-0,57, p=0,01) и связи между снижением активности ЭРф (по ΔVE), повышением показателей VO2ЛП (r=-0,55, p=0,001), VO2peak (r=0,49, p=0,001), снижением содержания моноцитов (r=0,63, p=0,01).
Заключение. У пациентов с ХСН III ФК, находящихся в стабильном состоянии и получающих максимально возможную болезнь-модифицирующую терапию, активность ЭРф повышена и связана с ФК, ТФН, активностью системного воспаления. В ходе физической реабилитации уменьшение активности ЭРф сопровождается снижением ФК, повышением ТФН, более выраженным на фоне персонифицированных аэробных тренировок, режим которых рассчитывали с помощью определения ЛП.
Ключевые слова
Для цитирования:
Лелявина Т.А., Ситникова М.Ю., Галенко В.Л., Борцова М.А. Роль активности эргорефлекса в патогенезе хронической сердечной недостаточности. Эффективность физической реабилитации. Российский кардиологический журнал. 2022;27(6):4937. https://doi.org/10.15829/1560-4071-2022-4937
For citation:
Lelyavina T.A., Sitnikova M.Yu., Galenko V.L., Bortsova M.A. Role of ergoreflex activity in the pathogenesis of heart failure. The effectiveness of physical rehabilitation. Russian Journal of Cardiology. 2022;27(6):4937. (In Russ.) https://doi.org/10.15829/1560-4071-2022-4937
Терапевтические стратегии, разработанные на основе нейрогормональной модели патогенеза хронической сердечной недостаточности (ХСН), привели к улучшению выживаемости пациентов, имеющих низкую и промежуточную фракцию выброса (ФВ) левого желудочка (ЛЖ), тем не менее летальность у таких больных остается высокой и составляет 65% в течение 10 лет [1][2]. Одним из мало изученных направлений у больных ХСН является модуляция активности вегетативной нервной системы, при этом часть подходов связана со стимуляцией парасимпатического звена, часть — с подавлением симпатической активности. Многие из этих методов находятся на этапе разработки, а крупномасштабные рандомизированные исследования их эффективности не проводились.
Одним из компонентов вегетативного дисбаланса при сердечной недостаточности (СН) является активированный эргорефлекс (ЭРф), связывающий миопатию при СН и прогрессирование заболевания. Вследствие хронической активации ЭРф, несмотря на ингибирующее действие бета-адреноблокаторов и блокаторов ренин-ангиотензин-альдостероновой системы, нейрогуморальная активация у больных ХСН остается постоянно повышенной [3], поэтому поиск немедикаментозных способов модуляции ЭРф у больных ХСН представляется актуальной задачей. Однако неясно, зависит ли активность ЭРф у больных ХСН от режима физической реабилитации.
Цель исследования: оценить изменение активности ЭРф у больных с ХСН на фоне сниженной систолической функции ЛЖ в исследовании эффективности курса физических тренировок (ФТ), режим которых рассчитывали по оригинальной методике, по сравнению с тренировками, режим которых рассчитывали традиционно.
Материал и методы
Дизайн исследования. Исследование выполнено в соответствии с Хельсинкской декларацией. Одноцентровое открытое исследование, в котором приняли участие 297 больных ХСН III функционального класса (ФК) (212 мужчин). Все пациенты соответствовали критериям включения и подписали информированное согласие.
Расчет требуемого объема выборки для мощности 80% и двустороннего уровня значимости 0,05 при сравнении двух групп производили по таблице по величине d/SD, где d — предварительная оценка величины эффекта (наименьшая разность в средних, которая клинически значима), SD — принятое стандартное отклонение наблюдений, одинаковое в каждой из 2 групп. Расчет требуемого объема выборки выполнили на основании предполагаемых изменений пиковый объем кислорода (VO2peak), ожидаемых на фоне физической реабилитации. Подставив эти данные в таблицу (0,656), получили реальный суммарный объем выборки с учетом выбывания для 2 групп исследования — 98 больных.
Пациентов распределяли методом конвертов 1:4 в две группы: основную (ОГ), пациентам которой интенсивность ФТ рассчитывали на основании определения лактатного порога (ЛП) [2]; и группу сравнения (ГС), пациентам которой расчет интенсивности физической нагрузки (ФН) осуществляли согласно существующим рекомендациям, на основании 60% VO2peak [3][4]. В результате в ОГ вошло 237 больных, в ГС — 60 больных.
Выполнен анализ 1) активности ЭРф, 2) связи ЭРф с толерантностью к ФН (ТФН), рутинными маркерами системного воспаления, клиническими проявлениями СН, 3) ТФН на основании оценки поглощения кислорода на пике ФН (VO2peak).
Критерии включения: наличие ХСН III ФК, установленной >6 мес. до включения [1], указание в анамнезе на ишемическую болезнь сердца или дилатационную кардиомиопатию в качестве причины ХСН, возраст больных 18-65 лет, индекс массы тела — 19-28 кг/м2 — данный диапазон обусловлен необходимостью исключить больных с кахексией и ожирением; стабильное клиническое состояние >2 нед., ФВ ЛЖ <45%, максимально переносимая пациентом болезнь-модифицирующая терапия СН, наблюдение в центре компетенции СН, способность выполнить кардиореспираторный тест (КРТ).
Критерии невключения: перенесенные <6 нед. инфаркт миокарда и тромбоэмболии легочной артерии, и <6 мес. — аортокоронарное шунтирование, острое нарушение мозгового кровообращения; хроническая обструктивная болезнь легких — GOLD 3-4; сахарный диабет; поражение мышц иной этиологии, кроме ХСН; выраженные интеллектуальномнестические нарушения, содержание гемоглобина в крови <121 г/л у женщин и <131 г/л у мужчин; наличие активного воспаления, инфекции; состояние после оперативного вмешательства, острая воспалительная реакция, острая ревматическая лихорадка, инфекционный эндокардит, диффузные заболевания соединительной ткани, заболевания суставов.
Нагрузочный тест. КРТ (аппаратура “Охусоn Рrо” — Jeger, Германия) выполняли на беговой дорожке GE Medical Systems Information Technologies по оригинальному, унифицированному для определения ЛП рамп-протоколу, состоящему из 49 ступеней длительностью 15 сек каждая. В режиме анализа дыхательного цикла “breath by breath” с автоматическим усреднением данных за 10 сек оценивали: объем минутной вентиляции (VE), дыхательный резерв (BR), вентиляторный эквивалент по углекислому газу (VE/VCO2), объем поглощенного кислорода (VO2) [5].
Исследование ЭРф выполняли методом постнагрузочной региональной циркуляторной окклюзии по стандартизованной методике Piepoli M, 1996 [6]. Оценивали диастолическое артериальное давление (ДАД), объем выделенной углекислоты (VCO2), VE.
Исследование содержания лактата венозной крови в покое и при ФН. Перед проведением КРТ исследуемым устанавливался катетер в локтевую вену. Заборы крови осуществляли исходно и каждую минуту во время выполнения ФН. Содержание лактата венозной крови оценивали на портативном газоанализаторе i-STAT (Abbott, США) с помощью наборов картриджей CG4. ЛП фиксировали в момент начала увеличения содержания лактата в крови.
Определение биологического резерва адаптации к ФН. Физиологические этапы включения компенсаторных механизмов при ФН были оценены методом, описанным ранее [7], по изменению уровня лактата и рН венозной крови, изменению VО2, VСО2 и их соотношения (RER=VCO2/VO2), VE, VE/VСO2.
Расчет режима тренировочной ходьбы. Пациентам
ОГ устанавливали скорость тренировочной ходьбы на уровне 95% от скорости, достигнутой на уровне ЛП [2][8], и в течение 12 нед. они ежедневно 60 мин ходили с интенсивностью 95% ЛП; после оценки ЛП через 3 мес. интенсивность ходьбы корректировали. Больные ГС, согласно рекомендациям [3][4], выполняли тренировочную ходьбу 3-5 раз в нед. со скоростью, зарегистрированной на уровне 60% VО2peak. Первые 2 нед. пациенты тренировались под наблюдением кардиолога-специалиста по СН на тредмиле. Затем больные выполняли тренировочную ходьбу в домашних условиях.
Оценка выраженности системного воспаления. Всем пациентам было проведено общеклиническое исследование крови в соответствии с клиническими стандартами. Забор крови производили между 7.00 и 9.00 утра натощак. Число форменных элементов крови определяли на автоматическом гематологическом анализаторе SISMEX XT-1800. Оценку выраженности системного воспаления выполняли с помощью исследования показателей абсолютного количества форменных элементов белой крови. В качестве маркеров воспалительной реакции оценивали абсолютное количество лейкоцитов и моноцитов, по примеру других исследователей [9][10].
Статистическая обработка данных. Обработку полученных данных проводили с помощью прикладных программ Microsoft Excel, Statistica for Windows 10.0, различия считали значимыми при уровне значимости p<0,05. Категориальные показатели описывались частотами и процентами, для анализа применялись критерий хи-квадрат или точный критерий Фишера (в случае малого числа наблюдений). Для количественных данных выполняли проверку нормальности с помощью критерия КолмогороваСмирнова. Количественные переменные, распределение которых не отличается от нормального, описаны через среднее значение и стандартную ошибку среднего. Количественные данные, распределение которых отличается от нормального, описаны при помощи медианы, 25 и 75 квартилей. Для данных, распределение которых отличаются от нормального, использовали критерий Манна Уитни. Для исследования взаимосвязи количественных параметров вычисляли коэффициент корреляции Спирмена, оценивающий меру линейной связи между признаками.
Показатели КРТ наряду с клиническими данными оценивали исходно и через 3 и 9 мес.
Ведение пациентов. Больных включали в исследование при условии стабильного состояния и оптимальной максимально переносимой терапии ХСН. При необходимости корректировались дозы диуретиков. Приверженность к терапии оценивалась лечащим врачом: если пациент был не привержен, ему предлагали досрочно завершить исследование (табл. 1).
Таблица 1
Ход исследования
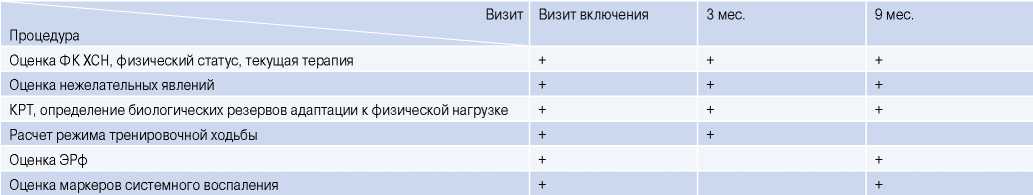
Сокращения: КРТ — кардиореспираторный тест, ФК — функциональный класс, ХСН — хроническая сердечная недостаточность, ЭРф — эргорефлекс.
Первичная конечная точка исследования — динамика активности ЭРф (по ΔVE).
Вторичные конечные точки исследования — динамика выраженности ХСН (ФК NYHA), ТФН (VO2peak).
Критерии ответа на ФТ: снижение активности ЭРф (по ΔVE) ≥15%, повышение VO2peak ≥10% от исходного уровня.
Результаты
Объем выборки составил 297 больных ХСН (мужчин — 71%; средний возраст 55 [ 44; 61]): 237 пациентов в ОГ с ФТ по оригинальной методике, основанной на определении ЛП, 60 пациентов в ГС — тренирующихся по традиционному методу.
Характеристика пациентов представлена в таблице 2.
Таблица 2
Исходные характеристики больных ХСН III ФК
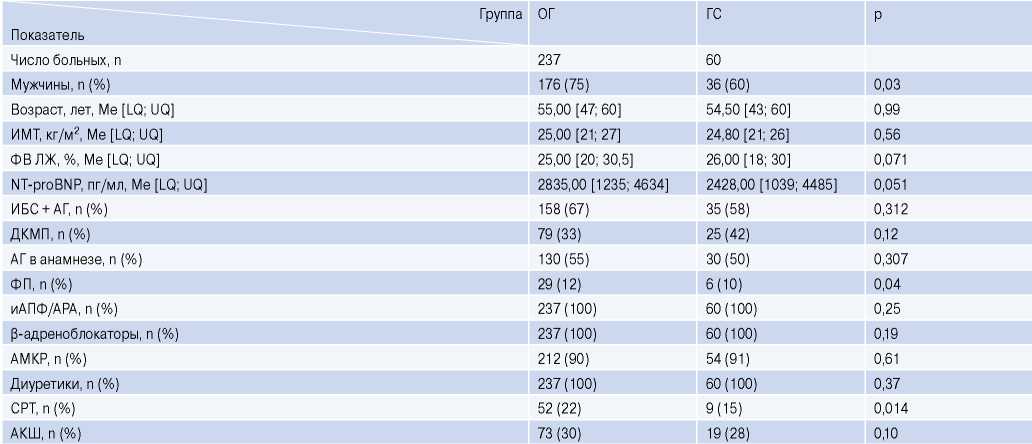
Сокращения: АГ — артериальная гипертензия, АКШ — аортокоронарное шунтирование, АМКР — антагонисты минералокортикоидных рецепторов, АРА — антагонисты рецепторов к ангиотензину II, ГС — группа сравнения, ДКМП — дилатационная кардиомиопатия, иАПФ — ингибиторы ангиотензин-превращающего фермента, ИБС — ишемическая болезнь сердца, ИМТ — индекс массы тела, ЛЖ — левый желудочек, ОГ — основная группа, СРТ — сердечная ресинхронизирующая терапия, ФВ — фракция выброса, ФП — фибрилляция предсердий, Ме — медиана, LQ — нижний квартиль, NT-proBNP — N-терминальный промозговой натрийуретический пептид, UQ — верхний квартиль.
Из 297 больных, исходно включенных в исследование, выбыли 23 человека: 13 больных (5%) — из ОГ, 10 (17%) — из ГС (р=0,02); причины: 10 человек — нежелание продолжать ФТ, 5 — трансплантация сердца, 6 — госпитализация по причинам, не связанным с ХСН, 2 — госпитализация, связанная с декомпенсацией ХСН на фоне острой респираторной вирусной инфекции. Из всех этих больных 10 человек вышли из исследования по причине отсутствия комплаенса: в ОГ — 3 человека, в ГС — 7. Таким образом, завершили исследование в ОГ — 224 (95%), в ГС — 50 (83%) пациентов.
Исходно пациенты в исследуемых группах не отличались по возрасту, индексу массы тела, ФВ ЛЖ. В ОГ исходно было больше мужчин, больше больных после сердечной ресинхронизирующей терапии.
Увеличение скорости ходьбы на уровне ЛП после 3 мес. ФТ зарегистрировано у 94% (210 человек) ОГ. В ГС через 3 мес. режим ФТ пересчитывали по 60% VO2peak, увеличение скорости ходьбы на этом уровне после 3 мес. ФТ зарегистрировано у 70% больных ГС (35 человек).
Результаты ФТ. Выраженность ХСН уменьшилась в обеих группах, но динамика была более явной в ОГ, где II ФК достигли 75% пациентов (в ГС — 44%, р=0,003).
В ОГ в большей степени, чем в ГС, увеличилась ТФН (табл. 3): VO2ЛП повысилось на 24% и 15% (p=0,005), соответственно; и VO2peak — на 45% и на 17%, соответственно (p=0,0017). VO2peak увеличился на ≥10% у 210 (94%) больных ОГ и у 35 (70%) больных ГС. Активность ЭРф (по ΔVE) снизилась на ≥15% у 230 (97%) больных ОГ и у 31 (63%) больного ГС.
Таблица 3
Динамика исследованных показателей в зависимости от вида ФТ
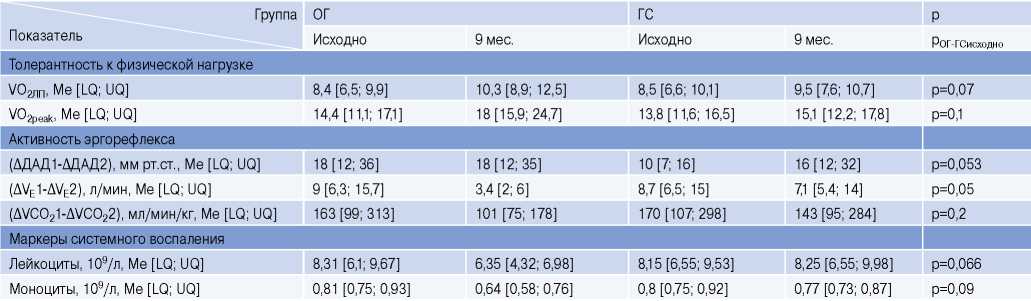
Сокращения: ДАД — диастолическое артериальное давление, LQ — нижний квартиль, Ме — медиана, VE — объем минутной вентиляции, VO2ЛП — объем кислорода, поглощенного на уровне лактатного порога, VO2peak — пиковый объем кислорода, VCO2 — объем выделенной углекислоты, UQ — верхний квартиль, Δ — динамика исследуемых показателей.
В настоящем исследовании прирост VO2ЛП в ходе ФТ сопровождался снижением абсолютного количества моноцитов периферической крови (r=-0,8, p=0,01).
Связь ЭРф и изучаемых показателей. Исходно по результатам корреляционного анализа выявили значимые прямые связи между: активностью ЭРф (по ΔVE) и VO2peak (r=-0,67, p=0,001), ЭРф (по ΔVE) и биологическими резервами адаптации к ФН (VO2ЛП) (r=-0,72, p=0,001), ЭРф (по ΔVE) и абсолютным количеством моноцитов периферической крови (r=0,42, p=0,02). Выявлены слабые, но статистически значимые связи активности ЭРф с возрастом и наличием ФП, r=0,21, p=0,03 и r=0,34, p=0,01, соответственно. Связи выраженности ЭРф и этиологии ХСН (r=0,2, p=0,05), пола (r=0,18, p=0,06), ФВ ЛЖ (r=0,22, p=0,05) не зарегистрировали (рис. 1).
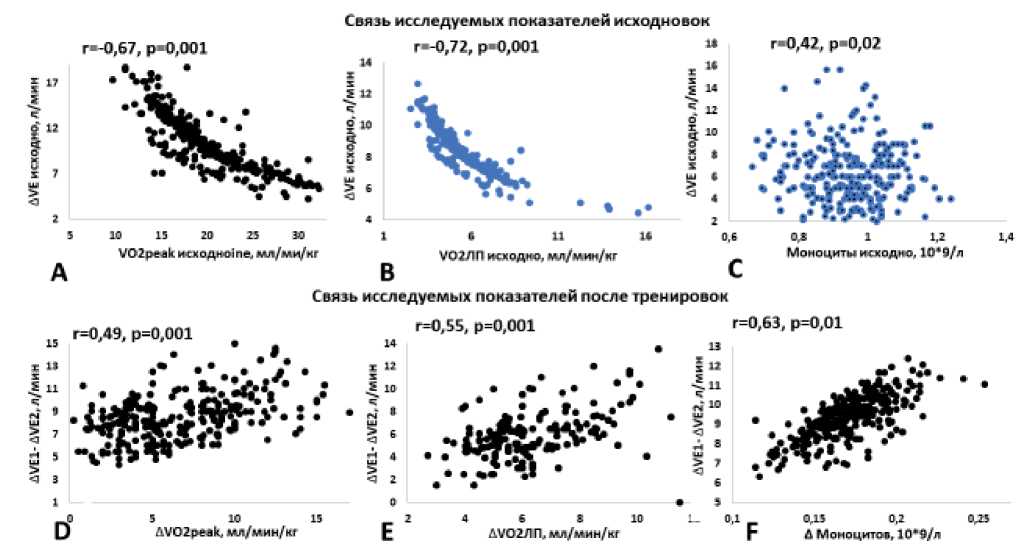
Рис. 1. Связь активности ЭРф с ТФН и активностью системного воспаления исходно и после курса ФТ. Исходно: А — связь активности ЭРф и VO2peak; В — связь активности ЭРф и VO2ЛП; С — связь активности ЭРф и содержания моноцитов в крови. После тренировок: D — связь активности ЭРф и VO2peak; Е — связь активности ЭРф и VO2ЛП; F — связь активности ЭРф и содержания моноцитов в крови.
Сокращения: ΔVE — отражает активность эргорефлекса исходно, (ΔVE1-ΔVE2) — изменение активности эргорефлекса на фоне тренировок, ΔVO2peak и ΔVO2ЛП — изменение толерантности к физическим нагрузкам на фоне тренировок, Δ моноциты — изменение активности системного воспаления на фоне тренировок.
После проведения ФТ у больных ОГ показано более выраженное, по сравнению с больными ГС, снижение активности ЭРф (табл. 3), в ОГ: по уровню ДАД — на 40%, по VE — на 53%, по VCO2 — на 38%, а в ГС — на 21%, 23% и 15%, соответственно (рVE=0,001, рДАД=0,002, pVCO2=0,04) (табл. 3). После завершения периода ФТ, когда у части пациентов ФК ХСН снизился до II (NYHA), была выявлена прямая ассоциация величины ЭРф (по ΔVE) с большей выраженностью ХСН (r=-0,57, p=0,01) и связи между снижением активности ЭРф (по ΔVE), повышением показателей VO2ЛП (r=-0,55, p=0,001), VO2peak (r=0,49, p=0,001), снижением содержания моноцитов (r=0,63, p=0,01) (табл. 3).
Обсуждение
В настоящем исследовании показана большая эффективность тренировочной ходьбы, рассчитанной на основании определения ЛП, в отношении активности ЭРф, выраженности ХСН, ТФН и активности системного воспаления.
Объектом нашего исследования были пациенты с выраженной ХСН (III ФК, NYHA), вследствие сниженной систолической функции ЛЖ находящиеся в стабильном состоянии на фоне оптимизированной комплексной терапии. Мы обнаружили статистически значимую связь ЭРф (по ΔVE) с выраженностью ХСН, поглощением кислорода на пике ФН и на уровне ЛП, а также с маркерами активности системного воспаления, тенденцию к возрастанию ЭРф (по ΔVE) у больных ХСН более старшего возраста и не выявили связей активности ЭРф с этиологией ХСН, полом исследованных и величиной ФВ ЛЖ.
Некоторые исследователи отметили у больных ХСН связь активности ЭРф с VO2peak и VE/VCO2 [6]. В работе Pardaens S, et al. (2014) при исследовании 24 больных СН с низкой ФВ было показано, что ЭРф повышается только у пациентов с декомпенсацией СН [11]. Другими исследователями, напротив, было продемонстрировано, что ЭРф повышен у больных с ХСН как в стабильном состоянии, так и в состоянии декомпенсации [12]. Notarius CF, et al. на 27 стабильных больных ХСН, получающих оптимальную медикаментозную терапию [13], и Toth MJ, et al. [14] в исследовании с участием 10 больных ХСН на оптимальной терапии, сообщали о снижении активности ЭРф на фоне ФТ. У здоровых лиц при выполнении пробы с циркуляторной окклюзией активность ЭРф не повышена [15].
Существует много свидетельств наличия связи выраженности миопатии при СН с активностью системного воспаления [16][17]. Данные нашего исследования полностью подтверждают наличие такой ассоциации у больных СН на фоне сниженной систолической функции ЛЖ, компенсированной на уровне III ФК: прямые взаимосвязи активности ЭРф с показателями активности системного воспаления, и обратные — с VO2ЛП и VO2peak, являются доказательством тесных патогенетических взаимоотношений между этими паттернами прогрессирования ХСН.
Возможность частичной инволюции как выраженности ЭРф в обеих группах на 15-53%, так и хронического воспаления в ОГ (>20%) выявлена на фоне длительных ФТ. Вероятно, уменьшение активности ЭРф является триггером снижения активности ренин-ангиотензиновой системы, симпатической нервной системы и хронического воспаления.
Выбор того или иного метода тренировок с целью модуляции ЭРф остается открытым вопросом. Мы провели сравнение двух подходов к подбору нагрузки для ФТ. Более выраженная клиническая динамика,
наряду с более серьёзным улучшением показателей потребления кислорода и более значимой понижающей модуляцией ЭРф были продемонстрированы у пациентов, ФТ которых проводились при учете динамики потребления кислорода на уровне ЛП — VO2ЛП (8). Лактат рассматривается [18] как координатор метаболизма, лимитирующий переносимость ФН вследствие развития усталости, поэтому величину VO2ЛП мы выбрали в качестве основы для расчета режима ФТ в режиме “без утомления”. Такой режим сохраняет приверженность ФТ и позволяет плавно повышать нагрузку. Недавние исследования [18] подтвердили важность выделения порога биологических резервов, основанного на оценке VO2ЛП. Персонифицированные ФТ, режим которых рассчитывали на основании оценки VO2ЛП, способствуют активации экспрессии генов, ответственных за целостность мышечных волокон, в механодетекцию и механотрансдукцию [19], а также сопровождаются регенерацией поперечнополосатой мышечной ткани [20], нормализацией обменных процессов в мышечных волокнах [20].
Значимое воздействие ФТ на активность ЭРф раскрывает еще один механизм позитивного влияния инверсии миопатии на течение СН, которая в ходе комплексного воздействия, включающего максимально возможную медикаментозную коррекцию, создает дополнительный положительный эффект в отношении клинической выраженности ХСН и “золотого стандарта” оценки ее тяжести — показателя VO2peak. Изучение и персонификация подходов к модуляции ЭРф может открыть перспективы оптимального контроля нейрогуморальной активности и выраженности хронического воспаления, которые сохраняются даже на фоне современной комплексной терапии у больных ХСН.
Применение методики расчета режима ФТ на основании определения ЛП в клинической практике позволило персонифицированно рассчитать режим ФТ. Использование персонифицированного подхода в расчете режима ФТ обеспечивает предупреждение развития мышечного утомления и возможность назначения более длительных ФТ. Это может способствовать интенсификации процессов аэробного окисления в мышечном волокне, увеличению ТФН.
В настоящем исследовании показано, что активность ЭРф может служить диагностическим маркером выраженности ХСН и терапевтической мишенью при ХСН.
Ограничения исследования. Исследованы больные только с ХСН, не страдающие сахарным диабетом, кахексией или ожирением, в терапии которых не использовали блокаторы рецепторов ангиотензина, ингибиторы неприлизина и препараты класса селективных ингибиторов почечного натрий-глюкозного ко-транспортера. Для оценки активности системного воспаления анализировали только некоторые маркеры, доступные при рутинном исследовании.
Заключение
1. У пациентов с ХСН III ФК, находящихся в стабильном состоянии и получающих максимально возможную болезнь-модифицирующую терапию, активность ЭРф повышена и связана с ФК СН, ТФН, активностью системного воспаления.
2. В ходе физической реабилитации уменьшение активности ЭРф сопровождается снижением ФК СН, повышением ТФН, более выраженным на фоне персонифицированных аэробных тренировок, режим которых рассчитывали с помощью определения ЛП.
Благодарности. Авторы выражают благодарность за помощь в работе над статьей Галагудза М. М. и Михайлову Е.Н.
Отношения и деятельность. Исследование было поддержано грантом Министерства науки и высшего образования Российской Федерации (соглашение № 075-15-2020-800).
Список литературы
1. McDonagh TA, Marco M, Marianna A, et al. 2021 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure: Developed by the Task Force for the diagnosis and treatment of acute and chronic heart failure of the European Society of Cardiology. European Heart Journal. 202;42:36:3599-726.
2. Giordano A, Biondi-Zoccai G, Finizio F, et al. Characteristics and outcomes of MitraClip in octogenarians: Evidence from 1853 patients in the GIOTTO registry. Int J Cardiol. 2021:S0167-5273(21)01220-1. doi:10.1016/j.ijcard.2021.08.010.
3. Российское кардиологическое общество (РКО). Хроническая сердечная недостаточность. Клинические рекомендации 2020. Российский кардиологический журнал. 2020;25(11):4083. doi:10.15829/1560-4071-2020-4083.
4. Арутюнов Г. П., Колесникова Е. А., Беграмбекова Ю. Л. и др. Рекомендации по назначению физических тренировок пациентам с хронической сердечной недостаточностью. Журнал Сердечная Недостаточность. 2017;18(1):41-66.
5. Mezzani A. Cardiopulmonary Exercise Testing: Basics of Methodology and Measurements. Ann Am Thorac Soc. 2017;14:S3-S11. doi:10.1513/AnnalsATS.201612-997.
6. Piepoli M, Clark A, Volterrani M, et al. Contribution of muscle afferents to the hemodynamic, autonomic, and ventilatory responses to exercise in patients with chronic heart failure: effects of physical training. Circulation. 1996;93:940-52.
7. Lelyavina T, Sitnikova M, Beresina A, et al. New Approaches to Marking Stages of Incremental Physical Work by Example of Cardiopulmonary Exercise Testing. Journal of US-China Medical Science. 2014;11:9-13. doi:10.17265/1548-6648/2014.01.002.
8. Lelyavina T, Sitnikova M, Galenko V, et al. Аerobic training in heart failure patients with optimal heart failure therapy — a prospective randomized study. World Journal of Pharmaceutical Research. 2017;6:2:59-67.
9. Waterhouse DF, Cahill RA, Sheehan F, et al. Prediction of calculated future cardiovascular disease by monocyte count in asymptomatic population. VascHealthRiskManag. 2008;V.4(1):177-87.
10. Nozawa N, Hibi K, Endo M, et al. Association between circulating monocytes and coronary plaque progression in patients with acute myocardial infarction. Circ J. 2010;74(7):1384-91. doi:10.1253/circj.CJ-09-0779.
11. Pardaens S, Vanderheyden M, Calders P, et al. Activation of the ergoreceptors in cardiac patients with and without heart failure. J Card Fail. 2014;20(10):747-54. doi:10.1016/j.cardfail.2014.07.006.
12. Ponikowski P, Chua T, Francis D, et al. Muscle ergoreceptor overactivity reflects deterioration in clinical status and cardiorespiratory reflex control in chronic heart failure. Circulation. 2001;104(19):2324-30. doi:10.1161/hc4401.098491.
13. Notarius C, Millar P, Keir D, et al. Training heart failure patients with reduced ejection fraction attenuates muscle sympathetic nerve activation during mild dynamic exercise. Am J Physiol Regul Integr Comp Physiol. 2019;317:R503-R512. doi:10.1152/ajpregu.00104.2019.
14. Toth M, Miller M, Van Buren P, et al. Resistance training alters skeletal muscle structure and function in human heart failure: effects at the tissue, cellular and molecular levels. J Physiol. 2012;590:1243-59.
15. Aimo A, Saccaro L, Chiara B, et al. The ergoreflex: how the skeletal muscle modulates ventilation and cardiovascular function in health and disease. European Journal of Heart Failure. 2021:10:1002-9.
16. Adamo L, Rocha-Resende C, Prabhu S, et al. Reappraising the role of inflammation in heart failure. Nat Rev Cardiol. 2020;17(5):269-85. doi:10.1038/s41569-019-0315-x.
17. Shirazi L, Bissett J, Romeo F, et al. Role of Inflammation in Heart Failure. Curr Atheroscler Rep. 2017;19(6):27. doi:10.1007/s11883-017-0660-3.
18. Poole D, Rossiter H, Brooks G. The anaerobic threshold: 50+ years of controversy. Int J Mol Sci. 2021;599(3):737-67. doi:10.1113/JP279963.
19. Lelyavina TA, Galenko VL, Ivanova OA, et al. Clinical Response to Personalized Exercise Therapy in Heart Failure Patients with Reduced Ejection Fraction Accompanied by Skeletal Muscle Histological Alterations. Int J Mol Sci. 2019;20(21):5514. doi:10.3390/ijms20215514.
20. Иванова О. А., Игнатьева Е. В., Лелявина Т. А. и др. Анализ транскриптома скелетной мускулатуры выявил влияние физических тренировок на молекулярные механизмы регуляции роста и метаболизма мышечной ткани у пациентов с хронической сердечной недостаточностью. Российский кардиологический журнал. 2020;25(10):4132. doi:10.15829/1560-4071-2020-4132.
Об авторах
Т. А. ЛелявинаРоссия
Лелявина Татьяна Александровна — кандидат медицинских наук, ведущий научный сотрудник, доцент кафедры патологической физиологии, НИО сердечной недостаточности.
Санкт-Петербург.
Конфликт интересов:
Нет
М. Ю. Ситникова
Россия
Ситникова Мария Юрьевна — доктор медицинских наук, главный научный сотрудник, профессор кафедры факультетской терапии, НИО сердечной недостаточности.
Санкт-Петербург.
Конфликт интересов:
Нет
В. Л. Галенко
Россия
Галенко Виктория Леонидовна — младший научный сотрудник, НИО сердечной недостаточности.
Санкт-Петербург.
Конфликт интересов:
Нет
М. А. Борцова
Россия
Борцова Мария Александровна — заведующая кардиологическим отделением.
Санкт-Петербург.
Конфликт интересов:
Нет
Дополнительные файлы
Рецензия
Для цитирования:
Лелявина Т.А., Ситникова М.Ю., Галенко В.Л., Борцова М.А. Роль активности эргорефлекса в патогенезе хронической сердечной недостаточности. Эффективность физической реабилитации. Российский кардиологический журнал. 2022;27(6):4937. https://doi.org/10.15829/1560-4071-2022-4937
For citation:
Lelyavina T.A., Sitnikova M.Yu., Galenko V.L., Bortsova M.A. Role of ergoreflex activity in the pathogenesis of heart failure. The effectiveness of physical rehabilitation. Russian Journal of Cardiology. 2022;27(6):4937. (In Russ.) https://doi.org/10.15829/1560-4071-2022-4937
JATS XML

















































