Перейти к:
Отдаленные результаты нового способа бедренно-подколенного шунтирования
https://doi.org/10.15829/1560-4071-2022-4843
Аннотация
Цель. Провести анализ отдаленных результатов нового способа бедренноподколенного шунтирования (БПШ).
Материал и методы. В настоящее ретроспективное открытое сравнительное исследование за период с 10.01.2016 по 25.12.2019 в ГБУЗ “Научноисследовательский институт — Краевая клиническая больница № 1 имени профессора С. В. Очаповского” Министерства здравоохранения Краснодарского края, г. Краснодар, было включено 473 пациента, которым выполнялось БПШ. В зависимости от вида шунта сформировано 5 групп: 1 группа (n=266) — реверсированная вена (большая подкожная вена (БПВ)); 2 группа (n=59) — аутовена (БПВ), подготовленная in situ; 3 группа (n=66) — аутовена (БПВ), подготовленная ex situ; 4 группа (n=9) — синтетический протез (Jotec, Германия); 5 группа (n=73) — вены верхней конечности. Во всех случаях по данным мультиспиральной компьютерной томографии с ангиографией было выявлено протяженное (≥25 см) атеросклеротическое окклюзионное поражение поверхностной бедренной артерии, соответствующее типу D согласно трансатлантическому консенсусу (TASC II). Отдаленный период наблюдения составил 16,6±10,3 мес. Технический результат нового вида БПШ достигался за счет применения предлагаемого вида подготовки аутовенозного шунта, при котором после выделения БПВ производилась вальвулотомия ex situ c последующим проведением шунта без реверсирования субфасциально ортотопически по ходу сосудисто-нервного пучка путем туннелирования (туннелер Sheath Tunneler Set; Peripheral Vascular, США) мягких тканей. БПВ ex situ подготавливалась следующим образом: выделяли БПВ от сафено-феморального соустья в дистальном направлении на необходимую длину и извлекали из раны. Далее через проксимальный конец БПВ выполняли вальвулотомию. Затем вальвулотом удаляли и вводили металлическую канюлю. Через нее с помощью шприца в просвет БПВ нагнетали физиологический раствор комнатной температуры с нефракционированным гепарином, имитируя кровоток, и проверяли качество проведенной вальвулотомии.
Результаты. В госпитальном послеоперационном периоде все осложнения развились в 1, 2, 3 и 5 группах. Тем не менее, значимых межгрупповых статистических различий выявлено не было. В отдаленном периоде наблюдения по частоте летального исхода (группа 1: 4,6%; группа 2: 1,7%; группа 3: 4,6%; группа 4: 0%; группа 5: 2,8%; р=0,78), инфаркта миокарда (группа 1: 1,9%; группа 2: 0%; группа 3: 1,5%; группа 4: 0%; группа 5: 0%; р=0,62), ишемического инсульта (группа 1: 0,8%; группа 2: 1,7%; группа 3: 1,5%; группа 4: 0%; группа 5: 0%; р=0,8) и тромбоза шунта (группа 1: 14,5%; группа 2: 19,3%; группа 3: 18,5%; группа 4: 44,4%; группа 5: 19,7%; р=0,16) значимых межгрупповых различий не выявлено. Однако наибольшее число ампутаций конечности (группа 1: 4,2%; группа 2: 5,3%; группа 3: 9,2%; группа 4: 22,2%; группа 5: 1,4%; р=0,03) и максимальный показатель комбинированной конечной точки (сумма всех осложнений) (группа 1: 26,0%; группа 2: 28,1%; группа 3: 35,4%; группа 4: 66,7%; группа 5: 23,9%; р=0,05) наблюдались после применения синтетического протеза.
Заключение. БПШ аутовеной ex situ характеризуется сопоставимой частотой госпитальных и отдаленных результатов с БПШ реверсированной аутовеной и БПШ аутовеной in situ. Таким образом, данная техника операции может стать одной из операций выбора для пациентов с протяженным окклюзионностенотическим поражением поверхностной бедренной артерии.
Ключевые слова
Для цитирования:
Закеряев А.Б., Виноградов Р.А., Сухоручкин П.В., Бутаев С.Р., Бахишев Т.Э., Дербилов А.И., Ураков Э.Р., Барышев А.Г., Порханов В.А. Отдаленные результаты нового способа бедренно-подколенного шунтирования. Российский кардиологический журнал. 2022;27(8):4843. https://doi.org/10.15829/1560-4071-2022-4843
For citation:
Zakeryaev A.B., Vinogradov R.А., Sukhoruchkin P.V., Butaev S.R., Bakhishev T.E., Derbilov A.I., Urakov E.R., Baryshev A.G., Porkhanov V.A. Long-term outcomes of a novel method of femoropopliteal bypass. Russian Journal of Cardiology. 2022;27(8):4843. (In Russ.) https://doi.org/10.15829/1560-4071-2022-4843
Реконструктивные вмешательства на артериях нижних конечностей всегда находились в области интересов сосудистых хирургов [1-3]. Согласно действующим отечественным и зарубежным рекомендациям, могут применяться как эндоваскулярные, так и открытые хирургические способы реваскуляризации [4-6]. Однако при протяженном поражении операцией выбора остается бедренно-подколенное шунтирование (БПШ) [46]. На сегодня существует обширный арсенал возможных кондуитов для реализации данного вмешательства: аутовенозные, биологические, синтетические [7-10]. При этом наибольшей популярностью пользуются аутотрансплантаты [7-10]. Другие же могут применяться в качестве альтернативы, когда аутовена не доступна или не пригодна для БПШ [4-6]. Во многом это обусловлено тем, что искусственные протезы имеют гораздо меньшие сроки службы и их имплантация может сопровождаться более частым развитием аневризм, инфицирования, ранней дисфункцией в результате выраженного рестенозирования [6-10].
В настоящее время наибольшей популярностью пользуются три методики БПШ аутовеной. Для реализации первых двух требуется большая подкожная вена (БПВ). В той ситуации, когда применяется ее реверсированный вариант, не соблюдается конгруэнтность диаметров дистального конца БПВ и подколенной артерии [11][12]. Иными словами, просвет БПВ расширяется в дистальном направлении, что вызывает увеличение периферического сопротивления и может привести к раннему тромбозу кондуита. Если же БПВ подготовлена методом in situ, то не только возрастает риск травматизации стенки сосуда в результате выполнения вальвулотомии фактически “вслепую” [13-17]. Сохраненные притоки БПВ служат мостом для сброса крови в венозное русло, что может привести к артериализации венозного кровотока [13-19]. В ряде случаев подобная ситуация может сопровождаться “синдромом обкрадывания” и вторичной ишемией конечности с дальнейшим неблагоприятным прогнозом. Когда же БПВ не доступна или не пригодна, во избежание применения искусственных протезов может имплантироваться аутовена верхней конечности. По данным литературы этот кондуит имеет меньшие сроки службы относительно БПВ и используется реже в связи с техническими сложностями его подготовки. В частности, может потребоваться несколько подкожных вен верхней конечности для достижения необходимой длины кондуита, что вызовет необходимость в выполнении анастомозов между ними, а также формирование обширных травматических доступов.
Таким образом, БПВ — “золотой стандарт” для реализации БПШ. При этом разработка новых способов подготовки БПВ, способных ликвидировать недостатки существующих, остается актуальной задачей современной сосудистой хирургии.
Целью настоящего исследования стал анализ отдаленных результатов нового способа БПШ.
Материал и методы
В настоящее ретроспективное открытое сравнительное исследование за период с 10.01.2016 по 25.12.2019 в ГБУЗ “Научно-исследовательский институт — Краевая клиническая больница № 1 имени профессора С. В. Очаповского” Министерства здравоохранения Краснодарского края, г. Краснодар, было включено 473 пациента, которым выполнялось БПШ. В зависимости от вида шунта сформировано 5 групп:
- 1 группа (n=266) — реверсированная вена (БПВ);
- 2 группа (n=59) — аутовена (БПВ), подготовленная in situ;
- 3 группа (n=66) — аутовена (БПВ), подготовленная ex situ;
- 4 группа (n=9) — синтетический протез (Jotec, Германия);
- 5 группа (n=73) — вены верхней конечности.
Степень хронической ишемии нижней конечности (ХИНК) определялась по классификации Фонтейна-Покровского (https://racvs.ru/clinic/files/2016/Diseaseslowerlimb-arteries.pdf).
Во всех случаях по данным мультиспиральной компьютерной томографии с ангиографией было выявлено протяженное (≥25 см) атеросклеротическое окклюзионное поражение поверхностной бедренной артерии (ПБА), соответствующее типу D согласно трансатлантическому консенсусу (TASC II) [1-3].
БПВ ex situ подготавливалась следующим образом (приоритетная справка 2021137226, заявка от 16.12.2021): выделяли БПВ от сафено-феморального соустья в дистальном направлении на необходимую длину и извлекали из раны. Вне операционной раны на “бэктейбле” выполняли вальвулотомию через проксимальный конец БПВ. Затем вальвулотом удаляли и вводили металлическую канюлю. Через нее с помощью шприца в просвет БПВ нагнетали физиологический раствор комнатной температуры с нефракционированным гепарином, имитируя кровоток, и проверяли качество проведенной вальвулотомии. Шунт тщательно подготавливался перед имплантацией: ушивались незначительные дефекты, тщательно выделялись и перевязывались под основание притоки, устранялись расширения и сужения шунта. Технический результат нового вида БПШ достигался за счет последующего проведения шунта без реверсирования путем туннелирования субфасциально ортотопически по ходу сосудисто-нервного пучка (туннелер Sheath Tunneler Set; Peripheral Vascular, США).
Критерии включения: наличие протяженного атеросклеротического окклюзионного поражения ПБА (≥25 см), отсутствие декомпенсированной коморбидной патологии (сахарный диабет, хроническая сердечная недостаточность и т.д.).
Критерии исключения: наличие патологии, лимитирующей наблюдение за пациентом в отдаленном периоде наблюдения.
В госпитальном периоде наблюдения производилась оценка следующих видов осложнений: летальный исход, инфаркт миокарда (ИМ), тромбоз шунта, кровотечение типа 3b и выше (требующие ревизии раны) по шкале Bleeding Academic Research Consortium (BARC), инфицирование послеоперационной раны, ампутация конечности, острое нарушение мозгового кровообращения (ОНМК), комбинированная конечная точка (сумма всех перечисленных осложнений).
В отдаленном периоде наблюдения (16,6±10,3 мес.) производилась оценка следующих видов осложнений: летальный исход, тромбоз шунта, ампутация конечности, ИМ, ОНМК, комбинированная конечная точка (сумма всех перечисленных осложнений). При этом при развитии летального исхода или выполнении ампутации реваскуляризированной конечности пациент исключался из выборки.
Все пациенты подписали письменное согласие на использование их данных в научных исследованиях. Работа выполнялась в соответствии со стандартами надлежащей клинической практики (Good Clinical Practice) и принципами Хельсинкской декларации, не противоречила Федеральному закону Российской Федерации от 21.11.2011 № 323-ФЗ “Об основах охраны здоровья граждан в Российской Федерации”, приказу Министерства здравоохранения Российской Федерации от 1 апреля 2016г № 200н “Об утверждении правил надлежащей клинической практики”.
Статистический анализ. Определение типа распределения осуществлялось с помощью критерия Колмогорова-Смирнова. Сравнение групп проводили с применением критерия хи-квадрат Пирсона и Краскела-Уоллиса. Для постройки кривых выживаемости в отдаленном периоде наблюдения применялся анализ Каплана-Мейера. Для сравнения кривых выполнялся Logrank test. Для идентификации группы, в которой развитие тех или иных осложнений было наиболее вероятно, рассчитывался коэффициент риска (Hazard ratios). Различия оценивались как значимые при р<0,05. Результаты исследований обработаны при помощи пакета прикладных программ Graph Pad Prism (www.graphpad.com) и MedCalc 19.2.1 (www.medcalc.org).
По основным характеристикам группы были полностью сопоставимы. Каждый третий страдал сахарным диабетом 2 типа, каждый десятый перенес ишемический инсульт и/или ИМ в анамнезе. В единичных случаях диагностировалась хроническая почечная недостаточность. При этом у подавляющего большинства пациентов отмечалась хроническая обструктивная болезнь легких и хроническая сердечная недостаточность (табл. 1).
Таблица 1
Клинико-анамнестическая характеристика
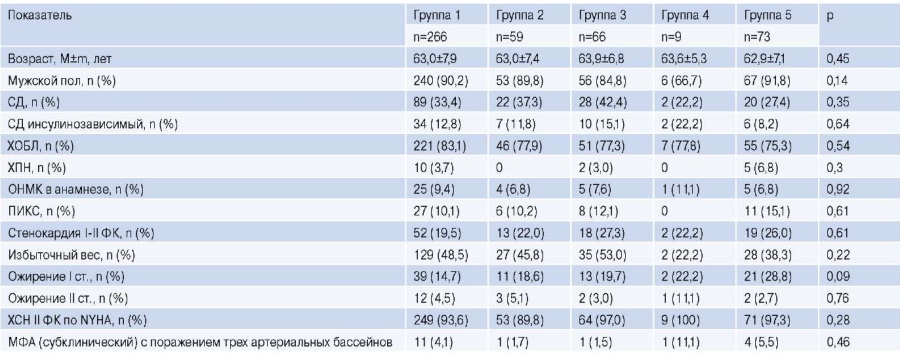
Сокращения: МФА — мультифокальный атеросклероз, ОНМК — острое нарушение мозгового кровообращения, ПИКС — постинфарктный кардиосклероз, СД — сахарный диабет, ФК — функциональный класс, ХОБЛ — хроническая обструктивная болезнь легких, ХПН — хроническая почечная недостаточность, ХСН — хроническая сердечная недостаточность.
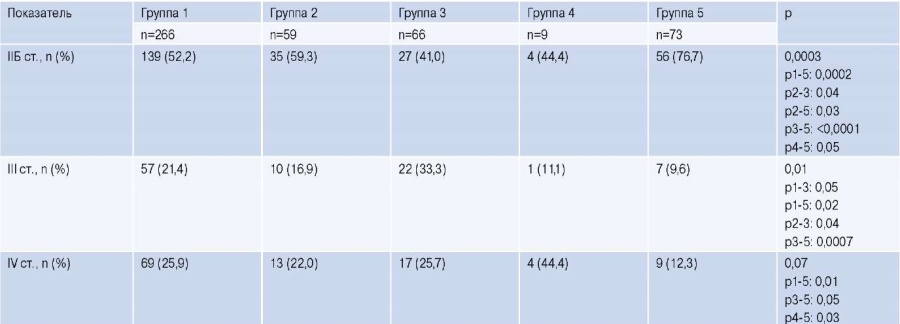
Группы были не сопоставимы по выраженности ХИНК согласно классификации Фонтейна-Покровского. IIБ ст. чаще всего диагностировалась во 2 и 5 группах, III ст. в 3 группе, а IV ст. в 1, 3, 4 группах (табл. 2).
Таблица 2
Выраженность ХИНК согласно действующим классификациям
По частоте выполнения БПШ выше (группа 1: 68,8% (n=183); группа 2: 59,9% (n=35); группа 3: 56,1% (n=37); группа 4: 44,4% (n=4); группа 5: 68,5% (n=50); р=0,14) и ниже (группа 1: 31,2% (n=83); группа 2: 39,0% (n=23); группа 3: 44,0% (n=29); группа 4: 55,5% (n=5); группа 5: 31,5% (n=23); р=0,14) щели коленного сустава группы были сопоставимы.
Результаты
В госпитальном послеоперационном периоде все осложнения развились в 1, 2, 3 и 5 группах. Тем не менее, значимых межгрупповых различий выявлено не было.
В отдаленном послеоперационном периоде статистически значимые различия были получены по выполнению ампутации конечности, которая наиболее часто производилась в группе применения синтетического протеза. При этом комбинированная конечная точка достигла максимальных значений в этой же выборке больных (табл. 3).
Таблица 3
Госпитальные и отдаленные результаты
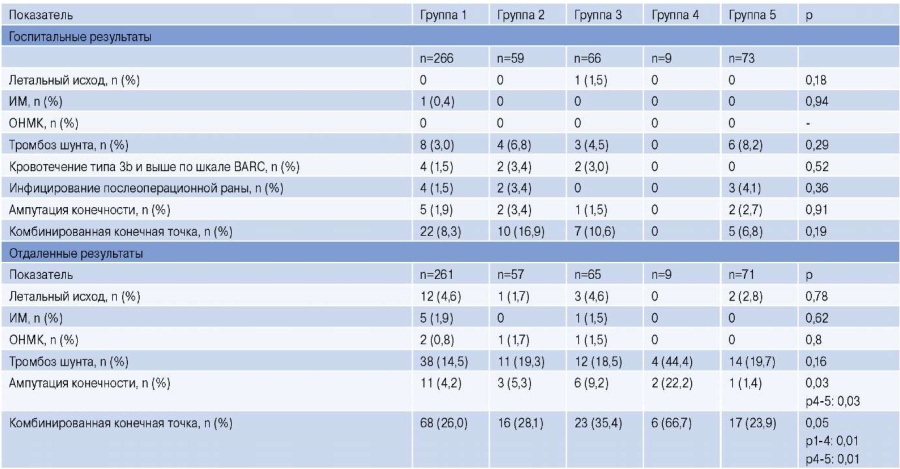
Сокращения: ИМ — инфаркт миокарда, ОНМК — острое нарушение мозгового кровообращения, BARC — Bleeding Academic Research Consortium.
При построении кривых выживаемости, свободной от летального исхода и сравнении их методом Logrank test статистически значимых различий не получено (рис. 1).
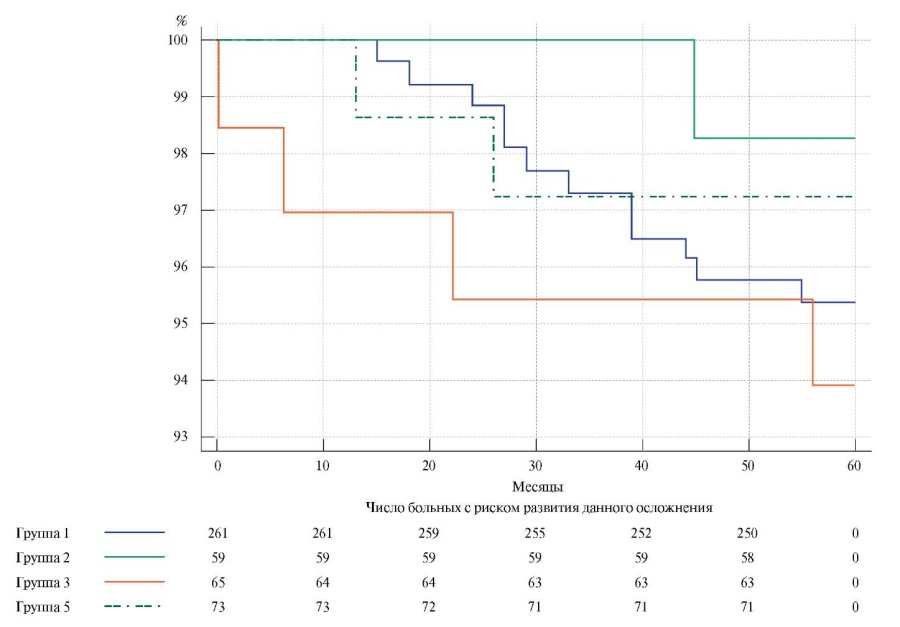
Рис. 1. Выживаемость, свободная от летального исхода (Logrank test: р=0,56).
Однако при расчете коэффициента риска выявлено, что наибольший риск развития летального исхода характерен для 2 и 5 групп (табл. 4).
Таблица 4
Коэффициент риска развития летального исхода
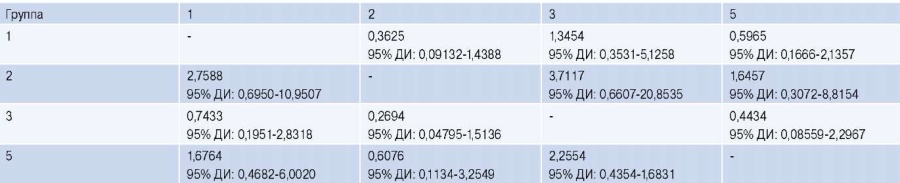
Сокращение: ДИ — доверительный интервал.
При построении кривых выживаемости, свободной от тромбоза шунта, и их сравнении методом Logrank test выявлены статистически значимые различия. Так, последний наиболее часто развивался в группе, в которой применялся синтетический протез (рис. 2).
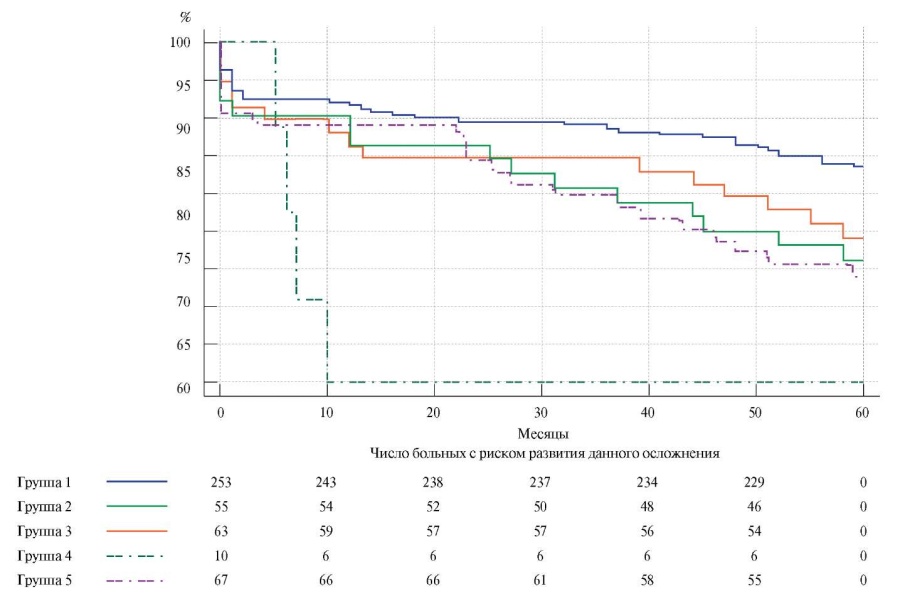
Рис. 2. Выживаемость, свободная от тромбоза шунта (Logrank test: р=0,01).
При расчете коэффициента риска развития тромбоза шунта выявлено, что наибольший риск характерен для 4 группы (табл. 5).
Таблица 5
Коэффициент риска развития тромбоза шунта
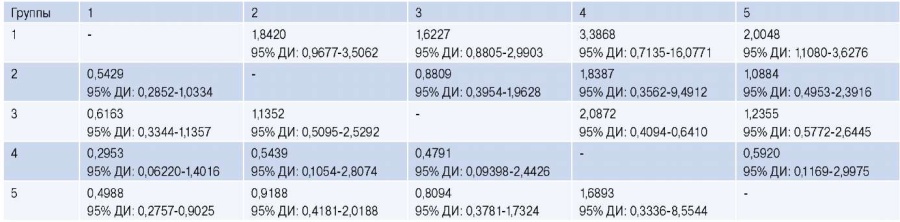
Сокращение: ДИ — доверительный интервал.
При построении кривых выживаемости, свободной от ампутации конечности, и их сравнении методом Logrank test статистически значимых различий не выявлено. Однако прослеживалась тенденция к увеличению частоты данного события в группе применения синтетического протеза (рис. 3).
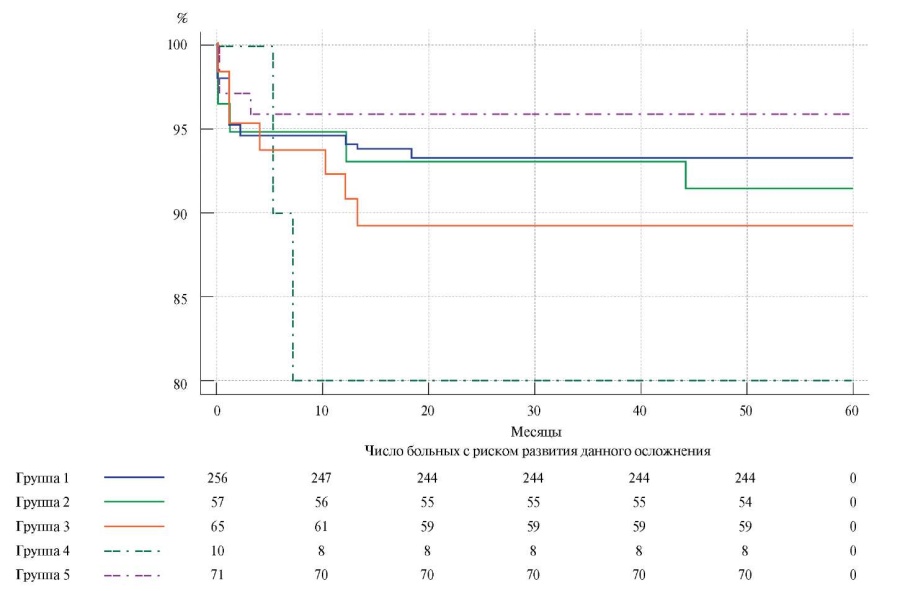
Рис. 3. Выживаемость, свободная от ампутации конечности (Logrank test: р=0,3).
В этой же группе были определены наибольшие коэффициенты риска ампутации конечности (табл. 6).
Таблица 6
Коэффициент риска ампутации конечности
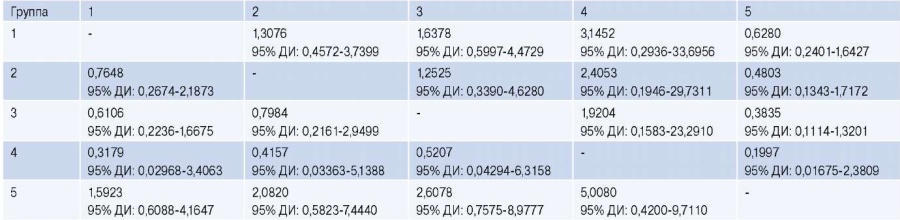
Сокращение: ДИ — доверительный интервал.
При построении кривых выживаемости, свободной от комбинированной конечной точки, и их сравнении методом Logrank test выявлены статистически значимые различия. Так, последняя наиболее часто развивалась в группе, в которой применялся синтетический протез (рис. 4).
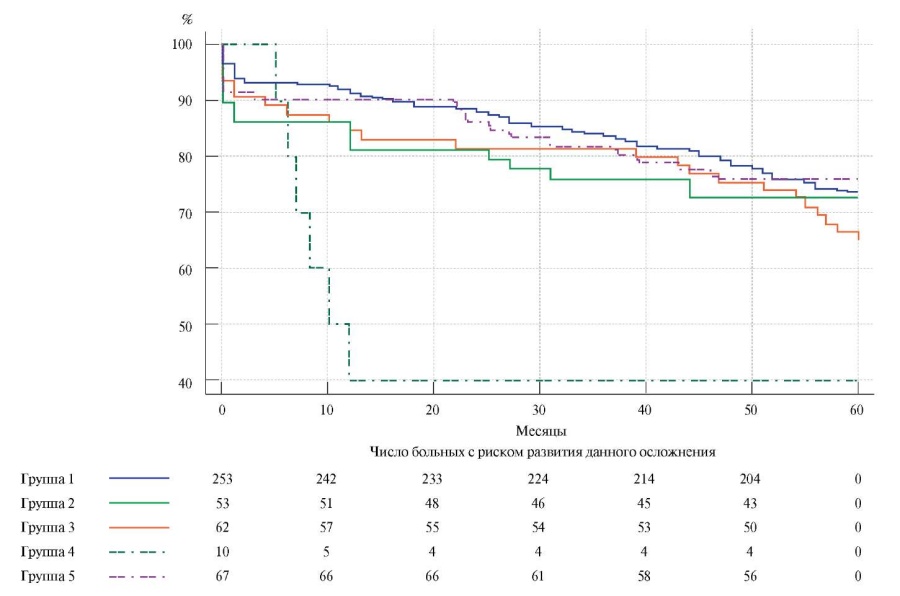
Рис. 4. Выживаемость, свободная от комбинированной конечной точки (Logrank test: р=0,02).
В этой же группе были определены наибольшие коэффициенты риска развития комбинированной конечной точки (табл. 7).
Таблица 7
Коэффициент риска развития комбинированной конечной точки
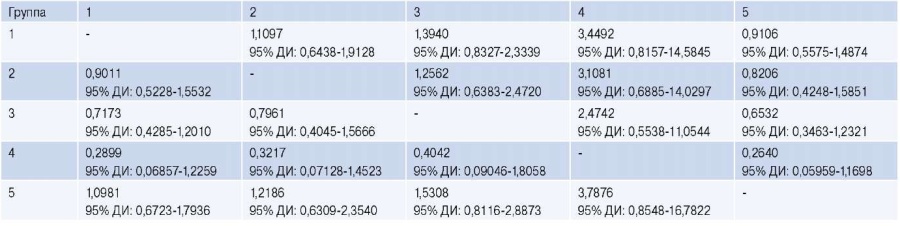
Сокращение: ДИ — доверительный интервал.
Обсуждение
По данным мировой литературы, частота окклюзии трансплантата в течение 5 лет после БПШ колеблется от 50 до 90% с 20% риском ампутации конечности [20]. При этом, если речь идет о реверсированной БПВ, то важную роль играет ее диаметр. Так как конгруэнтность ширины просвета аутовены может не соответствовать диаметру подколенной артерии, то возрастает периферическое сопротивление с последующим риском тромбоза. Такая закономерность неоднократно отмечалась во многих исследованиях. В частности, было доказано, что диаметр БПВ положительно коррелирует с послеоперационным лодыжечно-плечевым индексом (р<0,0001). Так, через неделю после БПШ лодыжечно-плечевой индекс был значительно ниже в группе аутотрансплантатов с диаметром <3 мм. Таким образом, авторы доказали, что верная конгруэнтность играет одну из ключевых ролей в достижении успешного исхода БПШ таким методом [21]. Однако, несмотря на заявленный недостаток, БПШ реверсированной веной пользуется высокой популярностью, т.к. не требует проведения вальвулотомии и не характеризуется высокой технической сложностью [22].
Другим широко признанным методом операции является БПШ аутовеной in situ. Его эффективность сопоставима с предыдущей техникой [23][24]. Двухлетняя выживаемость пациентов после применения данного вида реваскуляризации составила 75%, а свобода от тромбоза кондуита достигла 91,7% [24]. Выживаемость, свободная от дисфункции аутотрансплантата через 2 года после операции достигала 86,7% [25]. Таким образом, сопоставимый эффект обеих техник БПШ свидетельствует о том, что оба способа БПШ характеризуются высокой эффективностью и безопасностью [23-25]. При этом выбор в пользу того или иного способа может осуществляться на основе предпочтений оперирующего хирурга [4-6].
В той ситуации, когда БПВ не доступна или не пригодна, могут применяться аутовена верхней конечности и синтетический протез. Частота различных осложнений после их применении значительно выше, чем при использовании БПВ, однако для сохранения конечности в ситуации отсутствия “кондуита первой линии” выбор в их пользу является очевидным. Тем не менее аутотрансплантат является более предпочтительным относительно искусственного аналога, на основе проведенного анализа 740 БПШ: 506 аутовеной верхней конечности (1 группа) и 234 синтетическим протезом (2 группа) [26]. Проходимость шунта в течение 1 года составила 92,9% и 83,4%, соответственно, через 3 года — 72,8% и 55,5% [26]. Выживаемость, свободная от ампутации конечности спустя 1 год после БПШ достигла 100% и 91,3%, соответственно, через 3 года — 94,7% и 75,3% [26]. Более высокая частота дисфункции синтетического протеза относительно аутовены была объяснена тем, что БПВ имеет эндотелий, и это позволяет ей адаптироваться к артериализации. Выделение эндотелиоцитами оксида азота и VEGF-А препятствует гиперплазии неоинтимы в зоне реконструкции, что не допускает раннюю потерю просвета сосуда [27]. Имплантация синтетических протезов в результате отсутствия этих свойств будет сопровождаться гиперплазией неоинтимы, что приведет к их дисфункции с последующим неблагоприятным прогнозом [27].
Результаты представленного исследования продемонстрировали, что разработанный метод БПШ аутовеной ex situ сопоставим по эффективности и безопасности с БПШ реверсированной аутовеной и БПШ аутовеной in situ. Частота осложнений, полученных после этих и других техник БПШ (веной верхней конечности, синтетическим протезом), соответствует мировым данным. Таким образом, БПШ аутовеной ex situ может стать одним из основных вариантов хирургической помощи пациентам с протяженным атеросклеротическим поражением ПБА и ХИНК. Однако дополнительным преимуществом нашей разработки является то, что она исключает недостатки перечисленных аналоговых техник операции, а именно: 1. Соблюдается конгруэнтность просветов БПВ и подколенной артерии, что снижает вероятность тромбоза аутотрансплантата; 2. Вальвулотомия ex situ производится под визуальным контролем, что ликвидирует риск повреждения стенки сосуда; 3. Отсутствие сброса артериальной крови в венозное русло не допускает развития гиперволемии, синдрома “обкрадывания” и вторичной ишемии конечности. На этом фоне следует отметить, что существует публикация, в которой анализируется схожий метод БПШ [28]. Однако в работе кондуит не проводят ортотопически, что является важным отличием этого способа [28]. Таким образом, благодаря особенностям техники БПШ аутовеной ex situ, она может стать операцией выбора для данной когорты больных.
Заключение
БПШ аутовеной ex situ характеризуется сопоставимой частотой госпитальных и отдаленных результатов с БПШ реверсированной аутовеной и БПШ аутовеной in situ. Таким образом, данная техника операции может стать одной из операций выбора для пациентов с протяженным окклюзионно-стенотическим поражением ПБА.
Отношения и деятельность: все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье.
Список литературы
1. Покровский А. В., Дан В. Н., Зотиков А. Е. и др. Бедренно-подколенное шунтирование выше щели коленного сустава протезом из ПТФЭ: какой диаметр протеза лучше? Ангиология и сосудистая хирургия. 2008;14(4):104-10.
2. Закеряев А. Б., Виноградов Р. А., Матусевич В. В. и др. Бедренно-подколенное шунтирование: от истоков до наших дней. Вестник Национального медико-хирургического центра им. Н. И. Пирогова. 2021;16(3):57-60. doi:10.25881/20728255_2021_16_3_57.
3. Бурков Н. Н., Казанцев А. Н., Тарасов Р. С. Госпитальные исходы реконструктивных вмешательств на аортобедренном сегменте у пациентов с мультифокальным атеросклерозом. Ангиология и сосудистая хирургия. 2018;24(2):139-45.
4. Национальные рекомендации по диагностике и лечению заболеваний артерий нижних конечностей. Г. Москва. 2019 г. Источник: http://www.angiolsurgery.org/library/recommendations/2019/recommendations_LLA_2019.pdf.
5. Norgren L, Hiatt WR, Dormandy JA, et al.; TASC II Working Group. Inter-Society Consensus for the Management of Peripheral Arterial Disease (TASC II). J Vasc Surg. 2007;45 Suppl S:S5-67. doi:10.1016/j.jvs.2006.12.037.
6. Рекомендации ЕОК/ЕОСХ по диагностике и лечению заболеваний периферических артерий 2017. Российский кардиологический журнал. 2018;(8):164-221. doi:10.15829/1560-40712018-8-164-221.
7. Алекян Б. Г., Покровский А. В., Зотиков А. Е. и др. Госпитальные результаты чрескожных коронарных вмешательств и хирургических операций на артериях нижних конечностей у пациентов с критической ишемией нижних конечностей в сочетании с ишемической болезнью сердца. Эндоваскулярная хирургия. 2020;7(3):265-73. doi:10.24183/2409-4080-2020-7-3-265-273.
8. Сухоручкин П. В., Скрыпник Д. А., Коротун А. А. и др. Использование аутовенозного бифуркационного кондуита in situ для лечения нагноения аорто-бедренного бифуркационного протеза. Инфекции в хирургии. 2020;18(3-4):31-3.
9. Бурков Н. Н., Казанцев А. Н., Ануфриев А. И. и др. Результаты бедренно-подколенной реконструкции биологическим протезом “Кемангиопротез”. Кардиология и сердечно-сосудистая хирургия. 2020;13(1):29-35. doi:10.17116/kardio202013011129.
10. Луценко В. А., Султанов Р. В., Евтушенко А. В. и др. Результаты инфраингвинальных реконструкций с дистальным анастомозом ниже щели коленного сустава у пациентов с критической ишемией при использовании различных протезных материалов. Комплексные проблемы сердечно-сосудистых заболеваний. 2021;10(S2):45-9. doi:10.17802/2306-1278-2021-10-2S-45-49.
11. Arhuidese I, Hicks CW, Locham S, et al. Long-term outcomes after autogenous versus synthetic lower extremity bypass in patients on hemodialysis. Surgery. 2017;162(5):10719. doi:10.1016/j.surg.2017.04.026.
12. Vitalis A, Shantsila A, Kay M, et al. Outcome of Femoral-popliteal Bypass Procedures in Different Ethnic Groups in England: A Retrospective Analysis of Hospital Episode Statistics. Ann Vasc Surg. 2021;76:351-6. doi:10.1016/j.avsg.2021.04.018.
13. Гавриленко А. В., Скрылев С. И. Отдаленные результаты бедренно-подколенных аутовенозных шунтирований реверсированной веной и по методике “in situ”. Ангиология и сосудистая хирургия. 2007;13(3):120-4.
14. Суковатых Б. С., Беликов Л. Н., Суковатых М. Б. и др. Выбор способа бедренно-подколенного шунтирования ниже щели коленного сустава. Анналы хирургии. 2016;21(5):312-20. doi:10.18821/1560-9502-2016-21-5312-320.
15. Колобова О. И., Субботин Ю. Г., Козлов А. В. и др. Аутовенозное шунтирование in situ у больных с дистальными артериальными окклюзиями нижних конечностей при сахарном диабете. Хирургия. Журнал им. Н. И. Пирогова. 2011;7:18-23.
16. Бокерия Л. А., Темрезов М. Б., Коваленко В. И. и др. Хирургическое лечение больных с атеротромботическим поражением артерий нижних конечностей — выбор трансплантата при бедренно-подколенном шунтировании. Анналы хирургии. 2010;2:5-8.
17. Казаков Ю. И., Лукин И. Б., Великов П. Г. и др. Выбор метода реконструкции инфраингвинального артериального сегмента у больных с хронической критической ишемией нижних конечностей. Кардиология и сердечно-сосудистая хирургия. 2014;7(6):42-8.
18. Enzmann FK, Metzger P, Martin JES, et al. The Upper-Arm Basilic-Cephalic Loop: A Valueable Alternative for Below-Knee Arterial Reconstruction. Vasc Endovascular Surg. 2021;55(4):348-54. doi:10.1177/1538574420980610.
19. Nierlich P, Enzmann FK, Metzger P, et al. Alternative Venous Conduits for Below Knee Bypass in the Absence of Ipsilateral Great Saphenous Vein. Eur J Vasc Endovasc Surg. 2020;60(3):403-9. doi:10.1016/j.ejvs.2020.06.016.
20. Milasinovic DZ, Sekulic DB, Nikolic DD, et al. Virtual ABI: A computationally derived ABI index for noninvasive assessment of femoro-popliteal bypass surgery outcome. Comput Methods Programs Biomed. 2021;208:106242. doi:10.1016/j.cmpb.2021.106242.
21. Matsushita M, Ikezawa T, Banno H. Relationship between the diameter of the vein graft and postoperative ankle brachial pressure index following femoro-popliteal bypass. Int Angiol. 2008;27(4):329-32.
22. Юдин В. А., Виноградов С. А., Крылов А. А. и др. Аутовенозная реваскуляризация артерий нижних конечностей с вариантной анатомией периферического русла и прогрессирующим течением атеросклеротического процесса. Проблемы социальной гигиены, здравоохранения и истории медицины. 2019;27(6):1093-7. doi:10.32687/0869-866X-2019-27-6-1093-1097.
23. Vukobratov V, Kaćanski M, Pasternak J, et al. Femoro-popliteal reconstructions: “in situ” versus “reversed” technique: comparative results. Med Pregl. 2006;59(7-8):360-4. doi:10.2298/mpns0608360v.
24. Игнатьев И. М., Крепкогорский Н. В., Егоров Д. В. Результаты операции бедренноподколенного (берцового) шунтирования in situ при лечении острой артериальной недостаточности и критической ишемии у пациентов с постэмболическим поражением артериального русла нижних конечностей на фоне мерцательной аритмии. Кардиология и сердечно-сосудистая хирургия. 2016;9(2):24-8. doi:10.17116/kardio20169224-28.
25. Крепкогорский Н. В., Игнатьев И. М., Бредихин Р. А. и др. Первый опыт бедренно-подколенного шунтирования по методике in situ с использованием оригинального способа перевязки притоков аутовены. Кардиология и сердечно-сосудистая хирургия. 2021;14(5):386-91. doi:10.17116/kardio202114051386.
26. Faries PL, Logerfo FW, Arora S, et al. A comparative study of alternative conduits for lower extremity revascularization: all-autogenous conduit versus prosthetic grafts. J Vasc Surg. 2000;32(6):1080-90. doi:10.1067/mva.2000.111279.
27. Калинин Р. Е., Абаленихина Ю. В., Пшенников А. С. и др. Роль восстановленных тиолов в адаптации венозного эндотелия при аутовенозной реконструкции артерий нижних конечностей. Бюллетень сибирской медицины. 2020;19(4):86-93. doi:10.20538/1682-0363-2020-4-86-93.
28. Pomposelli FB Jr, Jepsen SJ, Gibbons GW, et al. A flexible approach to infrapopliteal vein grafts in patients with diabetes mellitus. Arch Surg. 1991;126(6):724-7; discussion 727-9. doi:10.1001/archsurg.1991.01410300070010.
Об авторах
А. Б. ЗакеряевРоссия
Аслан Бубаевич Закеряев — врач сердечно-сосудистый хирург отделения сосудистой хирургии.
Краснодар
Конфликт интересов:
нет
Р. А. Виноградов
Россия
Доктор медицинских наук, зав. отделением сердечно-сосудистой хирургии, зав. операционным блоком, главный сосудистый хирург Краснодарского края.
Краснодар
Конфликт интересов:
нет
П. В. Сухоручкин
Россия
Сердечно-сосудистый хирург.
Краснодар
Конфликт интересов:
нет
С. Р. Бутаев
Россия
Сердечно-сосудистый хирург.
Краснодар
Конфликт интересов:
нет
Т. Э. Бахишев
Россия
Сердечно-сосудистый хирург.
Краснодар
Конфликт интересов:
нет
А. И. Дербилов
Россия
Сердечно-сосудистый хирург.
Краснодар
Конфликт интересов:
нет
Э. Р. Ураков
Россия
Сердечно-сосудистый хирург.
Краснодар
Конфликт интересов:
нет
А. Г. Барышев
Россия
Сердечно-сосудистый хирург.
Краснодар
Конфликт интересов:
нет
В. А. Порханов
Россия
Директор, доктор медицинских наук, профессор, академик РАН.
Краснодар
Конфликт интересов:
нет
Дополнительные файлы
Рецензия
Для цитирования:
Закеряев А.Б., Виноградов Р.А., Сухоручкин П.В., Бутаев С.Р., Бахишев Т.Э., Дербилов А.И., Ураков Э.Р., Барышев А.Г., Порханов В.А. Отдаленные результаты нового способа бедренно-подколенного шунтирования. Российский кардиологический журнал. 2022;27(8):4843. https://doi.org/10.15829/1560-4071-2022-4843
For citation:
Zakeryaev A.B., Vinogradov R.А., Sukhoruchkin P.V., Butaev S.R., Bakhishev T.E., Derbilov A.I., Urakov E.R., Baryshev A.G., Porkhanov V.A. Long-term outcomes of a novel method of femoropopliteal bypass. Russian Journal of Cardiology. 2022;27(8):4843. (In Russ.) https://doi.org/10.15829/1560-4071-2022-4843

















































