Перейти к:
Ранние маркеры формирования патологического ремоделирования левого желудочка у больных после инфаркта миокарда с подъемом сегмента ST по результатам speckle tracking эхокардиографии
https://doi.org/10.15829/1560-4071-2022-4837
Аннотация
Цель. Поиск ранних предикторов формирования патологического постинфарктного ремоделирования у больных, перенесших инфаркт миокарда с подъемом сегмента ST (ИМпST), с помощью метода speckle tracking эхокардиографии (STE).
Материал и методы. В исследовании включено 114 больных ИМпST в возрасте 52 (44; 58) года. Проводилась двумерная эхокардиография c анализом стандартных параметров и STE с анализом деформационных и ротационных характеристик миокарда; определение концентрации мозгового натрийуретического пептида, уровень тропонина-I. В качестве конечной точки оценивали развитие патологического постинфарктного ремоделирования в течение 12 мес. наблюдения. В зависимости от исхода выделены 2 группы: с развитием патологического ремоделирования (ПР) — 45 (39,5%), без ПР (БПР) — 69 (60,5%).
Результаты. Раннее ремоделирование выявлено у 24 (53,3%) человек, среднесрочное — у 15 (33,4%) и у 6 (13,3%) — позднее ремоделирование. В группе “ПР” хроническая сердечная недостаточность (ХСН) наблюдалась у 100% больных, а в группе “БПР” 23 (33,3%) пациента не имели признаков ХСН.
Было установлено, что в раннем периоде инфаркта миокарда каждый из таких показателей, как глобальная продольная деформация (GLS) <11,7%, глобальная циркулярная деформация (GCS) <12,4% и снижение до 7,8o скручивания (Twist), c высокой чувствительностью и специфичностью прогнозирует развитие постинфарктной патологической дилатации. Была создана многофакторная логистическая регрессионная модель формирования ПР у больных ИМпST, в которую вошли GLS, глобальная радиальная деформация (GRS), индекс конечно-диастолического объема (иКДО), определенные на 7-9-е сут. ИМпST.
Заключение. GLS, GSC, Twist ЛЖ являются независимыми высокочувствительными и специфичными предикторами ПР. Установлены ранние предикторы постинфарктной патологической дилатации: сниженная GLS в сочетании с более высокой GRS и иКДО ЛЖ.
Ключевые слова
Для цитирования:
Олейников В.Э., Голубева А.В., Галимская В.А., Бабина А.В., Донецкая Н.А. Ранние маркеры формирования патологического ремоделирования левого желудочка у больных после инфаркта миокарда с подъемом сегмента ST по результатам speckle tracking эхокардиографии. Российский кардиологический журнал. 2022;27(6):4837. https://doi.org/10.15829/1560-4071-2022-4837
For citation:
Oleinikov V.E., Golubeva A.V., Galimskaya V.A., Babina A.V., Donetskaya N.A. Early markers of pathological left ventricular remodeling in patients after ST-elevation myocardial infarction according to speckle-tracking echocardiography. Russian Journal of Cardiology. 2022;27(6):4837. (In Russ.) https://doi.org/10.15829/1560-4071-2022-4837
Раннее патологическое ремоделирование (ПР) левого желудочка (ЛЖ) после инфаркта миокарда (ИМ) с подъемом сегмента ST (ИМпST) вызывается воспалительным процессом с координированной активацией генов, ответственных за транскрипцию серии цитокинов и адгезивных молекул [1][2]. В конечном счете это приводит к деградации экстрацеллюлярного матрикса миокарда и уменьшению мышечных пучков в зоне ИМ [3]. Со временем происходит истончение миокарда и повышение напряжения стенок ЛЖ вследствие увеличения систолической и диастолической нагрузки. Таким образом, ЛЖ меняет свою геометрию и дилатируется. Для ремоделирования характерны усиленный синтез сократительных белков и коллагена, изменение желудочковой реконструкции.
Первичное чрескожное коронарное вмешательство (ЧКВ) произвело революцию в лечении пациентов с ИМпST [4]. Однако даже после экстренного ЧКВ у части больных появляются признаки ремоделирования, несмотря на отсутствие остаточных стенозов и восстановление кровотока в инфаркт-связанной артерии [5].
Развитие ремоделирования ЛЖ является основной причиной появления и прогрессирования хронической сердечной недостаточности (ХСН) и жизнеопасных аритмий. В связи с этим безусловный интерес представляет изучение и прогнозирование данного патологического процесса для выявления лиц с высоким риском развития кардиальных осложнений и смерти от сердечно-сосудистых причин в среднесрочном постинфарктном периоде.
Целью работы являлся поиск ранних предикторов формирования патологического постинфарктного ремоделирования у больных, перенесших ИМпST, с помощью метода speckle tracking эхокардиографии (STE).
Материал и методы
На базе Пензенской областной больницы им. Бурденко проводили проспективное одноцентровое исследование с включением пациентов с ИМпST, госпитализированных в отделение неотложной кардиологии. Работа проведена в рамках клинического исследования с идентификационным номером NCT02590653 (clinicaltrials.gov). Локальный этический комитет Пензенского университета одобрил образцы исходной документации и протокол исследования.
Критерии включения: возраст от 35 до 65 лет, ИМпST, подтвержденный уровнем кардиоспецифических ферментов в диагностически значимом диапазоне, результатами электрокардиографии (ЭКГ), данными коронароангиографии (один гемодинамически значимый стеноз коронарной артерии, при стенозе других не >50%, ствола левой коронарной артерии — не >30%). Критерии исключения: предшествующие ИМ в анамнезе, ХСН выше I функционального класса, неконтролируемая артериальная гипертензия, не синусовый ритм, тяжелые сопутствующие патологии, плохая визуализация эхокардиограммы.
Всего в итоговый анализ вошло 114 больных, из них 100 (88,6%) лиц мужского пола, средний возраст которых составил 52 (44; 58) года. Большинство включенных в исследование имели повышенную массу тела — 27,2 (24,6; 29,2) кг/м2. Ишемическая болезнь сердца ранее выявлялась у 21 (18,4%) пациента; 58 (50,9%) указывали на наличие артериальной гипертензии; у 5 (5,6%) имелся сахарный диабет 2 типа, не требующий лечения инсулином. Заболевания сердечно-сосудистой системы у близких родственников имели 48 пациентов (42,1%), табакозависимость — 73 (64,0%).
Первичному ЧКВ подверглись 44 (38,6%) пациента. Тромболитическая терапия (ТЛТ) с последующим выполнением ЧКВ проведена у 70 (61,4%). Таким образом, реваскуляризация проведена 100% больных. Время от начала ангиозного приступа до проведения ТЛТ составило 2 (1,3; 4,3) ч, до ЧКВ — 6,3 (3,5; 9,9) ч.
По данным ЭКГ признаки переднего ИМ установлены у 66 больных (57,9%) и у 48 (42,1%) выявлен ИМ задней стенки ЛЖ.
Период наблюдения составил 48 нед. Полный спектр обследования проводили на 12, 24 и 48 нед. наблюдения. Клинический статус определяли с помощью шкалы оценки клинического состояния (ШОКС). С 12 нед. пациенты выполняли тест с 6-мин ходьбой (ТШХ).
Двумерная трансторакальная эхокардиография (ЭхоКГ) проводилась на ультразвуковом сканере MyLab Esaote (Италия). Методом индексирования к площади поверхности тела определяли индекс конечно-диастолического объема (иКДО) и индекс конечно-систолического объема (иКСО) ЛЖ. Величину фракции выброса (ФВ) ЛЖ (%) рассчитывали по модифицированному методу Симпсона.
Для количественной оценки сократительной способности миокарда ЛЖ использовали ультразвуковую методику STE (программное обеспечения X-Strain™). Полученные пиковые значения для каждого сегмента ЛЖ усреднялись для регистрации глобальных параметров: глобальная продольная деформация (GLS) (%), глобальная циркулярная деформация (GCS) (%), глобальная радиальная деформация (GRS) (%) и параметры ротационной механики (базальная ротация (Rot bas), апикальная ротация (Rot apex), скручивание ЛЖ/Twist, выраженные в градусах).
Для изучения особенностей постинфарктного периода на фоне изменения геометрии ЛЖ пациентов делили на группы: пациенты с патологическим постинфарктным ремоделированием “ПР” и пациенты без ПР “БПР” в течение 12 мес. после индексного события. ПР считали увеличение иКДО >20% и/или иКСО >15% в любой визит по сравнению с исходным уровнем, измеренным на 7-9-е сут. Выявляли: раннее ремоделирование — развивается в течение 3 мес. после ИМпST; среднесрочное ремоделирование — до 6 мес.; позднее ремоделирование — до 12 мес. наблюдения [5].
При поступлении в стационар у больных определяли уровень тропонина-I на анализаторе Architect I2000. На 7-9 сут., 24 и 48 нед. оценивали уровень мозгового натрийуретического пептида (BNP) в крови на анализаторе Olympus AU480.
Больные получали лечение согласно российским рекомендациям по ведению больных ИМпST [6].
Статистическая обработка результатов проводилась с помощью лицензионной версии Statistica 13.0 компании StatSoftInc (США). При сопоставлении качественных признаков применяли критерий χ2 для несвязанных выборок, МакНемара — при парном сравнении. Однофакторный дисперсионный анализ (ANOVA) с применением критерия Ньюмена-Кейлса использовался при оценке динамики номинальных значений параметров. Все значения количественных признаков приведены с указанием 95% доверительного интервала (ДИ). Анализ с построением ROCкривых применяли для определения диагностических пороговых уравнений с использованием ROC (receiver operating characteristic). Для изучения влияния независимых переменных на развитие патологического постинфарктного ремоделирования, учитывая временные рамки, использовали множественную логистическую регрессию Кокса.
Результаты
Из 135 включенных в исследование больных, 20 (14,8%) человек его не закончили: 6 — выбыли из-за низкой приверженности к лечению; 4 — сменили место жительства, 10 — исключены из-за низкого качества эхокардиографического изображения. За время наблюдения умерло 2 пациента, один на 16-е сут. от разрыва миокарда; второй на 42-ой нед. от отека легких по данным аутопсии. Таким образом, на 48 нед. исследование закончили 113 пациентов (79,7%) и 1 пациент прошел 3 визита и его данные включены в итоговый анализ.
Из 114 человек в группу “БПР” вошло 69 (60,5%) больных, а в группу “ПР” — 45 (39,5%) (табл. 1). Раннее ремоделирование выявлено у 24 (53,3%) человек, среднесрочное — у 15 (33,4%) и у 6 (13,3%) — позднее ремоделирование. Группы “ПР” и “БПР” не различались по гендерному составу, антропометрическим параметрам, факторам риска сердечно-сосудистых заболеваний, объему медикаментозной терапии (табл. 1).
Таблица 1
Характеристика групп в зависимости от отсутствия и наличия ПР
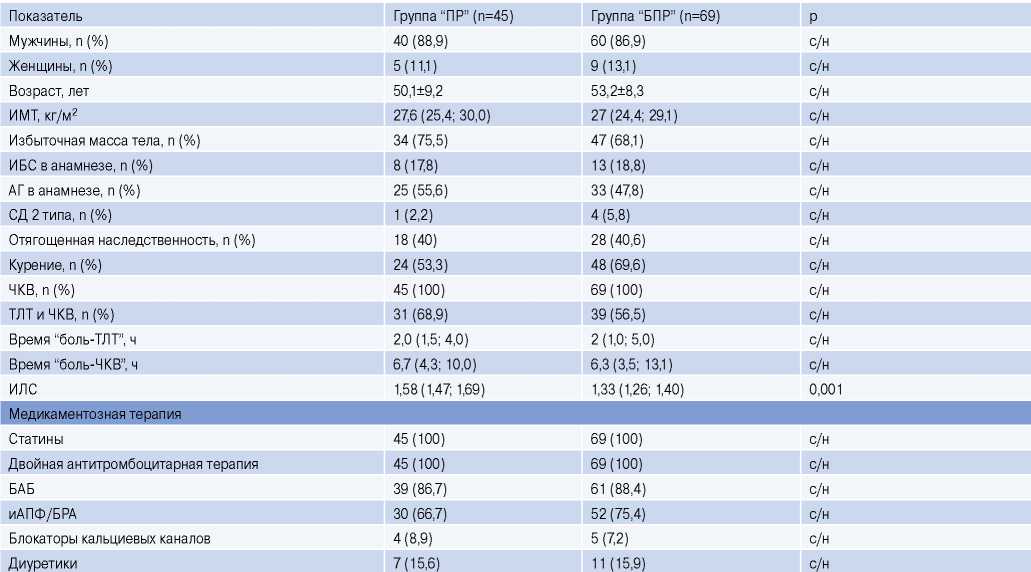
Сокращения: АГ — артериальная гипертония, БАБ — бета-адреноблокаторы, БПР — без патологического ремоделирования, БРА — блокаторы рецепторов ангиотензина II, иАПФ — ингибиторы ангиотензинпревращающего фермента, ИБС — ишемическая болезнь сердца, ИЛС — индекс локальной сократимости, ИМТ — индекс массы тела, ПР — патологическое ремоделирование, СД — сахарный диабет, с/н — статистически не значимо, ТЛТ — тромболитическая терапия, ЧКВ — чрескожное коронарное вмешательство.
Через 6 мес. среди пациентов с ПР выявлено 11 (24,4%) больных с ХСН с низкой ФВ, а в группе “БПР” — 3 (4,3%) (р=0,001). Больных с ХСН с умеренно сниженной ФВ ЛЖ в группе “ПР” было 27 (60%), а в группе “БПР” — 15 (21,7%) (р<0,001). Наконец, ХСН с сохраненной ФВ ЛЖ в группе “ПР”выявлена у 7 (15,6%), в группе “БПР” — у 28 (40,6%) (р=0,006) человек. Таким образом, в группе “ПР” ХСН наблюдалась у 100% больных, а в группе “БПР” 23 (33,3%) пациента не имели признаков ХСН.
Анализ уровня высокочувствительного тропонина-I выявил более высокие значения в группе с ПР 377,1 (95% ДИ 284,5-1038,7) vs 235,8 (95% ДИ 32,3- 503,9) нг/мл (р<0,01). Уровень BNP, измеренный на 7-9-е сут., был значительно больше в группе “ПР” — 240,2 (95% ДИ 104,6-375,8) пг/мл vs 83,4 (95% ДИ 61,4-105,3) пг/мл (р<0,01) у пациентов БПР. В обеих группах происходило значимое снижение BNP (р<0,01), однако на всех визитах в группе “ПР” уровень BNP был выше (р<0,01).
Отличий по среднему количеству баллов ШОКС на 7-9-е сут. в группах не выявлено. Необходимо отметить, что со временем, уже к 12-й нед., наблюдался прирост баллов в обеих группах с сохранением отрицательной динамики до 24-й нед. (p<0,05). С 24-й нед. в группе “БПР” выявили положительную динамику (p<0,05), тогда как в группе “ПР” баллы росли (p<0,05). К концу обследования группы стали различаться: 1,14 (95% ДИ 0,89-1,4) у пациентов “БПР” vs 1,91 (95% ДИ 1,47-2,71) группы “ПР” (p<0,01).
По результатам ТШХ через 6 мес. у обследуемых с ПР зарегистрировали среднюю дистанцию 489,5 (95% ДИ 454,7-524,4) м по сравнению с пациентами “БПР” — 535,5 (95% ДИ 515,5-555,6) м (р=0,01).
Особого внимания заслуживает изучение деформационных и ротационных характеристик миокарда ЛЖ (рис. 1). В группе “ПР” отмечалось снижение GLS и GCS к 24-й нед. (р<0,001), а GRS, вероятно, обусловливала относительную компенсацию инотропной функции, однако и она снизилась к концу обследования на 18,6% (р<0,001). Кроме того, выявили ухудшение скручивания ЛЖ к 48-й нед. (р<0,001) за счет уменьшения апикальной ротации.
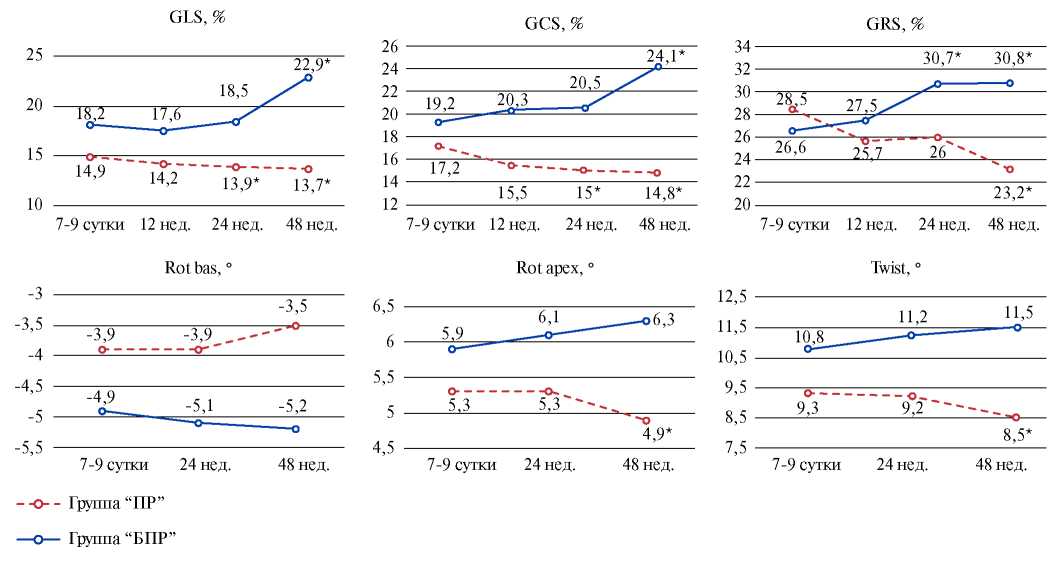
Рис. 1. Динамика деформационных и ротационных характеристик в группах “ПР” (n=45) и “БПР” (n=69).
Примечание: * — р<0,001 — различия между значениями показателей на 7-9-е сут. и последующими визитами.
Сокращения: БПР — без патологического ремоделирования, ПР — патологическое ремоделирование, GCS — глобальная циркулярная деформация, GLS — глобальная продольная деформация, GRS — глобальная радиальная деформация, Rot bas — базальная ротация, Rot apex — апикальная ротация, Twist — скручивание левого желудочка.
У больных группы “БПР” отмечалось улучшение GLS и GCS к концу наблюдения (р<0,001), тогда как GRS увеличилась раньше, уже к 24-й нед., на 13% (р<0,001) с сохранением положительной динамики к 48-й нед. обследования (рис. 1). Вероятно, более раннее улучшение радиальной деформации в данной группе связано с тем, что регенеративные процессы в циркулярном среднем слое миокарда протекают быстрее из-за лучшего кровоснабжения и повреждается он меньше субэндокардиального. Ротационные характеристики в динамике существенно не изменились.
Межгрупповой анализ параметров деформации и ротации уже на 7-9-е сут. показал отличие между группами по ряду параметров (p<0,01), кроме GRS и Rot apex. Статистически значимое различие этих параметров зафиксировали к 12-й нед. обследования (p<0,01). Следовательно, и это необходимо подчеркнуть, все рассматриваемые характеристики биомеханики сердца были лучше у лиц БПР (p<0,01).
Для выявления деформационных характеристик, отражающих развитие постинфарктного ПР, проведен ROC-анализ (табл. 2). Было установлено, что в раннем периоде ИМ каждый из таких показателей, как GLS <11,7%, GCS <12,4% и снижение до 7,80 Twist c высокой чувствительностью и специфичностью прогнозирует развитие постинфарктной патологической дилатации (рис. 2). GRS и Rot apex не имеют диагностической значимости в остром периоде ИМпST.
Таблица 2
Диагностическая значимость параметров деформации как маркеров прогнозирования патологической дилатации в течение 48-нед. периода
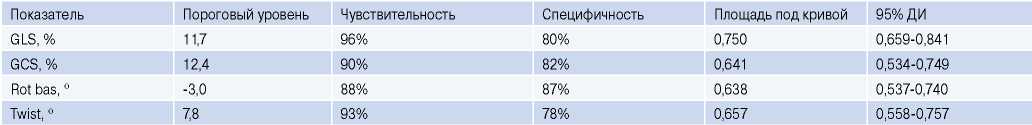
Примечание: p<0,01 во всех случаях.
Сокращения: ДИ — доверительный интервал, GCS — глобальная циркулярная деформация, GLS — глобальная продольная деформация, Rot bas — базальная ротация, Twist — скручивание левого желудочка.
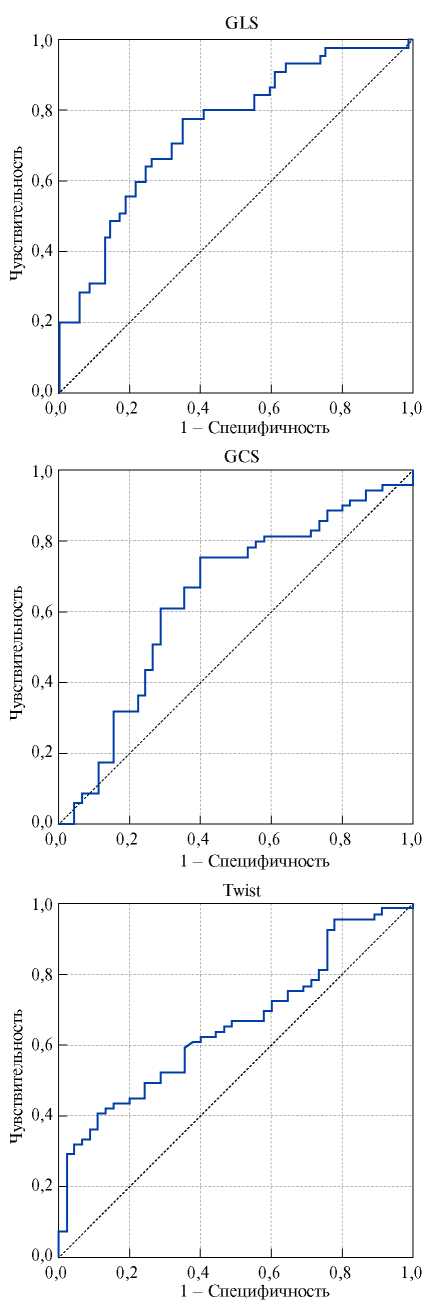
Рис. 2. ROC-анализ для оценки предикторной способности параметров деформации предсказывать ПР.
Примечание: p<0,01.
Сокращения: GCS — глобальная циркулярная деформация, GLS — глобальная продольная деформация, Twist — скручивание левого желудочка.
Для более подробного изучения независимых переменных основных параметров ЭхоКГ и всех показателей деформационной и ротационной биомеханики, как маркеров неблагоприятного ремоделирования в период до 48 нед., был проведен множественный регрессионный анализ Кокса [7]. После пошагового отбора с учетом корреляционных взаимосвязей в регрессионную модель вошли 3 переменные (GLS, GRS, иКДО) с определенным порядком включения на основании предсказательной способности предикторов (p<0,0001) (табл. 3). Однофакторная модель каждого критерия из данной модели продемонстрировала статистическую значимость только для GLS (p<0,0001) с критерием максимального правдоподобия (397,1) более высоким, чем многофакторная модель (385,0). Модель обладает большей предсказательной способностью, если значения этого показателя уменьшаются [8].
Таблица 3
Оценка факторов риска развития ПР у пациентов в постинфарктном периоде в течение 48 нед. по результатам множественного регрессионного анализа Кокса
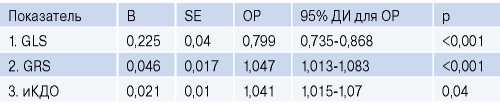
Примечание: Хи-квадрат модели 30,02, р<0,0001.
Сокращения: ДИ — доверительный интервал, иКДО — индекс конечногодиастолического объема, ОР — отношение рисков, В — регрессионный коэффициент, GLS — глобальная продольная деформация, GRS — глобальная радиальная деформация, SE — стандартная ошибка.
Обсуждение
Известно, что постинфарктное ремоделирование, включающее сложные взаимодействия клеточных и гуморальных механизмов и приводящее к структурной перестройке сердца, является основной причиной развития ХСН у пациентов после ИМ [9][10]. В ряде исследований показано, что у 30-48% больных происходит патологическое постинфарктное ремоделирование, вследствие чего качество жизни у них значительно страдает, часто развивается симптомная ХСН и регистрируется увеличение смертности [5][11][12]. Распространенность патологического постинфарктного ремоделирования зависит от используемых ЭхоКГ-критериев. Во всех исследованиях учитывается прирост иКДО или иКСО от исходных значений, однако пороговый уровень с течением времени менялся. Так, в ранних работах встречался прирост иКДО на 8% или на 15% [13][14]. В настоящее время используются более строгие критерии [5]. Также на данные о распространенности влияют временные рамки для диагностики ремоделирования. Поскольку синдром отражает перманентный процесс, протекающий весь год после ИМпST, диагностика определяется дискретностью проведения обследований. Оптимальными можно считать проведение обследования каждые 3 мес., что позволяет получить представление о доле больных, у которых это осложнение развилось на 3, 6, 9 и 12-й мес. постинфарктного периода.
Как установлено в ходе настоящего исследования, у большинства из тех, у кого развилось ПР, это произошло на протяжении первых 12 нед., что согласуется с результатами Van der Bijl P, et al. [5].
По сравнению с группой “БПР” в группе “ПР” была выявлена более высокая доля пациентов с ХСН с низкой ФВ ЛЖ (24,4%) и ХСН с умеренно сниженной ФВ ЛЖ (60%) (р<0,01). Развитие ПР сопровождалось тяжелым течением постинфарктного периода, о чем свидетельствовало увеличение баллов по шкале ШОКС, сниженная толерантность к физической нагрузке по ТШХ, более высокий уровень BNP. Согласно результатам ранее проведенных клинических исследований, постинфарктное ремоделирование ассоциировано с большим размером инфаркта и/или трансмуральностью ИМ, микрососудистой обструкцией, миокардиальным кровоизлиянием и возрастом пациента [15]. В ходе настоящего исследования тяжесть клинического состояния была обусловлена обширной зоной поражения миокарда у пациентов с передним распространенным ИМ по данным ЭКГ; более высоким уровнем тропонина-I; низким значением индекса локальной сократимости по данным ЭхоКГ.
Изучение динамики деформационных и ротационных свойств ЛЖ расширяет представления о механизмах постинфарктного ремоделирования [14][16]. В группе “ПР” к 24-й нед. выявили отрицательную динамику GLS и GCS, при этом средний слой миокарда, ответственный за GRS, по-видимому, обусловливал относительную компенсацию инотропной функции. Однако к 48-й нед. зарегистрировали снижение сократимости средних циркулярных волокон, что нашло отражение в ухудшении радиальной деформации. Важно отметить, что уменьшилась только апикальная ротация, и это повлияло на ухудшение скручивания к 48-й нед. Очевидно, последнее связано с доминированием пациентов, перенесших передний распространенный ИМ с переходом на верхушку ЛЖ.
В группе БПР наблюдали положительную динамику GLS и GCS к концу наблюдения; при этом GRS увеличилась раньше, уже к 24-й нед. на 13% с сохранением положительной динамики к 48-й нед. обследования. Объяснить это можно тем, что у большинства пациентов данной группы был нетрансмуральный ИМ, в меньшей степени затрагивающий средний циркулярный слой мышц, поэтому регенеративные процессы протекали лучше. Ротационные характеристики в динамике не изменились. Благоприятная эволюция биомеханических параметров, очевидно, ассоциировалась с восстановлением функции “оглушенного миокарда” и регрессом постинфарктного ремоделированием ЛЖ. Эффект обратного ремоделирования наблюдали и в других работах, причем в некоторых из них была установлена прогностическая ценность параметров деформации и ротации в изучении этого процесса [17].
Следует подчеркнуть, что межгрупповой анализ на 7-9 сут. ИМпST по параметрам STE установил значимые различия практически по всем показателям: GLS, GCS, Rot apex, Twist. Ранее в ряде публикаций отмечалось, что значения параметров STE являются более тонкими маркерами контрактильной функции ЛЖ, отражающими субклиническую дисфункцию раньше, чем традиционные параметры ЭхоКГ [14][17].
Поскольку отдельные деформационные характеристики миокарда отражают распространенность и глубину некроза после ИМпST [18], можно предположить возможность их использования для прогнозирования ремоделирования ЛЖ. В литературе, однако, имеются единичные сообщения, посвященные данной проблеме. В представленной нами работе на однородной когорте больных с ИМпST было доказано, что методика STE в ранние сроки ИМ позволяет предсказывать высокий риск развития ПР. GLS <11,7%, GCS <12,4% и снижение до 7,80 Twist на 7-9-е сут. заболевания являются независимыми высокочувствительными и высокоспецифичными предикторами постинфарктной патологической дилатации. Наиболее высокой прогностической ценностью обладала GLS, что было установлено и по результатам однофакторного регрессионного анализа. Полученные данные согласуются с рядом других работ, которые также выявили преимущества GLS, обладающего лучшей прогностической способностью в отношении неблагоприятного ремоделирования [14][17]. Важно отметить высокую чувствительность построенной нами многофакторной модели Кокса: сниженная GLS в сочетании с более высокими показателями GRS и иКДО прогнозировала увеличение риска развития патологического постинфарктного ремоделирования на 10% в течение года после ИМпST.
Заключение
1. Развитие патологического постинфарктного ремоделирования в течение первого года после ИМпST сопровождалось снижением всех деформационных характеристик, ухудшением апикальной ротации и скручивания ЛЖ, что приводило в 100% случаев к появлению ХСН.
2. Оценка деформационных и ротационных свойств миокарда в острый период ИМ позволяет предсказывать группу высокого риска для развития ПР. GLS <11,7%, GSC <12,4% и снижение Twist до 7,80 ЛЖ были независимыми высокочувствительными и специфичными предикторами ПР.
3. По результату многофакторного регрессионного анализа установлены ранние предикторы постинфарктной патологической дилатации: сниженная GLS в сочетании с более высокой GRS и иКДО ЛЖ.
Отношения и деятельность. Работа выполнена при финансовой поддержке Российского фонда фундаментальных исследований в рамках научного проекта № 19-315-90031/19.
Список литературы
1. Chowdhury N, Ullah M, Gafur S, et al. Post Infarct Left Ventricular Remodeling: Current Concept in Pathophysiology and Management. Cardiovascular Journal. 2011;3(2):248-53. doi:10.3329/cardio.v3i2.9199.
2. Sun Y. Myocardial repair/remodelling following infarction: roles of local factors. Cardiovascular Research. 2009;81:482-90. doi:10.1093/cvr/cvn333.
3. Azevedo PS, Polegato BF, Minicucci MF, et al. Cardiac Remodeling: Concepts, Clinical Impact, Pathophysiological Mechanisms and Pharmacologic Treatment. Arq Bras Cardiol. 2016;106(1):62-9. doi:10.5935/abc.20160005.
4. Keeley EC, Boura JA, Grines CL. Primary angioplasty versus intravenous thrombolytic therapy for acute myocardial infarction: a quantitative review of 23 randomised trials. Lancet. 2003;361:13-20. doi:10.1016/S0140-6736(03)12113-7.
5. van der Bijl P, Abou R, Goedemans L, et al. Left Ventricular Post-Infarct Remodeling: Implications for Systolic Function Improvement and Outcomes in the Modern Era. JACC Heart Fail. 2020;8(2):131-40. doi:10.1016/j.jchf.2019.08.014.
6. Российские клинические рекомендации. Острый инфаркт миокарда с подъемом сегмента ST электрокардиограммы: реабилитация и вторичная профилактика. Российский кардиологический журнал. 2015;(1):6-52. doi:10.15829/1560-4071-2015-1-6-52.
7. Шарашова Е. Е., Холматова К. К., Горбатова М. А. и др. Применение регрессии Кокса в здравоохранении с использованием пакета статистических программ spss. Наука и Здравоохранение. 2017;6:5-27.
8. Холматова К. К., Шарапова Е. Е., Горбатова М. А. и др. Применение множественного логистического регрессионного анализа в здравоохранении. Наука и Здравоохранение. 2017;4:5-26.
9. Ky B, French B, May Khan A, et al. Ventricular-Arterial Coupling, Remodeling, and Prognosis in Chronic Heart Failure. Journal of the American College of Cardiology. 2013;62(13):1165-72. doi:10.1016/j.jacc.2013.03.085.
10. Zhao W, Zhao J, Rong J. Pharmacological Modulation of Cardiac Remodeling after Myocardial Infarction. Oxidative Medicine and Cellular Longevity. 2020:8815349. doi:10.1155/2020/8815349.
11. Bolognese L, Neskovic AN, Parodi G, et al. Left Ventricular Remodeling After Primary Coronary Angioplasty: Patterns of Left Ventricular Dilation and Long-Term Prognostic Implications. Circulation. 2002;106:2351-7. doi:10.1161/01.cir.0000036014.90197.fa.
12. Flachskampf FA, Schmid M, Rost S, et al. Cardiac imaging after myocardial infarction. European Heart Journal. 2011;32(3):272-83. doi:10.1093/eurheartj/ehq446.
13. Перуцкий Д. Н., Макеева Т. И., Константинов С. Л. Основные концепции постинфарктного ремоделирования миокарда левого желудочка. Актуальные проблемы медицины. 2011;10(105):51-9.
14. D’Andrea A, Cocchia R, Caso P, et al. Global longitudinal speckle-tracking strain is predictive of left ventricular remodeling after coronary angioplasty in patients with recent non-ST elevation myocardial infarction. Intern. J. Cardiology. 2011;153(2):185-91. doi:10.1016/j.ijcard.2010.08.025.
15. Khorramirouz R, Corban MT, Yang SW, et al. Microvascular obstruction in non-infarct related coronary arteries is an independent predictor of major adverse cardiovascular events in patients with ST segment-elevation myocardial infarction. Int J Cardiol. 2018;273:22-8. doi:10.1016/j.ijcard.2018.08.020.
16. Павлюкова Е. Н., Кужель Д. А., Матюшин Г. В. и др. Ротация, скручивание и раскручивание левого желудочка: физиологическая роль и значение в клинической практике. Рациональная фармакотерапия в кардиологии. 2015;1:68-78.
17. Huttin O, Coiro S, Selton-Suty C, et al. Prediction of Left Ventricular Remodeling after a Myocardial Infarction: Role of Myocardial Deformation: A Systematic Review and Meta-Analysis. PLoS One. 2016;30;1:e0168349. doi:10.1371/journal.pone.0168349.
18. Zhu W, Liu W, Tong Y, et al. Three-dimensional speckle tracking echocardiography for the evaluation of the infarct size and segmental transmural involvement in patients with acute myocardial infarction. Echocardiography. 2014;31(1):58-66. doi:10.1111/echo.12284.
Об авторах
В. Э. ОлейниковРоссия
Олейников Валентин Эливич — доктор медицинских наук, профессор, заведующий кафедрой “Терапия”.
Пенза.
Конфликт интересов:
Нет
А. В. Голубева
Россия
Голубева Алена Владимировна — ассистент кафедры “Терапия”.
Пенза.
Конфликт интересов:
Нет
В. А. Галимская
Россия
Галимская Вера Александровна — кандидат медицинских наук, доцент кафедры “Терапия”.
Пенза.
Конфликт интересов:
Нет
А. В. Бабина
Россия
Бабина Анастасия Вячеславовна — аспирант кафедры “Терапия”.
Пенза.
Конфликт интересов:
Нет
Н. А. Донецкая
Россия
Донецкая Наталья Александровна — заведующая отделением лучевой диагностики.
Пенза.
Конфликт интересов:
Нет
Дополнительные файлы
Рецензия
Для цитирования:
Олейников В.Э., Голубева А.В., Галимская В.А., Бабина А.В., Донецкая Н.А. Ранние маркеры формирования патологического ремоделирования левого желудочка у больных после инфаркта миокарда с подъемом сегмента ST по результатам speckle tracking эхокардиографии. Российский кардиологический журнал. 2022;27(6):4837. https://doi.org/10.15829/1560-4071-2022-4837
For citation:
Oleinikov V.E., Golubeva A.V., Galimskaya V.A., Babina A.V., Donetskaya N.A. Early markers of pathological left ventricular remodeling in patients after ST-elevation myocardial infarction according to speckle-tracking echocardiography. Russian Journal of Cardiology. 2022;27(6):4837. (In Russ.) https://doi.org/10.15829/1560-4071-2022-4837
JATS XML

















































