Перейти к:
Дисфункция легочного гомографта после операции Росса у взрослых пациентов: опыт одного центра
https://doi.org/10.15829/1560-4071-2022-4804
Аннотация
Впервые операцию Росса предложил Donald Ross в 1967г. Многочисленные исследования показывают отличные отдаленные результаты операции Росса. Одним из недостатков операции Росса является вмешательство на двух клапанах вследствие дисфункции легочного гомографта.
Цель. Изучить отдаленные результаты состояния легочного гомографта при операции Росса (кумулятивную частоту дисфункции легочного гомографта, свободу от реоперации на легочном гомографте, отдаленную выживаемость, предикторы дисфункции легочного гомографта) с использованием данных одного российского центра.
Материал и методы. В ретроспективное исследование включены пациенты 18 лет и старше с поражением аортального клапана, которым была выполнена операция Росса с апреля 2009 по декабрь 2020гг одним хирургом. Возраст больных составил 35 (26-44) лет. Среди больных были 159 (75%) мужчин. Инфекционный эндокардит в качестве причины патологии аортального клапана был диагностирован у 55 (26%) больных. Двухстворчатый аортальный клапан был диагностирован у 131 (62%) больного. Медиана периода наблюдения составила 79 (26,5-102,7) мес.
Результаты. Комбинированные вмешательства выполнялись в 40 случаях (18,9%). Модифицированная методика Росса применялась в 54 (25,5%) случаях (интрааортальная — 29, окутывание дакроновым протезом в 25). Госпитальная летальность составила 0,5%. Пяти- и десятилетняя общая выживаемость составила 98,5% и 95,4%, кумулятивная частота повторного вмешательства на легочном клапане составила 4,6% через 10 лет, кумулятивная частота дисфункции легочного гомографта составила 35,2% через 10 лет, а единственным фактором, влияющим на дисфункцию легочного гомографта в отдаленном периоде, оказался возраст пациента ≤30 лет (отношение шансов =0,2, 95% доверительный интервал: 0,06-0,7; р=0,02).
Заключение. Свежеприготовленные легочные гомографты имеют низкую частоту дисфункций и повторного вмешательства на легочном клапане после операции Росса. Молодой возраст — это единственный независимый фактор риска дисфункции легочного гомотрансплантата.
Ключевые слова
Для цитирования:
Энгиноев С.Т., Кондратьев Д.А., Зеньков А.А., Магомедов Г.М., Рашидова Т.К., Абдурахманов А.А., Чернов И.И., Тарасов Д.Г. Дисфункция легочного гомографта после операции Росса у взрослых пациентов: опыт одного центра. Российский кардиологический журнал. 2022;27(8):4804. https://doi.org/10.15829/1560-4071-2022-4804
For citation:
Enginoev S.T., Kondratiev D.А., Zenkov A.A., Magomedov G.M., Rashidova T.K., Abdurakhmanov A.A., Chernov I.I., Tarasov D.G. Pulmonary homograft dysfunction after Ross procedure in adults: a single center experience. Russian Journal of Cardiology. 2022;27(8):4804. (In Russ.) https://doi.org/10.15829/1560-4071-2022-4804
Операция Росса имеет ряд преимуществ по гемодинамическим показателям, клапан-ассоциированным осложнениям и выживаемости у молодых пациентов [1-3]. Тем не менее процедура Росса остается ограниченной методикой даже у молодых пациентов [4-6]. В основном, это объясняется технической сложностью операции и риском повторных вмешательства на легочном клапане из-за дисфункции гомотрансплантата. Предыдущие исследования продемонстрировали, что это осложнение в основном связано со стенозом гомотрансплантата [7]. Хотя точный механизм, приводящий к стенозу, остается неясным, считается, что это результат сочетания воспаления, а также непрямой иммунной реакции между хозяином и гомотрансплантатом [7]. Таким образом, были разработаны стратегии, направленные на уменьшение воспаления, к ним относятся систематическое введение противовоспалительных средств в послеоперационном периоде и, начиная с 2001г, использование децеллюляризованных криоконсервированных легочных гомотрансплантатов в надежде снизить риск дисфункции [8]. Действительно, установлено, что стандартные (недецеллюляризованные) криоконсервированные гомотрансплантаты вызывают реакцию, которая частично опосредована иммунными процессами, что влияет на долговечность трансплантанта. Различные исследования сообщают о степени дисфункции от 6% и 30% через 5 лет со стандартными гомотрансплантатами [7][9-11].
Целью данного исследования было изучить отдаленные результаты легочного гомографта при операции Росса (кумулятивную частоту дисфункции легочного гомографта, свободу от реоперации на легочном гомографте, отдаленную выживаемость, предикторы дисфункции легочного гомографта) с использованием данных одного российского центра.
Материал и методы
Популяция включенных больных. В ретроспективное исследование включены 212 пациентов от 18 лет и старше с поражением аортального клапана (АК), которым была выполнена операция Росса с апреля 2009 по декабрь 2020гг одним хирургом. Все пациенты перенесли операцию Росса с использованием свежеприготовленного легочного гомографта (Санкт-Петербургский банк гомографтов, Санкт-Петербург, Россия1).
Всем пациентам проводилось эхокардиографическое (ЭхоКГ) исследование АК до, после операции и до выписки из стационара, пациентам ≥35 лет до операции выполнялась коронарография. До, интраоперационно и в раннем послеоперационном периоде (до выписки из стационара) ЭхоКГ проводились на аппарате экспертного класса ie 33 (Philips, Нидерланды). До и после операции выполнялись трансторакальные ЭхоКГ, интраоперационно чреспищеводное ЭхоКГ исследование. После выписки из стационара ЭхоКГ выполняли по месту жительства или в нашем учреждении. До операции и интраоперационно при ЭхоКГ измеряли необходимые параметры при патологии АК [12][13]. После операции оценивали степень аортальной недостаточности на неоАК (аутографте), пиковый и средний градиенты давления на неоАК (аутографте), размер синусов Вальсальвы, проксимальной части легочного аутографта и аорты, фракция выброса левого желудочка по Simpson, градиент давления на проксимальной и дистальной частях (в области анастомозов) легочного гомографта, степень регургитации легочного гомографта.
За дисфункцию легочного гомографта считали: пиковый градиент на легочном клапане ≥30 мм рт.ст., регургитация на легочном клапане ≥2 степени, хирургическое вмешательство на легочном гомографте. Медиана периода наблюдения составила 79 (26,5-102,7) мес. Исследование было одобрено местным этическим комитетом.
Критерии включения в исследование: пациенты 18 лет и старше.
Хирургическая техника. Двум (0,9%) пациентам доступ к сердцу осуществлялся через министернотомию, в остальных случаях через срединную стернотомию. Во всех случаях использовали полное замещение корня аорты (full root replacement). Проксимальный анастомоз легочного аутографта накладывали с использованием непрерывного (реже) или отдельных узловых швов. Методику окутывания легочного аутографта собственным корнем аорты использовали при расширении или аневризме аорты, при диаметре аорты ≥40 мм выполняли редукцию аорты, при нормальных размерах аорты использовали методику имплантации легочного аутографта в синтетический дакроновый протез, размер сосудистого протеза выбирали такого же диаметра как легочный аутографт или на 2-3 мм больше. При использовании обеих методик устья коронарных артерий имплантировались в легочный аутографт без захвата протеза/собственной аорты по методике “кнопок”. Дакроновый протез в области проксимального анастомоза (в области корня аорты) фиксировался как при операции Дэвида при помощи “П” образных швов на прокладках. Дистальный анастомоз укрепленного аутографта с восходящей аортой по типу “сэндвича” накладывали однорядным швом. Для реконструкции выводного тракта правого желудочка использовали свежеприготовленный легочный гомографт (Санкт-Петербургский банк гомографтов, Россия). Гомотрансплантат был имплантирован в анатомическую ориентацию при помощи непрерывных швов на проксимальном и дистальном концах с использованием нити полипропилен 4-0 и 5-0, соответственно. Техника имплантации была стандартизирована во всех случаях, т.к. выполнялась одним хирургом. После окончания искусственного кровообращения проводили контрольное чреспищеводное ультразвуковое исследование для оценки функции миокарда и клапанов, гемодинамики на аутографте в аортальной позиции и гомографте в выводном отделе правого желудочка (ВОПЖ). Более подробно хирургическая техника и рисунки были описаны нами ранее в соответствующей статье [14].
Статистический анализ. Статистическую обработку материала выполняли с использованием пакета программного обеспечения IBM SPSS Statistics 26 (США) и Jamovi (Version 1.6.9) https://www.jamovi. org. Выполнена проверка всех количественных переменных на тип распределения с помощью критерия Колмогорова-Смирнова с поправкой Лиллиефорса. Количественные признаки, имеющие распределение, близкое к нормальному, описывали в форме среднего значения и стандартного отклонения (M±SD), в случае отличного от нормального распределения в виде медианы и 25-й, 75-й процентили (Me [Q1-Q3]). Время до первого клинического события: летального исхода, реоперации на легочном клапане, а также дисфункции легочного гомографта были оценены с использованием метода Каплана-Майера. Регрессионный анализ Кокса использовали для определения независимых факторов риска наступления конечных точек (дисфункция легочного гомографта). Факторы, имеющие тенденцию к увеличению значимости при одномерном тестировании (p≤0,1), были введены в многомерный анализ. Отношения шансов с 95% доверительными интервалами (ДИ) были рассчитаны для каждого из значимых факторов риска. Проверка статистических гипотез проводилась при критическом уровне значимости р=0,05.
Результаты
Медиана возраста больных составила 35 (26-44) лет. В основном это были мужчины — 159 (75%) человек. Подробная дооперационная характеристика пациентов, включенных в исследование, представлена в таблице 1. Длительность искусственного кровообращения и ишемии миокарда составила 139 (123-155) мин и 115 (103-127) мин, соответственно. У 18,9% выполнялись комбинированные вмешательства: 17 (8%) — коронарное шунтирование, 16 (7,5%) вмешательство на митральном клапане, 4 (1,9%) вмешательство на трикуспидальном клапане, 14 (6,6%) протезирование восходящей аорты (табл. 2). В целом была 1 госпитальная летальность (1/212; 0,5%) (табл. 3).
Таблица 1
Демографические и дооперационные характеристики пациентов

Сокращения: АГ — артериальная гипертензия, АК — аортальный клапан, ИБС — ишемическая болезнь сердца, ИЭ — инфекционный эндокардит, СДЛА — систолическое давление в легочной артерии, ФВ ЛЖ — фракция выброса левого желудочка, ФК — функциональный класс, ФП — фибрилляция предсердий, ХОБЛ — хроническая обструктивная болезнь легких, ХСН — хроническая сердечная недостаточность, ЭКС — электрокардиостимулятор, NYHA — New York Heart Association.
Таблица 2
Интраоперационные параметры

Таблица 3
Постоперационные показатели
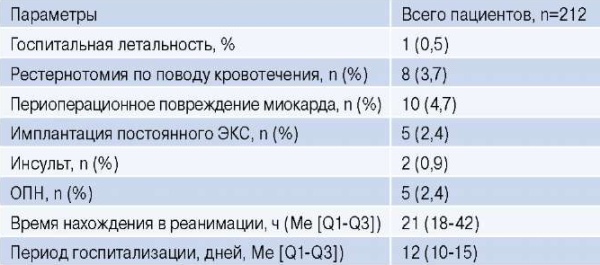
Сокращения: ОПН — острая почечная недостаточность, ЭКС — электрокардиостимулятор.
Отдаленные результаты
Медиана периода наблюдения составила 79 (26,5-102,7) мес. Часть пациентов обследована в нашей клинике, другая часть по месту жительства. Сбор данной информации производился при помощи очной и заочной консультации. При заочной консультации информацию собирали при помощи телефонной связи с пациентом или близким родственником, а также посредством электронной почты. Пятии десятилетняя выживаемость после операции Росса составили 98,5% и 95,4%, соответственно (рис. 1 и 2). Четверым больным после выписки понадобились реоперации на легочном клапане: троим по поводу стеноза c недостаточностью (одному выполнена пластика клапана, второму протезирование клапана аутоперикардом и третьему репротезирование легочным гомографтом), еще одному пациенту выполнена тромбэктомия из легочного гомографта. Таким образом, кумулятивная частота повторного вмешательства на легочном клапане через 10 лет составила 4,6% (рис. 2).
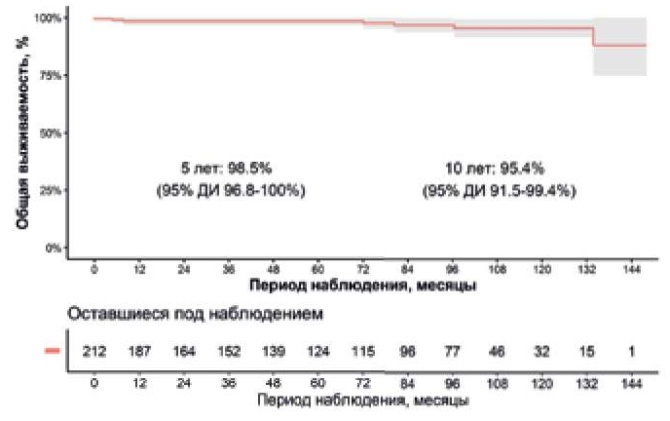
Рис. 1. Кривая Каплана-Мейера для общей выживаемости.
Сокращение: ДИ — доверительный интервал.
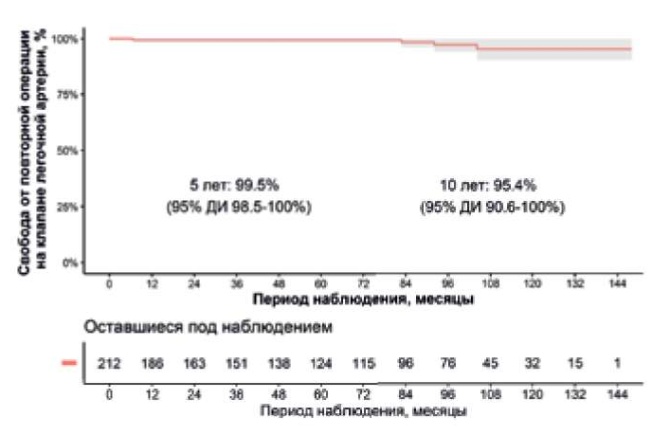
Рис. 2. Свобода от реоперации на легочном клапане.
Сокращение: ДИ — доверительный интервал.
ЭхоКГ наблюдение в отдаленном периоде было достигнуто у 209 (98,5%) больных. Медиана ЭхоКГ наблюдения за пациентами составила 26,5 (11-77) мес. Восемнадцать пациентов (18/158) соответствовали одному из критериев дисфункции легочного гомографта. У 9 пациентов развился стеноз (у двоих стеноз с недостаточностью), у 8 больных регургитация и у одного тромбоз гомографта. Кумулятивная частота дисфункции легочного гомографта через 1, 5 и 10 лет составила: 1,5%, 7,4% и 35,2%, соответственно (рис. 3).
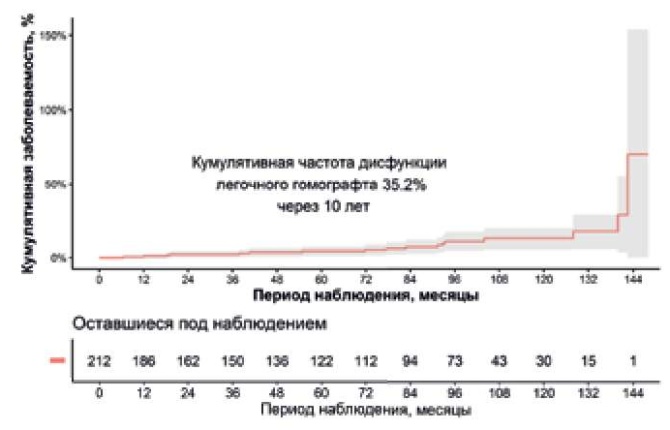
Рис. 3. Кумулятивная частота дисфункции легочного гомографта.
Обсуждение
Проведен сравнительный анализ клинических результатов использования криоконсервированных гомографтов (105 легочных и 5 аортальных) и биопротезов (73 биопротеза “Medtronic Freestyl”) для протезирования легочной артерии во время операции Росса (186 пациентов). По данным клинических наблюдений в течение 8 лет после операции было установлено, что применение гомографтов обеспечивало эффективную работу клапанов неолегочной артерии у 95% пациентов. При этом через 5 лет после операции у 99% пациентов отмечалось отсутствие значимых дисфункций клапанов, что исключало необходимость повторных операций. При использовании биопротезов адекватная работа клапанов неолегочной артерии наблюдалась у 95% пациентов в течение 3 лет после операции. Через 5 лет после операции только у 72% пациентов отсутствовали показания для проведения повторной имплантации. Отмечено также, что у пациентов с гомографтами в ряде случаев возникала регургитация клапанов, тогда как для пациентов с биопротезами характерным являлось формирование стеноза в области дистального анастомоза. На основании анализа результатов операции Росса с использованием гомографтов и биопротезов авторами статьи сделан вывод о том, что у пациентов с биопротезами в правых отделах сердца выше риск возникновения дисфункции имплантата, требующей его замены. При этом в качестве основной причины дисфункции предполагается выраженная воспалительная реакция в области анастомозов [15].
Практика, основанная на предыдущих исследованиях, показывает, что меньшие размеры гомотрансплантатов были связаны с более высокими показателями стенозов гомотрансплантатов в отдаленном периоде [16-18]. Опубликованы данные Канадского регистра по операциям Росса: размер имплантированного гомотрансплантанта в легочную позицию составлял ≥28 мм в 96% случаях [19]. По нашим данным, медиана размера имплантированного легочного гомографта составила 27 (26-29) мм. Частота имплантации ≥27 мм составила 70,7% (табл. 4).
Таблица 4
ЭхоКГ данные в отдаленном периоде наблюдения
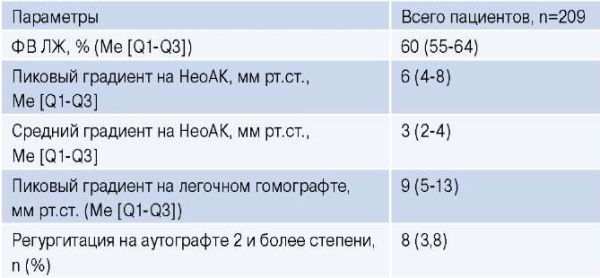
Сокращения: АК — аортальный клапан, ФВ ЛЖ — фракция выброса левого желудочка.
Кумулятивная частота дисфункции легочного децеллюляризованного гомографта (использовали такие же критерии) составила 2%, 9% и 11% через 1, 3 и 6 лет, соответственно, а кумулятивная частота вмешательства на легочном гомографте — 0,5%, 2%, 3% через 1, 3 и 6 лет, соответственно [19]. Проведённый анализ данных 443 пациентов после операции Росса показал свободу от повторного вмешательства на легочном гомографте (криоконсервированном) через 5, 10, 15, 20 лет — 98,9%, 97,7%, 96,6% и 96,6%, соответственно, свободу от дисфункции 94,5%, 88,1%, 84,9% и 78,3% через 5, 10, 15, 20 лет, соответственно [9]. По нашим же данным кумулятивная частота дисфункции легочного гомографта составила 1,5%, 4,4%, 9,4% через 1, 3 и 6 лет, а кумулятивная частота повторных вмешательств на легочном гомографте 0,5%, 0,5%, 1,2% через 1, 3 и 6 лет, соответственно (рис. 2 и 3). По данным Канадского регистра по операциям Росса возраст реципиентов <45 лет был независимым фактором риска дисфункции легочного децеллюляризованного гомографта [19]. По нашим данным, при проведении многофакторного анализа выявлен один фактор, влияющий на дисфункцию легочного гомографта — это возраст ≤30 лет (табл. 5).
Таблица 5
Факторы, влияющие на дисфункцию легочного гомографта
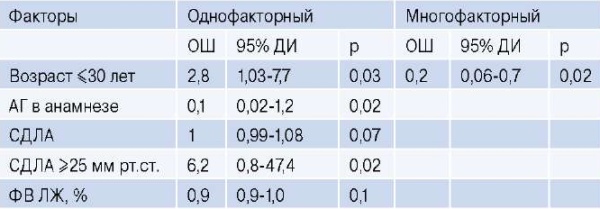
Сокращения: АГ — артериальная гипертензия, ДИ — доверительный интервал, ОШ — отношение шансов, СДЛА — систолическое давление в легочной артерии, ФВ ЛЖ — фракция выброса левого желудочка.
Опубликованы отдаленные результаты процедуры Росса с использованием децеллюляризованных биопротезов AutoTissue Matrix PVR. При ЭхоКГ контроле в отдаленном периоде была высокая частота дисфункции протеза и правожелудочковой недостаточности. Частота легочной регургитации ≥2 степени через 1, 5 и 10 лет составила 12,7%, 36,8% и 41,1%, а средний градиент на клапане через 1, 5 и 10 лет составил 35,2±12 мм рт.ст., 39,4±13,6 мм рт.ст. и 41,3±1,9 мм рт.ст. Свобода от повторной операции на легочном клапане через 5, 10 и 12,5 лет составила 76,2±2,1%, 58,6±2,9% и 53,4±3,4%, соответственно [20].
Были проанализированы результаты 28 пациентов, которым в качестве реконструкции ВОПЖ при операции Росса использовали кондуит из политетрафторэтилена. Средняя продолжительность наблюдения составила 48,5±31,2 мес. Транспротезные градиенты со временем значительно увеличились. Размер кондуита был единственным независимым предиктором прогрессирования пикового градиента ВОПЖ (р=0,02). Ни у одного из пациентов не наблюдалось значительной регургитации ВОПЖ. Одному пациенту потребовалась повторная операция на ВОПЖ [21].
В метаанализе по операциям Росса показано отсутствие вмешательства на ВОПЖ через 5, 10, 15 и 20 лет в 95,0% (95% ДИ: 94,2-95,7%), 90,6% (95% ДИ: 89,5-91,7%), 87,8% (95% ДИ: 86,3-89,2%) и 84,1% (81,9-86,3%) случаях. Свобода от повторного вмешательства при реконструкции ВОПЖ гомотрансплантатом составила 97,9% (95% ДИ: 97,4-98,4%) и 96,1% (95% ДИ: 95,3-96,9%), 93,5% (95% ДИ: 92,3-94,8%) и 89,6% (95% ДИ: 87,4-91,9%) в течение 5, 10, 15 и 20 лет, соответственно. Свобода от повторного вмешательства при реконструкции ВОПЖ ксенотрансплантатом составила 77,7% (95% ДИ: 71,4-81,4%) и 61,0% (95% ДИ: 56,0-66,5%) через 5 и 10 лет, соответственно [22].
Ограничение исследования. Исследование представляет собой ретроспективный анализ, все операции выполнены одним опытным хирургом. Проспективное рандомизированное исследование на большой выборке пациентов необходимо для повышения степени доказательств результатов.
Заключение
Свежеприготовленные легочные гомографты имеют низкую частоту дисфункций и повторного вмешательства на легочном клапане после операции Росса. Молодой возраст — это единственный независимый фактор риска дисфункции легочного гомотрансплантата.
Отношения и деятельность: все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье.
1. http://гомографт.рф
Список литературы
1. El-Hamamsy I, Eryigit Z, Stevens L-M, et al. Long-term outcomes after autograft versus homograft aortic root replacement in adults with aortic valve disease: a randomised controlled trial. Lancet. 2010;376:524-31. doi:10.1016/S0140-6736(10)60828-8.
2. Buratto E, Shi WY, Wynne R, et al. Improved Survival After the Ross Procedure Compared With Mechanical Aortic Valve Replacement. J Am Coll Cardiol. 2018;71:1337-44. doi:10.1016/j.jacc.2018.01.048.
3. Mazine A, David TE, Rao V, et al. Long-Term Outcomes of the Ross Procedure Versus Mechanical Aortic Valve Replacement: Propensity-Matched Cohort Study. Circulation. 2016;134:576-85. doi:10.1161/CIRCULATIONAHA.116.022800.
4. Reece TB, Welke KF, O’Brien S, et al. Rethinking the ross procedure in adults. Ann Thorac Surg. 2014;97:175-81. doi:10.1016/j.athoracsur.2013.07.036.
5. Carrel T. The Ross procedure is under-used although long-term results show superior results to those obtained following mechanical aortic valve replacement. Ann Transl Med. 2016;4:S21. doi:10.21037/atm.2016.10.12.
6. Otto CM, Nishimura RA, Bonow RO, et al. 2020 ACC/AHA Guideline for the Management of Patients With Valvular Heart Disease: Executive Summary: A Report of the American College of Cardiology/American Heart Association Joint Committee on Clinical Practice Guidelines. Circulation 2021;143:e35-71. doi:10.1161/CIR.0000000000000932.
7. Carr-White GS, Kilner PJ, Hon JK, et al. Incidence, location, pathology, and significance of pulmonary homograft stenosis after the Ross operation. Circulation. 2001;104:I16-20. doi:10.1161/hc37t1.094545.
8. Ghoneim A, Bouhout I, Losenno K, et al. Expanding Eligibility for the Ross Procedure: A Reasonable Proposition? Can J Cardiol. 2018;34:759-65. doi:10.1016/j.cjca.2018.01.023.
9. Fricke TA, Skillington PD, Shi WY, et al. Pulmonary Valve Function Late After Ross Procedure in 443 Adult Patients. Ann Thorac Surg. 2020;109:1127-31. doi:10.1016/j.athoracsur.2019.07.060.
10. Kalfa D, Feier H, Loundou A, et al. Cryopreserved homograft in the Ross procedure: outcomes and prognostic factors. J Heart Valve Dis. 2011;20:571-81.
11. Feier H, Collart F, Ghez O, et al. Risk factors, dynamics, and cutoff values for homograft stenosis after the Ross procedure. Ann Thorac Surg. 2005;79:1669-75; discussion 1675. doi:10.1016/j.athoracsur.2004.10.060.
12. Zoghbi WA, Adams D, Bonow RO, et al. Recommendations for Noninvasive Evaluation of Native Valvular Regurgitation: A Report from the American Society of Echocardiography Developed in Collaboration with the Society for Cardiovascular Magnetic Resonance. J Am Soc Echocardiogr Off Publ Am Soc Echocardiogr. 2017;30:303-71. doi:10.1016/j.echo.2017.01.007.
13. Baumgartner H, Hung J, Bermejo J, et al. Recommendations on the Echocardiographic Assessment of Aortic Valve Stenosis: A Focused Update from the European Association of Cardiovascular Imaging and the American Society of Echocardiography. J Am Soc Echocardiogr. 2017;30:372-92. doi:10.1016/j.echo.2017.02.009.
14. Tsaroev B, Chernov I, Enginoev S, Mustaev M. Survival and freedom from reoperation after the Ross procedure in a Russian adult population: A single-center experience. JTCVS Open 2022;10:140-7. doi:10.1016/j.xjon.2022.04.026.
15. Miskovic A, Monsefi N, Doss M, et al. Comparison between homografts and Freestyle® bioprosthesis for right ventricular outflow tract replacement in Ross procedures. Eur J Cardio-Thoracic Surg Off J Eur Assoc Cardio-Thoracic Surg. 2012;42:927-33. doi:10.1093/ejcts/ezs185.
16. Raanani E, Yau TM, David TE, et al. Risk factors for late pulmonary homograft stenosis after the Ross procedure. Ann Thorac Surg. 2000;70:1953-7. doi:10.1016/s00034975(00)01905-6.
17. Mokhles MM, Charitos EI, Stierle U, et al. The fate of pulmonary conduits after the Ross procedure: longitudinal analysis of the German-Dutch Ross registry experience. Heart. 2013;99:1857-66. doi:10.1136/heartjnl-2013-304425.
18. Pasquali SK, Shera D, Wernovsky G, et al. Midterm outcomes and predictors of reintervention after the Ross procedure in infants, children, and young adults. J Thorac Cardiovasc Surg. 2007;133:893-9. doi:10.1016/j.jtcvs.2006.12.006.
19. Chauvette V, Bouhout I, Tarabzoni M, et al. Pulmonary homograft dysfunction after the Ross procedure using decellularized homografts-a multicenter study. J Thorac Cardiovasc Surg. 2022;163:1296-1305.e3. doi:10.1016/j.jtcvs.2020.06.139.
20. Christ T, Paun AC, Grubitzsch H, et al. Long-term results after the Ross procedure with the decellularized AutoTissue Matrix P® bioprosthesis used for pulmonary valve replacement. Eur J Cardio-Thoracic Surg. 2019;55:885-92. doi:10.1093/ejcts/ezy377.
21. Sharifulin R, Bogachev-Prokophiev A, Demin I, et al. Right ventricular outflow tract reconstruction using a polytetrafluoroethylene conduit in Ross patients. Eur J Cardio-Thoracic Surg Off J Eur Assoc Cardio-Thoracic Surg. 2018;54:427-33. doi:10.1093/ejcts/ezy128.
22. Flynn CD, Bono JH De, Muston B, et al. Systematic review and meta-analysis of longterm outcomes in adults undergoing the Ross procedure. Ann Cardiothorac Surg. 2021;10(4):411-9. doi:10.21037/acs-2021-rp-30.
Об авторах
С. Т. ЭнгиноевРоссия
Сослан Тайсумович Энгиноев — кандидат медицинских наук, сердечно-сосудистый хирург, ассистент кафедры сердечно-сосудистой хирургии ФПО.
Астрахань
Конфликт интересов:
нет
Д. А. Кондратьев
Россия
Дмитрий Анатольевич Кондратьев — кандидат медицинских наук, зав. кардиохирургического отделения № 1, врач сердечно-сосудистый хирург.
Астрахань
Конфликт интересов:
нет
А. А. Зеньков
Россия
Александр Александрович Зеньков — доктор медицинских наук, зам. главного врача по научной работе и инновациям, врач сердечнососудистый хирург.
Астрахань
Конфликт интересов:
нет
Г. М. Магомедов
Россия
Гасан Магомедзагирович Магомедов — врач сердечно-сосудистый хирург.
Астрахань
Конфликт интересов:
нет
Т. К. Рашидова
Россия
Тамара Кулумбековна Рашидова — врач УЗИ.
Астрахань
Конфликт интересов:
нет
А. А. Абдурахманов
Россия
Астархан абдурахманович Абдурахманов — клинический ординатор 2 года кафедры сердечно-сосудистой хирургии ФПО.
Астрахань
Конфликт интересов:
нет
И. И. Чернов
Россия
Игорь Ионович Чернов — кандидат медицинских наук, зам. главного врача по хирургической помощи.
Астрахань
Конфликт интересов:
нет
Д. Г. Тарасов
Россия
Дмитрий Георгиевич Тарасов — кандидат медицинских наук, главный врач, врач сердечно-сосудистый хирург.
Астрахань
Конфликт интересов:
нет
Дополнительные файлы
Рецензия
Для цитирования:
Энгиноев С.Т., Кондратьев Д.А., Зеньков А.А., Магомедов Г.М., Рашидова Т.К., Абдурахманов А.А., Чернов И.И., Тарасов Д.Г. Дисфункция легочного гомографта после операции Росса у взрослых пациентов: опыт одного центра. Российский кардиологический журнал. 2022;27(8):4804. https://doi.org/10.15829/1560-4071-2022-4804
For citation:
Enginoev S.T., Kondratiev D.А., Zenkov A.A., Magomedov G.M., Rashidova T.K., Abdurakhmanov A.A., Chernov I.I., Tarasov D.G. Pulmonary homograft dysfunction after Ross procedure in adults: a single center experience. Russian Journal of Cardiology. 2022;27(8):4804. (In Russ.) https://doi.org/10.15829/1560-4071-2022-4804
JATS XML

















































