Перейти к:
Прогрессирование атеросклероза коронарных артерий у пациентов, перенесших коронарное стентирование, в зависимости от тактики наблюдения кардиологом
https://doi.org/10.15829/1560-4071-2022-4796
Аннотация
Цель. Сравнить частоту прогрессирования коронарного атеросклероза у пациентов, перенесших коронарное стентирование (КС), при очном и дистанционном наблюдении кардиологом по данным годового исследования.
Материал и методы. В исследование включено 279 пациентов 61,5±9,5 лет со стабильной стенокардией напряжения 2 функционального класса и выше, либо безболевой ишемией миокарда, которым было проведено КС. Было сформировано 3 группы: группа 1 (n=96) — непосредственное наблюдение кардиолога перед КС, через 1, 3, 6 и 12 мес. после него. Группа 2 (n=95) — дистанционное наблюдение: пациенты находились под непосредственным контролем терапевта по месту жительства с привлечением кардиолога по дистанционным каналам связи (электронная почта, телефон, Skype) через 1, 3, 6 и 12 мес. Группа 3 (n=88) — наблюдение терапевтом по месту жительства, контакт с координатором исследования осуществлялся перед КС и по истечении 12 мес. после вмешательства. По истечении 12 мес. после КС всем пациентам была проведена проба на стресс-индуцированную ишемию миокарда. При положительном либо сомнительном результате пробы проводилась коронароангиография (КАГ).
Результаты. Стресс-индуцированная ишемия миокарда в ходе инструментального обследования через 12 мес. после КС была верифицирована у 58 пациентов (21%): 19 пациентов (19,8%) группы 1, 9 пациентов (9,5%) группы 2 и 30 пациентов (34,1%) группы 3, р<0,05. Контрольная КАГ была проведена 96 пациентам (34,4% от общего числа больных). У 8 (2,9%) пациентов выявлен рестеноз, у 38 (13,6%) — прогрессирование коронарного атеросклероза и у 4 (1,4%) — сочетание вышеперечисленного. Прогрессирование коронарного атеросклероза достоверно чаще отмечалось в группе 3: 10,4%, 9,5% и 21,6% в группах 1, 2 и 3, соответственно (p<0,05). По частоте развития рестеноза стента группы были сопоставимы: 2,1%, 3,2% и 3,5% в группах 1, 2 и 3, соответственно.
Заключение. Прогрессирование коронарного атеросклероза было основной причиной повторных реваскуляризаций через 12 мес. после индексного КС. Очное и дистанционное наблюдение кардиолога ассоциировано с меньшей частотой прогрессирования коронарного атеросклероза и повторной КАГ на протяжении 12 мес. наблюдения после КС.
Для цитирования:
Щинова А.М., Осокина А.К., Потехина А.В., Шестова И.И., Филатова А.Ю., Долгушева Ю.А., Ефремова Ю.Е., Проваторов С.И. Прогрессирование атеросклероза коронарных артерий у пациентов, перенесших коронарное стентирование, в зависимости от тактики наблюдения кардиологом. Российский кардиологический журнал. 2022;27(6):4796. https://doi.org/10.15829/1560-4071-2022-4796
For citation:
Shchinova A.M., Osokina A.K., Potekhina A.V., Shestova I.I., Filatova A.Yu., Dolgusheva Yu.A., Efremova Yu.E., Provatorov S.I. Coronary atherosclerosis progression in patients after coronary stenting, depending on a cardiology follow-up strategy. Russian Journal of Cardiology. 2022;27(6):4796. (In Russ.) https://doi.org/10.15829/1560-4071-2022-4796
На настоящий момент эндоваскулярные вмешательства являются одним из самых распространенных методов диагностики и лечения. Так, по некоторым данным, в Российской Федерации выполняется >200 тыс. чрескожных коронарных вмешательств на коронарных артериях в год [1]. Согласно большинству крупных исследований, плановое коронарное стентирование (КС) не оказывает положительного влияния на прогноз у пациентов со стабильными формами ишемической болезни сердца (ИБС), но улучшает толерантность к физическим нагрузкам и качество жизни [2].
Значительное количество пациентов, перенесших операцию КС, проживают в удаленных районах и не имеют возможности регулярно контактировать с кардиологом, что влечет за собой снижение приверженности к лечению и увеличение риска сердечно-сосудистых осложнений [3]. По некоторым данным, в сельской местности, удаленных и труднодоступных областях России проживает до 50 млн человек1. Для категорий больных, имеющих затруднения в своевременном контакте с кардиологом, разрабатываются алгоритмы терапевтического наблюдения, подкрепленного консультативной кардиологической помощью с применением технологий дистанционного взаимодействия.
В последние годы количество публикаций, посвященных дистанционному наблюдению, значительно увеличилось [4]. Телемедицинские технологии активно изучаются в контексте наблюдения за пациентами с артериальной гипертензией, хронической сердечной недостаточностью, нарушениями ритма сердца, ИБС.
Согласно данным ряда исследований, телемедицинское наблюдение является альтернативой очному наблюдению как по эффективности, так и по экономическим затратам. Согласно результатам метаанализа, включившего 43 исследования, телемедицинские консультации проживающих в сельской местности пациентов сопоставимы по клиническим исходам с личными визитами больных к врачам [5]. В контексте эффективности телемедицинских технологий наиболее часто изучается возможность модификации факторов риска (ФР) сердечно-сосудистых заболеваний. Данные литературы свидетельствуют о том, что применение дистанционного наблюдения ассоциировано со снижением массы тела, уменьшением окружности талии, увеличением уровня физической активности, улучшением контроля артериального давления (АД), поддержанием оптимальных уровней атерогенных липидов, снижением общего сердечно-сосудистого риска, а также улучшением приверженности к лечению [6].
Целью исследования являлась оценка частоты прогрессирования коронарного атеросклероза у перенесших КС пациентов при непосредственном и дистанционном наблюдении кардиологом через 12 мес. после индексной реваскуляризации.
Материал и методы
Исследование было выполнено в соответствии со стандартами надлежащей клинической практики (Good Clinical Practice) и принципами Хельсинкской декларации. Протокол исследования был одобрен Этическим комитетом участвующего клинического центра. До включения в исследование у всех участников было получено письменное информированное согласие.
В исследование было включено 279 пациентов в возрасте от 31 до 80 лет (61,5±9,5 лет), находившихся на стационарном лечении в ФГБУ “НМИЦ кардиологии” Минздрава России с 2017 по 2019гг, которым было проведено стентирование коронарных артерий ввиду стенокардии напряжения II-IV функционального класса (определенной по шкале Канадской ассоциации кардиологов) либо безболевой ишемии миокарда, верифицированных по данным пробы на стресс-индуцированную ишемию миокарда (стресс-эхокардиография, тредмил-тест, велоэргометрия).
Критериями исключения из исследования были: невозможность выполнения КС у конкретного пациента; гемодинамически значимое поражение ствола левой коронарной артерии; наличие хронических воспалительных инфекционных заболеваний или других состояний, приводящих к повышению уровня маркеров воспаления в крови; наличие состояний, самостоятельно ухудшающих прогноз пациента, либо повышающих интраоперационный риск при процедуре стентирования (онкологические заболевания вне стойкой ремиссии, декомпенсированная недостаточность кровообращения с фракцией выброса левого желудочка <30%, хроническая болезнь почек при скорости клубочковой фильтрации <30 мл/мин/1,73 м2; планируемые в течение ближайшего года хирургические вмешательства; невозможность приема двойной антитромботической терапии, статинов на этапе включения пациентов в исследование; необходимость постоянного приема антикоагулянтов; невозможность наблюдения за пациентом.
Каждому пациенту, включенному в исследование, перед проведением стентирования проводился осмотр кардиологом, выполнялся общеклинический и биохимический анализ крови, включающий определение содержания гемоглобина, количества эритроцитов, лейкоцитов, тромбоцитов, и скорости оседания эритроцитов, содержания общего холестерина (ХС), ХС липопротеидов низкой плотности (ЛНП), ХС липопротеидов высокой плотности (ЛВП), триглицеридов (ТГ), глюкозы, креатинина, общего билирубина, аспартатаминотрансферазы, аланинаминотрансферазы, креатинфосфокиназы, С-реактивного белка, измеренного высокочувствительным методом (вчСРБ).
Для дальнейшего анализа пациенты были разделены на 3 группы. Группа 1 (n=96) — активное наблюдение кардиологом. Пациенты, включенные в группу, лично являлись в ФГБУ “НМИЦ кардиологии” Минздрава России через 1, 3, 6 и 12 мес. после эндоваскулярного лечения, в ходе визита осуществлялся осмотр кардиологом, оценивалась приверженность к приему назначенной терапии и ее эффективность, при необходимости выполнялась коррекция лечения. Также выполнялись общий и биохимический анализы крови.
Группа 2 (n=95) — дистанционное наблюдение кардиологом. Через 1, 3 и 6 мес. после стентирования пациенты, включенные в указанную группу, выполняли общий и биохимический анализ крови по месту жительства, после чего контактировали с кардиологом в ФГБУ “НМИЦ кардиологии” Минздрава России по телефону и передавали результаты анализов по каналам, позволяющим осуществлять шифрование данных. В ходе дистанционного контакта оценивалось общее состояние пациента, возможные проявления ишемии миокарда, проводился опрос на предмет приверженности к приему назначенной терапии. В случае необходимости формировались рекомендации по коррекции проводимой терапии.
Группа 3 (n=88) — стандартное наблюдение по месту жительства. Пациенты данной группы наблюдались терапевтом либо врачом общей практики по месту жительства и в случае необходимости направлялись на консультацию кардиолога в ФГБУ “НМИЦ кардиологии” Минздрава России по решению врача, осуществляющего наблюдение. Протокол исследования не предусматривал плановых контактов пациентов группы 3 с координатором исследования на протяжении наблюдения, однако у пациентов была возможность связаться с координатором при возникновении сердечно-сосудистых событий.
По истечении 12 мес. после стентирования каждый пациент, включенный в исследование, приглашался для планового обследования в ФГБУ “НМИЦ кардиологии” Минздрава России. Пациент осматривался кардиологом, выполнялись рутинные анализы крови, проводилась стресс-эхокардиография для верификации ишемии миокарда. В случае выявления ишемии миокарда либо при невозможности исключить ишемию миокарда с помощью нагрузочной пробы пациенту проводилась коронароангиография (КАГ).
Данные представлены как медиана (25-й; 75-й процентили) в случае несоответствия их параметрам нормального распределения, в случае нормального распределения — как среднее ± стандартное отклонение. Для множественного межгруппового сравнения использовался критерий КраскаллаУоллиса, для попарных межгрупповых сравнений — U-критерий Манна-Уитни, для попарных внутригрупповых сравнений — критерий Вилкоксона. Для сопоставления групп по качественным признакам использовали двусторонний критерий Фишера. Для сопоставления групп по бинарным признакам использовали метод χ2. В работе применяли пакет статистических программ Statistica 10, StatSoft. Различия считали статистически значимыми при p<0,05.
Результаты
Клиническая характеристика пациентов, включенных в исследование
В группах 1 и 3 доля мужчин была несколько выше в сравнении с группой 2. По остальным клиниколабораторным характеристикам группы между собой достоверно не отличались (табл. 1).
Таблица 1
Клиническая характеристика пациентов, включенных в исследование
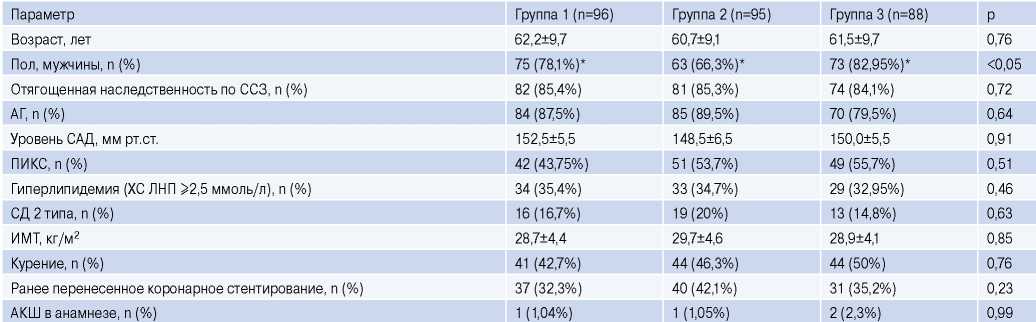
Примечание: возраст и ИМТ представлены как среднее и стандартное отклонение от среднего, остальные параметры представлены как абсолютное значение и процентное отношение к общему числу наблюдений в каждой группе, * — р<0,05.
Сокращения: АГ — артериальная гипертензия, АКШ — аортокоронарное шунтирование, ИМТ — индекс массы тела, ПИКС — постинфарктный кардиосклероз, САД — систолическое артериальное давление, СД — сахарный диабет, ССЗ — сердечно-сосудистые заболевания, ХС ЛНП — холестерин липопротеидов низкой плотности.
По основным лабораторным показателям, включая общегематологические, показатели липидного профиля, уровень глюкозы, креатинина, печеночных аминотрансфераз, общего билирубина, вчСРБ, креатинфосфокиназы, группы достоверно не отличались.
На момент включения в исследование каждый пациент получал гиполипидемическую (статины) и дезагрегантную терапию (сочетание ацетилсалициловой кислоты в дозе 75-100 мг/сут. и клопидогрела в дозе 75 мг/сут. либо тикагрелора 180 мг/сут.). Дозы статинов, получаемые пациентами каждой из групп на момент включения в исследование, были сопоставимы. По частоте приема различных препаратов группы значимо не отличались (табл. 2).
Таблица 2
Медикаментозная терапия у пациентов различных групп, включенных в исследование
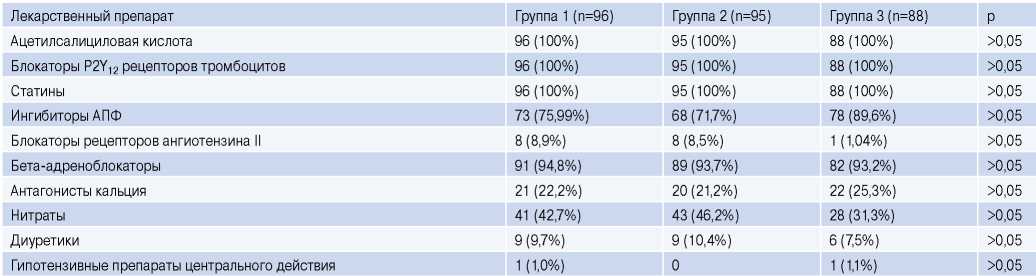
Сокращение: АПФ — ангиотензинпревращающий фермент.
Всем пациентам, включенным в исследование, была выполнена имплантация коронарных стентов с лекарственным антипролиферативным покрытием. По количеству пораженных коронарных артерий, диаметру и количеству имплантируемых стентов группы пациентов были сопоставимы.
Оценка клинического статуса и ангиографических характеристик через 12 мес. после КС
За обозначенный протоколом исследования период наблюдения 12 мес. случаев смерти, развития инфаркта миокарда, острого нарушения мозгового кровообращения среди включенных в исследование пациентов зарегистрировано не было. У 86 (31%) пациентов (26 в группе 1, 15 — в группе 2, 45 — в группе 3) отмечался рецидив болевого синдрома в грудной клетке, в ходе инструментального обследования преходящая ишемия миокарда была верифицирована у 58 (21%) пациентов: у 19 пациентов из группы 1, 9 — из группы 2 и 30 — из группы 3 (p<0,05).
Повторная КАГ проводилась при наличии у пациента возобновившейся стенокардии, положительном или сомнительном результате пробы на выявление стресс-индуцированной ишемии миокарда. Прогрессирование коронарного атеросклероза определялось как появление нового стеноза (≥50%) или усугубление существовавшего (≥30%) как минимум на 20% в артерии диаметром ≥2 мм. Рестеноз стентированного сегмента определялся как возникновение повторного стенозирования на 50% и более в стентированном сегменте, либо в прилегающих участках сосуда на протяжении 5 мм проксимальнее или дистальнее. Контрольная КАГ была проведена 96 пациентам (34,4% от общего числа больных, включенных в исследование).
Вновь возникшее значимое стенозирование коронарных артерий было отмечено у 50 пациентов (18% больных, включенных в исследование, и 52% больных, подвергшихся повторной КАГ). У 8 (2,9%) пациентов выявлен рестеноз, у 38 (13,6%) — прогрессирование коронарного атеросклероза и у 4 (1,4%) — сочетание рестеноза и прогрессирования коронарного атеросклероза. Повторная реваскуляризация была выполнена у 27 пациентов (10% больных, включенных в исследование, и 27% больных, подвергшихся повторной КАГ). У 25 из них выполнено повторное КС, двое подверглись операции шунтирования коронарных артерий. Изолированный рестеноз стал причиной повторного вмешательства у 1 пациента (3,7% от всех повторных вмешательств), прогрессирование атеросклероза — у 24 (88,9%), сочетание рестеноза с прогрессированием коронарного атеросклероза — у 2 (7,4%) пациентов. Таким образом, прогрессирование коронарного атеросклероза отмечалось у включенных в исследование пациентов чаще, чем развитие рестеноза (р<0,05), и чаще служило причиной повторной реваскуляризации (p<0,05) (табл. 3).
Таблица 3
Ангиографические характеристики пациентов по результатам повторного эндоваскулярного вмешательства через 12 мес. после индексной реваскуляризации
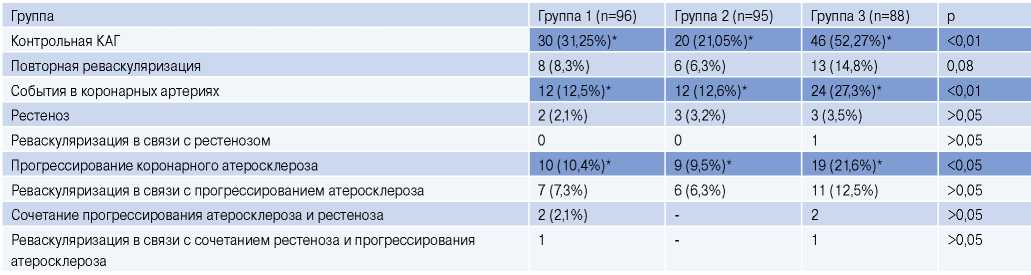
Примечание: данные представлены как число пациентов и процентное отношение к общему количеству пациентов в группе, * — р<0,05.
Сокращение: КАГ — коронароангиография.
Как следует из таблицы, у пациентов группы 3 чаще, чем в других группах (p<0,05) проводилась контрольная ангиография, что связано с более частым появлением загрудинных болей и более частым выявлением ишемии миокарда среди пациентов данной группы, а также чаще (р<0,05) выявлялось прогрессирование коронарного атеросклероза.
Анализ лабораторных показателей
Динамика содержания липидов в крови пациентов в различные сроки после эндоваскулярного вмешательства представлена в таблице 4.
Таблица 4
Показатели липидного спектра в различные сроки после вмешательства у пациентов, включенных в исследование
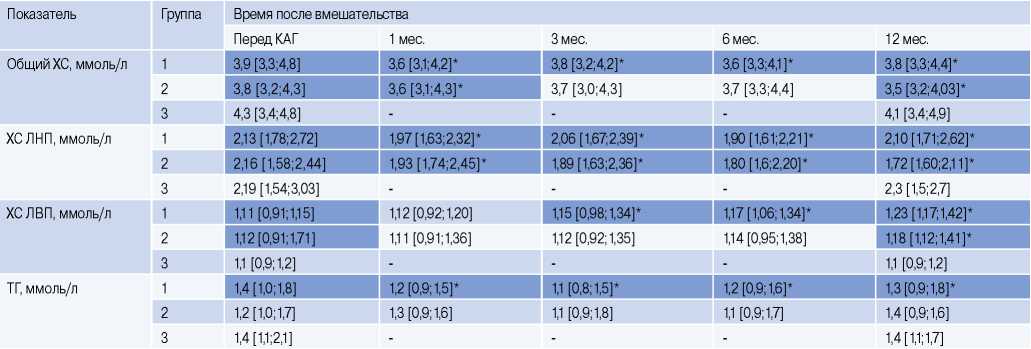
Примечание: данные представлены как медиана и интерквартильный размах, * — р<0,05 в сравнении с исходным значением.
Сокращения: КАГ — коронароангиография, ЛВП — липопротеиды высокой плотности, ЛНП — липопротеиды низкой плотности, ТГ — триглицериды, ХС — холестерин.
Исходно группы пациентов не различались по содержанию в крови общего ХС, ХС ЛНП, ХС ЛВП и ТГ. У пациентов групп 1 и 2 в ходе наблюдения отмечено значимое снижение в крови уровней общего ХС и ХС ЛНП, начиная с 1-го мес. после эндоваскулярного лечения, сохранявшееся вплоть до 12-го мес. наблюдения включительно. В группе 3 статистически значимых изменений общего ХС и ХС ЛНП через 12 мес. в сравнении с исходным уровнем отмечено не было. Снижение уровня ТГ в группе 1 отмечалось на всем протяжении наблюдения, начиная с 1-го мес. наблюдения. В группах 2 и 3 статистически значимых изменений содержания ТГ в крови не отмечено.
Значимой динамики в содержании вчСРБ как между группами, так и внутри каждой группы в сравнении с исходными уровнями выявлено не было. Значимых различий концентрации вчСРБ у пациентов с прогрессированием коронарного атеросклероза и у пациентов без такового через 12 мес. после вмешательства отмечено не было: 1,5 [ 1,1;4,3] мг/л vs 1,5 [ 0,7;2,9] мг/л, р=0,52.
Обсуждение
Данные литературы свидетельствуют о том, что телемедицинское наблюдение пациентов с ИБС способствует улучшению контроля ФР сердечнососудистых заболеваний, приверженности пациентов к лечению, а также улучшению клинических исходов [7][8]. В одном из исследований, включившем 335 человек после перенесенного чрескожного коронарного вмешательства, было показано, что в группе телемедицинского наблюдения частота неблагоприятных сердечно-сосудистых событий, включая сердечно-сосудистую смерть и внеплановую коронарную реваскуляризацию, составила 1,5%, тогда как в группе контроля 8,9% [9].
В исследование Blasko A, et al., посвященное возможностям дистанционного наблюдения за пациентами, было включено 203 пациента после перенесенного инфаркта миокарда. По истечении 12 мес. наблюдения контроль ФР в группе телемедицинского контроля оказался лучше: так, целевых уровней АД в указанной группе достигли 62,1% лиц, тогда как в группе контроля — 42,9%, целевых уровней гликированного гемоглобина — 86,4% и 54,2%, соответственно. Также отмечалась положительная динамика в отношении индекса массы тела: в группе дистанционного наблюдения он уменьшился на 0,77 кг/м2, в группе контроля — увеличился на 0,29 кг/м2. Статистически значимых различий в уровне ЛНП и статусе курения отмечено не было [10].
В метаанализе, включившем 11 исследований и посвященном оценке ФР пациентов с ИБС, продемонстрировано, что телемедицинское наблюдение приводит к улучшению физической активности, улучшению контроля АД и ЛНП [11]. По данным Vernooij JWP, et al. интегральный показатель риска по Фрамингемской шкале в группе дистанционного наблюдения через 1 год уменьшился на 14% в сравнении с группой контроля [12]. В метаанализе, включившем 6773 пациентов, было показано, что дистанционное ведение пациентов с ИБС приводит к уменьшению окружности талии, уровня общего ХС и ТГ, улучшает приверженность к лечению и физическую активность, а также приводит к небольшому, но значимому снижению АД и отказу от курения [13].
Существуют также данные, свидетельствующие о том, что при дистанционном ведении с использованием обучающих методик по физической активности улучшается толерантность к физическим нагрузкам, что отражается в увеличении пикового потребления кислорода по данным кардиореспираторного нагрузочного тестирования [14]. В ряде исследований показано, что дистанционный мониторинг сопоставим с очными визитами в отношении толерантности к нагрузкам, уровня АД, липидного профиля и качества жизни, поэтому может иметь преимущество в случае маломобильных пациентов и при недоступности очной кардиологической помощи [15]. Тем не менее, несмотря на описанные преимущества телемедицинского мониторинга за пациентами, в крупных работах продемонстрировано, что статистически значимого влияния на смертность они не оказывают [16][17].
Телемедицинские технологии являются эффективной альтернативой не только с позиции работников сферы здравоохранения, но и с точки зрения пациентов. Согласно Polinski J, et al., ~94% респондентов, опрошенных по поводу удовлетворенности телемедицинской помощью, отметили “значительную удовлетворенность”. Треть опрошенных пациентов предпочитала телемедицинские технологии традиционному личному визиту к врачу [18].
В нашем исследовании также было показано, что дистанционное ведение пациентов с ИБС, перенесших КС, является сопоставимым по эффективности с очными визитами как в плане контроля ФР ИБС, так и в плане прогрессирования коронарного атеросклероза. Оценить влияние телемедицинского наблюдения на отсроченную смертность и сердечнососудистые события в исследовании было невозможно, поскольку за период наблюдения летальных исходов, случаев инфаркта миокарда и острого нарушения мозгового кровообращения не было отмечено.
Заключение
Пациенты, перенесшие стентирование коронарных артерий, нуждаются в динамическом наблюдении кардиологом. Альтернативой непосредственному наблюдению может служить дистанционное мониторирование кардиологом для пациентов, проживающих в регионах с недостаточным количеством специалистов узкого профиля, в т.ч. кардиологов. Дистанционное наблюдение показало свою эффективность в отношении контроля показателей липидного спектра в крови и снижения вероятности прогрессирования коронарного атеросклероза.
Отношения и деятельность: все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье.
1. Кристальный Б.В., Натензон М.Я. Единая правовая база СНГ для создания и функционирования совместимых телемедицинских систем. Accessed November 1, 2021. http://emag.iis.ru/arc/infosoc/emag.nsf/BPA/78c304e7153c2ea8c32578ab003dcabd.
Список литературы
1. Алекян Б. Г., Григорьян А. М., Стафёров А. В., Карапетян Н. Г. Рентгенэндоваскулярная диагностика и лечение заболеваний сердца и сосудов в Российской Федерации — 2017 год. Эндоваскулярная хирургия. 2018;5(2):93-240.
2. Sedlis SP, Hartigan PM, Teo KK, et al. Effect of PCI on Long-Term Survival in Patients with Stable Ischemic Heart Disease. N Engl J Med. 2015;373(20):1937-46. doi:10.1056/NEJMoa1505532.
3. Kruse CS, Krowski N, Rodriguez B, Tran L, Vela J, Brooks M. Telehealth and patient satisfaction: a systematic review and narrative analysis. BMJ Open. 2017;7(8):e016242. doi:10.1136/bmjopen-2017-016242.
4. Wildevuur SE, Simonse LWL. Information and communication technology-enabled person-centered care for the “big five” chronic conditions: scoping review. J Med Internet Res. 2015;17(3):e77. doi:10.2196/jmir.3687.
5. Speyer R, Denman D, Wilkes-Gillan S, et al. Effects of telehealth by allied health professionals and nurses in rural and remote areas: A systematic review and meta-analysis. J Rehabil Med. 2018;50(3):225-35. doi:10.2340/16501977-2297.
6. Brouwers RWM, van Exel HJ, van Hal JMC, et al. Cardiac telerehabilitation as an alternative to centre-based cardiac rehabilitation. Neth Heart J. 2020;28(9):443-51. doi:10.1007/s12471-020-01432-y.
7. Hamine S, Gerth-Guyette E, Faulx D, et al. Impact of mHealth chronic disease management on treatment adherence and patient outcomes: a systematic review. J Med Internet Res. 2015;17(2):e52. doi:10.2196/jmir.3951.
8. Johnston N, Bodegard J, Jerström S, et al. Effects of interactive patient smartphone support app on drug adherence and lifestyle changes in myocardial infarction patients: A randomized study. Am Heart J. 2016;178:85-94. doi:10.1016/j.ahj.2016.05.005.
9. Ma J, Ge C, Shi Y, et al. Chinese Home-Based Cardiac Rehabilitation Model Delivered by Smartphone Interaction Improves Clinical Outcomes in Patients With Coronary Heart Disease. Front Cardiovasc Med. 2021;8:731557. doi:10.3389/fcvm.2021.731557.
10. Blasco A, Carmona M, Fernández-Lozano I, et al. Evaluation of a telemedicine service for the secondary prevention of coronary artery disease. J Cardiopulm Rehabil Prev. 2012;32(1):25-31. doi:10.1097/HCR.0b013e3182343aa7.
11. Rawstorn JC, Gant N, Direito A, et al. Telehealth exercise-based cardiac rehabilitation: a systematic review and meta-analysis. Heart Br Card Soc. 2016;102(15):1183-92. doi:10.1136/heartjnl-2015-308966.
12. Vernooij JW, Kaasjager HA, van der Graaf Y, et al. Internet based vascular risk factor management for patients with clinically manifest vascular disease: randomised controlled trial. BMJ. 2012;344:e3750. doi:10.1136/bmj.e3750.
13. Turan Kavradim S, Özer Z, Boz İ. Effectiveness of telehealth interventions as a part of secondary prevention in coronary artery disease: a systematic review and meta-analysis. Scand J Caring Sci. 2020;34(3):585-603. doi:10.1111/scs.12785.
14. Skobel E, Knackstedt C, Martinez-Romero A, et al. Internet-based training of coronary artery patients: the Heart Cycle Trial. Heart Vessels. 2017;32(4):408-18. doi:10.1007/s00380-016-0897-8.
15. Wu C, Li Y, Chen J. Hybrid versus traditional cardiac rehabilitation models: a systematic review and meta-analysis. Kardiol Pol. 2018;76(12):1717-24. doi:10.5603/KP.a2018.0175.
16. Huang K, Liu W, He D, et al. Telehealth interventions versus center-based cardiac rehabilitation of coronary artery disease: A systematic review and meta-analysis. Eur J Prev Cardiol. 2015;22(8):959-71. doi:10.1177/2047487314561168.
17. Devi R, Singh SJ, Powell J, et al. Internet-based interventions for the secondary prevention of coronary heart disease. Cochrane Database Syst Rev. 2015;(12):CD009386. doi:10.1002/14651858.CD009386.pub2.
18. Polinski JM, Barker T, Gagliano N, et al. Patients’ Satisfaction with and Preference for Telehealth Visits. J Gen Intern Med. 2016;31(3):269-75. doi:10.1007/s11606-015-3489-x.
Об авторах
А. М. ЩиноваРоссия
Щинова Александра Михайловна — аспирант отдела легочной гипертензии и заболеваний сердца ИКК им. А.Л. Мясникова.
Москва.
Конфликт интересов:
Нет
А. К. Осокина
Россия
Осокина Анна Константиновна — кандидат медицинских наук, младший научный сотрудник отдела легочной гипертензии и заболеваний сердца ИКК им. А.Л. Мясникова.
Москва.
Конфликт интересов:
Нет
А. В. Потехина
Россия
Потехина Александра Викторовна — кандидат медицинских наук, старший научный сотрудник отдела легочной гипертензии и заболеваний сердца ИКК им. А.Л. Мясникова.
Москва.
Конфликт интересов:
Нет
И. И. Шестова
Россия
Шестова Ирина Игоревна — ВРИО главного врача.
Тула.
Конфликт интересов:
Нет
А. Ю. Филатова
Россия
Филатова Анастасия Юрьевна — младший научный сотрудник лаборатории клеточной иммунологии НИИЭК.
Москва.
Конфликт интересов:
Нет
Ю. А. Долгушева
Россия
Долгушева Юлия Александровна — кандидат медицинских наук, младший научный сотрудник научно-организационного отдела.
Москва.
Конфликт интересов:
Нет
Ю. Е. Ефремова
Россия
Ефремова Юлия Евгеньевна — кандидат медицинских наук, старший научный сотрудник научно-организационного отдела.
Москва.
Конфликт интересов:
Нет
С. И. Проваторов
Россия
Проваторов Сергей Ильич — доктор медицинских наук, ведущий научный сотрудник отдела легочной гипертензии и заболеваний сердца ИКК им. А.Л. Мясникова.
Москва.
Конфликт интересов:
Нет
Дополнительные файлы
Рецензия
Для цитирования:
Щинова А.М., Осокина А.К., Потехина А.В., Шестова И.И., Филатова А.Ю., Долгушева Ю.А., Ефремова Ю.Е., Проваторов С.И. Прогрессирование атеросклероза коронарных артерий у пациентов, перенесших коронарное стентирование, в зависимости от тактики наблюдения кардиологом. Российский кардиологический журнал. 2022;27(6):4796. https://doi.org/10.15829/1560-4071-2022-4796
For citation:
Shchinova A.M., Osokina A.K., Potekhina A.V., Shestova I.I., Filatova A.Yu., Dolgusheva Yu.A., Efremova Yu.E., Provatorov S.I. Coronary atherosclerosis progression in patients after coronary stenting, depending on a cardiology follow-up strategy. Russian Journal of Cardiology. 2022;27(6):4796. (In Russ.) https://doi.org/10.15829/1560-4071-2022-4796

















































