Перейти к:
Роль маркеров фиброза в оценке риска развития неблагоприятных сердечно-сосудистых событий у больных сердечной недостаточностью
https://doi.org/10.15829/1560-4071-2022-4753
Аннотация
Цель. Оценить прогностическую роль сердечных биомаркеров (галектин-3, растворимый ST2 (sST2) и N-концевой промозговой натрийуретический пептид (NT-proBNP)) в стратификации риска развития неблагоприятных сердечно-сосудистых событий (ССС) у больных с хронической сердечной недостаточностью (ХСН) после имплантации автоматического имплантируемого кардиовертера-дефибриллятора (АИКД) в течение 12-мес. периода наблюдения.
Материал и методы. В исследование включено 57 пациентов (41 мужчина, средний возраст 65 [59; 68] лет) с ишемической болезнью сердца и ХСН II-III функционального класса по NYHA и фракцией выброса левого желудочка 34 [26; 40]%. Всем пациентам был имплантирован АИКД. Сывороточные уровни биомаркеров NT-proBNP, sST2 и галектина-3 определяли с помощью иммуноферментного анализа до имплантации АИКД.
Результаты. Установлено, что для стратификации риска развития неблагоприятного течения ХСН у больных после имплантации АИКД в течение 12-мес. периода проспективного наблюдения все три изучаемых биомаркера можно рассматривать в качестве прогностических факторов. Так, повышение уровня NT-proBNP ≥1046,6 пг/мл (AUC=0,68; p=0,009), sST2 ≥34,43 нг/мл (AUC=0,78; p<0,0001) и галектина-3 ≥11,6 нг/л (AUC=0,72; p=0,0014) позволяет прогнозировать высокий риск развития неблагоприятных ССС. Комбинация sST2 и галектина-3 увеличивает прогностическую значимость анализа (AUC=0,84; p<0,0001), тогда как добавление NT-proBNP не увеличивало точность стратификации риска.
Заключение. Установлено, что определение комбинации галектина-3 и sST2 потенциально может помочь идентифицировать группу пациентов с ХСН после имплантации АИКД с высоким риском неблагоприятных ССС для интенсификации и оптимизации лечения.
Ключевые слова
Для цитирования:
Гракова Е.В., Копьева К.В., Тепляков А.Т., Исаков Л.К., Синькова М.Н., Тарасов Н.И. Роль маркеров фиброза в оценке риска развития неблагоприятных сердечно-сосудистых событий у больных сердечной недостаточностью. Российский кардиологический журнал. 2022;27(7):4753. https://doi.org/10.15829/1560-4071-2022-4753
For citation:
Grakova E.V., Kopyeva K.V., Teplyakov A.T., Isakov L.K., Sinkova M.N., Tarasov N.I. Cardiology Research Institute, Tomsk National Research Medical Center. Russian Journal of Cardiology. 2022;27(7):4753. (In Russ.) https://doi.org/10.15829/1560-4071-2022-4753
Несмотря на успехи, достигнутые в диагностике и лечении пациентов с хронической сердечной недостаточностью (ХСН), распространенность этой патологии во всем мире возрастает с каждым годом, в основном из-за увеличения продолжительности жизни населения и успешного лечения сердечнососудистых заболеваний (ССЗ), включая инфаркт миокарда (ИМ), гипертонию, пороки сердца и т.д. [1]. Тем не менее, ХСН со сниженной фракцией выброса (ФВ) левого желудочка (ЛЖ) остается ведущей причиной ССЗ и смертности во всем мире [2], при этом фиброз миокарда приводит к увеличению жесткости стенок сердца, снижению сократительной способности, ухудшению сердечного выброса и, в конечном итоге, развитию систолической дисфункции ЛЖ [3]. Галектин-3 представляет собой β-галактозид-связывающий лектин, циркулирующие уровни которого при ССЗ связаны с развитием воспалительного процесса и последующего фиброза миокарда [4]. В нескольких исследованиях установлена прогностическая роль галектина-3 в отношении риска развития сердечно-сосудистой смертности и повторных госпитализаций при ХСН [5]. Однако имеются противоречивые данные о роли галектина-3 в оценке риска развития неблагоприятных сердечнососудистых событий (ССС), включая желудочковую тахиаритмию (ЖТ) и внезапную сердечную смерть (ВСС), в частности, у больных с перенесенным ИМ и сниженной ФВ ЛЖ [6].
В настоящее время автоматические имплантируемые кардиовертеры-дефибрилляторы (АИКД) используются для предотвращения ВСС у пациентов с ЖТ или фибрилляцией желудочков (ФЖ), а также у тех, кто подвержен высокому риску возникновения данных аритмий [7]. Однако польза АИКД в отношении снижения смертности может быть менее очевидной из-за снижения продолжительности жизни больных, особенно, с тяжелой систолической дисфункцией, и того факта, что в большинстве случаев пациенты не получают оптимальную медикаментозную терапию для лечения ХСН [8]. Для оптимизации тактики ведения данной когорты больных клинические исследования последних лет направлены на выявление потенциально новых предикторов высокого риска развития неблагоприятных CCC, включая ЖТ и ВСС, в дополнение к уже установленным факторам риска.
Целью нашего исследования была оценка прогностической роли галектина-3 и комбинации биомаркеров (галектин-3, растворимый ST2 (sST2) и Nконцевой промозговой натрийуретический пептид (NT-proBNP)) в стратификации риска развития неблагоприятных CCC, включая ЖТ и ВСС, у больных с ХСН после имплантации АИКД в течение 12-мес. наблюдения.
Материал и методы
Исследование было выполнено в соответствии со стандартами надлежащей клинической практики (Good Clinical Practice) и принципами Хельсинкской декларации. Исследование было одобрено локальным этическим комитетом Научно-исследовательского института кардиологии, Томского национального исследовательского медицинского центра Российской академии наук (протокол № 93 от 25 мая 2012г). Информированное письменное согласие было получено от всех пациентов до включения в исследование.
Данное исследование являлось проспективным наблюдательным одноцентровым. В исследование было включено 57 пациентов (41 мужчина, средний возраст 65 [ 59; 68] лет) со стабильной ишемической болезнью сердца и ХСН II-III функционального класса по NYHA и ФВ ЛЖ 34 [26; 40]%. Показаниями для имплантации АИКД были пароксизмы ЖТ, сопровождавшиеся синкопальным состоянием или выраженными нарушениями гемодинамики, не связанные с обратимыми или преходящими состояниями и не спровоцированные физической нагрузкой (8 пациентов, 14%), или ишемическая кардиомиопатия с ФВ ЛЖ <35% и высокой вероятностью развития ЖТ (49 пациентов, 86%) [7]. Критерии исключения включали недавние ССС (<6 мес.), возраст >75 лет, острые или хронические заболевания печени, скорость клубочковой фильтрации (<30 мл/мин/1,73 м2 по CKD-EPI), тяжелое течение бронхиальной астмы или хронической обструктивной болезни легких, аутоиммунные заболевания, беременность, злокачественные новообразования или невозможность подписать форму информированного согласия.
Конечная точка являлась комбинированной и определялась как смертность от ССЗ, нефатальный инсульт, нестабильная стенокардия, нефатальный ИМ, реваскуляризация миокарда, дефибрилляция желудочков с помощью имплантируемого кардиовертерадефибриллятора (ИКД), прогрессирование ХСН (появление новых или ухудшающиеся симптомы/признаки ХСН, требующие внепланового усиления и/или коррекции диуретической терапии). Диагноз ЖТ подтверждался с помощью суточного мониторирования электрокардиограммы как ≥3 последовательных эктопических желудочковых сокращений с частотой ≥120 уд./мин или дефибрилляцией желудочков с помощью ИКД. ВСС определяется как смерть по сердечно-сосудистой причине, которая наступала в течение одного часа после появления симптомов.
Уровни sST2, NT-proBNP и галектина-3 измеряли в образцах сыворотки с помощью иммуноферментного анализа (анализ Presage® ST2, Critical Diagnostics, США; Biomedica immunoassays, Австрия; BG Medicine, США).
Статистическая обработка результатов проводилась с помощью программ STATISTICA 10.0 и MedCalc 11.5.0.0. Для проверки статистических гипотез при сравнении двух независимых групп использовали критерий Манна-Уитни. При анализе качественных признаков проводили анализ таблиц сопряженности с использованием критерия χ2 Пирсона. Для выявления предикторов развития неблагоприятных ССС использовали ROC-анализ с построением характеристических кривых и расчетом площади под кривой (AUC). Для выявления факторов, оказывающих значимое влияние на течение и прогноз заболевания, производился расчет отношения шансов (ОШ) с 95% доверительным интервалом (ДИ). Данные представляли в виде медианы (Me) и межквартильного интервала (Q — 25-й и 75-й процентили). Критический уровень значимости p-value для всех используемых процедур анализа принимали равным 0,05. Статистическая мощность исследования составила 95,9%, с учетом значения ошибки 1 типа (альфа), равной 0,05.
Результаты
По данным ROC-анализа установлено, что у больных ХСН ишемического генеза с АИКД галектин-3 может рассматриваться в качестве биомаркера, позволяющего с высокой степенью вероятности прогнозировать неблагоприятные ССС (рис. 1). “Точкой отсечения” — cut off, характеризующей развитие неблагоприятных ССС (чувствительность 67,5%; специфичность 70,6%; AUC=0,72; p=0,0014), является концентрация галектина-3 ≥11,6 нг/л.
Согласно данным ROC-анализа все больные были разделены на 2 группы в зависимости от “cut off” галектина-3: в 1 группу вошли 29 больных с уровнем галектина-3 ≥11,6 нг/л, во 2 группу — 28 пациентов с уровнем галектина-3 <11,6 нг/л. Клиникодемографическая характеристика больных ХСН с АИКД представлена в таблице 1. Все пациенты получали оптимальную медикаментозную терапию, а дозировки препаратов были дотитрованы до максимально переносимых.
Пациенты с гиперэкспрессией галектина-3 (≥11,6 нг/л) имели более длительный анамнез ХСН (p=0,003), более высокие уровни sST2 (р<0,001) и NT-proBNP (р=0,004), а также более высокую частоту пароксизмов ЖТ в анамнезе (р=0,022). По остальным клинико-демографическим характеристикам группы были сопоставимы на момент включения в исследование (табл. 1).
Установлено, что для стратификации риска развития неблагоприятного течения ХСН у больных после имплантации АИКД в течение 12 мес. наблюдения в качестве прогностических факторов можно рассматривать все три биомаркера (рис. 1). Повышение уровня NT-proBNP ≥1046,6 пг/мл (p=0,009), sST2 ≥34,43 нг/мл (p<0,0001) и галектина-3 ≥11,6 нг/л (p=0,0014) позволяло прогнозировать высокий риск развития неблагоприятных ССС. Так, в частности, гиперэкспрессия NT-proBNP увеличивала риск развития неблагоприятных ССС в 1,3 раза (log(NT-proBNP) ОШ 1,27; 95% ДИ 0,89-2,21; p=0,036), галектина и sST2 — в 3 раза (log(галектин-3) ОШ 3,12; 95% ДИ 2,67-4,11; p<0,001 и log(sST2) ОШ 3,06; 95% ДИ 2,89-3,17; p<0,0001).
Определение комбинации sST2 и галектина-3 увеличивало прогностическую значимость анализа, тогда как добавление NT-proBNP к биомаркерам sST2 и галектину-3 (p<0,0001) не улучшало точность стратификации риска (рис. 1).
По результатам анализа по Каплану-Майеру (рис. 2) установлено, что частота наступления неблагоприятных ССС в группах различалась (p<0,001). Неблагоприятные ССС в течение года развились значительно чаще в 1 группе — у 22 (82,8%) пациентов, а во 2 группе — у 15 (53,6%) больных (табл. 2).
Таблица 1
Клинико-демографическая характеристика обследованных пациентов на момент включения в исследование
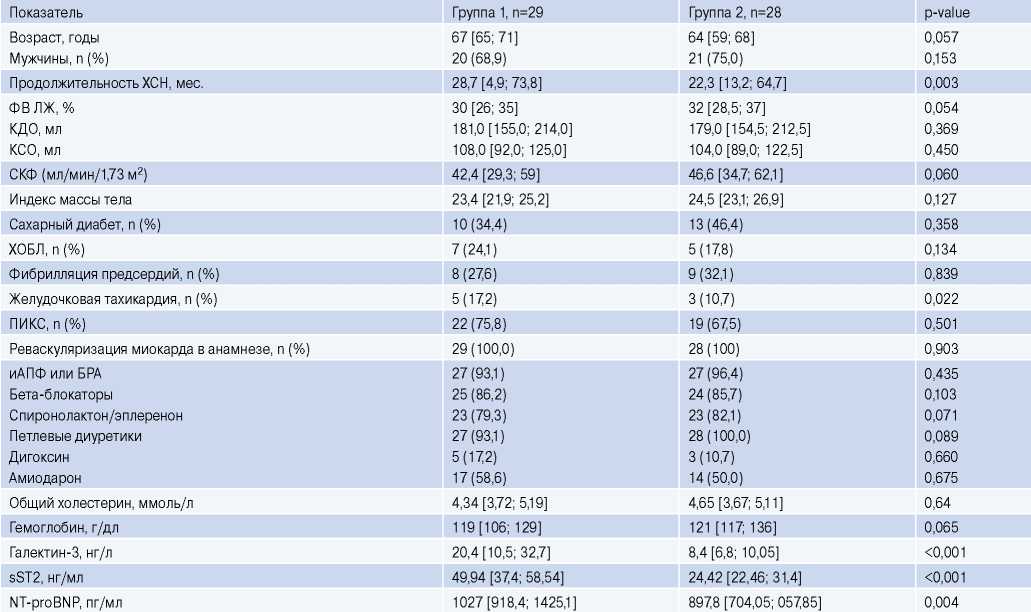
Сокращения: БРА — блокаторы рецепторов ангиотензина II, иАПФ — ингибиторы ангиотензинпревращающего фермента, КДО — конечный диастолический объем, КСО — конечный систолический объем, ПИКС — постинфарктный кардиосклероз, СКФ — скорость клубочковой фильтрации, ХОБЛ — хроническая обструктивная болезнь легких, ХСН — хроническая сердечная недостаточность, ФВ ЛЖ — фракция выброса левого желудочка, sST2 — растворимый ST2, NT-proBNP — N-концевой промозговой натрийуретический пептид.
Таблица 2
Частота неблагоприятных CCC в течение 12 мес. наблюдения
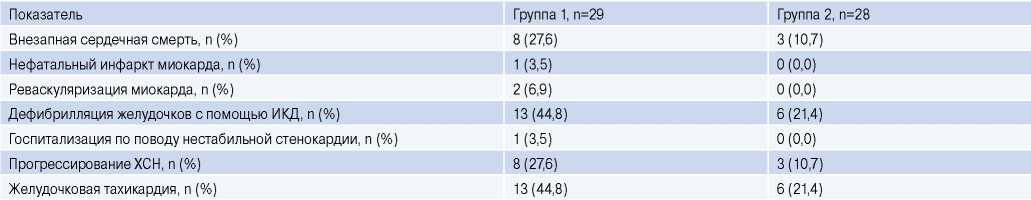
Сокращения: ИКД — имплантируемый кардиовертер-дефибриллятор, ХСН — хроническая сердечная недостаточность.
В течение периода наблюдения у 19 (33,3%) пациентов зарегистрированы пароксизмы ЖТ, а 11 больных (19,3%) внезапно умерли в течение периода наблюдения (табл. 2). По основным клинико-демографическим параметрам группы были сопоставимы. Однако при анализе роли изучаемых биомаркеров в группе пациентов, перенесших пароксизмы ЖТ, купированные срабатыванием ИКД, или погибших от них в течение последующих 12 мес. наблюдения после имплантации АИКД, мы выявили, что содержание галектина-3 у этих пациентов было выше (p<0,00001) на 49,3% по сравнению с больными без данных CCC (20,7 [ 18,9; 39,0] нг/мл и 10,5 [ 7,7; 14,8] нг/мл, соответственно). При проведении многофакторного регрессионного анализа установлено, что только повышенная экспрессия галектина-3 являлась независимым прогностическим маркером развития пароксизмов ЖТ, приводящих к срабатыванию ИКД, и ВСС у пациентов с ХСН ишемического генеза после имплантации АИКД в течение 12-мес. периода наблюдения (ОШ 3,72; 95% ДИ 1,18-11,71; p=0,00001). По данным ROC-анализа установлено, что уровень галектина-3 ≥16,6 нг/л (p=0,0001) можно рассматривать в качестве маркера развития ЖТ, вызывающей срабатывание ИКД для ее купирования, и ВСС в течение 12 мес. у больных ХСН ишемического генеза с АИКД (рис. 3), тогда как sST2 и NTproBNP не показывали схожие характеристики.
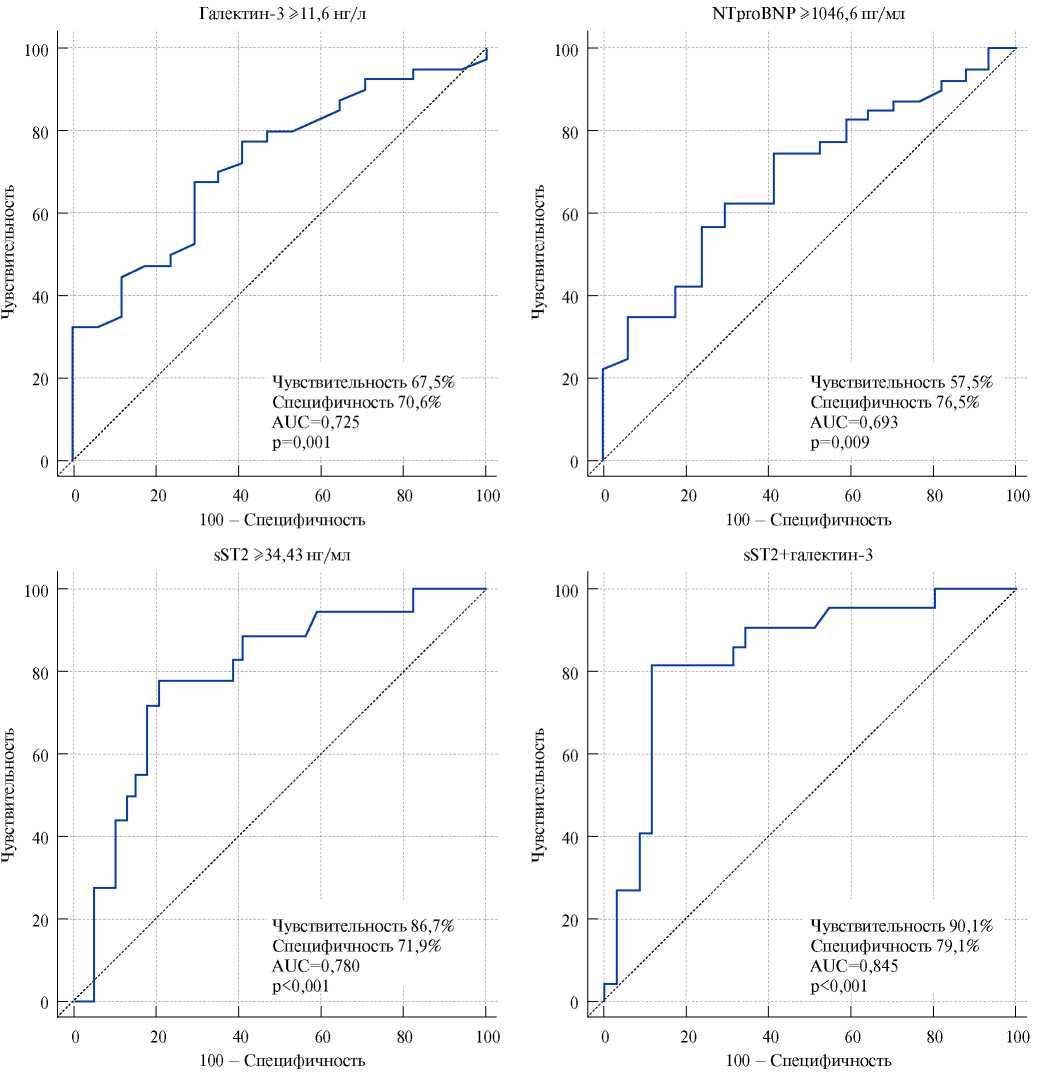
Рис. 1. Чувствительность и специфичность значений sST2, NT-proBNP и галектина-3 в стратификации риска развития неблагоприятных CCC у пациентов с ХСН после имплантации АИКД (ROC-анализ).
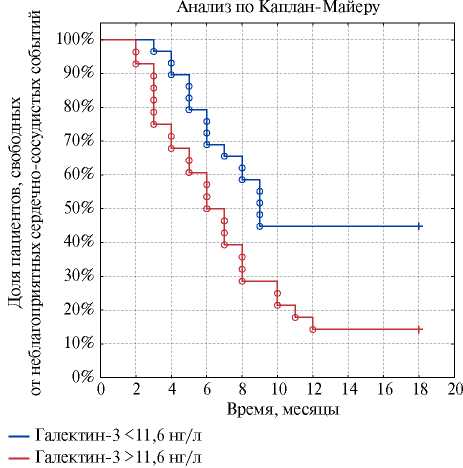
Рис. 2. Кривые Каплана-Майера вероятности развития неблагоприятных CCC в течение года в зависимости от уровней галектина-3 у больных ХСН после имплантации АИКД.
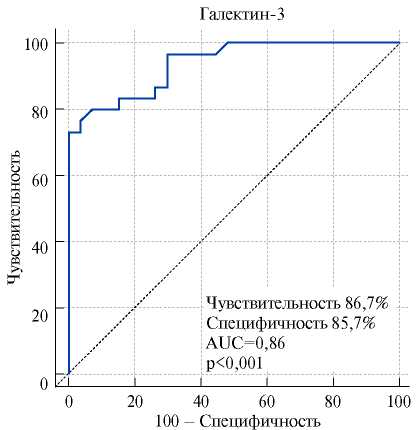
Рис. 3. Чувствительность и специфичность значений галектина-3 в стратификации риска развития ЖТ и ВСС у пациентов с ХСН после имплантации АИКД (ROC-анализ).
Обсуждение
Сердечная недостаточность является серьезной проблемой общественного здравоохранения, распространенность которой составляет от 5,8 до 6,5 млн в США [8], ~8,1 млн в России [9] и 26 млн во всем мире [10]. Сердечная недостаточность со сниженной ФВ ЛЖ возникает в результате сократительной дисфункции ЛЖ, вызванной прогрессирующими структурными и функциональными изменениями, при этом фиброз миокарда, являясь одним из патогенетических путей развития и прогрессирования ХСН, тесно связан с манифестацией желудочковых аритмий [3].
Галектин-3 представляет собой β-галактозидсвязывающий лектин, циркулирующие уровни которого связаны с развитием воспалительного процесса и фиброза миокарда при ССЗ [5]. В ряде исследований установлена прогностическая роль галектина-3 в отношении риска развития сердечно-сосудистой смертности и повторных госпитализаций при ХСН [6]. Однако имеются противоречивые данные о прогностической роли галектина-3 по сравнению с другими биомаркерами, такими как NT-proBNP, тропонин I и sST2 в оценке риска развития неблагоприятных ССС, включая ЖТ и ВСС, в частности, у больных с перенесенным ИМ в анамнезе и сниженной ФВ ЛЖ [11]. Например, в одном из исследований было показано, что галектин-3 и BNP имели больше значения в отношении стратификации риска для пациентов с сохраненной ФВ ЛЖ [12]. В другом исследовании галектин-3 показал меньшую прогностическую ценность, чем sST2, для отдаленной стратификации риска амбулаторных пациентов с ХСН независимо от ФВ ЛЖ [13]. В других исследованиях установлено, что sST2 может быть более полезным для долгосрочного мониторинга больных ХСН [14], а галектин-3 — для диагностики ремоделирования сердца при ХСН. Zhang Y, et al. (2015) выявили, что галектин-3 был недостаточно эффективным в качестве предиктора для оценки внезапной или внутрибольничной смертности, тогда как комбинация галектина-3 и NT-proBNP значительно улучшала реклассификацию для общей смертности и смертности от ССЗ у пациентов со сниженной ФВ ЛЖ [15]. В то же время имеются доказательства того, что комбинация галектина-3 и ST2 может использоваться для диагностики системного фиброза у пациентов, госпитализированных с декомпенсацией ХСН.
В нашем исследовании было показано, что галектин-3 является предиктором неблагоприятных ССС у больных ХСН ишемического генеза в течение 12-мес. периода наблюдения после имплантации АИКД. При этом комбинированная оценка биомаркеров sST2 и галектина-3 повышала прогностическую ценность анализа, тогда как добавление NT-proBNP не улучшало стратификацию риска. Объяснение этого факта, возможно, следует искать в патофизиологии данных биомаркеров. В частности, синтез и секреция NT-proBNP определяется перерастяжением кардиомиоцитов и вероятно, что систолическая дисфункция и распространенный фиброз миокарда приводят к истощению продукции NT-proBNP, поэтому этот биомаркер менее эффективен для стратификации риска в данной когорте больных. Экспрессия же sST2 и галектина-3 обусловлена пролиферативным эффектом макрофагов и фибробластов в сердце в ответ на патологические изменения, вызванные хроническими заболеваниями и/ или острыми повреждениями, отражая процесс ремоделирования желудочков и фиброз миокарда [14]. Поэтому уровни галектина-3 и sST2 могут быть повышены у пациентов с ХСН со сниженной ФВ ЛЖ, а их использование для стратификации риска является более эффективным. Комбинированное применение обоих биомаркеров демонстрирует более высокую точность для прогнозирования неблагоприятных исходов в сравнении с NT-proBNP. Таким образом, полученные данные достаточно противоречивы, что делает актуальным проведение дальнейших исследований с целью уточнения роли галектина-3 в патогенезе ХСН.
В отношении галектина-3 имеются также данные о том, что повышенный уровень данного биомаркера сопровождает различные воспалительные заболевания. Так, галектин-3 облегчает проникновение иммунных клеток в ткани, может усилить адгезию лейкоцитов к ткани и способствует экстравазации лейкоцитов [4]. Кроме того, данный биомаркер обладает свойствами сильного хемоаттрактанта, привлекающего макрофаги и моноциты к месту воспаления. Последующее связывание галектина-3 с макрофагами и моноцитами приводит к усилению процессов фагоцитоза и выработке провоспалительного цитокина — интерлейкина-1. Поэтому галектин-3 играет важную роль в запуске процессов хронической воспалительной реакции и развитии фиброза, а его уровни могут отражать выраженность данных процессов [6]. При этом хроническое воспаление в тканях может привести к электрической нестабильности в кардиомиоцитах и вызвать развитие жизнеугрожающей ЖТ.
Показано, что галектин-3 может быть недорогим и легкодоступным параметром для прогнозирования ЖТ у пациентов с АИКД, в случае отсутствия возможности выполнения магнитно-резонансной томографии [11], но данное исследование включало пациентов с гипертрофической кардиомиопатией. В другом исследовании оценивалась прогностическая роль галектина-3 в отношении развития ЖТ и ФЖ у пациентов с неишемической ХСН с АИКД: было установлено, что уровни галектина-3 в плазме крови можно рассматривать в качестве биомаркера для прогнозирования устойчивой ЖТ и ФЖ у пациентов с высоким риском ВСС [7].
Нами была изучена прогностическая роль галектина-3 в развитии пароксизмов ЖТ и ВСС у пациентов с ишемической ХСН после имплантации АИКД. Выявлено, что в данной когорте больных гиперэкспрессия галектина-3 ≥16,6 нг/мл связана с высоким риском развития пароксизмов ЖТ и ВСС в течение 12 мес. наблюдения после имплантации АИКД. Более того, только галектин-3 в отличие от sST2 и NTproBNP являлся независимым прогностическим маркером развития ЖТ в группе данных больных.
Заключение
Таким образом, нами была установлена прогностическая роль галектина-3 и многомаркерной стратегии (галектин-3, sST2 и NT-proBNP) в стратификации риска развития неблагоприятных ССС, включая ЖТ и ВСС, у больных с ХСН ишемической этиологии после имплантации АИКД в течение 12-мес. периода наблюдения. Показано, что определение комбинации галектина-3 и sST2 потенциально может помочь идентифицировать группу пациентов с ХСН ишемического генеза после имплантации АИКД с высоким риском неблагоприятного течения данной патологии для интенсификации и оптимизации лечения с целью уменьшения развития неблагоприятных ССС.
Отношения и деятельность: все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье.
Список литературы
1. Gehlken C, Suthahar N, Meijers WC, Rudolf A de Boerh. Galectin-3 in Heart Failure: An Update of the Last 3 Years. Heart Fail Clin. 2018;14(1):75-92. doi:10.1016/j.hfc.2017.08.009.
2. Ponikowski P, Voors AA, Anker SD, et al, ESC Scientific Document Group. 2016 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure: The Task Force for the diagnosis and treatment of acute and chronic heart failure of the European Society of Cardiology (ESC) developed with the special contribution of the Heart Failure Association (HFA) of the ESC. Eur. Heart J. 2016;37(27):2129-200. doi:10.1093/eurheartj/ehw128.
3. Díez J, Querejeta R, López B, et al. Losartan-dependent regression of myocardial fibrosis is associated with reduction of left ventricular chamber stiffness in hypertensive patients. Circulation. 2002;105:2512-7. doi:10.1161/01.cir.0000017264.66561.3d.
4. Besler C, Lang D, Urban D, et al. Plasma and cardiac galectin-3 in patients with heart failure reflects both inflammation and fibrosis: implications for its use as a biomarker. Circulation: Heart Failure. 2017;10:e003804. doi:10.1161/CIRCHEARTFAILURE.116.003804.
5. Meijers WC, Januzzi JL, deFilippi C, et al. Elevated plasma galectin-3 is associated with near-term rehospitalization in heart failure: a pooled analysis of 3 clinical trials. Am Heart J. 2014;167:853-60. doi:10.1016/j.ahj.2014.02.011.
6. van der Velde AR, Gullestad L, Ueland T, et al. Prognostic value of changes in galectin-3 levels over time in patients with heart failure: data from CORONA and COACH. Circ Heart Fail. 2013;6:219-26. doi:10.1161/CIRCHEARTFAILURE.112.000129.
7. Goldenberg I, Huang DT, Nielsen JC. The role of implantable cardioverter-defibrillators and sudden cardiac death prevention: indications, device selection, and outcome. Eur Heart J. 2019. pii: ehz788. doi:10.1093/eurheartj/ehz788.
8. Benjamin EJ, Blaha MJ, Chiuve SE, et al, American Heart Association Statistics Committee and Stroke Statistics Subcommittee. Heart Disease and Stroke Statistics-2017 Update: A Report From the American Heart Association. Circulation. 2017;135(10):e146-e603. doi:10.1161/CIR.0000000000000485.
9. Ageev FT, Danielyan MO, Mareev VYu, Belenkov YuN. Patients with chronic heart failure in Russian outpatient practice: features of the contingent, diagnosis and treatment: a study of EPOCH-O-CHF. Heart Failure. 2004;5(1):4-7. (In Russ.)
10. Ponikowski P, Anker SD, AlHabib KF, et al. Heart failure: preventing disease and death worldwide. ESC Heart Fail. 2014;1(1):4-25. doi:10.1002/ehf2.12005.
11. Bayes-Genis A, de Antonio M, Vila J, et al. A. Head-to-head comparison of 2 myocardial fibrosis biomarkers for long-term heart failure risk stratification: ST2 versus galectin-3. Journal of the American College of Cardiology. 2014;63(2):158-66. doi:10.1016/j.jacc.2013.07.087.
12. Груздева О. В., Акбашева О. Е., Учасова Е. Г. и др. Диагностическое значение стимулирующего фактора роста ST2 в госпитальном периоде инфаркта миокарда. Терапевтический архив. 2016;88(4):9-15. doi:10.15829/1560-4071-2015-12-63-71.
13. Wu AH, Wians F, Jaffe A. Biological variation of galectin-3 and soluble ST2 for chronic heart failure: Implication on interpretation of test results. Am Heart J. 2013;165:995-9. doi:10.1016/j.ahj.2013.02.029.
14. Копьева К. В., Тепляков А. Т., Гракова Е. В. и др. Роль нового биомаркера ST2 в оценке ремоделирования миокарда у больных хронической сердечной недостаточностью ишемического генеза с сохраненной фракцией выброса левого желудочка. Кардиология. 2018;58(10S):3343. doi:10.18087/cardio.2498.
15. Zhang Y, Zhang R, An T, et al. The utility of galectin-3 for predicting cause-specific death in hospitalized patients with heart failure. J Card Fail. 2015;21:51-9. doi:10.1016/j.cardfail.2014.10.006.
Об авторах
Е. В. ГраковаРоссия
Елена Викторовна Гракова — доктор медицинских наук, ведущий научный сотрудник отделения патологии миокарда.
Томск
Конфликт интересов:
нет
К. В. Копьева
Россия
Кристина Копьева — кандидат медицинских наук, научный сотрудник отделения патологии миокарда.
Томск
Конфликт интересов:
нет
А. Т. Тепляков
Россия
Александр Трофимович Тепляков — доктор медицинских наук, профессор, заслуженный деятель науки РФ, главный научный сотрудник.
Томск
Конфликт интересов:
нет
Л. К. Исаков
Россия
Леонид Константинович Исаков — кандидат медицинских наук, ассистент кафедры подготовки врачей первичного звена здравоохранения.
Кемерово
Конфликт интересов:
нет
М. Н. Синькова
Россия
Маргарита Николаевна Синькова — кандидат медицинских наук, ассистент кафедры подготовки врачей первичного звена здравоохранения.
Кемерово
Конфликт интересов:
нет
Н. И. Тарасов
Россия
Николай Иванович Тарасов — доктор медицинских наук, профессор, зав. кафедрой подготовки врачей первичного звена здравоохранения.
Кемерово
Конфликт интересов:
нет
Дополнительные файлы
Рецензия
Для цитирования:
Гракова Е.В., Копьева К.В., Тепляков А.Т., Исаков Л.К., Синькова М.Н., Тарасов Н.И. Роль маркеров фиброза в оценке риска развития неблагоприятных сердечно-сосудистых событий у больных сердечной недостаточностью. Российский кардиологический журнал. 2022;27(7):4753. https://doi.org/10.15829/1560-4071-2022-4753
For citation:
Grakova E.V., Kopyeva K.V., Teplyakov A.T., Isakov L.K., Sinkova M.N., Tarasov N.I. Cardiology Research Institute, Tomsk National Research Medical Center. Russian Journal of Cardiology. 2022;27(7):4753. (In Russ.) https://doi.org/10.15829/1560-4071-2022-4753
JATS XML

















































