Перейти к:
Роль антагонистов кальциевых каналов дигидропиридиновой группы при операции коронарного шунтирования с использованием лучевой артерии
https://doi.org/10.15829/1560-4071-2022-4744
Аннотация
Цель. Оценить влияние фармакологического протокола профилактики спазма лучевой артерии, основу которого составляет системное и местное применение антагонистов кальциевых каналов дигидропиридиновой группы, на отдалённые результаты аутоартериального коронарного шунтирования.
Материал и методы. Согласно протоколу за 3 сут. до операции назначается нифедипин в таблетированной форме в дозе 5 мг/сут. Затем после выделения лучевой артерии осуществляется консервация сосуда в растворе нифедипина (адалата) до момента его использования. После снятия зажима с аорты начинается инфузия нифедипина (адалата) внутривенно в дозе 0,63 мг/ч. В послеоперационном периоде продолжается инфузия нифедипина в течение 6 ч. В дальнейшем пациентам рекомендуется прием антагонистов кальциевых каналов дигидропиридиновой группы в дозе 5 мг/сут. после выписки из стационара.
Результаты. Применение фармакологического протокола (n=225) в сроки до 5 лет сопряжено с меньшим количеством больших сердечно-сосудистых событий (летальность, инфаркт миокарда, нарушения мозгового кровообращения) в сравнении с группой контроля (n=230) (9,3% и 15,7%, p=0,031). Такой результат был достигнут в основном за счет снижения случаев инфаркта миокарда (6,2% и 12,6%, p=0,018). Также применение фармакологического протокола привело к уменьшению повторных реваскуляризаций (4,4% и 16,1%, p=0,0001) по сравнению с контрольной группой.
Заключение. Применение фармакологического протокола профилактики спазма лучевой артерии на основе системного применения блокаторов кальциевых каналов дигидропиридиновой группы улучшает результаты аутоартериального коронарного шунтирования в отдалённом сроке наблюдения за пациентами.
Ключевые слова
Для цитирования:
Затолокин В.В., Вечерский Ю.Ю., Манвелян Д.В., Козлов Б.Н. Роль антагонистов кальциевых каналов дигидропиридиновой группы при операции коронарного шунтирования с использованием лучевой артерии. Российский кардиологический журнал. 2022;27(8):4744. https://doi.org/10.15829/1560-4071-2022-4744
For citation:
Zatolokin V.V., Vechersky Yu.Yu., Manvelyan D.V., Kozlov B.N. Role of dihydropyridine calcium channel blockers in coronary bypass surgery using the radial artery graft. Russian Journal of Cardiology. 2022;27(8):4744. (In Russ.) https://doi.org/10.15829/1560-4071-2022-4744
Успех хирургического лечения ишемической болезни сердца во многом зависит от продолжительности функционирования коронарных шунтов [1]. Высокая работоспособность внутренних грудных и лучевой артерий по сравнению с венами в отдаленном послеоперационном периоде свидетельствуют в пользу аутоартериальной реваскуляризации миокарда [2]. Сообщения о низкой проходимости лучевой артерии в позиции коронарного шунта, связанные с высокой вероятностью спазма, заставляют многих хирургов с осторожностью относиться к данному сосудистому трансплантату [3]. Существует мнение, что функциональность шунтов из лучевой артерии значительно улучшает фармакологическая профилактика спастических реакций в периоперационном периоде и в первый год после операции, т.к. в это время артерия наиболее уязвима к воздействиям различного рода факторов (отек, перепады давления, влияние инотропных препаратов, температура тела) [4]. В настоящее время не существует рекомендаций по фармакологической протекции шунтов из лучевой артерии от спазма. Поэтому во всем мире бессистемно используются различные лекарственные средства с разными механизмами фармакологического действия [5][6].
Целью настоящего исследования явилась оценка отдаленных результатов фармакологического протокола профилактики спазма шунтов из лучевой артерии при операции коронарного шунтирования, основанного на применении блокаторов кальциевых каналов дигидропиридиновой группы.
Материал и методы
В клиниках НИИ Кардиологии ТНИМЦ РАН лучевая артерия используется в качестве коронарного шунта с 2001г по настоящее время. В 2008г был внедрен протокол фармакологической профилактики спазма лучевой артерии, который включает в себя системное применение блокаторов кальциевых каналов дигидропиридиновой группы. Это в первую очередь назначение нифедипина в таблетированной форме в дозе 5 мг/сут. за 3 дня до операции. После выделения лучевой артерии кондуит консервируется в растворе адалата до момента его использования в качестве шунта. После снятия зажима с аорты начинается внутривенная инфузия адалата в дозе 0,63 мг/ч под контролем артериального давления. В послеоперационном периоде в палате интенсивной терапии продолжается инфузия адалата в течение 6 ч. В дальнейшем пациентам рекомендуется прием нифедипина по схеме — 5 мг в сутки в таблетках после выписки из стационара в течение 1 года [7]. Ретроспективному анализу подверглись пациенты, прооперированные в период с 2001 по 2008гг (n=230), в лечении которых не применялся описанный протокол профилактики спазма. Данные пациенты были включены в группу сравнения (контрольную группу). Пациенты, прооперированные в период с 2008 по 2016гг с применением предложенного фармакологического протокола (n=225), были включены в основную группу исследования.
Пациенты, включенные в настоящее исследование, перенесли полную аутоартериальную реваскуляризацию миокарда с использованием обеих внутренних грудных и лучевой артерий. Все операции были выполнены через срединную стернотомию в условиях искусственного кровообращения и кардиоплегии раствором “Кустодиол”. Во всех случаях лучевая артерия была использована для реваскуляризации целевого сосуда со степенью стеноза >75%. Ранее были опубликованы наши результаты 30-дневного и 3-летнего наблюдения за пациентами, получившими фармакологический протокол профилактики спазма антагонистами кальциевых каналов дигидропиридиновой группы при использовании лучевой артерии в качестве шунта [7]. Однако наибольший интерес представляет влияние применения предложенного протокола на послеоперационные клинические результаты в более продолжительном периоде наблюдения. В настоящей работе проведена клиническая оценка результатов наблюдения за этими пациентами в сроки до 5 лет.
Первичной композитной конечной точкой настоящего исследования являлись большие неблагоприятные сердечные и цереброваскулярные события (MACCE — major adverse cardiac and cerebrovascular events). Вторичными конечными точками в настоящем исследовании явились летальность, случаи инфаркта миокарда (ИМ), повторные реваскуляризации, случаи нарушения мозгового кровообращения.
Статистическая обработка проводилась с использованием IBM SPSS Statistics. Оценка частоты событий была основана на анализе Каплана-Мейера. Оценивалась разница между группами в частоте ключевых событий, которые происходили в течение 5-летнего периода наблюдения. Все переменные сравнивали с использованием критерия Уилкоксона, используемого для данных с неизвестным распределением. Значение “p” менее 0,05 указывало на статистическую значимость.
Результаты
Пациенты основной и контрольной группы были сопоставимы по сопутствующей патологии. Не было отмечено значимых отличий в наличии таких заболеваний, как сахарный диабет, фибрилляция предсердий, поражение периферических и брахиоцефальных сосудов у пациентов обеих групп (табл. 1).
Таблица 1
Характеристика исследуемых пациентов
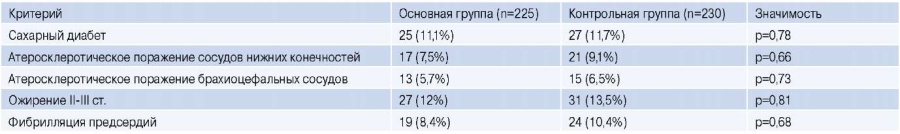
Примечание: p<0,05 — статистически значимые различия.
По результатам послеоперационного наблюдения до 5 лет в контрольной группе значительно чаще встречались компоненты первичной комбинированной конечной точки по сравнению с пациентами основной группы, которым применяли протокол профилактики спастических реакций лучевой артерии (15,7% (n=36) и 9,3% (n=21), соответственно; р=0,031) (табл. 2, рис. 1). То есть у пациентов, которые не получали фармакологическую профилактику спазма лучевой артерии, чаще встречались большие неблагоприятные сердечные и цереброваскулярные события, такие как ИМ, нарушения мозгового кровообращения и летальность. При детальном анализе вторичных конечных точек в контрольной группе была отмечена высокая частота ИМ (12,6% (n=29) и 6,2% (n=14), соответственно; р=0,018) и повторных реваскуляризаций методом чрескожных коронарных вмешательств (16,1% (n=37) и 4,4% (n=10), соответственно; р=0,0001) по сравнению с пациентами основной группы (табл. 2, рис. 2). Однако не было отмечено статистически значимых различий во встречаемости нарушений мозгового кровообращения (3,1% (n=7) в основной группе и 3% (n=7) в группе контроля, p=0,768) и летальности (5,3% (n=12) в основной группе и 9% (n=25) в группе контроля, p=0,684) (табл. 2, рис. 2).
Таблица 2
Клинические результаты до 5 лет после операции

Примечание: p<0,05 — статистически значимые различия.

Рис. 1. Первичная конечная точка (MACCE) до 5 лет после операции.
Примечание: ось ординат — процент пациентов, ось абсцисс — месяцы наблюдения.
Сокращения: ИМ — инфаркт миокарда, ОНМК — острое нарушение мозгового кровообращения.

Рис. 2. Вторичные конечные точки до 5 лет после операции.
Примечание: ось ординат — процент пациентов, ось абсцисс — месяцы наблюдения.
Сокращение: ОНМК — острое нарушение мозгового кровообращения.
Обсуждение
Клинический успех применения внутренних грудных артерий в операции коронарного шунтирования поддерживает интерес многих исследователей и хирургов к другим аутоартериальным графтам, в частности, к лучевым артериям, которые могут быть использованы для достижения полной артериальной реваскуляризации миокарда. Опасным осложнением при полной аутоартериальной реваскуляризации миокарда является неконтролируемая спастическая реакция шунтов [8]. Дисфункция кондуитов из лучевой артерии спастической природы может достигать 10% [9]. Аутоартериальные сосудистые трансплантаты отличаются как по степени подверженности спазму, так и по степени вазодилататорных ответных реакций при воздействии различными лекарственными препаратами. Профилактика спазма обычно состоит в местном и системном использовании различных спазмолитиков, таких как нитраты, ингибиторы фосфодиэстеразы, антагонисты кальция и даже нейролептики (аминазин) [8]. Параллельно с развитием коронарной хирургии продолжается разработка и изучение различных методов и подходов фармакологической протекции, позволяющих увеличить и сохранить адекватный кровоток в аутоартериальных шунтах на долгие годы.
Результаты проведенного исследования подтверждают безопасность и подчеркивают эффективность применяемого фармакологического протокола профилактики спазма коронарных шунтов из лучевых артерий в течение 5-летнего периода наблюдения за пациентами. Ключевым моментом в рассматриваемом протоколе является применение антагонистов кальциевых каналов дигидропиридиновой группы. Отличительной особенностью производных дигидропиридина является преимущественное воздействие на гладкую мускулатуру коронарных и периферических артерий и отсутствие неблагоприятной антиаритмической активности [10]. Отрицательному инотропному эффекту антагонистов кальциевых каналов дигидропиридиновой группы противостоит уменьшение нагрузки на миокард за счет снижения общего периферического сопротивление сосудов, а рефлекторное повышение симпатического тонуса нивелирует влияние на атриовентрикулярный и синусовый узел, что исключает отрицательный хронотропный эффект [9].
В настоящее время не существует рекомендаций о сроках приёма препаратов для профилактики спазма лучевой артерии, а некоторые исследователи полностью игнорируют мероприятия по профилактике спазма аутоартериальных шунтов в послеоперационном периоде, не сообщая о клинических результатах такого подхода [11][12]. Обычно профилактику спастических реакций проводят после операции эмпирически, основываясь на наблюдениях за отдельными случаями спазма лучевой артерии, которые разрешают с помощью введения в шунт нитроглицерина [13]. В нашем исследовании был обнаружен сравнительно высокий послеоперационный клинический статус пациентов после аутоартериального коронарного шунтирования с использованием лучевой артерии при профилактике спастических реакций блокаторами кальциевых каналов дигидропиридиновой группы на всех этапах оперативного лечения и в течение одного года после операции. Традиционная концепция прямой связи между проходимостью коронарных шунтов и выживаемостью является биологически обоснованной и косвенно подтверждается исследованиями [13][14]. Современные клинические исследования показывают лучшую выживаемость среди пациентов, коронарные шунты которых обладают более высокой долгосрочной проходимостью [15]. Есть четкие доказательства того, что окклюзия трансплантатов к передней нисходящей артерии отрицательно влияет на выживаемость, однако несостоятельность шунтов к другим целевым коронарным сосудам с большей вероятностью приводит к нефатальным сердечным событиям, таким как повторные ИМ и последующие повторные реваскуляризации [13][16][17]. В результате настоящего 5-летнего наблюдения было продемонстрировано значимое снижение нефатальных сердечно-сосудистых событий, таких как ИМ и случаи повторных реваскуляризаций у пациентов, которым применён протокол профилактики спазма лучевой артерии в течение года после операции.
Заключение
Таким образом, для достижения успеха использования лучевой артерии в коронарной хирургии обязательная медикаментозная профилактика спастических реакций на всех этапах оперативного лечения, включая приём препаратов в течение года после операции, является важным критерием в достижении удовлетворительных отдаленных клинических результатов.
Отношения и деятельность: все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье.
Список литературы
1. Torregrossa G, Amabile A, Williams EE, et al. Multi-arterial and total-arterial coronary revascularization: Past, present, and future perspective. J Card Surg. 2020;35:1072-81. doi:10.1111/jocs.14537.
2. Taggart DP. The Role of Multiple Arterial Grafts in CABG: All Roads Lead to ROMA. J Am Coll Cardiol. 2019;7418:2249-53. doi:10.1016/j.jacc.2019.09.016.
3. Ambrus N, Szolnoky J, Pollesello P, et al. Prolonged antispasmodic effect in isolated radial artery graft and pronounced platelet inhibition induced by the inodilator drug, levosimendan. Basic Clin Pharmacol Toxicol. 2012;110:269-74. doi:10.1111/j.1742-7843.2011.00801.x.
4. Achouha P, Isselmoua KO, Boutekadjirtb R, et al. Reappraisal of a 20-year experience with the radial artery as a conduit for coronary bypass grafting. Eur J Cardiothorac Surg. 2012;41:87-92. doi:10.1016/j.ejcts.2011.05.027.
5. Gaudino M, Benedetto U, Fremes SE, et al. Effect of Calcium-Channel Blocker Therapy on Radial Artery Grafts After Coronary Bypass Surgery. J Am Coll Cardiol. 2019;73:2299-306. doi:10.1016/j.jacc.2019.02.054.
6. Shipulin VM, Kozlov BN, Nasrashvili GG, et al. Intraoperative chlorpromazine treatment for prevention of radial artery spasm in aortocoronary bypass grafting. Interactive CardioVascular and Thoracic Surgery. 2017;25(3):493-495. doi:10.1093/icvts/ivx143.
7. Затолокин В. В., Вечерский Ю. Ю., Андреев С. Л. Фармакологический протокол профилактики спазма лучевой артерии. Сибирский Медицинский Журнал. 2013;3:52-4.
8. He GW. Arterial grafts: clinical classification and pharmacological management. Ann Cardiothorac Surg. 2013;2:507-18. doi:10.3978/j.issn.2225-319X.2013.07.12.
9. Tranbaugh RF, Dimitrova KR, Lucido DJ, et al. The second best arterial graft: a propensity analysis of the radial artery versus the free right internal thoracic artery to bypass the circumflex coronary artery. J Thorac Cardiovasc Surg. 2014;47:133-40. doi:10.1016/j.jtcvs.2013.08.040.
10. Аронов Д. М., Лупанов В. П. Антагонисты кальция в лечении больных с сердечнососудистыми заболеваниями. Фокус на амлодипин. Русский медицинский журнал. 2007;4;275-8.
11. Schwann TA, Gaudino M, Baldawi M. Optimal management of radial artery grafts in CABG: Patient and target vessel selection and anti-spasm therapy. J Card Surg. 2018;5:205-12. doi:10.1111/jocs.13517.
12. Rehman SM, Yi G, Taggart DP. The radial artery: current concepts on its use in coronary artery revascularization. Ann Thorac Surg. 2013;96:1900-9. doi:10.1016/j.athoracsur.2013.06.083.
13. He GW, Taggart DP. Spasm in Arterial Grafts in Coronary Artery Bypass Grafting Surgery. Ann Thorac Surg. 2016;101:1222-9. doi:10.1016/j.athoracsur.2015.09.071.
14. Shavadia J, Norris CM, Graham MM, et al. Symptomatic graft failure and impact on clinical outcome after coronary artery bypass grafting surgery: results from the Alberta Provincial Project for Outcome Assessment in Coronary Heart Disease registry. Am Heart J. 2015;169:833-40. doi:10.1016/j.ahj.2015.02.022.
15. Garcia S, Sandoval Y, Roukoz H, et al. Outcomes after complete versus incomplete revascularization of patients with multivessel coronary artery disease: a meta-analysis of 89883 patients enrolled in randomized clinical trials and observational studies. J Am Coll Cardiol. 2013;62:1421-31. doi:10.1016/j.jacc.2013.05.033.
16. Вечерский Ю. Ю., Андреев С. Л., Затолокин В. В. Сравнительное исследование функционирования различных аутоартериальных и венозных графтов по данным шунтографии после изолированного коронарного шунтирования. Сибирский Медицинский Журнал. 2013;25:43-9.
17. Фролов А. В., Загородников Н. И. Кардиопротективная роль артериальных кондуитов. Кардиологический вестник. 2019;14:18-22. doi:10.17116/Cardiobulletin20191401118.
Об авторах
В. В. ЗатолокинРоссия
Василий Викторович Затолокин — кандидат медицинских наук, научный сотрудник отделения сердечно-сосудистой хирургии.
Томск
Конфликт интересов:
нет
Ю. Ю. Вечерский
Россия
Юрий Юрьевич Вечерский — доктор медицинских наук, ведущий научный сотрудник отделения сердечно-сосудистой хирургии, завдующий кардиохирургическим отделением № 1.
Томск
Конфликт интересов:
нет
Д. В. Манвелян
Россия
Давид Владимирович Манвелян — кандидат медицинских наук, младший научный сотрудник отделения сердечно-сосудистой хирургии.
Томск
Конфликт интересов:
нет
Б. Н. Козлов
Россия
Борис Николаевич Козлов — доктор медицинских наук, профессор, руководитель отдела сердечно-сосудистой хирургии.
Томск
Конфликт интересов:
нет
Дополнительные файлы
Рецензия
Для цитирования:
Затолокин В.В., Вечерский Ю.Ю., Манвелян Д.В., Козлов Б.Н. Роль антагонистов кальциевых каналов дигидропиридиновой группы при операции коронарного шунтирования с использованием лучевой артерии. Российский кардиологический журнал. 2022;27(8):4744. https://doi.org/10.15829/1560-4071-2022-4744
For citation:
Zatolokin V.V., Vechersky Yu.Yu., Manvelyan D.V., Kozlov B.N. Role of dihydropyridine calcium channel blockers in coronary bypass surgery using the radial artery graft. Russian Journal of Cardiology. 2022;27(8):4744. (In Russ.) https://doi.org/10.15829/1560-4071-2022-4744
JATS XML

















































