Перейти к:
Деформация левого предсердия как предиктор фибрилляции предсердий у пациентов с бессимптомным выраженным аортальным стенозом и сохранной систолической функцией левого желудочка
https://doi.org/10.15829/1560-4071-2022-4668
Аннотация
Цель. Изучение структурных и функциональных параметров левых отделов сердца у пациентов с выраженным аортальным стенозом (АС) и сохраненной фракцией выброса (ФВ) с целью определения риска развития фибрилляции предсердий (ФП).
Материал и методы. В исследование включены 84 пациента (37 мужчин), средний возраст 68±8 лет, с выраженным АС и ФВ >55%. Все пациенты имели синусовый ритм и были бессимптомными. Эхокардиография проводилась с определением продольной деформации (ПД) левого желудочка (ЛЖ), правого желудочка, левого предсердия (ЛП) и жесткости левого предсердия (ЖЛП) методом speckle tracking. Также определялись индекс массы (ИМ) ЛЖ, и индекс максимального объема левого предсердия (ИОЛП). Пациенты наблюдались в течение 1 года.
Результаты. ФП была зарегистрирована у 27 (32%) пациентов, из коих 9 (33%) имели бессимптомные эпизоды ФП, выявленные 48 ч электрокардиографическим наблюдением. 18 (67%) пациентов с ФП чувствовали сердцебиение. Пациенты с эпизодами ФП и без нее имели недостоверные различия в ИМ ЛЖ, ИОЛП, ПД ЛЖ. Пациенты с ФП имели более низкую ПД ЛП и более высокую ЖЛП по сравнению с пациентами без развития ФП. Регрессионный анализ всех параметров выявил, что ПД ЛП и ЖЛП являлись независимыми предикторами развития ФП.
Заключение. ФП развивается у примерно одной трети бессимптомных пациентов с выраженным АС и нормальной ФВ. Развитие ФП предрасполагает к появлению симптомов АС у большинства пациентов. ПД ЛП и ЖЛП являлись предикторами ФП у этих пациентов. Выявление пациентов с риском развития ФП позволит провести замену аортального клапана в более ранние сроки.
Ключевые слова
Для цитирования:
Чилингарян А.Л., Тунян Л.Г., Адамян К.Г., Тумасян Л.Р., Кждрян О.К., Сисакян Д.Г., Асатрян А.А., Зелвеян П.А. Деформация левого предсердия как предиктор фибрилляции предсердий у пациентов с бессимптомным выраженным аортальным стенозом и сохранной систолической функцией левого желудочка. Российский кардиологический журнал. 2022;27(7):4668. https://doi.org/10.15829/1560-4071-2022-4668
For citation:
Chilingaryan A.L., Tunyan L.G., Adamyan K.G., Tumasyan L.R., Kzhdryan H.K., Sisakyan J.G., Asatryan A.A., Zelveyan P.H. Left atrial strain as a predictor of atrial fibrillation in patients with asymptomatic severe aortic stenosis and preserved left ventricular systolic function. Russian Journal of Cardiology. 2022;27(7):4668. (In Russ.) https://doi.org/10.15829/1560-4071-2022-4668
Аортальный стеноз (АС) является самой распространенной болезнью клапанов сердца, частота которой увеличивается с возрастом [1]. С развитием дисфункции левого желудочка (ЛЖ) прогноз пациентов резко ухудшается. Во избежание развития дисфункции ЛЖ при выраженном АС разработана тактика “бдительного выжидания” для своевременного оперативного вмешательства, основанная на наблюдении пациентов до появления симптомов и оценке фракции выброса (ФВ) ЛЖ [2]. Однако многие пациенты с бессимптомным выраженным АС также нуждаются в своевременной замене аортального клапана (АК), и выявление этих пациентов труднее и требует проведения нагрузочного теста для определения выраженности стеноза и нарушенной гемодинамики [3][4]. Кроме того, ФВ ЛЖ снижается на относительно поздних стадиях заболевания и является ненадежным параметром определения доклинической дисфункции ЛЖ со значительной внутриисследовательской вариабельностью. Возможно, определение продольной деформации (ПД) ЛЖ является более надежным методом оценки систолической функции
ЛЖ [5]. Несмотря на то, что все исследования направлены на оценку систолической функции ЛЖ, повышение постнагрузки и развитие концентрической гипертрофии ЛЖ с фиброзом миокарда и повышением его жесткости приводит к снижению податливости ЛЖ, а следовательно, и диастолической дисфункции ЛЖ [6]. В условиях диастолической дисфункции дилатация и дисфункция левого предсердия (ЛП) вследствие повышения ее постнагрузки являются надежными критериями продолжительной диастолической дисфункции ЛЖ [7]. Это, в свою очередь, повышает риск развития фибрилляции предсердий (ФП), что может привести к значительному ухудшению гемодинамики вследствие снижения сердечного выброса и появлению симптомов. По данным Ferreira J, et al., функция ЛП является независимым предиктором развития ФП после замены АК [8]. Таким образом, определение дисфункции ЛП и прогнозирование развития ФП у пациентов с АС является дополнительным фактором определения своевременности оперативного лечения у этих пациентов с нормальной ФВ. Данное исследование посвящено изучению структурных и функциональных параметров левых отделов сердца у пациентов с выраженным АС и нормальной ФВ с целью определения риска развития ФП.
Материал и методы
В исследование включены 84 пациента (37 мужчин), средний возраст 68±8 лет, с выраженным АС и ФВ >55%. Все пациенты имели синусовый ритм и были бессимптомными. 30 бессимптомных практически здоровых лиц соответствующего возраста и пола были включены в контрольную группу.
Стандартная эхокардиография (ЭхоКГ) проведена согласно рекомендациям Американского общества кардиологов на аппарате Vivid 7 Dimension (GE Healthcare, Норвегия) с датчиками M4S и 3V с частотой кадров минимум 50 в сек [9]. Все изображения получены и сохранены при задержке дыхания. Видео изображения и данные допплер-ЭхоКГ из 3 циклов сохранены для последующего просмотра с использованием пакета программ EchoPack, GE Healthcare. ФВ ЛЖ автоматически измерялась по специальной программе как среднее значение ФВ в четырехи двухкамерных апикальных позициях.
Скорость трансаортального кровотока, интеграл скорости и времени трансаортального потока определены постоянно-волновой допплерографией, площадь АК рассчитывалась по уравнению непрерывности потока [9].
Выраженный АС был диагностирован, если площадь раскрытия АК была <1 см2, максимальная скорость кровотока через АК >4 м/с, средний градиент давления ≥40 мм рт.ст. [10].
Для выявления истинно бессимптомных пациентов проводился стресс-ЭхоКГ тредмил тест, который считался отрицательным при отсутствии симптомов, гипотонии, аритмий больших градаций, депрессии ST-сегмента на электрокардиограмме и нарушений локальной сократимости ЛЖ [11].
Объем ЛП измерялся в конце систолы желудочков двуплановым методом дисков с последующим расчетом его индекса (ИОЛП) разделением на площадь поверхности тела [12]. Масса миокарда ЛЖ рассчитывалась по методу площадь-длина с последующим вычислением его индекса разделением на площадь поверхности тела. Гипертрофия ЛЖ диагностировалась при индексе массы тела ≥102 г/м2 у мужчин и ≥81 г/м2 у женщин [12].
Скорости раннего (Е) и предсердного (А) трансмитральных и транстрикуспидальных потоков, а также время спада Е измерялись в 4-камерной апикальной позиции в режиме пульсовой допплерографии с установкой метки в зоне кооптации створок митрального и трикуспидального клапана в диастолу при горизонтальной развертке 100 мм/сек. Регистрировались средние значения трех последовательных циклов. Скорости движения митрального и трикуспидального кольца в диастолу измерялись усреднением скоростей движения их латеральной и медиальной частей в раннюю (е’) диастолу после чего программа автоматически вычисляла соотношение Е/е’ [13]. ПД миокарда всех камер сердца измерялась в режиме автоматизированной функции изображения после получения и сохранения стандартных апикальных срезов с последующим вычислением программой EchoPac. ПД ЛЖ анализировалась впоследствии после сохранения изображений трех апикальных позиций ЛЖ, которые были взяты с обязательным включением в изображение истинной верхушки ЛЖ. Для измерения отмечались оба конца основания митрального кольца и верхушка ЛЖ, после чего программа автоматически обводила стенки ЛЖ. При необходимости проводилась ручная коррекция, после чего сегментная и общая 17-сегментная ПД ЛЖ вычислялась автоматически (рис. 1 А).
Для анализа ПД ЛП в резервуарной фазе также использовался программный пакет EchoPac. Изображения были получены в срезах с наибольшими размерами ЛП в 4- и 2-камерных апикальных позициях. В каждой позиции ПД ЛП определялось как среднее значение всех шести сегментов ЛП, после чего общая ПД ЛП измерялась как среднее значение ПД ЛП в обеих апикальных позициях (рис. 1 Б). Жесткость ЛП (ЖЛП) измерялась ее разделением Е/е’ на ПД ЛЖ [14].
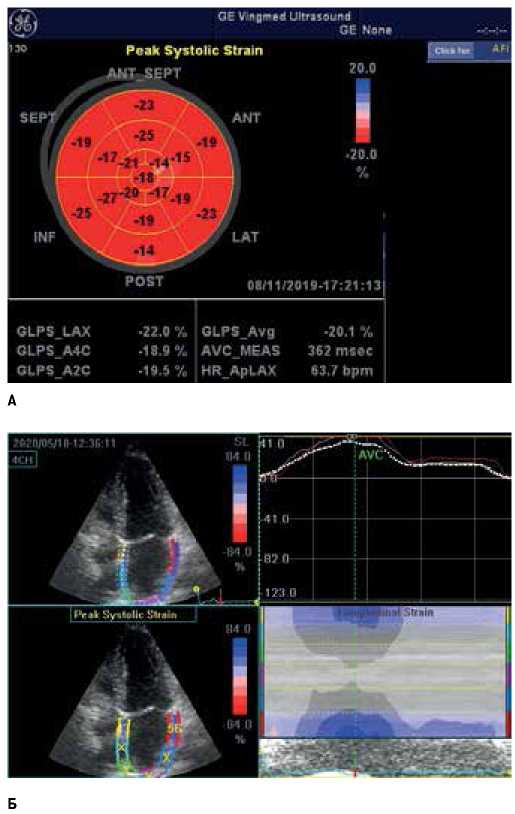
Рис. 1. Расчет ПД ЛЖ (А) и ЛП (Б).
48-ч электрокардиографическое наблюдение проводилось каждые 3 мес. для выявления бессимптомных эпизодов ФП.
Измерения проводились одним специалистом. Внутриисследовательская вариабельность определения ПД ЛЖ, ПД правого желудочка, ПД ЛП, ПД правого предсердия оценена у 10 исследуемых лиц (5 пациентов и 5 здоровых лиц) и была 4% и 7%, 8% и 6%, соответственно. Пациенты наблюдались в течение 1 года.
Исследование соответствует положениям Хельсинкской декларации. Местный комитет по этике одобрил протокол исследования, и было получено информированное согласие субъектов.
Статистический анализ проведен по программному пакету SPSS 16.0. Непрерывные параметры представлены как m±SD, категориальные параметры представлены как абсолютные значения и проценты. Данные анализированы по параметрическому тесту Стьюдента и непараметрическому Манна-Уитни U тесту. Значения p<0,05 приняты как статистически достоверные.
Результаты
Пациенты имели достоверно большие значения массы ЛЖ, ИОЛП и ЖЛП, давления наполнения ЛЖ также были повышены у пациентов по сравнению с контрольной группой. Исходные данные пациентов и контрольной группы приведены в таблице 1.
ФП была зарегистрирована у 27 (32%) пациентов, из них — 9 пациентов (33%) имели короткие бессимптомные эпизоды ФП, выявленные 48-ч электрокардиографическим наблюдением. У 18 (67%) пациентов с ФП появились симптомы слабости, головокружения и/или одышки, которые прошли после восстановления синусового ритма.
Пациенты с эпизодами ФП и без нее имели недостоверные различия в показателях индекса массы (ИМ) ЛЖ, ИОЛП, ПД ЛЖ. У пациентов с ФП значения ПД ЛП были ниже, а ЖЛП была повышена по сравнению с пациентами без развития ФП (табл. 2).
Наблюдалась тесная корреляция между ПД ЛП, ЖЛП, с одной стороны, и выраженностью АС, ИМ ЛЖ, ПД ЛЖ и давлений наполнения ЛЖ, с другой (табл. 3).
Регрессионный анализ всех параметров выявил, что ПД ЛП и ЖЛП являются независимыми предикторами развития ФП у исследуемых пациентов (табл. 4).
Таблица 1
Исходные данные пациентов и контрольной группы

Сокращения: АГ — артериальная гипертензия, ГДср — средний градиент давления через аортальный клапан, ЖЛП — жесткость левого предсердия, ИМЛЖ — индекс массы левого желудочка, ИМТ — индекс массы тела, ИОЛП — индекс объема левого предсердия, ПАО — площадь аортального отверстия, ПДЛЖ — продольная деформация левого желудочка, ПДЛП — продольная деформация левого предсердия, САД — систолическое артериальное давление, САК — максимальная скорость кровотока через аортальный клапан, ФВ — фракция выброса.
Таблица 2
Данные пациентов с ФП и без нее
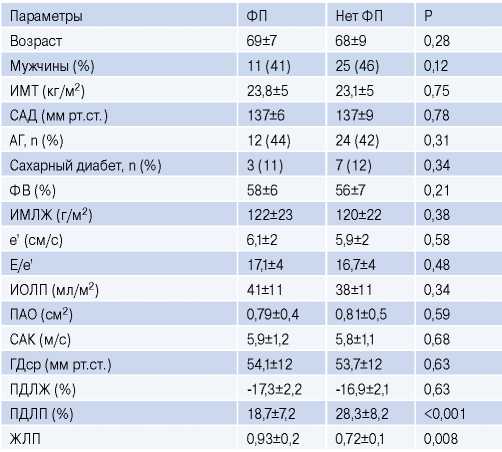
Сокращения: АГ — артериальная гипертензия, ГДср — средний градиент давления через аортальный клапан, ЖЛП — жесткость левого предсердия, ИМЛЖ — индекс массы левого желудочка, ИМТ — индекс массы тела, ИОЛП — индекс объема левого предсердия, ПАО — площадь аортального отверстия, ПДЛЖ — продольная деформация левого желудочка, ПДЛП — продольная деформация левого предсердия, САД — систолическое артериальное давление, САК — максимальная скорость кровотока через аортальный клапан, ФВ — фракция выброса, ФП — фибрилляция предсердий.
Таблица 3
Корреляционный анализ параметров
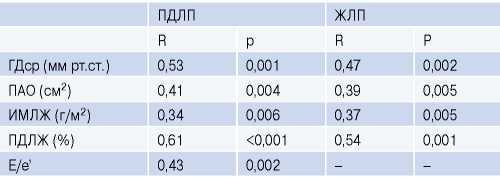
Сокращения: ГДср — средний градиент давления через аортальный клапан, ЖЛП — жесткость левого предсердия, ИМЛЖ — индекс массы левого желудочка, ПАО — площадь аортального отверстия, ПДЛЖ — продольная деформация левого желудочка, ПДЛП — продольная деформация левого предсердия.
Таблица 4
Регрессионный анализ показателей пациентов с АС
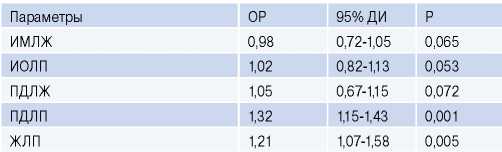
Сокращения: ДИ — доверительный интервал, ЖЛП — жесткость левого предсердия, ИМЛЖ — индекс массы левого желудочка, ИОЛП — индекс объема левого предсердия, ОР — отношение рисков, ПДЛЖ — продольная деформация левого желудочка, ПДЛП — продольная деформация левого предсердия.
Обсуждение
Данное исследование посвящено изучению структурных и функциональных ЭхоКГ параметров у бессимптомных пациентов с АС с целью прогнозирования новых эпизодов ФП.
АС является частой встречаемой патологией, при которой гипертрофия ЛЖ с повышением жесткости миокарда приводит к диастолической дисфункции, что, в свою очередь, повышает постнагрузку ЛП с повышением внутриполостного давления. Со временем дилатация полости и фибротические изменения ЛП создают условия для развития ФП, которая может привести к относительно “преждевременному” появлению симптомов у до этого бессимптомных пациентов, что ускорит протезирование АК. С другой стороны, ФП, независимо от ее типа, вдвое повышает риск сердечно-сосудистой и общей смертности после замены АК [15].
ФП является частым осложнением. Stortecky А, et al. наблюдали ФП у 33,7% исследуемых пациентов с выраженным АС [15]. Несмотря на то, что пациенты в исследовании Stortecky А, et al. были старше и были симптоматичными, в нашем исследовании частота случаев ФП была такой же (32%). По-видимому, факторы, предрасполагающие к ФП, формируются задолго до появления симптомов. Однако отличием нашего исследования было изучение появления новых эпизодов ФП, а не изучение распространенности ФП в популяции пациентов с выраженным АС.
Следует отметить, что по данным нашего исследования у 18 пациентов с возникновением ФП появились симптомы, характерные для АС — одышка у 9 пациентов, загрудинные боли у 6 пациентов, обмороки у 3 пациентов. Это позволяет заключить, что ФП способствует раннему выявлению кандидатов на замену АК.
Сравнение демографических, клинических и ЭхоКГ исходных параметров показало, что у пациентов с последующим развитием ФП только значения ПД ЛП и ЖЛП достоверно отличались от таковых у пациентов без эпизодов ФП. Интересно отметить, что изучаемые нами параметры ЛЖ не отличались у пациентов с ФП и без нее. По данным Todaro M, et al., ПД ЛЖ является предиктором исходов у бессимптомных пациентов с выраженным АС [16]. Marques-Alves P, et al. показали, что ПД ЛЖ является достоверным предиктором исходов, однако по их данным ПД ЛП являлась лучшим дискриминатором выраженности АС, превосходящим Е/е’ и ПД ЛЖ [17]. Таким образом, несмотря на роль ПД ЛЖ в прогнозировании исходов при АС и как индикатора выраженности АС, этот параметр не ответственен за прогноз ФП у пациентов с ФП. Результаты нашего исследования совпадают с данными Marques-Alves P, et al. в том, что ПД ЛП тесно коррелирует с выраженностью АС [17].
Несмотря на то, что в нашем исследовании наблюдалась достоверная корреляция параметром ПД ЛП и ЖЛП с параметрами ЛЖ, только ПД ЛП и ЖЛП являлись предикторами развития ФП у пациентов с выраженным АС.
По нашим данным, показатель давления наполнения ЛЖ Е/е’ также не отличался у пациентов с ФП и без нее, поэтому мы полагаем, что роль ЖЛП в развитии ФП больше зависит от ПД ЛП, а не от давления наполнения ЛЖ. Действительно, ПД ЛП является не только функциональным параметром эластичности ЛП, но также параметром, тесно коррелирующим с фибротическими изменениями миокарда ЛП, и поэтому скорее локальные структурно-электрические процессы, происходящие в ЛП, чем гемодинамические, предрасполагают к развитию ФП [18].
Ограничения исследования. Исследование является одноцентровым, количество пациентов было небольшим, короткий срок наблюдения, отсутствие регистрации аортального потока из правого парастернального доступа.
Заключение
ФП развивается у одной трети бессимптомных пациентов с выраженным АС. Развитие ФП предрасполагает к появлению симптомов АС у большинства пациентов. Локальные процессы, протекающие в ЛП, играют большую роль в развитии ФП, чем гемодинамические. ПД ЛП является надежным предиктором ФП у бессимптомных пациентов с выраженным АС. Выявление пациентов с риском развития ФП позволит провести замену АК в более точные сроки.
Отношения и деятельность: все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье.
Список литературы
1. Nkomo VT, Gardin JM, Skelton TN, et al. Burden of valvular heart diseases: a populationbased study. Lancet. 2006;368:1005-11. doi:10.1016/S0140-6736(06)69208-8.
2. Baumgartner H, Falk V, Bax JJ, et al. 2017 ESC/EACTS Guidelines for the management of valvular heart disease. Eur Heart J. 2017;38(36):2739-86. doi:10.1093/ejcts/ezx324.
3. Bhattacharyya S, Hayward C, Pepper J, Senior R. Risk stratification in asymptomatic severe aortic stenosis: a critical appraisal. Eur Heart J. 2012;33:2377-87. doi:10.1093/eurheartj/ehs190.
4. Marechaux S, Hachicha Z, Bellouin A, et al. Usefulness of exercise-stress echocardio- graphy for risk stratification of true asymptomatic patients with aortic valve stenosis. Eur Heart J. 2010;31:1390-7. doi:10.1093/eurheartj/ehq076.
5. Zito C, Longobardo L, Citro R, et al. Ten Years of 2D Longitudinal Strain for Early Myocardial Dysfunction Detection: A Clinical Overview. Biomed Res Int. 2018;2018:8979407. doi:10.1155/2018/8979407.
6. Cioffi G, Faggiano P, Vizzardi E, et al. Prognostic effect of inappropriately high left ventricular mass in asymptomatic severe aortic stenosis. Heart. 2011;97:301-7. doi:10.1136/hrt.2010.192997.
7. O’Connor K, Magne J, Rosca M, et al. Left atrial function and remodelling in aortic stenosis. Eur J Echocardiogr. 2011;12:299-305. doi:10.1093/ejechocard/jer006.
8. Ferreira J, Gonçalves V, Marques-Alves P, et al. Left atrial functional assessment and mortality in patients with severe aortic stenosis with sinus rhythm. Cardiovasc Ultrasound. 2021;19:1. doi:10.1186/s12947-020-00231-0.
9. Baumgartner H, Hung J, Bermejo J, et al. Recommendations on the echocardio- graphic assessment of aortic valve stenosis: a focused update from the European Association of Cardiovascular Imaging and the American Society of Echocardiography. Eur Heart J Cardiovasc Imaging. 2017;18(3):254-75. doi:10.1093/ ehjci/jew335.
10. Pierard LA, Dulgheru R. Evaluation of aortic stenosis: an update–including low-flow States, myocardial mechanics, and stress testing. Curr Cardiol Rep. 2015;17(6):42. doi:10.1007/ s11886-015-0601-0.
11. Nishimura RA, Otto CM, Bonow RO, et al. 2014 AHA/ACC guideline for the management of patients with valvular heart disease: a report of the American College of Cardiology/ American Heart Association Task Force on Practice Guidelines. Circulation. 2014;129:e521-e643. doi:10.1161/CIR.0000000000000031.
12. Lang RM, Badano LP, Mor-Avi V, et al. Recommendations for Cardiac Chamber Quantification by Echocardiography in Adults: An Update from the American Society of Echocardiography and the European Association of Cardiovascular Imaging. European Heart Journal — Cardiovascular Imaging. 2015;16,233-71. doi:10.1093/ehjci/jev014.
13. Nagueh SF, Smiseth OA, Appleton SP, et al. Recommendations for the Evaluation of Left Ventricular Diastolic Function by Echocardiography: An Update from the American Society of Echocardiography and the European Association of Cardiovascular Imaging. J Am Soc Echocardiogr. 2016;29:277-314. doi:10.1016/j.echo.2016.01.011.
14. Machino-Ohtsuka T, Seo Y, Tada H, et al. Left atrial stiffness relates to left ventricular diastolic dysfunction and recurrence after pulmonary vein isolation for atrial fibrillation. J Cardiovasc Electrophysiol. 2011;22:999-1006. doi:10.1111/j.15408167.2011.02049.x.
15. Stortecky S, Buellesfeld L, Wenaweser P, et al. Atrial fibrillation and aortic stenosis: impact on clinical outcomes among patients undergoing transcatheter aortic valve implantation. Circ Cardiovasc Interv. 2013;6(1):77-84. doi:10.1161/CIRCINTERVENTIONS.112.000124.
16. Todaro MC, Carerj S, Khandheria B, et al. Usefulness of atrial function for risk stratification in asymptomatic severe aortic stenosis. Journal of Cardiology 2016;67:71-9. doi:10.1016/j. jjcc.2015.04.010.
17. Marques-Alves P, Marinho AV, Teixeira R, et al. BMC Cardiovasc Disord. 2019;19(1):215. doi:10.1186/s12872-019-1204-2.
18. Habibi M, Lima JA, Khurram IM, et al. Association of left atrial function and left atrial enhancement in patients with atrial fibrillation: cardiac magnetic resonance study. Circ Cardiovasc Imaging. 2015;8(2):e002769. doi:10.1161/CIRCIMAGING.114.002769.
Об авторах
А. Л. ЧилингарянАрмения
Арам Левонович Чилингарян — доктор медицинских наук, научный руководитель рабочей группы по визуализационным методам Армянской ассоциации кардиологов; профессор кафедры кардиологии постдипломного образования.
Ереван
Конфликт интересов:
нет
Л. Г. Тунян
Армения
Лусине Герасимовна Тунян — доктор медицинских наук, научный сотрудник отделения инфаркта миокарда НИИ Кардиологии, преподаватель кафедры кардиологии постдипломного образования; ученый секретарь специализированного совета по защите диссертаций по специальности “Терапия” при ВАК, ученый секретарь.
Ереван
Конфликт интересов:
нет
К. Г. Адамян
Армения
Карлен Григорьевич Адамян — академик Академии наук РА, профессор кафедры кардиологии постдипломного образования; консультант директора.
Ереван
Конфликт интересов:
нет
Л. Р. Тумасян
Армения
Лиана Размиковна Тумасян — доктор медицинских наук, научный руководитель отделения Общей кардиологии.
Ереван
Конфликт интересов:
нет
О. К. Кждрян
Армения
Оганес Кайцакович Кждрян — кандидат медицинских наук, главный врач.
Ереван
Конфликт интересов:
нет
Д. Г. Сисакян
Армения
Джемма Григорьевна Сисакян — научный сотрудник отделения инфаркта миокарда.
Ереван
Конфликт интересов:
нет
А. А. Асатрян
Армения
Арменуи Артуровна Асатрян — научный сотрудник отделения инфаркта миокарда.
Ереван
Конфликт интересов:
not
П. А. Зелвеян
Армения
Парунак Арутюнович Зелвеян — доктор медицинских наук, профессор, директор.
Ереван
Конфликт интересов:
нет
Дополнительные файлы
Рецензия
Для цитирования:
Чилингарян А.Л., Тунян Л.Г., Адамян К.Г., Тумасян Л.Р., Кждрян О.К., Сисакян Д.Г., Асатрян А.А., Зелвеян П.А. Деформация левого предсердия как предиктор фибрилляции предсердий у пациентов с бессимптомным выраженным аортальным стенозом и сохранной систолической функцией левого желудочка. Российский кардиологический журнал. 2022;27(7):4668. https://doi.org/10.15829/1560-4071-2022-4668
For citation:
Chilingaryan A.L., Tunyan L.G., Adamyan K.G., Tumasyan L.R., Kzhdryan H.K., Sisakyan J.G., Asatryan A.A., Zelveyan P.H. Left atrial strain as a predictor of atrial fibrillation in patients with asymptomatic severe aortic stenosis and preserved left ventricular systolic function. Russian Journal of Cardiology. 2022;27(7):4668. (In Russ.) https://doi.org/10.15829/1560-4071-2022-4668
JATS XML

















































