Перейти к:
Исследование биоэквивалентности препарата Розувастатин у здоровых добровольцев при однократном приеме натощак
https://doi.org/10.15829/1560-4071-2025-6416
EDN: YBRRVL
Аннотация
Цель. Изучить сравнительную фармакокинетику и установить биоэквивалентность препаратов Розувастатин, таблетки, покрытые пленочной оболочкой, 20 мг (ООО "НТФФ "ПОЛИСАН", Россия) (Т) и препарата Крестор®, таблетки, покрытые пленочной оболочкой, 20 мг (АстраЗенека ЮК Лимитед, Великобритания) (R), при однократном применении в дозе 20 мг натощак здоровыми добровольцами, а также изучение безопасности и переносимости.
Материал и методы. Открытое рандомизированное перекрестное двухпериодное исследование сравнительной фармакокинетики и биоэквивалентности препаратов Т и R при однократном приеме натощак было проведено с участием 46 здоровых добровольцев на базе одного исследовательского центра. После рандомизации добровольцы в каждом Периоде исследования однократно принимали 20 мг розувастатина в различной последовательности (TR или RT). Периоды I и II были разделены 14-дневным отмывочным периодом. Концентрацию розувастатина в плазме определяли методом высокоэффективной жидкостной хроматографии с масс-спектрометрическим детектированием и рассчитывали основные фармакокинетические параметры: площадь под кривой "концентрация действующего вещества — время" в интервале времени от 0 до 72 ч (AUC0-t) и максимальную концентрацию (Cmax). Препараты считались биоэквивалентными, если 90% доверительные интервалы (ДИ) отношений средних геометрических значений T/R для Cmax и AUC0-t находились в диапазоне 80-125%. Оценка безопасности включала анализ показателей жизнедеятельности, физикального осмотра, лабораторных исследований, электрокардиографии в 12 отведениях и регистрацию нежелательных явлений (НЯ), возникших в ходе исследования.
Результаты. 44 из 46 рандомизированных добровольцев составили популяцию безопасности, 42 участника завершили исследование без значительных отклонений от протокола и составили популяцию для оценки фармакокинетических параметров, статистического анализа и оценки биоэквивалентности. Значения фармакокинетических параметров T и R были сопоставимы. 90% ДИ для AUC0-t и Cmax находились в границах приемлемости 80,00-125,00%: 91,71-107,41% и 91,58-115,83%, соответственно. Всего в исследовании было зарегистрировано 2 НЯ у 1 участника после приёма препарата R. Частота НЯ не отличалась между группами. Ни в одной из групп в ходе исследования не было зарегистрировано клинически значимых отклонений показателей жизнедеятельности, физикального осмотра, лабораторных исследований и ЭКГ.
Заключение. Препараты T и R были признаны биоэквивалентными и продемонстрировали сходные профили безопасности.
Ключевые слова
Для цитирования:
Котовская Ю.В., Малая И.П., Григорьев А.В., Сидорова А.A., Степанов В.А., Понасенкова С.В. Исследование биоэквивалентности препарата Розувастатин у здоровых добровольцев при однократном приеме натощак. Российский кардиологический журнал. 2025;30(7):6416. https://doi.org/10.15829/1560-4071-2025-6416. EDN: YBRRVL
For citation:
Kotovskaya Yu.V., Malaya I.P., Grigoriev A.V., Sidorova A.A., Stepanov V.A., Ponasenkova S.V. Bioequivalence study of Rosuvastatin in healthy volunteers after a single dose on an empty stomach. Russian Journal of Cardiology. 2025;30(7):6416. (In Russ.) https://doi.org/10.15829/1560-4071-2025-6416. EDN: YBRRVL
Сердечно-сосудистые заболевания (ССЗ) занимают лидирующее место в структуре причин инвалидизации и смертности [1]. По данным Всемирной организации здравоохранения, ежегодно от ССЗ погибает >17 млн человек, что составляет 32% всех случаев смерти в мире [2]. Совокупное влияние гиперхолестеринемии, дислипидемии и повышенных значений артериального давления вносит ключевой вклад в развитие и прогрессию ССЗ, в связи с чем контроль данных факторов риска должен являться единой приоритетной стратегией в рамках как первичной, так и вторичной профилактики [3][4]. Основным фактором риска развития ССЗ и атеросклероза считается повышенный уровень холестерина (ХС) липопротеинов низкой плотности (ЛНП), который преимущественно встречается у пациентов с гиперхолестеринемией. В равной степени развитию атерогенных поражений сосудов может способствовать снижение уровня липопротеинов высокой плотности [5]. По результатам рандомизированных исследований установлено, что снижение уровня ХС ЛНП на 1 ммоль/л снижает риск серьезных сосудистых событий на 22% и смертность от ишемической болезни сердца на 20% [6].
На сегодняшний день статины — одна из наиболее изученных групп препаратов с доказанной способностью снижать сердечно-сосудистую заболеваемость и смертность. Они по праву занимают одно из ключевых мест в международных клинических рекомендациях по лечению и профилактике ССЗ. Согласно рекомендациям Европейского общества кардиологов/Европейского общества атеросклероза и российским клиническим рекомендациям, терапия статинами в настоящее время показана следующим группам пациентов: лицам категории очень высокого риска сердечно-сосудистых осложнений независимо от исходного уровня ХС; лицам категории высокого риска при уровне ХС ЛНП ≥1,8 ммоль/л; лицам категории умеренного риска, если желаемый уровень ХС не достигнут при изменении образа жизни пациента и уровень ХС ЛНП исходно ≥2,6 ммоль/л; лицам из категории низкого риска при уровне ХС ЛНП исходно ≥4,9 ммоль/л и неэффективности немедикаментозных методов [7].
Ингибиторы 3-гидрокси-3-метилглутарил-кофермента А редуктазы, также известные как статины, в клинических исследованиях продемонстрировали наибольшую эффективность в снижении уровня ХС в сыворотке крови среди гиполипидемических препаратов и составляют основу фармакологического лечения дислипидемии и гиперхолестеринемии для предотвращения развития атерогенных ССЗ [8]. Розувастатин, аторвастатин, правастатин, симвастатин и питавастатин на сегодняшний день входят в число доступных статинов. При этом розувастатин является одним из наиболее широко назначаемых и эффективных препаратов для снижения целевых уровней общего ХС и ХС ЛНП в сравнении с другими представителями этого класса [9][10]. Препарат хорошо зарекомендовал себя в клинической практике, а его эффективность подтверждена многочисленными плацебо-контролируемыми и сравнительными исследованиями ANDROMEDA, STELLAR, DISCOVERY-PENTA, ATOROS, DISCOVERY BELUX, EXPLORER и др. [11-15]. Снижение сердечно-сосудистого риска и улучшение прогноза подтверждаются активным назначением розувастатина в когорте вторичной профилактики по данным фармакоэпидемиологических исследований DYSIS I и DYSIS II. В исследовании HOPE 3 применение розувастатина у мужчин ≥55 лет и женщин ≥65 лет без ССЗ, но имеющих один из факторов риска ССЗ, на 25% вызывало снижение риска комбинации сердечно-сосудистых осложнений, включая новые случаи острого инфаркта миокарда и ХСН [16].
В связи с широкими показаниями к назначению гиполипидемических препаратов актуальной становится проблема доступности лечения статинами, особенно для лиц пожилого возраста. Решить эту задачу помогает широкое внедрение воспроизведенных препаратов, стоимость которых значительно ниже, чем оригинала. Проведение клинических исследований биоэквивалентности позволяет оценить сопоставимость воспроизведенного и оригинального препаратов по фармакокинетическим параметрам, а также по профилю безопасности. Несмотря на то, что в настоящий момент на фармацевтическом рынке представлено >20 воспроизведенных препаратов розувастатина1, в т.ч. отечественных производителей, потребность в доступных гиполипидемических средствах сохраняется.
Клиническое исследование биоэквивалентности препарата Розувастатин, таблетки, покрытые пленочной оболочкой, 20 мг (ООО "НТФФ "ПОЛИСАН", Россия) (T) и оригинального препарата Крестор®, таблетки, покрытые пленочной оболочкой, 20 мг (АстраЗенека ЮК Лимитед, Великобритания) (R) имеет важное социальное значение для улучшения доступности лекарственного препарата.
Первичной целью исследования являлось изучение сравнительной фармакокинетики и установление биоэквивалентности препаратов T и R при однократном применении в дозе 20 мг натощак здоровыми добровольцами.
Вторичной целью было изучение безопасности и переносимости исследуемых препаратов (ИП) в рамках данного исследования.
Материал и методы
Дизайн: открытое рандомизированное перекрестное двухпериодное исследование сравнительной фармакокинетики и биоэквивалентности препаратов Т и R при однократном приеме натощак было проведено в октябре — ноябре 2024г с участием здоровых добровольцев на базе одного исследовательского центра после получения одобрения Минздрава России, Совета по этике и локального этического комитета.
Субъекты исследования: в исследовании принимали участие здоровые некурящие добровольцы мужского и женского пола европеоидной расы в возрасте от 18 до 45 лет. Обязательным условием участия в исследовании было подписание формы информированного согласия. Было скринировано 56 участников, из которых 46 добровольцев, соответствовавших всем критериям включения и не имеющих критериев невключения в исследование, рандомизировали в 2 группы, отличавшиеся последовательностью приёма препаратов исследования (23 в группе RT и 23 в группе TR).
Этапы и продолжительность исследования: по логистическим причинам исследование было проведено в 2 группах субъектов (когортах), каждая из которых начинала участие в исследовании с разницей в 3 дня. Когорта 1 включала 18 добровольцев (9 из группы RT, 9 из группы TR), когорта 2-28 добровольцев (14 из группы RT, 14 из группы TR). Каждая группа последовательно участвовала в Периодах I и II исследования. Период включал в себя госпитализацию продолжительностью не менее 36 ч и амбулаторные визиты в исследовательский центр через 36, 48 и 72 ч после приёма препарата. Периоды исследования были разделены отмывочным периодом длительностью 14 дней между приёмами ИП (>5 периодов полувыведения (t1/2) розувастатина). Последующее наблюдение проводилось с целью оценки безопасности в течение 6±1 дней с момента последнего визита добровольца в Периоде II исследования. Общая продолжительность исследования для добровольцев составила не более 33 дней.
Временные точки отбора образцов крови и биоаналитическая методика: данное исследование являлось открытым. Однако с целью минимизации субъективности для биоаналитической лаборатории было произведено заслепление получаемого добровольцами препарата. Для оценки концентрации розувастатина в каждом периоде производили отбор образцов крови за 30 мин до приёма ИП и через 30 мин, 1 ч, 1 ч 30 мин, 2 ч, 2 ч 30 мин, 3 ч, 3 ч 20 мин, 3 ч 40 мин, 4 ч, 4 ч 20 мин, 4 ч 40 мин, 5 ч, 5 ч 20 мин, 5 ч 40 мин, 6 ч, 7 ч, 8 ч, 10 ч, 12 ч, 24 ч, 36 ч, 48 ч, 72 ч (24 точки в каждом из Периодов исследования). Количественное определение розувастатина в плазме крови добровольцев проводили с использованием высокочувствительного и селективного метода высокоэффективной жидкостной хроматографии с масс-спектрометрическим детектированием. Метод был разработан и валидирован в аналитической лаборатории. Нижний предел количественного определения розувастатина в плазме крови составил 0,1 нг/мл, при этом было выполнено условие, что нижний предел количественного определения не превышал 5% от ожидаемого значения максимальной концентрации действующего вещества в плазме крови (Cmax). Подтвержденный аналитический диапазон методики для розувастатина составил 0,1-100 нг/мл, что позволило применить разработанную методику для проведения аналитической части исследований фармакокинетики.
Фармакокинетические параметры. Определяли следующие переменные: первичные фармакокинетические параметры — площадь под кривой "концентрация действующего вещества — время" в интервале времени от 0 до 72 ч (AUC0-t), Cmax, вторичные фармакокинетические параметры — время достижения максимальной концентрации (Tmax), t1/2, константу скорости элиминации, суммарную площадь под кривой "концентрация действующего вещества — время" в интервале времени от 0 до бесконечности (AUC0-∞), остаточную площадь, относительную степень (f′) и скорость абсорбции (f″). При расчете фармакокинетических параметров использовали фактические значения времени отбора образцов крови. Все отклонения по времени отбора образцов крови от запланированного времени учитывались при расчете индивидуальных значений фармакокинетических параметров.
Критерии оценки биоэквивалентности: сравнение исследуемых фармакокинетических параметров Cmax и AUC0-t проводилось с помощью дисперсионного анализа (ANOVA). Препараты признавались биоэквивалентными, если 90% доверительные интервалы (ДИ) f′ и f″ розувастатина находились в следующих диапазонах:
80,00≤ f′ (%) ≤125,00%,
80,00≤ f″ (%) ≤125,00%.
Оценка безопасности: проводилась на основании оценки жизненно важных показателей, данных физикального осмотра, электрокардиографии (ЭКГ) в 12 отведениях, лабораторных показателей (клинический анализ крови, биохимический анализ крови, общий анализ мочи) и анализа общего количества, характера и частоты регистрации нежелательных явлений (НЯ) на основании жалоб и изменения самочувствия добровольцев. Все отклонения от нормы лабораторных показателей, а также данных физикального обследования, данных измерений основных показателей жизнедеятельности и показателей ЭКГ, в т.ч. и клинически незначимые, также регистрировались как НЯ. Все НЯ были представлены в виде списка и кодированы в соответствии с терминологией словаря MedDRA (в последней версии) и представлены системно-органным классом и предпочтительным термином.
Статистический анализ фармакокинетических данных был осуществлен с помощью программного обеспечения WinNonlin 8.4 (Pharsight® Corporation, Certara Inc., США). Достоверность различий фармакокинетических параметров (Cmax, AUC0-t, AUC0-∞) оценивали с помощью ANOVA, параметрический метод. Были рассчитаны точечные оценки и ДИ для точечных оценок (отношений средних геометрических) Cmax, AUC0-t и AUC0-∞. Для статистического анализа Тmax использовали непараметрический критерий Вилкоксона-Манна-Уитни.
Количественные и качественные данные безопасности были представлены с группировкой по визиту и группе лечения и проанализированы методами описательной статистики. Различия считали значимыми при p≤0,05.
Результаты
Исходная характеристика субъектов исследования
44 из 46 рандомизированных добровольцев (21 в группе RT и 23 в группе TR) приняли хотя бы одну дозу препарата и составили популяцию безопасности (2 добровольца отказались от участия в исследовании и отозвали информированное согласие до приема ИП). 2 добровольца выбыли из исследования в соответствии с критериями исключения, таким образом, 42 участника (23 в группе TR и 19 в группе RT) завершили исследование без значительных отклонений от протокола и составили популяцию для оценки фармакокинетических параметров, статистического анализа и оценки биоэквивалентности. Схема распределения добровольцев по группам представлена на рисунке 1.
Все добровольцы относились к европеоидной расе. Возраст, рост, вес и индекс массы тела добровольцев статистически значимо не различались между группами (табл. 1, 2). В популяции безопасности средний возраст добровольцев в группе RT составил 28,67 лет, в группе TR — 30,61 лет. Группу RT составляли 15 добровольцев мужского пола и 6 добровольцев женского пола (71,43% и 28,57%, соответственно), в группе TR было 16 добровольцев мужского пола и 7 добровольцев женского пола (69,57% и 30,43%, соответственно). Результаты физикального осмотра, оценки жизненно-важных показателей, ЭКГ и лабораторных показателей добровольцев на скрининге представлены в таблице 3.
Оценка фармакокинетических параметров
На рисунке 2 представлены усредненные фармакокинетические профили розувастатина в образцах плазмы крови добровольцев после приема препаратов исследования (график в линейном и полулогарифмическом масштабе). Характер зависимости "концентрация-время" для сравниваемых препаратов не имел существенных различий.
Фармакокинетические параметры розувастатина в образцах плазмы добровольцев после приема препаратов T и R приведены в таблице 4. Медиана Тmax для препаратов T и R составила 3,33 ч и 4,33 ч, соответственно, однако различия не являлись статистически значимыми (Z=-1,929; p=0,054, критерий знаковых рангов Уилкоксона). Значения Cmax, AUC0-t, AUC0-∞, t1/2 были сопоставимы для препаратов T и R.
Параметры, характеризующие относительную биодоступность и относительную скорость всасывания розувастатина, представлены в таблице 5.
После проведения логарифмического преобразования фармакокинетические параметры Сmax, AUC0-t, AUC0-∞ анализировались с помощью ANOVA. Дисперсионный анализ применялся для проверки гипотез о статистической значимости вклада различных факторов в наблюдаемую вариабельность. Следующие фиксированные факторы были включены в модель дисперсионного анализа для статистической оценки: лекарственный препарат; период; последовательность приёма; субъект в последовательности. Так как исследование было проведено в 2 когортах субъектов, каждая из которых начинала участие в исследовании в разные дни, в целях отражения многогруппового характера исследования также был проведен анализ влияния группы (когорты), и статистическая модель была модифицирована следующим образом: группа; последовательность приема; лекарственный препарат; период (группа); группа×последовательность; субъект (последовательность×группа).
По результатам дисперсионного анализа логарифмически преобразованных основных фармакокинетических параметров розувастатина с учетом групп (когорт), не было обнаружено влияния дополнительных факторов на вариабельность данных.
Оценка биоэквивалентности
В качестве основного критерия биоэквивалентности использовали 90% ДИ для отношения геометрических средних, полученных в ходе дисперсионного анализа основных фармакокинетических параметров (Cmax и AUC0-t) для препаратов T и R. Такой подход равносилен двум односторонним проверкам нулевой гипотезы об отсутствии биоэквивалентности (о небиоэквивалентности) при 5% уровне значимости для каждого теста. Препараты признавали биоэквивалентными, если 90% ДИ для отношений средних геометрических значений Cmax и AUC0-t исследуемого препарата (T) и референтного препарата (R) находились в пределах 80,00-125,00%.
Таким образом, на основании данных, представленных в таблице 6, был сделан вывод о биоэквивалентности сравниваемых препаратов, т.к. полученные 90% ДИ для Cmax и AUC0-t находятся в границах приемлемости 80,00-125,00%:
- 90% ДИ для отношений значений Сmaxрозувастатина составили 91,58-115,83%;
- 90% ДИ для отношений значений AUC0-tрозувастатина составили 91,71-107,41%.
Оценка безопасности
В анализ данных безопасности применения ИП были включены данные по всем добровольцам, которые получили хотя бы один из ИП (n=44). Всего в исследовании было зарегистрировано 2 НЯ у 1 участника после приёма референтного препарата Крестор®, таблетки, покрытые пленочной оболочкой, 20 мг (АстраЗенека ЮК Лимитед, Великобритания). Частота НЯ в группе ИП Розувастатин, таблетки, покрытые пленочной оболочкой, 20 мг (ООО "НТФФ "ПОЛИСАН") и в группе референтного препарата Крестор®, таблетки, покрытые пленочной оболочкой, 20 мг (АстраЗенека ЮК Лимитед, Великобритания) значимо не различалась. Все НЯ были оценены как легкой степени тяжести. Были зарегистрированы следующие группы НЯ: нарушения со стороны дыхательной системы, органов грудной клетки и средостения (боль в ротоглотке (орофарингеальная)) — 1 НЯ, и общие нарушения и реакции в месте введения (гипертермия) — 1 НЯ. Связь с назначенными препаратами исследования для обоих НЯ была классифицирована как сомнительная, оба НЯ являлись непредвиденными. Ни одно из НЯ не потребовало изменения дозы препарата, все НЯ разрешились полным выздоровлением без последствий. Серьезных НЯ зарегистрировано не было.
Ни в одной из групп в ходе исследования не было зарегистрировано клинически значимых отклонений показателей общего клинического анализа крови, биохимического анализа крови и общего анализа мочи и от нормы. Жизненно-важные показатели и индивидуальные показатели физикального осмотра у всех добровольцев оставались в пределах физиологической нормы в течение всего исследования. Отклонений показателей ЭКГ от нормы в ходе исследования ни у одного из добровольцев выявлено не было.
ИП обладали сопоставимым профилем безопасности, частота развития НЯ в группах T и R достоверно не отличалась.
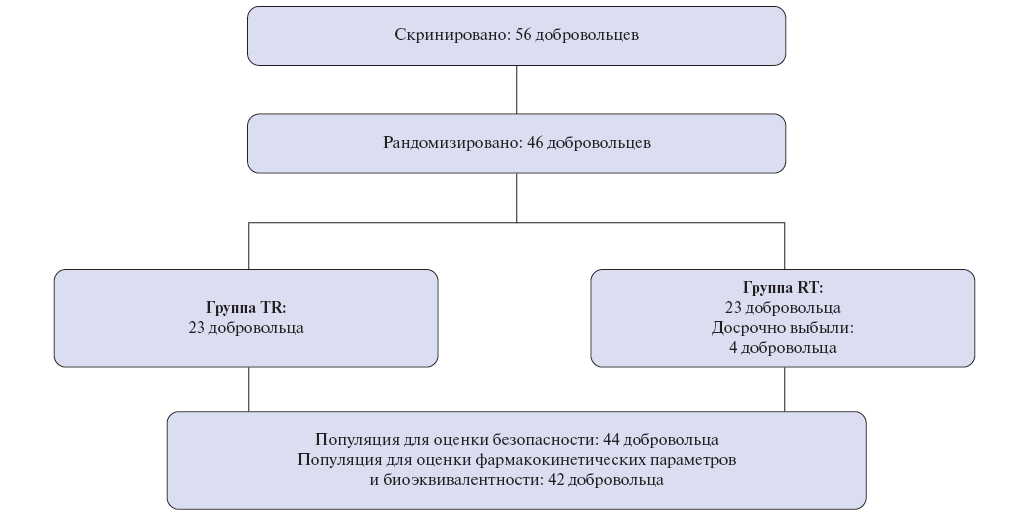
Рис. 1. Схема распределения добровольцев в исследовании.
Таблица 1
Демографические (пол и раса) данные добровольцев
|
Показатель |
Значение |
RT |
TR |
p |
||
|
n/N |
% |
n/N |
% |
|||
|
Пол |
Жен. |
6/21 |
28,57% [ 11,28-52,18%] |
7/23 |
30,43% [ 13,21-52,92%] |
1 |
|
Муж. |
15/21 |
71,43% [ 47,82-88,72%] |
16/23 |
69,57% [ 47,08-86,79%] |
||
|
Раса |
Европ. |
21/21 |
100% [ 83,89-100%] |
23/23 |
100% [ 85,18-100%] |
– |
Таблица 2
Возраст и антропометрические данные добровольцев на скрининге
|
Показатель |
Группа |
N |
Med |
Mean |
95% ДИ |
SD |
min |
max |
Q1 |
Q3 |
IQR |
p |
|
Возраст, лет |
RT |
21 |
30 |
28,67 |
[ 25,48-31,85] |
7,00 |
18 |
45 |
23 |
33,0 |
10,0 |
0,321 |
|
TR |
23 |
30 |
30,61 |
[ 28,15-33,07] |
5,69 |
23 |
42 |
26 |
35,5 |
9,5 |
||
|
Вес, кг |
RT |
21 |
71,1 |
73,41 |
[ 67,2-79,62] |
13,65 |
51,2 |
99,3 |
65,70 |
76,50 |
10,80 |
0,97 |
|
TR |
23 |
76,5 |
73,24 |
[ 66,26-80,22] |
16,15 |
50,3 |
99,6 |
58,25 |
86,85 |
28,60 |
||
|
ИМТ, кг/м2 |
RT |
21 |
24,0 |
23,77 |
[ 22,27-25,28] |
3,31 |
19,3 |
29,8 |
20,60 |
25,60 |
5,00 |
0,839 |
|
TR |
23 |
24,3 |
23,98 |
[ 22,44-25,52] |
3,56 |
18,7 |
29,7 |
20,95 |
26,70 |
5,75 |
||
|
Рост, см |
RT |
21 |
178,0 |
175,43 |
[ 170,58-180,27] |
10,64 |
159,0 |
197,0 |
169,00 |
180,00 |
11,00 |
0,639 |
|
TR |
23 |
175,0 |
173,91 |
[ 169,32-178,51] |
10,63 |
153,0 |
196,0 |
166,00 |
181,00 |
15,00 |
Сокращения: ДИ — доверительный интервал, ИМТ — индекс массы тела.
Таблица 3
Данные физикального осмотра, оценки жизненно-важных показателей, ЭКГ и лабораторные данные добровольцев на скрининге
|
Показатель |
Группа |
N |
Med |
Mean |
95% ДИ |
SD |
min |
max |
Q1 |
Q3 |
IQR |
p |
|
Оценка жизненно-важных показателей |
||||||||||||
|
ДАД, мм рт.ст. |
RT |
21 |
74,0 |
73,29 |
[ 71,91-74,66] |
3,02 |
67,0 |
77,0 |
70,00 |
75,00 |
5,00 |
0,951 |
|
TR |
23 |
73,0 |
73,35 |
[ 71,76-74,94] |
3,68 |
66,0 |
78,0 |
72,00 |
76,50 |
4,50 |
||
|
САД, мм рт.ст. |
RT |
21 |
115,0 |
114,29 |
[ 112,96-115,61] |
2,92 |
110,0 |
119,0 |
112,00 |
116,00 |
4,00 |
0,649 |
|
TR |
23 |
115,0 |
113,83 |
[ 112,22-115,43] |
3,71 |
105,0 |
119,0 |
111,50 |
116,50 |
5,00 |
||
|
Температура, С |
RT |
21 |
36,6 |
36,59 |
[ 36,55-36,62] |
0,09 |
36,4 |
36,7 |
36,50 |
36,60 |
0,10 |
0,91 |
|
TR |
23 |
36,6 |
36,59 |
[ 36,56-36,63] |
0,08 |
36,5 |
36,7 |
36,50 |
36,65 |
0,15 |
||
|
ЧДД, дв./мин |
RT |
21 |
16,0 |
16,38 |
[ 15,81-16,95] |
1,24 |
15,0 |
19,0 |
15,00 |
17,00 |
2,00 |
0,507 |
|
TR |
23 |
16,0 |
16,09 |
[ 15,74-16,43] |
0,79 |
15,0 |
17,0 |
15,50 |
17,00 |
1,50 |
||
|
ЧСС, уд./мин |
RT |
21 |
73,0 |
72,43 |
[ 70,36-74,5] |
4,55 |
66,0 |
83,0 |
70,00 |
75,00 |
5,00 |
0,9 |
|
TR |
23 |
72,0 |
72,26 |
[ 70,42-74,1] |
4,26 |
65,0 |
82,0 |
68,50 |
75,00 |
6,50 |
||
|
ЭКГ |
||||||||||||
|
HR |
RT |
21 |
72 |
70,86 |
[ 68,22-73,49] |
5,79 |
63 |
82 |
64,0 |
75,0 |
11,0 |
0,404 |
|
TR |
23 |
71 |
72,48 |
[ 69,47-75,48] |
6,95 |
60 |
84 |
67,5 |
79,0 |
11,5 |
||
|
PQ |
RT |
21 |
140 |
145,24 |
[ 136,65-153,83] |
18,87 |
120 |
180 |
140,0 |
150,0 |
10,0 |
0,254 |
|
TR |
23 |
150 |
152,17 |
[ 143,14-161,2] |
20,88 |
120 |
200 |
140,0 |
160,0 |
20,0 |
||
|
QRS |
RT |
21 |
90 |
91,43 |
[ 88,12-94,74] |
7,27 |
80 |
100 |
90,0 |
100,0 |
10,0 |
0,199 |
|
TR |
23 |
90 |
88,26 |
[ 84,43-92,1] |
8,87 |
80 |
100 |
80,0 |
100,0 |
20,0 |
||
|
QT |
RT |
21 |
370 |
372,86 |
[ 365,93-379,78] |
15,21 |
350 |
400 |
360,0 |
380,0 |
20,0 |
0,58 |
|
TR |
23 |
370 |
370,00 |
[ 364,32-375,68] |
13,14 |
350 |
400 |
360,0 |
380,0 |
20,0 |
||
|
RR |
RT |
21 |
830 |
851,43 |
[ 819,36-883,5] |
70,45 |
730 |
950 |
800,0 |
940,0 |
140,0 |
0,471 |
|
TR |
23 |
840 |
834,78 |
[ 799,58-869,98] |
81,40 |
710 |
1000 |
760,0 |
890,0 |
130,0 |
||
|
Клинический анализ крови |
||||||||||||
|
Нейтрофилы о/к (%) |
RT |
21 |
58,00 |
58,95 |
[ 56,47-61,44] |
5,46 |
51,00 |
70,00 |
54,00 |
62,00 |
8,00 |
0,717 |
|
TR |
23 |
57,00 |
58,35 |
[ 55,97-60,73] |
5,51 |
50,00 |
67,00 |
54,00 |
63,00 |
9,00 |
||
|
Нейтрофилы о/к (абс.) |
RT |
21 |
3,79 |
3,91 |
[ 3,5-4,32] |
0,91 |
2,71 |
5,46 |
3,11 |
4,78 |
1,67 |
0,758 |
|
TR |
23 |
3,57 |
3,82 |
[ 3,36-4,27] |
1,05 |
2,32 |
5,93 |
2,90 |
4,70 |
1,80 |
||
|
Моноциты (%) |
RT |
21 |
8,00 |
7,48 |
[ 6,89-8,06] |
1,29 |
5,00 |
9,00 |
6,00 |
9,00 |
3,00 |
0,681 |
|
TR |
23 |
7,00 |
7,30 |
[ 6,67-7,94] |
1,46 |
5,00 |
10,00 |
6,50 |
8,00 |
1,50 |
||
|
Моноциты (абс.) |
RT |
21 |
0,51 |
0,49 |
[ 0,44-0,54] |
0,12 |
0,28 |
0,69 |
0,43 |
0,59 |
0,16 |
0,874 |
|
TR |
23 |
0,45 |
0,49 |
[ 0,41-0,56] |
0,18 |
0,23 |
0,85 |
0,38 |
0,62 |
0,25 |
||
|
Лимфоциты (%) |
RT |
21 |
33,00 |
31,29 |
[ 28,95-33,63] |
5,14 |
21,00 |
37,00 |
26,00 |
36,00 |
10,00 |
0,878 |
|
TR |
23 |
33,00 |
31,83 |
[ 29,9-33,75] |
4,45 |
22,00 |
37,00 |
28,50 |
36,00 |
7,50 |
||
|
Лимфоциты (абс.) |
RT |
21 |
2,01 |
2,05 |
[ 1,84-2,26] |
0,46 |
1,47 |
2,97 |
1,68 |
2,35 |
0,67 |
0,683 |
|
TR |
23 |
1,75 |
2,13 |
[ 1,77-2,49] |
0,82 |
1,31 |
3,60 |
1,46 |
2,84 |
1,38 |
||
|
Гематокрит |
RT |
21 |
0,40 |
0,41 |
[ 0,39-0,42] |
0,03 |
0,36 |
0,48 |
0,39 |
0,43 |
0,04 |
0,765 |
|
TR |
23 |
0,41 |
0,41 |
[ 0,4-0,42] |
0,03 |
0,35 |
0,48 |
0,40 |
0,43 |
0,03 |
||
|
Гемоглобин, г/л |
RT |
21 |
138,00 |
137,95 |
[ 132,99-142,92] |
10,91 |
118,00 |
162,00 |
129,00 |
147,00 |
18,00 |
0,959 |
|
TR |
23 |
137,00 |
137,78 |
[ 133,01-142,56] |
11,04 |
118,00 |
165,00 |
133,00 |
145,00 |
12,00 |
||
|
Лейкоциты, 10*9/л |
RT |
21 |
6,70 |
6,61 |
[ 6,03-7,19] |
1,28 |
4,75 |
8,95 |
5,53 |
7,38 |
1,85 |
0,98 |
|
TR |
23 |
5,96 |
6,60 |
[ 5,74-7,46] |
1,99 |
4,50 |
10,59 |
4,83 |
7,99 |
3,16 |
||
|
СОЭ, мм/ч |
RT |
21 |
2,00 |
4,71 |
[ 2,81-6,62] |
4,19 |
2,00 |
17,00 |
2,00 |
7,00 |
5,00 |
0,782 |
|
TR |
23 |
2,00 |
4,48 |
[ 2,58-6,38] |
4,40 |
2,00 |
19,00 |
2,00 |
6,00 |
4,00 |
||
|
Тромбоциты, 10*9/л |
RT |
21 |
301,00 |
298,52 |
[ 271,18-325,87] |
60,07 |
206,00 |
395,00 |
247,00 |
347,00 |
100,00 |
0,336 |
|
TR |
23 |
261,00 |
280,65 |
[ 254-307,31] |
61,64 |
174,00 |
391,00 |
246,50 |
331,50 |
85,00 |
||
|
Эритроциты, 10*12/л |
RT |
21 |
4,73 |
4,65 |
[ 4,48-4,82] |
0,37 |
3,84 |
5,49 |
4,48 |
4,82 |
0,34 |
0,84 |
|
TR |
23 |
4,72 |
4,68 |
[ 4,5-4,86] |
0,41 |
3,82 |
5,65 |
4,42 |
4,93 |
0,51 |
||
|
Биохимический анализ крови |
||||||||||||
|
АЛТ, ед./л |
RT |
21 |
14,00 |
16,76 |
[ 13,6-19,93] |
6,95 |
9,00 |
40,00 |
13,00 |
17,00 |
4,00 |
0,725 |
|
TR |
23 |
15,00 |
17,57 |
[ 14,06-21,07] |
8,10 |
7,00 |
38,00 |
11,50 |
21,00 |
9,50 |
||
|
АСТ, ед./л |
RT |
21 |
19,00 |
19,05 |
[ 16,6-21,5] |
5,38 |
12,00 |
36,00 |
16,00 |
20,00 |
4,00 |
0,689 |
|
TR |
23 |
19,00 |
20,04 |
[ 17,33-22,76] |
6,28 |
13,00 |
36,00 |
15,00 |
23,00 |
8,00 |
||
|
Гамма-ГТ, Ед/л |
RT |
21 |
16,00 |
19,29 |
[ 15,01-23,56] |
9,40 |
9,00 |
40,00 |
13,00 |
25,00 |
12,00 |
0,536 |
|
TR |
23 |
15,00 |
17,57 |
[ 13,75-21,38] |
8,82 |
7,00 |
39,00 |
10,00 |
23,50 |
13,50 |
||
|
Глюкоза, ммоль/л |
RT |
21 |
4,90 |
4,84 |
[ 4,66-5,02] |
0,39 |
4,10 |
5,90 |
4,70 |
5,00 |
0,30 |
0,831 |
|
TR |
23 |
4,90 |
4,87 |
[ 4,67-5,06] |
0,45 |
4,20 |
5,80 |
4,60 |
5,05 |
0,45 |
||
|
Креатинин, мкмоль/л |
RT |
21 |
73,00 |
74,38 |
[ 70,22-78,54] |
9,13 |
64,00 |
99,00 |
70,00 |
75,00 |
5,00 |
0,525 |
|
TR |
23 |
73,00 |
76,22 |
[ 71,95-80,48] |
9,86 |
63,00 |
96,00 |
68,00 |
82,50 |
14,50 |
||
|
Мочевина, ммоль/л |
RT |
21 |
4,40 |
4,65 |
[ 4,24-5,07] |
0,91 |
3,30 |
6,70 |
4,00 |
5,20 |
1,20 |
0,477 |
|
TR |
23 |
4,30 |
4,43 |
[ 3,96-4,91] |
1,10 |
2,90 |
6,80 |
3,55 |
5,15 |
1,60 |
||
|
Общий белок, г/л |
RT |
21 |
74,00 |
73,62 |
[ 71,78-75,45] |
4,03 |
67,00 |
83,00 |
72,00 |
75,00 |
3,00 |
0,937 |
|
TR |
23 |
72,00 |
73,52 |
[ 71,74-75,3] |
4,11 |
67,00 |
81,00 |
70,50 |
77,00 |
6,50 |
||
|
Общий билирубин, мкмоль/л |
RT |
21 |
7,50 |
8,65 |
[ 6,86-10,44] |
3,93 |
3,70 |
16,80 |
6,30 |
10,20 |
3,90 |
0,672 |
|
TR |
23 |
8,70 |
9,13 |
[ 7,66-10,59] |
3,38 |
3,40 |
17,10 |
6,65 |
11,40 |
4,75 |
||
|
СКФ |
RT |
21 |
112,00 |
113,52 |
[ 108,83-118,21] |
10,30 |
94,00 |
132,00 |
106,00 |
120,00 |
14,00 |
0,441 |
|
TR |
20 |
114,50 |
110,90 |
[ 105,65-116,15] |
11,22 |
90,00 |
126,00 |
100,75 |
117,25 |
16,50 |
||
|
Триглицериды |
RT |
21 |
0,83 |
0,89 |
[ 0,72-1,05] |
0,36 |
0,40 |
1,59 |
0,54 |
1,13 |
0,59 |
0,348 |
|
TR |
23 |
0,99 |
0,99 |
[ 0,84-1,14] |
0,35 |
0,31 |
1,53 |
0,70 |
1,27 |
0,57 |
||
|
Холестерин, ммоль/л |
RT |
21 |
3,99 |
3,94 |
[ 3,66-4,23] |
0,63 |
2,97 |
4,93 |
3,37 |
4,44 |
1,07 |
0,056 |
|
TR |
23 |
4,57 |
4,28 |
[ 4,07-4,49] |
0,50 |
3,32 |
4,87 |
3,84 |
4,66 |
0,82 |
||
|
Щелочная фосфатаза, ед./л |
RT |
21 |
71,00 |
73,33 |
[ 64,65-82,02] |
19,07 |
45,00 |
120,00 |
62,00 |
82,00 |
20,00 |
0,169 |
|
TR |
23 |
64,00 |
66,00 |
[ 59,42-72,58] |
15,22 |
43,00 |
97,00 |
53,00 |
78,00 |
25,00 |
||
|
Клинический анализ мочи |
||||||||||||
|
Количественные данные |
||||||||||||
|
pH |
RT |
21 |
6,00 |
6,14 |
[ 5,98-6,31] |
0,36 |
5,50 |
7,00 |
6,00 |
6,00 |
0,00 |
0,685 |
|
TR |
23 |
6,00 |
6,20 |
[ 6,03-6,36] |
0,39 |
6,00 |
7,50 |
6,00 |
6,25 |
0,25 |
||
|
Лейкоциты, кл. |
RT |
21 |
0,00 |
0,00 |
– |
0,00 |
0,00 |
0,00 |
0,00 |
0,00 |
0,00 |
– |
|
TR |
23 |
0,00 |
0,00 |
– |
0,00 |
0,00 |
0,00 |
0,00 |
0,00 |
0,00 |
||
|
Относительная плотность |
RT |
21 |
1,02 |
1,02 |
[ 1,02-1,02] |
0,01 |
1,00 |
1,03 |
1,01 |
1,02 |
0,01 |
0,591 |
|
TR |
23 |
1,02 |
1,02 |
[ 1,01-1,02] |
0,01 |
1,00 |
1,03 |
1,01 |
1,02 |
0,01 |
||
|
Уробилиноген, мкмоль/л |
RT |
21 |
0,00 |
0,00 |
– |
0,00 |
0,00 |
0,00 |
0,00 |
0,00 |
0,00 |
– |
|
TR |
23 |
0,00 |
0,00 |
– |
0,00 |
0,00 |
0,00 |
0,00 |
0,00 |
0,00 |
||
|
Категориальные данные |
||||||||||||
|
Показатель |
RT |
TR |
р |
|||||||||
|
Значение |
n/N |
% |
n/N |
% |
||||||||
|
pH |
Норма |
21/21 |
100% [ 83,89%-100%] |
23/23 |
100% [ 85,18%-100%] |
– |
||||||
|
Белок |
Норма |
21/21 |
100% [ 83,89%-100%] |
23/23 |
100% [ 85,18%-100%] |
– |
||||||
|
Билирубин |
Норма |
21/21 |
100% [ 83,89%-100%] |
23/23 |
100% [ 85,18%-100%] |
– |
||||||
|
Глюкоза |
Норма |
21/21 |
100% [ 83,89%-100%] |
23/23 |
100% [ 85,18%-100%] |
– |
||||||
|
Кетоны |
Норма |
21/21 |
100% [ 83,89%-100%] |
23/23 |
100% [ 85,18%-100%] |
– |
||||||
|
Лейкоциты, кл. |
Норма |
21/21 |
100% [ 83,89%-100%] |
23/23 |
100% [ 85,18%-100%] |
– |
||||||
|
Нитриты |
Норма |
21/21 |
100% [ 83,89%-100%] |
23/23 |
100% [ 85,18%-100%] |
– |
||||||
|
Относительная плотность |
Норма |
21/21 |
100% [ 83,89%-100%] |
23/23 |
100% [ 85,18%-100%] |
– |
||||||
|
Уробилиноген, мкмоль/л |
Норма |
21/21 |
100% [ 83,89%-100%] |
23/23 |
100% [ 85,18%-100%] |
– |
||||||
|
Эритроциты, кл. |
Норма |
21/21 |
100% [ 83,89%-100%] |
23/23 |
100% [ 85,18%-100%] |
– |
||||||
|
Данные физикального осмотра |
||||||||||||
|
ЖКТ |
Норма |
21/21 |
100% [ 83,89%-100%] |
23/23 |
100% [ 85,18%-100%] |
– |
||||||
|
Дыхательная система |
Норма |
21/21 |
100% [ 83,89%-100%] |
23/23 |
100% [ 85,18%-100%] |
– |
||||||
|
Кожные покровы и видимые слизистые оболочки |
Норма |
21/21 |
100% [ 83,89%-100%] |
23/23 |
100% [ 85,18%-100%] |
– |
||||||
|
Костно-мышечная система |
Норма |
21/21 |
100% [ 83,89%-100%] |
23/23 |
100% [ 85,18%-100%] |
– |
||||||
|
ЛОР |
Норма |
21/21 |
100% [ 83,89%-100%] |
23/23 |
100% [ 85,18%-100%] |
– |
||||||
|
Мочевыделительная система |
Норма |
21/21 |
100% [ 83,89%-100%] |
23/23 |
100% [ 85,18%-100%] |
– |
||||||
|
Сердечно-сосудистая система |
Норма |
21/21 |
100% [ 83,89%-100%] |
23/23 |
100% [ 85,18%-100%] |
– |
||||||
|
ЦНС |
Норма |
21/21 |
100% [ 83,89%-100%] |
23/23 |
100% [ 85,18%-100%] |
– |
||||||
|
Эндокринная система |
Норма |
21/21 |
100% [ 83,89%-100%] |
23/23 |
100% [ 85,18%-100%] |
– |
||||||
Сокращения: АЛТ — аланинаминотрансфераза, АСТ — аспартатаминотрансфераза, ДАД — диастолическое артериальное давление, ДИ — доверительный интервал, ЖКТ — желудочно-кишечный тракт, ЛОР — ухо, нос и горло, включая гортань, САД — систолическое артериальное давление, СКФ — скорость клубочковой фильтрации, СОЭ — скорость оседания эритроцитов, ЧДД — частота дыхательных движений, ЧСС — частота сердечных сокращений, ЦНС — центральная нервная система, ЭКГ — электрокардиография.
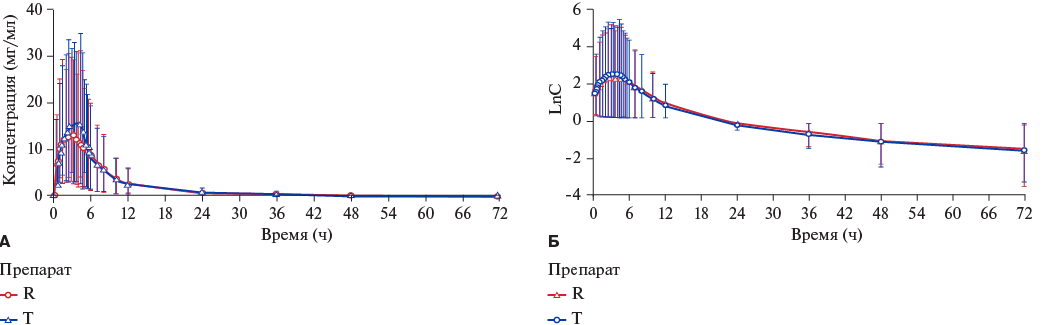
Рис. 2. Усреднённые фармакокинетические профили концентрации розувастатина в плазме крови добровольцев после однократного приёма препаратов T и R.
Примечание: А — в линейных координатах; Б — в полулогарифмических координатах; величина ошибки соответствует 90% ДИ. Цветное изображение доступно в электронной версии журнала.
Таблица 4
Фармакокинетические параметры розувастатина в образцах плазмы крови добровольцев, принимавших препараты T и R
|
Фармакокинетический параметр (арифметическое среднее±СО (СV%)) |
T (n=23) |
R (n=19) |
|
Cmax (нг/мл) |
17,658±11,167 (63,2) |
17,586±15,433 (87,8) |
|
Tmax (ч)* |
3,33 (1-4,67) |
4,33 (1-6) |
|
AUC0-t (ч·нг/мл) |
140,172±75,821 (54,1) |
139,276±75,062 (53,9) |
|
AUC0-∞ (ч·нг/мл) |
145,283±75,872 (52,2) |
144,633±75,727 (52,4) |
|
t1/2, ч |
15,003±6,873 (45,8) |
14,434±7,173 (49,7) |
|
Kel (ч-1) |
0,055±0,022 (39,6) |
0,057±0,021 (36,9) |
|
AUCextrap% (%) |
4,368±3,079 (70,5) |
4,208±4,189 (99,6) |
Примечание: * — данные представлены как медиана (минимальное-максимальное значение).
Сокращения: СО — стандартное отклонение, AUC0-t — суммарная площадь под кривой "концентрация действующего вещества — время" в интервале времени от 0 до 72 ч, AUCextrap% — остаточная площадь под кривой "концентрация действующего вещества — время", Cmax — максимальная концентрация действующего вещества в плазме крови, СV — коэффициент вариации, Kel — константа скорости элиминации, Tmax — время достижения максимальной концентрации, t1/2 — период полувыведения, T — исследуемый препарат Розувастатин, таблетки, покрытые пленочной оболочкой, 20 мг (ООО "НТФФ "ПОЛИСАН", Россия), R — референтный препарат Крестор®, таблетки, покрытые пленочной оболочкой, 20 мг (АстраЗенека ЮК Лимитед, Великобритания).
Таблица 5
Относительная биодоступность розувастатина после однократного приема препаратов Т и R
|
Показатель |
f |
f' |
f'' |
|
Mean |
103,943 |
103,996 |
113,637 |
|
SD |
30,103 |
30,6 |
46,965 |
|
CV% |
29 |
29,4 |
41,3 |
Сокращения: СV — коэффициент вариации, f=AUC0→∞®¥ (T)/AUC0→∞®(R) — относительная степень абсорбции, f' — относительная степень абсорбции (отношения средних геометрических значений AUC0-t препаратов T и R), f'' — относительная скорость абсорбции (отношения средних геометрических значений Cmax препаратов T и R), Mean — среднее арифметическое, SD — стандартное отклонение.
Таблица 6
Результаты оценки биоэквивалентности розувастатина для препаратов T и R
|
Параметр |
GM |
Отношение GМ (T/R), % |
90% ДИ для отношения GM, % |
CVintra, % |
Мощность теста, % |
||
|
[T] |
[R] |
Нижняя граница |
Верхняя граница |
||||
|
AUC0-t, ч·нг/мл |
121,64 |
122,55 |
99,25 |
91,71 |
107,41 |
21,70% |
99,81 |
|
AUC0-∞, ч·нг/мл |
127,24 |
128,09 |
99,34 |
91,96 |
107,31 |
21,21% |
99,86 |
|
Cmax, нг/мл |
14,71 |
14,28 |
102,99 |
91,58 |
115,83 |
32,60% |
93,12 |
Примечание: ДИ представлены после обратного преобразования, т.е. отражают отношение средних в исходных (не преобразованных) единицах измерения.
Сокращения: ДИ — доверительный интервал, AUC0-t — суммарная площадь под кривой "концентрация действующего вещества — время" в интервале времени от 0 до 72 ч, Cmax — максимальная концентрация действующего вещества в плазме крови, CVintra — внутрииндивидуальный коэффициент вариации, GМ — геометрические средние, R — референтный препарат Крестор®, таблетки, покрытые пленочной оболочкой, 20 мг (АстраЗенека ЮК Лимитед, Великобритания), T — исследуемый препарат Розувастатин, таблетки, покрытые пленочной оболочкой, 20 мг (ООО "НТФФ "ПОЛИСАН", Россия).
Обсуждение
Данное исследование биоэквивалентности препаратов розувастатина было проведено с использованием стандартного двухэтапного перекрестного дизайна, согласно рекомендациям FDA2 и материалам диссертационной работы Ромодановского Д. П. (2020)3. Статины, в частности розувастатин, относятся к высоковариабельным препаратам, для подтверждения биоэквивалентности которых обычно требуется большое количество субъектов исследования. В противном случае результаты исследования таких препаратов часто демонстрируют неэквивалентность референтному препарату из-за недостаточной выборки в исследовании [17]. По литературным данным, коэффициент внутрииндивидуальной вариабельности розувастатина для Сmax составляет ~30% [18]. Полученное в данном исследовании значение коэффициента внутрииндивидуальной вариабельности для Сmax, равное 32,60%, согласуется с опубликованными данными. Объем выборки рандомизированных добровольцев, завершивших исследование по протоколу (n=42), оказался достаточным для подтверждения биоэквивалентности ИП розувастатина при достаточной мощности исследования (93,12% для Сmax и 99,81% для AUC0-t).
Заключение
Препараты T и R были признаны биоэквивалентными, т.к. полученные 90% ДИ для отношений средних геометрических значений находились в границах приемлемости 80,00-125,00% и составили 91,58-115,83% для Сmax и 91,71-107,41% для AUC0-t. Частота развития НЯ в группах ИП статистически значимо не отличалась. Препараты T и R обладали сопоставимым профилем безопасности.
Благодарности. Выражаем благодарность сотрудникам ООО "Экс Севен Клиникал Ресеч": врачу-неврологу Никоновой О. В., врачу-терапевту Жернакову К. А., врачу-терапевту, пульмонологу, Симоновой Е. С., врачу-кардиологу Липченко Е. Ю.
Отношения и деятельность. Проведение исследования и написание статьи выполнено при финансовой поддержке фармацевтической компании ООО "НТФФ "ПОЛИСАН" (Россия).
1 Государственный реестр лекарственных средств. https://grls.rosminzdrav.ru/GRLS.aspx? RegNumber=&MnnR=%d0%a0%d0%be%d0%b7%d1%83%d0%b2%d0%b0%d1%81%d1%82%d0%b0%d1%82%d0%b8%d0%bd&lf=&TradeNmR=&OwnerName=&MnfOrg=&MnfOrgCountry=&isfs=0®type=1%2c6&pageSize=10&order=Registered&orderType=desc&pageNum=1&token=85a282c0-dd25-4d72-8b98-f4d54a933069.
2 FDA Draft Guidance on Rosuvastatin Calcium, Finalized May 2008. https://www.accessdata.fda.gov/drugsatfda_docs/psg/Rosuvastatin_Calcium_tab_21366_RC3-05.pdf.
3 Ромодановский Д. П. Докторская диссертация на тему: Разработка требований для оценки фармакокинетики синтетических препаратов в рамках концепции терапевтической эквивалентности особых категорий лекарственных препаратов, 2020, 450 с. https://www.volgmed.ru/dissertatsionnye-sovety-volgmu/21-2-005-02/arkhiv/romodanovskii/.
Список литературы
1. Chong B, Jayabaskaran J, Jauhari SM, et al. Global burden of cardiovascular diseases: projections from 2025 to 2050. European Journal of Preventive Cardiology. 2024:zwae281. doi:10.1093/eurjpc/zwae281. Epub ahead of print.
2. Munir A, Kousar I, Iqbal N, et al. The Effect of Hyperlipidemia on Cardiovascular Diseases: A Risk Factor in Cardiovascular Diseases at FMH Hospital Lahore. Journal of Health and Rehabilitation Research. 2024;4(2):1057-61. doi:10.61919/jhrr.v4i2.1014.
3. Ежов М.В., Кухарчук В.В., Сергиенко И.В. и др. Нарушения липидного обмена. Клинические рекомендации 2023. Российский кардиологический журнал. 2023;28(5):5471. doi:10.15829/1560-4071-2023-5471. EDN: YVZOWJ.
4. Emberson J, Whincup P, Morris R, et al. Evaluating the impact of population and high-risk strategies for the primary prevention of cardiovascular disease. European heart journal. 2004;25(6):484-91. doi:10.1016/j.ehj.2003.11.012.
5. Chapman MJ, Ginsberg HN, Amarenc, P, et al. for the European Atherosclerosis Society Consensus Panel. Triglyceride-rich lipoproteins and high-density lipoprotein cholesterol in patients at high risk of cardiovascular disease: evidence and guidance for management. European heart journal. 2011;32(11):1345-61. doi:10.1093/eurheartj/ehr112.
6. Trialists C, Baigent C, Blackwell L, et al. Efficacy and safety of more intensive lowering of LDL cholesterol: a meta-analysis of data from 170,000 participants in 26 randomised trials. Lancet. 2010;376(9753):1670-81. doi:10.1016/S0140-6736(10)61350-5.
7. Catapano AL, Graham I, De Backer G, et al. ESC/EAS Guidelines for the Management of Dyslipidaemias. European Heart Journal. 2016;37(39):2999-3058. doi:10.1093/eurheartj/ehw272.
8. Wazir M, Olanrewaju OA, Yahya M, et al. Lipid Disorders and Cardiovascular Risk: A Comprehensive Analysis of Current Perspectives. Cureus. 2023;15(12): e51395. doi:10.7759/cureus.51395.
9. Shaheen S, Elserafy ASH, Amin M, et al. Brand versus Generic Rosuvastatin in Egyptian Patients with Hyperlipidemia; Cost-Minimization Analysis. Int J Clin Med. 2019;10:631-8. doi:10.4236/ijcm.2019.1012052.
10. Adams SP, Sekhon SS, Wright JM. Lipid-lowering efficacy of rosuvastatin. Cochrane Database of Systematic Reviews. 2014; Issue 11. Art. No.: CD010254. doi:10.1002/14651858.CD010254.pub2.
11. Betteridge DJ, Gibson JM, Sager PT. Comparison of effectiveness of rosuvastatin versus atorvastatin on the achievement of combined C-reactive protein (<2 mg/l) and low — density lipoprotein cholesterol (<70 mg/dl) targets in patients with type 2 diabetes mellitus (from the ANDROMEDA study). Am J Cardiol. 2007;100:1245-8. doi:10.1016/j.amjcard.2007.05.044.
12. Jones PH, Davidson MH, Stein EA, et al. Comparison of the efficacy and safety of rosuvastatin versus atorvastatin, simvastatin, and pravastatin across doses (STELLAR trial). Am J Cardiol. 2003;92:152-60. doi:10.1016/S0002-9149(03)00530-7.
13. Milionis H, Rizos E, Kostapanos M, et al. Treating to target patients with primary hyperlipidaemia: Comparison of the effects of ATOrvastatin and ROSuvastatin (the ATOROS study). Current medical research and opinion. 2006;22:1123-31. doi:10.1185/030079906x112462.
14. Herregods MC, Daubresse JC, Michel G, et al. Discovery Belux: comparison of rosuvastatin with atorvastatin in hypercholesterolaemia. Acta cardiologica. 2008;63(4):493-9. doi:10.2143/AC.63.4.2033049.
15. Ballantyne CM, Weiss R, Moccetti T, et al. Efficacy and safety of rosuvastatin 40 mg alone or in combination with ezetimibe in patients at high risk of cardiovascular disease (results from the EXPLORER study). The American journal of cardiology. 2007;99(5):673-80. doi:10.1016/j.amjcard.2006.10.022.
16. Конради А. О., Алиева А. С. Артериальная гипертензия и дислипидемия. Параллельный контроль двух факторов риска — роль комбинаций препаратов. Артериальная гипертензия. 2021;27(3):376-83. doi:10.18705/1607-419X2021-27-3-376-383.
17. Ромодановский Д. П., Драницына М.А., Горячев Д. В. и др. Планирование дизайна и оценка результатов исследований биоэквивалентности высоковариабельных препаратов на примере розувастатина. Экспериментальная и клиническая фармакология. 2015;78(6):19-25.
18. Ромодановский Д.П., Горячев Д.В., Хохлов А.Л. и др. Планирование и оценка исследований биоэквивалентности ингибиторов ГМГ-КоА-редуктазы. Медицинский вестник Северного Кавказа. 2020;15(2):247-51. doi:10.14300/mnnc.2020.15058.
Об авторах
Ю. В. КотовскаяРоссия
Котовская Юлия Викторовна — д.м.н., профессор, зам. директора по научной работе, ОСП Российский геронтологический научно-клинический центр.
Москва
Конфликт интересов:
Нет
И. П. Малая
Россия
Малая Ирина Павловна — к.м.н., зав. лабораторией изучения геропротекторов и клинических исследований ОСП Российский геронтологический научно-клинический центр.
Москва
Конфликт интересов:
Нет
А. В. Григорьев
Россия
Григорьев Александр Викторович — к.ф.-м.н., генеральный директор.
Санкт-Петербург
Конфликт интересов:
Нет
А. A. Сидорова
Россия
Сидорова Алла Анатольевна — к.х.н., зав. лабораторией.
Санкт-Петербург
Конфликт интересов:
Нет
В. А. Степанов
Россия
Степанов Вадим Алексеевич — врач-терапевт.
Санкт-Петербург
Конфликт интересов:
Нет
С. В. Понасенкова
Россия
Понасенкова Светлана Валерьевна — врач-нефролог, зав. отделением I фазы и биоэквивалентности.
Санкт-Петербург
Конфликт интересов:
Нет
Дополнительные файлы
Рецензия
Для цитирования:
Котовская Ю.В., Малая И.П., Григорьев А.В., Сидорова А.A., Степанов В.А., Понасенкова С.В. Исследование биоэквивалентности препарата Розувастатин у здоровых добровольцев при однократном приеме натощак. Российский кардиологический журнал. 2025;30(7):6416. https://doi.org/10.15829/1560-4071-2025-6416. EDN: YBRRVL
For citation:
Kotovskaya Yu.V., Malaya I.P., Grigoriev A.V., Sidorova A.A., Stepanov V.A., Ponasenkova S.V. Bioequivalence study of Rosuvastatin in healthy volunteers after a single dose on an empty stomach. Russian Journal of Cardiology. 2025;30(7):6416. (In Russ.) https://doi.org/10.15829/1560-4071-2025-6416. EDN: YBRRVL
JATS XML

















































