Перейти к:
Организация медицинской помощи при остром коронарном синдроме в рамках федерального проекта «Борьба с сердечно-сосудистыми заболеваниями»: результаты и перспективы
https://doi.org/10.15829/1560-4071-2025-6405
EDN: NIAIKY
Аннотация
Инфаркт миокарда (ИМ) продолжает сохранять статус одного из ключевых жизнеугрожающих сердечно-сосудистых заболеваний с высоким бременем заболеваемости и смертности, включая население трудоспособного возраста. В рамках федерального проекта "Борьба с сердечно-сосудистыми заболеваниями" в Российской Федерации в 2019-2024гг была проведена масштабная модернизация системы оказания медицинской помощи при остром коронарном синдроме и ИМ: расширена сеть региональных сосудистых центров, оптимизирована маршрутизация пациентов, что позволило увеличить охват чрескожным коронарным вмешательством при ИМ с подъемом сегмента ST с 56% до 77%, а при ИМбпST — с 21% до 48%, и достичь снижения смертности от ИМ на 100 тыс. населения на 19,6%, а больничной летальности от ИМ — на 32%. Однако сохраняются межрегиональные различия, в связи с чем необходима дальнейшая работа над повышением доступности и своевременности реперфузионной терапии. В рамках федерального проекта "Борьба с сердечнососудистыми заболеваниями" Национального проекта "Продолжительная и активная жизнь" будет происходить мониторинг целевого показателя охвата реперфузионной терапией больных ИМ, госпитализированных в первые сутки от начала заболевания, уровень которого должен достичь 95% к 2030г. Реализация дополнительных мероприятий позволит сократить дифференциацию показателей между регионами, снизить смертность от болезней системы кровообращения и достичь национальных целей по увеличению продолжительности жизни.
Ключевые слова
Для цитирования:
Камкин Е.Г., Каракулина Е.В., Гульшина В.А., Москалёв А.А., Анисимова Н.С., Мазыгула Е.П., Иващенко Р.М., Чекулаев А.С., Звартау Н.Э., Яковлев А.Н., Виллевальде С.В., Медведева Е.А., Недбаева Д.Н., Федоренко А.А., Даутов Д.Р., Шляхто Е.В. Организация медицинской помощи при остром коронарном синдроме в рамках федерального проекта «Борьба с сердечно-сосудистыми заболеваниями»: результаты и перспективы. Российский кардиологический журнал. 2025;30(9):6405. https://doi.org/10.15829/1560-4071-2025-6405. EDN: NIAIKY
For citation:
Kamkin E.G., Karakulina E.V., Gulshina V.A., Moskalev A.A., Anisimova N.S., Mazygula E.P., Ivaschenko R.M., Chekulaev A.S., Zvartau N.E., Yakovlev A.N., Villevalde S.V., Medvedeva E.A., Nedbaeva D.N., Fedorenko A.A., Dautov D.R., Shlyakhto E.V. Management of health care for acute coronary syndrome within the federal project "Control of Cardiovascular Diseases": results and prospects. Russian Journal of Cardiology. 2025;30(9):6405. (In Russ.) https://doi.org/10.15829/1560-4071-2025-6405. EDN: NIAIKY
Острый инфаркт миокарда (ИМ) остается одним из наиболее значимых жизнеугрожающих сердечно-сосудистых заболеваний с высоким бременем заболеваемости и смертности, в т.ч. среди лиц трудоспособного возраста. Для обозначения спектра острых состояний с высоким риском развития ИМ используется термин "острый коронарный синдром" (ОКС).
Организация медицинской помощи при ОКС отражает зрелость системы здравоохранения, т.к. требует высокого уровня развития инфраструктуры и координированного взаимодействия участников на всех этапах для оказания своевременной высококвалифицированной помощи с минимальными временными задержками с целью достижения наилучших результатов лечения, включая снижение сердечно-сосудистой смертности. В связи с этим в Российской Федерации (РФ), начиная с 2000-х годов, во всех национальных программах по развитию здравоохранения (приоритетный Национальный проект "Здоровье", Программа по снижению сердечно-сосудистой смертности, Указ Президента РФ от 07.05.2012 № 598 "О совершенствовании государственной политики в сфере здравоохранения", Постановление Правительства РФ от 15.04.2014 № 294 "Об утверждении государственной программы РФ "Развитие здравоохранения", Постановление Правительства РФ от 26.12.2017 № 1640 "Об утверждении государственной программы РФ "Развитие здравоохранения", Национальный проект "Здравоохранение") уделялось пристальное внимание развитию региональных систем организации медицинской помощи при ОКС, что внесло свой вклад в стойкое снижение смертности от болезней системы кровообращения (БСК) (рис. 1).
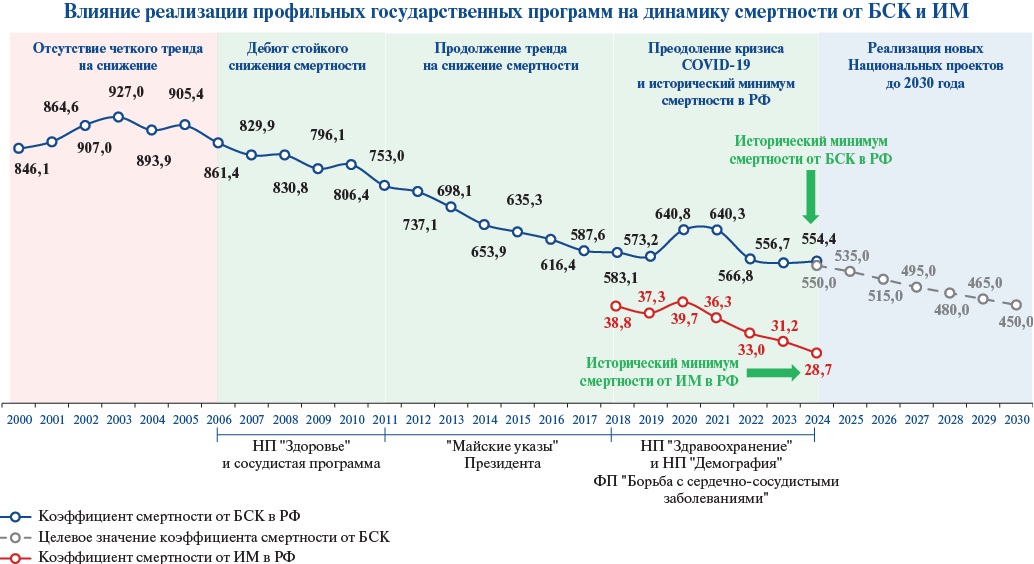
Рис. 1. Реализация государственных программ по развитию здравоохранения и динамика смертности от БСК и ИМ с 2000 по 2024гг. Годовые данные по смертности представлены в соответствии с данными Федеральной службы государственной статистики. Оперативные данные за 2024г соответствуют данным ЕГР ЗАГС за период с 01.01.2024 по 01.01.2025.
Примечание: цветное изображение доступно в электронной версии журнала.
Сокращения: БСК — болезни системы кровообращения, ИМ — инфаркт миокарда, НП — национальный проект, РФ — Российская Федерация, ЕГР ЗАГС — единый государственный реестр записей актов гражданского состояния, ФП — федеральный проект.
Одной из ключевых задач Федерального проекта "Борьба с сердечно-сосудистыми заболеваниями" (ФП "БССЗ") Национального проекта "Здравоохранение", реализуемого с 2019 по 2024гг, было повышение эффективности оказания медицинской помощи больным с сердечно-сосудистыми заболеваниями, совершенствование организации оказания помощи пациентам с ОКС на всех этапах — начиная от информирования населения о симптомах и догоспитального этапа и заканчивая стационарным и амбулаторным этапами. Особое внимание уделялось совершенствованию схем маршрутизации, увеличению доступности высокотехнологичной медицинской помощи. Отдельный блок мероприятий был направлен на дооснащение и переоснащение региональных сосудистых центров (РСЦ) и первичных сосудистых отделений (ПСО), что позволило расширить сеть РСЦ и ПСО, увеличить доступность высокоэффективных методов лечения и добиться уникальных результатов: с 2018 по 2023гг смертность от ИМ на 100 тыс. населения снизилась на 19,6%1, больничная летальность от ИМ снизилась на 32%. Если в 2018г из поступивших в стационар с ИМ умирал каждый шестой, то в 2023г — каждый десятый, а суммарно в период 2018-2023гг среди госпитализированных с ИМ удалось сохранить 16786 жизней2.
Несмотря на достигнутые результаты, система оказания медицинской помощи при ОКС требует дальнейшего совершенствования, в связи с чем актуален детальный анализ ситуации на уровне регионов и поиск резервов, которые должны максимально эффективно использоваться при реализации обновленного ФП "БССЗ" Национального проекта "Продолжительная и активная жизнь" в период 2025-2030гг для достижения установленных целей.
Путь пациента с ОКС и ИМ: ключевые этапы и технологии
Для эффективной организации медицинской помощи при ОКС требуется тесная координация догоспитального, стационарного и амбулаторного этапов, возможность выполнения высокотехнологичных вмешательств в ежедневном круглосуточном режиме с минимизацией задержек и соблюдением установленных временных интервалов.
В соответствии с имеющимися на данный момент научными данными, полученными в ряде рандомизированных клинических исследований и обобщёнными в масштабных метаанализах, а также данными реальной клинической практики (результатами анализа крупных регистров и административных баз данных) актуальные клинические рекомендации по лечению ОКС [1][2] включают ряд принципиальных позиций, имеющих наивысший класс доказательности. Обеспечение доступности наиболее значимых для улучшения результатов лечения вмешательств, представленных в клинических рекомендациях, с соблюдением необходимых временных интервалов и охват данными вмешательствами максимальной доли нуждающихся в них пациентов с ОКС является основой для совершенствования региональных систем помощи на всех этапах её оказания.
Своевременность обращения и начала оказания помощи
У пациентов с ИМ, особенно со стойким подъёмом сегмента ST (ИМпST) на электрокардиограмме (ЭКГ), как правило, имеется тотальная тромботическая окклюзия инфаркт-связанной коронарной артерии. Наилучшей в плане ближайшего и отдалённого прогноза стратегией лечения таких пациентов является восстановление кровотока по поражённой артерии (реперфузия) в максимально короткие сроки с момента установления диагноза. Такая стратегия наиболее актуальна в первые 12 ч с момента дебюта заболевания. Именно для этих временных рамок имеются наиболее убедительные доказательства возможности сохранения жизнеспособности части поражённого миокарда и улучшения выживаемости пациентов [3][4].
В связи с этим крайне важным является проведение информационных кампаний, в т.ч. с привлечением СМИ, по повышению осведомленности населения о симптомах ОКС, необходимости обращения за медицинской помощью в кратчайшие сроки, рисках отказа от обращения за медицинской помощью, порядке получения экстренной медицинской помощи по месту проживания. Отсутствие задержки на этапе обращения пациента является важным условием успеха для своевременного восстановления коронарного кровотока и предотвращения неблагоприятных исходов. Реализация информационной кампании в СМИ ассоциирована с достоверным увеличением обращаемости пациентов с ОКС за неотложной медицинской помощью, включая вызов скорой медицинской помощи (СМП) [5].
Выбор стратегии лечения
Первый контакт пациента с подозрением на ОКС с медицинским персоналом обозначается термином "первичный медицинский контакт", который может осуществляться бригадой СМП или врачами медицинской организации.
В течение 10 мин от начала первичного медицинского контакта с пациентом с подозрением на ОКС необходима регистрация ЭКГ как минимум в 12 стандартных отведениях для определения типа ОКС и дифференциальной диагностики с иными заболеваниями [6-13]. Если у медицинского персонала возникают сложности с интерпретацией ЭКГ на месте регистрации, рекомендуется расшифровка, описание и интерпретация данных ЭКГ-исследования с применением телемедицинских технологий.
В обновленных российских клинических рекомендациях "Острый инфаркт миокарда с подъемом сегмента ST электрокардиограммы" 2024г подчеркивается необходимость соблюдения профильности госпитализации пациентов с ОКС с акцентом на приоритетную госпитализацию в РСЦ: "Маршрутизация пациентов должна быть организована так, чтобы все они госпитализировались или как можно быстрее переводились в стационар с возможностью инвазивного лечения ОКС".
Предпочтительной стратегией реперфузионной терапии при ИМпST является проведение первичного чрескожного коронарного вмешательства (ПЧКВ) — коронарной ангиографии (КАГ) с последующей ангиопластикой и стентированием инфаркт-связанной коронарной артерии в течение первых 12 ч с момента дебюта заболевания, выполняемой в течение ближайших 120 мин с момента установления диагноза ИМпST [4][14-16]. При невозможности проведения ПЧКВ в указанные временные рамки современный подход к лечению пациентов с ИМпST предполагает возможность проведения (при отсутствии противопоказаний) системной тромболитической терапии (ТЛТ), также в период до 12 ч от начала симптомов. В более поздние временные сроки, а именно в период 12-24 ч от начала симптомов, при невозможности выполнения чрескожного коронарного вмешательства (ЧКВ), сохранении симптомов и признаков трансмуральной ишемии (подъемов сегмента ST на ЭКГ) использование ТЛТ возможно с меньшим классом рекомендаций и уровнем доказательности у отдельных пациентов, у которых под угрозой повреждения большая зона миокарда и/или имеется гемодинамическая нестабильность [17-19].
С целью сокращения интервала по времени до достижения восстановления коронарного кровотока ТЛТ при ИМпST строго рекомендуется проводить на догоспитальном этапе помощи [20-22], оптимально — начало внутривенного введения лекарственных препаратов для ТЛТ в течение ближайших 10 мин с момента установления диагноза [14][16][23].
Кроме того, важно отметить, что ТЛТ при ИМпST не является альтернативой ПЧКВ. Тромболизис должен обязательно сопровождаться выполнением последующего ЧКВ, при отсутствии признаков достижения реперфузии миокарда после ТЛТ или развитии жизнеугрожающих состояний — в экстренном порядке ("спасительное" ЧКВ) [24-28], а в случае успешной ТЛТ — "ранним рутинным" ЧКВ — в пределах от 2 до 24 ч после введения тромболитического препарата. Таким образом, проведение ТЛТ, в случае её эффективности, позволяет только отсрочить выполнение ЧКВ на срок до 24 ч без увеличения рисков развития неблагоприятных событий для пациента. Невыполнение ЧКВ после проведённой ТЛТ ассоциировано со значимым увеличением летальности при ИМпST [29][30].
Вышеуказанный подход носит название фармакоинвазивной стратегии. Обновленные российские клинические рекомендации "Острый инфаркт миокарда с подъемом сегмента ST электрокардиограммы" 2024г содержат акцент на догоспитальную ТЛТ при реализации фармакоинвазивного подхода: "Фармакоинвазивная стратегия заключается в догоспитальной ТЛТ с последующей КАГ с намерением выполнить ЧКВ в инфаркт-связанной артерии ("спасающее" ЧКВ — немедленное ЧКВ при отсутствии свидетельств реперфузии миокарда после ТЛТ или появлении жизнеугрожающих состояний; "раннее рутинное" ЧКВ — в ближайшие 2-24 ч после успешной ТЛТ)" [1].
Для пациентов с ИМпST, госпитализированных в интервале 12-48 ч от начала симптомов заболевания, с меньшим классом рекомендаций и уровнем доказательности рекомендована рутинная стратегия ПЧКВ [31-35].
Относительно тактики ведения пациентов с ИМпST, у которых с момента начала симптомов ИМпST прошло >48 ч, в клинических рекомендациях [1] содержится следующая позиция: "рутинное реперфузионное лечение (ЧКВ или коронарное шунтирование) инфаркт-связанной коронарной артерии обычно не рекомендуется при ее полной окклюзии и отсутствии дополнительных оснований для вмешательства, таких как продолжающаяся или рецидивирующая ишемии миокарда, симптомы тяжелой сердечной недостаточности, угрожающие жизни нарушения сердечного ритма" [36][37]. Одним из ключевых факторов в данной рекомендации является наличие полной окклюзии коронарной артерии, что подразумевает под собой выполнение КАГ для выявления данного патологического состояния. Соответственно, пациенты с ИМпST даже в случае превышения 48-ч интервала от начала симптомов заболевания должны маршрутизироваться в РСЦ для выполнения КАГ и определения дальнейшей тактики ведения.
Отдельным аспектом лечения является необходимость достижения полной реваскуляризации у пациентов с ИМпST. В большом числе исследований подтверждено, что гемодинамически стабильным пациентам с ИМпST, имеющим многососудистое поражение коронарного русла, необходимо проведение ЧКВ на не-инфаркт-связанных коронарных артериях в случае выявления в них значимых изменений либо во время ЧКВ инфаркт-связанной артерии, либо в течение 45 дней после него для снижения суммарного риска ишемических событий (смерть, рецидив ИМ или необходимость в повторной реваскуляризации) [38-45].
У части пациентов с ОКС без стойкого подъема сегмента ST ЭКГ (ОКСбпST), основу патогенеза которого составляет неокклюзирующий пристеночный коронарный тромбоз, тоже развивается ИМ [2]. У всех пациентов с подозрением на ОКСбпST рекомендуется исследование динамики уровня сердечного тропонина Т или I с получением результата в течение 60 мин после взятия крови. При ОКСбпST изменение уровня биомаркеров в крови используется как для выявления острого ИМ, так и для стратификации риска неблагоприятного исхода и принятия решения по стратегии ведения пациента — выбора инвазивного или неинвазивного подходов к лечению, определения времени выполнения КАГ [46-50].
Использование высокочувствительных методов определения концентрации сердечных тропонинов в крови предпочтительнее, поскольку они обладают большей диагностической точностью. Повышение уровня сердечного тропонина выше 99-го перцентиля верхней референсной границы в условиях, указывающих на наличие ишемии миокарда, свидетельствует об остром ИМ. Оценка уровня сердечных тропонинов в крови является более чувствительным и специфичным методом, чем определение МВ-фракции креатинфосфокиназы или миоглобина, и последний в настоящее время не рекомендуется для исключения ИМ. Качественные и полуколичественные методики определения тропонина могут использоваться при недоступности количественного метода, однако они непригодны для выявления динамики концентрации сердечного тропонина в крови.
Необходимо иметь в виду, что повышение концентрации сердечных тропонинов в крови до диагностически значимых уровней происходит в период от 1 до 6 ч после дебюта ишемии миокарда в зависимости от чувствительности метода. Поэтому часто требуется повторная оценка уровня этого показателя для выявления диагностически значимой динамики, свидетельствующей в пользу развития острого повреждения миокарда. В связи с этим при ОКСбпST при получении первого отрицательного или диагностически незначимого уровня сердечного тропонина рекомендуется повторное исследование уровня биомаркера в соответствии с валидированными алгоритмами для быстрого подтверждения или исключения ИМ (повторное взятие крови через 1 ч или 2 ч, или 3 ч — в зависимости от используемого алгоритма 0/1 или 0/2, или 0/3 ч, регламентированного для отдельных тест-систем и производителей).
У пациентов с нормальным уровнем сердечного тропонина при двукратном определении и сохраняющемся клиническом подозрении на ОКС следует предусмотреть дополнительные определения в более поздние сроки заболевания (через 3 ч и иногда позже, особенно при использовании невысокочувствительных методов определения концентрации сердечного тропонина в крови).
ИМ без подъема сегмента ST (ИМбпST) даже при отсутствии других критериев относится к категории высокого риска неблагоприятного исхода, что обусловливает необходимость проведения КАГ с намерением выполнить реваскуляризацию миокарда до выписки из стационара для снижения риска неблагоприятных исходов. Следует отметить, что данная группа пациентов становится отдельным вызовом в связи с увеличением их доли в структуре ОКС.
Наиболее предпочтительной для данной категории больных является ранняя инвазивная стратегия лечения — в первые 24 ч после госпитализации в стационар — с целью снижения риска рецидива ишемии миокарда и сокращения длительности госпитализации [2]. При ИМбпST в случае многососудистого поражения коронарных артерий, неполной реваскуляризации, наличия технической возможности дальнейшей реваскуляризации, перед выпиской из стационара необходимо определять сроки и порядок проведения этапной реваскуляризации не-инфаркт-связанных коронарных артерий.
Амбулаторный этап
Выше были указаны ключевые аспекты догоспитального и стационарного этапов оказания помощи пациентам с ИМ. В то же время, несмотря на очевидные достижения в лечении ОКС на данных этапах, среднесрочный и долгосрочный прогноз остается в целом неблагоприятный. По данным исследований, в течение первого года после перенесенного ОКС каждый десятый пациент умирает, а из числа выживших — до 20% подвержены развитию повторных сердечно-сосудистых событий [51]. Этот риск сохраняется в последующем, составляя 25% в течение 5 лет после выписки по поводу ОКС [52]. Важно отметить, что отдаленный прогноз у пациентов с ИМбпST значимо не отличается от пациентов, перенесших ИМпST, и также является неблагоприятным [53]. Следовательно, пациенты после ИМ относятся к категории очень высокого риска осложнений, что диктует необходимость диспансерного наблюдения и проведения эффективной вторичной профилактики, как медикаментозной, так и немедикаментозной.
В соответствии с Приказом Минздрава России от 15.03.2022 № 168н (ред. от 28.02.2024) "Об утверждении порядка проведения диспансерного наблюдения за взрослыми"3 диспансерное наблюдение при перенесенном ИМ в первые 12 мес. после установки диагноза осуществляется врачом-кардиологом, по прошествии 12 мес. и при отсутствии дополнительных обоснований продолжения наблюдения врачом-кардиологом пациент переходит под наблюдение врача-терапевта. Диспансерное наблюдение включает в себя осмотры не реже 2 раз в год и выполнение ряда лабораторных и инструментальных методов исследования в целях своевременного выявления и профилактики рецидивов и осложнений, а также достижения целевых значений показателей состояния здоровья в соответствии с клиническими рекомендациями.
С 2020г в РФ в рамках ФП "БССЗ", входящего в состав национального проекта "Здравоохранение"4, реализуется программа бесплатного лекарственного обеспечения пациентов с БСК высокого риска неблагоприятного исхода, находящихся под диспансерным наблюдением, и одной из ключевых групп пациентов, включенных в данную программу, являются лица, перенесшие ИМ. В настоящее время программа включает в себя возможность обеспечения лекарственными препаратами по 31 международному непатентованному наименованию в течение 2 лет с даты постановки диагноза.
На рисунке 2 суммированы ключевые аспекты "идеального пути" больного с ОКС на догоспитальном, стационарном и амбулаторном этапе.
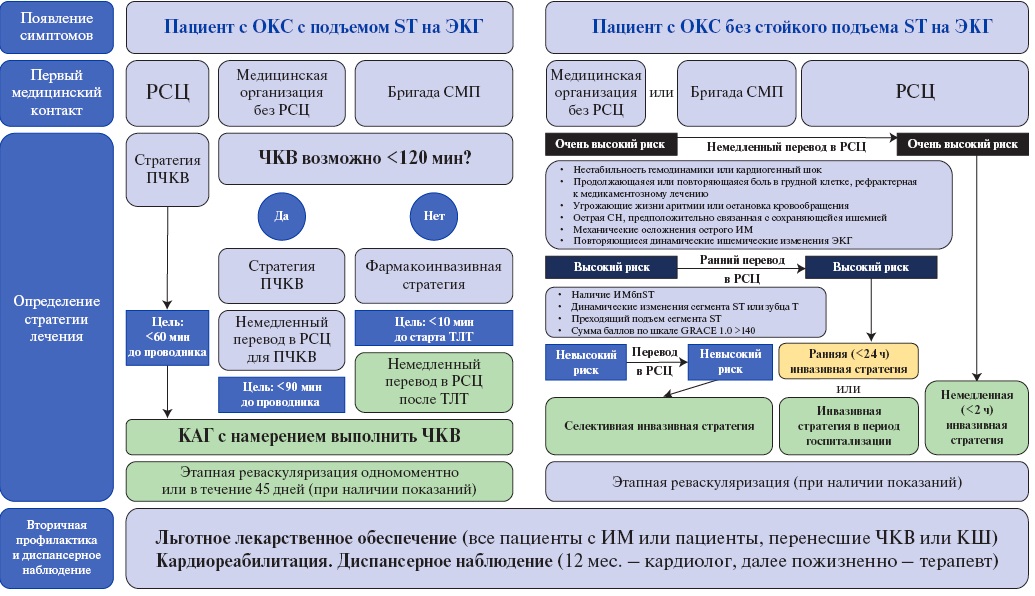
Рис. 2. Идеальный путь больного с ОКС в соответствии с обновленными клиническими рекомендациями Российского кардиологического общества 2024г.
Сокращения: ИМ — инфаркт миокарда, ИМбпST — инфаркт миокарда без подъема сегмента ST, КАГ — коронарная ангиография, КШ — коронарное шунтирование, ОКС — острый коронарный синдром, ПЧКВ — первичное чрескожное коронарное вмешательство, РСЦ — региональный сосудистый центр, СМП — скорая медицинская помощь, СН — сердечная недостаточность, ТЛТ — тромболитическая терапия, ЧКВ — чрескожное коронарное вмешательства, ЭКГ — электрокардиограмма.
Основные резервы в оказании помощи пациентам с ОКС и ИМ
Для эффективной координации на всех этапах оказания помощи формируются системы маршрутизации пациентов на основе утвержденных региональных порядков, необходимым элементом которых является мониторинг качества помощи. В РФ осуществляется ежемесячный сбор данных об оказании помощи при ОКС в рамках "Мониторинга снижения смертности от ишемической болезни сердца (ИБС)" и "Мониторинга сигнальных показателей", размещенных на портале автоматизированной системы мониторинга медицинской статистики (АСММС) Федерального государственного бюджетного учреждения "Центральный научно-исследовательский институт организации и информатизации здравоохранения" Минздрава России (ФГБУ "ЦНИИОИЗ" Минздрава России) (http://asmms.mednet.ru). Ежегодно окончательные статистические данные по оказанию медицинской помощи в стационарах суммируются в федеральной форме статистического наблюдения "Сведения о деятельности подразделений медицинской организации, оказывающих медицинскую помощь в стационарных условиях" № 14 (ФФСН № 14). В данной статье представлены данные по 85 субъектам РФ без учета данных новых регионов.
Ключевым индикатором, характеризующим качество оказания помощи при ИМ, является больничная летальность от ИМ, которая является одним из основных целевых показателей, мониторируемых в рамках ФП "БССЗ". По данным ФФСН № 14, в 2023г в РФ выбыло из стационаров с острым и повторным ИМ 221605 человек, из них летальных исходов — 22656. Как уже было сказано выше, больничная летальность от ИМ в РФ в 2023г снизилась по сравнению с 2018г (с 15,0%) на треть и составила 10,2%, однако по данному показателю также сохраняются значимые различия между регионами, а в 45 субъектах уровень показателя был выше среднероссийского значения (рис. 3).
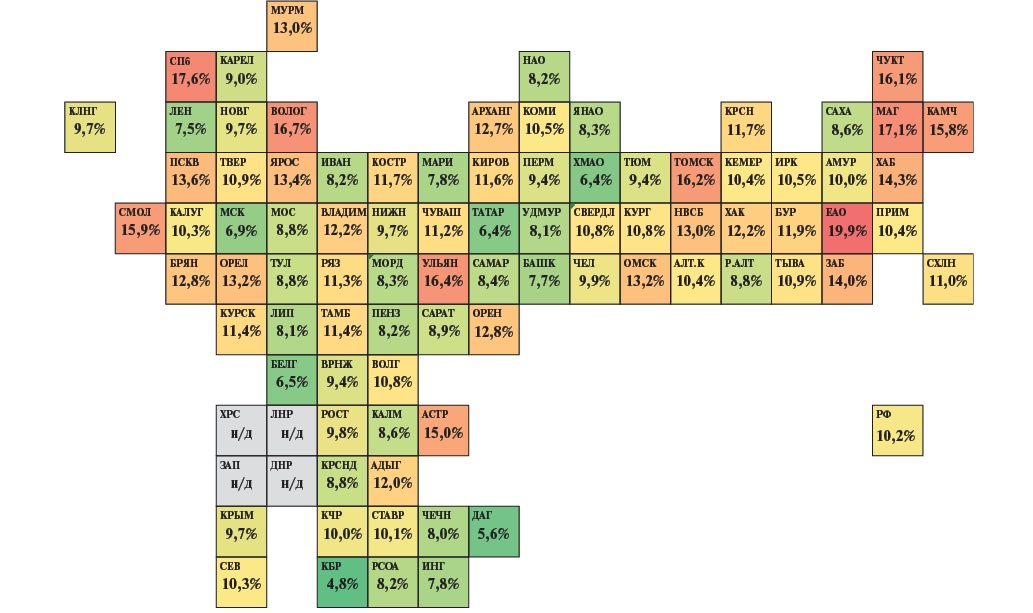
Рис. 3. Тепловая карта субъектов РФ по показателю больничной летальности от ИМ в 2023г (расчет по данным ФФСН № 14).
Примечание: цветное изображение доступно в электронной версии журнала.
На рисунках 4 и 5 представлены фактические данные о пути больного ОКС с подъемом сегмента ST (ОКСпST) и ОКСбпST в 2018 и 2023гг. За прошедшие 5 лет на треть увеличился охват ЧКВ при ОКСпST, и если в 2018г по "идеальному пути" в соответствии с клиническими рекомендациями (ПЧКВ в первые 12 ч от начала симптомов или ЧКВ в течение 24 ч после ТЛТ) прошли только 46,7% пациентов, то в 2023г доля таких пациентов возросла до 70,4%. Все это позволило снизить общую летальность при ОКСпST с 14,1% до 10,9%, однако группа больных с ОКСпST, которые не подвергаются ЧКВ, имеет значительно более высокие показатели летальности (25,1% в 2018г, 25,5% в 2023г), которые отличаются в 4,2-4,7 раза от показателей летальности среди пациентов с ОКСпST, прошедших "идеальный путь" (5,3% в 2018г, 6,0% в 2023г). Несмотря на почти двукратное снижение за прошедшие 5 лет доли больных с ОКСпST, которым не выполнено ЧКВ (с 44% в 2018г до 23% в 2023г), эта группа больных продолжает иметь значимый удельный вес в общей популяции пациентов с ОКСпST, что является резервом дальнейшего снижения летальности и совершенствования медицинской помощи (рис. 4).
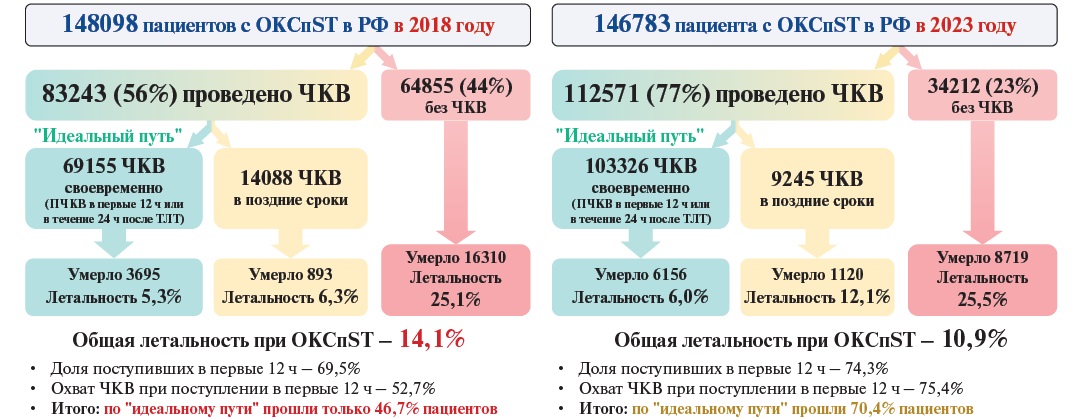
Рис. 4. Путь больного с ОКСпST в 2018 и 2023гг (расчет по данным Мониторинга снижения смертности от ИБС asmms.mednet.ru).
Сокращения: ОКСпST — острый коронарный синдром с подъемом сегмента ST, ПЧКВ — первичное чрескожное коронарное вмешательство, РФ — Российская Федерация, ТЛТ — тромболитическая терапия, ЧКВ — чрескожное коронарное вмешательство.

Рис. 5. Путь больного с ОКСбпST в 2018 и 2023гг (расчет по данным Мониторинга снижения смертности от ИБС (asmms.mednet.ru) и по данным ФФСН № 14).
Сокращения: ИМбпST — инфаркт миокарда без подъема сегмента ST, ОКСбпST — острый коронарный синдром без подъема сегмента ST, РФ — Российская Федерация, ЧКВ — чрескожное коронарное вмешательство.
Стационарный путь больного с ОКСбпST также значительно изменился за 5 лет, в основном, за счет почти двукратного повышения охвата ЧКВ. Общий показатель летальности при ОКСбпST остался на прежнем уровне, что, однако, может быть связано с воздействием других факторов, прежде всего, увеличения тяжести состояния больных, возраста, коморбидности, снижения смертности на дому, последствий коронавирусной инфекции и т.д. Тем не менее эффект от повышения доступности экстренных рентгенэндоваскулярных вмешательств можно продемонстрировать, если пойти от обратного — предположить, что было бы, если в 2023г охват ЧКВ при ОКСбпST оставался таким же, как в 2018г, при схожих уровнях заболеваемости и летальности в подгруппах ЧКВ и консервативного лечения. В таком случае от ОКСбпST умерло бы на 1000 пациентов больше, что можно трактовать как потенциально сохраненные жизни на стационарном этапе.
Этот тезис находит свое подтверждение при анализе показателей, характеризующих оказание помощи больным с ИМбпST: с 2018 по 2023гг охват ЧКВ при ИМбпST также возрос более чем в 2 раза (с 21,1% до 47,6%), что сопровождалось снижением больничной летальности на 15% (с 10,0% до 8,5%), а суммарно за 5 лет удалось сохранить 2242 жизни пациентов с ИМбпST (рис. 5). Дальнейшее увеличение охвата реваскуляризацией при ИМбпST может быть достигнуто за счет максимального охвата КАГ данной категории больных, корректной стратификации риска и своевременного выполнения реваскуляризации тем, кому это показано в соответствии с клиническими рекомендациями.
Таким образом, одним из ключевых резервов в дальнейшем снижении летальности и смертности от ИМ является оказание помощи при ИМ со строгим соблюдением временных интервалов и дальнейшее повышение охвата реваскуляризирующими вмешательствами в соответствии с клиническими рекомендациями.
В 2023г охват ЧКВ среди больных с ИМпST, госпитализированных в первые 12 ч от начала симптомов заболевания, в РФ составил 75,4%. Несмотря на рост среднероссийского показателя по сравнению с 2018г (52,7%) почти в 1,5 раза, в 2023г только 15 субъектов имели охват ЧКВ среди данной категории пациентов >90%, в 25 субъектах показатель находился в диапазоне от 80 до 90%, в 24 регионах — от 60 до 80%, а в 21 субъекте охват ЧКВ среди больных с ИМпST, госпитализированных в первые 12 ч от начала симптомов заболевания, составил <60% (рис. 6).
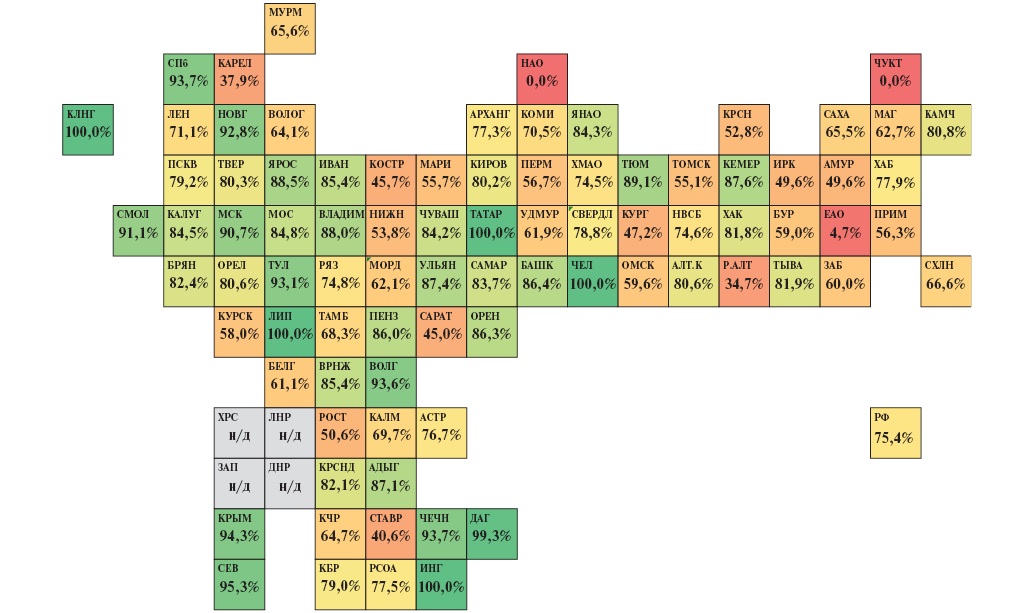
Рис. 6. Тепловая карта субъектов РФ по охвату ЧКВ среди больных с ИМпST, госпитализированных в первые 12 ч от начала симптомов заболевания, в 2023г (расчет по данным Мониторинга снижения смертности от ИБС asmms.mednet.ru).
Примечание: цветное изображение доступно в электронной версии журнала.
Как уже было сказано, при невозможности выполнения ПЧКВ в пределах 120 мин современный подход к лечению пациентов с ИМпST предполагает возможность проведения (при отсутствии противопоказаний) системной ТЛТ. Потребность в проведении ТЛТ в субъектах РФ очень различна и зависит как от географической протяженности региона, так и доступности центров, обладающих возможностью круглосуточного выполнения ЧКВ. В 2023г охват ТЛТ при ИМпST в РФ составил 23,4% (в 2018г — 27,2%), при этом максимальный охват ТЛТ зарегистрирован в Еврейской автономной области (53,9%), а в 6 субъектах доля ТЛТ составила <5% ввиду достигнутой доступности приоритетной госпитализации в РСЦ для проведения ЧКВ в первые 120 мин от контакта с медицинским работником. В целом в период с 2018 по 2023гг увеличение доступности ЧКВ при ОКС позволило снизить применение ТЛТ при ИМпST в 54 регионах, из них в 22 субъектах — более, чем на 10%. Данные по охвату ТЛТ при ИМпST в разрезе субъектов РФ в 2023г представлены на рисунке 7.
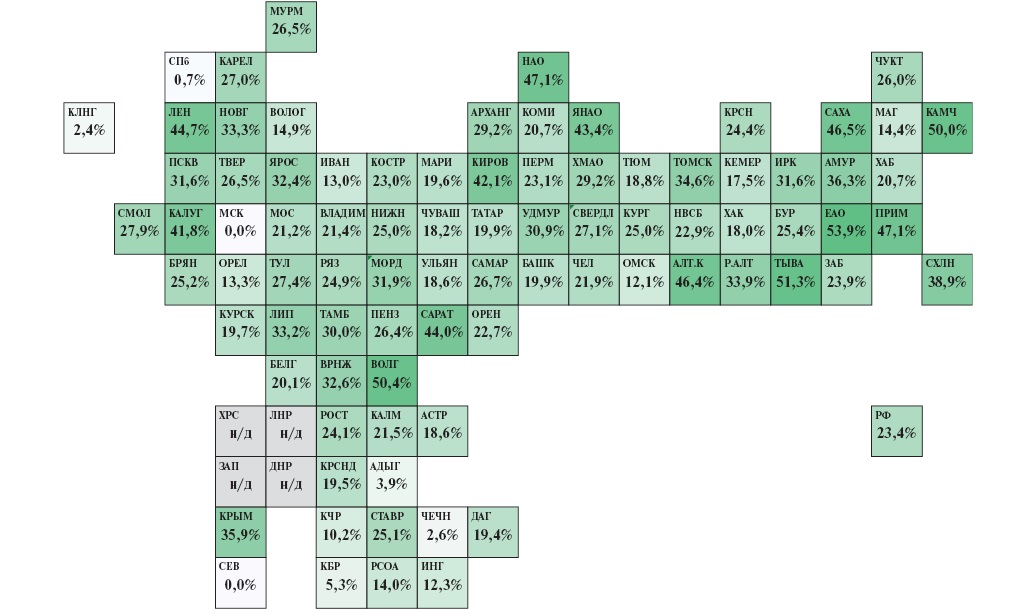
Рис. 7. Охват ТЛТ среди больных с ИМпST в 2023г (расчет по данным Мониторинга снижения смертности от ИБС asmms.mednet.ru).
Примечание: цветное изображение доступно в электронной версии журнала.
С целью сокращения временного интервала до достижения восстановления кровотока ТЛТ при ИМпST строго рекомендуется проводить на догоспитальном этапе помощи, идеально в течение ближайших 10 мин с момента установления диагноза. Несмотря на это, в настоящее время в ряде регионов сохраняется практика выполнения большей части процедур тромболизиса на госпитальном этапе в ПСО, что ассоциировано с более поздней реперфузией при ИМпST и ухудшением ближайшего и отдаленного прогноза. В 2023г доля ТЛТ при ИМпST на догоспитальном этапе помощи в РФ составила 77,2% (в 2018г — 52,8%), при этом только в 18 регионах данный показатель был на уровне 90% и выше, а в 21 субъекте регистрировались значения ниже 60%. Данные в разрезе субъектов РФ представлены на рисунке 8.
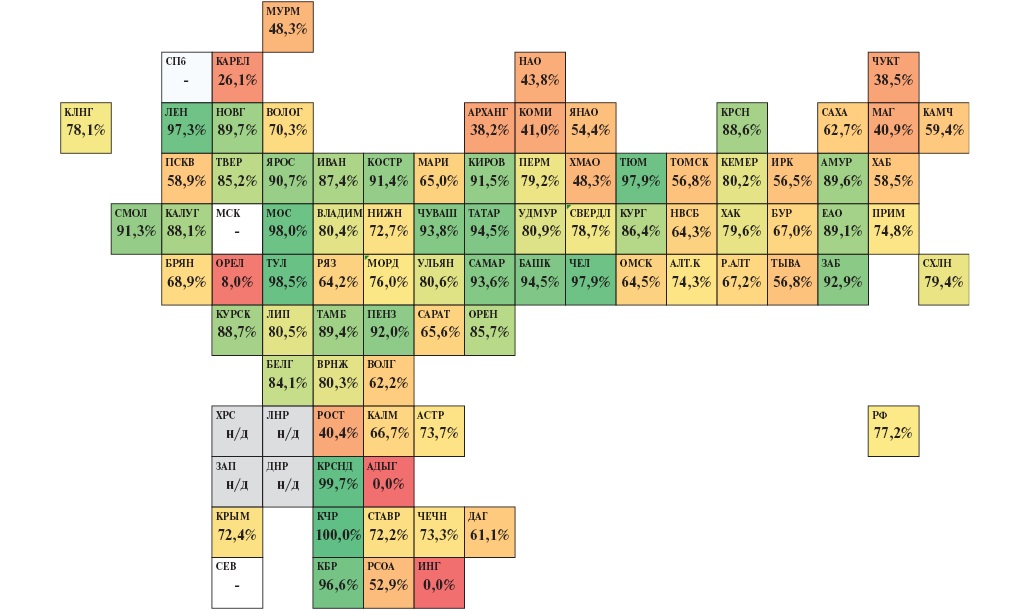
Рис. 8. Тепловая карта субъектов РФ по доле ТЛТ при ИМпST на догоспитальном этапе помощи в 2023г (расчет по данным Мониторинга снижения смертности от ИБС asmms.mednet.ru).
Примечание: цветное изображение доступно в электронной версии журнала.
Кроме того, ТЛТ при ИМпST должна обязательно сопровождаться последующим выполнением ЧКВ в пределах от 2 до 24 ч после введения тромболитического препарата (фармакоинвазивный подход). В 2018г доля фармакоинвазивного подхода от всех ТЛТ при ИМпST в РФ составляла 37,1%. Несмотря на то, что к концу 2023г показатель возрос до 61,6%, сохраняются значительные резервы для дальнейшего внедрения фармакоинвазивного подхода, поскольку, исходя из текущего значения показателя, более трети больных с ИМпST, которым выполнялась ТЛТ, ЧКВ не было выполнено вовсе или выполнено в сроки позднее 24 ч. При этом в 14 регионах показатель был >80%, а в 29 регистрировались значения <50%. Данные в разрезе субъектов РФ представлены на рисунке 9.
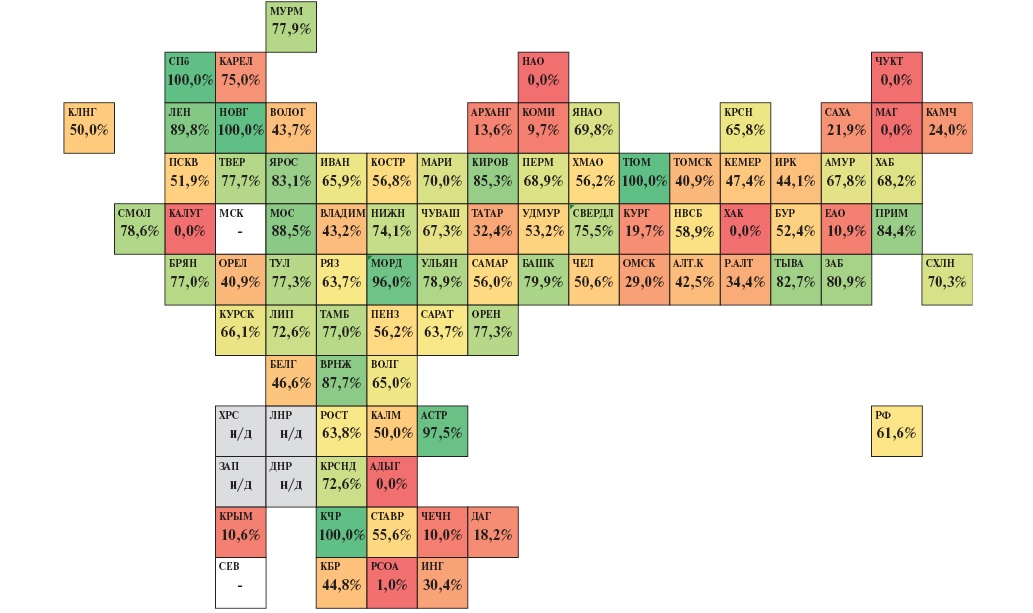
Рис. 9. Тепловая карта субъектов РФ по доле фармакоинвазивного подхода среди случаев ТЛТ при ИМпST в 2023г (расчет по данным Мониторинга снижения смертности от ИБС asmms.mednet.ru).
Примечание: цветное изображение доступно в электронной версии журнала.
В ФГБУ "ЦНИИОИЗ" Минздрава России сформированы сигнальные показатели мониторинга снижения смертности от ИБС и цереброваскулярных заболеваний, значения которых также размещается на портале АСММС. Показатели ежемесячно мониторируются и отражают эффективность мероприятий, направленных на снижение смертности от БСК. Одним из сигнальных показателей, характеризующим своевременность и качество оказания медицинской помощи при ИМпST, является "Частота лечебных вмешательств с целью восстановления коронарного кровотока (ТЛТ, ЧКВ) у пациентов с ОКСпST в первые 12 ч от начала симптомов заболевания". В 2018г данный показатель в РФ составлял 63,8%, за 5 лет произошел рост только до 79,4%. В 24 регионах уровень показателя был на уровне 90% и выше; в 23 регионах — в диапазоне от 80 до 90%; в 17 субъектах — в диапазоне от 70 до 80%; и в 21 регионе охват реперфузионными вмешательствами в пределах 12 ч от начала симптомов заболевания составил <70%. Данные в разрезе субъектов РФ представлены на рисунке 10.
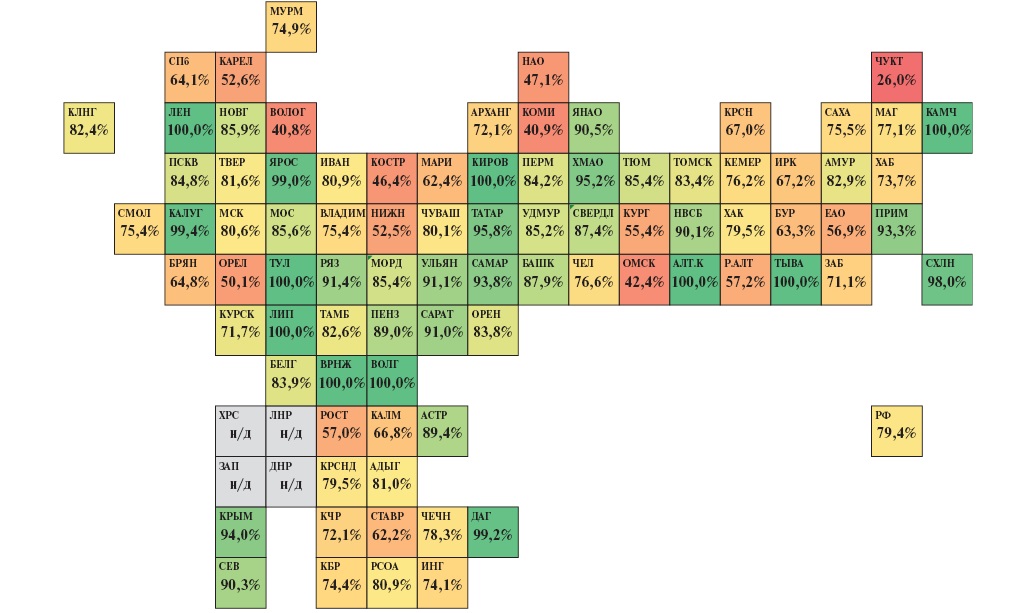
Рис. 10. Тепловая карта субъектов РФ по частоте лечебных вмешательств с целью восстановления коронарного кровотока (ТЛТ, ЧКВ) у пациентов с ОКСпST в первые 12 ч от начала симптомов заболевания в 2023г (данные Мониторинга сигнальных показателей asmms.mednet.ru).
Примечание: цветное изображение доступно в электронной версии журнала.
Были проанализированы данные Мониторинга снижения смертности от ИБС о структуре выбывших с ОКСбпST из стационаров. В 2023г доля выбывших с ИМбпST среди всех выбывших с ОКСбпST в РФ составила 26,5%, в 12 субъектах данный показатель ниже 15%, и одной из причин может быть недостаточное использование количественного определения уровня сердечных тропонинов высокочувствительными методами, за счет чего часть случаев ИМбпST могут остаться недиагностированными (рис. 11).
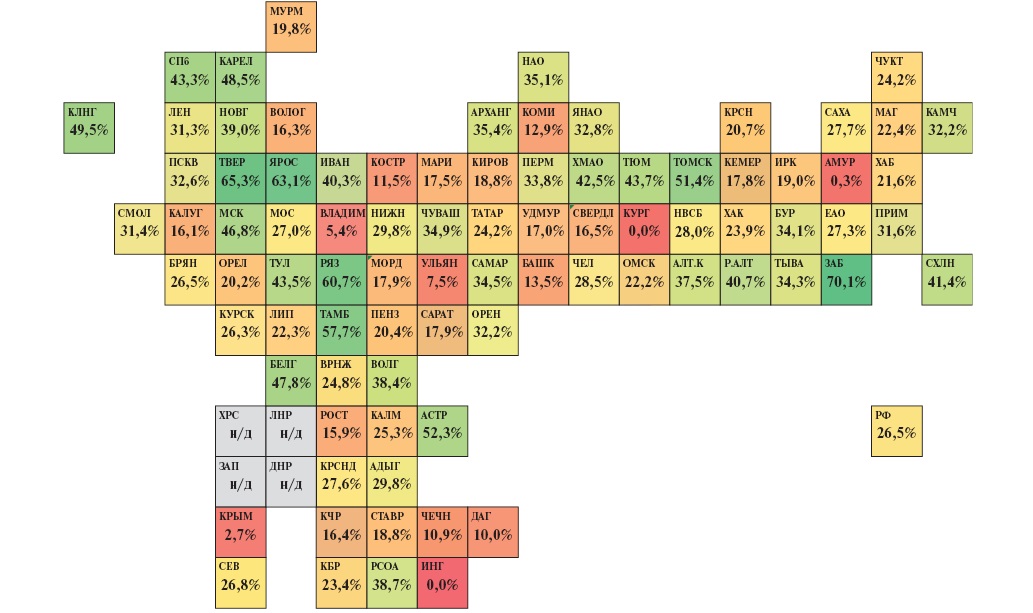
Рис. 11. Тепловая карта субъектов РФ по доле ИМбпST в структуре выбывших с ОКСбпST в 2023г (расчет по данным Мониторинга снижения смертности от ИБС asmms.mednet.ru).
Примечание: цветное изображение доступно в электронной версии журнала.
С целью мониторинга повышения доступности и охвата реперфузионным лечением среди категории больных с ИМ, госпитализированных в первые 24 ч от начала заболевания, в перечень целевых показателей ФП "БССЗ" Национального проекта "Продолжительная и активная жизнь", реализуемого в период 2025-2030гг, включен показатель "Доля случаев выполнения тромболитической терапии и стентирования коронарных артерий пациентам с инфарктом миокарда от всех пациентов с инфарктом миокарда, госпитализированных в стационар в первые сутки от начала заболевания (охват реперфузионной терапией)", в котором будет учитываться выполнение ТЛТ, ЧКВ, а также коронарное шунтирование (при выполнении в течение первых 7 сут. от начала заболевания) пациентам с ИМ, госпитализированным в первые сутки от начала заболевания.
По данным, доступным в ФФСН № 14, в 2023г охват реперфузионной терапией (ТЛТ и ЧКВ, без учета аортокоронарного шунтирования) среди пациентов с ИМ, госпитализированных в стационар в первые сутки от начала заболевания, в РФ составил 82,2%. Целевое значение показателя к концу 2030г для РФ — 95,0%. В зависимости от исходных данных в 2023г для каждого субъекта РФ разработана линейка ежегодных целевых значений показателя на период 2025-2030гг. Декомпозиция показателей ФП "БССЗ" в разрезе субъектов РФ проводилась в соответствии с Указом Президента РФ "О национальных целях развития Российской Федерации на период до 2030 года и на перспективу до 2036 года" от 07.05.2024 № 309 в части снижения к 2036г дифференциации показателей ожидаемой продолжительности жизни не менее, чем на 25% по сравнению с уровнем 2023г; а также в соответствии с Перечнем поручений по итогам заседания Совета по стратегическому развитию и национальным проектам (утвержденным Президентом РФ 26 января 2023г № Пр-144), Перечнем поручений Председателя Правительства РФ М. В. Мишустина от 26.08.2020 № ММ-П47-9866, Перечнем поручений по итогам совещания с членами Правительства (утв. Президентом РФ 27 марта 2019г № Пр-528), письмом Минэкономразвития России от 13.05.2024 № 16137-СН/Д23и — в части приоритизации территорий Дальневосточного и Северо-Кавказского федеральных округов, регионов зоны Арктики.
Заключение
За период реализации ФП "БССЗ" в 2019-2024гг отмечалось значительное улучшение системы оказания медицинской помощи пациентам с ОКС в РФ. Масштабное расширение сети РСЦ, дооснащение и переоснащение учреждений позволило существенно повысить доступность высокотехнологичной помощи и охват ЧКВ, что привело к снижению смертности от ИМ. В то же время сохраняются значимые резервы по дальнейшему повышению охвата различными методами реперфузии и по повышению своевременности оказания помощи. Более того, следует отметить, что структура заболеваемости ОКС существенно меняется в последние годы. Совершенствование помощи, улучшение контроля факторов риска, диагностики и плановой помощи приводит к существенному увеличению доли пациентов с ОКСбпST, в т.ч. старших возрастных групп, со множественной коморбидностью и повторными реваскуляризирующими вмешательствами в анамнезе, что является отдельным вызовом для системы здравоохранения.
Новый целевой показатель ФП "БССЗ" по охвату реперфузионной терапией позволит по-другому взглянуть на резервы оказания помощи при ИМ, обеспечить дальнейшее совершенствование региональных систем помощи больным с ОКС, станет базисом для последующего снижения смертности от ИМ, что будет способствовать снижению заболеваемости и смертности от БСК, и, как результат — росту ожидаемой продолжительности жизни и достижению установленных национальных целей в сфере здравоохранения.
Отношения и деятельность: все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье.
1. Данные Мониторинга снижения смертности от ишемической болезни сердца ФГБУ "Центральный научно-¬исследовательский институт организации и информатизации здравоохранения" Минздрава России (asmms.mednet.ru).
2. Данные федеральных форм статистического наблюдения (ФФСН № 14) по РФ за 2018-2023гг.
3. Приказ Минздрава России от 15.03.2022 № 168н (ред. от 28.02.2024) "Об утверждении порядка проведения диспансерного наблюдения за взрослыми" (Зарегистрировано в Минюсте России 21.04.2022 № 68288).
4. Постановление Правительства РФ от 26.12.2017 № 1640 (ред. от 27.12.2024) "Об утверждении государственной программы Российской Федерации "Развитие здравоохранения" (с изм. и доп., вступ. в силу с 01.01.2025).
Список литературы
1. Аверков О.В., Арутюнян Г.К., Дупляков Д.В. и др. Острый инфаркт миокарда с подъемом сегмента ST электрокардиограммы. Клинические рекомендации 2024. Российский кардиологический журнал. 2025;30(3): 6306. doi:10.15829/1560-4071-2025-6306. EDN: IVJCUK.
2. Аверков О.В., Арутюнян Г.К., Дупляков Д.В. и др. Острый коронарный синдром без подъема сегмента ST электрокардиограммы. Клинические рекомендации 2024. Российский кардиологический журнал. 2025;30(5): 6319. doi:10.15829/1560-4071-2025-6319. EDN: CXJUIB.
3. Williams C, Fordyce CB, Cairns JA, et al. Temporal Trends in Reperfusion Delivery and Clinical Outcomes Following Implementation of a Regional STEMI Protocol: A 12-Year Perspective. CJC Open. 2022;5(3):181-90. doi:10.1016/j.cjco.2022.11.015.
4. Jortveit J, Pripp AH, Halvorsen S. Outcomes after delayed primary percutaneous coronary intervention vs. pharmaco-¬invasive strategy in ST-segment elevation myocardial infarction in Norway. Eur Heart J Cardiovasc Pharmacother. 2022;8(5):442-51. doi:10.1093/ehjcvp/pvab041.
5. Eastwood K, Howell S, Nehme Z, et al. Impact of a mass media campaign on presentations and ambulance use for acute coronary syndrome. Open Heart. 2021;8:e001792. doi:10.1136/openhrt2021-001792.
6. Thygesen K, Alpert JS, Jaffe AS, et al.; ЕОК Scientific Document Group. Fourth universal definition of myocardial infarction (2018). Eur Heart J. 2019;40:237-69. doi:10.1161/CIR.0000000000000617.
7. Diercks DB, Peacock WF, Hiestand BC, et al. Frequency and consequences of recording an electrocardiogram >10 minutes after arrival in an emergency room in non-¬STsegment elevation acute coronary syndromes (from the CRUSADE Initiative). Am J Cardiol. 2006;97:437-42. doi:10.1016/j.amjcard.2005.09.073.
8. Schmitt C, Lehmann G, Schmieder S, et al. Diagnosis of acute myocardial infarction in angiographically documented occluded infarct vessel: limitations of ST-segment elevation in standard and extended ECG leads. Chest. 2001;120:1540-6. doi:10.1378/chest.120.5.1540.
9. Fesmire FM, Percy RF, Bardoner JB, et al. Usefulness of automated serial 12 lead ECG monitoring during the initial emergency department evaluation of patients with chest pain. Ann Emerg Med. 1998;31:3-11. doi:10.1016/S0196-0644(98)70274-4.
10. Rouan GW, Lee TH, Cook EF, et al. Clinical characteristics and outcome of acute myocardial infarction in patients with initially normal or nonspecific electrocardiograms (a report from the Multicenter Chest Pain Study). Am J Cardiol. 1989;64:1087-92. doi:10.1016/00029149(89)90857-6.
11. McCarthy BD, Wong JB, Selker HP. Detecting acute cardiac ischemia in the emergency department. J Gen Intern Med. 1990;5:365-73. doi:10.1007/BF02600409.
12. Savonitto S, Ardissino D, Granger CB, et al. Prognostic value of the admission electrocardiogram in acute coronary syndromes. JAMA. 1999;281:707-13. doi:10.1001/jama.281.8.707.
13. Дроздов Д.В., Макаров Л.М., Иртюга О.Б. и др. Регистрация электрокардиограммы покоя в 12 общепринятых отведениях взрослым и детям 2023. Методические рекомендации. Российский кардиологический журнал. 2023;28(10):5631. doi:10.15829/1560-4071-2023-5631.
14. Bainey KR, Armstrong PW, Zheng Y, et al. Pharmacoinvasive Strategy Versus Primary Percutaneous Coronary Intervention in ST-Elevation Myocardial Infarction in Clinical Practice: Insights From the Vital Heart Response Registry. Circ Cardiovasc Interv. 2019;12(10):e008059. doi:10.1161/CIRCINTERVENTIONS.119.008059.
15. Boersma E, Maas AC, Deckers JW, Simoons ML. Early thrombolytic treatment in acute myocardial infarction: reappraisal of the golden hour. Lancet. 1996;348:771-5. doi:10.1016/s0140-6736(96)02514-7.
16. Boersma E. Does time matter? A pooled analysis of randomized clinical trials comparing primary percutaneous coronary intervention and in-hospital fibrinolysis in acute myocardial infarction patients. Eur Heart J. 2006;27:779-88. doi:10.1093/eurheartj/ehi810.
17. Byrne RA, Rossello X, Coughlan JJ, et al.; ESC Scientific Document Group. 2023 ESC Guidelines for the management of acute coronary syndromes. Eur Heart J. 2023;44(38):3720-826. doi:10.1093/eurheartj/ehad191.
18. O’Gara PT, Kushner FG, Ascheim DD, et al.; American College of Cardiology Foundation/ American Heart Association Task Force on Practice Guidelines. 2013 ACCF/AHA guideline for the management of ST-elevation myocardial infarction: a report of the American College of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines. Circulation. 2013;127(4):e362-425. doi:10.1161/CIR.0b013e3182742cf6.
19. Steg PG, James SK, Atar D, et al. Task Force on the management of ST-segment elevation acute myocardial infarction of the European Society of Cardiology (ESC); ESC Guidelines for the management of acute myocardial infarction in patients presenting with ST-segment elevation. Eur Heart J. 2012;33(20):2569-619. doi:10.1093/eurheartj/ehs215.
20. Morrison LJ, Verbeek PR, McDonald AC, et al. Mortality and prehospital thrombolysis for acute myocardial infarction: a meta-analysis. J Am Med Assoc. 2000;283:2686-92. doi:10.1001/jama.283.20.2686.
21. McCaul M, Lourens A, Kredo T. Pre-hospital versus in-hospital thrombolysis for ST-elevation myocardial infarction Cochrane Database Syst Rev. 2014:(9):CD010191. doi:10.1002/14651858.CD010191.pub2.
22. Bonnefoy E, Steg PG, Boutitie F, et al. Comparison of primary angioplasty and pre-hospital fibrinolysis in acute myocardial infarction (CAPTIM) trial: a 5 year follow-up. Eur Heart J. 2009;30(13):1598-606. doi:10.1093/eurheartj/ehp156.
23. Armstrong PW, Gershlick AH, Goldstein P, et al.; STREAM Investigative Team. Fibrinolysis or primary PCI in ST-segment elevation myocardial infarction. N Engl J Med. 2013;368(15):1379-87. doi:10.1056/NEJMoa1301092.
24. Ellis SG, da Silva ER, Heyndrickx G, et al.; RЕSCUE Investigators. Randomized comparison of rescue angioplasty with conservative management of patients with early failure of thrombolysis for acute anterior myocardial infarction. Circulation. 1994;90(5):2280-4. doi:10.1161/01.cir.90.5.2280.
25. Sutton AGC, Campbell PG, Graham R, et al. A randomized trial of rescue angioplasty versus a conservative approach for failed fibrinolysis in ST-segment elevation myocardial infarction: the Middlesbrough Early Revascularization to Limit INfarction (MERLIN) trial. J Am Coll Cardiol. 2004;44:287-96. doi:10.1016/j.jacc.2003.12.059.
26. Wijeysundera H, Vijayaraghavan R, Nallamothu B, et al. Rescue Angioplasty or Repeat Fibrinolysis After Failed Fibrinolytic Therapy for ST-Segment Myocardial Infarction: A Meta--Analysis of Randomized Trials. JACC. 2007;49(4):422-30. doi:10.1016/j.jacc.2006.09.033.
27. Collet JP, Montalesot G, Le May M, et al. Percutaneous coronary intervention after fibrinolysis: a multiple meta-analyses approach according to the type of strategy. J Am Coll Cardiol. 2006;48:1326-35. doi:10.1016/j.jacc.2006.03.064.
28. Appleton DL, Abbate A, Biondi-¬Zoccai GGL. Late percutaneous coronary intervention for the totally occluded infarct-¬related artery: a meta-analysis of the effects on cardiac function and remodeling. Catheter Cardiovasc Interv. 2008;71:772-81. doi:10.1002/ccd.21468.
29. Borgia F, Goodman SG, Halvorsen S, et al. Early routine percutaneous coronary intervention after fibrinolysis vs. standard therapy in ST-segment elevation myocardial infarction: a meta-analysis. Eur Heart J. 2010;31(17):2156-69. doi:10.1093/eurheartj/ehq204.
30. D’Souza SP, Mamas MA, Fraser DG, et al. Routine early coronary angioplasty versus ischaemia-¬guided angioplasty after thrombolysis in acute ST-elevation myocardial infarction: a meta-analysis. Eur Heart J. 2011;32(8):972-82. doi:10.1093/eurheartj/ehq398.
31. Hochman JS, Lamas GA, Buller CE, et al.; Occluded Artery Trial Investigators. Coronary intervention for persistent occlusion after myocardial infarction. N Engl J Med. 2006; 355(23):2395-407. doi:10.1056/NEJMoa066139.
32. Schömig A, Mehilli J, Antoniucci D, et al. Mechanical Reperfusion in Patients With Acute Myocardial Infarction Presenting More Than 12 Hours From Symptom Onset: A Randomized Controlled Trial. JAMA. 2005;293(23):2865-72. doi:10.1001/jama.293.23.2865.
33. Nadrepepa G, Kastrati A, Mehilli J, et al. Mechanical reperfusion and long-term mortality in patients with acute myocardial infarction presenting 12 to 48 hours from onset of symptoms. JAMA. 2009;301(5):487-8. doi:10.1001/jama.2009.32.
34. Bouisset F, Gerbaud E, Bataille V, et al. Percutaneous myocardial revascularization in latepresenting patients with STEMI. J Am Coll Cardiol. 2021;78:1291-305. doi:10.1016/j.jacc.2021.07.039.
35. Busk M, Kaltoft A, Nielsen SS, et al. Infarct size and myocardial salvage after primary angioplasty in patients presenting with symptoms for <12 h vs. 12-72 h. Eur Heart J. 2009;30:1322-30. doi:10.1093/eurheartj/ehp113.
36. Ioannidis JP, Katritsis DG. Percutaneous coronary intervention for late reperfusion after myocardial infarction in stable patients. Am Heart J. 2007;154(6):1065-71. doi:10.1016/j.ahj.2007.07.049.
37. Menon V, Pearte CA, Buller CE, et al. Lack of benefit from percutaneous intervention of persistently occluded infarct arteries after the acute phase of myocardial infarction is time independent: insights from Occluded Artery Trial. Eur Heart J. 2009;30(2):183-91. doi:10.1093/eurheartj/ehn486.
38. Wald DS, Morris JK, Wald NJ, et al. & PRAMI Investigators. Randomized trial of preventive angioplasty in myocardial infarction. The New England journal of medicine. 2013;369(12):1115-23. doi:10.1056/NEJMoa1305520.
39. Engstrøm T, Kelbæk H, Helqvist S, et al. Complete revascularisation versus treatment of the culprit lesion only in patients with ST-segment elevation myocardial infarction and multivessel disease (DANAMI 3 — PRIMULTI): an open-label, randomised controlled trial. Lancet. 2015;386:665-71. doi:10.1016/s0140-6736(15)60648-1.
40. Smits PC, Abdel-¬Wahab M, Neumann FJ, et al. Fractional flow reserve-¬guided multivessel angioplasty in myocardial infarction. N Engl J Med. 2017;376:1234-44. doi:10.1056/NEJMoa1701067.
41. Mehta SR, Wang J, Wood DA, et al.; COMPLETE Trial Investigators. Complete Revascularization vs Culprit Lesion-¬Only Percutaneous Coronary Intervention for Angina--Related Quality of Life in Patients With ST-Segment Elevation Myocardial Infarction: Results From the COMPLETE Randomized Clinical Trial. JAMA cardiology. 2022;7(11):1091-9. doi:10.1001/jamacardio.2022.3032.
42. Gershlick AH, Khan JN, Kelly DJ, et al. Randomized trial of complete versus lesion-only revascularization in patients undergoing primary percutaneous coronary intervention for STEMI and multivessel disease: the CvLPRIT trial. J Am Coll Cardiol. 2015;65:963-72. doi:10.1016/j.jacc.2014.12.038.
43. Chin CT, L’Allier P, Neumann FJ, et al. The Compare-¬Acute trial of fractional flow reserve--guided multivessel angioplasty in myocardial infarction. EuroIntervention: journal of EuroPCR in collaboration with the Working Group on Interventional Cardiology of the European Society of Cardiology. 2017;13(5):e613 e616. doi:10.4244/EIJV13I5A96.
44. Diletti R, den Dekker WK, Bennett J; BIOVASC Investigators. Immediate versus staged complete revascularisation in patients presenting with acute coronary syndrome and multivessel coronary disease (BIOVASC): a prospective, open-label, non-inferiority, randomised trial. Lancet. 2023;401(10383):1172-82. doi:10.1016/S0140-6736(23)00351-3.
45. Biscaglia S, Guiducci V, Escaned J, et al.; FIRE Trial Investigators. Complete or Culprit-Only PCI in Older Patients with Myocardial Infarction. N Engl J Med. 2023;389(10):88998. doi:10.1056/NEJMoa2300468.
46. Reichlin T, Twerenbold R, Reiter M, et al. Introduction of high-sensitivity troponin assays: impact on myocardial infarction incidence and prognosis. Am J Med. 2012;125:1205-13. doi:10.1016/j.amjmed.2012.07.015.
47. Сhapman AR, Lee KK, McAllister DA, et al. Association of High-¬Sensitivity Cardiac Troponin I Concentration With Cardiac Outcomes in Patients With Suspected Acute Coronary Syndrome. JAMA. 2017;318:1913-24. doi:10.1001/jama.2017.17488.
48. Mueller C, Giannitsis E, Mockel M, et al., Biomarker Study Group of the ESC ACCA. Rapid rule out of acute myocardial infarction: novel biomarker-¬based strategies. Eur Heart J Acute Cardiovasc Care. 2017;6:218-22. doi:10.1177/2048872616653229.
49. Pickering JW, Than MP, Cullen L, et al. Rapid Rule-out of Acute Myocardial Infarction With a Single HighSensitivity Cardiac Troponin T Measurement Below the Limit of Detection: A Collaborative Meta-analysis. Ann Intern Med. 2017;166:715-3724. doi:10.7326/M16-2562.
50. Miller-¬Hodges E, Anand A, Shah ASV, et al. High-¬Sensitivity Cardiac Troponin and the Risk Stratification of Patients With Renal Impairment Presenting With Suspected Acute Coronary Syndrome. Circulation. 2018;137:425-35. doi:10.1161/CIRCULATIONAHA.117.030320.
51. Townsend N, Wilson L, Bhatnagar P, et al. Cardiovascular disease in Europe: epidemiological update 2016. European Heart Journal. 2016;37(42):3232-45. doi:10.1093/eurheartj/ehw334.
52. Abu-¬Assi E, López-¬López A, González-¬Salvado V, et al. The Risk of Cardiovascular Events After an Acute Coronary Event Remains High, Especially During the First Year, Despite Revascularization. Revista Espanola de Cardiologia. 2016;69(1):11-8. doi:10.1016/j.rec.2015.06.015.
53. Bouisset F, Ruidavets J-B, Dallongeville J, et al. Comparison of Short- and Long-¬Term Prognosis between ST-Elevation and Non-¬ST-Elevation Myocardial Infarction. Journal of Clinical Medicine. 2021;10(2):180. doi:10.3390/jcm10020180.
Об авторах
Е. Г. КамкинРоссия
Камкин Евгений Геннадьевич — к.м.н., зам. Министра здравоохранения Российской Федерации
Москва
Е. В. Каракулина
Россия
Каракулина Екатерина Валерьевна — к.м.н., директор департамента организации медицинской помощи и санаторно-курортного дела
Москва
В. А. Гульшина
Россия
Гульшина Валерия Александровна — к.б.н., зам. директора департамента организации медицинской помощи и санаторно-курортного дела
Москва
А. А. Москалёв
Россия
Москалев Андрей Александрович — начальник отдела реализации региональных программ организации медицинской помощи и санаторно-курортного дела
Москва
Н. С. Анисимова
Россия
Анисимова Наталья Сергеевна — к.м.н., зам. начальника отдела реализации региональных программ организации медицинской помощи и санаторно-курортного дела
Москва
Е. П. Мазыгула
Россия
Мазыгула Елена Петровна — к.м.н., руководитель Координационного центра по реализации федерального проекта "Борьба с сердечно-сосудистыми заболеваниями"
Москва
Р. М. Иващенко
Россия
Иващенко Регина Маратовна — зам. руководителя Координационного центра по реализации федерального проекта "Борьба с сердечно-сосудистыми заболеваниями"
Москва
А. С. Чекулаев
Россия
Чекулаев Александр Сергеевич — зав. отделом методической поддержки и координации мероприятий федерального проекта "Борьба с сердечно-сосудистыми заболеваниями"
Москва
Н. Э. Звартау
Россия
Звартау Надежда Эдвиновна — к.м.н., зам. генерального директора по работе с регионами, доцент кафедры факультетской терапии с клиникой Института медицинского образования
Санкт-Петербург
А. Н. Яковлев
Россия
Яковлев Алексей Николаевич — к.м.н., начальник службы по развитию регионального здравоохранения Управления по реализации федеральных проектов, зав. научно-исследовательской лабораторией острого коронарного синдрома, доцент кафедры анестезиологии и реаниматологии лечебного факультета Института медицинского образования
Санкт-Петербург
С. В. Виллевальде
Россия
Виллевальде Светлана Вадимовна — д.м.н., профессор, начальник службы анализа и перспективного планирования Управления по реализации федеральных проектов, зав. кафедрой кардиологии факультета послевузовского и дополнительного образования Института медицинского образования
Санкт-Петербург
Е. А. Медведева
Россия
Медведева Елена Александровна — к.м.н., зав. отделом стратегического развития кардиологической службы в регионах Управления по реализации федеральных проектов
Санкт-Петербург
Д. Н. Недбаева
Россия
Недбаева Дарья Николаевна — специалист отдела мониторинга и анализа показателей регионального здравоохранения Службы по развитию регионального здравоохранения Управления по реализации федеральных проектов
Санкт-Петербург
А. А. Федоренко
Россия
Федоренко Алексей Александрович — зам. начальника службы по развитию регионального здравоохранения Управления по реализации федеральных проектов
Санкт-Петербург
Д. Р. Даутов
ФГБУ Национальный медицинский исследовательский центр им. В. А. Алмазова Минздрава России
Россия
Даутов Дмитрий Рафагатьевич — врач-кардиолог отдела информационного обеспечения и телемедицины Управления по реализации федеральных проектов
Санкт-Петербург
Е. В. Шляхто
Россия
Шляхто Евгений Владимирович — д.м.н., профессор, академик РАН, генеральный директор, главный внештатный специалист кардиолог Минздрава России Северо-Западного, Северо-Кавказского, Приволжского и Южного федеральных округов, Херсонской и Запорожской областей
Санкт-Петербург
Дополнительные файлы
Рецензия
Для цитирования:
Камкин Е.Г., Каракулина Е.В., Гульшина В.А., Москалёв А.А., Анисимова Н.С., Мазыгула Е.П., Иващенко Р.М., Чекулаев А.С., Звартау Н.Э., Яковлев А.Н., Виллевальде С.В., Медведева Е.А., Недбаева Д.Н., Федоренко А.А., Даутов Д.Р., Шляхто Е.В. Организация медицинской помощи при остром коронарном синдроме в рамках федерального проекта «Борьба с сердечно-сосудистыми заболеваниями»: результаты и перспективы. Российский кардиологический журнал. 2025;30(9):6405. https://doi.org/10.15829/1560-4071-2025-6405. EDN: NIAIKY
For citation:
Kamkin E.G., Karakulina E.V., Gulshina V.A., Moskalev A.A., Anisimova N.S., Mazygula E.P., Ivaschenko R.M., Chekulaev A.S., Zvartau N.E., Yakovlev A.N., Villevalde S.V., Medvedeva E.A., Nedbaeva D.N., Fedorenko A.A., Dautov D.R., Shlyakhto E.V. Management of health care for acute coronary syndrome within the federal project "Control of Cardiovascular Diseases": results and prospects. Russian Journal of Cardiology. 2025;30(9):6405. (In Russ.) https://doi.org/10.15829/1560-4071-2025-6405. EDN: NIAIKY
JATS XML

















































