Перейти к:
Долгосрочное наблюдение пациентов с тромбоэмболией легочной артерии высокого и промежуточного риска летального исхода
https://doi.org/10.15829/1560-4071-2025-6354
EDN: WKGXPL
Аннотация
Цель. Изучение результатов долгосрочного наблюдения пациентов с тромбоэмболией легочной артерии (ТЭЛА) промежуточного и высокого риска тридцатидневной летальности.
Материал и методы. В ретроспективное исследование включено 53 пациента (45,3% мужчины) с ТЭЛА промежуточного и высокого риска, госпитализированных в ФГБУ "НМИЦ им. В. А. Алмазова" с 2019 по 2020гг. Средний период наблюдения составил 20,9 [4,0; 33,5] мес. Данные были получены из медицинской информационной системы, а также посредством телефонных звонков.
Результаты. 7 (13,2%) пациентов относились к категории высокого, 29 (54,7%) — к категории промежуточно-высокого и 17 (32,1%) — к категории промежуточно-низкого риска 30-дневной летальности. Системная тромболитическая терапия выполнялась в 11,3% случаях, селективный транскатетерный тромболизис в 24,5% случаях. Из 33 пациентов, данные которых оказались доступны, очные амбулаторные приемы посетили 23 (69,7%) пациента. Еще 10 (30,3%) пациентов были опрошены при телефонном контакте. Онкоскрининг был рекомендован 36 (73,5%) пациентам, при этом только в четверти случаев рекомендация была выполнена и у одного больного выявлен папиллярный рак щитовидной железы. Обследование на протромботические состояния рекомендовалось 20 (40,8%) пациентам, его прошли 12 (60,0%) больных, у 5 (41,6%) из которых были обнаружены наследственные тромбофилии. После выписки 15 (30,6%) пациентов выполнили контрольное эхокардиографическое исследование, и 8 (16,3%) пациентов повторную мультиспиральную компьютерную ангиопульмонографию. В двух случаях была констатирована хроническая тромбоэмболическая болезнь легких, у одного больного подтверждена хроническая тромбоэмболическая легочная гипертензия. При выписке 30 (61,2%) пациентам назначались прямые оральные антикоагулянты, 15 (30,5%) — антагонисты витамина К, 4 (8,2%) — низкомолекулярный гепарин. Медиана длительности приема антикоагулянтов составила 22 [7,5; 31,5] мес., при этом 20 (69,0%) пациентов получали антикоагулянты >12 мес. Кровотечения на амбулаторном этапе отмечались у 4 (13,8%) пациентов, и все относились к малым по классификации Международного общества по тромбозу и гемостазу (ISTH). Не было отмечено ни одного рецидива тромбоза глубоких вен и/или ТЭЛА. После выписки зарегистрировано 3 (6,1%) летальных исхода, причины которых неизвестны. Годичная выживаемость составила 88%.
Заключение. Наблюдается недостаточная приверженность пациентов в отношении рекомендаций при выписке и низкая преемственность стационарного и амбулаторного этапов в лечении пациентов с легочной эмболией. Требуется дальнейшее внедрение алгоритма амбулаторного ведения пациентов после ТЭЛА, который позволит принимать решения об антикоагулянтной терапии и эффективно и своевременно выявлять последствия перенесенной легочной эмболии.
Ключевые слова
Для цитирования:
Пархоменко С.И., Симакова М.А., Моисеева О.М. Долгосрочное наблюдение пациентов с тромбоэмболией легочной артерии высокого и промежуточного риска летального исхода. Российский кардиологический журнал. 2025;30(9):6354. https://doi.org/10.15829/1560-4071-2025-6354. EDN: WKGXPL
For citation:
Parkhomenko S.I., Simakova M.A., Moiseeva O.M. Long-term follow-up of patients with highand intermediate-risk pulmonary embolism. Russian Journal of Cardiology. 2025;30(9):6354. (In Russ.) https://doi.org/10.15829/1560-4071-2025-6354. EDN: WKGXPL
Тромбоэмболия легочной артерии (ТЭЛА) ассоциирована с высокой заболеваемостью и смертностью, что делает эту патологию весомой составляющей глобального бремени болезней — интегрального показателя здоровья населения, обобщающего количество потерянных лет жизни в результате преждевременной смерти и лет, прожитых с инвалидностью [1]. В настоящее время отмечается тенденция увеличения заболеваемости легочной эмболией [2][3], что, с одной стороны, связано с повышением доли пожилых людей в популяции [2], а с другой стороны, с внедрением в клиническую практику алгоритмов диагностики и более широким использованием визуализирующих исследований [4].
Несмотря на совокупное снижение показателей смертности, связанной с ТЭЛА [5], постгоспитальный прогноз таких пациентов продолжает оставаться серьезным. Каждый пятый пациент, перенесший легочную эмболию, умирает в течение первого года после выписки [6], и этот показатель мало изменяется с течением времени. Так, по данным Ng AC, et al., в течение 7 лет наблюдавших 1023 пациента, перенесших ТЭЛА, кумулятивные показатели смертности за 1 год, 3 года и 5 лет составили 16,3%, 26,7% и 31,6%, соответственно [7]. Эти данные соответствуют результатам наблюдательного немецкого регистра пациентов с ТЭЛА, в котором показатели летальности за 1, 3 и 5 лет составили 19,7%, 30,1% и 37,1% [1].
Важно отметить, что перенесенная легочная эмболия может приводить к долгосрочным неблагоприятным последствиям, связанным с развитием посттромбоэмболического синдрома, осложнениями проводимой антикоагулянтной терапии, сохраняющимся эмоциональным стрессом и тревогой, ассоциированными с долгосрочной нетрудоспособностью пациентов [8]. Все эти данные подчеркивают необходимость наблюдения больных после выписки и важность преемственности в работе стационара и амбулаторного звена.
Несмотря на то, что современные руководства все больше внимания уделяют амбулаторному ведению пациентов, перенесших легочную эмболию [2][9][10], большинство научно обоснованных рекомендаций ограничены специфическими когортами пациентов. Это связано с тем, что наблюдательные исследования в основном затрагивали отдельные выборки больных: пациентов, получивших определенный вид терапии [11], пациентов той или иной категории риска летального исхода [12], пациентов пожилого возраста [13] или больных со злокачественными новообразованиями (ЗНО) [14]. В связи с этим особый интерес представляют регистровые исследования, обобщающие результаты реальной клинической практики, включая этап амбулаторного ведения больных.
Целью настоящего исследования было изучение результатов долгосрочного наблюдения пациентов с ТЭЛА промежуточного и высокого риска тридцатидневной летальности.
Материал и методы
В ретроспективное исследование включались пациенты, госпитализированные в отделения анестезиологии и реанимации кардиологического профиля ФГБУ "НМИЦ им. В. А. Алмазова" с 2019 по 2020гг. Были проанализированы данные медицинской информационной системы с поиском больных по коду международной классификации болезней (МКБ) 10 (I26) основного диагноза и отделению за указанный период времени. Критериями включения в исследование были: возраст старше 18 лет, диагноз ТЭЛА высокого и промежуточного риска тридцатидневной летальности (МКБ I26), поставленный согласно клиническим рекомендациям Европейского общества кардиологов [2]. Из информационной медицинской системы было извлечено 85 историй болезни, для окончательного анализа в соответствии с критериями были отобрано 53 пациента (рис. 1).
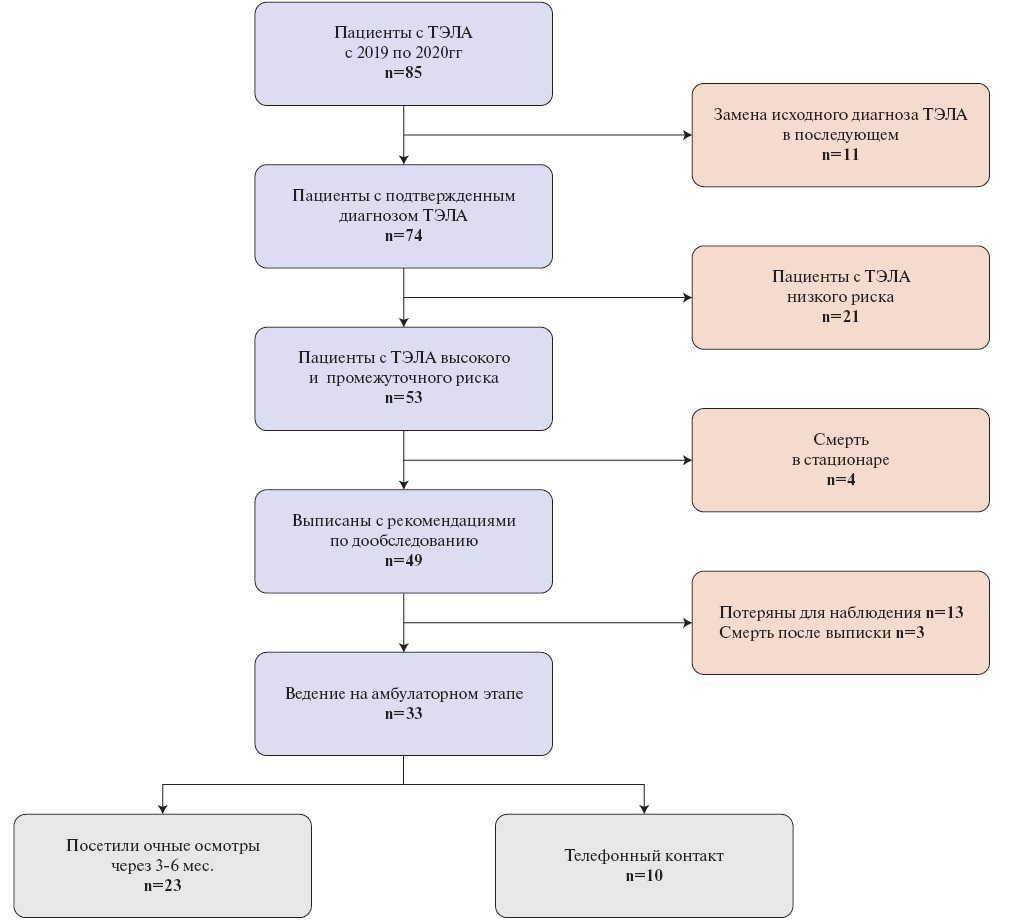
Рис. 1. Дизайн исследования.
Сокращение: ТЭЛА — тромбоэмболия легочной артерии.
Лечение острой ТЭЛА в каждой подгруппе пациентов проводилось в соответствии с текущими клиническими рекомендациями [2]. Средний период наблюдения пациентов составил 20,9 [ 4,0; 33,5] мес., максимальный период наблюдения — 60 мес. Данные были получены из медицинской информационной системы, а также посредством телефонных звонков. В анализе использованы следующие клинические характеристики включенных в исследование пациентов: персональные данные (пол, возраст), имеющиеся факторы риска ТЭЛА, источник ТЭЛА (тромбозы глубоких вен (ТГВ) и тромбозы иных локализаций), симптомы при поступлении и их длительность от момента возникновения до постановки диагноза, группа риска 30-дневной летальности ТЭЛА, проведенное в стационаре лечение, сопутствующая патология, вид, дозы и длительность антикоагулянтной терапии после эпизода ТЭЛА, осложнения, рецидивы ТГВ/ТЭЛА и геморрагические события на амбулаторном этапе, проведенное после выписки наблюдение и дообследование, летальные исходы и их причины. Диагнозы хронической тромбоэмболической легочной гипертензии и хронической тромбоэмболической болезни легких были переоценены и выставлялись в соответствии с рекомендациями Министерства здравоохранения по ведению пациентов с легочной гипертензией [15]. Исследование выполнено в соответствии со стандартами надлежащей клинической практики (Good Clinical Practice) и принципами Хельсинкской декларации. Протокол исследования одобрен локальным этическим комитетом (№ 1511-23 от 27.11.2023). До включения в исследование у всех участников было получено письменное информированное согласие.
Статистическая обработка выполнялась в программе SPSS 23 (version 23.0 (21.05.2021), IBM® SPSS® Statistics (США). Дескриптивные характеристики с распределением отличным от нормального представлены в виде медианы и межквартильного интервала — МЕД [ 25%; 75%], нормальные показатели описывались как среднее ± стандартное отклонение — СРЕД±СО. Качественные данные представлены в виде частот — в абсолютном количестве и в процентах — n (%). Для построения функций выживаемости использовался метод Каплана-Майера, сравнение выживаемости групп выполнялось log-rank тестом, проверка статистических гипотез проводилась при уровне значимости р=0,05, нижняя граница доказательной мощности 80%.
Результаты
Госпитальный этап
В ретроспективный анализ включено 53 пациента (45,3% мужчины), 7 (13,2%) пациентов относились к категории высокого, 29 (54,7%) — к категории промежуточно-высокого и 17 (32,1%) — к категории промежуточно-низкого риска 30-дневной летальности. Среднее время от возникновения симптомов до постановки диагноза составило 2,8 [ 0; 3,0] дня. При поступлении в качестве симптомов у большинства пациентов имелась одышка — в 83% (n=44) случаев, боль в грудной клетке присутствовала в 34% (n=18), синкопальное состояние в 17% (n=9), кашель в 9,4% (n=5), боль в нижних конечностях в 7,5% (n=4) случаев. ТЭЛА у 4 пациентов имела бессимптомное течение и была выявлена по результатам мультиспиральной компьютерной ангиопульмонографии (МСКТ-АПГ), выполненной при обследовании в рамках иной нозологии. В 29 (54,7%) случаях ТЭЛА сочеталась с ТГВ. У одной пациентки с текущей беременностью был обнаружен атипичный источник тромбоза с поражением вен параметрия.
С учетом ретроспективного характера исследования оценка факторов риска развития венозных тромбозов оказалась затруднена. Из больших факторов риска можно выделить рецидивирующие венозные тромбоэмболические осложнения (ВТЭО) (17%), оперативное лечение под общей анестезией в течение >30 мин (5,7%), инфаркт миокарда в предшествующие 3 мес. (3,8%), госпитализацию по причине фибрилляции предсердий в предшествующие 3 мес. (1,9%). 7 (13,2%) пациентов на момент госпитализации с ТЭЛА имели ЗНО, при этом в 3 случаях онкологический процесс был в активной фазе. Из факторов низкого риска наиболее часто встречались старший возраст (88,7%, n=44), артериальная гипертензия (69,8%, n=37), сахарный диабет (18,9%, n=10), ожирение (22,6%, n=12), беременность (3,8%, n=2). Стандартный подход с использованием консервативной антикоагулянтной терапии применялся в 34 (64,2%) случаях. 6 (11,3%) пациентам проводилась системная тромболитическая терапия. Селективный транскатетерный тромболизис сниженными дозами тромболитика выполнен у 13 (24,5%) больных с последующим переходом на пероральные антикоагулянтные препараты. Один пациент высокого риска имел инсульт по геморрагическому типу, что ограничило применение тромболитической терапии.
Внутригоспитальная летальность составила 7,5% (n=4), при этом 3 пациента относились к категории высокого риска и во всех случаях причиной смертельного исхода стала ТЭЛА. Одна смерть на стационарном этапе зарегистрирована в группе промежуточно-низкого риска по причине полиорганной недостаточности на фоне терминальной стадии ЗНО яичников.
Кровотечения на стационарном этапе встречались в 15 (28,3%) случаях. Большие кровотечения согласно классификации Европейского общества по тромбозу и гемостазу [16] имели место в 5 (9,4%) случаях.
Общая длительность наблюдения в условиях отделения анестезиологии и реанимации составила 2 [ 2; 4] дня, длительность стационарного лечения — 12 [ 10,5; 16] дней.
Амбулаторный этап лечения
После завершения стационарного лечения 49 пациентов были выписаны с рекомендациями по дообследованию и обращению на амбулаторный прием через 3-6 мес. после эпизода ТЭЛА. Из всех пациентов 32,7% оказались потеряны для дальнейшего наблюдения в ФГБУ "НМИЦ им. В. А. Алмазова" после выписки из стационара. Из 33 пациентов, данные которых оказались доступны, очные амбулаторные приемы посетили 23 (69,7%) пациента. Еще 10 (30,3%) пациентов были опрошены при телефонном контакте, выполненном на момент проведения настоящего исследования.
С учетом возраста (старше 50 лет) и отсутствия больших транзиторных факторов риска 36 (73,5%) пациентам при выписке был рекомендован онкоскрининг на амбулаторном этапе. Очный амбулаторный прием из проанализированных нами больных посетили 19 (57,6%), но только 9 из них выполнили рекомендованный объем обследования на предмет наличия ЗНО. В ходе этого обследования в 1 случае был выявлен папиллярный рак щитовидной железы.
Обследование на протромботические состояния при выписке рекомендовано 20 (40,8%) пациентам. Показаниями для дообследования были молодой возраст (<50 лет) на момент эпизода ТЭЛА, рецидивирующее течение ВТЭО, ТЭЛА при отсутствии идентифицированного фактора риска в сочетании с семейным анамнезом ВТЭО. Обследование прошли 12 (60,0%) пациентов, у 5 (41,6%) пациентов были обнаружены наследственные тромбофилии — в 4 случаях тромбофилии низкого риска ВТЭО (у 3 пациентов гетерозиготное носительство мутации в гене протромбина (FII) и у одного — гетерозиготное носительство Лейденовской мутации (FV); в 1 случае — гомозиготное носительство мутации в гене FV, относящееся к категории высокого риска тромбоза. Скрининг на антифосфолипидный синдром был выполнен только у 5 пациентов и был отрицательный, оценка на активность антитромбина 3 и протеинов С, S проводилась у 5 пациентов и была в пределах нормальных значений.
Выполнение дообследования на предмет наличия посттромбоэмболического синдрома, включая проведение эхокардиографического исследования и МСКТ-АПГ, инициировалось врачом после амбулаторного осмотра пациента на сроке 3-6 мес. после ТЭЛА, согласно действующим клиническим рекомендациям и индивидуальному мнению врача-клинициста. 15 (30,6%) пациентов прошли контрольное эхокардиографическое исследование в связи с жалобами на одышку или снижение толерантности к физическим нагрузкам. В одном случае сохранялась перегрузка правого желудочка с увеличенным базальным размером при его сохранной систолической функции. Также у одного пациента имело место умеренное снижение систолической функции левого желудочка на фоне перенесенного ранее инфаркта миокарда. Гипертрофия левого желудочка и диастолическая дисфункция 1 типа встречались в 33,3% случаев, клапанная патология в обследованной группе пациентов не отмечалась. Повторную МСКТ-АПГ выполнили 8 (16,3%) пациентов, у 3 пациентов был выявлен резидуальный тромбоз легочной артерии. В 2 случаях была констатирована хроническая тромбоэмболическая болезнь легких, у 1 больного подтверждена хроническая тромбоэмболическая легочная гипертензия (ХТЭЛГ).
В качестве антикоагулянтных препаратов при выписке 30 (61,2%) пациентам назначались прямые оральные антикоагулянты (ПОАК). 15 больным (30,5%) был рекомендован прием антагонистов витамина К (АВК), в связи с выявлением наследственной тромбофилии, рецидивирующим течением ВТЭО, наличием тромбоза левого предсердия и подозрением на ХТЭЛГ (рис. 2). 4 пациентам (8,2%) при выписке в качестве антикоагулянтной терапии был назначен низкомолекулярный гепарин в дозе, рассчитанной на массу тела. Среди них были 2 пациентки с ТЭЛА на фоне текущей беременности и 2 пациента с активным ЗНО. Данные о длительности антикоагулянтной терапии с учетом умерших и потерянных для наблюдения пациентов оказались доступными у 29 больных. Медиана времени приема антикоагулянтов составила 22 [ 7,5; 31,5] мес. Помимо легочной эмболии 13% пациентов уже на этапе стационара имели иные показания для продолжения антикоагулянтной терапии. В течение 3 мес. антикоагулянтную терапию получали 28 (96,6%) пациентов, 6 мес. — 24 (82,8%) пациента, ≥12 мес. — 20 (69,0%) пациентов. Таким образом, только у 31% (n=9) пациентов антикоагулянтная терапия была полностью отменена. Во всех случаях отмена антикоагулянтной терапии проводилась после обследования и с разрешения врача. Смена антикоагулянтного препарата проводилась у 21% (n=6) пациентов. При этом в 4 случаях имел место переход с АВК на ПОАК, в 1 случае с низкомолекулярного гепарина на ПОАК и в 1 случае с ПОАК на АВК в связи с развитием у пациента ХТЭЛГ. Среди пациентов, получающих ПОАК (82,8%, n=24), у 31% пациентов была произведена замена лечебных доз на профилактические через 6 мес. от момента выписки. 4 пациента (13,8%) в рамках пролонгированной антикоагулянтной терапии получали АВК с коррекцией дозы по международному нормализованному отношению.
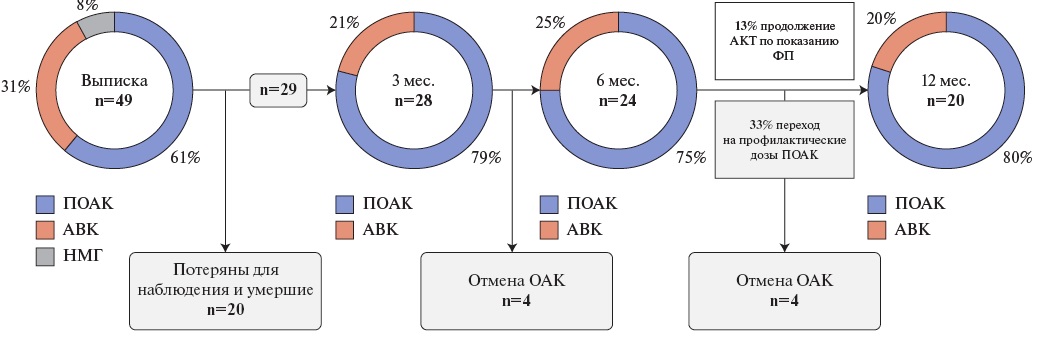
Рис. 2. Антикоагулянтная терапия на амбулаторном этапе.
Сокращения: АВК — антагонисты витамина К, АКТ — антикоагулянтная терапия, НМГ — низкомолекулярный гепарин, ОАК — оральные антикоагулянты, ПОАК — прямые оральные антикоагулянты, ФП — фибрилляция предсердий.
Кровотечения на фоне пролонгированной антикоагулянтной терапии отмечались у 4 (13,8%) пациентов. Все они относились к малым по классификации Международного общества по тромбозу и гемостазу (ISTH) [16] и типу 1 по классификации Исследовательского академического консорциума по кровотечениям (BARC) [17]. В наблюдаемой группе пациентов не было отмечено ни одного рецидива ТГВ и/или ТЭЛА.
После выписки зарегистрировано 3 (6,1%) летальных исхода, причины которых неизвестны. Годичная выживаемость в группе составила 88%.
Обсуждение
На каждом этапе ведения пациентов с ТЭЛА перед врачом-клиницистом стоят различные задачи. В остром периоде основная цель — стратификация риска ранней летальности с целью маршрутизации и выбора оптимальной стратегии лечения (монотерапия антикоагулянтами, системный или селективный тромболизис, механическая поддержка кровообращения и т.д.), что определяет прогноз больного. Так, по данным Eckelt J, et al., изучавших долгосрочную летальность 896 пациентов с острой ТЭЛА, смертность пациентов в первые 30 дней составила 8,7% [ 7,0; 10,7], при этом 50% умерших пациентов имели гемодинамическую нестабильность при поступлении [1]. Аналогичные данные получены и в нашем исследовании: внутригоспитальная летальность пациентов высокого риска была ассоциирована исключительно с ТЭЛА и составила 42,9% в данной подгруппе. Одной из возможностей снижения смертности пациентов высокого риска летальности является оптимизация их маршрутизации в центры с большим потоком данных больных, имеющих все современные опции лечения, включая транскатетерные технологии, экстракорпоральную мембранную оксигенацию и открытую эмболэктомию. Так, по данным Jiménez D, et al., проанализировавших многолетний опыт работы 353 стационаров в 16 странах и обобщивших результаты стационарного лечения 39257 пациентов с ТЭЛА, было показано, что госпитализация больного в высокопотоковый центр (>40 ТЭЛА в год) ассоциирована со снижением 30-дневной летальности на 44% (отношение шансов (ОШ) 0,56, р=0,03) [18]. Важной составляющей работы подобного центра является наличие команды, принимающей оперативное персонализированное решение в отношении каждого больного. Эта стратегия, активно внедряется американскими коллегами под обобщающим термином — pulmonary embolism response teams (PERTs). В работе Carroll BJ, et al. подведен итог внедрения данного подхода. По результатам проанализированных данных использование системного тромболизиса уменьшилось с 3,8% (до внедрения PERT) до 2,1% (после внедрения PERT), р=0,02. При этом отмечалось увеличение доли транскатетерных технологий в лечении пациентов с ТЭЛА — 1,3% до внедрения PERT против 3,3% после внедрения PERT, р=0,05 [19]. Исследователи не обнаружили разницы в смертности, частоте кровотечений, средней продолжительности стационарного лечения и повторных госпитализаций между группами. Однако есть данные, позволяющие полагать, что использование стратегии PERT в сочетании с более широким распространением транскатетерных технологий снижает смертность пациентов с ТЭЛА. Так, Chaudhury P, et al. отметили значительное снижение 30-дневной/стационарной летальности (8,5% vs 4,7%, p=0,03) в группе пациентов со стратегией PERT. Эти различия были более выражены у пациентов с ТЭЛА промежуточного и высокого риска (смертность 10,0% vs 5,3%, p=0,02) [20]. В другой работе британских коллег не было продемонстрировано различий в выживаемости пациентов, однако было отмечено снижение длительности стационарного пребывания (9,22 vs 6,31 дней, р<0,005) и нахождения в отделении анестезиологии и реанимации (6,86 vs 4,4 дней, р<0,005) в группе пациентов со стратегией PERT [21].
Следующим и не менее важным в отношении прогноза пациента с ТЭЛА является амбулаторный этап обследования и лечения [2][9][22]. Основными целями амбулаторного ведения пациентов являются принятие решения о сроках, виде и дозах антикоагулянтной терапии, мониторинг переносимости препаратов, оценка сохраняющихся факторов риска ВТЭО и геморрагических рисков, скрининг и выявление последствий ТЭЛА, таких как посттромбоэмболический синдром и его крайняя форма — хроническая тромбоэмболическая легочная гипертензия [9]. Позиция современных руководств заключается в том, что продолжительность антикоагуляции должна основываться на оценке у больного провоцирующих факторов риска ТЭЛА и возможности их коррекции (понятие транзиторных и персистирующих факторов риска ТЭЛА), а решение о продолжении и объеме антикоагулянтной терапии сверх периода 3 мес. принимается на основе предполагаемого риска рецидива при прекращении лечения антикоагулянтами [2][10][23][24]. Так, по данным обзора Iorio A, et al., самый высокий риск рецидива имел место у пациентов с неспровоцированными ВТЭО, он был в 2,5 раза выше, чем у всех пациентов с ВТЭО, спровоцированными преходящим фактором риска, и в 7 раз выше, чем у пациентов с венозными тромбозами на фоне хирургических вмешательств [25]. В реестре COMMAND VTE показано, что после прекращения антикоагулянтной терапии кумулятивная трёхлетняя частота рецидивирующей венозной тромбоэмболии была самой низкой в группе пациентов с обратимыми факторами риска (6,1% vs 15,3% при неспровоцированных ВТЭО и 13,2% при рак-ассоциированных тромбозах, р=0,001) [26]. В связи с этим у пациентов с ТЭЛА, спровоцированной большим транзиторным фактором риска, рекомендована отмена антикоагулянтов через 3-6 мес. [2]. Примерами таких факторов могут служить хирургические вмешательства под общей анестезией продолжительностью >30 мин, строгий постельный режим в стационаре как минимум в течение 3 дней, перенесенное кесарево сечение и др. В нашем исследовании с учетом ретроспективной оценки большие транзиторные факторы риска имели 4 пациента, что позволило через 3-6 мес. отменить антикоагулянтную терапию у этих больных.
Одним их главных персистирующих факторов риска рецидива венозных тромбозов, а также ведущей причиной смертности пациентов с ТЭЛА после выписки являются онкологические заболевания. Так, Eckelt J, et al., указывают, что ЗНО на момент постановки диагноза ТЭЛА представляют собой самый сильный предиктор летальности в течение первых 3 лет после ТЭЛА (ОШ 3,76 (2,95-4,80)) [1]. Важно отметить, что легочная эмболия может быть первым проявлением латентно протекающих неоплазий [27]. По данным Pandit V, et al., проанализировавших 116048 пациентов, частота впервые выявленных онкологических заболеваний в течение 6 мес. после ВТЭО составила 2,4% [28], а в систематическом обзоре Carrier M, et al. частота выявления ЗНО в течение 12 мес. после ВТЭО достигала 10% (95% доверительный интервал (ДИ): 8,6-11,3%) [29]. Все это актуализирует необходимость проведения онкоскрининга у пациентов после перенесенной ТЭЛА при отсутствии больших транзиторных факторов риска, особенно, в группах повышенного риска. Исследователями предпринималось несколько попыток создать модели прогнозирования наличия латентного онкологического заболевания у пациентов с ТЭЛА. Так, на основе регистра RIETE, Jara-Palomares L, et al. предложили одноименную шкалу риска скрытого ЗНО, включающую в себя 7 характеристик: мужской пол, возраст >70 лет, хронические заболевания легких, анемию, повышенное количество тромбоцитов, предшествующие ВТЭО и недавнее оперативное вмешательство [30]. Ihaddadene R, et al., проанализировав данные 854 пациентов с легочной эмболией, предложили использовать возраст ≥60 лет, предшествующее спровоцированное ВТЭО и курение в качестве факторов, увеличивающих вероятность наличия онкологического заболевания [31]. Ferreyro BL, et al. разработали модель прогнозирования латентного онкологического заболевания, основанную на трех признаках: эпизод ВТЭО в анамнезе, недавнее оперативное вмешательство и сопутствующая патология (индекс коморбидности Чарлсона ≥2) [32]. Однако, согласно недавно проведенному метаанализу, шкалы RIETE [30] и SOME [31] показали низкую предиктивную способность [33]. Авторы предполагают, что этот результат объясняется большим числом вариантов выявленных ЗНО, что может объяснять низкую специфичность шкал в такой популяции и актуализирует поиск новых биомаркеров для прогнозирования наличия ЗНО.
В настоящее время существуют две стратегии скрининга на предмет ЗНО после перенесенного эпизода ВТЭО: базовый скрининг, куда относятся сбор анамнеза, физикальное обследование, основные анализы крови, органоспецифические тесты (половые онкомаркеры, рентген органов грудной клетки и пр.), и расширенный скрининг, включающий в себя мультиспиральную компьютерную томографию (МСКТ) грудной клетки или позитронно-эмиссионную томографию, МСКТ брюшной полости и малого таза, фиброгастродуоденоскопию, колоноскопию и т.д. [34]. В литературе обсуждается отсутствие значимого преимущества расширенного скрининга в отношении клинической пользы и улучшения прогноза пациентов. Так, по данным Van Doormaal FF, et al. в группе расширенного скрининга подозрение на ЗНО возникло у 17,0% пациентов в ходе базовых процедур скрининга, при этом в группе ограниченного скрининга сопоставимая доля пациентов (19,4%) имела подозрение на ЗНО, р=0,42 [35]. Диагноз был подтвержден у 3,5% пациентов в группе расширенного скрининга и у 2,4% в группе базового скрининга (ОШ 1,56 (0,53-4,55)), типы ЗНО и предполагаемый прогноз были сопоставимы между двумя группами. Carrier M, et al., изучающие преимущества дополнительного использования МСКТ брюшной полости и малого таза в рамках скрининга ЗНО, выявили сопоставимое число диагностированных случаев онкологического заболевания при базовом и расширенном обследовании (3,2% в группе базового скрининга vs 4,5% в группе базового скрининга + МСКТ, р=0,28), при этом не было никакой существенной разницы между двумя исследуемыми группами в среднем времени до постановки диагноза или в смертности, ассоциированной с ЗНО [36].
В нашем исследовании лишь 42,1% пациентов выполнили рекомендованное дообследование на предмет ЗНО с выявлением 1 случая папиллярного рака щитовидной железы, что свидетельствует о низкой приверженности пациентов к рекомендациям и требует особого внимания врачей стационаров, формулирующих выписной эпикриз с перечнем дообследования.
Другим персистирующим немодифицируемым фактором риска рецидивирующих ВТЭО является наличие врожденных или приобретенных тромбофилий. В соответствии с вероятностью развития ВТЭО выделяют тромбофилии высокого (дефицит антитромбина, комбинированная наследственная тромбофилия, гомозиготная мутация FV или FII G20210A, антифосфолипидный синдром, гомозиготный дефицит протеина С или S), умеренного (гетерозиготный дефицит протеина С или S) и низкого (гетерозиготная мутация FV или FII G20210A) риска венозного тромбоза. Показания для скрининга на тромбофилии достаточно четко регламентированы в современных руководствах [9][37][38] и основываются на том, изменят ли результаты тестирования решение о типе, дозировке или продолжительности антикоагулянтной терапии или тактику ведения в отношении оральной контрацепции или беременности. Важно отметить, что оптимальным временем тестирования на большинство тромбофилий является 3-6 мес. после эпизода острого тромбоза, когда возможна временная отмена антикоагулянта для получения репрезентативного результата лабораторного теста [38]. Спектр показаний для рекомендаций тестирования на тромбофилии представляется сложным оценить ретроспективно. Очевидно, что в нашем исследовании скрининг был неполный и в большинстве случаев включал только генетический анализ на мутации FV или FII G20210A. Тем не менее он позволил выявить 4 случая тромбофилий низкого риска ВТЭО (гетерозиготное носительство мутации FII и FV) и 1 случай тромбофилии высокого риска венозного тромбоза (гомозиготное носительство мутации FV). Решение о пролонгации или отмене антикоагулянтной терапии в данной когорте пациентов принималось лечащими врачами индивидуально в зависимости от наличия или отсутствия иных факторов риска, рецидивирующих ВТЭО в анамнезе, типе тромбофилии и предпочтениях пациента.
Отдельной группой для наблюдения является неспровоцированная ТЭЛА (частота варьирует от 16,5% до 69%), когда провоцирующий фактор не удалось идентифицировать [39][40]. Есть данные, позволяющие полагать, что использование пролонгированной антикоагуляции позволит получить клиническую пользу у таких больных. Так, по результатам исследования PADIS-PE, среди пациентов с первым эпизодом неспровоцированной ТЭЛА, дополнительные 18 мес. лечения АВК снижали риски рецидивирующей венозной тромбоэмболии (отношение рисков 0,15; 95% ДИ: 0,05-0,43) [41]. Это подтверждается и в обсервационном анализе Chopard R, et al., где пациенты, получавшие антикоагулянтную терапию в течение 2,5 лет после перенесенной ТЭЛА, имели более низкий риск смерти от всех причин или рецидива ВТЭО по сравнению с пациентами с ограниченной антикоагуляцией (2,1% (95% ДИ: 1,2-3,5) vs 7,7% (95% ДИ: 4,8-12,1)) [42].
В связи с ретроспективным характером оценки в нашем исследовании не удалось определить истинную частоту неспровоцированной ТЭЛА, при этом отмечен высокий процент пациентов, получавших антикоагулянтную терапию более года — 69%, при этом лишь 13% из них имели дополнительные показания для приема антикоагулянтов (тромбы в полостях сердца и фибрилляция предсердий). По результатам отечественного исследования Тереховской Ю. В. и др. получены аналогичные результаты: 89,9% пациентов продолжали прием антикоагулянтных препаратов >12 мес. [43]. Важно подчеркнуть, что принятие решения об отмене антикоагулянтной терапии возможно только при очном амбулаторном приеме, в рамках которого проводится оценка достаточности и качества обследования, который в нашем исследовании посетили <50% пациентов, что может объяснить необоснованно долгий прием антикоагулянтов.
При этом длительная антитромботическая терапия безусловно ассоциирована с многократно возрастающими рисками геморрагических событий и смертность от большого кровотечения может оказаться выше смертности от рецидива ВТЭО [44]. Так, по данным систематического обзора Khan F, et al., показатель летальности при крупных кровотечениях у пациентов, получающих длительную антикоагулянтную терапию по поводу первого неспровоцированного ВТЭО, составил 8,3% (ДИ: 5,1-12,2) при применении АВК и 9,7% (ДИ: 3,2-19,2) при применении ПОАК [45]. Lecumberri R, et al., проанализировавшие данные пациентов, включенных в регистр RIETE, показали, что в первые 3 мес. лечения коэффициенты смертности от рецидива ВТЭО и большого кровотечения оказались сопоставимы — 16,1% (95% ДИ: 13,6-18,9) и 20,2% (95% ДИ: 17,5-23,1), соответственно [46]. Однако при расширении сроков наблюдения за пределы 3 мес. коэффициент смертности от ВТЭО снижался до 2,0% (95% ДИ: 0-4,2), в то время как летальность пациентов от больших кровотечений оставалась схожей — 18,2% (95% ДИ: 14,0-23,2).
В нашем исследовании получены благоприятные данные в отношении частоты кровотечений — большие кровотечения не встречались, а малые имели место у 4 (13,8%) пациентов и не требовали какой-либо дополнительной медицинской помощи, при условии, что большинство пациентов (69,2%), принимающих ПОАК, продолжали прием препаратов в лечебной дозе.
Одним из важных аспектов ведения пациентов после перенесенной ТЭЛА является оценка наличия посттромбоэмболического синдрома, под которым понимают новую или прогрессирующую одышку, непереносимость физических нагрузок и/или нарушенное функциональное или психическое состояние после как минимум 3 мес. адекватной антикоагуляции после ТЭЛА, которое не может быть объяснено другими заболеваниями [9]. В исследовании FOCUS впервые предложены четкие критерии для его постановки, включающие в себя группу клинико-лабораторных и эхокардиографических данных (табл. 1) [47]. В нашем исследовании в период амбулаторного наблюдения пациенты имели жалобы на одышку, снижение переносимости физической нагрузки, общую слабость, что и стало в большинстве случаев поводом обращения к врачу. Симптомностью пациентов, по всей видимости, объясняется высокий процент выполнения МСКТ-АПГ на амбулаторном этапе (16,3%).
Таблица 1
Параметры, используемые для определения посттромбоэмболического синдрома
(адаптировано из Valerio L, et al. [47])
|
Нормальный или легкий/слабый |
Умеренный |
Тяжелый/высокий |
|
|
Эхокардиографические (‘a’) параметры |
|||
|
(a1) Базальный диаметр ПЖ (альтернатива — соотношение ПЖ/ЛЖа или диаметр ВТПЖb) |
≤4,2 см |
>4,2 см |
|
|
(a2) Конечно-систолическая площадь ПП |
≤18 см² |
>18 см² |
|
|
(a3) TAPSE |
≥1,6 см |
<1,6 см |
|
|
(a4) Индекс эксцентричности ЛЖ (альтернатива — парадоксальное движение межжелудочковой перегородкис) |
≤1,0 |
>1,0 |
|
|
(a5) Расчетное давление в ПП |
диаметр нижней полой вены ≤2,1 см + коллабирование ее на вдохе >50% (соответствует примерно 0-5 мм рт.ст.) |
диаметр нижней полой вены ≤2,1 см + коллабирование ее на вдохе <50%; ИЛИ диаметр нижней полой вены >2,1 см + коллабирование ее на вдохе >50% (соответствует примерно 10 мм рт.ст.) |
диаметр нижней полой вены >2,1 см + коллабирование ее на вдохе <50% |
|
(a6) Систолическая скорость трикуспидальной регургитации |
<2,8 м/с |
2,9-3,4 м/с |
>3,4 м/с |
|
(a7) Перикардиальный выпот |
нет |
да |
|
|
Клинические, функциональные и лабораторные ("б") параметры |
|||
|
(b1) Прогрессирование имеющихся симптомов |
нет |
да |
|
|
(b2) Клинические признаки ПЖ недостаточности |
нет |
да |
|
|
(b3) Синкопе |
нет |
да |
|
|
(b4) Функциональный класс по ВОЗ |
I или II |
III или IV |
|
|
(b5) Расстояние, пройденное в тесте 6-минутной ходьбы |
>500 м |
300-500 м |
<300 м |
|
(b6) Уровни BNP или NT-proBNP в плазме |
BNP <50 нг/л или NT-proBNP<300 нг/л |
BNP 50-300 нг/л или NT-proBNP 300-1400 нг/л |
BNP >300 нг/л или NT-proBNP >1400 нг/л |
|
(b7) Кардиопульмональное нагрузочное тестированиеd (пиковое потребление O2 и систолическое АД) |
>64,5% и >120 мм рт.ст. или >64,5% и ≤120 мм рт.ст. или 46,3-64,5% и >120 мм рт.ст. |
46,3-64,5% и ≤120 мм рт.ст. или 34,1-46,3% и >120 мм рт.ст. или 34,1-46,3% и ≤120 мм рт.ст. |
<34,1% и >120 мм рт.ст. или <34,1% и ≤120 мм рт.ст. |
Примечание: а — нормальное: <1,0; умеренное/тяжелое: >1,0; b — нормальное: ≤35 мм; повышенное: >35 мм; с — отсутствие парадоксального движения перегородки считалось эквивалентным индексу эксцентричности ЛЖ 1,0; d — пиковое потребление O2 в процентах от должного; систолическое артериальное давление, измеренное на пике нагрузки. Диагноз посттромбоэмболического синдрома устанавливается при ухудшении по сравнению с предыдущим визитом/выпиской по крайней мере на одну категорию или сохранении высшей категории тяжести по ≥1 из параметров "a" и ≥1 из параметров "b". Для трехуровневых параметров "a" или "b" наивысшей категорией тяжести была та, которая определялась как "тяжелая/высокая"; для двухуровневых параметров это была категория "умеренная или тяжелая/высокая".
Сокращения: АД — артериальное давление, ВОЗ — Всемирная организация здравоохранения, ВТПЖ — выходной тракт правого желудочка, ЛЖ — левый желудочек, ПЖ — правый желудочек, ПП — правое предсердие, BNP — мозговой натрийуретический пептид, NT-proBNP — N-концевой промозговой натрийуретический пептид, TAPSE — максимальная амплитуда систолического смещения латеральной части трикуспидального кольца.
Заключение
Таким образом, наблюдается недостаточная приверженность пациентов в отношении рекомендаций при выписке и низкая преемственность стационарного и амбулаторного этапов в лечении пациентов с легочной эмболией. Требуется дальнейшее внедрение алгоритма амбулаторного ведения пациентов после ТЭЛА, который позволит принимать решения о длительности антикоагулянтной терапии и эффективно и своевременно выявлять последствия перенесенной легочной эмболии.
Отношения и деятельность. Работа выполнена в рамках государственного задания № 056-000081-25-00 от 01.01.2025 "Разработка метода транскатетерной реперфузионной терапии с использованием низких доз тромболитического препарата у пациентов с острой тромбоэмболией легочной артерии промежуточного-высокого риска".
Список литературы
1. Eckelt J, Hobohm L, Merten MC, et al. Long-term mortality in patients with pulmonary embolism: results in a single-¬center registry. Res Pract Thromb Haemost. 2023;7(5): 100280. doi:10.1016/j.rpth.2023.100280.
2. Konstantinides SV, Meyer G, Becattini C, et al. 2019 ESC Guidelines for the diagnosis and management of acute pulmonary embolism developed in collaboration with the European Respiratory Society (ERS). Eur Heart J. 2020;41(4):543-603. doi:10.1093/eurheartj/ehz405.
3. Raskob GE, Angchaisuksiri P, Blanco AN, et al. Thrombosis: a major contributor to global disease burden. Arterioscler Thromb Vasc Biol. 2014;34(11):2363-71. doi:10.1161/ATVBAHA.114.304488.
4. Sharma S, Lucas CD. Increasing use of CTPA for the investigation of suspected pulmonary embolism. Postgrad Med. 2017;129(2):193-7. doi:10.1080/00325481.2017.1281084.
5. Barco S, Mahmoudpour SH, Valerio L, et al. Trends in mortality related to pulmonary embolism in the European Region, 2000-15: analysis of vital registration data from the WHO Mortality Database. Lancet Respir Med. 2020;8(3):277-87. doi:10.1016/S22132600(19)30354-6.
6. Bikdeli B, Wang Y, Jimenez D, et al. Pulmonary Embolism Hospitalization, Readmission, and Mortality Rates in US Older Adults, 1999-2015. JAMA. 2019;322(6):574-6. doi:10.1001/jama.2019.8594.
7. Ng AC, Chung T, Yong AS, et al. Long-term cardiovascular and noncardiovascular mortality of 1023 patients with confirmed acute pulmonary embolism. Circ Cardiovasc Qual Outcomes. 2011;4(1):122-8. doi:10.1161/CIRCOUTCOMES.110.958397.
8. Sista AK, Klok FA. Late outcomes of pulmonary embolism: The post-¬PE syndrome. Thromb Res. 2018;164:157-62. doi:10.1016/j.thromres.2017.06.017.
9. Klok FA, Ageno W, Ay C, et al. Optimal follow-up after acute pulmonary embolism: a position paper of the European Society of Cardiology Working Group on Pulmonary Circulation and Right Ventricular Function, in collaboration with the European Society of Cardiology Working Group on Atherosclerosis and Vascular Biology, endorsed by the European Respiratory Society. Eur Heart J. 2022;43(3):183-9. doi:10.1093/eurheartj/ehab816.
10. Stevens SM, Woller SC, Kreuziger LB, et al. Antithrombotic Therapy for VTE Disease: Second Update of the CHEST Guideline and Expert Panel Report. Chest. 2021;160(6):e545 e608. doi:10.1016/j.chest.2021.07.055.
11. Kong NW, Acosta M, Zahid A, et al. Long-¬Term Outcomes of Patients With Pulmonary Embolism Managed With Endovascular Therapies Compared to Medical Therapy. J Soc Cardiovasc Angiogr Interv. 2023;2(3):100602. doi:10.1016/j.jscai.2023.100602.
12. Matusov Y, Yaqoob M, Karumanchi A, et al. Long term recovery of right ventricular function after treatment of intermediate and high risk pulmonary emboli. Thromb Res. 2023;225:5762. doi:10.1016/j.thromres.2023.03.012.
13. Faller N, Limacher A, Méan M, et al. Predictors and Causes of Long-¬Term Mortality in Elderly Patients with Acute Venous Thromboembolism: A Prospective Cohort Study. Am J Med. 2017;130(2):198-206. doi:10.1016/j.amjmed.2016.09.008.
14. Farmakis IT, Barco S, Mavromanoli AC, et al. Performance Status and Long-¬Term Outcomes in Cancer-¬Associated Pulmonary Embolism: Insights From the Hokusai-¬VTE Cancer Study. JACC CardioOncol. 2022;4(4):507-18. doi:10.1016/j.jaccao.2022.07.008.
15. Авдеев С.Н., Барбараш О.Л., Валиева З.С. и др. Легочная гипертензия, в том числе хроническая тромбоэмболическая легочная гипертензия. Клинические рекомендации 2024. Российский кардиологический журнал. 2024;29(11):6161. doi:10.15829/1560-4071-2024-6161.
16. Schulman S, Kearon C; Subcommittee on Control of Anticoagulation of the Scientific and Standardization Committee of the International Society on Thrombosis and Haemostasis. Definition of major bleeding in clinical investigations of antihemostatic medicinal products in non-surgical patients. J Thromb Haemost. 2005;3(4):692-4. doi:10.1111/j.1538-7836.2005.01204.x.
17. Mehran R, Rao SV, Bhatt DL, et al. Standardized bleeding definitions for cardiovascular clinical trials: a consensus report from the Bleeding Academic Research Consortium. Circulation. 2011;123(23):2736-47. doi:10.1161/CIRCULATIONAHA.110.009449.
18. Jiménez D, Bikdeli B, Quezada A, et al. Hospital volume and outcomes for acute pulmonary embolism: multinational population based cohort study. BMJ. 2019;366:l4416. doi:10.1136/bmj.l4416.
19. Carroll BJ, Beyer SE, Mehegan T, et al. Changes in Care for Acute Pulmonary Embolism Through A Multidisciplinary Pulmonary Embolism Response Team. Am J Med. 2020;133(11):1313-21. doi:10.1016/j.amjmed.2020.03.058.
20. Chaudhury P, Gadre SK, Schneider E, et al. Impact of Multidisciplinary Pulmonary Embolism Response Team Availability on Management and Outcomes. Am J Cardiol. 2019;124(9):1465-9. doi:10.1016/j.amjcard.2019.07.043.
21. Xenos ES, Davis GA, He Q, et al. The implementation of a pulmonary embolism response team in the management of intermediate- or high-risk pulmonary embolism. J Vasc Surg Venous Lymphat Disord. 2019;7(4):493-500. doi:10.1016/j.jvsv.2018.11.014.
22. Rivera-¬Lebron B, McDaniel M, et al. Diagnosis, Treatment and Follow Up of Acute Pulmonary Embolism: Consensus Practice from the PERT Consortium. Clin Appl Thromb Hemost. 2019;25:1076029619853037. doi:10.1177/1076029619853037.
23. Ortel TL, Neumann I, Ageno W, et al. American Society of Hematology 2020 guidelines for management of venous thromboembolism: treatment of deep vein thrombosis and pulmonary embolism. Blood Adv. 2020;4(19):4693-738. doi:10.1182/bloodadvances.2020001830.
24. Schulman S, Konstantinides S, Hu Y, et al. Venous Thromboembolic Diseases: Diagnosis, Management and Thrombophilia Testing: Observations on NICE Guideline [NG158]. Thromb Haemost. 2020;120(8):1143-6. doi:10.1055/s-0040-1712913.
25. Iorio A, Kearon C, Filippucci E, et al. Risk of recurrence after a first episode of symptomatic venous thromboembolism provoked by a transient risk factor: a systematic review. Arch Intern Med. 2010;170(19):1710-6. doi:10.1001/archinternmed.2010.367.
26. Yamashita Y, Morimoto T, Amano H, et al. Anticoagulation Therapy for Venous Thromboembolism in the Real World — From the COMMAND VTE Registry. Circ J. 2018;82(5): 1262-70. doi:10.1253/circj.CJ-17-1128.
27. Robertson L, Broderick C, Yeoh SE, et al. Effect of testing for cancer on cancer- or venous thromboembolism (VTE)-related mortality and morbidity in people with unprovoked VTE. Cochrane Database Syst Rev. 2021;10(10):CD010837. doi:10.1002/14651858.CD010837.pub5.
28. Pandit V, Kempe K, Hanna K, et al. Venous thromboembolism as the first sign of malignancy. J Vasc Surg Venous Lymphat Disord. 2022;10(6):1260-6. doi:10.1016/j.jvsv.2022.05.014.
29. Carrier M, Le Gal G, Wells PS, et al. Systematic review: the Trousseau syndrome revisited: should we screen extensively for cancer in patients with venous thromboembolism? Ann Intern Med. 2008;149(5):323-33. doi:10.7326/0003-4819-149-5-200809020-00007.
30. Jara-¬Palomares L, Otero R, Jimenez D, et al. Development of a Risk Prediction Score for Occult Cancer in Patients With VTE. Chest. 2017;151(3):564-71. doi:10.1016/j.chest.2016.10.025.
31. Ihaddadene R, Corsi DJ, Lazo-¬Langner A, et al. Risk factors predictive of occult cancer detection in patients with unprovoked venous thromboembolism. Blood. 2016;127(16): 2035-7. doi:10.1182/blood-2015-11-682963.
32. Ferreyro BL, Angriman F, Giunta D, et al. Predictive score for estimating cancer after venous thromboembolism: a cohort study. BMC Cancer. 2013;13:352. doi:10.1186/14712407-13-352.
33. Mulder FI, Carrier M, van Doormaal F, et al. Risk scores for occult cancer in patients with unprovoked venous thromboembolism: Results from an individual patient data metaanalysis. J Thromb Haemost. 2020;18(10):2622-8. doi:10.1111/jth.15001.
34. Селиверстов Е.И., Лобастов К.В., Илюхин Е.А. и др. Профилактика, диагностика и лечение тромбоза глубоких вен. Рекомендации российских экспертов. Флебология. 2023;17(3):152-296. doi:10.17116/flebo202317031152.
35. Van Doormaal FF, Terpstra W, Van Der Griend R, et al. Is extensive screening for cancer in idiopathic venous thromboembolism warranted? J Thromb Haemost. 2011;9(1):79-84. doi:10.1111/j.1538-7836.2010.04101.x.
36. Carrier M, Lazo-¬Langner A, Shivakumar S, et al. Screening for Occult Cancer in Unprovoked Venous Thromboembolism. N Engl J Med. 2015;373(8):697-704. doi:10.1056/NEJMoa1506623.
37. Middeldorp S, Nieuwlaat R, Baumann Kreuziger L, et al. American Society of Hematology 2023 guidelines for management of venous thromboembolism: thrombophilia testing. Blood Adv. 2023;7(22):7101-38. doi:10.1182/bloodadvances.2023010177.
38. Nicolaides AN, Fareed J, Spyropoulos AC, et al. Prevention and management of venous thromboembolism. International Consensus Statement. Guidelines according to scientific evidence. Int Angiol. 2024;43(1):1-222. doi:10.23736/S0392-9590.23.05177-5.
39. Pollack CV, Schreiber D, Goldhaber SZ, et al. Clinical characteristics, management, and outcomes of patients diagnosed with acute pulmonary embolism in the emergency department: initial report of EMPEROR (Multicenter Emergency Medicine Pulmonary Embolism in the Real World Registry). J Am Coll Cardiol. 2011;57(6):700-6. doi:10.1016/j.jacc.2010.05.071.
40. Gjonbrataj E, Kim JN, Gjonbrataj J, et al. Risk factors associated with provoked pulmonary embolism. Korean J Intern Med. 2017;32(1):95-101. doi:10.3904/kjim.2015.118.
41. Couturaud F, Sanchez O, Pernod G, et al. Six Months vs Extended Oral Anticoagulation After a First Episode of Pulmonary Embolism: The PADIS-PE Randomized Clinical Trial. JAMA. 2015;314(1):31-40. doi:10.1001/jama.2015.7046.
42. Chopard R, Albertsen IE, Ecarnot F, et al. Extended Anticoagulation After Pulmonary Embolism: A Multicenter Observational Cohort Analysis. J Am Heart Assoc. 2022;11(13): e024425. doi:10.1161/JAHA.121.024425.
43. Тереховская Ю.В., Ахмедова Н.Э., Леоненко Д.И. и др. Прогноз пациентов, перенесших тромбоэмболию легочной артерии, и факторы, его определяющие (результаты 12 месяцев наблюдения). Российский медико-¬биологический вестник имени академика И.П. Павлова. 2023;31(1):49-58. doi:10.17816/PAVLOVJ165196.
44. Walia A, Prasad V. Extended anticoagulation for VTE: what evidence justifies it? Front Pharmacol. 2023;14:1241979. doi:10.3389/fphar.2023.1241979.
45. Khan F, Tritschler T, Kimpton M, et al. Long-¬Term Risk for Major Bleeding During Extended Oral Anticoagulant Therapy for First Unprovoked Venous Thromboembolism: A Systematic Review and Meta-analysis. Ann Intern Med. 2021;174(10):1420-9. doi:10.7326/M21-1094.
46. Lecumberri R, Alfonso A, Jiménez D, et al. Dynamics of case-fatalilty rates of recurrent thromboembolism and major bleeding in patients treated for venous thromboembolism. Thromb Haemost. 2013;110(4):834-43. doi:10.1160/TH13-02-0132.
47. Valerio L, Mavromanoli AC, Barco S, et al. Chronic thromboembolic pulmonary hypertension and impairment after pulmonary embolism: the FOCUS study. Eur Heart J. 2022;43(36):3387-98. doi:10.1093/eurheartj/ehac206.
Об авторах
С. И. ПархоменкоРоссия
Пархоменко София Иосифовна — врач-кардиолог, аспирант кафедры кардиологии
Санкт-Петербург
М. А. Симакова
Россия
Симакова Мария Александровна — к.м.н., зав. научно-исследовательским отделом кардиоонкологии и постинфекционной соматической патологии
Санкт-Петербург
О. М. Моисеева
Россия
Моисеева Ольга Михайловна — д.м.н., зав. научно-исследовательским отделом некоронарогенных заболеваний сердца
Санкт-Петербург
Дополнительные файлы
- Перенесенная тромбоэмболия легочной артерии (ТЭЛА) может приводить к долгосрочным неблагоприятным последствиям и ассоциироваться с длительной нетрудоспособностью пациентов.
- В настоящем исследовании обобщены данные стационарного и амбулаторного этапов ведения больных с ТЭЛА.
- Полученные результаты позволяют сделать вывод о недостаточной приверженности пациентов после выписки и актуализируют необходимость внедрения алгоритма амбулаторного ведения больных после ТЭЛА, что позволит своевременно выявлять осложнения и принимать решения о длительности антикоагулянтной терапии.
Рецензия
Для цитирования:
Пархоменко С.И., Симакова М.А., Моисеева О.М. Долгосрочное наблюдение пациентов с тромбоэмболией легочной артерии высокого и промежуточного риска летального исхода. Российский кардиологический журнал. 2025;30(9):6354. https://doi.org/10.15829/1560-4071-2025-6354. EDN: WKGXPL
For citation:
Parkhomenko S.I., Simakova M.A., Moiseeva O.M. Long-term follow-up of patients with highand intermediate-risk pulmonary embolism. Russian Journal of Cardiology. 2025;30(9):6354. (In Russ.) https://doi.org/10.15829/1560-4071-2025-6354. EDN: WKGXPL
JATS XML

















































