Перейти к:
Анализ предиктивной ценности электрокардиографических, эхокардиографических и гематологических показателей для прогнозирования "новой" фибрилляции предсердий у больных инфарктом миокарда с подъемом сегмента ST после чрескожного коронарного вмешательства
https://doi.org/10.15829/1560-4071-2025-6353
EDN: JXFOOY
Аннотация
Цель. Сравнительная оценка предиктивного потенциала электрокардиографических, эхокардиографических и гематологических показателей для прогнозирования "новой" фибрилляции предсердий (ФП) у больных инфарктом миокарда с подъемом сегмента ST после чрескожного коронарного вмешательства (ЧКВ) и разработка новых прогностических моделей на основе методов машинного обучения.
Материал и методы. Проведено одноцентровое проспективное исследование, в рамках которого анализировали данные 733 больных инфарктом миокарда с подъемом сегмента ST. Было выделено 2 группы лиц, в первую из которых вошли 57 (7,8%) пациентов с впервые зарегистрированной ФП в послеоперационном периоде ЧКВ, а во вторую — 676 (92,2%) больных без нарушения сердечного ритма. Для прогнозирования ФП использовали методы однофакторной и многофакторной логистической регрессии, деревья решений, градиентный бустинг CatBoost.
Результаты. Сравнительный анализ электрокардиографии, эхокардиографии, гематологических и клинических показателей демонстрировал, что наиболее высоким предиктивным потенциалом обладают соотношение нейтрофилов к эозинофилам (NER) >48,7 усл.ед. (отношение шансов (ОШ) 7,1), класс острой сердечной недостаточности по Т. Killip >2 (ОШ 4,44), скорость оседания эритроцитов >36 мм/ч (ОШ 4) и индекс системного воспалительного ответа (SIRI) >5 усл.ед. (ОШ 3,8). Лучшая прогностическая модель "новой" ФП после ЧКВ (AUC=0,806) включала в свою структуру 9 категориальных предикторов: NER >48,7 усл.ед., SIRI >5 усл.ед., скорость оседания эритроцитов >36 мм/ч, PQ >200 мс, 600 мс< RR >1200 мс, систолическое давление в легочной артерии >33,5 мм рт.ст., возраст >66 лет, TIMI <3 и класс острой сердечной недостаточности по Т. Killip >2.
Заключение. Повышение точности прогноза "новой" ФП после ЧКВ может быть достигнуто за счет расширения спектра потенциальных предикторов и использования современных технологий объяснимого искусственного интеллекта.
Ключевые слова
Для цитирования:
Гельцер Б.И., Шахгельдян К.И., Пак Р.Л., Куксин Н.С., Домжалов И.Г., Кокарев Е.А., Котельников В.Н. Анализ предиктивной ценности электрокардиографических, эхокардиографических и гематологических показателей для прогнозирования "новой" фибрилляции предсердий у больных инфарктом миокарда с подъемом сегмента ST после чрескожного коронарного вмешательства. Российский кардиологический журнал. 2025;30(8):6353. https://doi.org/10.15829/1560-4071-2025-6353. EDN: JXFOOY
For citation:
Geltser B.I., Shahgeldyan K.I., Pak R.L., Kuksin N.S., Domzhalov I.G., Kokarev E.A., Kotelnikov V.N. Predictive value of electrocardiographic, echocardiographic and hematological parameters for predicting new‑onset atrial fibrillation in patients with ST‑segment elevation myocardial infarction after percutaneous coronary intervention. Russian Journal of Cardiology. 2025;30(8):6353. (In Russ.) https://doi.org/10.15829/1560-4071-2025-6353. EDN: JXFOOY
Фибрилляция предсердий (ФП) является одним из наиболее распространенных нарушений ритма сердца у больных инфарктом миокарда с подъемом сегмента ST (ИМпST). Впервые возникшая или "новая" ФП фиксируется у 6-21% больных ИМпST и ассоциируется прежде всего со значительным увеличением нежелательных сердечно-сосудистых событий и госпитальной летальности [1][2]. Широкая вариативность показателей распространенности этой формы ФП в различных исследованиях обусловлена клинико-демографическими особенностями анализируемых когорт, локализацией и тяжестью ИМпST, профилем и выраженностью коморбидной патологии, эффективностью чрескожного коронарного вмешательства (ЧКВ) и другими факторами.
Развитие "новой" ФП в остром периоде ИМпST обусловлено реализацией комплекса патофизиологических механизмов, ключевыми из которых являются ишемия предсердий, их перегрузка, острое ремоделирование и нарушение электрической активности [3]. В ряде работ к электрокардиографическим (ЭКГ) предикторам этой формы ФП относили расширение зубца Р (>110 мс), его дисперсию, удлинение интервала PQ >200 мс или его укорочение <120 мс [4]. Прогностическими свойствами в отношении "новой" ФП обладают также эхокардиографические (ЭхоКГ) показатели дилатации левого предсердия, сниженной фракции выброса (ФВ) левого желудочка (ЛЖ), клапанной патологии [5]. В последние годы в качестве индикаторов воспалительного ответа, демонстрирующих его интенсивность, помимо изолированных показателей клинического анализа крови, все чаще используют различные варианты их соотношений, наиболее известными из которых являются нейтрофильно-лимфоцитарный индекс (NLR), индексы системного иммунного воспаления (SII), системного воспалительного ответа (SIRI), совокупный системный индекс воспаления (AISI) и др. Некоторые из них в ряде исследований были представлены как предикторы жизнеугрожающих аритмий после ЧКВ, что подтверждает важную роль провоспалительных факторов в патогенезе данного осложнения [6]. ЧКВ является доминирующей стратегией реваскуляризации миокарда, эффективность которой оценивают по шкале TIMI (Thrombolysis in Myocardial Infarction). В патогенезе ФП, возникшей после ЧКВ, важное значение принадлежит ишемическим и реперфузионным факторам, интенсивность влияния которых на аритмогенез зависит от сроков и качества выполненной реваскуляризации [7]. Необходимо также отметить, что в настоящее время не разработаны общепринятые инструменты стратификации риска "новой" ФП у больных ИМпST, в т.ч. после ЧКВ [8]. Это обусловлено отсутствием надежных предикторов этого осложнения, что является поводом для более детальной оценки прогностической ценности инструментальных и лабораторных показателей, используемых в повседневной клинической практике.
Цель исследования состояла в сравнительной оценке предиктивного потенциала ЭКГ, ЭхоКГ и гематологических показателей для прогнозирования "новой" ФП у больных с ИМпST после ЧКВ.
Материал и методы
Данные. Проведено одноцентровое проспективное когортное исследование, в рамках которого анализировали данные 733 больных ИМпST (499 мужчин и 234 женщины) в возрасте от 23 до 97 лет с медианой (Me) 63 года и 95% доверительным интервалом (ДИ) [ 55; 71], поступивших в Региональный сосудистый центр ГБУЗ "Приморская краевая клиническая больница № 1" г. Владивостока с апреля 2024 по февраль 2025 гг. Критерии включения: пациенты с диагнозом ИМпST, которым было выполнено ЧКВ. Критерии исключения: пациенты с ИМпST, у которых фиксировалась любая форма ФП при поступлении в стационар или имеющая место в анамнезе. Было выделено 2 группы лиц, в первую из которых вошли 57 (7,8%) пациентов с впервые зарегистрированной ФП после выполнения ЧКВ, а во вторую — 676 (92,2%) больных без нарушения сердечного ритма. Наличие ФП подтверждали посредством непрерывного мониторинга ЭКГ в отделении реанимации и интенсивной терапии и ежедневного ЭКГ-контроля в кардиологическом отделении. Всем пациентам в первые сутки нахождения в стационаре проведен забор венозной крови, выполнена ЭхоКГ.
Конечная точка исследования была представлена впервые возникшей ФП у больных ИМпST в форме категориального бинарного признака ("отсутствие" или "развитие"). Входные признаки — подгруппа потенциальных предикторов выражалась в форме непрерывных и категориальных переменных.
Статистический анализ. Для обработки и анализа данных использовали методы статистического анализа и машинного обучения. Первые включали тесты хи-квадрат, Фишера, Манна-Уитни, однофакторную логистическую регрессию (ОЛР). Вторые — многофакторную логистическую регрессию (МЛР), градиентный бустинг CatBoost и деревья решений, с по- мощью которых разрабатывали прогностические модели "новой" ФП. Показатели были представлены Me и их 95% ДИ, т.к. их распределение не соответствовало нормальному. Статистическая значимость подтверждалась значением p-value<0,05. Качество моделей оценивали по 3 метрикам: площадь под ROC-кривой (AUC), чувствительность (Sen) и специфичность (Sp). Метрики Sen и Sp определялись с учетом несбалансированности выборки по критерию равенства Sen и Sp (Sen ≈ Sp).
При построении моделей данные были разделены следующим образом: 80% — для обучения и кросс-валидации, которая проводилась методом стратифицированного KFold по 10 выборкам, и 20% — для заключительного тестирования. Разделение данных для обучения и заключительного тестирования повторялось случайным образом 100 раз, все метрики качества усредняли с вычислением 95% ДИ.
Дизайн исследования. Дизайн исследования включал 4 этапа. На первом из них проведен статистический анализ 38 показателей в группах сравнения. На втором этапе с помощью метода CatBoost разрабатывали прогностические модели ФП, используя показатели в непрерывной или дискретной форме. Отбор предикторов выполнялся пошаговым включением отдельных признаков в структуру моделей с последующей оценкой их метрик качества. При увеличении последних, включенный в модель показатель рассматривали как предиктор ФП. На третьем шаге с по- мощью деревьев решений определяли пороговые значения предикторов, выделенных на втором этапе, критериями отбора которых были максимальные уровни AUC при итоговом тестировании.
Показатели, значения которых отклонялись за пределы пороговых границ, относили к факторам риска ФП. Последние валидировали методом ОЛР, максимально увеличивая AUC. На четвертом этапе на основе МЛР были разработаны прогностические модели "новой" ФП с использованием предикторов в дихотомической форме. Анализ данных и разработка моделей выполнялись на языке Python.
Результаты
Межгрупповой анализ клинико-функциональных параметров показал, что статистически значимые различия имеют место у 19 из 38 показателей (табл. 1). Так, пациенты первой группы отличались более старшим возрастом, преобладанием лиц женского пола, значительным (в 2,75 раза) ростом госпитальной летальности и 2-кратным увеличением случаев тяжелой сердечной недостаточности (класс острой сердечной недостаточности (ОСН) по Т. Killip >2). При этом медианные значения индекса массы тела, систолического артериального давления, диастолического артериального давления, частоты сердечных сокращений и всех показателей ЭКГ не отличались между собой. По данным ЭхоКГ у больных ИМпST с впервые возникшей ФП после ЧКВ чаще фиксировались признаки митральной недостаточности 1-2 степени, более высокий уровень систолического давления в легочной артерии (СДЛА), конечно-систолический размер, увеличение медиально-латерального (La1) и верхне-нижнего (La2) размеров левого предсердия, медиально-латерального (Ra2) размера правого предсердия, более низкое значение ФВ ЛЖ. Среди 9 гематологических показателей, характеризующих выраженность системного воспалительного ответа на острую ишемию и некроз кардиомиоцитов, только тромбоцитарно-лимфоцитарный индекс (PLR) не имел линейной взаимосвязи с "новой" ФП (p-value=0,72). Остальные параметры этого пула демонстрировали статистически значимые различия в группах сравнения.
Предварительный анализ предиктивной ценности гематологических показателей, проведенный на 1 этапе исследования, показал, что более высокая статистическая значимость ассоциируется с нейтрофильно-эозинофильным индексом (NER) (p-value=0,000002), скоростью оседания эритроцитов (СОЭ) (p-value=0,00023), нейтрофильно-базофильным индексом (NBR) (p-value=0,00093), SIRI (p-value=0,0013), моноцитарно-лимфоцитарным индексом (МLR) (p-value=0,0092), совокупным системным индексом воспаления (AISI) (p-value=0,023). Анализ качества реваскуляризации миокарда по критерию TIMI показал, что у пациентов с "новой" ФП признак неполного восстановления коронарной перфузии после ЧКВ (TIMI <3) фиксировался значительно чаще, чем у лиц без нарушения сердечного ритма (23% vs 9%, p-value=0,0013).
На втором этапе исследования предиктивный потенциал анализируемых факторов уточняли в процессе разработки прогностических моделей ФП, где все показатели использовались в непрерывной форме (табл. 2). Структура базовой модели включала комбинацию только гематологических показателей (NER, MLR, SIRI и СОЭ), т.к. при тестировании предсказательной ценности изолированных параметров ЭКГ, ЭхоКГ или их комплексов прогностическая точность моделей на их основе не соответствовала приемлемому уровню (AUC<0,7). Наилучшие показатели метрик качества были у модели 5, включающей помимо гематологических индикаторов показатели СДЛА, RR, PQ, возраст, TIMI и класс ОСН по Т. Killip (AUC=0,763; Sen=0,719; Sp=0,708).
На третьем этапе исследования с помощью деревьев решений и ОЛР у ранее отобранных предикторов, входящих в структуру лучшей модели (5), выделяли и валидировали пороговые значения, отклонение от которых повышало их прогностическую ценность и позволяло отнести к факторам риска ФП, развившейся после ЧКВ (табл. 3, рис. 1). Установлено, что наибольшая вероятность возникновения последней ассоциировалась с NER >48,7 усл.ед. (отношение шансов (ОШ) 7,1), класс ОСН по T. Killip >2 (ОШ 4,44), СОЭ >36 (ОШ 4), SIRI >5 усл.ед. (ОШ 3,8), MLR усл.ед. >0,256 (ОШ 3,2) и TIMI <3 (ОШ 3,1), СДЛА >33,5 мм рт.ст. (ОШ 2,96), длительностью RR <600 мс или RR >1200 мс (ОШ 2,7). Более чем 2-кратное увеличение риска послеоперационной ФП было связано с возрастом пациентов старше 66 лет (ОШ 2,56), верхне-нижними размерами правого (>5,2 см) и левого (>5,5 см) предсердий (ОШ 2,17).
На четвертом этапе исследования на основе МЛР были разработаны прогностические модели "новой" ФП, структура которых была представлена предикторами в категориальной форме (факторами риска) (табл. 4). Базовая модель (1), включающая только гематологические параметры (NER, SIRI и СОЭ), имела приемлемую точность прогноза (AUC=0,757). Последовательное расширение состава предикторов этой модели за счет показателей ЭхоКГ (СДЛА >33,5 мм рт.ст.), ЭКГ (PQ >200 мс, RR <600 мс или RR >1200 мс) позволило увеличить метрику AUC до 0,783 (модель 3). Наиболее высокий уровень AUC, соответствующий хорошей точности прогноза (AUC=0,806 — на тестовой выборке и 0,809 — на выборке для валидации), был достигнут в модели (6), при включении в ее структуру показателя возраста больных >66 лет, ангиографического критерия TIMI <3 и класса ОСН по Т. Killip >2 (рис. 2).
Таблица 1
Клинико-функциональные показатели больных ИМпST при поступлении в стационар
|
Показатели |
Группа 1 (n=57) |
Группа 2 (n=676) |
p-value |
|
Возраст, лет |
68 [ 61; 75] |
63 [ 55; 70,25] |
0,0017 |
|
Женский пол, n (%) |
22 (39%) |
205 (31%) |
0,3 |
|
ГЛ, n (%) |
5 (8,8%) |
21 (3,2%) |
0,049 |
|
ИМТ, кг/м2 |
28,08 [ 25,71; 32,05] |
27,46 [ 25,14; 30,48] |
0,136 |
|
САД, мм рт.ст. |
130 [ 110; 140] |
130 [ 120; 150] |
0,068 |
|
ДАД, мм рт.ст. |
80 [ 70; 90] |
80 [ 80; 90] |
0,055 |
|
ЧСС, уд./мин |
75 [ 70; 80] |
72 [ 70; 80] |
0,49 |
|
ОСН по T. Killip >2, n (%) |
16 (28%) |
99 (15%) |
0,016 |
|
Параметры ЭКГ |
|||
|
P, мс |
100 [ 80; 100] |
100 [ 80; 100] |
0,98 |
|
PQ, мс |
170 [ 160; 195] |
160 [ 160; 180] |
0,568 |
|
QRS, мс |
80 [ 60; 80] |
70 [ 60; 80] |
0,253 |
|
QT, мс |
360 [ 340; 400] |
360 [ 340; 400] |
0,88 |
|
QTc, мс |
417,76 [ 371,1; 438,75] |
408,6 [ 381,88; 434,06] |
0,64 |
|
RR, мс |
760 [ 620; 1000] |
800 [ 700; 920] |
0,672 |
|
Эхокардиографические данные |
|||
|
ФВ, n (%) |
50 [ 45; 54] |
54 [ 48; 60] |
0,013 |
|
ФВ ≤45%, n (%) |
15 (26%) |
105 (16%) |
0,081 |
|
МН 1 степени, n (%) |
29 (51%) |
269 (41%) |
0,022 |
|
МН 2 степени, n (%) |
8 (14%) |
57 (8,6%) |
0,029 |
|
НТК 1 степени, n (%) |
17 (30%) |
164 (25%) |
0,057 |
|
КДР ЛЖ, см |
5 [ 4,6; 5,3] |
4,9 [ 4,6; 5,3] |
0,23 |
|
КСР ЛЖ, см |
3,6 [ 3,3; 3,9] |
3,4 [ 3,1; 3,8] |
0,02 |
|
La1, см |
4 [ 3,7; 4,3] |
3,8 [ 3,5; 4,1] |
0,025 |
|
La2, см |
5,1 [ 4,7; 5,6] |
4,9 [ 4,6; 5,2] |
0,0049 |
|
Ra1, см |
3,6 [ 3,5; 3,9] |
3,6 [ 3,3; 3,8] |
0,14 |
|
Ra2, см |
4,8 [ 4,6; 5,1] |
4,6 [ 4,4; 4,9] |
0,043 |
|
СДЛА, мм рт.ст. |
30 [ 26; 37] |
28 [ 25; 30] |
0,025 |
|
Гематологические индикаторы воспалительного ответа |
|||
|
NLR, усл.ед. |
4,39 [ 2,93; 6,74] |
3,16 [ 2,23; 4,99] |
0,0012 |
|
PLR, усл.ед. |
114,36 [ 78,27; 144,83] |
113,1 [ 86,18; 151,44] |
0,72 |
|
MLR, усл.ед. |
0,53 [ 0,33; 0,62] |
0,39 [ 0,29; 0,52] |
0,0092 |
|
NER, усл.ед. |
125,06 [ 69,53; 294,42] |
60,38 [ 32,73; 149,6] |
0,000002 |
|
NBR, усл.ед. |
341 [ 144,32; 422,83] |
185,33 [ 119,8; 308,5] |
0,00093 |
|
SII, усл.ед. |
939,25 [ 592,53; 1468,45] |
735,38 [ 478,1; 1165,16] |
0,038 |
|
SIRI, усл.ед. |
3,81 [ 2,28; 6,69] |
2,52 [ 1,59; 4,2] |
0,0013 |
|
AISI, усл.ед. |
835,94 [ 409,3; 1386,46] |
557,93 [ 336,06; 1017,43] |
0,029 |
|
СОЭ, мм/ч |
31 (14; 46) |
16 (9; 29) |
0,00023 |
|
Результат ЧКВ |
|||
|
TIMI =3 |
4 (77%) |
599 (91%) |
0,024 |
|
TIMI <3 |
13 (23%) |
57 (9%) |
0,0013 |
Сокращения: ГЛ — госпитальная летальность, ДАД — диастолическое артериальное давление, ИМТ — индекс массы тела, КДР ЛЖ — конечно-диастолический размер левого желудочка, КСР ЛЖ — конечно-систолический размер левого желудочка, МН — митральная недостаточность, НТК — недостаточность трикуспидального клапана, ОСН — острая сердечная недостаточность, САД — систолическое артериальное давление, СДЛА — систолическое давление в легочной артерии, СОЭ — скорость оседания эритроцитов, ФВ — фракция выброса, ЧКВ — чрескожное коронарное вмешательство, ЧСС — частота сердечных сокращения, ЭКГ — электрокардиография, AISI — совокупный системный индекс воспаления, La1 — медиально-латеральный размер левого предсердия в апикальной проекции, La2 — верхне-нижний размер левого предсердия в апикальной проекции, MLR — моноцитарно-лимфоцитарный индекс, NBR — отношение нейтрофилов к базофилам, NER — отношение нейтрофилов к эозинофилам, NLR — нейтрофильно-лимфоцитарный индекс, NRL — нейтрофильно-лимфоцитарный индекс, PLR — тромбоцитарно-лимфоцитарный индекс, Ra1 — медиально-латеральный размер правого предсердия в апикальной проекции, Ra2 — верхне-нижний размер правого предсердия в апикальной проекции, QTc — корригированная величина интервала QT, рассчитанная по формуле Bazett, SII — индекс системного иммунного воспаления, SIRI — индекс системного воспалительного ответа, TIMI — шкала The thrombolysis in myocardial infarction.
Таблица 3
Пороговые значения предикторов "новой" ФП у больных ИМпST после ЧКВ
|
№ |
Параметр |
Группа 1 (n=57) |
Группа 2 (n=676) |
ОШ (95%) ДИ |
p-value |
AUC |
|
1 |
СДЛА >33,5 мм рт.cт. |
20 (35,1%) |
99 (15%) |
2,96 [ 1,65; 5,31] |
0,00065 |
0,596 |
|
2 |
La2 >5,5 см и Ra2 >5,2 см |
19 (33,3%) |
120 (18,3%) |
2,17 [ 1,2; 3,9] |
0,014 |
0,578 |
|
3 |
NER >48,7 усл.ед. |
52 (91%) |
370 (56%) |
7,1 [ 2,8; 18,05] |
<0,000001 |
0,66 |
|
4 |
MLR >0,526 усл.ед. |
29 (49%) |
154 (23,5%) |
3,2 [ 1,85; 5,55] |
0,000058 |
0,638 |
|
5 |
SIRI >5 усл.ед. |
26 (45,6%) |
114 (17,4%) |
3,8 [ 2,17; 6,64] |
0,000007 |
0,641 |
|
6 |
СОЭ >36 мм/ч |
23 (40,4%) |
89 (13,6%) |
4 [ 2,26; 7,13] |
0,000006 |
0,633 |
|
7 |
PQ >200 мс |
10 (17,5%) |
140 (21,3%) |
0,82 [ 0,4; 1,7] |
0,718 |
0,516 |
|
8 |
RR <600 мс или RR >1200 мс |
18 (31,5%) |
98 (14,9%) |
2,7 [ 1,48; 4,98] |
0,002 |
0,594 |
|
9 |
Возраст >66 лет |
36 (63,1%) |
263 (40,1%) |
2,56 [ 1,46; 4,49] |
0,0011 |
0,6112 |
|
10 |
TIMI <3 |
13 (22,8%) |
57 (8,7%) |
3,1 [ 1,58; 6,1] |
0,0014 |
0,572 |
|
11 |
Класс ОСН по T. Killip >2 |
10 (17,5%) |
30 (4,6%) |
4,44 [ 2; 9,6] |
0,00062 |
0,567 |
Сокращения: ДИ — доверительный интервал, ОСН — острая сердечная недостаточность, ОШ — отношение шансов, СДЛА — систолическое давление в легочной артерии, СОЭ — скорость оседания эритроцитов, La2 — верхне-нижний размер левого предсердия, MLR — моноцитарно-лимфоцитарный индекс, NER — отношение нейтрофилов к эозинофилам, Ra2 — верхне-нижний размер правого предсердия, SIRI — индекс системного воспалительного ответа, TIMI — шкала "Thrombolysis In Myocardial Infarction".
Таблица 2
Оценка точности прогностических моделей "новой" ФП после ЧКВ у больных ИМпST, разработанных на основе предикторов в непрерывной форме (Ме, 95% ДИ)
|
№ |
Предикторы моделей |
Тестовые выборки |
Выборки для валидации |
||||
|
Auc |
Sen |
Sp |
Auc |
Sen |
Sp |
||
|
1 |
NER, MLR, SIRI, СОЭ |
0,726 [ 0,713; 0,738] |
0,659 [ 0,634; 0,683] |
0,659 [ 0,642; 0,676] |
0,723 [ 0,688; 0,758] |
0,692 [ 0,634; 0,752] |
0,653 [ 0,615; 0,691] |
|
2 |
NER, MLR, SIRI, СОЭ, СДЛА |
0,73 [ 0,725; 0,734] |
0,681 [ 0,672; 0,69] |
0,685 [ 0,682; 0,688] |
0,74 [ 0,729; 0,752] |
0,703 [ 0,68; 0,727] |
0,681 [ 0,673; 0,69] |
|
3 |
NER, MLR, SIRI, СОЭ, СДЛА, RR, PQ, возраст |
0,754 [ 0,75; 0,758] |
0,7 [ 0,69; 0,711] |
0,673 [ 0,669; 0,677] |
0,762 [ 0,751; 0,774] |
0,712 [ 0,687; 0,737 |
0,68 [ 0,671; 0,688] |
|
4 |
NER, MLR, SIRI, СОЭ, СДЛА, RR, PQ, возраст, TIMI |
0,758 [ 0,753; 0,762] |
0,713 [ 0,704; 0,721] |
0,695 [ 0,691; 0,699] |
0,761 [ 0,747; 0,775] |
0,697 [ 0,668; 0,726] |
0,7 [ 0,692; 0,709] |
|
5 |
NER, MLR, SIRI, СОЭ, СДЛА, RR, PQ, возраст, TIMI, класс ОСН по T. Killip |
0,763 [ 0,758; 0,767] |
0,719 [ 0,71; 0,728] |
0,708 [ 0,704; 0,711] |
0,767 [ 0,754; 0,78] |
0,723 [ 0,695; 0,751] |
0,714 [ 0,706; 0,721] |
Сокращения: ОСН — острая сердечная недостаточность, СДЛА — систолическое давление в легочной артерии, СОЭ — скорость оседания эритроцитов, MLR — моноцитарно-лимфоцитарный индекс, NER — отношение нейтрофилов к эозинофилам, SIRI — индекс системного воспалительного ответа, TIMI — шкала "Thrombolysis In Myocardial Infarction".
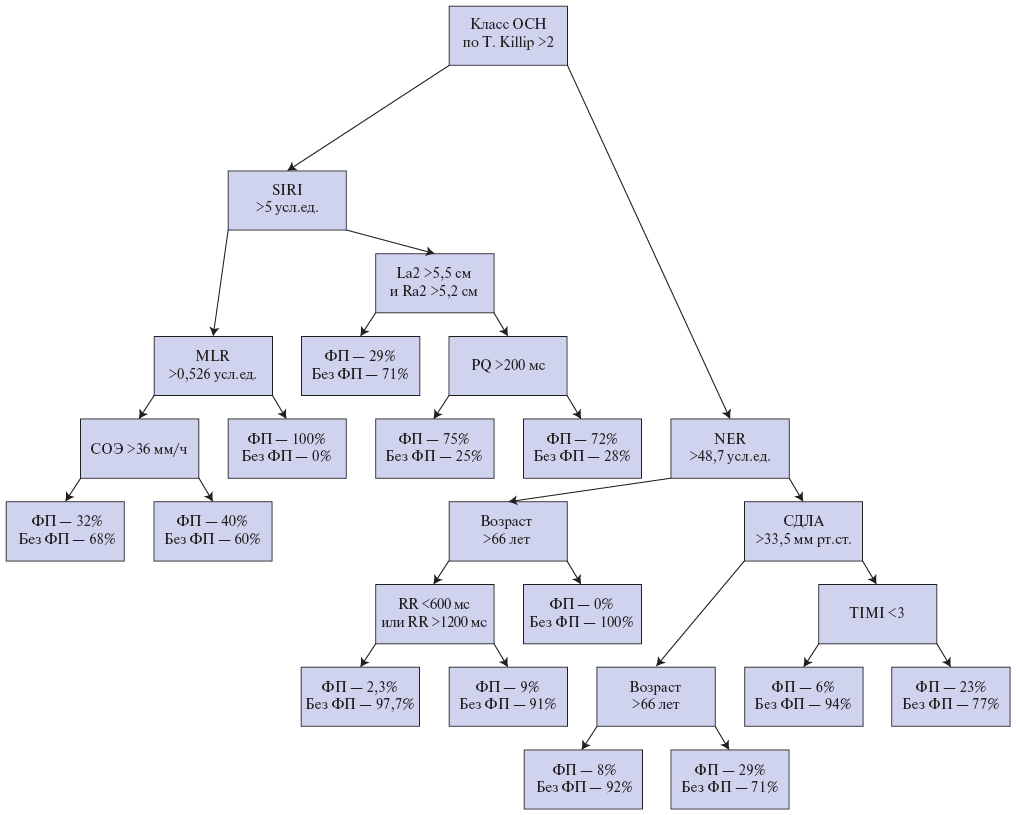
Рис. 1. Дерево решений для выделения пороговых значений предикторов "новой" ФП.
Сокращения: ОСН — острая сердечная недостаточность, СДЛА — систолическое давление в легочной артерии, СОЭ — скорость оседания эритроцитов, ФП — фибрилляция предсердий, La2 — верхне-нижний размер левого предсердия, MLR — моноцитарно-лимфоцитарный индекс, NER — нейтрофильно-эозинофильный индекс, Ra2 — верхне-нижний размер правого предсердия, SIRI — индекс системного воспалительного ответа.
Таблица 4
Оценка точности прогностических моделей "новой" ФП у больных ИМпST после ЧКВ, разработанных на основе категориальных предикторов (Ме, 95% ДИ)
|
№ |
Предикторы моделей |
Тестовые выборки |
Выборки для валидации |
||||
|
Auc |
Sen |
Sp |
Auc |
Sen |
Sp |
||
|
1 |
NER >48,7 усл.ед., SIRI >5 усл.ед., СОЭ >36 мм/ч |
0,757 [ 0,753; 0,76] |
0,686 [ 0,676; 0,695] |
0,7 [ 0,682; 0,718] |
0,774 [ 0,763; 0,786] |
0,715 [ 0,69; 0,74] |
0,713 [ 0,685; 0,741] |
|
2 |
NER >48,7 усл.ед., SIRI >5 усл.ед., СОЭ >36 мм/ч, СДЛА >33,5 усл.ед. |
0,776 [ 0,773; 0,78] |
0,732 [ 0,721; 0,743] |
0,733 [ 0,73; 0,736] |
0,785 [ 0,774; 0,796] |
0,782 [ 0,76; 0,803] |
0,724 [ 0,716; 0,732] |
|
3 |
NER >48,7 усл.ед., SIRI >5 усл.ед., СОЭ >36 мм/ч, PQ >200 мс, RR >1200 мс или RR <600 мс, СДЛА >33,5 мм рт.ст. |
0,783 [ 0,779; 0,786] |
0,716 [ 0,706; 0,725] |
0,729 [ 0,725; 0,732] |
0,785 [ 0,773; 0,797] |
0,724 [ 0,698; 0,75] |
0,728 [ 0,719; 0,737] |
|
4 |
NER >48,7 усл.ед., SIRI >5 усл.ед., СОЭ >36 мм/ч, PQ >200 мс, RR >1200 мс или RR <600 мс, СДЛА >33,5 мм рт.ст., возраст >66 лет |
0,789 [ 0,786; 0,793] |
0,735 [ 0,727; 0,742] |
0,74 [ 0,735; 0,745 |
0,791 [ 0,78; 0,802] |
0,743 [ 0,718; 0,768] |
0,747 [ 0,736; 0,758] |
|
5 |
NER >48,7 усл.ед., SIRI >5 усл.ед., СОЭ >36 мм/ч, PQ >200 мс, RR >1200 мс или RR <600 мс, СДЛА >33,5 мм рт.ст., возраст >66 лет, TIMI <3 |
0,802 [ 0,798; 0,805] |
0,768 [ 0,761; 0,776] |
0,757 [ 0,754; 0,759] |
0,8 [ 0,789; 0,812] |
0,761 [ 0,737; 0,785] |
0,759 [ 0,751; 0,767] |
|
6 |
NER >48,7 усл.ед., SIRI >5 усл.ед., СОЭ >36 мм/ч, PQ >200 мс, RR >1200 мс или RR <600 мс, СДЛА >33,5 мм рт.ст., возраст >66 лет, TIMI <3, класс ОСН Т. Killip >2 |
0,806 [ 0,802; 0,81] |
0,769 [ 0,76; 0,779] |
0,769 [ 0,767; 0,771] |
0,809 [ 0,797; 0,82] |
0,769 [ 0,742; 0,796] |
0,769 [ 0,763; 0,776] |
Сокращения: ОСН — острая сердечная недостаточность, СДЛА — систолическое давление в легочной артерии, СОЭ — скорость оседания эритроцитов, NER — отношение нейтрофилов к эозинофилам, SIRI — индекс системного воспалительного ответа, TIMI — шкала "Thrombolysis In Myocardial Infarction".
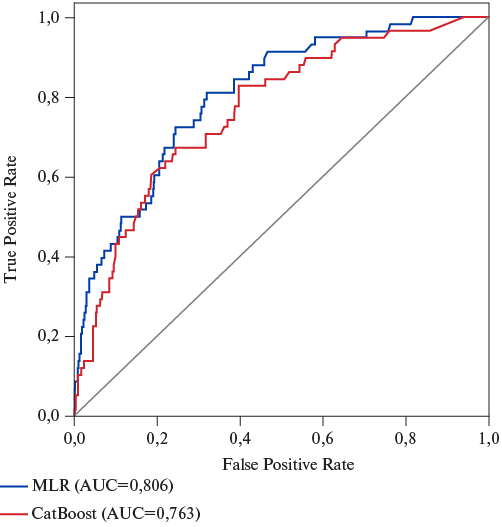
Рис. 2. График ROC AUC лучших моделей с непрерывными (CatBoost) и категориальными (MLR) предикторами.
Сокращение: MLR — моноцитарно-лимфоцитарный индекс.
Обсуждение
ФП относится к наиболее распространенным вариантам нарушений сердечного ритма при ИМ. Её клиническое значение определяется ухудшением прогноза ближайших и отдаленных результатов реваскуляризации миокарда и возрастающим риском госпитальной летальности [9]. Выделяют две основных формы ФП, ассоциированные с ИМ: хроническую, предшествующую его развитию и впервые возникшую или "новую" ФП, доля которой может достигать 70% [3]. К подтипам "новой" ФП относят варианты ее развития в периоды до или после реваскуляризации миокарда, выделение которых может быть полезным для более точной оценки инициирующих ее факторов и патофизиологических механизмов [10]. Реперфузионные аритмии, связанные с ЧКВ, имеют место у 11% больных ИМпST и могут быть проявлениями как успешного восстановления коронарного кровотока, так и продолжающегося ишемического повреждения кардиомиоцитов [11]. Многообразие и сложность причинно-следственных взаимосвязей различных патогенетических факторов "новой" ФП являются препятствием для разработки универсального прогностического инструмента, позволяющего стратифицировать риск развития данного осложнения после ЧКВ [9]. Вместе с тем интерес к решению данной задачи иллюстрируется многочисленными публикациями, связанными с поиском надежных предикторов ФП [5][8][9]. К последним чаще всего относят высокий класс ОСН по Т. Killip, пожилой или старческий возраст больных, увеличение размеров левого предсердия, ИМ в анамнезе, низкую ФВ ЛЖ, неуспешность реваскуляризации миокарда [8]. Одной из проблем этих исследований является недостаточная точность разработанных прогностических моделей, на что указывали значения AUC<0,7 [6]. В ряде работ авторы добивались приемлемой точности прогноза (AUC в диапазоне 0,7-0,79) [6][12]. В нашем исследовании сопоставимый результат (AUC=0,726-0,763) был получен уже при разработке моделей машинного обучения методом CatBoost на основе предикторов в непрерывной форме (табл. 2, модели 1-5). В ряде работ было показано, что категоризация непрерывных переменных с определением их пороговых значений повышает качество прогноза за счет клинического обоснования предсказанной вероятности неблагоприятных событий [13]. Результаты настоящего исследования демонстрировали взаимо-связь "новой" ФП после ЧКВ с комплексом клинико-инструментальных и лабораторных показателей в категориальной форме, а построение на их основе моделей МЛР позволило не только повысить точность прогноза (AUC=0,806), но и расширить возможности для интерпретации генерируемых заключений. Необходимо отметить, что несмотря на невысокий уровень AUC изолированных факторов риска, их комбинация в многофакторной модели обеспечивала хорошее качество прогноза за счет взаимосвязанного и модифицирующего влияния на конечную точку.
Сравнительный анализ предиктивной ценности показателей ЭКГ, ЭхоКГ и индикаторов воспалительного ответа показал, что приемлемый результат прогноза могла обеспечить только комбинация гематологических маркеров как в непрерывной (AUC=0,726), так и в категориальной (AUC=0,757) формах. При этом более заметными предсказательными свойствами обладали NER >48,7 усл.ед. (ОШ 7,1), СОЭ >36 мм/ч (ОШ 4) и SIRI >5 (ОШ 3,8). В ряде исследований была доказана информативность SIRI как индикатора воспалительного ответа, обладающего предиктивным потенциалом для решения прогностических задач при различных заболеваниях, в т.ч. инфаркта миокарда [14]. При этом NER в качестве прогностического маркера упоминается значительно реже, несмотря на доказанное значение эозинопении и нейтрофильного лейкоцитоза как маркеров неблагоприятных клинических событий [6]. Установлено, что качество восстановления коронарного кровотока после ЧКВ тесно связано с вероятностью развития ФП. Неуспешность ЧКВ или проявления реперфузионного синдрома миокарда усиливают процессы его повреждения, стимулируя ремоделирование и электрическую нестабильность предсердий [15]. В нашем исследовании включение в структуру модели (5) критерия TIMI <3 повышало точность прогноза (табл. 4). Клинические признаки нарастающей левожелудочковой недостаточности при ИМпST являются классическим предиктором неблагоприятных сердечно-сосудистых событий, риск развития которых чаще всего стратифицируется по шкале GRACE. В нашей работе на этапе категоризации анализируемых факторов класс ОСН по Т. Killip >2 ассоциировался с высокой вероятностью "новой" ФП после ЧКВ (ОШ 4,44). Расширение спектра предикторов модели (6) за счет этого показателя увеличивало метрику AUC. Среди ЭКГ параметров прогностическими свойствами в отношении "новой" ФП после ЧКВ обладали только два показателя: PQ >200 мс и 600 мс< RR >1200 мс. Реализация их предиктивного потенциала обеспечивалась при комбинации с гематологическими показателями и СДЛА >33,5 мм рт.ст. в модели (3) (AUC=0,783). Категориальный признак СДЛА был единственным ЭхоКГ-параметром, имеющим прогностический ресурс для оценки вероятности развития "новой" ФП.
Ограничения исследования. Ограничения исследования связаны с его одноцентровым характером, необходимостью увеличения выборки больных, валидации моделей на когортах больных ИМпST из других лечебных учреждений.
Заключение
Прогнозирование "новой ФП" у больных ИМпSТ после ЧКВ остается актуальной задачей кардиологической практики ввиду ее высокой распространенности и возрастающего риска госпитальной летальности. В нашем исследовании "новая ФП" фиксировалась у 7,8% больных, а госпитальная летальность в этой группе была почти в 3 раза выше, чем среди больных без нарушений сердечного ритма. Сравнительный анализ ЭКГ, ЭхоКГ, гематологических и клинических показателей демонстрировал, что наиболее высоким предиктивным потенциалом обладают NER >48,7 усл.ед. (ОШ 7,1), класс ОСН по Killip >2 (ОШ 4,44), СОЭ >36 мм/ч (ОШ 4) и SIRI >5 усл.ед. (ОШ 3,8). Лучшая прогностическая модель "новой" ФП после ЧКВ (AUC=0,806) имела в своей структуре 9 предикторов: NER >48,7 усл.ед., SIRI >5 усл.ед., СОЭ >36 мм/ч, PQ >200 мс, 600 мс< RR >1200 мс, СДЛА >33,5 мм рт.ст., возраст >66 лет, TIMI <3 и класс ОСН Т. Killip >2.
Список литературы
1. Karataş MB, Çanga Y, İpek G, et al. Association of admission serum laboratory parameters with new-onset atrial fibrillation after a primary percutaneous coronary intervention. Coronary Artery Disease. 2016; 27:128-134. DOI: 10.1097/MCA.0000000000000333
2. Obayashi Y, Shiomi H, Morimoto T et al. Newly Diagnosed Atrial Fibrillation in Acute Myocardial Infarction. Journal of the American Heart Association. 2021; 10:e021417. DOI:10.1161/JAHA.121.021417
3. Зыков М.В., Барбараш О.Л. Патогенетические и клинические аспекты фибрилляции предсердий при инфаркте миокарда. Российский кардиологический журнал. 2021;26(2):4307 DOI:10.15829/1560-4071-2021-43073.
4. Максакова А. Ю., Ким С. А., Ашурова М. А., Сергеева И. Г., Шляхтина Н. В., Епифанов Р. Ю., Столяров С. С. Выявление предикторов развития фибрилляции предсердий на электрокардиограмме с помощью нейросети. Российский кардиологический журнал. 2024;29(11S):5907. DOI: 10.15829/1560-4071-2024-5907.
5. Котляров С.Н., Любавин А.В. Эффективность прогнозирования развития фибрилляции предсердий на основании показателей трансторакальной эхокардиографии, анализируемых нейронной сетью: проспективное исследование. Альманах клинической медицины. 2024;52(8):417. DOI: 10.18786/2072-0505-2024-52-041.
6. Пак Р.Л., Гельцер Б.И., Шахгельдян К.И., и др. Показатели клинического анализа крови в прогнозировании фибрилляции предсердий у больных инфарктом миокарда с подъемом сегмента ST после чрескожного коронарного вмешательства. Вестник современной клинической медицины. 2025;18(1):48. DOI:10.20969/VSKM.2025.18(1).48-56.
7. Laxmi Narayan Goit, Shaning Yang. Slow Blood Flow after Percutaneous Coronary Intervention in Patients with ST-Segment Elevation Myocardial Infarction, Unstable Angina and Coronary Total Occlusion. Global Journal of Life Sciences. 2021; 2(1): 37. DOI:10.46633/gjls.020105
8. Al-Obaidi F., Al-Kinani T., M. Al-Ali H, Al-Myahi M. H.. New-onset atrial fibrillation in the post-primary PCI setting: a systematic review. Acta Medica Bulgarica. 2019; 46(2):62. DOI:10.2478/amb-2019-0021
9. Шишкина Е.А., Хлынова О.В., Лебедева Ю.И. и др. Фибрилляция предсердий и инфаркт миокарда: клинико-патогенетические взаимосвязи и влияние на прогноз. Кардиометаболическая медицина. 2023;22(8):23. DOI:10.31550/1727-2378-2023-22-8-23-28
10. Пак Р.Л., Гельцер Б.И., Шахгельдян К.И. и др. Эффективность прогностических шкал в оценке риска впервые возникшей фибрилляции предсердий у больных инфарктом миокарда с подъемом сегмента ST после чрескожного коронарного вмешательства. Российский кардиологический журнал. 2024;29(12):6125. DOI:10.15829/1560-4071-2024-6125. EDN ZDFYDZ
11. Хубулава Г. Г., Козлов К. Л., Шишкевич А. Н. и др. Предикторы реперфузионного синдрома миокарда: современный взгляд на вопрос и актуальные проблемы. Часть 1: Реперфузионные аритмии, необратимое повреждение и оглушение миокарда (обзор литературы). Регионарное кровообращение и микроциркуляция. 2021;20(2):20. DOI:10.24884/1682-6655-2021-20-2-20-26.
12. Mazzone A., Scalese M., Paradossi U. et al. Development and validation of a risk stratification score for new-onset atrial fibrillation in STEMI patients undergoing primary percutaneous coronary intervention. Int J Clin Pract. 2018;e13087. DOI:10.1111/ijcp.13087
13. Шахгельдян К.И., Куксин Н.С., Домжалов И.Г. и др. Анализ эффективности прогностических моделей внутригоспитальной летальности у больных инфарктом миокарда с подъемом сегмента ST на основе предикторов в категориальной и непрерывной формах. Современные технологии в медицине. 2024;16(1). DOI:10.17691/stm2024.16.1.02
14. Wang J, Hu S, Liang C, Ling Y.. The association between systemic inflammatory response index and new-onset atrial fibrillation in patients with ST-elevated myocardial infarction treated with percutaneous coronary intervention. BMC Cardiovascular Disorders. 2022;22(1):525. DOI: 10.1186/s12872-022-02989-9
15. Олейников В. Э., Чернова А. А., Кулюцин А.В. и др. Патогенез и клиническое значение реперфузионных аритмий при остром инфаркте миокарда. Российский кардиологический журнал. 2024;29(3S):5958. DOI:10.15829/1560-4071-2024-5958
Об авторах
Б. И. ГельцерРоссия
Борис Израйльевич Гельцер — д.м.н., профессор, член‑корр. РАН, зам. директора по научной работе, Школа медицины и наук о жизни, Дальневосточный федеральный университет; г.н.с., научный образовательный центр "Искусственный интеллект", Владивостокский государственный университет
Владивосток
К. И. Шахгельдян
Россия
Карина Иосифовна Шахгельдян — д.т.н., доцент, зав. лабораторией анализа больших данных в здравоохранении и медицине, Школа медицины, Дальневосточный федеральный университет; директор, научный образовательный центр "Искусственный интеллект", Владивостокский государственный университе
Владивосток
Конфликт интересов:
.
Р. Л. Пак
Россия
Регина Леонидовна Пак — ассистент, Школа медицины и наук о жизни, Департамент клинической медицины, Дальневосточный федеральный университет; отделение реанимации и интенсивной терапии регионального сосудистого центра, врач, Приморская краевая клиническая больница № 1
Владивосток
Конфликт интересов:
.
Н. С. Куксин
Россия
Никита Сергеевич Куксин — аспирант, Институт математики и компьютерных технологий, Дальневосточный федеральный университет; м.н.с., научный образовательный центр "Искусственный интеллект", Владивостокский государственный университет
Владивосток
Конфликт интересов:
.
И. Г. Домжалов
Россия
Игорь Геннадьевич Домжалов — аспирант, Школа медицины и наук о жизни, Департамент клинической медицины, Дальневосточный федеральный университет; отделение реанимации и интенсивной терапии регионального сосудистого центра, врач, Приморская краевая клиническая больница № 1
Владивосток
Конфликт интересов:
.
Е. А. Кокарев
Россия
Евгений Анатольевич Кокарев — к.м.н., зав. отделением реанимации и интенсивной терапии отделения реанимации и интенсивной терапии регионального сосудистого центра
Владивосток
Конфликт интересов:
Нет конфликта
В. Н. Котельников
Россия
Владимир Николаевич Котельников — д.м.н., профессор, Школа медицины и наук о жизни, Департамент клинической медицины
Владивосток
Конфликт интересов:
Нет конфликта
Дополнительные файлы
- Наиболее высоким предиктивным потенциалом для прогнозирования "новой" фибрилляции предсердий (ФП) у больных инфарктом миокарда с подъемом сегмента ST (ИМпST) после чрескожного коронарного вмешательства (ЧКВ) обладают: соотношение нейтрофилов к эозинофилам, класс острой сердечной недостаточности по Т. Killip, скорость оседания эритроцитов, индекс системного воспалительного ответа.
- Электрокардиографические и эхокардиографические показатели в изолированной форме имели меньшую прогностическую ценность.
- Структура лучшей прогностической модели "новой" ФП у больных ИМпST после ЧКВ, разработанной на основе многофакторной логистической регрессии, включала 9 предикторов в категориальной форме.
Рецензия
Для цитирования:
Гельцер Б.И., Шахгельдян К.И., Пак Р.Л., Куксин Н.С., Домжалов И.Г., Кокарев Е.А., Котельников В.Н. Анализ предиктивной ценности электрокардиографических, эхокардиографических и гематологических показателей для прогнозирования "новой" фибрилляции предсердий у больных инфарктом миокарда с подъемом сегмента ST после чрескожного коронарного вмешательства. Российский кардиологический журнал. 2025;30(8):6353. https://doi.org/10.15829/1560-4071-2025-6353. EDN: JXFOOY
For citation:
Geltser B.I., Shahgeldyan K.I., Pak R.L., Kuksin N.S., Domzhalov I.G., Kokarev E.A., Kotelnikov V.N. Predictive value of electrocardiographic, echocardiographic and hematological parameters for predicting new‑onset atrial fibrillation in patients with ST‑segment elevation myocardial infarction after percutaneous coronary intervention. Russian Journal of Cardiology. 2025;30(8):6353. (In Russ.) https://doi.org/10.15829/1560-4071-2025-6353. EDN: JXFOOY

















































