Перейти к:
Неиммуногенная стафилокиназа у пациентов с массивной тромбоэмболией легочных артерий промежуточно-высокого риска: протокол многоцентрового двойного слепого рандомизированного плацебо-контролируемого исследования ФОРПЕ-2
https://doi.org/10.15829/1560-4071-2025-6291
EDN: UEUTUR
Аннотация
Цель. Оценка эффективности и безопасности неиммуногенной стафилокиназы при ее однократном болюсном введении в сравнении с плацебо у пациентов с тромбоэмболией легочных артерий (ТЭЛА) промежуточно-высокого риска в клиническом исследовании ФОРПЕ-2.
Материал и методы. Неиммуногенная стафилокиназа обладает высокой тромболитической активностью и фибринселективностью. Клиническое исследование ФОРПЕ-2 — многоцентровое двойное слепое рандомизированное плацебо-контролируемое исследование. На клинических базах пациенты (общее количество 486 человек с учетом возможного 10%-го выбывания) с подтвержденной ТЭЛА и признаками дисфункции правого желудочка по данными мультиспиральной компьютерной томографии с контрастированием легочных артерий и повышенным риском гемодинамической нестабильности (ТЭЛА промежуточно-высокого риска) будут поровну рандомизированы на две группы для назначения неиммуногенной стафилокиназы или плацебо. В протоколе исследования представлены критерии включения и невключения, расчет необходимого объема выборки пациентов и план проведения исследования. В качестве первичной конечной точки эффективности будет использоваться совокупность смертности от всех причин, гемодинамического коллапса и повторной ТЭЛА в течение 30 дней после рандомизации. Критериями безопасности будут являться случаи геморрагического инсульта в течение госпитализации и кровотечения 3 и 5 типов по критериям BARC.
Результаты. По итогам исследования будут получены данные об эффективности и безопасности неиммуногенной стафилокиназы у пациентов с ТЭЛА промежуточно-высокого риска. Будет составлен отчет с приложениями индивидуальных данных и статистического анализа результатов.
Ключевые слова
Для цитирования:
Терещенко С.Н., Яровая Е.Б., Леонтьев С.Г., Явелов И.С., Шахнович Р.М., Эрлих А.Д., Ускач Т.М., Дупляков Д.В., Куценкo В.А., Ивлев О.Е., Сопленкова А.Г., Семенов А.М., Семенов M.П., Иванов С.В., Маркин С.С. Неиммуногенная стафилокиназа у пациентов с массивной тромбоэмболией легочных артерий промежуточно-высокого риска: протокол многоцентрового двойного слепого рандомизированного плацебо-контролируемого исследования ФОРПЕ-2. Российский кардиологический журнал. 2025;30(2):6291. https://doi.org/10.15829/1560-4071-2025-6291. EDN: UEUTUR
For citation:
Tereshchenko S.N., Yarovaya E.B., Leontiev S.G., Yavelov I.S., Shakhnovich R.M., Erlikh A.D., Uskach T.M., Duplyakov D.V., Kutsenko V.A., Ivlev O.E., Soplenkova A.G., Semenov A.M., Semenov M.P., Ivanov S.V., Markin S.S. Non-immunogenic staphylokinase in patients with massive intermediate-high risk pulmonary embolism: protocol of the FORPE-2 multicenter, double-blind, randomized, placebo-controlled trial. Russian Journal of Cardiology. 2025;30(2):6291. (In Russ.) https://doi.org/10.15829/1560-4071-2025-6291. EDN: UEUTUR
Тромбоэмболия лёгочных артерий (ТЭЛА) — важнейшая проблема современной медицины, занимающая одно из ведущих мест среди причин внезапной смерти. Наиболее часто ТЭЛА развивается после травм (24%), оперативных вмешательств (25%) и заболеваний, протекающих с нарушением гемодинамики (51%). В Российской Федерации смертность от ТЭЛА колеблется в пределах 10-30% в зависимости от своевременной диагностики и применения адекватных методов лечения — в первую очередь тромболитической терапии [1].
Согласно принятой в Российской Федерации и странах Европы классификации, выделяют ТЭЛА высокого, промежуточного и низкого риска (табл. 1) [1][2].
Таблица 1
Классификация ТЭЛА с учетом риска смерти во время госпитализации/в ближайшие 30 суток
Риск смерти при ТЭЛА | Показатели риска | ||||
Шок | Класс III-IV по PESI или sPESI ≥1 | Признаки дисфункции ПЖ | Повышенный уровень сердечных биомаркеров в крови* | ||
Высокий | + | + | + | (+)** | |
Промежуточный | Высокий | - | + | + | + |
Низкий | - | + | только один или оба отсутствуют*** | ||
Низкий | - | - | оценка не обязательна; если оценены, то оба отсутствуют | ||
Примечание: * — сердечный тропонин или мозговой натрийуретический пептид/NT-концевой фрагмент предшественника мозгового натрийуретического пептида, ** — при шоке/артериальной гипотонии их оценка не нужна, *** — одного позитивного признака достаточно даже при невысоком индексе PESI.
Сокращения: КТ — компьютерная томография, ПЖ — правый желудочек, ТЭЛА — тромбоэмболия легочной артерии, ЭхоКГ — эхокардиография, PESI — индекс тяжести тромбоэмболии легочной артерии.
В соответствии с российскими и европейскими клиническими рекомендациями, системная тромболитическая терапия — патогенетически обоснованный нехирургический метод лечения массивной ТЭЛА, позволяющий быстро снизить постнагрузку на правый желудочек (ПЖ) путём растворения (лизиса) тромбов в системе лёгочной артерии, улучшить лёгочную перфузию и, таким образом, стабилизировать системную гемодинамику и улучшить газообмен. Максимальная польза от проведения тромболитической терапии доказана у пациентов с массивной ТЭЛА, т. е. ТЭЛА высокого риска, сопровождающейся шоком или системной гипотензией [3]. Однако вопрос о том, может ли тромболитическая терапия улучшать клинический исход гемодинамически стабильных пациентов, т. е. с ТЭЛА промежуточно-высокого риска, до сих пор остается дискуссионным [4].
В проводимых ранее исследованиях тромболитической терапии включались пациенты с ТЭЛА промежуточного риска без выделения в отдельную подгруппу пациентов промежуточно-высокого риска для проведения тромболизиса. В исследовании MAPPETT у пациентов с ТЭЛА промежуточного риска применялся препарат алтеплазе (100 мг) в сравнении с плацебо. Первичной конечной точкой эффективности являлась смертность от всех причин или клиническое ухудшение, которое соответствовало признакам гемодинамического коллапса (необходимость инфузии катехоламинов, сердечно-легочной реанимации) или повторной ТЭЛА (проведение повторного тромболизиса или хирургической эмболэктомии) в течение 30 дней после рандомизации. Суммарное количество пациентов, достигших первичной конечной точки, было статистически достоверно в группе плацебо (24,6%) в сравнении с группой алтеплазе (11%) (р=0,006) [5].
В проведенном клиническом исследовании PEITHO у пациентов с ТЭЛА промежуточного риска с признаками дисфункции ПЖ препарат тенектеплаза, вводимый по схеме однократного болюса в дозе 30-50 мг в зависимости от массы тела, сравнивался с плацебо. Была показана высокая эффективность тенектеплазы, сочетавшаяся со значительным (6,3%) риском геморрагического инсульта, что не позволило включить тенектеплазу в список рекомендуемых тромболитических препаратов при ТЭЛА [6].
В настоящее время стартовало клиническое исследование PEITHO-3, в котором пациентам с ТЭЛА промежуточно-высокого риска с поражением ПЖ вводится уменьшенная доза алтеплазы (0,6 мг/кг инфузионно в зависимости от массы тела, максимально 50 мг) в сравнении с плацебо [7]. Ожидается, что снижение дозы тромболитика будет способствовать сокращению развития нежелательных явлений.
Неиммуногенная стафилокиназа (Фортелизин®, "СупраГен", Россия, МНН/химическое наименование — рекомбинантный белок, содержащий аминокислотную последовательность стафилокиназы) — тромболитический препарат с высокой фибринселективностью. В клиническом исследовании ФРИДОМ1 неиммуногенная стафилокиназа показала сопоставимую с препаратом тенектеплаза эффективность и отсутствие геморрагических осложнений. Это позволило включить ее в стандарты лечения острого инфаркта миокарда с подъемом ST и клинические рекомендации, в т. ч. для пациентов с кардиогенным шоком [8-10].
По результатам исследования ФРИДА неиммуногенная стафилокиназа была включена в протокол лечения ишемического инсульта в период до 4,5 ч от начала симптомов [11][12]. Благодаря высокой фибринселективности риск симптомных геморрагических трансформаций при использовании неиммуногенной стафилокиназы минимален.
В клиническом исследовании ФОРПЕ неиммуногенная стафилокиназа вводилась пациентам с массивной ТЭЛА высокого риска с признаками перегрузки ПЖ однократного болюсно в дозе 15 мг независимо от массы тела. Результаты исследования показали ее высокую эффективность, сопоставимую с эффективностью препарата сравнения алтеплазе, и отсутствие геморрагических осложнений. При использовании неиммуногенной стафилокиназы установлено сокращение объема эмболического поражения легочных артерий, снижение признаков перегрузки ПЖ по данным эхокардиографии, нормализация систолического давления в легочной артерии [13][14].
Потому представляется актуальным проведение плацебо-контролируемого клинического исследования ФОРПЕ-2 у пациентов с ТЭЛА промежуточно-высокого риска с поражением ПЖ. Предполагается, что тромболитическая терапия неиммуногенной стафилокиназой в дозе 15 мг приведет к снижению признаков дисфункции ПЖ, нормализации гемодинамики и снижению смертности у этой категории пациентов.
Исходя из вышеизложенного, целью настоящего исследования является оценка эффективности и безопасности неиммуногенной стафилокиназы при ее однократном болюсном введении в сравнении с плацебо у пациентов с ТЭЛА промежуточно-высокого риска.
Материал и методы
Протокол исследования ФОРПЕ, версия 1.2 утвержден Минздравом России № 106 от 21.03.2024г, Советом по Этике Минздрава России № 346 от 17.10.2023г и зарегистрирован на clinicaltrials.gov № NCT06362746 (FORPE-2). Национальный исследователь-координатор — д. м. н., проф. С. Н. Терещенко. Критерии включения и невключения в исследование ФОРПЕ-2 представлены в таблице 2.
Таблица 2
Критерии включения и невключения
Критерии включения |
• Мужчины и женщины в возрасте 18 лет и старше. • Верифицированный диагноз массивная ТЭЛА промежуточно-высокого риска, не более двух недель от начала симптомов, определяемая по данным МСКТ с контрастированием легочных артерий. • Дисфункция ПЖ, определяемая как отношение конечных диастолических диаметров ПЖ/ЛЖ >1,0 по данным МСКТ с контрастированием легочных артерий. • Повышенный риск ранней смерти или гемодинамического коллапса, определенный по одному из следующих критериев: а) САД <110 мм рт.ст., но не <90 мм рт.ст. в течение >15 мин; б) Частота дыхания >20 в мин или SpO2 <90% без кислородной поддержки; в) Хроническая сердечная недостаточность со сниженной фракцией выброса ЛЖ <40%. • Концентрация высокочувствительного тропонина I в сыворотке >14 пг/мл в возрасте до 75 лет, и >45 пг/мл в возрасте 75 лет и старше. • Согласие пациента на использование надежных методов контрацепции на протяжении всего исследования и в течение 3 нед. после: — женщины, имеющие отрицательный тест на беременность и использующие следующие средства контрацепции: внутриматочные спирали, оральные контрацептивы, контрацептивный пластырь, инъекционные контрацептивы пролонгированного действия, двойной барьерный метод контрацепции. В исследовании также могут принять участие женщины, не способные к деторождению (документально подтвержденные состояния: гистерэктомия, перевязка маточных труб, бесплодие, менопауза >1 года); — мужчины, использующие барьерные средства контрацепции. В исследовании также могут принять участие мужчины, не способные к деторождению (документально подтвержденные состояния: вазэктомия, бесплодие). • Наличие подписанного и датированного информированного согласия пациента на участие в исследовании. |
Критерии невключения |
• Массивная ТЭЛА высокого риска с нестабильной гемодинамикой. • Повышенный риск кровотечений: — продолжающееся тяжелое или угрожающее кровотечение в настоящее время или в течение предыдущих 6 мес.; — внутричерепное (в т. ч. субарахноидальное) кровоизлияние в настоящее время; — геморрагический инсульт (давностью <6 мес.); — заболевания центральной нервной системы в анамнезе (новообразования, аневризма); — интракраниальные или спинальные хирургические вмешательства (за последние 2 мес.); — обширное хирургическое вмешательство или обширная травма в течение предыдущих 4 нед.; — недавно произведенная пункция некомпрессируемого кровеносного сосуда (например, подключичной или яремной вены); — тяжелые заболевания печени, в т. ч. печеночная недостаточность, цирроз, портальная гипертензия (в т. ч. варикозное расширение вен пищевода) и активный гепатит; — язвенная болезнь желудка или двенадцатиперстной кишки (в течение последних 3 мес. от момента обострения); — новообразование с повышенным риском развития кровотечения; — одновременный прием дабигатрана без предварительного введения идаруцизумаба; — артериальные аневризмы, дефекты развития артерий/вен; — острый панкреатит; — септический эндокардит, перикардит; — подозрение на расслаивающую аневризму аорты; — любые другие состояния, по мнению врача связанные с высоким риском кровотечения. • Лактация, беременность. • Известная гиперчувствительность к неиммуногенной стафилокиназе. |
Сокращения: ЛЖ — левый желудочек, МСКТ — мультиспиральная компьютерная томография, ПЖ — правый желудочек, САД — систолическое артериальное давление, ТЭЛА — тромбоэмболия легочной артерии, SpO2 — сатурация.
Дизайн исследования и расчет необходимой выборки пациентов. Исследование является многоцентровым двойным слепым рандомизированным плацебо-контролируемым исследованием большей эффективности и безопасности в двух параллельных группах, проводимым в рамках IIIb фазы. В клинических центрах пациенты с диагнозом ТЭЛА промежуточно-высокого риска будут поровну распределены случайным образом на две группы для назначения неиммуногенной стафилокиназы или плацебо (1:1). Рандомизационная последовательность определена независимыми специалистами с помощью генератора случайных чисел и не будет известна ни спонсору, ни главным исследователям, ни пациентам в клинических центрах.
Расчет объема выборки пациентов для клинического исследования ФОРПЕ-2 проводился на основании результатов предшествующих исследований тромболитической терапии у пациентов с ТЭЛА промежуточно-высокого риска. В исследовании PEITHO была выделена подгруппа пациентов с ТЭЛА промежуточно-высокого риска. Анализ эффективности и безопасности тромболитической терапии в этой подгруппе показал, что первичная конечная точка эффективности — совокупность смертности от всех причин, гемодинамического коллапса и повторной ТЭЛА в течение 30 дней после рандомизации — достигалась у 3,7% пациентов в группе тенектеплазы и у 11,2% пациентов в группе плацебо [15]. В исследовании ФОРПЕ-2 в качестве первичной конечной точки эффективности также предлагается использовать показатель совокупности смертности от всех причин, гемодинамического коллапса и повторной ТЭЛА в течение 30 дней после рандомизации.
Расчет необходимой численности пациентов проведен для исследования большей эффективности (superiority) в параллельных группах. Нулевая гипотеза состоит в том, что проведение тромболитической терапии неиммуногенной стафилокиназой даст тот же эффект, как и применение плацебо. Это соответствует тому, что вероятность возникновения первичного критерия в группе сравнения (p1) равна таковой в группе исследуемого препарата (p2):
H0: p1 = p2
Альтернативная гипотеза состоит в том, что терапия неиммуногенной стафилокиназой отличается от терапии плацебо:
H0: p1 ≠ p2
Расчет объема выборки для подобной гипотезы и одинаковой численности групп проведен для критерия о равенстве долей по формуле [16]:
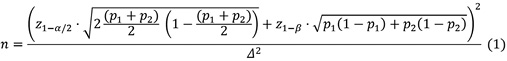
где n – число пациентов в каждой из сравниваемых групп без поправки на непрерывность; p1 — доля ответивших, у которых достигнут первичный критерий эффективности в группе исследуемого препарата (неиммуногенной стафилокиназы); p2 — доля ответивших, у которых достигнут первичный критерий эффективности в группе сравнения (плацебо); Δ=p2-p1 — ожидаемая разность между долями ответивших в группах исследуемого препарата и сравнения; α и β — вероятности ошибки I и II рода соответственно; z1–α/2 и z1–β – критические значения стандартного нормального распределения.
К указанной выше формуле необходимо применить поправку на непрерывность согласно следующей формуле [16]:
n' = n + 2|∆| (2)
где n' — итоговое число пациентов в каждой из сравниваемых групп.
Ожидаемая частота достижения первичного критерия эффективности при применении неиммуногенной стафилокиназы Pтромболизис принята равной 3,7%, та же частота в группе применения плацебо принята равной 11,2% [15]. Таким образом, разность между вероятностью достижения первичного критерия эффективности в группе неиммуногенной стафилокиназы и той же вероятностью в группе плацебо равна Δ = p2 – p1 = 11,2% – 3,7% = 7,5%.
Уровень значимости исследования предполагается равным 5% (α = 0,05). Мощность исследования принята равной 80% (1 – β = 0,8).
В этом случае z1–α/2 = 1,96 и z1–β = 0,84. Тогда по формуле (1) получаем 191,2.
По формуле (2) вычисляем объем выборки с учетом поправки на непрерывность:
n' = n + 2|∆| = 192,2 + 20,075 ≈ 218.
Таким образом, в каждую терапевтическую группу необходимо включить 218 участников. С учетом возможного выбывания 10% пациентов размер выборки в каждой группе увеличивается до 243 участников. Таким образом, общий размер выборки с учетом выбывания составляет 486 участников.
Статистический анализ. Все показатели, внесенные в индивидуальные регистрационные карты, будут и отсортированы по группам (неиммуногенная стафилокиназа или плацебо), рандомизационному номеру пациента и визиту.
Статистическая обработка данных будет проведена с использованием статистических пакетов R 4.2 (R Foundation for Statistical Computing).
Для непрерывных показателей в группах будут представлены следующие описательные статистики: количество данных за вычетом пропусков (n), среднее арифметическое (M), стандартное отклонение (SD), медиана (Med), 25- и 75-процентили (Q1 и Q3, соответственно), минимум и максимум, стандартная ошибка (m) и 95% доверительный интервал (ДИ) для среднего значения. Для проверки гипотез, в зависимости от поставленной задачи, будут рассматриваться как односторонние, так и двусторонние альтернативы. Для всех тестов уровень ошибки I рода полагается равным 0,05.
Частота достижения конечных точек эффективности и безопасности будет описана с помощью абсолютных и относительных значений, для которых будут рассчитаны двусторонние 95% ДИ. Для разности относительных частот (рисков) будут приведены 95% ДИ.
Для всех серьезных нежелательных явлений будут определены их абсолютные и относительные частоты и соответствующие 95% ДИ по методу Клоппера-Пирсона. Для каждого серьезного нежелательного явления, наблюдавшегося неоднократно, будет вычислено отношение числа пациентов, по крайней мере, с одним подобным случаем к общему числу пациентов и его ДИ.
Гипотезы об однородности распределений параметров в группах исследуемого препарата и плацебо будут производиться с помощью стандартных непараметрических статистических методов. Сравнение распределений в группах будет производиться при помощи теста Манна-Уитни для количественных переменных и точного критерия Фишера для категориальных переменных. Гипотезы о динамике количественных показателей в каждой из групп будут проверяться при помощи непараметрического теста Фридмана. Динамики в группах исследуемого препарата и плацебо будут сравниваться с помощью непараметрического аналога дисперсионного анализа повторных измерений для двух факторов. Различия при проверке гипотез будут считаться статистически значимыми при уровне значимости p<0,05.
План проведения исследования ФОРПЕ
В исследование будет включено 486 пациентов с ТЭЛА промежуточно-высокого риска. Пациенты будут наблюдаться в течение 30 дней: первые двое суток (в среднем) в отделении реанимации, в оставшиеся дни до выписки — в стационаре (в среднем до 7 дней). Амбулаторный визит запланирован на 30-й день (табл. 3).
Таблица 3
План проведения исследования ФОРПЕ-2
Наименование процедур исследования | V1 | V2 | V3 | V4 | V5 |
0 | 1 cут. | 2 cут. | При выписке | 30 cут. (амбулаторно) | |
Оценка критериев включения/невключения | + | — | — | — | — |
Подписание информированного согласия | + | — | — | — | — |
Сбор демографических данных | + | — | — | — | — |
Сбор медицинского анамнеза | + | — | — | — | — |
Оценка проводимого ранее лечения | + | — | — | — | — |
Стратификация риска по классификациям PESI и SIRENA | + | — | — | + | — |
МСКТ с контрастированием ЛА | + | — | + | — | — |
ЭхоКГ с определением СДЛА | + | + | — | + | + |
УЗАС системы нижней полой вены | + | + | — | — | — |
Оценка жизненно-важных показателей | + | + | + | + | + |
Определение риска гемодинамической нестабильности | + | + | + | + | — |
Физикальное обследование | + | — | — | — | — |
Оценка сопутствующих заболеваний | + | — | — | — | — |
Оценка изменений по органам и системам | — | + | + | + | + |
ЭКГ | + | — | — | + | — |
Коагулограмма | + | + | + | + | — |
Общий анализ крови | + | + | — | + | — |
Биохимический анализ крови | + | — | — | + | — |
Липидный профиль | + | — | — | — | — |
Определение тропонина I | + | + | + | + | — |
Общий анализ мочи | + | + | — | + | — |
Введение неиммуногенной стафилокиназы или плацебо | + | — | — | — | — |
Изменения сопутствующей терапии | — | + | + | + | + |
Регистрация НЯ/СНЯ | — | + | + | + | + |
Оценка кровотечений | — | + | + | + | — |
Сокращения: ЛА — легочные артерии, МСКТ — мультиспиральная компьютерная томография, НЯ —нежелательное явление, СДЛА — систолическое давление в легочной артерии, СНЯ — серьезное нежелательное явление, УЗАС — ультразвуковое ангиосканирование, ЭКГ — электрокардиография, ЭхоКГ — эхокардиография, PESI — индекс тяжести тромбоэмболии легочной артерии.
В каждом исследовательском центре субъекту исследования присваивается порядковый номер, который соответствует последовательности включения пациента в исследование. Порядковый номер вносится в индивидуальную регистрационную карту.
До начала участия пациента в клиническом исследовании должны быть подписаны и датированы пациентом или его законным представителем два заполненных экземпляра Информированного согласия. Один экземпляр подписанного и датированного письменного Информированного согласия будет предоставлен пациенту, второй будет храниться у исследователя.
В случаях, когда состояние пациента не позволяет ему выразить свою волю и законный представитель отсутствует, а необходимость проведения лечения неотложна, вопрос о медицинском вмешательстве в интересах пациента и включении его в исследование решает консилиум, а при невозможности собрать консилиум — непосредственно лечащий (дежурный) врач с последующим уведомлением главного исследователя, должностных лиц клинического центра, законного представителя и пациента с предоставлением ему возможности лично подписать форму Информированного согласия (утверждено Советом по Этике Минздрава России, протокол № 346 от 17.10.2023г).
У всех пациентов будет собран тщательный медицинский анамнез, проведена оценка жизненно-важных показателей, признаков риска гемодинамической нестабильности, стратификации риска для оценки прогноза по классификациям PESI [17] и SIRENA [18], проведены мультиспиральная компьютерная томография с контрастированием легочных артерий, электрокардиография, эхокардиография, ультразвуковое ангиосканирование системы нижней полой вены, взяты образцы крови и мочи для проведения лабораторных исследований.
Объем эмболического поражения легочных артерий по данным мультиспиральной компьютерной томографии будет оцениваться в баллах с использованием КТ-индекса по А. И. Кириенко [19] и индекса Qanadli [20].
Критерием дисфункции ПЖ при ТЭЛА принято считать увеличение отношения конечных диастолических диаметров ПЖ к левому желудочку (ЛЖ) >1,0 [2]. Также будут оцениваться объемы камер сердца, систолическое давление в легочной артерии, наличие гипокинеза свободной стенки ПЖ, фракция выброса ЛЖ.
Препараты будут вводиться всем рандомизированным пациентам в/в в дозе 15 мг однократно болюсно в течение 10-15 с.
Лечение пациентов будет осуществляться в соответствии с действующими рекомендациями [1][2]. После проведения тромболизиса будет начата антикоагулянтная терапия нефракционированным гепарином в течение 24 ч. Через 24 ч будет осуществлен переход на низкомолекулярный гепарин, который будет вводиться в течение 7 суток. Прием пероральных антикоагулянтов или варфарина будет осуществляться не менее 6 мес. Критерии эффективности и безопасности представлены в таблице 4.
Таблица 4
Критерии оценки эффективности и безопасности тромболитической терапии
Критерии оценки эффективности | |
Первичная конечная точка эффективности | смерть от всех причин в течение 30 дней + гемодинамический коллапс в течение 30 дней + повторная ТЭЛА в течение 30 дней |
Вторичные конечные точки эффективности | — динамика отношения конечных диастолических диаметров ПЖ/ЛЖ в диастолу через 24 ч по данным МСКТ и через 30 дней после тромболизиса по данным ЭхоКГ |
— динамика объема ПЖ в диастолу по данным МСКТ через 24 ч после тромболизиса | |
— динамика объема эмболического поражения легочных артерий по данным МСКТ через 24 ч после тромболизиса | |
— смерть от всех причин в период госпитализации | |
— смерть от всех причин в течение 30 дней | |
Критерии оценки безопасности | |
Конечные точки безопасности | — геморрагический инсульт в период госпитализации |
— кровотечения по критериям BARC типы 3 и 5 | |
— количество и выраженность серьезных нежелательных явлений по органам и системам | |
Сокращения: ЛЖ — левый желудочек, МСКТ — мультиспиральная компьютерная томография, ПЖ — правый желудочек, ТЭЛА — тромбоэмболия легочной артерии, ЭхоКГ — эхокардиография.
Для оценки хода клинического исследования, включая рассмотрение критериев безопасности и эффективности, а также для выработки рекомендаций о целесообразности продолжения, прекращения исследования или внесения в него изменений, будет образован Независимый комитет по мониторингу данных. Он будет анализировать промежуточные результаты оценки эффективности и безопасности проводимого исследования по достижению 25%, 50%, 75% и 100% набора пациентов в исследование.
По итогам исследования будет составлен отчет с приложениями индивидуальных данных и статистическим анализом. Статистическая обработка будет осуществляться независимым экспертом по статистике на основании данных индивидуальных регистрационных карт. Результаты исследования будут опубликованы в печати и представлены на конференциях.
Отношения и деятельность: все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье.
Список литературы
1. Bokeriya LA, Zatevakhin II, Kirienko AI, et al. Russian guidelines for the diagnosis, danger and prevention of venous thromboembolic complications. Flebologiya. 2015;4(2):1-52. (In Russ.) Бокерия Л. А., Затевахин И. И., Кириенко А. И. и др. Российские клинические рекомендации по диагностике, лечению и профилактике венозных тромбоэмболических осложнений (ВТЭО). Флебология. 2015;4(2):1-52.
2. Konstantinides SV, Meyer G, Becattini C, et al. 2019 ESC Guidelines for the diagnosis and management of acute pulmonary embolism developed in collaboration with the European Respiratory Society (ERS). Eur. Heart J. 2019;00:31-61. doi:10.1093/eurheartj/ehu283.
3. Konstantinides SV, Barco S, Lankeit M, et al. Management of pulmonary embolism: an update. J. Am. Coll. Cardiol. 2016;67(8):976-90. doi:10.1016/j.jacc.2015.11.061.
4. Konstantinides S. Clinical practice. Acute pulmonary embolism. N. Engl. J. Med. 2008; 359(26):2804-13. doi:10.1056/NEJMcp0804570.
5. Konstantinides S, Geibel A, Heusel G, et al. Heparin plus alteplase compared with heparin alone in patients with submassive pulmonary embolism. N. Engl. J. Med. 2002; 347(15):1143-50. doi:10.1056/NEJMoa021274.
6. Meyer G, Vicaut E, Danays T, et al. Fibrinolysis for Patients with Intermediate-Risk Pulmonary Embolism. N. Engl. J. Med. 2014;370:1402-11. doi:10.1056/NEJMoa1302097.
7. Sanchez O, Charles-Nelson A, Ageno W, et al. Reduced-Dose Intravenous Thrombolysis for Acute Intermediate-High-risk Pulmonary Embolism: Rationale and Design of the Pulmonary Embolism International THrOmbolysis (PEITHO)-3 trial. Thromb. Haemost. 2022;22(5):857-66. doi:10.1055/a-1653-4699.
8. Маркин С. С., Семенов А. М., Марков В. А. и др. Клиническое исследование отечественного фибринселективного тромболитического препарата Фортелизин® (III фаза). Вестник Российского университета дружбы народов. Серия: Медицина. 2012; 1:105-10.
9. Марков В. А., Дупляков Д. В., Константинов С. Л. и др. Фортелизин® в сравнении с Метализе® при инфаркте миокарда с подъемом сегмента ST: результаты многоцентрового рандомизированного исследования ФРИДОМ1. Кардиологический вестник. 2017;14:52-9.
10. Марков В. А., Дупляков Д. В., Константинов С. Л. и др. Расширенные результаты применения лекарственного препарата Фортелизин® в исследовании ФРИДОМ1 и реальной клинической практике. Российский кардиологический журнал. 2022;27(8):5178. doi:10.15829/1560-4071-2022-5178.
11. Gusev EI, Martynov MYu, Nikonov AA, et al. Non-immunogenic recombinant staphylokinase versus alteplase for patients with acute ischaemic stroke 4.5 h after symptom onset in Russia (FRIDA): a randomised, open label, multicentre, parallel-group, non-inferiority trial. Lancet Neurol. 2021;20:721-8. doi:10.1016/S1474-4422(21)00210-6.
12. Гусев Е. И., Мартынов М. Ю., Шамалов Н. А. и др. Неиммуногенная стафилокиназа — новый тромболитический препарат в лечении ишемического инсульта (результаты исследования ФРИДА). Журнал неврологии и психиатрии им. С. С. Корсакова. 2022;122(7):56-65. doi:10.17116/jnevro202212207156.
13. Kirienko AI, Leontyev SG, Tereschenko SH, et al. Non-immunogenic recombinant staphylokinase versus alteplase for patients with massive pulmonary embolism: a randomised open-label, multicenter, parallel-group, non-inferiority trial FORPE. J. Thromb. Haemost. 2024;S1538-7836(24)00624-X. doi:10.1016/j.jtha.2024.09.035.
14. Кириенко А. И., Леонтьев С. Г., Яровая Е. Б. и др. Неиммуногенная стафилокиназа — тромболитический препарат в лечении массивной тромбоэмболии легочной артерии: результаты клинического исследования ФОРПЕ. Российский кардиологический журнал. 2024;29(11):6157. doi:10.15829/1560-4071-2024-6157.
15. Barco S, Vicaut E, Klok FA, et al. Improved identification of thrombolysis candidates amongst intermediate-risk pulmonary embolism patients: implications for future trials. Eur. Respir. J. 2018;51:1701-75. doi:10.1183/13993003.01775-2017.
16. Fleiss JL, Levin B, Paik MC. Statistical Methods for Rates and Proportions, 3rd Edition, 2013.
17. Donzé J, Gal G, Fine MJ, et al. Prospective validation of the Pulmonary Embolism Severity Index: A clinical prognostic model for pulmonary embolism. Thromb. Haemost. 2008;100:943-8. doi:10.1160/th08-05-0285.
18. Эрлих А. Д., Барбараш О. Л., Бернс С. А. и др. Шкала SIRENA для оценки риска госпитальной смерти у пациентов с острой лёгочной эмболией. Российский кардиологический журнал. 2020;25(4S):4231. doi:10.15829/1560-4071-2020-4231.
19. Кириенко А. И., Яровая Е. Б., Куценко В. А. и др. Неиммуногенная стафилокиназа в сравнении с алтеплазой у пациентов с массивной ТЭЛА: протокол многоцентрового открытого рандомизированного сравнительного клинического исследования ФОРПЕ. Флебология. 2022;16(2):114-21. doi:10.17116/flebo202216021114.
20. Qanadli SD, Hajjam ME, Vieillard-Baron A, et al. New CT index to quantify arterial obstruction in pulmonary embolism: comparison with angiographic index and echocardiography. Am. J. Roentgenol. 2001;176:1415-20. doi:10.2214/ajr.176.6.1761415.
Об авторах
С. Н. ТерещенкоРоссия
д.м.н., профессор, руководитель отдела заболеваний миокарда и сердечной недостаточности, зав. кафедрой кардиологии.
Москва
Конфликт интересов:
нет
Е. Б. Яровая
Россия
д.ф.м.н., профессор кафедры теории вероятностей отделения математики механико-математического факультета.
Москва
Конфликт интересов:
нет
С. Г. Леонтьев
Россия
д.м.н., профессор, кафедра факультетской хирургии.
Москва
Конфликт интересов:
нет
И. С. Явелов
Россия
д.м.н., профессор, руководитель отдела фундаментальных и клинических проблем тромбоза при неинфекционных заболеваниях.
Москва
Конфликт интересов:
нет
Р. М. Шахнович
Россия
д.м.н., профессор, в.н.с. отдела неотложной кардиологии.
Москва
Конфликт интересов:
нет
А. Д. Эрлих
Россия
д.м.н., профессор кафедры факультетской терапии.
Москва
Конфликт интересов:
нет
Т. М. Ускач
Россия
д. м. н., профессор, в. н. с. отдела заболеваний миокарда и сердечной недостаточности.
Москва
Конфликт интересов:
нет
Д. В. Дупляков
Россия
д. м. н., профессор, зам. главного врача.
Самара
Конфликт интересов:
нет
В. А. Куценкo
Россия
к.ф.м.н., с. н. с. лаборатории биостатистики.
Москва
Конфликт интересов:
нет
О. Е. Ивлев
Россия
м.н.с. лаборатории биостатистики, аспирант кафедры теории вероятностей, механико-математический факультет.
Москва
Конфликт интересов:
нет
А. Г. Сопленкова
Россия
м.н.с. лаборатории биостатистики, м.н.с. лаборатории искусственного интеллекта в биоинформатике и медицине, институт перспективных исследований проблем искусственного интеллекта и интеллектуальных систем.
Москва
Конфликт интересов:
нет
А. М. Семенов
Россия
к.э.н., доцент, генеральный директор.
Москва
Конфликт интересов:
нет
M. П. Семенов
Россия
сотрудник.
Москва
Конфликт интересов:
нет
С. В. Иванов
Россия
к.б.н., специалист по клиническим исследованиям; с.н.с.
Москва
Конфликт интересов:
нет
С. С. Маркин
Россия
д.м.н., профессор, г.н.с.
Москва
Конфликт интересов:
нет
- Неиммуногенная стафилокиназа обладает высокой тромболитической активностью и фибринселективностью.
- Клиническое исследование ФОРПЕ-2 — многоцентровое двойное слепое рандомизированное плацебо-контролируемое исследование, в котором изучается эффективность и безопасность неиммуногенной стафилокиназы у пациентов с тромбоэмболией легочных артерий промежуточно-высокого риска.
Рецензия
Для цитирования:
Терещенко С.Н., Яровая Е.Б., Леонтьев С.Г., Явелов И.С., Шахнович Р.М., Эрлих А.Д., Ускач Т.М., Дупляков Д.В., Куценкo В.А., Ивлев О.Е., Сопленкова А.Г., Семенов А.М., Семенов M.П., Иванов С.В., Маркин С.С. Неиммуногенная стафилокиназа у пациентов с массивной тромбоэмболией легочных артерий промежуточно-высокого риска: протокол многоцентрового двойного слепого рандомизированного плацебо-контролируемого исследования ФОРПЕ-2. Российский кардиологический журнал. 2025;30(2):6291. https://doi.org/10.15829/1560-4071-2025-6291. EDN: UEUTUR
For citation:
Tereshchenko S.N., Yarovaya E.B., Leontiev S.G., Yavelov I.S., Shakhnovich R.M., Erlikh A.D., Uskach T.M., Duplyakov D.V., Kutsenko V.A., Ivlev O.E., Soplenkova A.G., Semenov A.M., Semenov M.P., Ivanov S.V., Markin S.S. Non-immunogenic staphylokinase in patients with massive intermediate-high risk pulmonary embolism: protocol of the FORPE-2 multicenter, double-blind, randomized, placebo-controlled trial. Russian Journal of Cardiology. 2025;30(2):6291. (In Russ.) https://doi.org/10.15829/1560-4071-2025-6291. EDN: UEUTUR

















































