Перейти к:
Роль гепсидина в оценке прогноза у пациентов пожилого и старческого возраста с хронической сердечной недостаточностью и анемией
https://doi.org/10.15829/1560-4071-2025-6288
EDN: OFEPJC
Аннотация
Цель. Изучить роль гепсидина в оценке прогноза у пациентов пожилого и старческого возраста с хронической сердечной недостаточностью (ХСН) и анемией.
Материал и методы. В исследование включили 105 пациентов от 65 до 90 лет с ХСН II‑IV функционального класса (NYHA) ишемической этиологии с анемией. У пациентов однократно при поступлении исследовали уровни гепсидина и N‑концевого промозгового натрийуретического пептида (NT‑proBNP). Наблюдали пациентов до наступления первичной конечной точки — смерти от сердечно‑сосудистых и не сердечно‑сосудистых причин до 24 мес. Для оценки влияния уровней гепсидина на риск смерти пациентов стратифицировали по квартильным интервалам (КИ) уровней гепсидина. В каждом КИ пациентов разделили на 2 группы: с абсолютным и функциональным дефицитом железа. Для оценки влияния уровней гепсидина на риск смерти использовали регрессионный анализ пропорциональных рисков Кокса.
Результаты. У пациентов с ХСН и анемией уровни гепсидина значимо различались между 1КИ и 4КИ (р<0,001). Выявлено, что выраженность абсолютного дефицита железа уменьшалась от 1КИ к 4КИ, а выраженность системной воспалительной реакции, напротив, возрастала от 1КИ к 4КИ. За первые 6 мес. наблюдения выявлена самая высокая смертность у пациентов 1КИ (40%), а за 24 мес. — у пациентов 4КИ (77%). Регрессионный анализ выявил значимое влияние на риск смерти низких уровней гепсидина (3,05‑10,33 нг/мл) у пациентов 1КИ в модели 1 (отношение рисков (ОР) 1,661 (95% доверительный интервал (ДИ): 1,198‑2,303), р=0,002), в модели 2 (ОР 1,911 (95% ДИ: 1,350‑2,705), р<0,001), а также тенденцию к значимому влиянию на риск смерти повышенных уровней гепсидина (25,81‑70,71 нг/мл) у пациентов 4КИ в модели 1 (ОР 1,044 (95% ДИ: 0,997‑1,099), р=0,070), a в модели 2 — значимых влияний на риск смерти не выявлено (ОР 1,036 (95% ДИ: 0,989‑1,086), р=0,135). Зависимость между гепсидином и риском смерти имела вид U‑образной кривой в обеих моделях.
Заключение. Для оценки прогноза у пациентов пожилого и старческого возраста с ХСН и анемией, с учетом выявленного влияния на риск смерти как низких, так и повышенных уровней гепсидина, помимо общепринятого биомаркера — NT‑proBNP целесообразно определение уровней гепсидина.
Для цитирования:
Соломахина Н.И., Дементьева А.В., Соколов А.А. Роль гепсидина в оценке прогноза у пациентов пожилого и старческого возраста с хронической сердечной недостаточностью и анемией. Российский кардиологический журнал. 2025;30(8):6288. https://doi.org/10.15829/1560-4071-2025-6288. EDN: OFEPJC
For citation:
Solomakhina N.I., Dementyeva A.V., Sokolov A.A. Role of hepcidin in assessing the prognosis of elderly and senile patients with heart failure and anemia. Russian Journal of Cardiology. 2025;30(8):6288. (In Russ.) https://doi.org/10.15829/1560-4071-2025-6288. EDN: OFEPJC
Общепринятым биомаркером для диагностики и оценки тяжести хронической сердечной недостаточности (ХСН) является N-концевой промозговой натрийуретический пептид (NT-proBNP). Однако у пациентов с ХСН в сочетании с воспалительным, а также анемическим синдромами целесообразно исследовать прогностическую значимость маркеров, участвующих в патогенезе как анемии, так и воспаления, и которые могли бы дополнительно к NT-proBNP прогнозировать риски развития сердечно-сосудистых событий и смерти.
В настоящее время особое внимание придают белку гепсидину, открытому Park CH, et al. в 2001г [1], секретируемому в печени под влиянием провоспалительных цитокинов, преимущественно — интерлейкина-6 (ИЛ-6) [2]. Гепсидин, признанный главным регулятором обмена железа [3, 4], является, наряду с ферритином и С-реактивным белком (СРБ), медиатором воспаления [3-5], обладая свойствами, характерными для белков острой фазы [2][6].
Ранее предлагалось использовать гепсидин в качестве дополнительного диагностического критерия для дифференциальной диагностики между железодефицитной анемией и анемией хронических заболеваний наряду с ферритином и растворимыми рецепторами трансферрина [7]. А в последние годы предпринимаются попытки оценить прогностическую роль гепсидина при различных заболеваниях, в т.ч. при ХСН, однако полученные данные противоречивы.
Так, Ellingsen TS, et al. в исследовании TROMCE у пациентов старше 25 лет выявили, что повышенные уровни гепсидина коррелируют с повышенным риском венозных тромбоэмболий [8]. Li X, et al. выявили корреляцию повышенных уровней гепсидина со смертностью у пациентов с острым коронарным синдромом, но не выявили — у пациентов со стабильной ишемической болезнью сердца (ИБС) [9]. В то же время Grammer TB, et al. у пациентов со стабильной ИБС выявили более высокую смертность от сердечно-сосудистых и от всех причин при низких уровнях гепсидина [10]. Однако Ruhe J, et al. и Zeller T, et al. также у пациентов со стабильной ИБС не выявили существенного влияния низких уровней гепсидина на риск развития инфаркта миокарда [11] и смерти от сердечно-сосудистых причин [11][12].
У пациентов с ХСН многими авторами показана корреляция низких уровней гепсидина с риском смерти от всех причин, в т.ч. сердечно-сосудистых [13-15], в то же время корреляции повышенных уровней гепсидина с риском смерти выявлено не было [16]. При этом работы, где анализировалось бы прогностическое значение уровней гепсидина у пациентов с ХСН пожилого и старческого возраста, немногочисленны. Так, в цитируемых выше работах пациенты с ХСН были моложе (от 25 до 75 лет), исключались пациенты с воспалительным синдромом и не во всех исследованиях были пациенты с анемией. А работ, в которых прогностическая роль гепсидина оценивалась бы у когорты пациентов пожилого и старческого возраста, целенаправленно набранных для проспективного наблюдения не только с ХСН, но в сочетании с анемией и воспалительным синдромом, в доступной литературе мы не встретили.
Между тем, именно для пациентов пожилого и старческого возраста вследствие крайне высокой коморбидности характерно сочетание ХСН с анемией и воспалительным синдромом, которое часто встречается в реальной клинической практике, особенно на фоне декомпенсации ХСН, что обусловливает актуальность настоящего исследования.
Цель исследования: изучить роль гепсидина в оценке прогноза у пациентов пожилого и старческого возраста с ХСН и анемией.
Материал и методы
В исследование включили 105 пациентов пожилого и старческого возраста (от 65 до 90 лет), Госпиталя для ветеранов войн № 1 ДЗМ с ХСН II-IV функционального класса (NYHA) ишемической этиологии в сочетании с анемией (уровнем гемоглобина <12,0 г/дл как для мужчин, так и для женщин). Согласно диагностическим критериям анемии Всемирной организации здравоохранения (1968г), уровень гемоглобина должен быть ниже 130 г/л у мужчин и 120 г/л у женщин, однако при их разработке не включались пациенты старше 65 лет. Авторы последующих крупных популяционных исследований, направленных на определение нормальных уровней гемоглобина у пациентов пожилого и старческого возраста, встретились с трудностями регистрации адекватного числа действительно здоровых людей в этом возрасте [17][18].
В связи с чем многими гериатрами предлагается равный у обоих полов порог уровня гемоглобина в 12 г/дл для определения анемии, т.к. снижение гемоглобина с возрастом имеет тенденцию быть более выраженным у мужчин, чем у женщин, что связывают с прогрессирующим дефицитом андрогенов [18][19].
В исследование не включали пациентов с доказанной острой или хронической кровопотерей, гемолитическими, апластическими и мегалобластными анемиями, аутоиммунными и онкологическими заболеваниями, первичными заболеваниями почек.
У всех пациентов при поступлении осуществляли забор венозной крови для определения в сыворотке уровней гепсидина (Human Hepcidin-25), эритропоэтина (ЭПО), ИЛ-6 и NT-proBNP методом иммуноферментного анализа, а также — СРБ, ферритина и трансферрина, которые исследовали иммунотурбидиметрическим методом. Коэффициент насыщения трансферрина железом (КНТЖ) рассчитывали по формуле: сывороточное железо (мкмоль/л)/трансферрин (г/л) × 3,98.
Далее пациентов наблюдали до 24 мес. и фиксировали случаи смерти от сердечно-сосудистых и не сердечно-сосудистых причин (первичная конечная точка (ПКТ)), т.е. от всех причин, за исключением несчастных случаев. Все больные получали медикаментозную терапию ХСН согласно Клиническим рекомендациям по ХСН 2020 (Российское кардиологическое общество), утвержденным Минздравом России [20].
Исследование одобрено ЛЭК Первого МГМУ им. И. М. Сеченова (Сеченовский Университет). Протокол 01.21 от 22.01.2021. Все участники подписали информированное согласие.
Статистический анализ проводили с использованием пакетов статистических программ Statistica 8.0 Statsoft Inc. и IBM SPSS Statistics 23 (США). Статистические характеристики нормально распределенных показателей сравнивали при помощи параметрических тестов: дисперсионного анализа (one-way ANOVA) и post-hoc теста Ньюмена-Келлса (N-К). Прочие показатели сравнивали посредством непараметрических тестов: Манна-Уитни (U) или точного критерия Фишера. Для попарных множественных сравнений использовали дисперсионный анализ Краскала-Уоллиса (Н) с поправкой Бонферрони.
Для оценки влияния различных уровней гепсидина на риск смерти пациентов стратифицировали по квартильным интервалам (КИ) уровней гепсидина. Для каждого КИ построили по две многофакторные регрессионные модели Кокса. В модель 1 помимо гепсидина включали показатели, характеризующие обмен железа (гемоглобин, КНТЖ, ферритин, ЭПО). В модель 2 помимо гепсидина включали показатели, характеризующие системное воспаление (СРБ, ИЛ-6), а также ферритин. Для каждого КИ определяли отношение рисков и его 95% доверительные интервалы. Для визуализации связи гепсидина с риском смерти для каждой модели построили графики переменных регрессии с использованием кубических сплайнов, где в качестве контрольных точек использовали значения отношение рисков для каждого КИ.
Для сравнения частоты смертности и сроков наступления ПКТ в зависимости от выраженности дефицита железа (ДЖ) в каждом КИ пациентов разделили на 2 группы: с абсолютным ДЖ и функциональным ДЖ. ДЖ определяли как уровень ферритина <100 нг/мл ("абсолютный ДЖ") или уровень ферритина от 100 до 299 нг/мл при КНТЖ <20% ("функцио- нальный ДЖ") [17, 18, 21]. Уровнем статистической значимости считали р<0,05.
Результаты
Характеристика пациентов пожилого и старческого возраста с ХСН и анемией, стратифицированных по КИ уровней гепсидина
Пациенты с ХСН и анемией, стратифицированные по КИ уровней гепсидина, были сопоставимы по возрасту, тяжести ХСН и анемии, значимо не различались по сердечной коморбидности, однако у пациентов 4КИ чаще диагносцировались пневмонии (р=0,038) и мочевые инфекции (р=0,025), чем у пациентов 1КИ (табл. 1).
Согласно полученным данным, у обследованных пациентов выявлен широкий разброс значений ферритина, гепсидина, ЭПО, а также — СРБ и ИЛ-6, уровни которых значимо различались между 1КИ и 4КИ (р<0,001) (табл. 2).
Так как ранее Ponikowska B, et al. выявили повышенный риск смерти у пациентов как с низкими, так и высокими уровнями ферритина [22], а также с учетом положительной связи между уровнями ферритина и гепсидина [9][15], мы проанализировали процент пациентов с низкими уровнями ферритина <100 мкг/л (абсолютным ДЖ) и уровнями ферритина от 100 до 299 мкг/л (функциональным ДЖ) в разных КИ уровней гепсидина (рис. 1).
Выявлено, что уровни ферритина <100 мкг/л (от 3,1 до 99,2 мкг/л) при сниженном КНТЖ <20% (от 3,4 до 17,5%) были у всех пациентов 1КИ, т.е. у 100% пациентов 1КИ выявлен абсолютный ДЖ (рис. 1).
Во 2КИ уровни ферритина <100 мкг/л (от 11,1 до 88,1 мкг/л) были выявлены у 23 пациентов (85%), в то же время у 4 пациентов (15%) уровни ферритина были >100 мкг/л (от 104,2 до 126,1 мкг/л) при КНТЖ <20% (от 2,91% до 18,9%), т.е. у 85% пациентов 2КИ выявлен абсолютный ДЖ, а у 15% функциональный ДЖ (рис. 1).
В 3КИ уровни ферритина <100 мкг/л (от 44,2 до 91,1 мкг/л) были выявлены у 14 пациентов (52%), в то же время у 13 пациентов (48%) уровни ферритина были >100 мкг/л (от 101,1 до 282 мкг/л) при КНТЖ <20% (от 3,12 до 19,4%), т.е. у 52% пациентов 3КИ выявлен абсолютный ДЖ, а у 48% функциональный ДЖ (рис. 1).
В 4КИ только у 4 пациентов (15%) уровни ферритина были <100 мкг/л (от 57,1 до 96,1 мкг/л), а у 22 пациентов (85%) >100 мкг/л (от 105,1 до 300,0 мкг/л) при КНТЖ <20% (от 4,9 до 19,1%), т.е. у 15% пациентов 4КИ выявлен абсолютный ДЖ, а у 85% функциональный ДЖ (рис. 1).
Таким образом, большинство пациентов с абсолютным ДЖ выявлено среди пациентов 1КИ, у которых выявлены низкие уровни гепсидина, а большинство пациентов с функциональным ДЖ — среди пациентов 4КИ, у которых выявлены повышенные уровни гепсидина. При этом процент пациентов с абсолютным ДЖ уменьшался от 1КИ к 4КИ, а выраженность системной воспалительной реакции, напротив, возрастала от 1КИ к 4КИ (табл. 2, рис. 1-3). С учетом выявленного абсолютного и функционального ДЖ и повышенных уровней белков острой фазы воспаления: СРБ, ферритина, а также провоспалительного цитокина ИЛ-6, анемический синдром у пациентов всех КИ носил смешанный характер (железодефицитная анемия и анемия хронических заболеваний), с преимущественно абсолютным (1КИ) или функциональным ДЖ (4КИ).
Уровни гепсидина у пациентов пожилого и старческого возраста с ХСН и анемией и время наступления ПКТ
За 24 мес. наблюдения умерли 70 пациентов из 105 (67%), при этом в 1КИ — 15 из 25 (60%), во 2КИ — 19 из 27 (70%), в 3КИ — 16 из 27 (59%), а в 4КИ — 20 из 26 (77%) пациентов. Частота смертности и причины смерти представлены в таблице 3. Сравнение процентов смертности как для всех КИ (по критерию хи-квадрат (χ2=0,31; р=0,96), так и для отдельных КИ, а также по точному критерию Фишера, р=0,236) показало отсутствие значимых различий между КИ уровней гепсидина.
Учитывая это, мы проанализировали частоту смертности в разных КИ уровней гепсидина: до 6 мес., от 6 до 12, от 12 до 18 и от 18 до 24 мес. (рис. 4). Обращает внимание значимо высокая смертность (40%) за первые 6 мес. наблюдения в 1КИ, в котором все пациенты (100%) были с абсолютным ДЖ. А наибольшее количество умерших (77%) за 24 мес. наблюдения выявлено в 4КИ, в котором большинство пациентов (85%) были с функциональным ДЖ и у всех пациентов которого были выраженные признаки системной воспалительной реакции (табл. 2, рис. 4).
Анализ 24-мес. выживаемости пациентов пожилого и старческого возраста с ХСН и анемией, стратифицированных по КИ уровней гепсидина в регрессионных моделях Кокса
Анализ 24-мес. выживаемости выявил значимое влияние на риск смерти низких уровней гепсидина (3,05-10,33 нг/мл) у пациентов 1КИ в модели 1 (р=0,002), в модели 2 (р<0,001), а также тенденцию к значимому влиянию на риск смерти повышенных уровней гепсидина (25,81-70,71 нг/мл) у пациентов 4КИ в модели 1 (р=0,070), а в модели 2 — значимых влияний на риск смерти не выявлено (р=0,135) (табл. 4).
Для визуализации полученных данных были построены графики переменных регрессии с использованием кубических сплайнов для каждой модели, на которых зависимость между гепсидином и риском смерти представляет собой U-образную кривую как в модели 1, так и в модели 2 для всех КИ уровней гепсидина (рис. 5 А, Б).
Таблица 1
Сравнительная характеристика пациентов пожилого и старческого возраста с ХСН и анемией по тяжести ХСН, сердечной и внесердечной коморбидности при низких (1КИ) и повышенных (4КИ) уровнях гепсидина
|
1КИ уровней гепсидина (3,05-10,33 нг/мл) (n=25) |
2КИ уровней гепсидина (10,62-15,04 нг/мл) (n=27) |
3КИ уровней гепсидина (15,33-24,52 нг/мл) (n=27) |
4КИ уровней гепсидина (25,81-70,71 нг/мл) (n=26) |
Тест |
Р (1-4) |
|
|
Возраст |
83,1 [ 65;90] |
80,2 [ 65;90] |
84,4 [ 68;90] |
82,7 [ 65;90] |
U |
0,428 |
|
Мужчины, n (%) |
9 (36) |
13 (48,1) |
11 (40,7) |
19 (73,1) |
ТКФ |
0,011 |
|
Тяжесть ХСН |
||||||
|
II ФК, n (%) |
4 (16) |
0 |
3 (11,1) |
1 (3,8) |
ТКФ |
0,119 |
|
III ФК, n (%) |
12 (48) |
17 (62,9) |
15 (55,5) |
16 (61,5) |
ТКФ |
0,404 |
|
IV ФК, n (%) |
9 (36) |
10 (37,1) |
9 (33,3) |
9 (34,6) |
ТКФ |
1,000 |
|
ФВ, % (M±SE) |
43,9±1,71 |
42,07±1,41 |
43,03±1,86 |
40,9±1,73 |
U |
0,289 |
|
Сердечная коморбидность |
||||||
|
АГ, n (%) |
22 (88) |
18 (66,6) |
18 (66,6) |
17 (65,3) |
ТКФ |
0,097 |
|
ПИКС, n (%) |
21 (84) |
24 (88,8) |
20 (74,1) |
25 (96,1) |
ТКФ |
0,190 |
|
Постоянная форма ФП, n (%) |
14 (56) |
17 (62,9) |
18 (66,6) |
17 (65,3) |
ТКФ |
0,572 |
|
ТЭЛА, n (%) |
8 (32) |
15 (55,5) |
5 (18,5) |
11 (42,3) |
ТКФ |
0,565 |
|
ОНМК, n (%) |
2 (8) |
6 (22,2) |
6 (22,2) |
6 (23,1) |
ТКФ |
0,248 |
|
Внесердечная коморбидность |
||||||
|
Пневмонии, n (%) |
2 (8) |
6 (22,2) |
6 (22,2) |
9 (34,6) |
ТКФ |
0,038 |
|
Сахарный диабет 2 типа, n (%) |
5 (20) |
10 (37,1) |
13 (48,1) |
10 (38,4) |
ТКФ |
0,220 |
|
ХОБЛ, n (%) |
5 (20) |
10 (37,1) |
9 (33,3) |
6 (23,0) |
ТКФ |
1,000 |
|
Трофические язвы на коже нижних конечностей, n (%) |
7 (28) |
7 (25,9) |
9 (33,3) |
7 (26,9) |
ТКФ |
1,000 |
|
Мочевые инфекции, n (%) |
8 (32) |
10 (37) |
12 (44,4) |
17 (65,4) |
ТКФ |
0,025 |
Примечание: Р определяли между 1КИ и 4 КИ уровней гепсидина.
Сокращения: АГ — артериальная гипертензия, КИ — квартильные интервалы, ОНМК — острое нарушение мозгового кровообращения, ПИКС — постинфарктный кардиосклероз, ТКФ — точный критерий Фишера, ТЭЛА — тромбоэмболия легочной артерии, ФК — функциональный класс, ФВ — фракция выброса, ФП — фибрилляция предсердий, ХОБЛ — хроническая обструктивная болезнь легких, ХСН — хроническая сердечная недостаточность.
Таблица 2
Сравнение лабораторных показателей у пациентов пожилого и старческого возраста с ХСН и анемией при низких (1КИ) и повышенных (4КИ) уровнях гепсидина (M±SE)
|
1КИ уровней гепсидина (3,05-10,33 нг/мл) (n=25) |
2КИ уровней гепсидина (10,62-15,04 нг/мл) (n=27) |
3КИ уровней гепсидина (15,33-24,52 нг/мл) (n=27) |
4КИ уровней гепсидина (25,81-70,71 нг/мл) (n=26) |
Тест |
Р (1-4) |
|
|
NТ-proBNP, пг/мл |
1110,2±0,001 [ 455;2271] |
1362,5±0,002 [ 562;3442] |
1295,5±0,001 [ 614;3202] |
1459,7±0,001 [ 478;3467] |
U |
0,198 |
|
Гемоглобин, г/дл |
10,179±0,271 [ 6,8;11,6] |
10,004±0,261 [ 7,2;11,7] |
10,700±0,175 [ 8,7;11,9] |
10,104±0,251 [ 8,5;11,9] |
N-K |
0,825 |
|
Железо, мкмоль/л |
5,544±1,033 [ 2,1;11,2] |
6,541±1,648 [ 2,2;11,1] |
5,819±1,015 [ 2,1;8,8] |
6,846±1,017 [ 3,1;8,9] |
N-K |
0,174 |
|
Трансферрин |
2,783±0,116 [ 2,13;4,2] |
2,698±0,093 [ 1,9;3,55] |
2,401±0,071 [ 1,6;3,21] |
2,337±0,075 [ 1,67;3,24] |
N-K |
0,751 |
|
КНТЖ, % |
8,099±0,865 [ 3,4;17,5] |
9,898±0,833 [ 2,91;18,9] |
10,031±0,833 [ 3,12;19,4] |
11,425±0,848 [ 4,9;19,1] |
N-K |
0,032 |
|
Ферритин, мкг/л |
30,196±5,019 [ 3,1;99,2] |
51,989±6,968 [ 11,1;126,1] |
107,526±11,765 [ 44,2;282] |
152,00±12,33 [ 57,1;300] |
N-K |
<0,001 |
|
Гепсидин, нг/мл |
7,235±1,367 [ 3,05;10,3] |
12,253±1,315 [ 10,62;15,04] |
18,942±1,315 [ 15,33;24,52] |
37,626±1,341 [ 25,81;70,71] |
N-K |
<0,001 |
|
ЭПО, мМЕ/мл |
48,038±5,54 [ 16,0;95,7] |
41,482±5,49 [ 8,4;100] |
34,427±5,887 [ 10,0;101] |
34,225±2,351 [ 8,5;56,1] |
N-K |
0,099 |
|
СРБ, мг/л |
9,511±1,541 [ 0,9;40,2] |
12,985±1,863 [ 2,1;47,9] |
15,000±2,006 [ 2,4;52,1] |
28,808±3,126 [ 8,9;71,1] |
N-K |
<0,001 |
|
ИЛ-6, пг/мл |
6,169±0,891 [ 1,1;20,2] |
7,906±0,791 [ 3,20;20,1] |
8,379±1,062 [ 1,2;24,8] |
15,669±1,663 [ 1,1;39,4] |
N-K |
<0,001 |
Примечание: Р между 1КИ и 4КИ уровней гепсидина.
Сокращения: ИЛ-6 — интерлейкин-6, КНТЖ — коэффициент насыщения трансферрина железом, СРБ — С-реактивный белок, ЭПО — эритропоэтин, NТ-proBNP — N-концевой промозговой натрийуретический пептид.
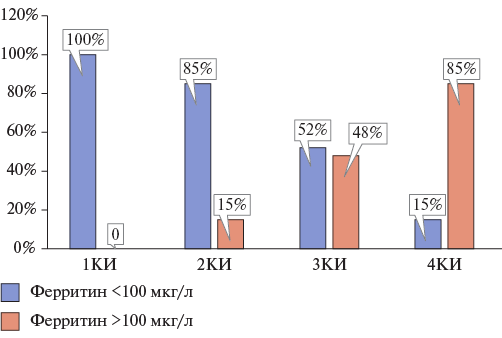
Рис. 1. Процент пациентов с абсолютным ДЖ и функциональным ДЖ в разных КИ уровней гепсидина у пациентов пожилого и старческого возраста с ХСН и анемией.
Сокращение: КИ — квартильные интервалы.
Таблица 3
Частота смертности и причины смерти у пациентов пожилого и старческого возраста с ХСН и анемией, стратифицированных по КИ уровней гепсидина
|
Причины смерти |
Всего (n=105) |
1КИ (n=25) |
2КИ (n=27) |
3КИ (n=27) |
4КИ (n=26) |
Р (1-4) |
|
1. Прогрессирующая ХСН, n, % |
41 (39) |
9 (36) |
10 (37) |
12 (44) |
10 (39) |
1,000 |
|
2. Сердечно-сосудистые причины, n, %, из них: ТЭЛА, ОНМК, ОИМ, ВСС |
21 (20) |
6 (24) |
6 (22) |
4 (15) |
5 (19) |
0,743 |
|
3. Не сердечно-сосудистые причины (пневмонии, COVID-19, рак), n, % |
8 (7.6) |
0 |
3 (11) |
0 |
5 (19) |
<0,001 |
|
Всего умерших, n, % |
70 (67) |
15 (60) |
19 (70) |
16 (59) |
20 (77) |
0,236 |
Примечание: Р определяли между 1КИ и 4КИ уровней гепсидина.
Сокращения: ВСС — внезапная сердечная смерть, ОИМ — острый инфаркт миокарда, ОНМК — острое нарушение мозгового кровообращения, ТЭЛА — тромбоэмболия легочной артерии, ХСН — хроническая сердечная недостаточность.
Таблица 4
Анализ 24-мес. выживаемости у пациентов пожилого и старческого возраста с ХСН и анемией, стратифицированных по КИ уровней гепсидина в регрессионных моделях Кокса
|
ОР |
95% ДИ |
p |
||
|
1КИ (n=25) Уровень гепсидина (3,05-10,33 нг/мл) |
Модель 1 Модель 2 |
1,661 1,911 |
1,198-2,303 1,350-2,705 |
0,002 <0,001 |
|
2КИ (n=27) Уровень гепсидина (10,62-15,04 нг/мл) |
Модель 1 Модель 2 |
1,297 0,933 |
0,714-2,357 0,498-1,746 |
0,393 0,827 |
|
3КИ (n=27) Уровень гепсидина (15,33-24,52 нг/мл) |
Модель 1 Модель 2 |
0,836 0,698 |
0,614-1,138 0,477-1,023 |
0,255 0,195 |
|
4КИ (n=26) Уровень гепсидина (25,81-70,71 нг/мл) |
Модель 1 Модель 2 |
1,044 1,036 |
0,997-1,099 0,989-1,086 |
0,070 0,135 |
Примечание: модель 1 — гепсидин + ферритин, КНТЖ, гемоглобин, ЭПО, возраст; модель 2 — гепсидин + ферритин, ИЛ-6, СРБ, возраст; p≤0,05 — значимое влияние на риск смерти, р 0,05-0,1 — влияние на уровне тенденции.
Сокращения: ДИ — доверительный интервал, ИЛ-6 — интерлейкин-6, КНТЖ — коэффициент насыщения трансферрина железом, ОР — отношение рисков, СРБ — С-реактивный белок, ЭПО — эритропоэтин.
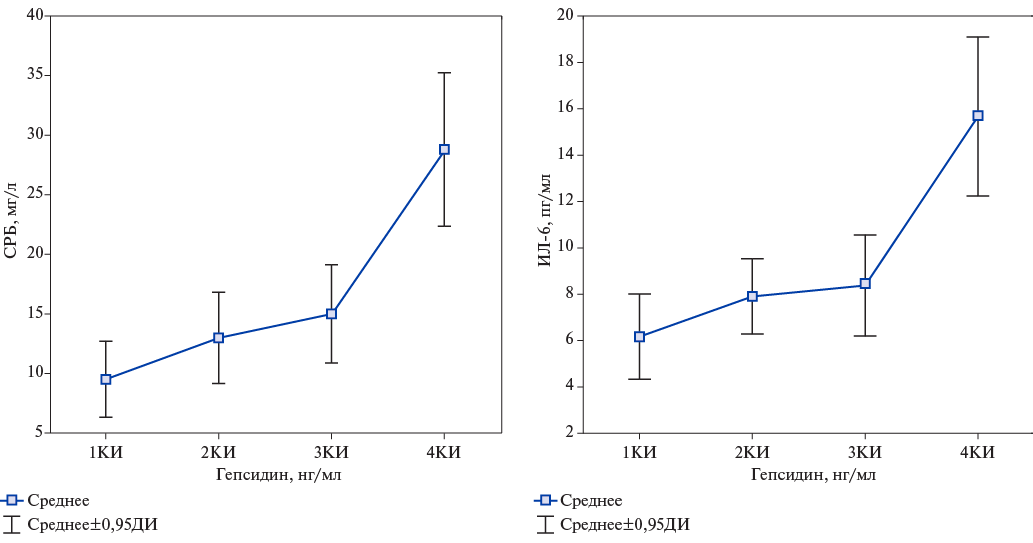
Рис. 2. Уровни СРБ у пациентов пожилого и старческого возраста с ХСН и анемией в разных КИ уровней гепсидина.
Сокращения: ДИ — доверительный интервал, КИ — квартильные интервалы, СРБ — С-реактивный белок.
Рис. 3. Уровни ИЛ-6 у пациентов пожилого и старческого возраста с ХСН и анемией в разных КИ уровней гепсидина.
Сокращения: ДИ — доверительный интервал, ИЛ-6 — интерлейкин-6.
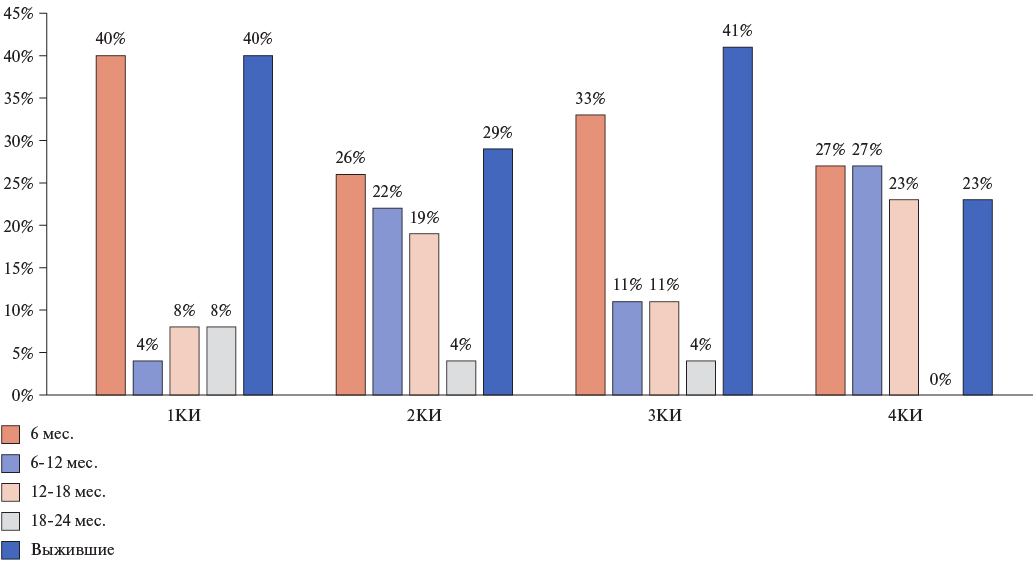
Рис. 4. Процент умерших пациентов пожилого и старческого возраста с ХСН и анемией в разных КИ уровней гепсидина: до 6 мес., от 6 до 12, от 12 до 18 и от 18 до 24 мес.
Примечание: процент выживших пациентов в разных КИ указан на конец периода наблюдения (24 мес.).
Сокращение: КИ — квартильные интервалы.
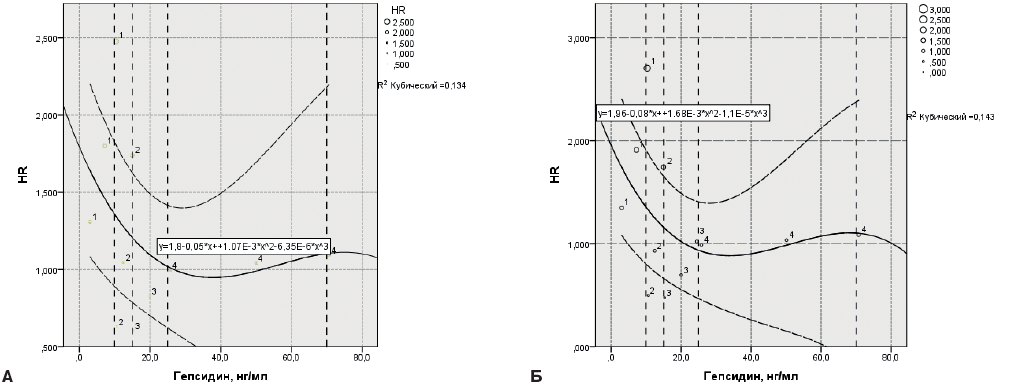
Рис. 5. U-образная зависимость между уровнями гепсидина и риском смерти от всех причин в течение 24 мес. у пациентов пожилого и старческого возраста с ХСН и анемией: А — в модели 1 и Б — в модели 2.
Примечание: вертикальные штриховые линии — границы КИ уровней гепсидина, HR — отношение рисков — сплошная центральная линия, 95% СI — 95% доверительные интервалы HR — штриховые горизонтальные линии.
Обсуждение
Выявленные в настоящем исследовании уровни гепсидина у пациентов пожилого и старческого возраста с ХСН и анемией имели широкий диапазон значений: от 3,05 до 70,71 нг/мл. В предыдущих исследованиях у пациентов с ХСН также был выявлен большой разброс значений гепсидина: от 0,5 до 28 нг/мл [14, 15], от 2,2 до 141,8 нг/мл [13], от 20,8 до 69,6 нг/мл [16], что, очевидно, обусловлено неоднородностью обследуемых пациентов (различной сте- пенью тяжести ХСН, разной выраженностью ДЖ, различиями по возрасту, наличием или отсутствием сопутствующей патологии, в т.ч. анемии и воспалительных заболеваний), использованием разных тест-систем.
Известно, что при абсолютном ДЖ низкий уровень сывороточного железа опосредованно через растворимые рецепторы трансферрина, а также высокий уровень ЭПО — через эритроферрон, по типу обратной связи подавляют выработку гепсидина для обеспечения физиологической концентрации железа в плазме, поскольку гепсидин при низких значениях, наряду с ферритином и КНТЖ, более чувствителен к ДЖ, чем гемоглобин [13][23].
А при воспалении, вследствие длительной иммунной активации под влиянием ИЛ-6 выработка гепсидина повышается, что сопровождается снижением его чувствительности к растворимым рецепторам трансферрина и приводит к неконтролируемой деградации ферропортина, снижению уровня железа в сыворотке крови и накоплению его в депо в виде ферритина с развитием функционального или ("перераспределительного") ДЖ [2][3][23][24].
Выявленные у 66 из 105 (62,85%) обследуемых пациентов признаки абсолютного ДЖ (причем у всех пациентов 1КИ, т.е. при пониженных уровнях гепсидина) согласуются с данными Singh B, et al., которые выявили абсолютный ДЖ у 83% пациентов с ХСН [25]. Причинами абсолютного ДЖ могут быть не диагносцированные микрокровопотери вследствие приема антикоагулянтов [26] и антиагрегантов [27], а также недостаточное всасывание железа вследствие отека стенки кишки [16][23][28].
Абсолютный ДЖ, обуславливая системную гипоксию и глобальные метаболические нарушения в тканях, часто необратимые, приводит к высокой смертности, что ранее было показано многими авторами [6][13][21], а также — в настоящем исследовании у пациентов 1КИ (т.е. при низких уровнях гепсидина), у которых смертность составила 60% за 24 мес. наблюдения, причем 40% пациентов умерли в первые 6 мес.
Функциональный ДЖ, выявленный у 39 из 105 обследованных пациентов (37,15%), причем у большинства (85%) пациентов 4КИ (т.е. при повышенных уровнях гепсидина), по данным литературы также ухудшает прогноз, качество и продолжительность жизни пациентов как с анемией [29], так и без анемии [13], но в меньшей степени, чем абсолютный ДЖ [30][31].
Очевидно, абсолютный ДЖ, выявленный у большинства пациентов 1КИ, приводит к более ранней смертности, а функциональный ДЖ на фоне выраженной системной воспалительной реакции у пациентов 4КИ, усугубляемой частыми декомпенсациями, пневмониями, мочевыми и другими рецидивирующими инфекциями, характерными для пациентов пожилого и старческого возраста с ХСН, оказывает влияние на смертность в течение всего периода наблюдения, включая отдаленный период, что приводит к наибольшему проценту умерших (77%) к 24 мес. по сравнению с другими КИ. У пациентов 2КИ и 3КИ на смертность влиял как абсолютный ДЖ, но в меньшей степени чем в 1КИ, так и системная воспалительная реакция, но в меньшей степени, чем в 4КИ.
Полученные нами результаты подтверждают мнение Grammer TB, et al. о том, что как глубокое истощение запасов сывороточного и тканевого железа, так и секвестрация его в макрофагах со снижением пула железа в сыворотке на фоне длительного системного воспаления связаны с плохим прогнозом [10].
Выявленное у пациентов 1КИ, как в 1, так во 2 модели, значимое влияние низких уровней гепсидина (<10,33 нг/мл) на риск 24-мес. смертности, вероятно, объясняется тем, что именно абсолютный ДЖ ухудшает прогноз, на что ранее обращали внимание многие авторы [10][32], причем независимо от анемии и даже при умеренном уровне воспаления [33]. Ранее связь низких уровней гепсидина со смерт- ностью в регрессионных моделях Кокса была показана у пациентов с ХСН и анемией [14][15], а также — у пациентов с ХСН без анемии [10][13].
Выявленная у пациентов 4КИ тенденция к значимому влиянию повышенных уровней гепсидина (>25,81 нг/мл) на риск смерти в модели 1, вероятно, объясняется тем, что повышенный уровень гепсидина вследствие выраженной системной воспалительной реакции способствует депонированию железа в тканях, что приводит к функциональному ДЖ, который также ухудшает прогноз, но в меньшей степени, чем абсолютный ДЖ [34]. Однако у пациентов в настоящем исследовании помимо ДЖ были признаки выраженной системной воспалительной реакции. Очевидно, именно это обусловило высокую смертность на протяжении всего периода наблюдения. Это предположение подтверждается отсутствием влияния повышенных уровней гепсидина на риск смерти в модели 2.
Вероятно, с увеличением тяжести ХСН и выраженности системной воспалительной реакции вследствие частых декомпенсаций, повторных пневмоний, мочевых и других рецидивирующих инфекций, влияние гепсидина на прогноз ослабевает, уступая маркерам воспаления — ИЛ-6 и СРБ, влияние которых на смертность было показано ранее [30]. Ранее также было показано, что активность гепсидина как регулятора обмена железа при повышенных его уровнях проявляется в меньшей степени, чем при низких [17]. При повышенных уровнях гепсидин проявляет себя в большей степени как белок острой фазы, отражая выраженность системной воспалительной реакции, наряду с СРБ и ферритином [2-6].
Таким образом, прогностическая значимость низких уровней гепсидина для риска смерти у пациентов с ХСН, показанная ранее многими авторами [13-15], подтверждена и в настоящей работе. Однако корреляция повышенных уровней гепсидина со смертностью ранее не была показана [9][13][16]. Выявленная в настоящем исследовании связь гепсидина с риском смерти имеет U-образную кривую, что подразумевает неблагоприятный прогноз как при низких, так и повышенных уровнях гепсидина. Следует отметить, что в процитированных выше исследованиях пациенты с воспалительным синдромом не включались, что является принципиальным отличием от настоящего исследования, в которое включались пациенты не просто с ХСН и анемией, но с декомпенсированной ХСН, для которой характерна системная воспалительная реакция, усугубляемая пневмониями, мочевыми и другими рецидивирующими инфекциями, характерными для пациентов пожилого и старческого возраста, и которых много в реальной клинической практике.
Таким образом, настоящее исследование подтвердило выводы немногочисленных авторов о негативном влиянии на прогноз низких уровней гепсидина, и одновременно показало, что повышенные уровни гепсидина также могут быть неблагоприятны для прогноза. Но это предположение нуждается в дополнительных, более крупных исследованиях.
Ограничения исследования. Результаты исследования получены на небольшой выборке — 105 пациентов пожилого и старческого возраста (от 65 до 90 лет), поэтому полученные данные могут быть экстраполированы на другие возрастные группы с осторожностью.
Заключение
У пациентов пожилого и старческого возраста с ХСН, анемией и признаками системной воспалительной реакции с учетом значимого влияния (р=0,002) на риск смерти низких (<10,33 нг/мл), а также — на уровне тенденции (р=0,070) повышенных (>25,81 нг/мл) уровней гепсидина, для оценки прогноза (как краткосрочного, так и отдаленного) помимо NT-proBNP целесообразно определение уровней гепсидина.
Список литературы
1. Park CH, Valore EV, Waring AJ, et al. Hepcidin, a urinary antimicrobial peptide synthesized in the liver. J Biol Chem. 2001;276(11):7806‑10. doi:10.1074/jbc.M008922200.
2. Nemeth E, Rivera S, Gabayan V, et al. IL‑6 mediates hypoferremia of inflammation by inducing the synthesis of the iron regulatory hormone hepcidin. J Clin Invest. 2004;113(9):1271‑6. doi:10.1172/JCI20945.
3. Nemeth E, Valore EV, Territo M, et al. Hepcidin, a putative mediator of anemia of inflammation, is a type II acute‑phase protein. Blood. 2003;101(7):2461‑3. doi:10.1182/blood2002‑10‑3235.
4. Lanser L, Fuchs D, Kurz K, et al. Physiology and Inflammation Driven Pathophysiology of Iron Homeostasis‑Mechanistic Insights into Anemia of Inflammation and Its Treatment. Nutrients. 2021;13(11):3732. doi:10.3390/nu13113732.
5. Соломахина Н. И., Лишута А. С., Дементьева А. В. Гепсидин как регулятор метаболизма железа и медиатор воспаления у больных пожилого и старческого возраста с хронической сердечной недостаточностью и анемией хронических заболеваний. Рациональная Фармакотерапия в Кардиологии. 2022;18(5):55363. doi:10.20996/1819‑6446‑2022‑09‑03.
6. Nemeth E, Ganz T. Hepcidin and Iron in Health and Disease. Annu Rev Med. 2023;74:26177. doi:10.1146/annurev‑med‑043021‑032816.
7. Блиндарь В. Н., Зубрихина Г. Н., Матвеева И. И. Основные метаболиты феррокинетики в дифференциальной диагностике анемического синдрома. Клиническая лабораторная диагностика. 2016;61(4):219‑23. doi:10.18821/0869‑2084‑2016‑61‑4219‑223.
8. Ellingsen TS, Lappegård J, Ueland T, et al. Plasma hepcidin is associated with future risk of venous thromboembolism. Blood Adv. 2018;2(11):1191‑7. doi:10.1182/bloodadvances.2018018465.
9. Li X, Ding D, Zhang Y, et al. Associations of plasma hepcidin with mortality risk in patients with coronary artery disease. Oncotarget. 2017;8(65):109497‑508. doi:10.18632/oncotarget.22722.
10. Grammer TB, Scharnagl H, Dressel A, et al. Iron Metabolism, Hepcidin, and Mortality (the Ludwigshafen Risk and Cardiovascular Health Study). Clin Chem. 2019;65(7):849‑61. doi:10.1373/clinchem.2018.297242.
11. Zeller T, Altay A, Waldeyer C, et al. Prognostic Value of Iron‑Homeostasis Regulating Peptide Hepcidin in Coronary Heart Disease‑Evidence from the Large AtheroGene Study. Biomolecules. 2018;8(3):43. doi:10.3390/biom8030043.
12. Ruhe J, Waldeyer C, Ojeda F, et al. Intrinsic Iron Release Is Associated with Lower Mortality in Patients with Stable Coronary Artery Disease‑First Report on the Prospective Relevance of Intrinsic Iron Release. Biomolecules. 2018;8(3):72. doi:10.3390/biom8030072.
13. Jankowska EA, Kasztura M, Sokolski M, et al. Iron deficiency defined as depleted iron stores accompanied by unmet cellular iron requirements identifies patients at the highest risk of death after an episode of acute heart failure. Eur Heart J. 2014;35(36):2468‑76. doi:10.1093/eurheartj/ehu235.
14. Alnuwaysir RIS, Grote Beverborg N, Hoes MF, et al. Additional burden of iron deficiency in heart failure patients beyond the cardio‑renal anaemia syndrome: findings from the BIOSTAT‑CHF study. Eur J Heart Fail. 2022;24(1):192‑204. doi:10.1002/ejhf.2393.
15. Matsumoto M, Tsujino T, Lee‑Kawabata M, et al. Iron regulatory hormone hepcidin decreases in chronic heart failure patients with anemia. Circ J. 2010;74(2):301‑6. doi:10.1253/circj.cj‑09‑0663.
16. Подзолков В. И., Драгомирецкая Н. А., Столбова С. К. и др. Ассоциации уровней NT‑proBNP и гепсидина с клинико‑лабораторными параметрами у больных хронической сердечной недостаточностью с разной степенью систолической дисфункции левого желудочка. Кардиоваскулярная терапия и профилактика. 2020;19(4):2587. doi:10.15829/1728‑8800‑2020‑2587.
17. Girelli D, Marchi G, Camaschella C. Anemia in the Elderly. Hemasphere. 2018;2(3):40. doi:10.1097/HS9.0000000000000040.
18. Булгакова С. В., Захарова Н. О., Тренева Е. В. и др. Современные представления об анемическом синдроме у лиц старших возрастных групп (обзор литературы). Современные проблемы здравоохранения и медицинской статистики. 2020;(2);45‑68. doi:10.24411/2312‑2935‑2020‑10031.
19. Merchant AA, Roy CN. Not so benign haematology: anaemia of the elderly. Br J Haematol. 2012;156(2):173‑85. doi:10.1111/j.1365‑2141.2011.08920.x.
20. Хроническая сердечная недостаточность. Клинические рекомендации 2020. Российское кардиологическое общество (РКО). Российский кардиологический журнал. 2020;25(11):4083. doi:10. 15829/1560‑4071‑2020‑4083.
21. Мареев В. Ю., Фомин И. В., Агеев Ф. Т. и др. Клинические рекомендации ОССН — РКО — РНМОТ. Сердечная недостаточность: хроническая (ХСН) и острая декомпенсированная (ОДСН). Диагностика, профилактика и лечение. Кардиология. 2018;58(6S):8‑158. doi:10.18087/cardio.2475.
22. Ponikowska B, Suchocki T, Paleczny B, et al. Iron status and survival in diabetic patients with coronary artery disease. Diabetes Care. 2013;36(12):4147‑56. doi:10.2337/dc13‑0528.
23. Alnuwaysir RIS, Hoes MF, van Veldhuisen DJ, et al. Iron Deficiency in Heart Failure: Mechanisms and Pathophysiology. J Clin Med. 2021;11(1):125. doi:10.3390/jcm11010125.
24. Nemeth E, Ganz T. Hepcidin‑Ferroportin Interaction Controls Systemic Iron Homeostasis. Int J Mol Sci. 2021;22(12):6493. doi:10.3390/ijms22126493.
25. Singh B, Bajaj N, Singh P, et al. Iron deficiency in patients of heart failure with reduced ejection fraction. Med J Armed Forces India. 2022;78(4):463‑8. doi:10.1016/j.mjafi.2022.04.013.
26. Зубрихина Г. Н., Блиндарь В. Н., Матвеева И. И. Дифференциальная диагностика анемического синдрома при истинном железодефицитном состоянии и функциональном дефиците железа у больных с хроническими заболеваниями (злокачественными новообразованиями). Терапевтический архив. 2016;88(4):61‑7. doi:10.17116/terarkh201688461‑67.
27. Воробьева Н. М., Ткачева О. Н. Вопросы безопасности антиагрегантной и антикоагулянтной терапии в кардиологической практике. Фарматека. 2020;27(13). doi:10.18565/pharmateca. 2020.13.
28. Арутюнов Г. П., Кафарская Л. И., Былова Н. А. и др. Качественные и количественные показатели микрофлоры толстого кишечника при различных функциональных классах хронической сердечной недостаточности. Журнал Сердечная Недостаточность. 2005;4(5):176‑81.
29. Смирнова Е. А., Седых Е. В., Якушин С. С. и др. Распространенность и клиническое значение дефицита железа у пациентов с острой декомпенсацией сердечной недостаточности. Российский кардиологический журнал. 2023;28(8):5413. doi:10.15829/1560‑4071‑2023‑5413.
30. Köseoğlu FD, Özlek B. Anemia and Iron Deficiency Predict All‑Cause Mortality in Patients with Heart Failure and Preserved Ejection Fraction: 6‑Year Follow‑Up Study. Diagnostics (Basel). 2024;14(2):209. doi:10.3390/diagnostics14020209.
31. Klip IT, Voors AA, Swinkels DW, et al. Serum ferritin and risk for new‑onset heart failure and cardiovascular events in the community. Eur J Heart Fail. 2017;19(3):348‑56. doi:10.1002/ejhf.622.
32. Docherty KF, Welsh P, Verma S, et al. DAPA‑HF Investigators and Committees. Iron Deficiency in Heart Failure and Effect of Dapagliflozin: Findings From DAPA‑HF. Circulation. 2022;146(13):980‑94. doi:10.1161/CIRCULATIONAHA.122.060511.
33. de Almeida AJPO, de Almeida Rezende MS, Dantas SH, et al. Unveiling the Role of Inflammation and Oxidative Stress on Age‑Related Cardiovascular Diseases. Oxid Med Cell Longev. 2020;2020:1954398. doi:10.1155/2020/1954398.
34. Kuster N, Huet F, Dupuy AM, et al. Multimarker approach including CRP, sST2 and GDF‑15 for prognostic stratification in stable heart failure. ESC Heart Fail. 2020;7(5):2230‑9. doi:10.1002/ehf2.12680.
Об авторах
Н. И. СоломахинаРоссия
Нина Иосифовна Соломахина — д.м.н., профессор кафедры госпитальной терапии № 1 ИКМ им. Н. В. Склифосовского
Москва
А. В. Дементьева
Россия
Анна Викторовна Дементьева — соискатель кафедры госпитальной терапии № 1 ИКМ им. Н. В. Склифосовского, врач функциональной диагностики отделения ультразвуковой и функциональной диагностики
Москва
А. А. Соколов
Россия
Александр Александрович Соколов — зав. отделением ультразвуковой диагностики
Москва
Конфликт интересов:
Дополнительные файлы
- Для оценки прогноза у пациентов с хронической сердечной недостаточностью (ХСН) пожилого и старческого возраста изучалась роль гепсидина как маркера, участвующего в патогенезе как анемии, так и воспаления, которые часто сопровождают течение ХСН у этих пациентов вследствие высокой коморбидности.
- Выявленная U-образная связь гепсидина с риском смерти у пациентов пожилого и старческого возраста с ХСН, анемией и воспалительным синдромом подразумевает неблагоприятный прогноз как при низких (3,05-10,33 нг/мл), так и при повышенных уровнях гепсидина (25,81-70,71 нг/мл), в связи с чем для оценки прогноза целесообразно определять, помимо N-концевого промозгового натрийуретического пептида, уровни гепсидина.
Рецензия
Для цитирования:
Соломахина Н.И., Дементьева А.В., Соколов А.А. Роль гепсидина в оценке прогноза у пациентов пожилого и старческого возраста с хронической сердечной недостаточностью и анемией. Российский кардиологический журнал. 2025;30(8):6288. https://doi.org/10.15829/1560-4071-2025-6288. EDN: OFEPJC
For citation:
Solomakhina N.I., Dementyeva A.V., Sokolov A.A. Role of hepcidin in assessing the prognosis of elderly and senile patients with heart failure and anemia. Russian Journal of Cardiology. 2025;30(8):6288. (In Russ.) https://doi.org/10.15829/1560-4071-2025-6288. EDN: OFEPJC

















































