Перейти к:
Кардиохирургические операции у пациентов с новообразованиями легких: локальный опыт Краснодарского края
https://doi.org/10.15829/1560-4071-2025-6263
EDN: TTPSIJ
Аннотация
Цель. Сравнить ближайшие и отдаленные результаты хирургического лечения больных с новообразованиями лёгкого с сопутствующей ишемической болезнью сердца (ИБС), потребовавшей реваскуляризация миокарда, с реваскуляризированными пациентами без образования в легком.
Материал и методы. В работу вошло изучение результатов обследования, лечения и наблюдения за 30345 пациентами, прооперированными в плановом порядке в ГБУЗ "Научно-исследовательском институте — Краевой клинической больнице № 1 им. проф. С. В. Очаповского" в период с 01.01.2015 по 01.06.2024. Из них 21909 пациентов имели диагноз стабильной ИБС в возрасте от 28 до 90 лет (средний возраст больных составил 64,1±12,4 года) и 9426 была выполнена реваскуляризация миокарда методом аортокоронарного шунтирования (АКШ). Было сформировано 2 группы пациентов: группа А — пациенты с ИБС и верифицированным по данным компьютерной томографии органов грудной клетки новообразованием легкого, которым выполнено симультанное оперативное вмешательство (АКШ + резекция легкого) (71 человек); группа Б — пациенты с ИБС без опухоли легкого, которым выполнено изолированно АКШ, выбранная при помощи генератора случайных чисел в связи с многочисленностью исходной когорты (154 пациента).
Результаты. У пациентов из группы А чаще наблюдались внутригоспитальные осложнения (острая сердечная недостаточность 6,86% vs 2,6%, р=0,02; нарушения ритма сердца по типу фибрилляции предсердий 15,49% vs 4,55%, р=0,005; пневмония 16,9% vs 4,55%, р=0,002; тромбоз шунтов 2,82% vs 0%, р=0,04; сепсис 8,45% vs 1,3%, р=0,007), что закономерно привело к увеличению длительности пребывая в стационаре (15,06±8,69 vs 9,36±8,26 дней, р<0,001). В группе А умерло на госпитальном этапе наблюдения 2 пациента по причине тромбоза шунта, а в группе Б не умер ни один пациент, однако данный показатель не достиг статистической значимости (р=0,06). В отдаленном периоде наблюдения (6 мес. — 6 лет) выявлена высокая летальность у пациентов из группы А по причине прогрессирования онкологического процесса, тогда как сердечно-сосудистая смертность и ишемические события были сопоставимы в обеих группах. Кроме того, прогноз пациентов зависел от гистологической характеристики опухоли и, предсказуемо, лучшая долгосрочная выживаемость была у пациентов с доброкачественными новообразованиями легких, а также с аденокарциномой легкого.
Заключение. Наши результаты имеют важные последствия для практикующего хирурга, поскольку они улучшат его процесс принятия решения о типе реваскуляризации. Однако необходимы дальнейшие исследования факторов, лежащих в основе принятия решения о проведении АКШ у онкологических больных, влияния восприятия прогноза рака пациентом и врачом и факторов, связанных с выживаемостью после АКШ среди онкологических больных.
Ключевые слова
Для цитирования:
Татаринцева З.Г., Барбухатти К.О., Халафян А.А., Акиньшина В.А., Космачева Е.Д., Синельникова М.Г. Кардиохирургические операции у пациентов с новообразованиями легких: локальный опыт Краснодарского края. Российский кардиологический журнал. 2025;30(8):6263. https://doi.org/10.15829/1560-4071-2025-6263. EDN: TTPSIJ
For citation:
Tatarintseva Z.G., Barbukhatti K.O., Halafan A.A., Akinshina V.A., Kosmachova E.D., Sinelnikova M.G. Cardiac surgery in patients with lung tumor: local experience of Krasnodar Krai. Russian Journal of Cardiology. 2025;30(8):6263. (In Russ.) https://doi.org/10.15829/1560-4071-2025-6263. EDN: TTPSIJ
Ишемическая болезнь сердца (ИБС) остается ведущей причиной смертности от сердечно-сосудистых заболеваний (ССЗ), на которую приходится почти 50% смертей от ССЗ [1]. Однако недавние данные свидетельствуют о значительном сдвиге в представлении людей с ИБС, с более высокой распространенностью среди пациентов с сопутствующим диагнозом рака, состоянием, для которого новое поколение новых иммунных и таргетных методов лечения изменило и значительно продлило жизнь. Несмотря на эти улучшенные результаты, в течение нескольких месяцев после постановки диагноза рака больные сталкиваются с почти в два раза повышенным риском развития ИБС, включая острые коронарные синдромы [2]. Этот повышенный риск еще больше усугубляется недавними достижениями в области лечения рака, включая лучевую терапию, которая значительно продлила продолжительность жизни больных раком, но часто связана с повышенным риском ССЗ [1]. У многих из этих пациентов наблюдаются все более тяжелые формы ИБС и сложные клинические сценарии. Хотя имеющиеся данные свидетельствуют о большей распространенности чрескожных коронарных вмешательств (ЧКВ) в качестве метода выбора с целью реваскуляризации миокарда в этой популяции пациентов, частота использования аортокоронарного шунтирования (АКШ) остается в значительной степени неизвестной [1].
Имеющиеся данные свидетельствуют о том, что у онкологических больных, перенесших ЧКВ, чаще наблюдаются осложнения, такие как внутрибольничная смертность и кровотечения. Это во многом объясняется неблагоприятными последствиями современной противораковой терапии на ССЗ, а также изменениями в профиле коагуляции, наблюдаемыми при раке [3, 4]. Однако данные о клинических результатах после АКШ у пациентов с сопутствующим диагнозом рака ограничены. Кроме того, большинство рандомизированных контролируемых исследований лечения и результатов лечения ССЗ исключают пациентов с активными злокачественными новообразованиями. Более того, еще более скудны данные о клинических результатах после АКШ при конкретных типах рака или наличии метастаз.
Цель исследования: провести сравнительный анализ ближайших и отдаленных исходов комбинированного хирургического вмешательства у пациентов с новообразованием легкого и сопутствующей ИБС, подвергшихся хирургической реваскуляризации миокарда, относительно группы реваскуляризированных пациентов без наличия опухолевого поражения легких.
Материал и методы
Настоящая работа посвящена исследованию итогов диагностического процесса, лечебного вмешательства и последующего динамического наблюдения за пациентами, подвергшимися хирургическому лечению в плановом порядке в Государственном бюджетном учреждении здравоохранения "Научно-исследовательский институт — Краевая клиническая больница № 1 им. проф. С. В. Очаповского", расположенном в городе Краснодар, за временной интервал с 1 января 2015г по 1 июня 2024г (оперативная активность в НИИ-ККБ № 1 с 2003г по годам представлена на рисунке 1).
Частота оперативного лечения ИБС в указанный период составила существенную долю от общего количества операций. Одним из методов хирургического лечения являлся метод АКШ, примененный также к значительной части пациентов. Динамика объема оперируемой патологии с 2003г представлена на рисунке 2.
Выбор метода реваскуляризации миокарда (АКШ или ЧКВ) зависел от индивидуальных характеристик состояния сосудистого русла каждого конкретного пациента и степени соответствия установленным стандартам рекомендаций по проведению реваскуляризационных процедур на миокард в зависимости от анатомических особенностей коронарного русла и/или предпочтений самого пациента [5, 6].
Все пациенты были распределены на две группы:
Группа А — пациенты с ИБС и верифицированным по данным компьютерной томографии органов грудной клетки новообразованием легкого, которым выполнено симультанное оперативное вмешательство (АКШ + резекция легкого) (71 человек);
Группа Б — пациенты с ИБС без опухоли легкого, которым выполнено изолированно АКШ, выбранная при помощи генератора случайных чисел в связи с многочисленностью исходной когорты (154 пациентов).
Критерии исключения:
1) возраст до 18 лет;
2) острый период инфаркта миокарда;
3) выраженная дисфункция клапанов на фоне ИБС;
4) рак с отдаленными метастазами;
5) неспособность пациента самостоятельно принимать решения;
6) декомпенсация имеющейся сопутствующей патологии (сахарный диабет, гипертиреоз, эрозивно-язвенное поражение желудка, панкреатит, гепатит, бронхо-легочные заболевания, подагра и др.);
7) отказ пациента от хирургического лечения.
Основная часть исследования состояла из госпитального этапа и этапа наблюдения (рис. 3). Госпитальный этап начинался от момента поступления в стационар и соответствовал периоду нахождения пациентов в стационаре. Основная цель госпитального этапа — изучение: 1) влияния образования легкого на течение стабильной ИБС в реальной клинической практике; 2) влияния новообразования легкого на краткосрочный прогноз у пациентов с ИБС; 3) влияния реваскуляризации методом АКШ на течение ИБС при сопутствующем новообразовании легкого. Оценивались острая левожелудочковая недостаточность, жизнеопасные нарушения ритма, госпитальная летальность, тромбоэмболические и геморрагические осложнения.
Этап наблюдения составил 6 мес. — 6 лет после выписки из стационара. Основная цель этапа наблюдения — изучить влияние рака легкого у пациентов с ИБС на долгосрочный прогноз. Наблюдение проводилось путём телефонных контактов с частотой 1 раз в 6 мес. с целью выявления и регистрации клинически значимых исходов: смерть от любых причин, ССЗ, инфаркт миокарда, инсульт, кровотечение, смерть по причине прогрессирования онкологического процесса.
Статистический анализ. Статистический анализ данных был выполнен с помощью пакета прикладных программ STATISTICA 22. При описании количественных клинических показателей использовали среднее арифметическое и стандартное отклонения (М±SD); медиану (Ме) и межквартильный размах [25%; 75%], минимальное (мин.) и максимальное (макс.) значения. Для изучения корреляционных связей вычисляли непараметрический коэффициент корреляции Спирмена. Сравнение средних в двух независимых группах проводили при помощи критерия Манна-Уитни, при числе групп более двух применяли критерий Краскела-Уоллиса. Для оценки выживаемости использовался критерий Каплана-Мейера. За критическую величину уровня значимости (p) принимали значение <0,05.
Результаты
При сравнении пациентов, подвергнутых АКШ, с образованием в легком и без такового выяснилось, что пациенты из группы А были достоверно моложе, чаще мужского пола, имели более отягощенный сердечно-сосудистый анамнез (чаще переносили инфаркт миокарда, гипертоническую болезнь, сахарный диабет, периферический атеросклероз, хроническую болезнь почек), по данным эхокардиографического исследования отмечался больший размер левого предсердий, а также в лабораторных показателях обращали на себя внимание достоверно большие уровни гемоглобина, эритроцитов, тромбоцитов, нейтрофилов и фибриногена. Однако возникшая воспалительная теория у пациентов с образованиями в легких не подтвердилась и такие воспалительные маркеры, как соотношение нейтрофилов к лимфоцитам, тромбоцитов к лимфоцитам и индекс системного иммунного воспаления, не отличались в сравниваемых группах (табл. 1).
У пациентов из группы А чаще наблюдались внутригоспитальные осложнения (острая сердечная недостаточность 6,86% vs 2,6%, р=0,02; нарушения ритма сердца по типу фибрилляции предсердий 15,49% vs 4,55%, р=0,005; пневмония 16,9% vs 4,55%, р=0,002; тромбоз шунтов 2,82% vs 0%, р=0,04; сепсис 8,45% vs 1,3%, р=0,007), что закономерно привело к увеличению длительности пребывания в стационаре (15,06±8,69 vs 9,36±8,26 дней, р<0,001). Течение послеоперационного периода у пациентов из групп А и Б представлено в таблице 2.
Динамика летальности по годам, начиная с 2003г, при реваскуляризации миокарда методом АКШ представлена на рисунке 4.
Причины летального исхода при АКШ представлены на рисунке 5.
В группе А умерло на госпитальном этапе наблюдения 2 пациента по причине тромбоза шунта, а в группе Б не умер ни один пациент, однако данный показатель не достиг статистической значимости (р=0,06).
Полученные данные демонстрируют, что у больных в группе с симультанной операцией (АКШ + вмешательство на легком) чаще регистрируются различные осложнения, а также достоверно выше длительность госпитализации в стационаре по сравнении с пациентами из группы с изолированным АКШ.
В отдаленном периоде наблюдения (6 мес. — 6 лет) выявлена высокая летальность у пациентов из группы А по причине прогрессирования онкологического процесса, тогда как сердечно-сосудистая смертность и ишемические события были сопоставимы в обеих группах (табл. 3).
Сроки наступления летальности в группе А представлены в таблице 4. Средняя продолжительность жизни 10 умерших пациентов составила 31,1±16,31 мес.
Всем пациентам после удаления новообразования легкого проводилось гистологическое исследование патологоанатомом. Характеристика гистологического исследования удаленных образований легких представлена в таблице 5.
Из представленных данных видно, что у пациентов из группы А чаще были распространены доброкачественные новообразования.
Кроме того, прогноз пациентов зависел от гистологической характеристики опухоли и, предсказуемо, лучшая долгосрочная выживаемость была у пациентов с доброкачественными новообразованиями легких, а также с аденокарциномой легкого (рис. 6).
Пациентам с верифицированным злокачественным новообразованием (20 человек (28,17%) проводилась полихимиотерапия (ПХТ) (15 человек из 20 с гистологической картиной рака (75%)) и выживаемость у таких пациентов была значительно ниже, чем у пациентов, которым не требовалось дополнительно химиотерапевтическое лечение (рис. 7). Необходимость проведения ПХТ в дополнении к хирургическому лечению решалась мультидисциплинарной командой, включающей онколога, торакального хирурга, химиотерапевта и патологоанатома. Из 15 пациентов, получивших ПХТ, 6 умерло в различные сроки (летальность 40%), тогда как из 5 пациентов с верифицированным раком, не потребовавшим ПХТ, летальность составила 0%, р=0,91 и из 51 пациента с доброкачественным новообразованием по данным патологоанатомического исследования умерло 5 пациентов (9,80%), р=0,006. Данные показатели не достигли статистически значимых значений ввиду малого количества пациентов в группах. Худшая выживаемость на фоне ПХТ демонстрирует прогрессирование онкологического процесса в сравнении с пациентами с доброкачественными новообразованиями в легких или пациентами со злокачественными образованиями, пролеченных радикально хирургическими методами и не потребовавшими проведения ПХТ.
Полученные данные подтверждают необходимость тщательной предоперационной оценки рисков и выбора оптимального подхода к выбору методики оперативного вмешательства. Учитывая повышенную вероятность осложнений и увеличенную продолжительность реабилитационного периода у пациентов, нуждающихся в одновременном проведении АКШ и резекции легкого, врачи-кардиологи, кардиохирурги и торакальные хирурги должны учитывать этот фактор при принятии решений о тактике лечения.
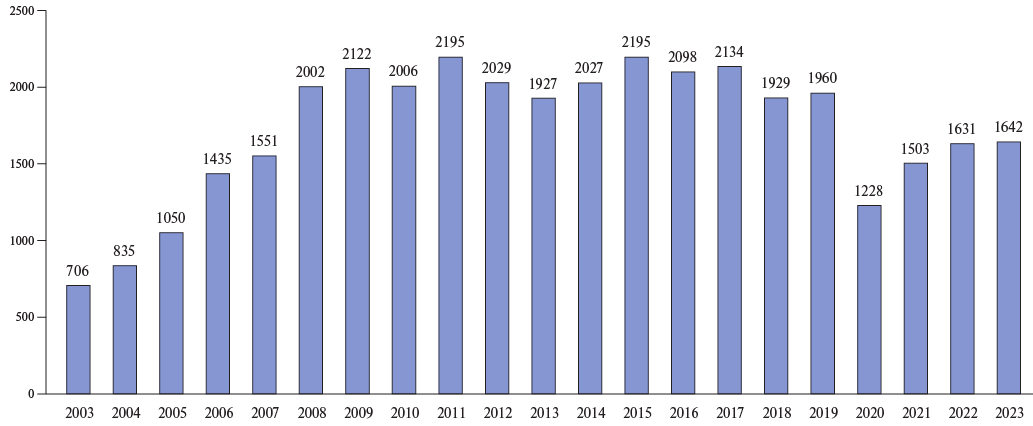
Рис. 1. Оперативная активность на открытом сердце НИИ-ККБ № 1 по годам.
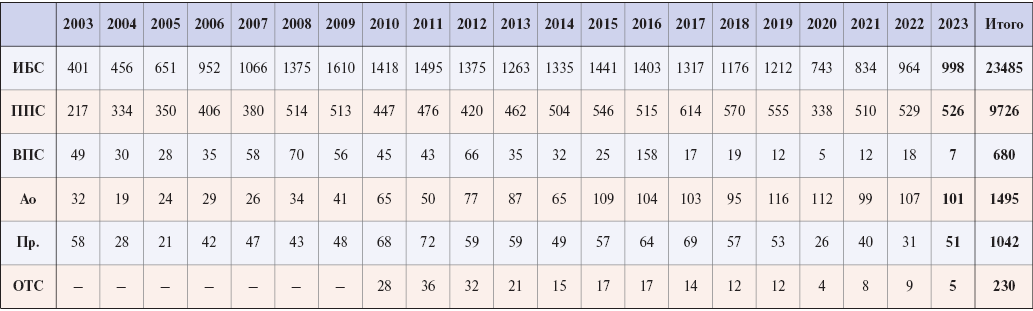
Рис. 2. Динамика объема оперируемой патологии на открытом сердце.
Сокращения: Ао — аорты, ВПС — врожденные пороки сердца, ИБС — ишемическая болезнь сердца, ОТС — ортотопическая трансплантация сердца, ППС — приобретенные пороки сердца, Пр. — прочие оперативные вмешательства (реконструкция левого желудочка, удаление образований из камер сердца, перикардэктомия, коррекция частичного аномального дренажа легочных вен, тромбэндартерэктомия из легочной артерии).
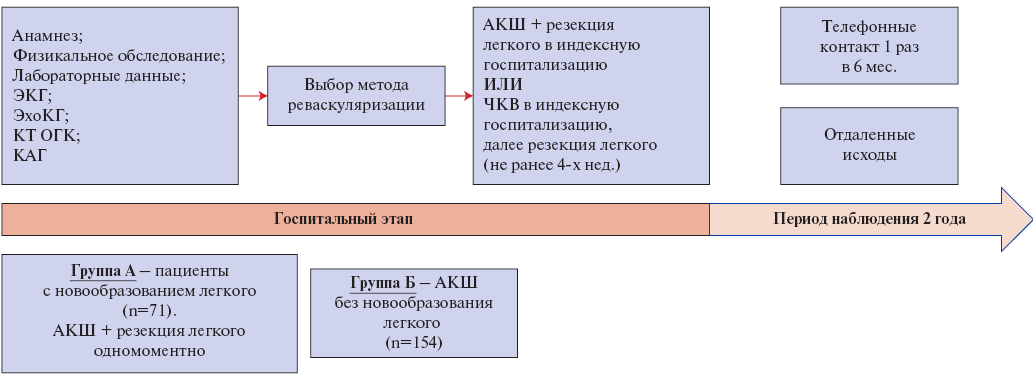
Рис. 3. Методы исследования на госпитальном этапе и этапе наблюдения.
Сокращения: АКШ — аортокоронарное шунтирование, КАГ — коронароангиография, КТ ОГК — компьютерная томография органов грудной клетки, ЧКВ — чрескожное коронарное вмешательство, ЭКГ — электрокардиография, ЭхоКГ — эхокардиография.
Таблица 1
Сравнительные характеристики пациентов из групп А и Б при поступлении в стационар
|
Переменная |
Группа А, n=71 |
Группа Б, n=154 |
р |
|
Возраст, лет (M±SD) |
63,00±12,34 |
67,1±8,6 |
<0,001 |
|
Мужчины, n (%) |
60 (84,5) |
106 (66,3) |
0,005 |
|
Женщины, n (%) |
11 (15,5) |
55 (33,7) |
0,005 |
|
Анамнестические данные |
|||
|
ИМ в анамнезе, n (%) |
25 (35,21) |
16 (10) |
<0,001 |
|
Хроническая сердечная недостаточность II-IV кл. по NYHA, n (%) |
70 (98,60) |
148 (92,5) |
0,08 |
|
АГ, n (%) |
68 (95,77) |
102 (64,6) |
<0,001 |
|
ИКЧ ≥60 пачка/лет, n (%) |
38 (22) |
32 (20) |
0,18 |
|
ОНМК в анамнезе, n (%) |
6 (8,45) |
17 (10,6) |
0,62 |
|
Периферический атеросклероз, n (%) |
51 (71,83) |
67 (41,9) |
<0,001 |
|
СД, n (%) |
12 (16,90) |
59 (36,9) |
0,002 |
|
Хроническая болезнь почек с СКФ <60 мл/мин, n (%) |
5 (7,04) |
32 (20,78) |
0,01 |
|
СКФ, мл/мин/1,72 м2 |
69,61±14,26 |
84,5±28,9 |
<0,001 |
|
ИМТ, кг/м2 |
30,18±12,16 |
27,8±11,4 |
0,15 |
|
Данные ЭхоКГ при поступлении в стационар |
|||
|
Левое предсердие, мм (M±SD) |
43,72±8,13 |
40,60±5,06 |
0,006 |
|
Конечный диастолический размер левого желудочка, мм (M±SD) |
53,66±8,51 |
51,83±6,01 |
0,672 |
|
Фракция выброса левого желудочка, % (M±SD) |
49,15±10,18 |
50,08±7,75 |
0,315 |
|
Правое предсердие, мм (M±SD) |
45,04±7,48 |
44,69±4,19 |
0,640 |
|
Правый желудочек, мм (M±SD) |
27,99±3,47 |
27,63±4,58 |
0,090 |
|
Максимальная толщина межжелудочковой перегородки, мм (M±SD) |
12,48±2,75 |
11,95±2,57 |
0,210 |
|
Систолическое давление в легочной артерии, мм рт.ст. (M±SD) |
21,31±18,15 |
19,88±15,22 |
0,854 |
|
Лабораторные данные при поступлении |
|||
|
Мочевина, ммоль/л (M±SD) |
6,93±2,11 |
7,15±1,05 |
0,37 |
|
Креатинин, мкмоль/л (M±SD) |
96,99±22,35 |
95,24±0,80 |
0,13 |
|
Аспартатаминотрансфераза, Ед/л (M±SD) |
42,26±37,66 |
48,65±0,95 |
0,054 |
|
Аланинаминотрансфераза, ЕД/л (M±SD) |
28,91±17,18 |
27,93±2,62 |
0,386 |
|
Холестерин общий, ммоль/л (M±SD) |
4,67±1,25 |
4,80±2,92 |
0,499 |
|
ЛНП, ммоль/л (M±SD) |
2,95±0,90 |
2,93±1,20 |
0,428 |
|
ЛВП, ммоль/л (M±SD) |
1,00±0,33 |
1,10±1,85 |
0,13 |
|
Триглицериды, ммоль/л (M±SD) |
1,99±2,5 |
1,59±1,45 |
0,64 |
|
Билирубин, ммоль/л (M±SD) |
16,18±6,84 |
18,43±1,27 |
0,061 |
|
Лейкоциты, 10Е9/л |
8,43±2,59 |
7,22±0,33 |
0,64 |
|
Гемоглобин, г/л (M±SD) |
135,70±22,45 |
123,21±3,45 |
<0,001 |
|
Эритроциты, 10Е12/л (M±SD) |
4,58±0,68 |
4,50±1,32 |
<0,001 |
|
Тромбоциты, 10Е9/л (M±SD) |
240,52±70,48 |
213,28±2,62 |
0,01 |
|
Фибриноген, г/л (M±SD) |
6,13±1,63 |
4,93±1,94 |
<0,001 |
|
АЧТВ, сек (M±SD) |
33,16±5,92 |
33,71±4,51 |
0,16 |
|
ПТВ, сек (M±SD) |
12,51±6,68 |
11,94±8,41 |
0,057 |
|
Нейтрофилы, 10Е9/л |
5,26±2,10 |
4,37±1,44 |
<0,001 |
|
Лимфоциты, 10Е9/л |
2,11±0,67 |
2,26±0,82 |
0,59 |
|
Нейтрофилы/лимфоциты, Ед (M±SD) |
2,89±2,27 |
2,96±2,54 |
0,35 |
|
Тромбоциты/лимфоциты, Ед (M±SD) |
151,70±151,03 |
146,84±1,97 |
0,99 |
|
Индекс системного иммунного воспаления, Ед (M±SD) |
974,88±170,78 |
936,22±0,8 |
0,30 |
Сокращения: АГ — артериальная гипертензия, АЧТВ — активированное частичное тромбопластиновое время, ИКЧ — индекс курящего человека, ИМ — инфаркт миокарда, ИМТ — индекс массы тела, ЛВП — липопротеины высокой плотности, ЛНП — липопротеины низкой плотности, ОНМК — острое нарушение мозгового кровообращения, ПТВ — протромбиновое время, СД — сахарный диабет, СКФ — скорость клубочковой фильтрации, ЭхоКГ — эхокардиография.
Таблица 2
Госпитальные осложнения у пациентов из групп А и Б
|
Показатель |
Группа А, n=71 |
Группа Б, n=154 |
р |
|
Инфаркт миокарда, n (%) |
0 |
1 (0,65) |
0,49 |
|
Острая сердечная недостаточность, n (%) |
7 (9,86) |
4 (2,60) |
0,02 |
|
Острая почечная недостаточность, n (%) |
0 |
1 (0,65) |
0,49 |
|
Фибрилляция предсердий, n (%) |
11 (15,49) |
7 (4,55) |
0,005 |
|
Атриовентрикулярная блокада, n (%) |
1 (1,4) |
0 |
0,14 |
|
Пневмония, n (%) |
12 (16,90) |
7 (4,55) |
0,002 |
|
Тромбоз шунтов, n (%) |
2 (2,82) |
0 |
0,04 |
|
Сепсис, n (%) |
6 (8,45) |
2 (1,30) |
0,007 |
|
Инсульт, n (%) |
0 |
1 (0,65) |
0,49 |
|
Кровотечение — рестернотомия, n (%) |
1 (1,4) |
3 (1,95) |
0,77 |
|
Постгипоксическая энцефалопатия, n (%) |
7 (9,86) |
15 (9,74) |
0,98 |
|
Анемия, потребовавшая переливание крови, n (%) |
3 (4,23) |
2 (1,3) |
0,17 |
|
Легочное кровотечение, n (%) |
1 (1,4) |
0 |
0,14 |
|
Длительность пребывания в отделении реанимации, дни (M±SD) |
4,48±5,52 |
3,17±3,54 |
0,06 |
|
Длительность пребывания в стационаре, дни (M±SD) |
15,06±8,69 |
9,36±8,26 |
<0,001 |
|
Летальный исход, n (%) |
2 (2,28) |
0 |
0,06 |
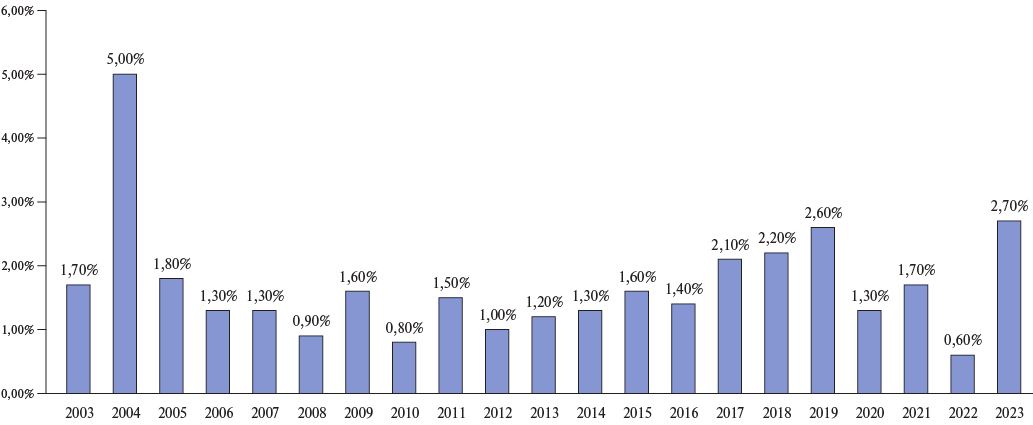
Рис. 4. Динамика летальности при АКШ по годам.
Таблица 3
Сердечно-сосудистые события и летальность у пациентов из групп А и Б в отдаленном периоде (6 мес. — 6 лет)
|
Показатель |
Группа А, n=69 |
Группа Б, n=154 |
р |
|
Повторный инфаркт миокарда, n (%) |
4 (5,80) |
8 (5,19) |
0,85 |
|
Повторные коронароангиографии по любой причине, n (%) |
4 (5,80) |
12 (7,79) |
0,59 |
|
Чрескожные коронарные вмешательства со стентированием коронарных артерий, n (%) |
4 (5,80) |
7 (4,54) |
0,69 |
|
Летальность от сердечно-сосудистых причин, n (%) |
0 |
3 (1,95) |
0,24 |
|
Летальность от прогрессирования онкологического процесса, n (%) |
10 (14,49) |
0 |
<0,001 |
Таблица 4
Сроки наступления летального исхода в группе А
|
Срок летального исхода после выписки из стационара |
Количество пациентов |
|
До 6 мес. |
0 |
|
6-12 мес. |
1 |
|
12-24 мес. |
3 |
|
24-36 мес. |
2 |
|
36 мес. — 9,5 лет |
4 |
Таблица 5
Гистологическая картина образований пациентов из групп А
|
Параметр |
Группа А, n=71 |
|
Доброкачественное новообразование, n (%) |
51 (71,83) |
|
Аденокарцинома, n (%) |
14 (19,72) |
|
Плоскоклеточный рак, n (%) |
4 (5,63) |
|
Метастаз из кишечника, n (%) |
1 (1,41) |
|
Метастаз из печени, n (%) |
1 (1,41) |
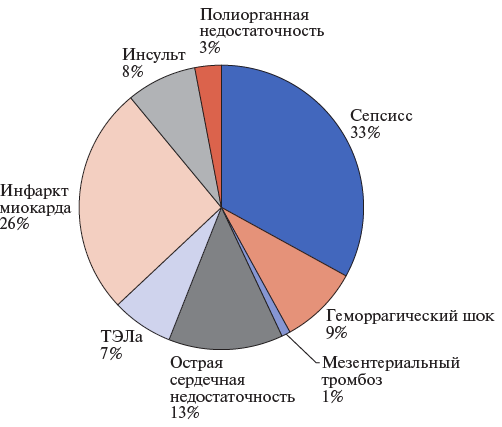
Рис. 5. Причины летального исхода при АКШ.
Сокращение: ТЭЛА — тромбоэмболия легочной артерии.
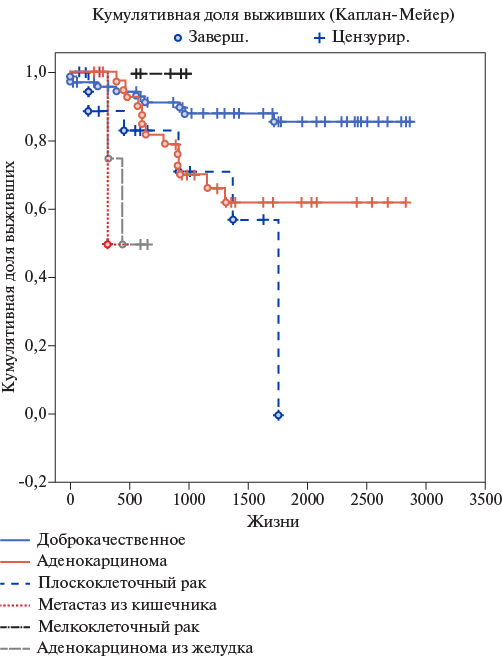
Рис. 6. Долгосрочная выживаемость в зависимости от гистологической картины опухоли.
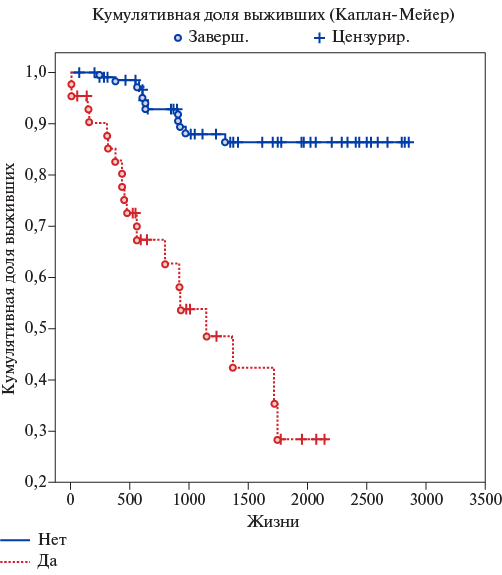
Рис. 7. Кривые выживаемости в зависимости от выполнения химиотерапевтического лечения.
Обсуждение
Guha A, et al. в большом современном популяционном анализе, включившем 2126331 пациента АКШ, из которых у 183185 (8,6%) был обнаружен сопутствующий рак, а у 14266 (0,67%) — метастатический рак, обнаружили, что, хотя общее количество ежегодных процедур АКШ с течением временем уменьшилось, относительная доля пациентов с сопутствующим раком увеличилась. Среди пациентов, перенесших АКШ с сопутствующим раком, внутрибольничная смертность не изменилась со временем. Однако доля пациентов, перенесших АКШ, осложнившееся кровотечением или ишемическим инсультом, со временем увеличилась. Более того, у онкологических пациентов не наблюдалось повышенного риска, связанного с использованием АКШ, по сравнению с пациентами без рака, за исключением рака молочной железы и предстательной железы, у которых была более высокая распространенность сильного кровотечения, связанного с использованием АКШ. Эти результаты свидетельствуют о том, что среди отдельных пациентов использование АКШ может быть эффективным даже при наличии диагноза рака [1].
Наше исследование также демонстрирует динамику снижения количества АКШ с течением времени, начиная с 2020 г. Сокращение числа пациентов с АКШ, наблюдаемое с течением времени в нашем исследовании, может быть отражением возросшего использования процедур ЧКВ как у пациентов без сопутствующего онкологического процесса, так и при раке.
Недавнее исследование показало, что у пациентов с раком, перенесших ЧКВ в Соединенных Штатах Америки, краткосрочные клинические результаты хуже по сравнению с пациентами без рака [1, 4]. Важно отметить, что у пациентов с раком, перенесших ЧКВ, как известно, повышен риск потенциальных перипроцедурных или внутрибольничных нежелательных явлений, таких как повышенная внутрибольничная смертность и кровотечение. Это только усугубляется потенциальными нецелевыми неблагоприятными сердечно-сосудистыми эффектами многих современных противораковых методов лечения, а также изменениями в профиле коагуляции, наблюдаемыми при раке. Наконец, учитывая рост заболеваемости сложными формами ИБС на фоне рака, необходимы эффективные стратегии реваскуляризации для оптимизации результатов, особенно у тех, кто не подходит для ЧКВ [3, 4].
Альтернативная стратегия реваскуляризации, менее изученная при раке, — это АКШ [7]. Онкологические пациенты с ИБС и многососудистым пора- жением коронарного русла, а также пациенты с противопоказаниями к ЧКВ, такие как пациенты, не способные переносить двойную антиагрегантную терапию, часто требуют потенциального АКШ для реваскуляризации [1]. Кроме того, среди пациентов, выбравших АКШ, за последние несколько лет было зарегистрировано снижение смертности [8]. Наше исследование продемонстрировало сопоставимые показатели смертности между онкологическими и неонкологическими пациентами. Прошлые исследования показали увеличение частоты послеоперационных кровотечений, связанных с процедурой АКШ [9]. Во-первых, это может быть связано с введением в последние годы новых антикоагулянтов и антифибринолитических препаратов, которые могут снижать ишемический риск, но повышают риск кровотечения при некоторых видах рака. Во-вторых, рак груди и простаты может быть у пациентов с очень поздней стадией рака и, таким образом, иметь более высокий риск кровотечения, связанный с АКШ, по сравнению с другими типами рака. Наконец, использование противораковой терапии, специфичной для рака груди и простаты, такой как селективный модулятор эстрогеновых рецепторов и терапия андрогенной депривации соответственно, может частично объяснить более высокий риск кровотечения, связанный с раком груди и простаты [1]. В нашем исследовании не было выявлено повышенной частоты послеоперационных кровотечений у пациентов с новообразованиями легких.
Результаты госпитализации, осложнения и предрасположенности, не отличающиеся между большинством типов рака и нераковыми, дополнительно свидетельствуют об избирательной эффективности среди этой группы населения. Различные типы рака представляют совершенно разные профили рис- ка, и поэтому требуется больше данных для проверки влияния селективных вмешательств по типам рака. Тем не менее хирургическая реваскуляризация может оставаться сильным вариантом для пациентов со сложными ИБС и раком. Наши результаты помогут перейти к персонализированному лечению путем точной стратификации риска различных типов рака и, соответственно, выбора лучшей формы реваскуляризации. Эти результаты имеют важные последствия для практикующего хирурга, поскольку они улучшат его процесс принятия решения о типе реваскуляризации, который будет использоваться надлежащим образом в этой растущей группе населения [10].
Однако необходимы дальнейшие исследования факторов, лежащих в основе принятия решения о проведении АКШ у онкологических больных, влияния восприятия прогноза рака пациентом и врачом и факторов, связанных с выживаемостью после АКШ среди онкологических больных.
Несмотря на малый объем изучаемого контингента, представленная выборка позволила выявить существенные различия в частоте осложнений, продолжительности госпитальной фазы и отдаленных результатах лечения между группой пациентов с симультанным вмешательством и контрольной группой пациентов, подвергшихся изолированному АКШ. Результаты настоящего исследования отражают специфику коморбидной популяции и требуют дальнейшего изучения в крупных многоцентровых исследованиях для подтверждения полученных выводов и разработки унифицированных подходов к ведению данной категории пациентов.
Заключение
Полученные данные демонстрируют большую частоту возникновения различных осложнений на раннем госпитальном периоде после АКШ, что связано с большей инвазивностью метода и большим объемом оперативного вмешательства в сравнении с изолированным АКШ, однако данные особенности не влияют на отдаленную выживаемость пациентов по причине сердечно-сосудистых событий.
Одностадийный хирургический подход снижает общий уровень стресса и травматичности для организма пациента, предотвращает задержку начала специфического противоопухолевого лечения, улучшает функциональные возможности миокарда и повышает шансы на успешное удаление первичного очага опухоли. В данном исследовании продемонстрировано, что такая стратегия не ухудшает отдаленный сердечно-сосудистый прогноз пациентов и дает шансы на минимизацию риска рецидива и распространения опухолевых клеток, в связи с чем данный метод можно применять в рутинной клинической практике.
Необходимы дальнейшие исследования факторов, лежащих в основе принятия решения о проведении АКШ у пациентов с новообразованиями в легких, т.к. остается высокая летальность по причине прогрессирования онкологического процесса у данных пациентов.
Список литературы
1. Guha A, Dey AK, Jneid H, Addison D. Acute Coronary Syndromes in Cancer Patients. European heart journal. 2019;40:1487-90. doi:10.1093/eurheartj/ehz267.
2. Navi BB, Reiner AS, Kamel H, et al. Arterial thromboembolic events preceding the diagnosis of cancer in older persons. Blood. 2019;133:781-9. doi:10.1182/blood-2018-06-860874.
3. Al-Hawwas M, Tsitlakidou D, Gupta N, et al. Acute Coronary Syndrome Management in Cancer Patients. Curr Oncol Rep. 2018;20:78. doi:10.1007/s11912-018-0724-8.
4. Potts JE, Iliescu CA, Lopez Mattei JC, et al. Percutaneous coronary intervention in cancer patients: a report of the prevalence and outcomes in the United States. European heart journal. 2019;40:1790-800. doi:10.1093/eurheartj/ehy769.
5. Windecker S, Kolh P, Alfonso F, et al. 2014 ESC/EACTS Guidelines on myocardial revascularization: The Task Force on Myocardial Revascularization of the European Society of Cardiology (ESC) and the European Association for Cardio-Thoracic Surgery (EACTS) Developed with the special contribution of the European Association of Percutaneous Cardiovascular Interventions (EAPCI). Eur Heart J. 2014;35(37):2541-619. doi:10.1093/eurheartj/ehu278.
6. Lawton JS, Tamis-Holland JE, Bangalore S, et al. 2021 ACC/AHA/SCAI Guideline for Coronary Artery Revascularization: Executive Summary: A Report of the American College of Cardiology/American Heart Association Joint Committee on Clinical Practice Guidelines. Circulation. 2022;145(3):e4-e17. doi:10.1161/CIR.0000000000001039.
7. Герасимов С. С., Давыдов М. И., Давыдов М. М. Современная стратегия хирургического лечения онкологических больных с тяжелыми сопутствующими сердечно-сосудистыми заболеваниями. Российский онкологический журнал. 2018;23(3-6):120-8. doi:10.18821/1028-99842018-23-3-6-120-128.
8. Серебрянская М. В., Герасимов С. С., Бузиашвили Ю. И. и др. Сравнительный анализ результатов хирургического лечения больных раком лёгкого с сопутствующей ИБС после профилактической реваскуляризации миокарда и больных раком лёгкого без ИБС. Московский хирургический журнал. 2023;(3):104-15. doi:10.17238/2072-3180-2023-3-104-115.
9. Герасимов С. С., Серебрянская М. В., Давыдов М. И. и др. Результаты хирургического лечения больных раком легкого с сопутствующей ИБС. Практическая онкология. 2023;24(1):80-93. doi:10.31917/2401080.
10. Решетов А. В., Елькин А. В., Николаев Г. В., Степанов С. С. Хирургическое лечение рака легкого у больных, перенесших операции на коронарных артериях. Вестник хирургии имени И. И. Грекова. 2021;180(1):60-4. doi:10.24884/0042-46252021-180-1-60-64.
Об авторах
З. Г. ТатаринцеваРоссия
Зоя Геннадьевна Татаринцева — к.м.н., зав. отделением кардиологии, ассистент кафедры кардиохирургии и кардиологии факультета повышения квалификации и профессиональной переподготовки специалистов
Краснодар
К. О. Барбухатти
Россия
Кирилл Олегович Барбухатти — д.м.н., профессор, кардиохирург, заведующий отделением кардиохирургии, заведующий кафедрой кардиохирургии и кардиологии
Краснодар
А. А. Халафян
Россия
Александр Альбертович Халафян — д.т.н., профессор кафедры прикладной математики
Краснодар
В. А. Акиньшина
Россия
Вера Александровна Акиньшина — к.п.н., доцент кафедры прикладной математики
Краснодар
Е. Д. Космачева
Россия
Елена Дмитриевна Космачева — д.м.н., профессор, кардиохирург, зав. отделением кардиохирургии, зав. кафедрой кардиохирургии и кардиологии ФПК и ППС
Краснодар
М. Г. Синельникова
Россия
Мария Геннадьевна Синельникова — ординатор кафедры кардиохирургии и кардиологии ФПК и ППС
Краснодар
Дополнительные файлы
- Сердечно-сосудистые заболевания и рак остаются основными причинами госпитализации и смертности во всем мире. В ряде случаев оба заболевания встречаются у одного человека и требуют оперативного вмешательства.
- Во всем мире не определена хирургическая тактика ведения пациентов с сочетанием гемодинамически значимого атеросклероза коронарных артерий и образованием легкого.
- Результаты нашего исследования важны для практикующего хирурга и кардиолога, поскольку они улучшат его процесс принятия решения о типе реваскуляризации миокарда у пациента с образованием легкого.
Рецензия
Для цитирования:
Татаринцева З.Г., Барбухатти К.О., Халафян А.А., Акиньшина В.А., Космачева Е.Д., Синельникова М.Г. Кардиохирургические операции у пациентов с новообразованиями легких: локальный опыт Краснодарского края. Российский кардиологический журнал. 2025;30(8):6263. https://doi.org/10.15829/1560-4071-2025-6263. EDN: TTPSIJ
For citation:
Tatarintseva Z.G., Barbukhatti K.O., Halafan A.A., Akinshina V.A., Kosmachova E.D., Sinelnikova M.G. Cardiac surgery in patients with lung tumor: local experience of Krasnodar Krai. Russian Journal of Cardiology. 2025;30(8):6263. (In Russ.) https://doi.org/10.15829/1560-4071-2025-6263. EDN: TTPSIJ

















































