Перейти к:
Хронический миокардит у пациентов с фибрилляцией предсердий неясного генеза: объективные сложности диагностики и нерешенные вопросы
https://doi.org/10.15829/1560-4071-2025-6242
EDN: ENXIWO
Аннотация
Цель. Проанализировать значимость магнитно-резонансной томографии (МРТ) сердца с контрастированием и эндомиокардиальной биопсии (ЭМБ) в диагностике миокардита у пациентов с фибрилляцией предсердий (ФП) неясного генеза.
Материал и методы. В исследование включено 57 пациентов с ФП неясного генеза 45,5 [38,8;53,3] лет (77,2% мужчин). У 56,1% пациентов была пароксизмальная, у 22,8% — персистирующая и у 21,1% длительно персистирующая ФП. 35 пациентам была выполнена МРТ сердца с контрастированием с оценкой критериев Lake-Louise. Всем пациентам одномоментно с катетерным лечением ФП выполнена ЭМБ из межжелудочковой перегородки, выводного тракта и верхушки правого желудочка с гистологической диагностикой миокардита на основании модифицированных Всемирной Федерацией сердца Далласских критериев.
Результаты. По данным МРТ сердца с контрастированием у 91,4% диагностировано отсроченное накопление контраста. В 17,1% случаев выявлены признаки отека на Т2-взвешенных изображениях, при этом среднее значение индекса отека по левому желудочку составило 1,6±0,3 (норма <2,0). У 25,7% — были выявлены признаки гиперемии, при расчете индекса гиперемии левого желудочка его среднее значение составило 3,4 [2,2;4,0] (норма <4,0). Миокардит был диагностирован у 12 пациентов (34,3%) с выявлением 3 критериев у 2 пациентов, 2 — у 10 (у 6 — гиперемия+фиброз, у 4 — отек+фиброз), 1 (фиброз) — у 22. Гистологические критерии лимфоцитарного миокардита выявлены у 28 пациентов из 57 (49,1%): у 19 (67,9%) — очаговый, у 6 (21,4%) диффузный и у 3 (10,7%) — диффузно-очаговый. Наличие признаков отека по МРТ было фактором, наиболее сильно связанным с общим количеством выявленных Т-лимфоцитов во фрагментах миокарда, оцененного при помощи ROC-анализа (AUC 0,782 (95% доверительный интервал: 0,61-0,93), р=0,032). Сочетанное использование МРТ и ЭМБ позволило повысить точность диагностики миокардита с 34,3 до 62,9%.
Заключение. Миокардит был диагностирован у 34,3% больных по данным МРТ и у 49,1% по данным ЭМБ. Наличие отека по данным МРТ было единственным признаком, имеющим предсказательную значимость выраженности воспалительной клеточной инфильтрации во фрагментах миокарда. Гистология в сочетании с МРТ повысила точность диагностики миокардита у пациентов с ФП неясного генеза с 34,3 до 62,9%.
Ключевые слова
Для цитирования:
Ситкова Е.С., Усенков С.Ю., Баталов Р.Е., Мочула О.В., Степанов И.В., Драгунова М.А., Московских Т.В., Афанасьев С.А. Хронический миокардит у пациентов с фибрилляцией предсердий неясного генеза: объективные сложности диагностики и нерешенные вопросы. Российский кардиологический журнал. 2025;30(7):6242. https://doi.org/10.15829/1560-4071-2025-6242. EDN: ENXIWO
For citation:
Sitkova E.S., Usenkov S.Yu., Batalov R.E., Mochula O.V., Stepanov I.V., Dragunova M.A., Moskovskikh T.V., Afanasyev S.A. Chronic myocarditis in patients with atrial fibrillation of unknown origin: diagnostic challenges and unresolved issues. Russian Journal of Cardiology. 2025;30(7):6242. (In Russ.) https://doi.org/10.15829/1560-4071-2025-6242. EDN: ENXIWO
Миокардит является серьезной проблемой современной кардиологии. Типы его клинического течения варьируют об бессимптомного до тяжелого, обусловливая развитие до 4% всех случаев хронической сердечной недостаточности, 21% — дилатационной кардиомиопатии, от 6 до 10% случаев внезапной сердечной смерти лиц молодого возраста, а также тахиаритмий и нарушений проводимости сердца [1][2]. Многоликость проявлений миокардита является непредсказуемой, что не позволяет однозначно подойти к вопросу диагностики и, соответственно, курации пациента. Раннее, в течение 1 мес., формирование хронической воспалительной кардиомиопатии c развитием ремоделирования и прогрессирующей дилатацией полостей зачастую не позволяет своевременно диагностировать заболевание.
Магнитно-резонансная томография (МРТ) сердца с контрастированием в настоящее время обладает высокой диагностической значимостью и широко рекомендуется как неинвазивная методика диагностики острого миокардита. При этом диагностика основана на верификации как минимум 2 критериев из 3 (Lake Louise Criteria): отек на Т2-взвешенных изображениях (ВИ), гиперемия на Т1-ВИ (при сравнении пре- и постконтрастных изображений в раннюю фазу контрастирования), отсроченное контрастирование (ОК), имеющих мультифокальный характер, патоморфологически соответствующих фиброзу/некрозу миокарда [3]. Сочетание 2 критериев из трех со специфичностью 95,5%, чувствительностью 76% и точностью 85% позволяет диагностировать острый миокардит. При этом спорным остается вопрос диагностической ценности МРТ у пациентов с хроническим миокардитом, когда критерии показывают низкую эффективность, а также при различных подтипах миокардита [4]. Обусловлено это преимущественным выявлением в данных случаях фиброза с отсутствием активности воспалительного процесса, что при отсутствии характерной клинико-лабораторной картины в совокупности не позволяет диагностировать заболевание.
Эндомиокардиальная биопсия (ЭМБ) остается золотым стандартом диагностики миокардита. Действующие рекомендации Минздрава России 2020г регламентируют использование ЭМБ в качестве прижизненной диагностики чаще в случаях, когда наступили выраженные нарушения функции сердца (снижение фракции выброса (ФВ), развитие сердечной недостаточности, возникновение жизнеугрожающих желудочковых тахиаритмий). Широкое ее использование в клинической практике лимитировано риском развития осложнений у 1-2% пациентов в экспертных центрах и до 9% в центрах с небольшим опытом проведения и существующими рекомендациями по применению ЭМБ, в которых пациенты с предсердными тахиаритмиями остаются вне зоны возможности рутинного применения метода при неясном генезе нарушений ритма. Вместе с тем эффективность катетерного лечения предсердной тахиаритмии у пациентов с критериями миокардита по данным ЭМБ не превышает 35% vs 89% у пациентов с интактным миокардом [5].
Цель исследования — проанализировать значимость МРТ сердца с контрастированием и ЭМБ в диагностике миокардита у пациентов с фибрилляцией предсердий (ФП) неясного генеза.
Материал и методы
Одноцентровое наблюдательное исследование выполнено на базе отделения хирургического лечения сложных нарушений ритма сердца и электрокардиостимуляции в соответствии с национальными и международными стандартами проведения клинических исследований (Хельсинкская декларация Всемирной медицинской ассоциации) при одобрении Комитета по биомедицинской этике НИИ кардиологии ФГБНУ Томский НИМЦ. В исследование включались пациенты старше 18 лет, поступающие в отделение с ФП неясного генеза, имеющие показания для проведения катетерной аблации и подписавшие информированное согласие на включение в исследование.
Критериями невключения являлись органическая патология сердца, гипертоническая болезнь, клапанная патология, ишемическая болезнь сердца, эндокринный или токсический генез аритмии. Ишемическая болезнь сердца была исключена на основании данных инвазивной коронарографии или мультиспиральной томографии коронарных артерий.
35 пациентам кроме общеклинического обследования выполнена МРТ сердца с контрастированием на томографе мощностью 1,5 Т (Vantage Titan, Toshiba Medical Systems Corporation, Япония). В качестве контрастного препарата был использован "Гадобутрол" (Гадовист Bayer AG, Германия) в дозе 0,1-0,2 мл/кг. МРТ была выполнена по стандартному протоколу: кино-последовательности (ИП GRE-SSFP) в стандартных проекциях; Т2-ВИ и Т1-ВИ (ИП TSE) по короткой оси левого желудочка (ЛЖ); раннее и ОК. На Т2-ВИ определяли наличие признаков отека миокарда. Ранние контрастные изображения были получены через 1-2 мин после внутривенного введения контрастного препарата на Т1-ВИ по короткой оси ЛЖ для определения гиперемии миокарда ЛЖ. Отсроченные контрастные изображения были получены через 8-15 мин на Т1-ВИ в ИП GRE (режим "Inversion recovery") с ручным подбором времени инверсии для определения характера и локализации ОК. Анализ МР-исследований сердца проводился на специализированной рабочей станции для постпроцессинга CMR42 (Circle Cardiovascular Imaging, Калгари, Канада).
Одномоментно с катетерным лечением ФП 57 пациентам выполнена ЭМБ с забором фрагментов миокарда из выводного тракта правого желудочка, межжелудочковой перегородки и верхушки правого желудочка с последующим проведением гистологического и иммуногистохимического исследования с выявлением антигенов вирусов. Фрагменты миокарда размером не менее 1 мм2 фиксировали в течение 24 ч в 10% забуференном нейтральном формалине, после чего выполняли стандартную гистологическую проводку в аппарате Thermo Fisher Scientific Excelsior AS (США), заливку в парафин на модульной системе Sacura Tissue-Tec®TEC™ 5 (Япония). Затем при помощи ротационного микротома Thermo Scientific HM355S (Thermo Fisher Scientific, США) с каждого парафинового блока были приготовлены срезы толщиной 2-3 мкм для последующего гистологического и иммуногистохимического исследования. Для иммуногистохимического исследования срезы фиксировались на предметных стеклах с адгезивным полилизиновым покрытием. Для рутинного гистологического исследования препараты окрашивали гематоксилином и эозином, а также по Ван Гизону на автоматическом гистостейнере Leica ST5010 XL (Германия) в соответствие со стандартными протоколами окрашивания, заключали под покровные стекла на аппарате Thermo Fisher Scientific ClearVue (США). Микроскопическое исследование полученных образцов проводили на исследовательском микроскопе Carl Zeiss Axio Imager M2 (Германия), в светлом поле. Морфологическую верификацию миокардита проводили в соответствии с модифицированными Всемирной Федерацией сердца Далласскими критериями. Степень активности воспаления и выраженности фиброза оценивали с использованием полуколичественных гистологических критериев, предложенных Basso C, et al.
Иммуногистохимическое исследование проводилось с использованием мышиных моноклональных антител к CD45RO (Clone UCHL-1, Leica) RTU, CD3 (Clone LN10, Leica) RTU, CD68 (Clone 514H12, Leica) RTU, Adenovirus (Clone 20/11 & 2/6, Cell Marque), Parvovirus B19 (Clone R92F6, Cell Marque), Anti-HHV6 (Clone C3108-103, Abcam), CMV (Clone DDG9/CCH2, Cell Marque), кроличьего моноклонального антитела к Epstein-Barr Virus (Clone MRQ-47, Cell Marque). А также кроличьих поликлональных антител к Herpes Simplex Virus I (Polyclonal, Cell Marque), Herpes Simplex Virus II (Polyclonal, Cell Marque) и к Enterovirus 71 Antibody (Polyclonal, Invitrogen). Иммуногистохимическое окрашивание проводилось по следующей методике. Изучаемые срезы сушили в термостате при температуре 60 C в течение ночи. Далее их помещали в автоматизированный иммуностейнер Leica BOND-MAX (Leica Microsystems GmbH, Вецлар, Германия) для окрашивания в соответствии с протоколом. Сначала ткань подвергали депарафинизации и предварительной обработке раствором для демаскировки антигенов (ER1, pH 7,5) при 98 C в течение 20 мин. После промывки наносился пероксидазный блок с использованием набора Bond Polymer Refine Detection Kit DC9800 (Leica Microsystems GmbH) на 10 мин. Далее срезы снова промывали и инкубировали с первичным антителом в течение 30 мин и затем инкубировали с полимером в течение 10 мин. В заключение тканевые образцы обрабатывали DAB-хромогеном в течение 10 мин и докрашивали гематоксилином и эозином в течение 10 мин.
Статистическая обработка полученных данных производилась с помощью пакета прикладных программ SPSS. Для выявления типа распределения выборки использован анализ гистограмм и критерий Шапиро-Уилка. Корреляционный анализ выполнен с расчетом коэффициента Спирмена или Пирсона в зависимости от нормальности распределения и типа анализируемых данных. Для оценки прогностической значимости факторов использована однофакторная логистическая регрессия. С использованием ROC-анализа доказана диагностическая эффективность использованных в работе методик. Показатель информативности диагностического теста получен путем определения площади под ROC-кривой и нахождением оптимального порогового значения. Различия величин оценивались как значимые при p<0,05. Данные представлены в виде М±SD, где М — среднее арифметическое значение, SD — стандартное отклонение, Me [LQ; UQ], где Me — медиана, а LQ и UQ — 25-й и 75-й квартиль, соответственно.
Результаты
Таким образом, в исследование было включено 57 пациентов с ФП неясного генеза в возрасте 46±9,5 лет (77,2% мужчин). У 32 пациентов (56,1%) была пароксизмальная, у 13 (22,8%) — персистирующая и у 12 (21,1%) длительно персистирующая форма ФП. Клиническая характеристика пациентов представлена в таблице 1.
При трансторакальной эхокардиографии средний показатель глобальной систолической функции был в пределах нормы. При этом ФВ ≤40% документирована у 6 чел. (13,9%), ФВ 40-50% — 7 чел. (19,4%) и ФВ ≥50% — у 24 чел. (66,7%). Медиана размеров полостей сердца не выходила за пределы нормальных значений. У 2 пациентов документировано повышение тропонина I при отсутствии повышения креатинфосфокиназы-МВ (КФК-МВ) и С-реактивного белка (СРБ).
По данным МРТ сердца с контрастированием у 91,4% диагностировано ОК неишемического генеза. В 17,1% случаев выявлены признаки отека на Т2-ВИ, при этом среднее значение индекса отека по ЛЖ (T2 SI Ratio) составило 1,6±0,3 (норма <2,0). У 25,7% — были выявлены признаки гиперемии, при расчете индекса гиперемии ЛЖ (EGER) его среднее значение составило 3,4 [ 2,2;4,0] (норма <4,0). Примеры томографических изображений, отражающих отек и отсроченное накопление парамагнетика представлены в рисунках 1 и 2.
При анализе ОК в миокард большее распространение накопления контраста отмечено в базальных нижних и перегородочных отделах, в меньшей мере — в передних срединных и базальных боковых (рис. 3).
По данным МРТ миокардит был диагностирован у 12 пациентов (34,3%) с выявлением 3 критериев у 2 пациентов, 2 — у 10 (у 6 в сочетании гиперемия+фиброз, у 4 — отек+фиброз), 1 (фиброз) — у 22, ни одного — у 1 пациента.
Гистологические критерии лимфоцитарного миокардита выявлены у 28 пациентов из 57 (49,1%): у 19 (67,9%) — очаговый, у 6 (21,4%) диффузный и у 3 (10,7%) — диффузно-очаговый. Общее количество Т-лимфоцитов в 3 фрагментах у всех пациентов составило 8 [ 4;15], 9 [ 5;16] и 8 [ 4,5;13,5] клеток, соответственно. Активность воспаления соответствовала 1 степени — у 46,4%, 2 степени — 35,7% и 3 степени — у 1,8%, при отсутствии активности воспаления у 14,3% больных. Отсутствие фиброза во фрагментах миокарда документировано у 16 пациентов, фиброз 1 степени — у 34, 2 — у 4, 3 — у 2 пациентов.
При иммуногистохимическом исследовании у большинства больных выявлена экспрессия антигенов вируса герпеса 6 типа (90,6%) и энтеровируса (77,4%) с их сочетанием у 37 больных (69,8%), у 3,8% пациентов выявлена экспрессия вируса герпеса 2 типа, у 5,7% — парвовируса, у 2 — Эпштейн-Барр, у 11,9% — цитомегаловируса, у 1,9% — вируса гриппа тип А, у 11,3% — антигена Covid-19 nucleocapsid.
Наличие признаков отека по МРТ было фактором, наиболее сильно связанным с общим количеством выявленных Т-лимфоцитов во фрагментах миокарда, оцененного при помощи ROC-анализа (AUC 0,782 (95% доверительный интервал: 0,61-0,93), р=0,032). При этом наличие отека по результатам МРТ предсказывает выраженность лимфоцитарной инфильтрации биоптатов более 11,5 клеток с чувствительностью 83% и специфичностью 76%. Наличие гиперемии не обладало предсказательной способностью в выявлении миокардита по ЭМБ (рис. 4, 5).
Связь при этом была двусторонней: при применении однофакторной логистической регрессии Т-клеточная лимфоцитарная инфильтрация предсказывает вероятность выявления накопления контраста на Т2-ВИ с индексом >2 (р=0,036), что соответствует критерию отека, отношение шансов 1,18; 95% доверительный интервал: 1,01-1,38.
Схематичное сопоставление данных МРТ диагностики и ЭМБ представлено на рисунке 6. При сочетании критериев гиперемия+фиброз гистологические критерии миокардита присутствовали во фрагментах у 50% больных. При наличии критерия отека в 5 из 6 случаев документирован миокардит. При отсутствии критериев Lake Louise или наличии только позднего гадолиниевого усиления гистологически в 10 случаях подтвержден миокардит, что повышает диагностику с 34,3% до 62,9%. Совпадение диагностики по данным МРТ и ЭМБ составило 60%.
Таблица 1
Клиническая характеристика пациентов
|
Параметр |
Все пациенты (n=57) |
|
Возраст, лет, Me [LQ;UQ] |
45,5 [ 38,8;53,3] |
|
Мужчины, % |
77,2 |
|
Пароксизмальная ФП, n (%) |
32 (56,1) |
|
Персистирующая ФП, n (%) |
13 (22,8) |
|
Длительно персистирующая ФП, n (%) |
12 (21,1) |
|
Данные ЭхоКГ |
|
|
ФВ ЛЖ, %, Me [LQ;UQ] |
65 [ 55;69] |
|
ЛП, мм, Me [LQ;UQ] |
42 [ 38,8;45,0] |
|
МЖП, мм, Me [LQ;UQ] |
10 [ 9;10,5] |
|
ЗСЛЖ, мм, Me [LQ;UQ] |
9,5 [ 9;10] |
|
КДР, мм, Me [LQ;UQ] |
49,5 [ 47;54] |
|
КСР, мм, Me [LQ;UQ] |
32 [ 30;36] |
|
Лабораторные данные |
|
|
КФК-МВ, ед./л, Me [LQ;UQ] |
10,7 [ 9,1;12,6] |
|
Тропонин I, ед./л, Me [LQ;UQ] |
3,8 [ 2,4;7,3] |
|
СРБ, мг/л, Me [LQ;UQ] |
1 [ 1;1,5] |
|
Антиаритмическая терапия |
|
|
Амиодарон, n (%) |
15 (26,3) |
|
Соталол, n (%) |
6 (10,5) |
|
Пропафенон, n (%) |
15 (26,3) |
|
Аллапинин, n (%) |
3 (5,3) |
|
Бета-блокатор, n (%) |
9 (15,8) |
Сокращения: ЗСЛЖ — задняя стенка левого желудочка, КДР — конечный диастолический размер, КСР — конечный систолический размер, КФК-МВ — креатинфосфокиназа MB фракция, ЛП — левое предсердие, МЖП — межпредсердная перегородка, СРБ — С-реактивный белок, ФВ ЛЖ — фракция выброса левого желудочка, ФП — фибрилляция предсердий, ЭхоКГ — эхокардиография.
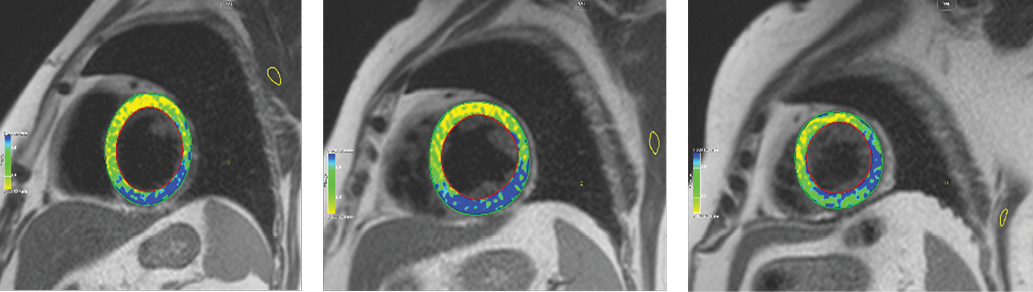
Рис. 1. Изображения по короткой оси ЛЖ в базальном, среднем, апикальном отделах с оценкой тканевых характеристик миокарда (с использованием программы для постпроцессинга CMR42).
Примечание: синим цветом показана область миокарда, соответствующая признакам отека — Т2 Ratio >2. Индекс раннего гадолиниевого усиления (EGER) в базальном отделе — 4,25, среднем — 4,75, апикальном — 4,25. Цветное изображение доступно в электронной версии журнала.
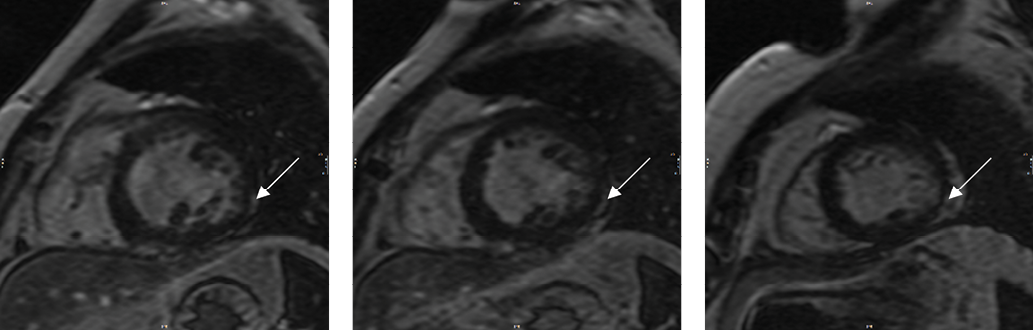
Рис. 2. Изображения по короткой оси ЛЖ в базальном, среднем, апикальном отделах в IR-режиме (ОК).
Примечание: в проекции нижнебоковой стенки ЛЖ определяется субэпикардиальное контрастирование (стрелки), также в проекции нижней стенки ЛЖ можно видеть низкой интенсивности минимальное интрамиокардиальное мелкоочаговое контрастирование.
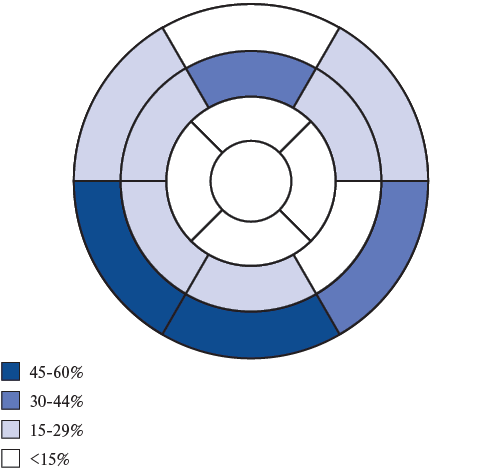
Рис. 3. Частота встречаемости поражения сегментов ЛЖ на поздних изображениях (LGE). 17-сегментарная модель ЛЖ.
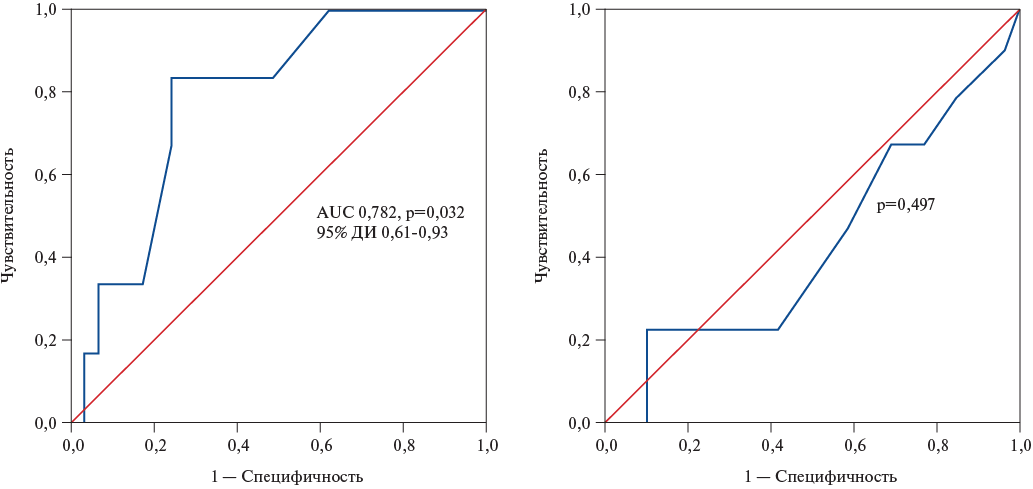
Рис. 4. Связь критерия накопления контрастного вещества на Т2-ВИ (отек) с общим количеством Т-лимфоцитов во фрагментах.
Сокращение: ДИ — доверительный интервал.
Рис. 5. Связь критерия накопления контрастного вещества на Т1-ВИ (гиперемия) с общим количеством Т-лимфоцитов во фрагментах.
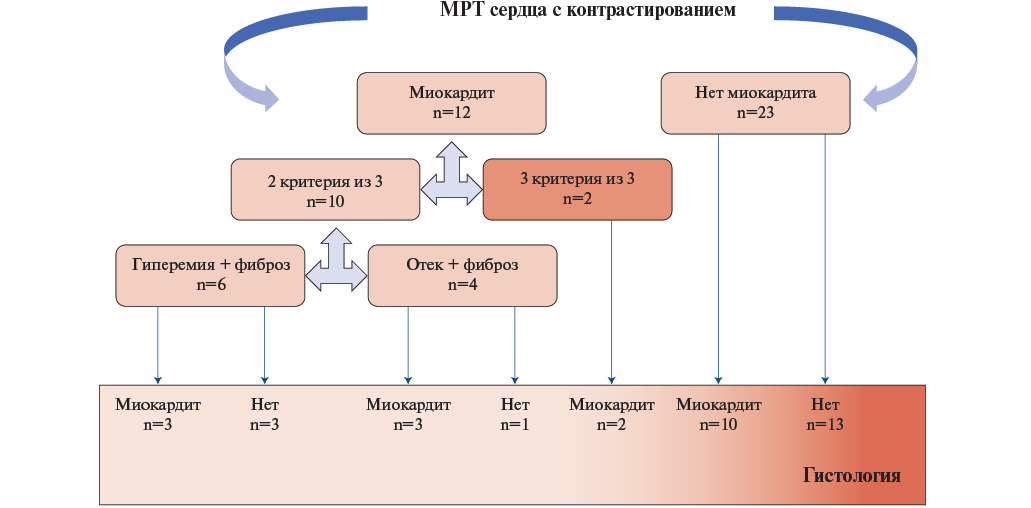
Рис. 6. Схематичное сопоставление данных МРТ и ЭМБ у пациентов с ФП неясного генеза.
Сокращение: МРТ — магнитно-резонансная томография.
Обсуждение
Актуальной проблемой в аритмологии при курации пациентов с ФП неясного генеза является выбор стратегии лечения и дальнейшего наблюдения. Отсутствие документированной причины и, как следствие, понимания перспектив дальнейшего течения заболевания не дает возможности прогнозировать эффективность катетерного лечения аритмии. Важно, что в клинике пациентов, поступающих в плановом порядке для катетерной аблации ФП неясного генеза, доминируют жалобы на неритмичное и/или частое сердцебиение, проявления сердечной недостаточности разной степени выраженности, реже боль в грудной клетке. Следование перечню диагностических критериев при предполагаемом миокардите в такой категории пациентов должно потенцировать поиск маркеров и критериев воспалительного поражения миокарда. Среди таких критериев острая боль в груди, в т.ч. по типу перикардита, или псевдоишемическая боль; вновь возникшая (от нескольких дней до 3 мес.) или ухудшение имевшейся ранее одышки в покое или нагрузке и/или утомляемость, с/без признаков лево- и/или правожелудочковой недостаточности; подострое/хроническое (>3 мес.) наличие одышки в покое или нагрузке, и/или утомляемости, с/без признаков лево- и/или правожелудочковой недостаточности, или ухудшение этих симптомов; сердцебиение и/или аритмия неясного генеза и/или синкопальные состояния и/или предотвращенная внезапная сердечная смерть (успешная реанимация); кардиогенный шок, причина которого неясна [6]. По данным одноцентрового исследования в НИИ кардиологии при обследовании 145 пациентов с неясной этиологией ФП в 44,1% случаев гистологически был подтвержден миокардит [7].
Наиболее простым и доступным методом диагностики является определение кардиоспецифических ферментов и острофазовых показателей воспаления. Однако согласно литературным данным между высвобождением тропонина и тяжестью сердечной дисфункции существует лишь слабая корреляция [8]. Даже нормальные значения тропонина T, I, КФК и КФК-МВ не исключают диагноза миокардит. Еще одним важным диагностическим методом является определение СРБ. Его повышение является неспецифическим маркером миокардита. Сравнительный анализ групп пациентов с острым (<14 дней) процессом и хроническим (>14 дней) продемонстрировал значительно более высокие уровни как КФК-МВ, так и СРБ, в то время как уровень тропонина был сопоставим между группами. Важно, что подобный результат имеет большее клиническое значение в острый период заболевания и отражает выраженность повреждения миокарда в ранней стадии. В нашей практике плановый характер госпитализации не позволяет соблюсти подобные временные сроки. Анамнез заболевания во включенной нами категории пациентов составил 2 [ 1;5] лет. Этим может объясняться отсутствие у них повышения острофазовых показателей и кардиоспецифических маркеров. Повышение тропонина I выявлено в 2 случаях (3,5%).
Ограничения критериев Lake-Louise с помощью МРТ в данной категории пациентов обусловлены в первую очередь необходимостью использования эталонных областей интереса в предполагаемой нормальной ткани миокарда, которая может иметь явления отека, но визуально/качественно не определяться. Обусловлено это тем, что явления отека являются динамическим процессом при воспалении, который постепенно исчезает с течением времени. Выявление ОК в основном отражает поствоспалительный заместительный фиброз, что, безусловно, при стертой клинико-лабораторной картине не позволяет достоверно диагностировать миокардит. При этом методика с ОК не позволяет оценивать диффузное поражение миокарда, которое нередко встречается в хроническую фазу заболевания. По нашим данным при выявлении в 91,4% феномена ОК, раннее накопление на Т2-ВИ выявлено в 17,1% случаев, на Т1-ВИ — в 25,7%, позволяя диагностировать миокардит в 34,3% случаев. Высокая прогностическая значимость и двусторонняя связь с Т-клеточной лимфоцитарной инфильтрацией в биоптатах критерия раннего контрастного усиления на Т2-ВИ придает большое значение выявлению данного феномена на МРТ. Наши данные аналогичны ранее описанным группой авторов во главе с Philipp Lurz, где в диагностике хронического миокардита прогностическое значение было значимым только для этого критерия [9].
Повысить диагностическую ценность и преодолеть ограничения критериев Lake-Louise стало возможным благодаря методам параметрического Т1- и Т2-картирования за счет прямых количественных попиксельных карт без необходимости использования эталонных областей интереса. Bohnen S, et al. и ряд других авторов показали, что как нативные T1- и T2-карты, так и сочетание ОК с анализом фракции внеклеточного объема (ECV-карты) являются диагностическими в острую и хроническую фазу заболевания [10].
Чувствительность метода ЭМБ составляет 53-98% и зависит от опыта центра, количества фрагментов, размера биоптатов и характера патологического процесса [11]. При локализации процесса в ЛЖ информативность ЭМБ из правого желудочка снижается до 53%, а мозаичность поражения миокарда приводит к снижению чувствительности и ценности метода. Несмотря на объективные ограничения и недостаточную эффективность ЭМБ, его недоступность в большинстве клиник [12], методика обладает равной диагностической ценностью как в выявлении острого, так и хронического миокардита. Возможности иммуногистохимии позволяют достоверно оценить персистирование вируса в ткани миокарда, определить стратегию этиотропного противовирусного лечения, иммуномодулирующей терапии. В нашей работе миокардит по данным ЭМБ подтвержден в 49,1% случаев, в ряде из которых при наличии диагностических критериев по МРТ гистологически миокардит не подтвердился. И напротив, в 10 из 21 случаев отсутствия критериев миокардита по данным МРТ гистологически был диагностирован миокардит. При этом совпадение данных, как по исключению, так и по диагностике достигло 60%. Учитывая специфику метода и его ограничения, расценивать подобные результаты как исключающие миокардит лишь на основании данных ЭМБ неправильно. В подобных случаях диагностика должна быть комплексной и опираться на совокупность клинико-лабораторных и инструментальных данных, поскольку комбинация МРТ с контрастом и ЭМБ более значима, чем каждый метод по отдельности [6]. В нашем исследовании подобный подход позволил повысить точность диагностики миокардита с 34,3 до 62,9%.
Ограничения исследования. Ограничениями исследования является малая выборка пациентов, что может снижать достоверность полученных результатов. В нашем исследовании ввиду технических ограничений не использована методика мультипараметрического Т1- и Т2-картирования, что при реализации поспособствовало бы повышению диагностической ценности МРТ.
Заключение
В настоящее время имеющиеся рекомендации о порядке диагностики миокардита имеют существенные пробелы. Точность диагностики/исключения миокардита по данным МРТ при сопоставлении с ЭМБ у пациентов с ФП неясной этиологии составила 60%. Наличие отека по данным МРТ было единственным признаком, имеющим предсказательную значимость выраженности воспалительной клеточной инфильтрации во фрагментах миокарда. Достичь повышения точности диагностики возможно, используя совокупность данных клинико-лабораторных, инструментальных методик, в т.ч. с использованием ЭМБ. Гистология в сочетании с МРТ повысила точность диагностики миокардита с 34,3 до 62,9%. Невысокая точность неинвазивной диагностики хронического миокардита у пациентов с предсердными тахиаритмиями при ограничении использования метода ЭМБ требует решения вопроса об алгоритме использования гистологического исследования после МРТ и возможном расширении показаний к ЭМБ.
Отношения и деятельность: все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье.
Список литературы
1. Ammirati E, Frigerio M, Adler ED, et al. Management of Acute Myocarditis and Chronic Inflammatory Cardiomyopathy: An Expert Consensus Document. Circ Heart Fail. 2020; 13(11):e007405. doi:10.1161/CIRCHEARTFAILURE.120.007405.
2. De Gaspari M, Rizzo S, Thiene G, et al. Causes of sudden death. Eur Heart J Suppl. 2023;25(Suppl B):B16-B20. doi:10.1093/eurheartjsupp/suad077.
3. Georgiopoulos G, Figliozzi S, Sanguineti F, et al. Prognostic Impact of Late Gadolinium Enhancement by Cardiovascular Magnetic Resonance in Myocarditis: A Systematic Review and Meta-Analysis. Circ Cardiovasc Imaging. 2021;14(1):e011492. doi:10.1161/CIRCIMAGING.120.011492.
4. Domínguez F, Uribarri A, Larrañaga-Moreira JM, et al. Diagnosis and treatment of myocarditis and inflammatory cardiomyopathy. Consensus document of the SEC-Working Group on Myocarditis. Rev Esp Cardiol (Engl Ed). 2024;77(8):667-79. doi:10.1016/j.rec.2024.02.022.
5. Batalov RE, Khlynin MS, Rogovskaya YuV, et al. S. Isolated Atrial Fibrillation, Inflammation and Efficacy of Radiofrequency Ablation: Preliminary Insights Based on a Single-Center Endomyocardial Biopsy Study. J. Clin. Med. 2023;12:1254. doi:10.3390/jcm12041254.
6. Арутюнов Г.П., Палеев Ф.Н., Моисеева О.М. и др. Миокардиты у взрослых. Клинические рекомендации 2020. Российский кардиологический журнал. 2021;26(11): 4790. doi:10.15829/1560-4071-2021-4790.
7. Баталов Р.Е., Роговская Ю.В., Рябов В.В. и др. Идиопатическая форма фибрилляции предсердий, воспаление и клинические результаты радиочастотной аблации. Российский кардиологический журнал. 2014;(12):7-12. doi:10.15829/1560-4071-2014-12-7-12.
8. Chauin A. The Main Causes and Mechanisms of Increase in Cardiac Troponin Concentrations Other Than Acute Myocardial Infarction (Part 1): Physical Exertion, Inflammatory Heart Disease, Pulmonary Embolism, Renal Failure, Sepsis. Vasc Health Risk Manag. 2021;17:601-17. doi:10.2147/VHRM.S327661.
9. O’Brien AT, Gil KE, Varghese J, et al. T2 mapping in myocardial disease: a comprehensive review. J Cardiovasc Magn Reson. 2022;24(1):33. doi:10.1186/s12968-022-00866-0.
10. Gaizauskiene K, Leketaite K, Glaveckaite S, et al. Diagnostic Value of Cardiovascular Magnetic Resonance T1 and T2 Mapping in Acute Myocarditis: A Systematic Literature Review. Medicina (Kaunas). 2024;60(7):1162. doi:10.3390/medicina60071162.
11. Митрофанова Л.Б. Роль эндомиокардиальной биопсии в диагностике воспалительных заболеваний миокарда. Российский кардиологический журнал. 2016;(1):73-9. doi:10.15829/1560-4071-2016-1-73-79.
12. Li ZP, Li GL, Wang RN, et al. Endomyocardial Biopsy: short- and long-term safety in myocarditis patients. Cardiology. 2025:1-26. doi:10.1159/000543593.
Об авторах
Е. С. СитковаРоссия
Ситкова Екатерина Сергеевна — к.м.н., с.н.с. лаборатории высоких технологий диагностики и лечения нарушений ритма сердца.
Томск
Конфликт интересов:
Нет
С. Ю. Усенков
Россия
Усенков Станислав Юрьевич — к.м.н., врач по эндоваскулярным методам диагностики и лечения отделения хирургического лечения сложных нарушений ритма сердца и электрокардиостимуляции.
Томск
Конфликт интересов:
Нет
Р. Е. Баталов
Россия
Баталов Роман Ефимович — д.м.н., руководитель лаборатории высоких технологий диагностики и лечения нарушений ритма сердца.
Томск
Конфликт интересов:
Нет
О. В. Мочула
Россия
Мочула Ольга Витальевна — к.м.н., н.с. отделения рентгеновских и томографических методов диагностики.
Томск
Конфликт интересов:
Нет
И. В. Степанов
Россия
Степанов Иван Вадимович — к.м.н., зав. патологоанатомическим отделением.
Томск
Конфликт интересов:
Нет
М. А. Драгунова
Россия
Драгунова Марина Александровна — к.м.н., н.с. лаборатории высоких технологий диагностики и лечения нарушений ритма сердца.
Томск
Конфликт интересов:
Нет
Т. В. Московских
Россия
Московских Татьяна Валерьевна — м.н.с. лаборатории высоких технологий диагностики и лечения нарушений ритма сердца.
Томск
Конфликт интересов:
Нет
С. А. Афанасьев
Россия
Афанасьев Сергей Александрович — д.м.н., руководитель лаборатории молекулярно-клеточной патологии и генодиагностики.
Томск
Конфликт интересов:
Нет
Дополнительные файлы
- Рассмотрена проблема верификации хронического миокардита у пациентов с фибрилляцией предсердий неясного генеза, что связано с диагностическими ограничениями метода магнитно-резонансной томографии (МРТ) и ограниченного использования эндомиокардиальной биопсии в клинической практике.
- Показано, что наличие отека по данным МРТ сердца является единственным признаком, имеющим предсказательную значимость выраженности воспалительной клеточной инфильтрации во фрагментах миокарда по данным гистологического исследования.
- Сочетанное использование МРТ сердца с контрастированием и эндомиокардиальной биопсии повышает диагностику хронического миокардита у пациентов с фибрилляцией предсердий неясного генеза.
Рецензия
Для цитирования:
Ситкова Е.С., Усенков С.Ю., Баталов Р.Е., Мочула О.В., Степанов И.В., Драгунова М.А., Московских Т.В., Афанасьев С.А. Хронический миокардит у пациентов с фибрилляцией предсердий неясного генеза: объективные сложности диагностики и нерешенные вопросы. Российский кардиологический журнал. 2025;30(7):6242. https://doi.org/10.15829/1560-4071-2025-6242. EDN: ENXIWO
For citation:
Sitkova E.S., Usenkov S.Yu., Batalov R.E., Mochula O.V., Stepanov I.V., Dragunova M.A., Moskovskikh T.V., Afanasyev S.A. Chronic myocarditis in patients with atrial fibrillation of unknown origin: diagnostic challenges and unresolved issues. Russian Journal of Cardiology. 2025;30(7):6242. (In Russ.) https://doi.org/10.15829/1560-4071-2025-6242. EDN: ENXIWO

















































